脂肪是决定肉制品感官特性的重要成分之一,在肉制品加工过程中可以降低水分的流失从而增加产率,同时也是风味物质的主要来源。脂肪也可提高肉制品的营养价值,作为脂溶性维生素和必需脂肪酸的重要来源[1]。然而,由于肉制品中存在高盐、高脂、高热量的问题,肉类摄入过量也会增加心血管疾病、冠心病、癌症、肥胖和高血压的风险。因此,随着人们健康膳食观念的增强,对低脂肉制品的需求也愈来愈强烈。传统乳化型肉制品可能含有高达30%的动物脂肪,特别是德国慕尼黑香肠、法兰克福香肠和中国传统的腊肠等,具有较高的饱和脂肪和胆固醇含量。为了满足消费者的健康需求,肉类行业正在发展高质量的低脂肉制品并且不断增加其产品价值。为了降低肉制品的脂肪含量,可通知添加非肉蛋白、改性脂肪、胶体和水作为脂肪替代品来生产乳化型肉类产品。预乳化技术是指添加不同种类的植物油,乳化剂和水制备预乳化液,或使用功能特性良好的预乳化液凝胶代替动物脂肪,从而降低饱和脂肪酸和胆固醇含量,提高肉制品的产量[2]。在已有研究中,大豆、酪蛋白酸钠和乳清蛋白已被用于制备预乳液,并成功地应用于肉类产品加工中替代动物脂肪[3]。
圆苞车前子属车前科车前属,目前主要生长在印度、巴基斯坦、伊朗和欧洲一些国家。圆苞车前子壳粉(psyllium husk powder,PHP)是通过机械研磨筛选出种子的最外层部分。PHP含有丰富的粗蛋白、膳食纤维、碳水化合物、微量元素以及天然黏液物质[4]。黏性膳食纤维已被证明有利于人类健康[5]。PHP含有的纤维不仅有助于降低人类高血脂、高血压和血清总胆固醇水平,而且有助于提高肠道功能,预防结肠癌及其他肠胃疾病的罹患病机率[6]。PHP的主要成分是一种阴离子多糖,其具有一般亲水胶体所具备的良好增稠性、保水性和胶凝特性,在食品中可替代传统的亲水胶体[7]。圆苞车前子多糖主要由阿拉伯木聚糖和木糖残基组成,阿拉伯木聚糖由阿拉伯糖、木糖和其他糖组成。由于阿拉伯木聚糖可以在水中形成强凝胶,因此PHP可以增加连续相的黏度,抑制聚结,并提高水包油乳液的一致性和物理稳定性[8]。食用圆苞车前子不仅能降低高血脂、高血压和胆固醇,还能降低糖尿病患者的血糖水平并减少冠心病的发生[9]。本研究旨在制备稳定的PHP-大豆油-酪蛋白酸钠乳液,通过测定乳化稳定性指数、粒径、流变性能、表面蛋白含量、激光共聚焦扫描显微镜和冷冻扫描电镜等指标对PHP乳液的稳定性和乳化性能进行评价,探讨不同PHP添加量对乳液稳定性和微观结构的影响,以期为制备蛋白稳定乳液替代动物脂肪在肉品工业应用提供重要的理论基础。
1 材料与方法
1.1 材料与试剂
圆苞车前子壳粉,上海味庆生物科技有限公司;金龙鱼牌大豆油,南京江宁区苏果超市;食品级酪蛋白酸钠,郑州塔博商贸有限公司;尼罗红、尼罗蓝,上海西格玛-奥利奇公司。
1.2 仪器与设备
IKA C-MAG HS7 磁力搅拌器、Turrax T18 Basic高速匀浆机,德国IKA公司;Avanti J-E落地式高速冷冻离心机,美国Beckman Coulter公司;UV-2450紫外分光光度计,日本岛津公司;Turbiscan分析仪,法国Formulaction公司;Masterizer 3000激光粒度仪,英国马尔文仪器有限公司;MCR301旋转流变仪,奥地利安东帕(中国)有限公司;LSM 700 META 激光共聚焦显微镜,德国卡尔蔡司有限公司;冷冻电镜,日本日立有限公司。
1.3 实验方法
1.3.1 PHP水包油乳液的制备
按照以下方法制备乳液:在预实验的基础上,分别制备质量分数为0%、0.3%、0.5%、0.7%、0.9%的PHP水包油乳液。将PHP加蒸馏水充分溶胀,得到0.3%、0.5%、0.7%、0.9% PHP水溶液。在PHP水溶液中加入30%(质量分数,下同)大豆油和2%(质量分数,下同)酪蛋白酸钠,并使用高速均质机在4 ℃下12 000 r/min均质30 s,均质3次,每次中间间隔30 s。
1.3.2 乳液的贮藏稳定性
取15 mL新鲜制备乳液置于20 mL透明西林瓶(27 mm×57 mm)内,加盖密封,在4 ℃的冰箱内贮藏,观察乳液在2 h、1、3、5、7 d的分层情况,并用数码相机拍照观察乳液贮藏期间的分层情况。
1.3.3 乳液的乳化稳定性指数(turbiscan stability index,TSI)
根据WANG等[10]的方法稍作修改,将新鲜制备的乳液置于用于分析乳化稳定性指数的玻璃瓶内,在常温25 ℃下静置30 min后,使用稳定性分析仪进行分析。扫描时间为30 min,分析仪每30 s扫描1次,测量温度为25 ℃。通过稳定性分析仪自带的TurbiscanEasysoftLab 2.0软件计算分析。
1.3.4 乳液粒径大小及分布
乳液颗粒大小及分布通过Mastersizer 3000激光粒度分析仪测定,记录乳液中油滴体积质量等效平均直径(D4,3)。分析模式为湿法进样,颗粒折射率为1.520,吸收率为0.001;分散介质为水,分散剂折射率为1.330。
1.3.5 乳液流变特性
乳液流变特性由MCR301旋转流变仪测定,转子型号为PP50,测定温度为25 ℃,间隙设置为0.5 mm。稳态测定在小幅度范围内进行(0.01~10 s-1)。
1.3.6 乳液光学显微镜观察
取2滴乳液样品直接滴在玻璃载玻片上,小心地盖上盖玻片,确保没有气泡。选择有代表性的区域在20倍目镜上观看,并使用照相机拍摄图像。所有样品均在25 ℃下观测。
1.3.7 乳液激光共聚焦显微镜观察
根据龙肇[11]的方法稍作修改,乳液中脂肪与蛋白质的分布可通过荧光染料染色观察。每毫升乳液加入各40 μL 0.01%荧光染料[V(尼罗蓝)∶V(尼罗红)=1∶1]充分混匀,在4 ℃黑暗条件下孵育6 h。随后滴加到载玻片上,并附上盖玻片于20×目镜下观察。2种染料的激发波长分别为514 nm (尼罗红),633 nm (尼罗蓝)。
1.3.8 乳液冷冻电镜观察
将新鲜乳液用蒸馏水稀释10倍,取2滴乳液转移到平板上,使用载玻片覆盖并立即冷冻在液氮中。然后将乳液升华20 min,最后在加速电压为3 kV条件下用扫描电镜采集微观形貌图像。
1.3.9 乳液表面蛋白含量测定
水包油乳液表面蛋白含量测定参照LONG等[12]方法并稍作修改。乳液于0 ℃ 10 000×g离心30 min。乳化层中总蛋白含量为乳液制备过程所用蛋白与凯氏定氮法测定的下清液中蛋白含量之差。表面积结果使用Mastersizer 3000测定。表面蛋白含量计算如公式(1)所示:
表面蛋白含量=(总蛋白含量/表面积)×1 000
(1)
1.4 数据统计与分析
使用Origin 8.5软件对所有数据进行作图,采用SAS 8.0软件对所有数据进行统计分析。所有数据均表示为平均值±标准偏差,每个处理组均做4个重复。平均值的差异比较采用邓肯的多重比较,差异显著性通过t-检验(P<0.05)。
2 结果与分析
2.1 乳液贮藏稳定性
乳液分层是从宏观上反应乳液是否稳定的重要指标之一,乳液分层反映乳液中水和油的聚集和分离状态,较大的分层代表更多的聚集[13]。由图1可知,在贮藏2 h后,与空白对照组对比,0.3%、0.5%的PHP乳液发生较小分层,并且随着浓度的上升,乳液下部的乳清层越来越少。在4 ℃冰箱内贮藏7 d后,与低添加量的PHP乳液相比,添加0.7%PHP能显著降低乳液分层,抑制相分离的发生,这是由于PHP添加量高于0.7%时,体系内黏度显著上升,乳液内部形成了弱凝胶网络结构,从而抑制流体流动,分层大大降低。含多糖的乳液具有极好的物理稳定性,高浓度的PHP有利于乳液的贮藏稳定性,可能由于多糖可增加乳液体系的黏度,减少液滴碰撞,抑制絮凝分层现象[14]。

a-2 h;b-7 d
图1 不同浓度PHP乳液的表观观察
Fig.1 The visual images of the fresh emulsions with different levels of PHP
2.2 乳液TSI
通常使用TSI参数来评估新鲜乳液的整体稳定性,较大的TSI值表明乳液不稳定[15]。由图2可知,随着扫描时间的变化,同一PHP添加量乳液体系的稳定性随着贮存时间的延长而逐渐降低,乳液体系的TSI值逐渐增大。在同一扫描时间下,对比不同PHP添加量的乳液,其TSI值随着PHP浓度减少而减小,0.7%、0.9%PHP乳液的TSI值很接近。表明相较于低浓度的PHP乳液,高浓度的PHP乳液可以提高乳液的乳化稳定指数。
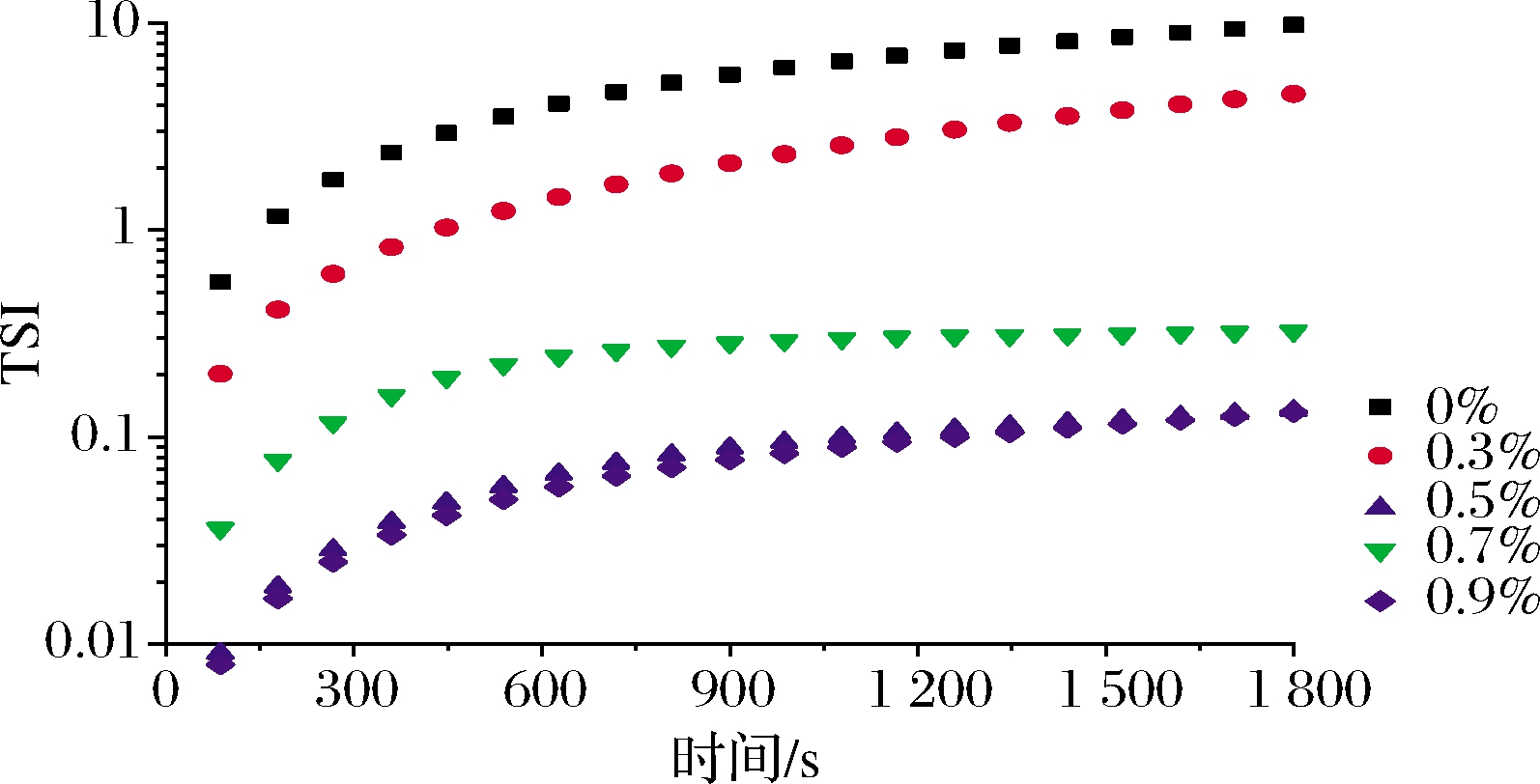
图2 不同浓度的PHP乳液的TSI值
Fig.2 The TSI values of the fresh emulsions with different levels of PHP
2.3 乳液粒径大小及分布
乳液的稳定性可以通过乳液粒径大小和分布来表征,D4,3越小粒径分布越向较小尺寸移动,其乳化能力越好[16]。由图3可知,乳液体系的平均粒径随着PHP浓度的增加而减小,空白对照组与其他添加PHP的乳液的粒径大小存在显著性差异(P<0.05),0.7%、0.9%PHP乳液的平均粒径无显著性差异(P>0.05)。
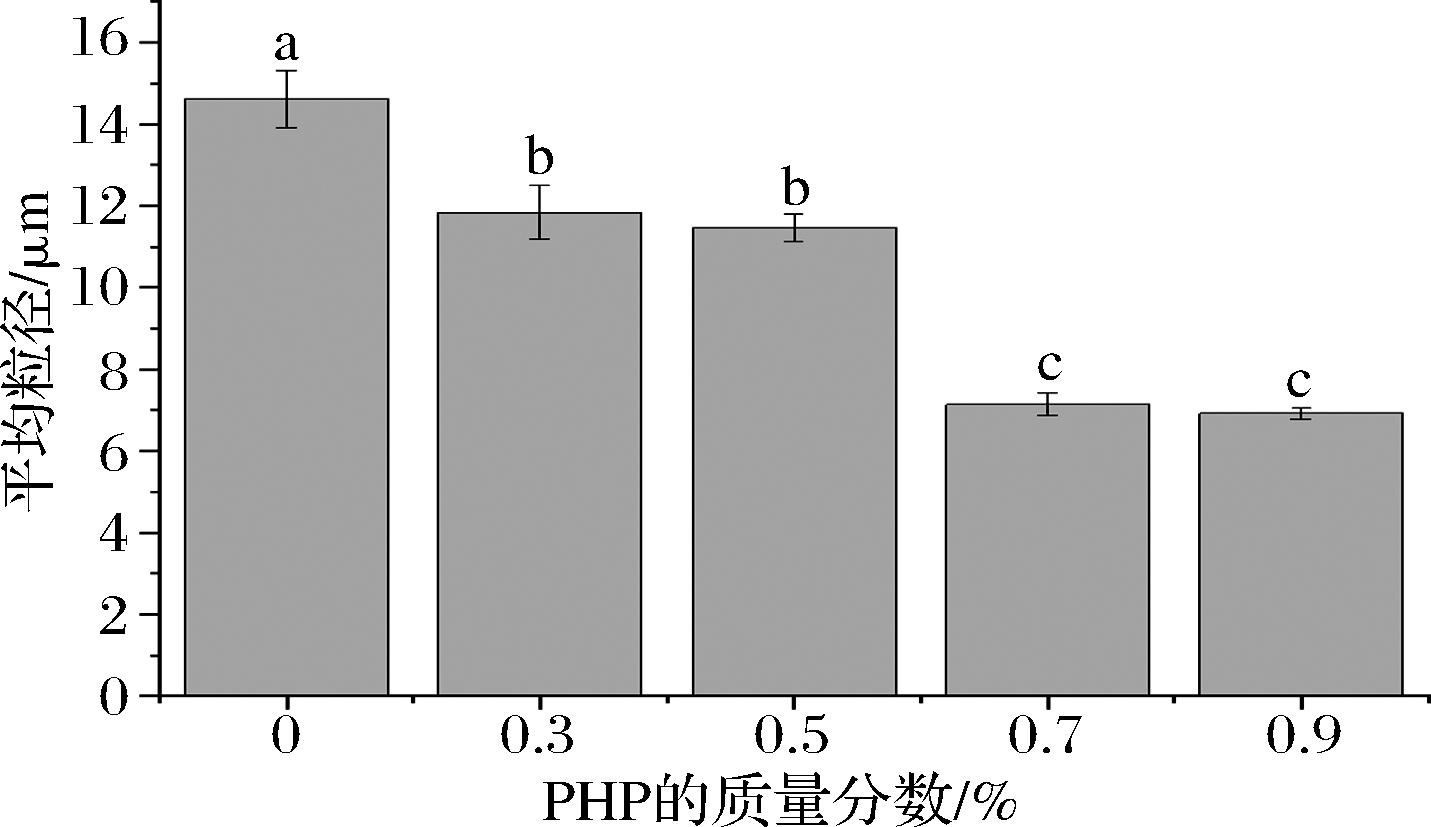
图3 不同浓度的PHP乳液的平均粒径
Fig.3 The particle size of the fresh emulsions with different levels of PHP
注:不同字母表示差异显著(P<0.05)(下同)
从图4粒径分布图中可以看到,随着PHP浓度的增加,乳液粒径分布的峰值逐渐向左移动,向较小的液滴尺寸靠近。这可能是因为,高浓度的PHP可以增加酪蛋白酸钠对乳液的吸附量,降低油水两相的界面张力,提高了乳液体系的黏度,并降低了液滴的絮凝速率,限制油滴移动[17],PHP对减小体系的粒径大小有积极作用。这一结果与后文的激光共聚焦表征结果互相佐证。
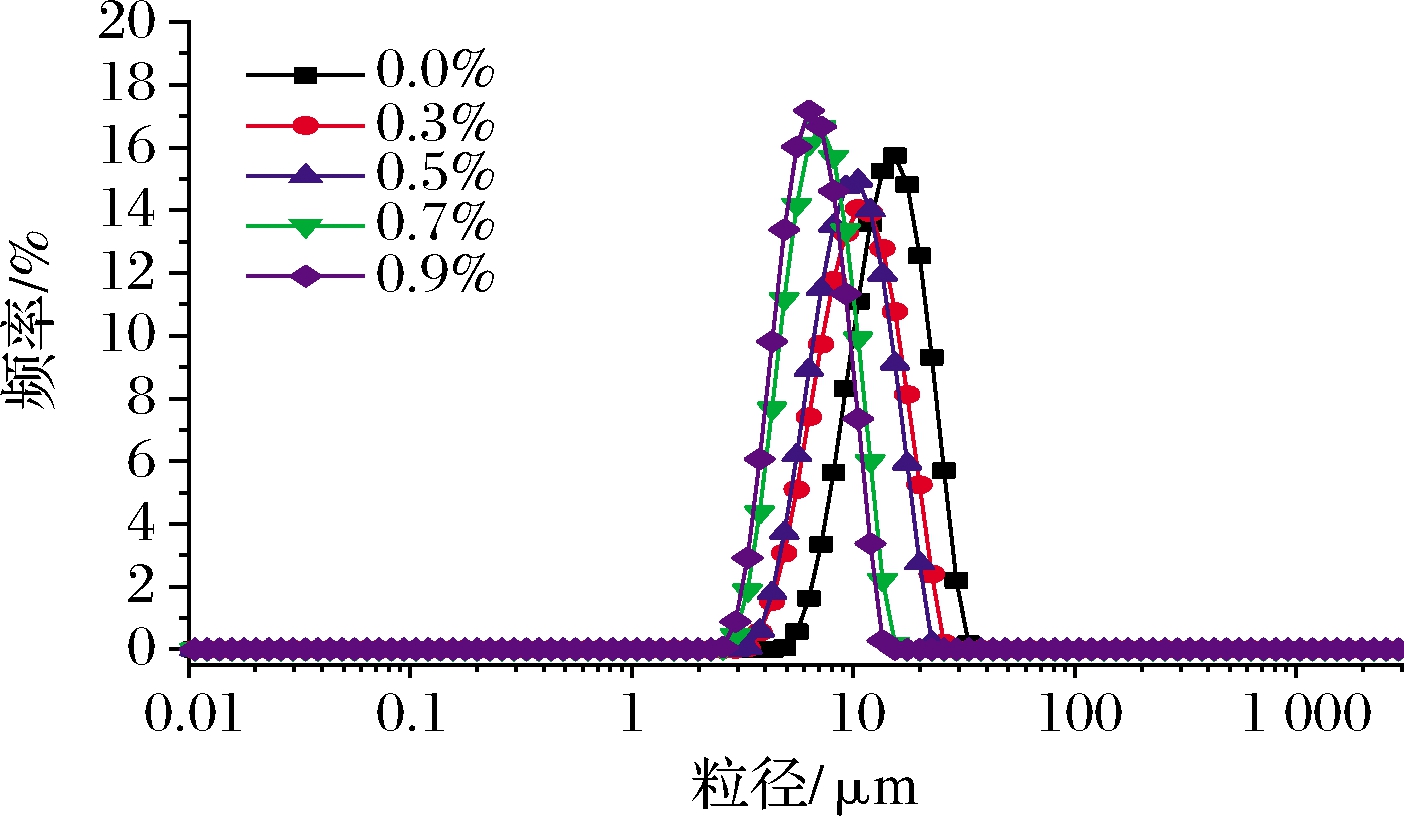
图4 不同浓度的PHP乳液粒径分布
Fig.4 Particle size distribution of the fresh emulsions with different levels of PHP
2.4 乳液流变特性
由图5可知,随着剪切速率的增加,与空白对照组相比,添加PHP乳液的黏度随着剪切速度的增大,急剧下降,黏度的变化和剪切速度呈现相反的趋势,说明这是一种典型的假塑性流体[18]。同时可以看到,在相同的剪切速率下,高浓度PHP乳液的黏度比低浓度PHP乳液的黏度高。乳液的黏度和连续相的黏度成正比,连续相的黏度变化对整个体系黏度变化有相应的影响[19]。PHP能够显著增加乳液体系的黏度,这是因为在高浓度PHP的作用体系中,其纤维网状结构会包裹一定量的连续相水,减少乳液絮凝,引起PHP富集区的有效体积增大,从而引起表观黏度增大。添加PHP可以增加乳液的相互作用,使一个小分子油滴同时结合多个蛋白质分子,形成更大的聚集体[20]。
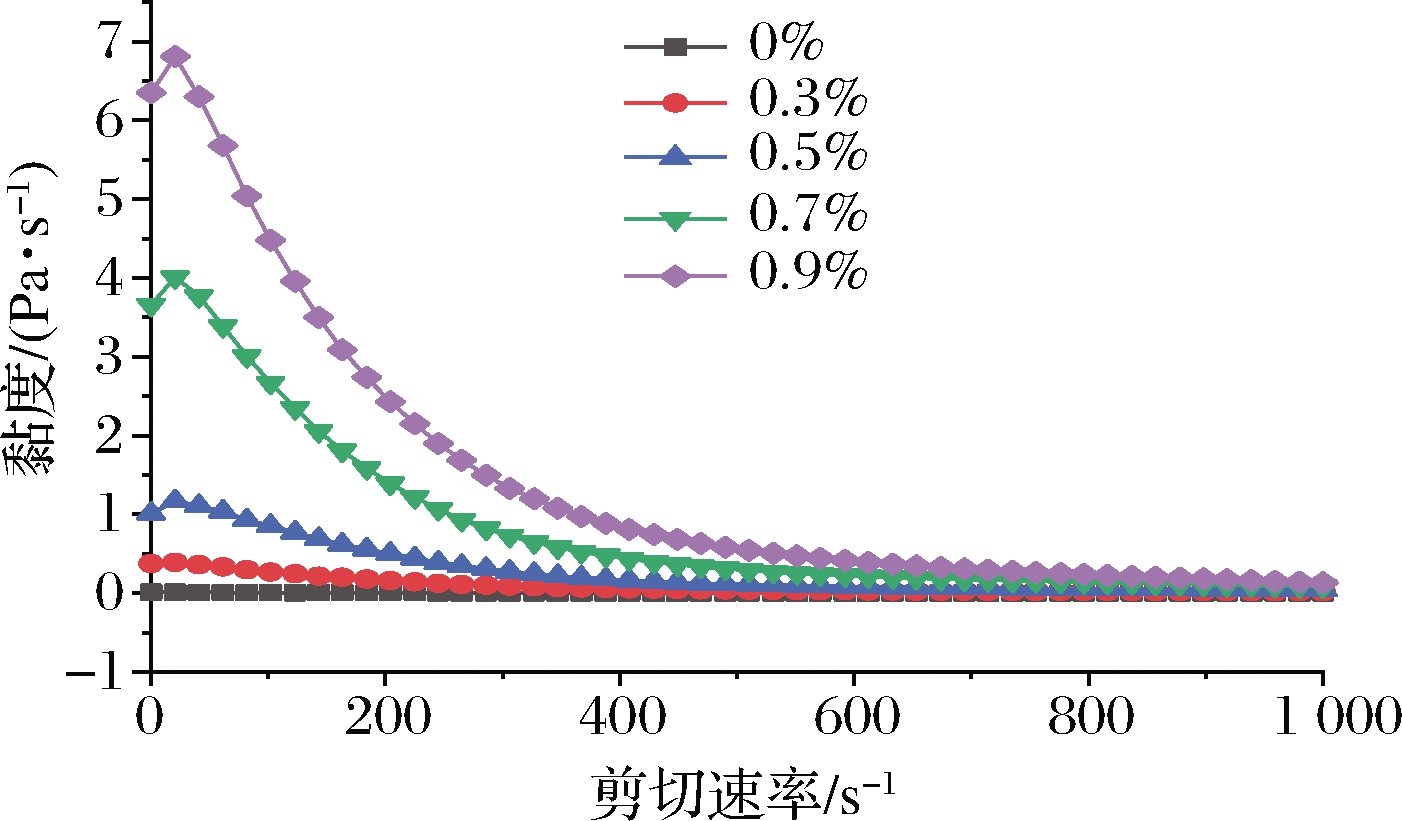
图5 不同浓度的PHP乳液的表观黏度
Fig.5 The apparent viscosity of the fresh emulsions with different levels of PHP
2.5 乳液的光学显微镜观察
由图6可知,0%、0.3% PHP乳液的油滴粒径较大,两两液滴之间距离较大,而0.5%~0.9%PHP乳液的液滴排列较为紧密,并且油滴大小随着PHP的浓度增大而减小,这一结果与前文Masterizer 3000激光粒度仪测定的结果一致。这说明在较低的PHP浓度下,脂肪球重新聚结是产生大粒径的主要因素,而PHP的添加增加了酪蛋白酸钠的界面活性,使其有效依附于新形成的油-水界面抵抗脂肪球聚结。0.7%、0.9% PHP乳液的液滴粒径几乎没有差别,可以推断,若再增加PHP浓度,可能会出现液滴絮凝,油滴粒径增大现象,这可能是由于高浓度的阴离子多糖聚合物的界面共享导致液滴桥连[21]。

a-0%;b-0.3%;c-0.5%;d-0.7%;e-0.9%
图6 不同浓度PHP新鲜乳液在光学显微镜照片(×100倍)
Fig.6 The optical micrographs of the fresh emulsions with different levels of PHP
2.6 乳液激光共聚焦扫描显微镜观察
激光共聚扫描显微镜表征了PHP、酪蛋白酸钠和油脂分布及相互作用。结果如图7所示,红色代表被尼罗红染色的大豆油,绿色为被尼罗蓝染色的PHP和酪蛋白酸钠。随着PHP浓度增大,PHP增加了蛋白质在液滴表面的吸附量,且PHP均一的分布在连续相中,激光共聚焦扫描显微镜观察到,不添加PHP的乳液液滴较大,随着PHP浓度增加,乳化液滴逐渐减小。值得注意的是,随着PHP浓度增大,连续相中的纤维素复合结构增强,变得更加紧密,PHP和酪蛋白酸钠包裹着液滴,从而削弱液滴与液滴之间的作用力。有研究报道,非晶纤维素通过皮克林乳液形成的网络结构机制吸附在液滴表面,防止絮凝和聚结的发生从而达到稳定乳液的目的[22]。
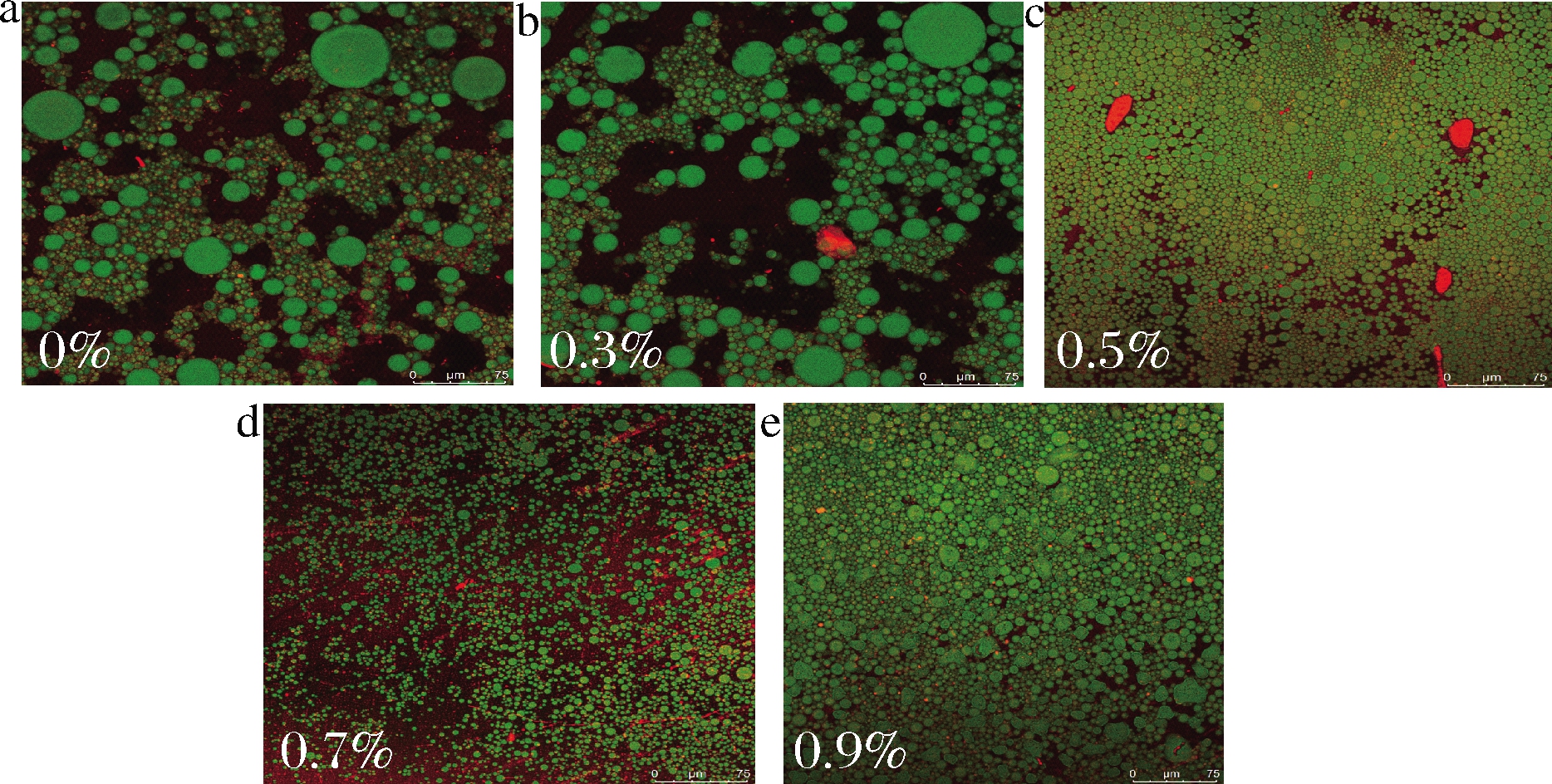
a-0%;b-0.3%;c-0.5%;d-0.7%;e-0.9%
图7 不同浓度PHP新鲜乳液激光共聚焦照片
Fig.7 The CLSM micrographs of the fresh emulsions with different levels of PHP
2.7 乳液冷冻电镜观察
冷冻扫描电子显微镜更加细致地显示了乳液中油滴与PHP和酪蛋白酸钠的三维空间关系。由图8可知,随着PHP浓度的增加,三者的空间结构变得更加紧密,相较于其他网状结构,添加0.7%、0.9%PHP乳液更稳定,油滴被包裹在网状结构中。这可能是由于酪蛋白酸钠具有典型两亲结构,因而表现强的界面活性,将PHP添加到蛋白质稳定乳液中,可通过改变连续相的连续特性或形成空间网状结构,抑制相分离或重力引起的分层。还有可能是因为酪蛋白酸钠与阴离子多糖PHP之间以疏水作用或静电力主导的相互作用发生吸附,从而使酪蛋白酸钠逐个排布于PHP分子链的骨架上,这一结果与KOBORI等[23]的研究的结果一致。

a-0%;b-0.3%;c-0.5%;d-0.7%;e-0.9%
图8 不同浓度PHP新鲜乳液的冷冻电镜显微照片
Fig.8 The cryo-SEM micrographs of the fresh emulsions with different levels of PHP
2.8 乳液表面蛋白含量
蛋白通过与乳液体系中其他亲水性胶体或者小分子乳化剂发生竞争吸附或者协同交互作用,从而影响乳液的稳定性。在乳液的乳化过程中,蛋白质迅速从连续相吸附到新形成的小油滴表面上,阻止液滴间重新聚结,保持乳液稳定[24]。表面蛋白含量受乳液表面蛋白吸附含量和表面积的影响。随着PHP浓度的增加,蛋白吸附含量显著增加,粒径显著减小而表面积显著增加(图9)。PHP质量分数从0%增加到0.9%,表面蛋白含量相应的从8.83 mg/m2 增加到15.91 mg/m2。同时0.7%、0.9%PHP乳液的表面蛋白含量不存在显著性差异(P>0.05)。基于以上研究,添加高于0.5%的PHP可提高蛋白质在液滴表面的吸附作用。这可能是由于高浓度的阴离子多糖与酪蛋白酸钠之间的静电力作用,减弱了吸附过程分子间的排斥力,从而促使更多蛋白质在界面的吸附[25]。此结果与粒径分布和微观观察结果均一致。
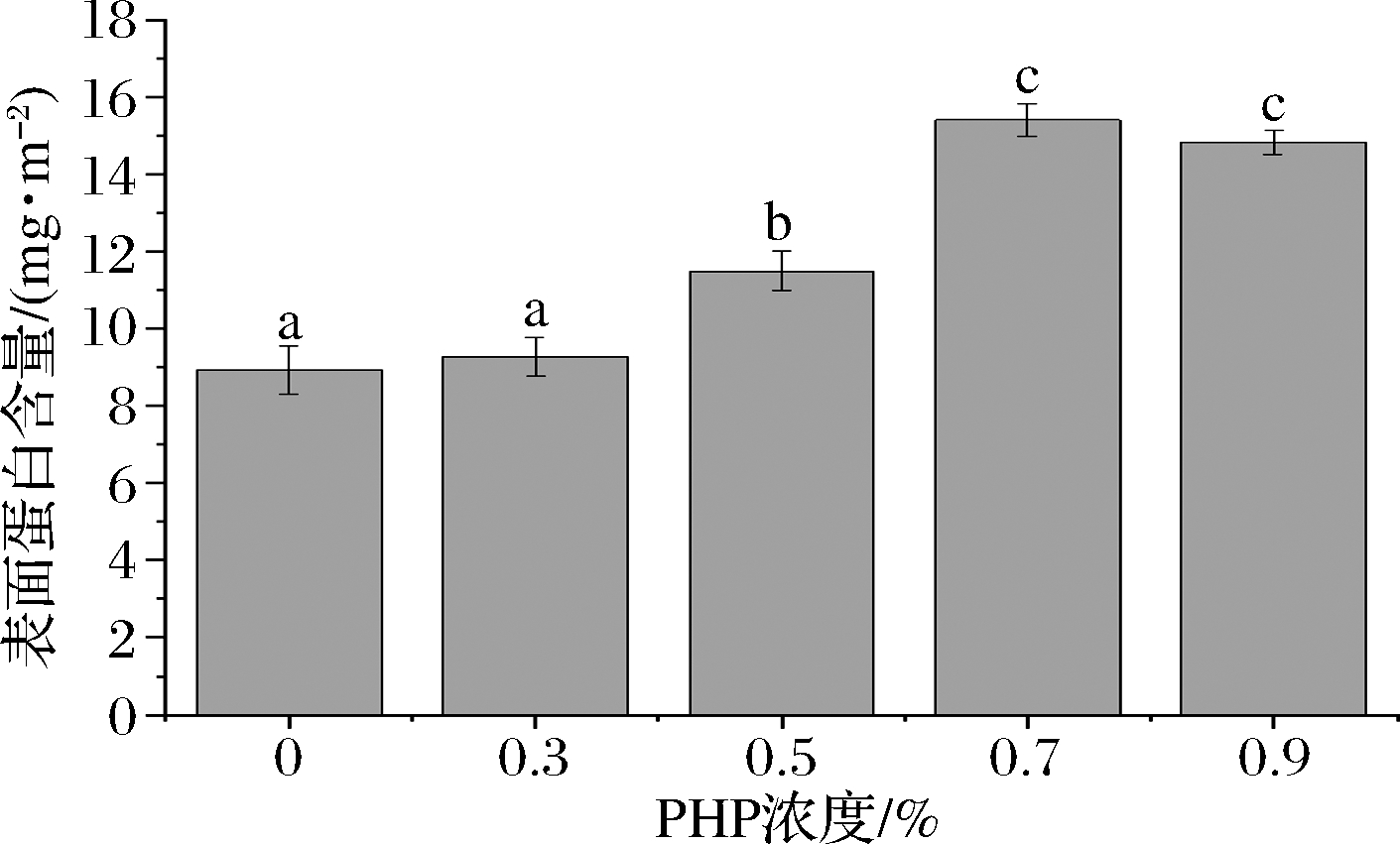
图9 不同浓度PHP新鲜乳液的表面蛋白含量
Fig.9 The surface protein content of the fresh emulsions with different levels of PHP
3 结论
PHP具有良好的乳化稳定性能。质量分数≥0.5%时,乳化分层现象得到抑制。PHP浓度为0.7%、0.9%时,PHP的乳化稳定性指数较高、粒径较小,且0.7%、0.9% PHP乳液的平均粒径无显著差异,贮藏1周后乳化稳定性保持不变。PHP具有增加连续相黏度的能力,减少液滴碰撞,从而减少絮凝和聚结,与酪蛋白酸钠协同作用,减弱分层现象的发生。稳定的乳液体系中PHP最佳添加量为0.7%、酪蛋白酸钠2%、大豆油30%。关于PHP阴离子多糖与酪蛋白酸钠相互作用的具体影响机制尚不明确,两者相互作用后对乳液乳化稳定性的影响有待进一步研究。
[1] CAMPAGNO L P C B, DOS SANTOS B A, WAGNER R, et al.Amorphous cellulose gel as a fat substitute in fermented sausages[J].Meat Science, 2012, 90(1):36-42.
[2] SHAO J H, ZOU Y F, XU X L, et al.Evaluation of structural changes in raw and heated meat batters prepared with different lipids using Raman spectroscopy[J].Food Research International, 2011,44(9): 2 955-2 961.
[3] YOUSSEF M K, BARBUT S.Fat reduction in comminuted meat products-effects of beef fat, regular and pre-emulsified canola oil[J].Meat Science, 2011, 87(4): 356-360.
[4] ANJALI V, RENU M.Psyllium (Plantago ovata) husk:A wonder food for good health[J].International Journal of Science and Research, 2015, 4(9): 1 581-1 585.
[5] SINGH B.Psyllium as therapeutic and drug delivery agent[J].International Journal of Pharmaceutics, 2007, 334(1-2): 1-14.
[6] SOL R, BRUCKERT E, VALLS R M, et al.Soluble fibre (Plantago ovata husk) reduces plasma low-density lipoprotein (LDL) cholesterol, triglycerides, insulin, oxidized LDL and systolic blood pressure in hyper cholesterol laemic patients:A randomised trial[J].Atherosclerosis, 2010, 211(2), 630-637.
R, BRUCKERT E, VALLS R M, et al.Soluble fibre (Plantago ovata husk) reduces plasma low-density lipoprotein (LDL) cholesterol, triglycerides, insulin, oxidized LDL and systolic blood pressure in hyper cholesterol laemic patients:A randomised trial[J].Atherosclerosis, 2010, 211(2), 630-637.
[7] LADJEVARDI Z S, GHARIBZAHEDI S M T, MOUSAVI M.Development of a stable low-fat yogurt gel using functionality of Psyllium (Plantago ovata Forsk) husk gum[J].Carbohydrate Polymers,2015, 125:272-280.
[8] CHEN K, CHEN M C, FENG Y H, et al.Application and rheology of anisotropic particle stabilized emulsions:Effects of particle hydrophobicity and fractal structure[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2017, 524: 8-16.
[9] SOL R, GOD
R, GOD S G,RIBALTA J,et al, et al.Effects of soluble fiber (Plantago ovata husk) on plasma lipids, lipoproteins, and apolipoproteins in men with ischemic heart disease[J].The American Journal of Clinical Nutrition, 2007,85(4):1 157-1 163.
S G,RIBALTA J,et al, et al.Effects of soluble fiber (Plantago ovata husk) on plasma lipids, lipoproteins, and apolipoproteins in men with ischemic heart disease[J].The American Journal of Clinical Nutrition, 2007,85(4):1 157-1 163.
[10] WANG K L, ZHANG B W, LI G.Effects of weak-alkali ASP composition on the stability of O/W emulsions[J].Energy Sources, Part A:Recovery, Utilization, and Environmental Effects, 2019, 41(4): 438-450.
[11] 龙肇. 蛋白质—多糖交互作用对高乳脂乳浊液稳定性的影响及作用机理研究[D].广州:华南理工大学, 2014.
LONG Z.Effect of Protein-polysaccharide interactions on the stability of concentrated emulsions and its mechanism[D]. Guangzhou:South China University of Technology Guangzhou, 2014.
[12] LONG Z, ZHAO Q Z, LIU T X, et al.Role and properties of guar gum in sodium caseinate solution and sodium caseinate stabilized emulsion[J].Food Research International, 2012, 49(1):545-552.
[13] WANG B, LI D, WANG L J, et al.Effect of concentrated flaxseed protein on the stability and rheological properties of soybean oil-in-water emulsions[J].Journal of Food Engineering, 2010, 96(4): 555-561.
[14] 刘丽娅. 酪蛋白酸钠—多糖界面相互作用及其对乳状液稳定性的影响[D].广州:华南理工大学,2011.
LIU L Y.Sodium caseinate-polysaccharide interactions at the oil-water interface:Effect on emulsion stability[D].Guangzhou:South China University of Technology Guangzhou, 2011.
[15] MIN C, LEONARD M C. The influence of protein/phospholipid ratio on the physicochemical and interfacial properties of biomimetic milk fat globules[J]. Food Hydrocolloids, 2019, 105:105179.
[16] 邵云. 大豆蛋白稳定乳液的物化性质及油脂氧化稳定性研究[D].广州:华南理工大学, 2014.
SHAO Y.Physicochemical properties and oxidation stability of oil-in-water emulsions stabilized by soy protein[D].Guangzhou: South China University of Technology Guangzhou, 2014.
[17] CAI X R, DU X F, ZHU G L, et al.Induction effect of NaCl on the formation and stability of emulsions stabilized by carboxymethyl starch/xanthan gum combinations [J].Food Hydrocolloids, 2020, 105:105776.
[18] XIAO M L, QIU T X, JIE Z, et al. Chitosan hydrochloride/carboxymethyl starch complex nanogels as novel Pickering stabilizers: Physical stability and rheological properties[J]. Food Hydrocolloids, 2019, 95:215-225.
[19] 万刘静, 张利.阿拉伯胶对豌豆蛋白制备的水包油型乳状液稳定性的影响[J].粮食与油脂,2021,34(2):47-50.
WAN L J, ZHANG L.Effect of Arabic gum on the stability of oil-in-water emulsion prepared from pea protein [J].Cereals and Oils, 2021,34(2):47-50.
[20] 安秀林,李庆忠.乳状液稳定性的影响因素和表达[J].张家口农专学报, 2003,19 (3):29-31.
AN X L, LI Q Z.The factors affecting stability of emulsion and its expression[J].Journal of Hebei North University, 2003, 19 (3):29-31.
[21] 崔健,郦金龙,刘欢,等.乳清分离蛋白-多糖乳状液制备与乳化稳定性研究[J].农业机械学报,2011,64(9):139-143.
CUI J, LI J L, LIU H, et al.Whey protein isolated-polysaccharide multilayer emulsions by layer-by-layer electrostatic self-assembly technique[J].Transaction of the Chinese Society for Agricultural Machinery, 2011,64 (9):139-143.
[22] JIA X J, XU R R, SHEN W, et al.Stabilizing oil-in-water emulsion with amorphous cellulose[J].Food Hydrocolloids, 2015, 43:275-282.
[23] KOBORI T, MATSUMOTO A, SUGIYAMA S.pH-Dependent interaction between sodium caseinate and xanthan gum [J].Carbohydrate Polymers, 2009, 75 (4):719-723.
[24] TSAI M J,WENG Y M.Novel edible composite films fabricated with whey protein isolate and zein:Preparation and physicochemical property evaluation[J].LWT, 2019,101:567-574.
[25] KHALID N, SHU G F,HOLLAND B J, et al.Formulation and characterization of O/W nanoemulsions encapsulating high concentration of astaxanthin[J].Food Research International, 2017,102:364-371.