豆清液是指在传统豆制品生产过程中蹲脑与压榨时产生的上清液,俗称黄浆水[1]。豆清液中含有丰富的大豆异黄酮、低聚糖、蛋白质、脂肪[2],豆清饮料以豆清液为主要原料,通过添加辅料、菌种进行发酵而成[3]。传统利用豆清液方法主要包括物理方法回收利用功能物质和微生物/酶法生产新化合物、功能性饮料生产和生物燃料等[4]。而豆清饮料既能解决豆清液排放引起的环境问题,又可以提高代谢产物,近年来被广泛研究。
大豆异黄酮广泛存在于豆科植物中,大豆种子中尤为丰富,在加工过程中,部分大豆异黄酮会流失到豆清液中[5]。大豆异黄酮具有多种生理功能,如抗氧化、抑制乳腺癌、前列腺癌、防治骨骼疏松症、预防动脉硬化症[6]等。其中染料木素是植物雌激素,除了具有上述功能特性之外,还能抑制脂肪细胞中脂肪的生成、降低胆固醇与甘油三酯、抗骨质疏松等[7]。限制豆清液广泛利用的主要原因之一是豆清液具有豆腥味、蘑菇味与青草味等不良风味物质,普通人很难接受该风味,如果能够将不良风味降低到痕量水平具有重要研究意义。
本研究以豆清液为主要原料,通过添加鼠李糖乳杆菌(Lactobacillus rhamnosus)、肠膜明串珠菌(Leuconostoc marxianus)、克鲁维酵母(Kluyveromyces marxianus)进行混菌发酵,探究豆清饮料发酵过程中大豆异黄酮、有机酸与风味物质的变化规律。对豆清液的综合应用及实际生产有很大意义,为豆清液发酵制备新型饮料开发提供理论支撑。
1 材料与方法
1.1 材料与试剂
豆清液、克鲁维酵母、明串珠菌、鼠李糖乳杆菌,豆制品加工与安全控制湖南省重点实验室提供;大麦芽、麦芽糖、低聚果糖、酒花,市售;L-乳酸、L-酒石酸、琥珀酸、柠檬酸、富马酸、丙酮酸、黄豆黄素、大豆苷、大豆苷元、染料木素、染料木苷、黄豆黄素苷元,北京索莱宝科技有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
IS-RDD3型台式恒温振荡器,苏州捷美电子有限公司;SB-5200 DTD型超声清洗机,宁波新芝生物科技股份有限公司;RE-5299型旋转蒸发器,巩义市予华有限责任公司;VELOCITY 18R 型高速冷冻离心机,澳大利亚 Dynamica 公司;ULtiMate 3000型高效液相色谱仪,美国赛默飞有限公司;Agilent 7890A-5 975C型气质联用仪,安捷伦科技有限公司;HP-INNOWax色谱柱(60 mm×320 mm,0.25 μm),手动固相微萃取进样器50/30 μm DVB/CAR/PDMS萃取头(57328-U),美国Supelco公司;
1.3 实验方法
1.3.1 生产工艺流程
豆清饮料生产工艺如下:
豆清液过滤→添加配料→调节pH→灭菌→接种→发酵→离心→豆清饮料
豆清液过滤,添加低聚果糖质量分数为5%、麦芽汁质量分数为4%、酒花质量分数为0.02%,麦芽糖质量分数为6%,调节pH 6.0,105 ℃、8 min进行灭菌之后接种,接种量5%、菌液浓度108 CFU/mL,菌液的制备:菌种分别在MRS培养基上进行活化,分别接种于5 mL灭菌的豆清液培养基中进行驯化,对已驯化的微生物分别先后以3%的接种量于28 ℃,24 h培养条件下进行100、500 mL两级扩大培养,进行活菌计数,克鲁维酵母、明串珠菌、鼠李糖乳杆菌按照1∶1∶1的比例进行复配。28 ℃条件下进行发酵,每隔2 h取样测指标的变化情况,22 h结束发酵。
1.3.2 大豆异黄酮测定
参照GB/T 23788—2009《保健食品中大豆异黄酮的测定方法 高效液相色谱法》[8],并做一定调整,取15 mL 样品转移到锥形瓶中,加入35 mL 80%(体积分数)甲醇,室温超声处理提取1 h。将样品提取液在5 000 r/min下离心12 min,离心之后的样品进行旋转蒸发浓缩,用10%甲醇溶液定容至10 mL容量瓶,均匀取1 mL样品提取液在10 000 r/min下离心10 min,吸取1 mL离心后的液体通过0.45 μm的滤膜,供高效液相色谱仪测定,每组实验重复3次。色谱柱参数:流动相A为0.1%乙酸溶液、流动相B为0.1%乙酸乙腈溶液、波长260 nm、流速1 mL/min、柱温40 ℃、进样量20 μL。根据峰面积与标准样品质量浓度的关系建立线性回归方程,见表1。
表1 大豆异黄酮回归方程
Table 1 Regression equation of soybean isoflavones

大豆异黄酮回归方程决定系数大豆苷 y=1.037 6x+0.095 4R2=0.996 4黄豆黄苷y=3.018 5x+0.139 5R2=0.996 9染料木苷y=1.407 9x+0.182 5R2=0.995 3大豆苷元y=1.449 8x+0.296 5R2=0.995 0黄豆黄素y=1.432 0x+0.146 4R2=0.996 4染料木素y=1.316 7x+0.312 5R2=0.997 2
1.3.3 有机酸测定
参考王容等[9]的方法,并稍作修改,取样液5 mL,在10 000 r/min下离心20 min,取上清液1 mL,过0.22 μm滤膜,供高效液相色谱仪测定。液相色谱条件:色谱柱为CAPE-CELL PAK MG-C18柱(4.6 mm×250 mm,5 μm),柱温30 ℃,检测波长210 nm,流动相V(甲醇)∶V(pH=2.65 0.01 mol/L KH2PO4溶液)=3∶97;流速1.0 mL/min;进样量20 μL。根据峰面积与标准样品质量浓度的关系建立线性回归方程,见表2。
表2 有机酸回归方程
Table 2 Regression equation of organic acids
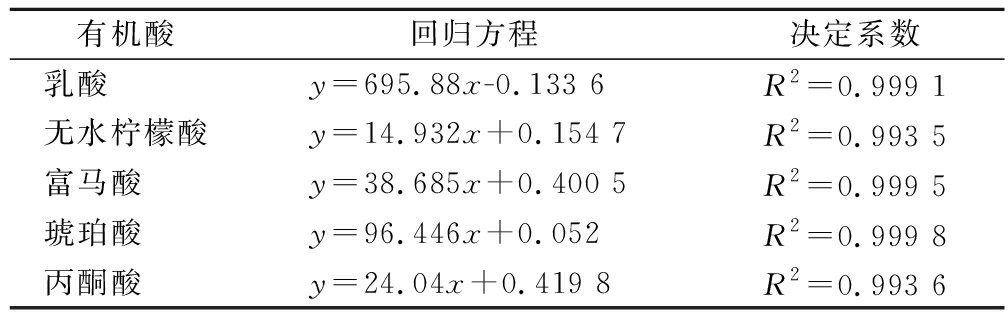
有机酸回归方程决定系数乳酸 y=695.88x-0.133 6R2=0.999 1无水柠檬酸y=14.932x+0.154 7R2=0.993 5富马酸 y=38.685x+0.400 5R2=0.999 5琥珀酸 y=96.446x+0.052R2=0.999 8丙酮酸 y=24.04x+0.419 8R2=0.993 6
1.3.4 风味物质测定
样品处理:均匀称取2 g样品放入萃取瓶内,在55 ℃恒温水浴搅拌平衡30 min。用50/30 μm DVB/CAR/PDMS萃取纤维头吸附30 min,将纤维头于GC进样口270 ℃解吸附5 min。
GC条件:色谱柱:HP-INNOWax色谱柱(60 mm×320 mm, 0.25 μm);进样方式:不分流进样,载气流速1.0 mL/min,进样口250 ℃。升温程序:60 ℃保持5 min,以8 ℃/min升至100 ℃,保持3 min,以8 ℃/min升至230 ℃,保持5 min。
MS条件:电离方式:EI;色谱-质谱接口温度250 ℃;离子化能量70 eV;离子源温度250 ℃;四级杆温度180 ℃;MS扫描范围m/z 20~550。
数据处理:检测的化合物与NIST.11 library相匹配,匹配度大于80(最大值为100)的鉴定结果予以确认;采用峰面积归一化法对各化合物进行相对定量。
1.3.5 数据处理
实验结果每组重复3次,数据采用Excel 2017、Origin 2018和IBM SPSS Statistics 22.0进行图像绘制及处理。
2 结果与分析
2.1 大豆异黄酮的变化分析
由图1可知,发酵0 h的豆清饮料中大豆苷、黄豆黄苷、染料木苷含量分别为(41.921±1.01)、(3.24±0.01)、(54.187±0) mg/kg,随着发酵时间的延长,整体呈下降趋势,经过微生物发酵22 h之后,大豆苷、黄豆黄苷、染料木苷含量减少至(17.613±1.00)、(0.039±0.07)、(21.983±0.07) mg/kg,下降率分别达到57.98%、98.79%、59.43%。发酵0 h的豆清饮料中大豆苷元、黄豆黄素、染料木素的含量为(10.643±0.30)、(3.273±0.01)、(6.945±1.01) mg/kg,随着时间的延长,含量呈直线上升。发酵22 h大豆苷元、黄豆黄素、染料木素的含量增加为(22.552±1.02)、(8.842±0.07)、(33.013±0.21) mg/kg,上升率达到52.81%、62.98%、78.96%。从整体看,黄酮苷下降率为60.10%、黄酮苷元上升率为67.61%。本研究结果表明可以得到富含染料木素的豆清饮料。黄酮类化合物清除自由基能力和螯合活性的能力与其化学结构直接相关,染料木素比大豆苷元和黄豆黄素具有更高的抗氧化活性[10]。发酵可以将黄酮苷转化为黄酮苷元,可能是乳酸菌产β-葡萄糖苷酶,MARAZZA等[11]研究发现鼠李糖乳杆菌CRL981产β-葡萄糖苷酶,能够在豆奶发酵过程中增加生物活性异黄酮,发酵12 h时黄酮苷转化为黄酮苷元的生物转化率达到100%。ZHU等[12]发现产β-葡萄糖苷酶的鼠李糖乳杆菌和副干酪乳杆菌对大豆异黄酮苷元的富集具有很大的潜力,大豆苷元和染料木素的含量发酵后从4.6%提高到93.78%。在微生物发酵过程中,与不溶性纤维结合的黄酮类化合物被释放出来,可以导致黄酮苷元含量的增加[13]。黄酮苷转化为黄酮苷元不是单一的转化方式,ZHU等[12]发现仅以β-葡萄糖苷酶活性作为转化率筛选指标是不可靠的。在发酵过程中,大豆异黄酮总含量呈递减的趋势,主要是大部分黄酮在离解条件下,容易与氧气结合,发生氧化反应,所以在过程中,出现含量的降低[14]。

a-大豆苷、染料木苷、黄豆黄苷;b-大豆苷元、黄豆黄素、染料木素;c-黄酮苷、黄酮苷元、总大豆异黄酮
图1 发酵过程中大豆异黄酮的含量
Fig.1 Contents of soybean isoflavones at different fermentation time
2.2 大豆异黄酮的变化曲线拟合
用Origin 2018对豆清饮料中的大豆异黄酮与发酵时间进行曲线拟合,拟合结果见表3。根据以上拟合曲线,可以得到黄酮苷元达到的最高值的理论发酵时间。黄酮苷元含量与发酵时间之间的关系为:y=0.021 56x2+1.464 68x+21.030 53,对函数求导数得:y′=0.043 12x+1.464 68,随着发酵时间的延长,黄酮苷元含量呈现一次函数的变化。同理,可以得到大豆苷、染料木苷、黄豆黄苷、大豆苷元、黄豆黄素、染料木素、黄酮苷的变化趋势。
表3 发酵过程中大豆异黄酮含量变化拟合曲线
Table 3 Fitting curve of soybean isoflavone content during fermentation
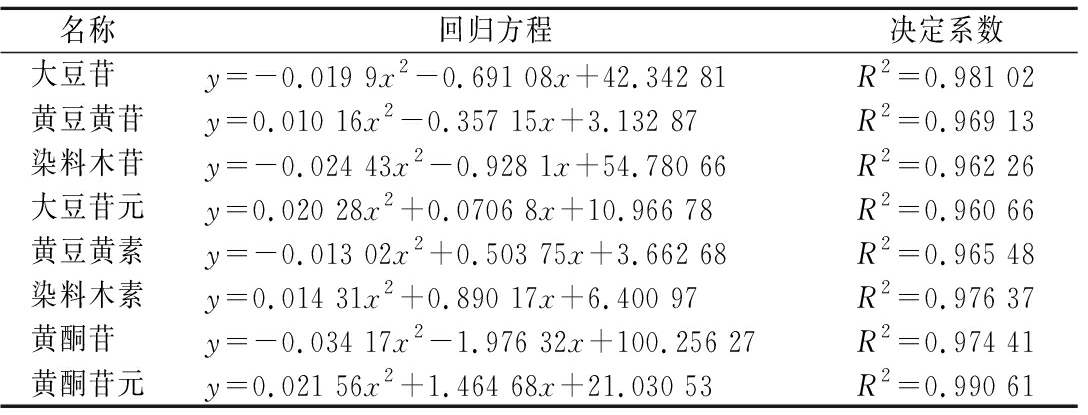
名称回归方程决定系数大豆苷 y=-0.019 9x2-0.691 08x+42.342 81R2=0.981 02黄豆黄苷y=0.010 16x2-0.357 15x+3.132 87R2=0.969 13染料木苷y=-0.024 43x2-0.928 1x+54.780 66R2=0.962 26大豆苷元y=0.020 28x2+0.0706 8x+10.966 78R2=0.960 66黄豆黄素y=-0.013 02x2+0.503 75x+3.662 68R2=0.965 48染料木素y=0.014 31x2+0.890 17x+6.400 97R2=0.976 37黄酮苷 y=-0.034 17x2-1.976 32x+100.256 27R2=0.974 41黄酮苷元y=0.021 56x2+1.464 68x+21.030 53R2=0.990 61
2.3 有机酸的变化分析
如图2所示,发酵22 h时,丙酮酸的含量为0.000 g/L、乳酸(0.63±0.008) g/L、无水柠檬酸(2.672±0.002) g/L、富马酸(0.12±0.02) g/L、琥珀酸(0.231±0.01) g/L。无水柠檬酸的含量占比约64%、乳酸占比约18%、琥珀酸12%、富马酸占比约5%。无水柠檬酸占比重高存在以下原因,pH值的调节采用无水柠檬酸。乳酸占比重高主要是植物乳杆菌进行了柠檬酸代谢,自身通过2-羟基羧酸盐转运蛋白运输柠檬酸盐,柠檬酸盐在柠檬酸裂解酶复合物催化下转化为草酰乙酸盐,再经草酰乙酸脱羧酶脱羧产生丙酮酸最后生成乳酸及芳香化合物。乔明武等[15]运用乳酸菌、酵母菌发酵豆清液,有机酸含量均有显著性提高,柠檬酸达(1.207±0.005) g/L、乳酸(1.044±0.004) g/L。TU等[16]发现柠檬酸在发酵过程中变化不大,基本保持在1.1~1.3 g/L。FEI等[17]发酵豆清液36 h,酒石酸、乳酸、柠檬酸分别达到(1.03±0.04)、(6.21±0.01)、(0.52±0.0) g/L,与本研究结果一致。
在发酵过程中,乳酸菌经糖酵解途径将原料中的还原糖降解成丙酮酸,丙酮酸在乳酸脱氢酶的作用下,直接被还原为乳酸,所以在发酵过程中,乳酸含量不断增加,丙酮酸作为中间代谢产物,发酵过程中呈现动态变化,如图2所示,在0~14 h时,丙酮酸含量检测不到。柠檬酸是三羧酸循环的中间代谢产物,含量处于动态变化中,由于苹果酸-乳酸发酵过程中乳酸菌将柠檬酸分解成丙酮酸、乙酸或者乳酸。琥珀酸在苹果酸-乳酸途径中,可通过部分丙酮酸氧化为乙酸和H+,H+再将延胡索酸还原得到琥珀酸[18],处于动态平衡。
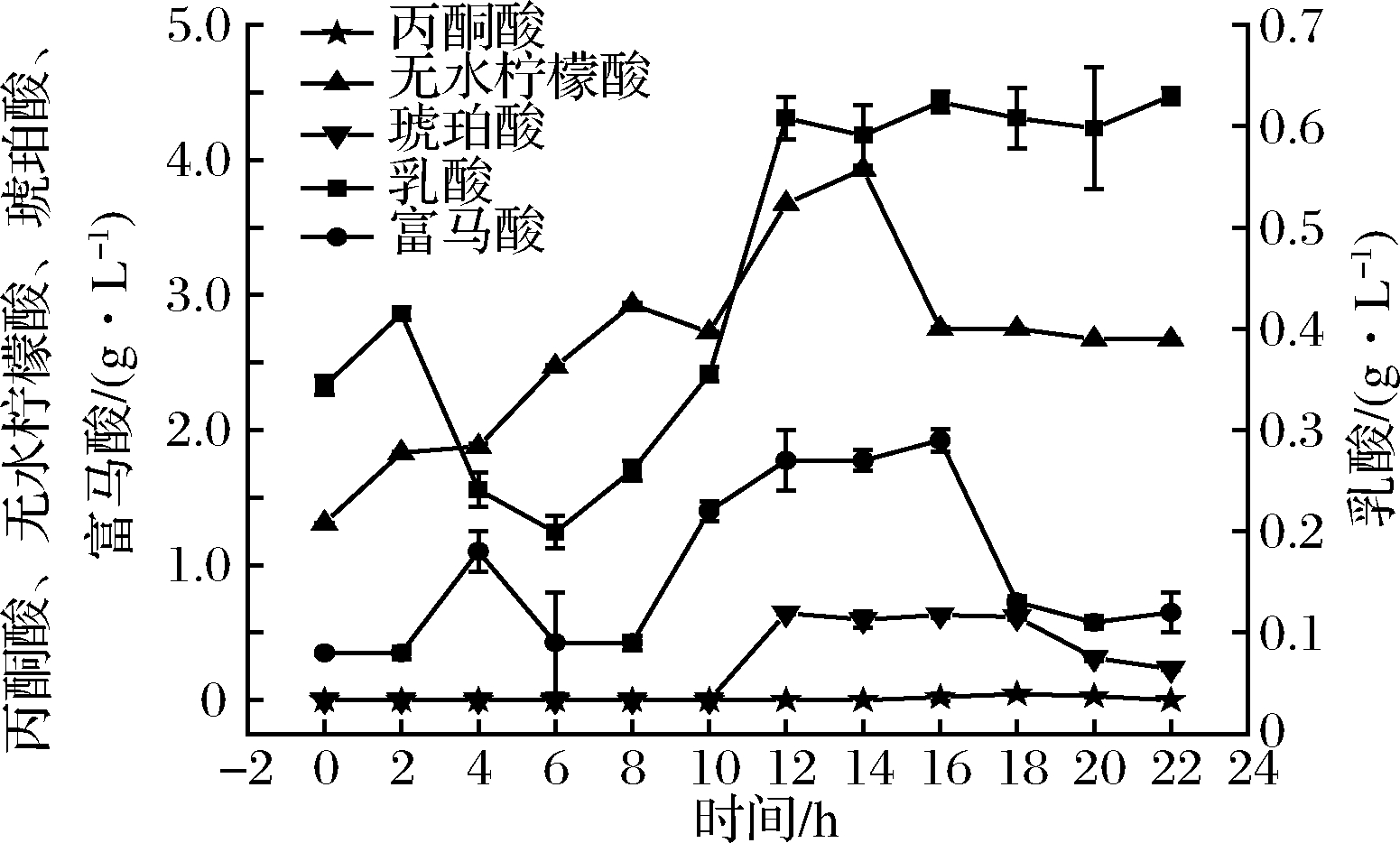
图2 不同发酵时间有机酸含量变化
Fig.2 Changes of organic acid content in different fermentation time
2.4 豆清饮料品质相关性分析
根据表4的品质指标之间的相关性分析表明,乳酸与琥珀酸、大豆苷、黄豆黄苷、染料木苷、黄酮苷、大豆苷元、染料木素、黄豆黄素、黄酮苷元呈显著关系(r为0.848、-0.809、-0.628、-0.785、-0.794、0.718、0.671、0.802、0.781),柠檬酸与富马酸、琥珀酸、黄豆黄苷、黄豆黄素呈显著关系(r为0.637、0.689、-0.803、0.760),其中,染料木素与各种有机酸中的乳酸之间的相关性最高(r为0.802)。有机酸可以促进黄酮苷水解为黄酮苷元,乳酸可以促进染料木素的生成。研究发现乳酸水溶液浓度2.0 mol/L,黄酮苷水解率可达100%[19]。乳酸与柠檬酸的浓度相对比较高,所以其他有机酸的相关性比较小。
表4 豆清饮料品质指标之间的相关性分析
Table 4 Correlation analysis of quality index of soybean whey beverage
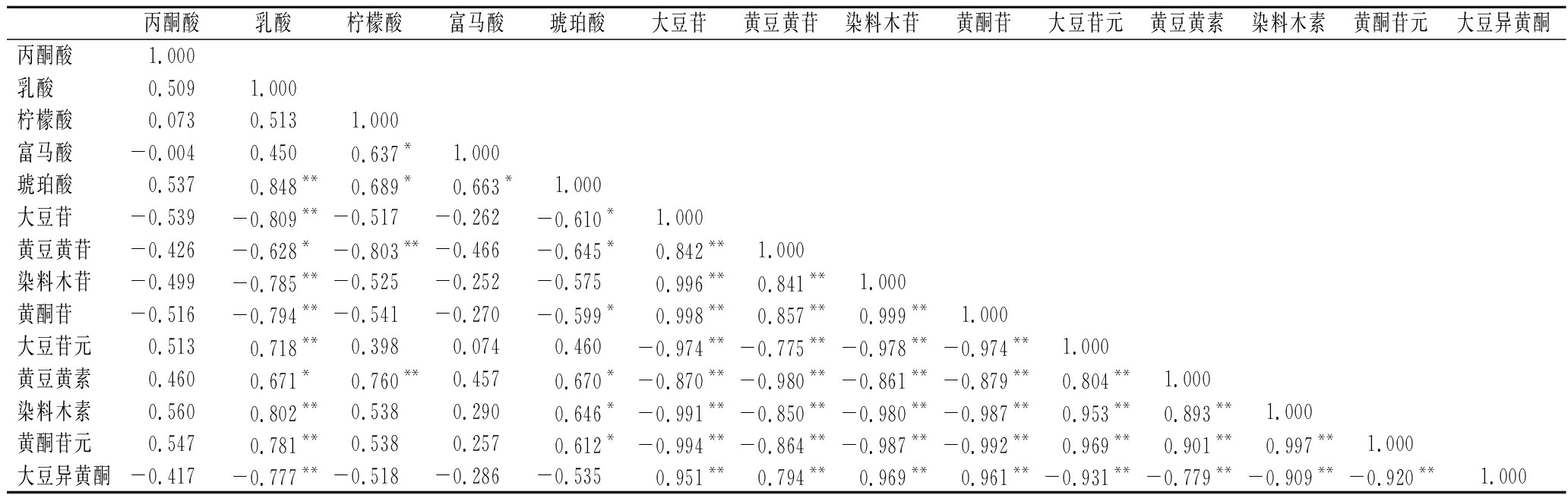
丙酮酸乳酸柠檬酸富马酸琥珀酸大豆苷黄豆黄苷染料木苷黄酮苷大豆苷元黄豆黄素染料木素黄酮苷元大豆异黄酮丙酮酸 1.000乳酸 0.5091.000柠檬酸 0.0730.5131.000富马酸 -0.0040.4500.637*1.000琥珀酸 0.5370.848**0.689*0.663*1.000大豆苷 -0.539-0.809**-0.517-0.262-0.610*1.000黄豆黄苷 -0.426-0.628*-0.803**-0.466-0.645*0.842**1.000染料木苷 -0.499-0.785**-0.525-0.252-0.5750.996**0.841**1.000黄酮苷 -0.516-0.794**-0.541-0.270-0.599*0.998**0.857**0.999**1.000大豆苷元 0.5130.718**0.3980.0740.460-0.974**-0.775**-0.978**-0.974**1.000黄豆黄素 0.4600.671*0.760**0.4570.670*-0.870**-0.980**-0.861**-0.879**0.804**1.000染料木素 0.5600.802**0.5380.2900.646*-0.991**-0.850**-0.980**-0.987**0.953**0.893**1.000黄酮苷元 0.5470.781**0.5380.2570.612*-0.994**-0.864**-0.987**-0.992**0.969**0.901**0.997**1.000大豆异黄酮-0.417-0.777**-0.518-0.286-0.5350.951**0.794**0.969**0.961**-0.931**-0.779**-0.909**-0.920**1.000
注:**表示差异极显著(P<0.01);*表示差异显著(P<0.05)
大豆苷、黄豆黄苷、染料木苷、黄酮苷相互之间呈现极显著正相关性(P<0.01),大豆苷元、染料木素、黄豆黄素、黄酮苷元相互之间呈极显著正相关(P<0.01)。黄酮苷与黄酮苷元呈现极显著负相关(r为-0.987)。大豆异黄酮苷的变化与其组成的各个物质的变化呈显著正相关,与黄酮苷元呈显著负相关,可以得出黄酮苷元主要是由黄酮苷水解得到。
2.5 风味物质的变化分析
由表5可知,豆清液和豆清饮料共鉴定出37种化合物,包括醇类8种、烯烃类7种、酯类6种、醛类5种、酮类2种、酸类2种、芳香化合物2种、烷烃1种、其他类4种。由表6和图3可知,不同发酵时间检测的挥发性化合物有差别且总挥发性物质含量存在显著差异(P<0.05),随着发酵时间的延长,其挥发性物质种类数量检出呈先增加、后减少、再增加的趋势。表6分析了不同时间中鉴定出不同化合物的种类与数量。从统计结果来看,豆清液中检测出11种挥发性风味物质,主要是醇类与醛类[20],大部分醇类和醛类物质是在大豆脂氧合酶的催化作用下,由亚油酸和亚麻酸氧化而形成的[21]。发酵至6 h时,烯烃类物质和酯类物质种类增加,发酵12 h时总计检出24种挥发性物质,其中醇类、烯烃类、醛类和酯类物质占主要比例,发酵至22 h时检出17种风味物质。

图3 豆清饮料不同发酵时间风味物质含量变化
Fig.3 Variation of flavor substance content in soybean whey beverage with different fermentation time
表5 豆清饮料的风味物质 单位:%
Table 5 Flavor substance of soybean whey beverage
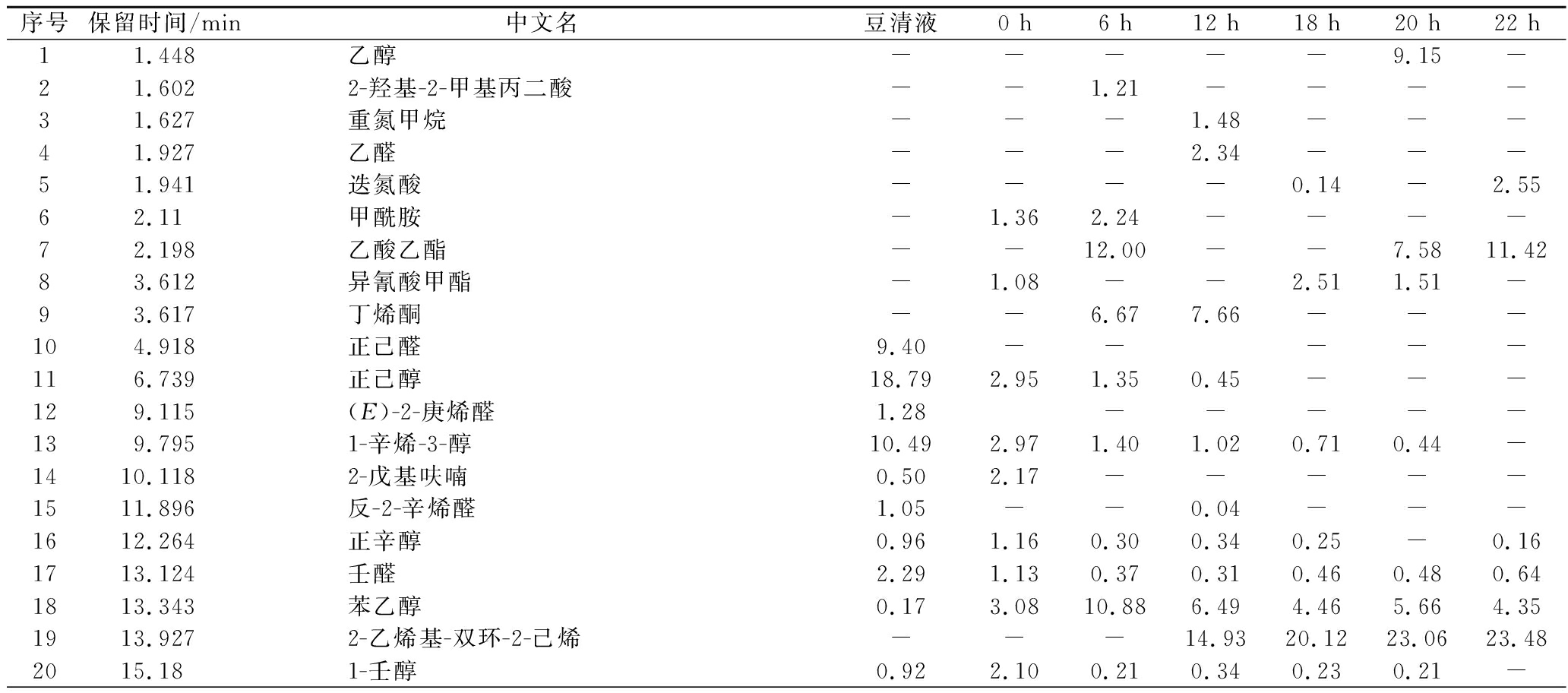
序号保留时间/min中文名豆清液0 h6 h12 h18 h20 h22 h11.448乙醇-----9.15-21.6022-羟基-2-甲基丙二酸--1.21----31.627重氮甲烷---1.48---41.927乙醛---2.34---51.941迭氮酸----0.14-2.5562.11甲酰胺-1.362.24----72.198乙酸乙酯--12.00--7.5811.4283.612异氰酸甲酯-1.08--2.511.51-93.617丁烯酮--6.677.66---104.918正己醛9.40-----116.739正己醇18.792.951.350.45---129.115(E)-2-庚烯醛1.28-----139.7951-辛烯-3-醇10.492.971.401.020.710.44-1410.1182-戊基呋喃0.502.17-----1511.896反-2-辛烯醛1.05--0.04---1612.264正辛醇0.961.160.300.340.25-0.161713.124壬醛2.291.130.370.310.460.480.641813.343苯乙醇0.173.0810.886.494.465.664.351913.9272-乙烯基-双环-2-己烯---14.9320.1223.0623.482015.181-壬醇0.922.100.210.340.230.21-
续表5
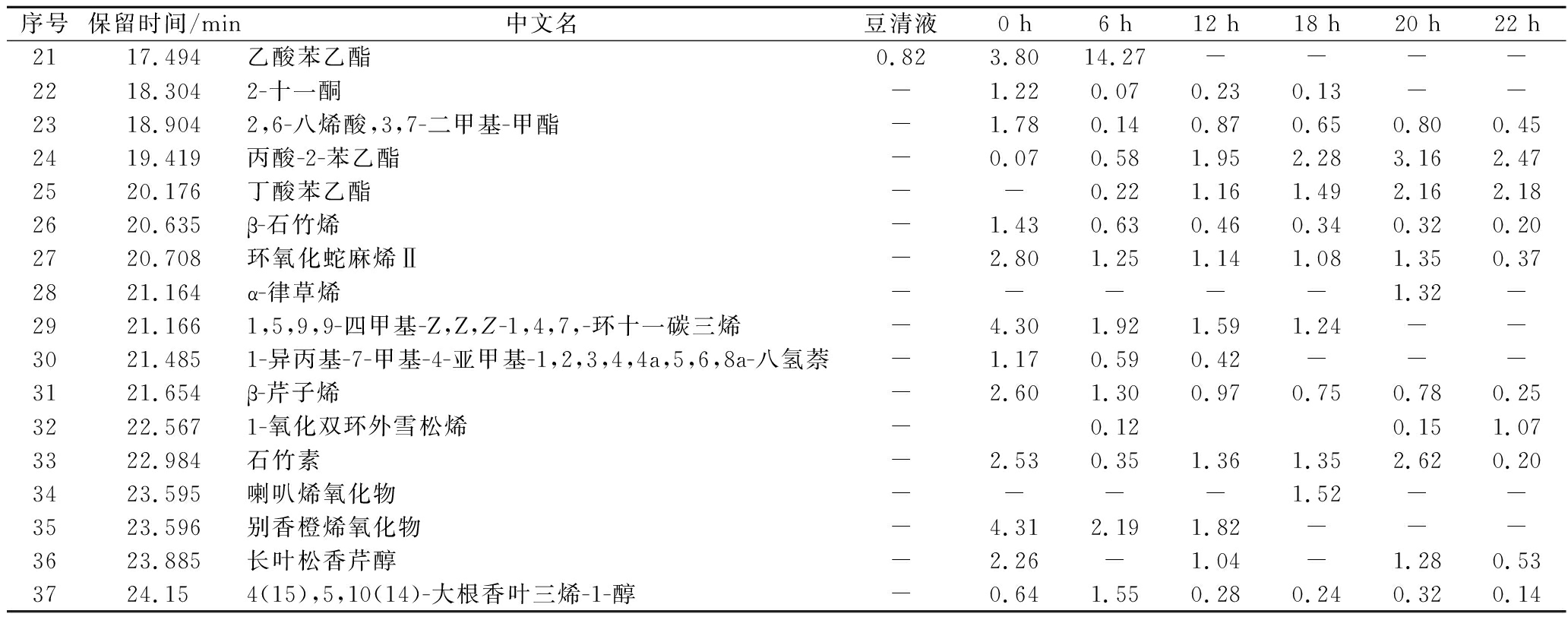
序号保留时间/min中文名豆清液0 h6 h12 h18 h20 h22 h2117.494乙酸苯乙酯0.823.8014.27----2218.3042-十一酮-1.220.070.230.13--2318.9042,6-八烯酸,3,7-二甲基-甲酯-1.780.140.870.650.800.452419.419丙酸-2-苯乙酯-0.070.581.952.283.162.472520.176丁酸苯乙酯--0.221.161.492.162.182620.635β-石竹烯-1.430.630.460.340.320.202720.708环氧化蛇麻烯Ⅱ-2.801.251.141.081.350.372821.164α-律草烯-----1.32-2921.1661,5,9,9-四甲基-Z,Z,Z-1,4,7,-环十一碳三烯-4.301.921.591.24--3021.4851-异丙基-7-甲基-4-亚甲基-1,2,3,4,4a,5,6,8a-八氢萘-1.170.590.42---3121.654β-芹子烯-2.601.300.970.750.780.253222.5671-氧化双环外雪松烯-0.120.151.073322.984石竹素-2.530.351.361.352.620.203423.595喇叭烯氧化物----1.52--3523.596别香橙烯氧化物-4.312.191.82---3623.885长叶松香芹醇-2.26-1.04-1.280.533724.154(15),5,10(14)-大根香叶三烯-1-醇-0.641.550.280.240.320.14
表6 豆清饮料挥发性化合物数量统计
Table 6 Statistical analysis of volatile compounds in soybean whey beverage
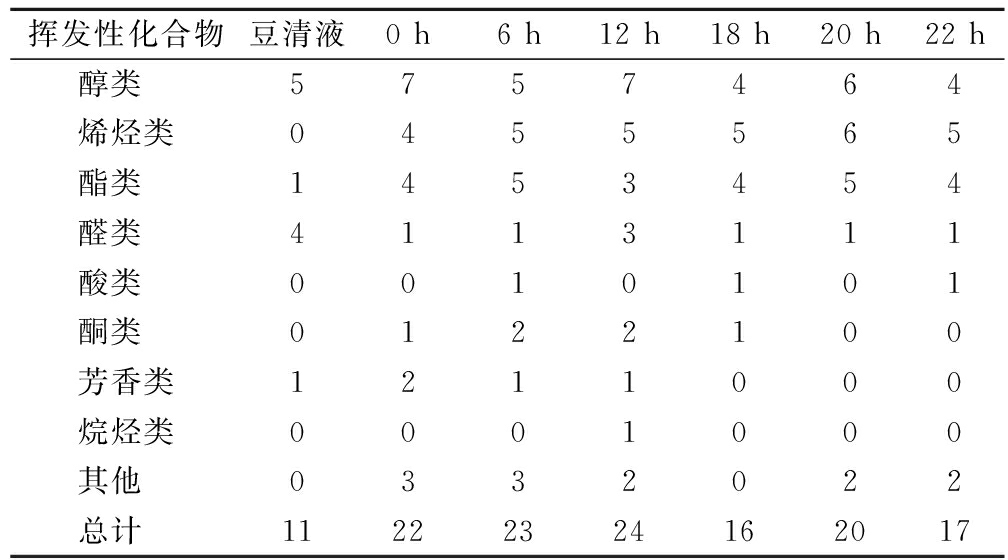
挥发性化合物豆清液0 h6 h12 h18 h20 h22 h醇类 5757464烯烃类0455565酯类 1453454醛类 4113111酸类 0010101酮类 0122100芳香类1211000烷烃类0001000其他 0332022总计 11222324162017
由表5可知,豆清液中正己醇、1-辛烯-3-醇、正己醛、壬醛占主要比例,占比分别为18.79%、10.49%、9.40%、2.29%。这些都被描述为产生令人不快的味道、香气,在乳酸菌的代谢作用下,不愉快的风味都被代谢到较低或检测不到的水平,形成了新的风味酯类和醛类。豆清液中检测到的呋喃物质2-戊基呋喃,它有一种豆类味,会导致豆制品的油脂味和豆类味,经过发酵之后,被微生物完全代谢。醛类由于其阈值低,且具有类脂肪香味及清新果香,是构成特征性风味的主要成分。壬醛有橘子和玫瑰的气味,发酵22 h时,增长到0.64%。正辛醇、苯乙醇这些高级醇在酵母的氨基酸合成途径中形成,适量的高级醇可以提高香气的层次感和浓郁度。苯乙醇具有新鲜面包香、清甜的玫瑰样花香,发酵6 h时,相对含量达到10.88%,发酵后期,相对含量减少至4.35%。主要是在发酵过程中,醛类物质可以被氧化或还原为各自的酸或醇。醇类物质与酸类物质形成酯类物质,随着发酵时间的变化,苯乙醇反应生成丙酸-2-苯乙酯、丁酸苯乙酯、乙酸苯乙酯的含量也随着增加。2-乙烯基-双环-2-己烯在豆清饮料中占主要风味物质,从0.00%增加到23.48%,为豆清饮料提供香甜风味。酯类化合物是构成香气的重要物质,酯类具有花、果香,对主体香型及风格具有重要的影响,乙酸苯乙酯会提供果香、花香、蜜糖及热带水果香气、带有酵母香的味道[22],发酵6 h时达到14.67%,在整体风味中具有重要贡献值。β-石竹烯具有淡的似丁香香味,主要用于配制精仿制品和定香剂,属于天然等同香料和人造香料,可从丁香叶油、丁香茎油、肉桂叶油等物质中分离。环氧化蛇麻烯II是植物啤酒花球果提取精油中的成分之一,主要是原料中携带;酮类的风味通常是令人满意的风味,例如,2-十一酮有油脂气息,具有特有的类似芸香的香气,浓度低时具有类似桃子的香气。1-辛烯-3-酮具有强烈的壤香、蘑菇香。发酵6、12 h时产生了丁烯酮,丁烯酮具有臭味,但是发酵完成时被微生物代谢。长叶松香芹醇、别香橙烯氧化物、喇叭烯氧化物、β-芹子烯、石竹素一般常见于植物提取物中,具有保湿,抗氧化、抑菌等功能特性。
3 结论
本研究以豆清液为原料,接种克鲁维酵母、肠膜明串珠菌、鼠李糖乳杆菌发酵成豆清饮料,发酵22 h之后,大豆苷、黄豆黄苷、染料木苷含量减少至(17.613±1.00)、(0.039±0.07)、(21.983±0.07) mg/kg,大豆苷元、黄豆黄素、染料木素的含量增加为(22.552±1.02)、(8.842±0.07)、(33.013±0.21) mg/kg,在整个发酵过程中,黄酮苷下降率为60.10%、黄酮苷元上升率为67.61%,大豆异黄酮苷的变化与其组成的各个物质的变化呈显著正相关,与黄酮苷元呈显著负相关,黄酮苷元与之相反,可以得出黄酮苷元主要是由黄酮苷水解得到。发酵22 h时,丙酮酸的含量为0.000 g/L、乳酸(0.63±0.008) g/L、无水柠檬酸(2.672±0.002) g/L、富马酸(0.12±0.02) g/L、琥珀酸(0.231±0.01) g/L,进行相关性分析,发现一定浓度的有机酸可以促进黄酮苷水解为黄酮苷元。豆清液发酵形成豆清饮料的过程中,共鉴定出37种化合物。在微生物的代谢作用下,豆清液中令人不快的味道、香气正己醇、1-辛烯-3-醇、正己醛、壬醛被代谢到较低或检测不到的水平,形成了新的具有花、果香风味酯类和醛类,生成具有抗氧化、抑菌等功能特性的风味物质。该研究可以为豆清饮料提供理论依据。
[1] 孔彦卓, 尹乐斌, 雷志明, 等.豆清液综合利用研究进展[J].现代农业科技, 2017(1):247-249.
KONG Y Z, YIN L B, LEI Z M, et al.Research progress on comprehensive utilization of soybean processing wastewater[J].Modern Agricultural Science and Technology, 2017(1):247-249.
[2] 杨凤吾. 黄浆水发酵生产细菌纤维素的研究及应用[D].长沙:湖南农业大学, 2009.
YANG F W.Studies on the production of bacterial cellulose using bean curd wastewater and application of bacterial cellulose[D].Changsha:Hunan Agricultural University, 2009.
[3] 欧红艳, 赵良忠, 王容, 等.多菌株协同发酵豆清饮料工艺优化[J].食品安全质量检测学报, 2020, 11(16):5 635-5 640.
OU H Y, ZHAO L Z, WANG R, et al.Optimization of multi-strain co-fermentation process for Douqing beverage[J].Journal of Food Safety & Quality, 2020, 11(16):5 635-5 640.
[4] CHUA J Y, LIU S Q.Soy whey:More than just wastewater from tofu and soy protein isolate industry[J].Trends in Food Science & Technology, 2019, 91:24-32.
[5] 王欣欣. 利用黄浆水制备富含苷元型大豆异黄酮发酵乳的研究[D].青岛:中国海洋大学, 2014.
WANG X X.Study on production of soybean whey-yogurt rich with isoflavone aglycones[D].Qingdao:Ocean University of China, 2014.
[6] 杜欣. 发酵黄浆水的抗氧化和抑菌活性研究[D].广州:华南理工大学, 2014.
DU X.Studies on antioxidant and bacteriostatic activities of fermented soybean wheys[D].Guangzhou:South China University of Technology, 2014.
[7] LEIS K, ![]() A, RACINOWSKI M, et al.Genistein-a supplement improving efficiency of the human body:A review[J].Science & Sports, 2021,36(5):359-367.
A, RACINOWSKI M, et al.Genistein-a supplement improving efficiency of the human body:A review[J].Science & Sports, 2021,36(5):359-367.
[8] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员.GB/T 23788—2009 保健食品中大豆异黄酮的测定方法 高效液相色谱法[S].北京:中国标准出版社, 2009.
General Administration of Quality Supervision, Inspection and Quarantine of the People′s Republic of China, National Committee of Standardization Administration of China.GB/T 23788—2009, Determination of soy isoflavones in health-care food High performance liquid chromatography [S].Beijing:Standards Press of China, 2009.
[9] 王容, 赵良忠, 李明, 等.米酸汤在发酵过程中品质变化及发酵动力学研究[J].食品与发酵工业, 2020, 46(1):82-90.
WANG R, ZHAO L Z, LI M, et al.Study on the quality change and fermentation kinetics of rice sour soup during fermentation[J].Food and Fermentation Industries, 2020, 46(1):82-90.
[10] HEIM K E, TAGLIAFERRO A R, BOBILYA D J.Flavonoid antioxidants:Chemistry, metabolism and structure-activity relationships[J].The Journal of Nutritional Biochemistry, 2002, 13(10):572-584.
[11] MARAZZA J A, GARRO M S, SAVOY DE GIORI G.Aglycone production by Lactobacillus rhamnosus CRL981 during soymilk fermentation.[J].Food Microbiology, 2009, 26(3):333-339.
[12] ZHU Y, WANG Z M, ZHANG L.Optimization of lactic acid fermentation conditions for fermented tofu whey beverage with high-isoflavone aglycones[J].LWT, 2019, 111:211-217.
[13] CHANDRASEKARA A, SHAHIDI F.Bioaccessibility and antioxidant potential of millet grain phenolics as affected by simulated in vitro digestion and microbial fermentation[J].Journal of Functional Foods, 2012, 4(1):226-237.
[14] 从彦丽, 彭梦雪, 刘冬, 等.柑橘在体外模拟胃肠消化过程中总多酚、总黄酮及总抗氧化活性的变化规律[J].食品科学, 2016, 37(17):96-103.
CONG Y L, PENG M X, LIU D, et al.Changes in total polyphenols, total flavonoids and antioxidant activity of Citrus during in vitro gastrointestinal digestion process[J].Food Science, 2016, 37(17):96-103.
[15] 乔明武, 何人可, 宋莲军, 等.乳酸菌和酵母菌发酵黄浆水制备有机酸工艺优化[J].农产品加工, 2018(17):19-21;28.
QIAO M W, HE R K, SONG L J,et al.Optimal preparation technology of organic acids by lactic acid bacteria and yeast fermentation of yellow pulp water[J].Farm Products Processing, 2018(17):19-21;28.
[16] TU C H, TANG S J, AZI F, et al.Use of kombucha consortium to transform soy whey into a novel functional beverage[J].Journal of Functional Foods, 2019, 52:81-89.
[17] FEI Y T, LIU L, LIU D M, et al.Investigation on the safety of Lactobacillus amylolyticus L6 and its fermentation properties of tofu whey[J].LWT, 2017, 84:314-322.
[18] 李维妮, 张宇翔, 魏建平, 等.益生菌发酵苹果汁工艺优化及有机酸的变化[J].食品科学, 2017, 38(22):80-87.
LI W N, ZHANG Y X, WEI J P, et al.Optimization of fermentation of apple juice by probiotics and organic acids evolution during fermentation[J].Food Science, 2017, 38(22):80-87.
[19] 谭乃迪, 于丽颖, 张鹏.乳酸催化大豆异黄酮糖苷水解的工艺研究[J].食品工业, 2016, 37(3):21-23.
TAN N D, YU L Y, ZHANG P.Synthetic research of soybean isoflavone glycoside hydrolyzed into isoflavone aglucon by lactic acid catalysis[J].The Food Industry, 2016, 37(3):21-23.
[20] ACHOURI A, BOYE J I, ZAMANI Y.Identification of volatile compounds in soymilk using solid-phase microextraction-gas chromatography[J].Food Chemistry, 2006, 99(4):759-766.
[21] MIZUTANI T, HASHIMOTO H.Effect of grinding temperature on hydroperoxide and off-flavor contents during soymilk manufacturing process[J].Journal of Food Science, 2004, 69(3):SNQ112-SNQ116.
[22] 王昕悦, 曹少军, 赵华杰, 等.不同菌种发酵苹果浓缩汁的风味成分变化分析[J].食品与发酵工业, 2017, 43(4):238-243.
WANG X Y, CAO S J, ZHAO H J, et al.Analysis on flavor compounds of concentrated apple juice fermented by different strains[J].Food and Fermentation Industries, 2017, 43(4):238-243.