大肠杆菌O157∶H7是肠出血性大肠杆菌中最典型的一种食源性致病菌,因产生志贺毒素从而引起腹泻、出血性结肠炎、溶血性尿毒综合症等疾病,严重时有可能导致死亡[1-2]。但用抗生素控制大肠杆菌O157∶H7存在争议,因为抗生素可能导致志贺毒素被大量释放[3]。临床实验表明,抗生素治疗可能增加溶血性尿毒综合症的风险[3-4]。另外,抗生素的滥用致使耐药性大肠杆菌O157的数量增加[3,5]。因此,寻找新型的抗菌物质刻不容缓。
近几年,噬菌体作为一种新型的抑菌剂开始被大量研究,食源性致病菌的噬菌体被分离,并应用于医疗、食品等多个领域[3,6-7]。但噬菌体作为活体病毒,不易保存且不易被人们接受,而具有抑菌作用的内溶酶和穿孔素能很好地解决这些问题[8]。穿孔素和内溶酶在噬菌体裂解细菌中发挥着重要的作用,“穿孔素-内溶酶”裂解体系是dsDNA噬菌体经典的裂解系统[9-10]。内溶酶是一种由dsDNA噬菌体编码的酶,可降解细菌的肽聚糖并导致细菌死亡[8,11]。高效、抑菌谱宽、不容易产生耐药性等优点使内溶酶开始应用于医疗、食品安全、病原菌检测等各个方面[8,11-12]。穿孔素是一种含有跨膜结构的疏水蛋白。在噬菌体裂解细菌过程中,通过在细胞膜上形成孔径,协助内溶酶与肽聚糖接触[13]。
本实验分离得到1株大肠杆菌O157∶H7噬菌体EC-p9,通过十聚体寡核苷酸随机引物PCR扩增对该噬菌体进行初步鉴定,并通过生物信息学对该噬菌体的内溶酶和穿孔素的生理特征及跨膜结构等进行预测。最后,用大肠杆菌表达体系获得内溶酶Lys 9和穿孔素Hol 9。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株和质粒
噬菌体为本实验室分离保存的烈性大肠杆菌O157∶H7噬菌体EC-p9。感受态大肠杆菌Trans1-T1、BL21(DE3)和载体pEasy-Blunt E1,北京全式金生物有限公司。
1.1.2 试剂与培养基
LB肉汤和TSA培养基,青岛海博生物技术有限公司;氨苄青霉素、异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactopyranoside IPTG)、咪唑、SDS-PAGE凝胶试剂盒,索莱宝生物技术有限公司;Ni-IDA填料、胶回收试剂盒、质粒提取试剂盒、蛋白和DNA Marker,PCR扩增所用的酶和试剂,北京全式金生物有限公司;噬菌体DNA提取试剂盒,艾德莱生物有限公司;本研究所用DNA引物的合成和PCR产物的测序均由上海生工生物工程技术服务有限公司完成,DNA引物见表1。其他试剂均为国产分析纯。
表1 本研究所用引物
Table 1 Primers in this study

引物名称引物序列(5′-3′)来源十聚体寡核苷酸随机引物208ACGGCCGACC[14]228GCTGGGCCGA[14] 241GCCCGAGCGG[14]270TGCGCGCGGG[14]272AGCGGGCCAA[14]275CCGGGCAAGC[14]277AGGAAGGTGC[14]287CGAACGGCGG[14]Lys 9-FATGGCCATTCTAAAAC本实验室Lys 9-RTTAACAGAAACTCTTGTA本实验室Hol 9-FATGGCAGCACCTGAAT本实验室Hol 9-RTTATTTAGCCCTTCCTAA本实验室
1.2 实验方法
1.2.1 噬菌体的初步鉴定
用试剂盒提取噬菌体EC-p9的DNA,以此为模板,用引物208、228、242、270、272、275、277和287进行PCR扩增。PCR扩增条件如下:在94 ℃预变性4 min;94 ℃变性1 min,34 ℃复性1 min,72 ℃延伸2 min,共45个循环;最后72 ℃延伸10 min。根据扩增结果,选择条带少且亮PCR产物进行再次扩增,将产物胶回收后进行TA克隆并测序。通过国际生物技术信息中心(NCBI)(https://www.ncbi.nlm.nih.gov/)进行相似性比对,确定噬菌体的种类。根据相似度最高的噬菌体内溶酶和穿孔素的基因设计噬菌体EC-p9的内溶酶Lys 9和穿孔素Hol 2的引物。以噬菌体EC-p9的DNA为模板,Lys 9-F和Lys 9-R(Hol 9-F和Hol 9-R)为引物进行PCR扩增。扩增条件如下:95 ℃预变性5 min;95 ℃变性30 s,55 ℃复性30 s,72 ℃延伸1 min,共30个循环;最后72 ℃延伸10 min。检测PCR产物并送往上海生工测序。
1.2.2 内溶酶Lys 9和穿孔素Hol 9特性预测
利用NCBI提供的局域相似性比对工具(BLAST)(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行相似性分析。分别利用ExPASy ProtParamtool (https://web.expasy.org/protparam/)、SOPMA (https://npsa-prabi.ibcp.fr/)和TMHMM Server v.2.0(http://www.cbs.dtu.dk/services/TMHMM/)对内溶素和穿孔素的理化特征、二级结构和跨膜结构进行预测。
1.2.3 质粒pEASY-Lys 9和pEASY-Hol 9的构建与转化
按1∶7的摩尔质量比分别加入质粒pEasy-Blunt E1和内溶酶Lys 9或穿孔素Hol 9的基因,25 ℃反应5 min。然后加入50 μL Trans1-T1感受态细胞(刚解冻转化效果最好)混匀,冰浴30 min后,42 ℃水浴30 s,立刻置于冰中2 min。加入250 μL LB肉汤,在200 r/min、37 ℃的条件下培养1 h。将8 μL 500 mmol/L IPTG和40 μL 20 g/L X-gal混合均匀。并涂布在TSA平板(含100 g/L Amp+)上,37 ℃放置30 min后,取200 μL菌液涂布到平板上37 ℃过夜培养。随机挑取白色的单克隆进行菌落PCR、引物为载体pEasy-Blunt E1中配套的T7 promoter primer和目的基因的下游引物(Lys 9-R或Hol 9-R)。将验证正确的单克隆经摇瓶培养后提取质粒送到上海生工测序。将测序正确的质粒转到大肠杆菌BL21(DE3)。
1.2.4 内溶酶Lys 9的最佳诱导时间和诱导剂浓度
1.2.4.1 最佳诱导时间
挑取含有pEASY-Lys 9的BL21(DE3)到5 mL LB(含100 g/L Amp+)中,37 ℃,120 r/min培养16 h。按1%的接种量接种到100 mL的LB(含100 g/L Amp+),于37 ℃,200 r/min培养2~3 h(OD600为0.4~0.6)。加入终浓度为1 mmol/L的IPTG,在37 ℃、200 r/min的条件下诱导蛋白表达。诱导过程中每隔1 h取1 mL细菌样本,共8 h。取样后,迅速在4 ℃、12 000 r/min的条件下离心1 min。去除上清液,用36 μL无菌ddH2O重悬,加入4 μL的4×SDS-PAGE Loading Buffer混匀并煮沸3~5 min。待所有样本制备完成后进行SDS-PAGE电泳,从而检测不同诱导时间对内溶酶Lys 9表达的影响。
1.2.4.2 最佳IPTG诱导浓度
在OD600为0.4~0.6含有pEASY-Lys 9的BL21(DE3)中,分别加入终浓度为0.1、0.5、1、2、5 mmol/L的IPTG,并在 37 ℃,200 r/min的条件下振动培养5 h。每个浓度取1 mL细菌样本,按1.2.3.1小节的方法制备SDS-PAGE电泳上样液,并进行SDS-PAGE电泳,从而检测不同浓度的诱导剂对内溶酶Lys 9表达的影响。
1.2.5 穿孔素Hol 9的诱导表达
1.2.5.1 穿孔素Hol 9表达对大肠杆菌BL21(DE3)的作用
挑取含有pEASY-Hol 9的BL21(DE3)到5 mL的LB(含100 g/L Amp+)中,37 ℃,120 r/min培养16 h。按1%的接种量接种到100 mL的LB(含100 g/L Amp+),37 ℃培养5 h(OD600为0.4~0.6),加入终浓度为1 mmol/L的IPTG。在 37 ℃,200 r/min的条件下振动培养。在诱导过程中每隔20 min取菌液样品,并测定菌液OD600值,共测定2 h。根据细菌生长曲线的变化趋势,确定穿孔素Hol 9最佳表达时间并且描述Hol 9表达对细菌生长速度的影响。
1.2.5.2 最佳IPTG诱导浓度
在OD600值为0.4~0.6,含有pEASY-Hol 9的BL21(DE3)中,按1.2.3.2小节的方法检测不同浓度IPTG对穿孔素Hol 9表达的影响。其中诱导时间为30 min,其他条件不变。
1.2.6 重组蛋白的纯化
按最佳诱导条件表达内溶酶Lys 9和穿孔素Hol 9,诱导表达的菌液总体积为400 mL。诱导结束后,于8 000 r/min离心10 min,收集细菌沉淀。细菌沉淀用100 mL 无菌Tris-NaCl缓冲液(50 mmol/L Tris-HCl,500 mmol/L NaCl,pH 7.5)重悬,并在冰浴条件下超声破菌(120 W,工作3 s,间歇10 s,共 10 min)。将超声破碎后的产物在4 ℃、13 000 r/min下离心1 h,上清液用0.45 μm的滤膜过滤。将5 mL Ni-NTA填料装入柱子中,用25 mL Tris-NaCl缓冲液平衡柱子;将过滤后的上清液加入柱子,填料重悬,上清液自然流出并收集穿透液。再用25 mL Tris-NaCl缓冲液清洗柱子并收集洗涤液后,分别用50 mL 20 mmol/L和50 mmol/L的咪唑洗脱杂蛋白,并收集洗脱液。分别用10 mL 200 mmol/L和500 mmol/L的咪唑洗脱目的蛋白。将纯化好的目的蛋白用0.22 μm的滤膜过滤后加入20%的甘油,保存于-20 ℃,并进行SDS-PAGE检测。用微量紫外分光光度计检测蛋白浓度。
2 实验结果
2.1 噬菌体的初步鉴定
如图1-b所示,用引物270扩增PCR产物的条带少且亮,将产物再次进行PCR扩增,产物如图1-c所示。最终回收到一段700~800 bp的DNA片段,克隆测序并将序列通过Blasts工具对比,结果显示,噬菌体EC-p9与大肠杆菌噬菌体PE37相识度最高为81.20%。根据Escherichia phage PE37内溶酶和穿孔素的核苷酸序列设计引物,调取噬菌体EC-p9的内溶酶Lys 9和穿孔素Hol 9的核苷酸序列,获得长度分别为800和700 bp左右的PCR产物,见图1-d。

图1 琼脂糖凝胶电泳检测噬菌体EC-p9的DNA(a)、噬菌体的随机引物扩增的PCR产物(b)、
引物270的在扩增后的PCR产物(c)和噬菌体内溶酶和穿孔素的PCR产物(d)
Fig.1 EC-p9 DNA (a),PCR products of random primer amplification of phage (b),PCR products
by 270 primer (c) and PCR products of Lys 9 and Hol 9 (d) by agarose gel electrophoresis
注:M为marker;图a中,1和2为DNA。图b中,1、2、3、4、5、6、7和8分别为引物208、228、241、270、272、275、277和287的产物;
图c中,1为引物270的PCR再扩增产物;图d中,1和2分别穿孔素Hol 9 和内溶酶Lys 9的基因片段
2.2 内溶酶Lys 9和穿孔素Hol 9的特性预测
2.2.1 内溶酶Lys 9和穿孔素Hol 9的理化性质和二级结构预测
利用ExPASy Prot Paramtool预测内溶酶Lys 9和穿孔素Hol 9的特性,如表2所示。利用SOPMA内溶酶Lys 9和穿孔素Hol 9的二级结构,内溶酶Lys 9的α-螺旋、β-折叠、延长链、β-转角和无规则卷曲分别占氨基酸总数的54.62%、0%、9.62%、8.85%和36.92%。穿孔素Hol 9的α-螺旋、β-折叠、延长链、β-转角和无规则卷曲分别占氨基酸总数的44.44%、0%、13.43%、5.09%和37.04%。
表2 内溶酶Lys 9和穿孔素Hol 9的理化性质
Table 2 The physicochemical properties of
endolysin Lys9 and holin Hol 9

项目Hol 9Lys 9碱基数/bp652785氨基酸数216260分子质量/kDa24.9728.46等电点8.369.30不稳定系数44.6924.20亲水系数-0.17-0.093
2.2.2 内溶酶Lys 9和穿孔素Hol 9的结构域预测
利用Pfam数据库检索,对内溶酶Lys 9和穿孔素的Hol 9的结构域进行预测,见图2。结果表明,内溶酶Lys 9具有2个保守的结构域,其中1个为N端酶活结构域,属于Muraidase家族,能裂解β-1,4-糖苷键,是N-乙酰胞壁酸酶;另1个为肽聚糖结合域,属于PG_binding_1家族。穿孔素Hol 9含有1个保守的结构域,属于Bacteriophage T holin家族,能破坏细胞,并传递信息来控制细胞的裂解时间。

图2 内溶酶Lys 9(a)和穿孔素Hol 9(b)的结构域
Fig.2 The structural domain of endolysin Lys 9 (a) and
holin Hol 9 (b)
2.2.3 内溶酶Lys 9和穿孔素Hol 9的跨膜结构预测
利用TMHMM Server v.2.0对内溶酶Lys 9和穿孔素Hol 9的跨膜结构进行预测,见图3。结果显示,内溶酶Lys 9没有跨膜结构;穿孔素Hol 9在N端1~26位氨基酸处于胞内,47~126位氨基酸处于胞外,在27~46位氨基酸形成一个跨膜结构。
2.3 内溶酶Lys 9和穿孔素Hol 9质粒的构建
按照1.2.2小节的方法构建重组表达质粒pEASY-Lys 9和pEASY-Hol 9,用菌落PCR验证重组质粒pEASY-Lys 9和pEASY-Hol 9。结果如图4所示,PCR产物在700 bp(泳道6)和800 bp(泳道7、8和9)左右有明显的条带,这与穿孔素和内溶酶的基因大小一致,表明获得了表达方向正确的重组表达质粒。
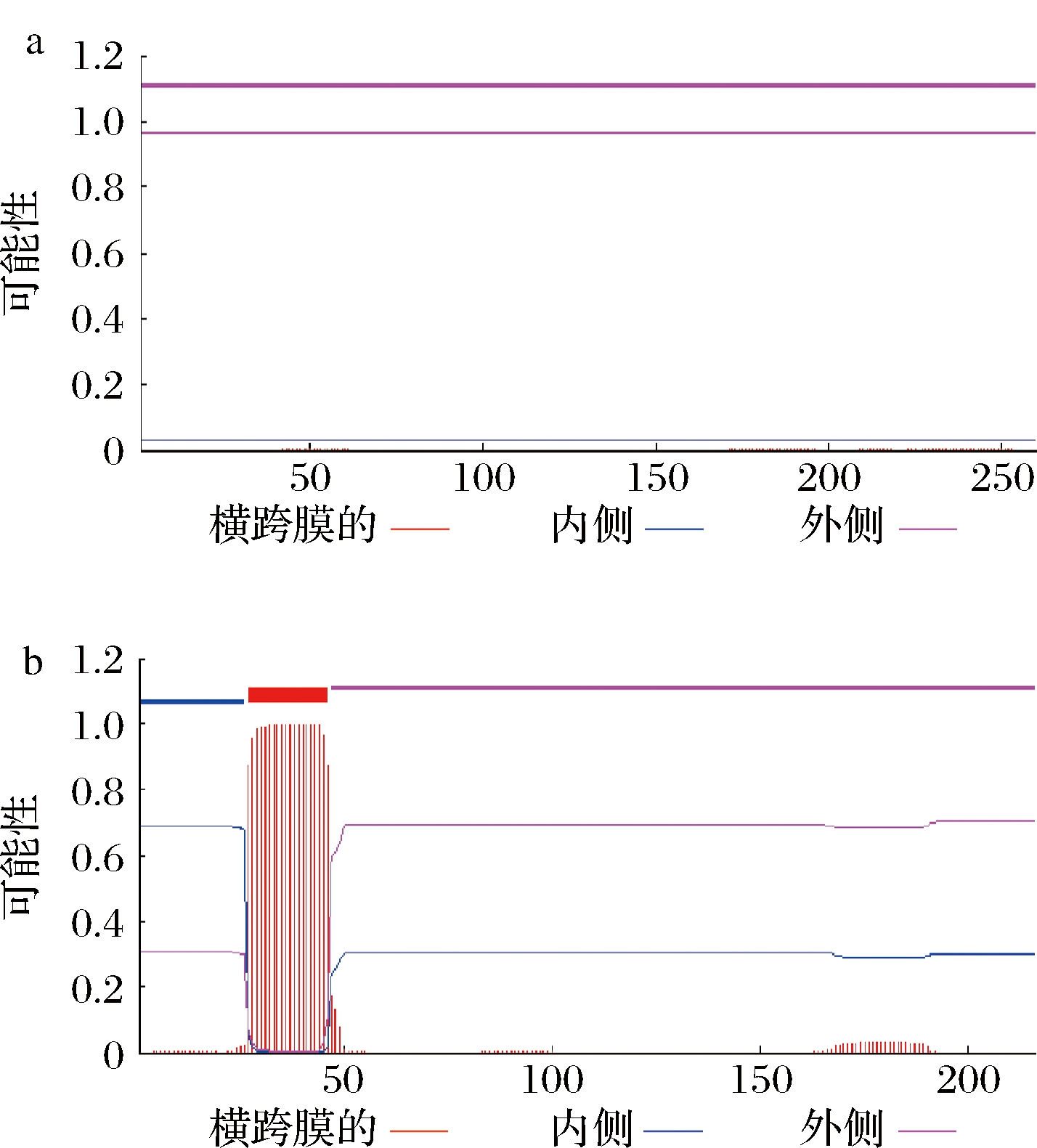
图3 内溶酶Lys 9的跨膜结构(a)和穿孔素
Hol 9的跨膜结构(b)
Fig.3 Transmembrane structure of endolysin
Lys 9 (a) and holin Hol 9 (b)

图4 琼脂糖凝胶电泳分析质粒(a)和菌落PCR产物(b)
Fig.4 Plasmid (a) and PCR products of colony (b)
by agarose gel electrophoresis
注:M为marker;图a中,1和2分别为pEASY-Hol 9和
pEASY-Lys 9;图b中,1-6为穿孔素的白色单克隆的菌落
PCR产物,7-10为内溶酶的白色单克隆的菌落PCR产物
2.4 内溶酶Lys 9的表达和纯化
2.4.1 内溶酶Lys 9最佳诱导条件的确定
内溶酶Lys 9在表达感受态细胞BL21(DE3)中大量表达,在30 kDa左右出现明显条带,与预测的内溶酶Lys 9的分子质量一致。不含重组蛋白基因的空质粒经诱导培养后无法检测到相应的蛋白,因此内溶酶在含有pEASY-Lys 9质粒的BL21(DE3)成功表达。由图5-a可见,内溶酶的表达量随着诱导时间的延长而逐渐增加,在诱导5 h后表达量到达峰值,因此最佳诱导时间为5 h。由图5-b可见,当IPTG的浓度在1和2 mmol/L时表达量最大,出于经济方面的考虑将最佳诱导浓度定为1 mmol/L。
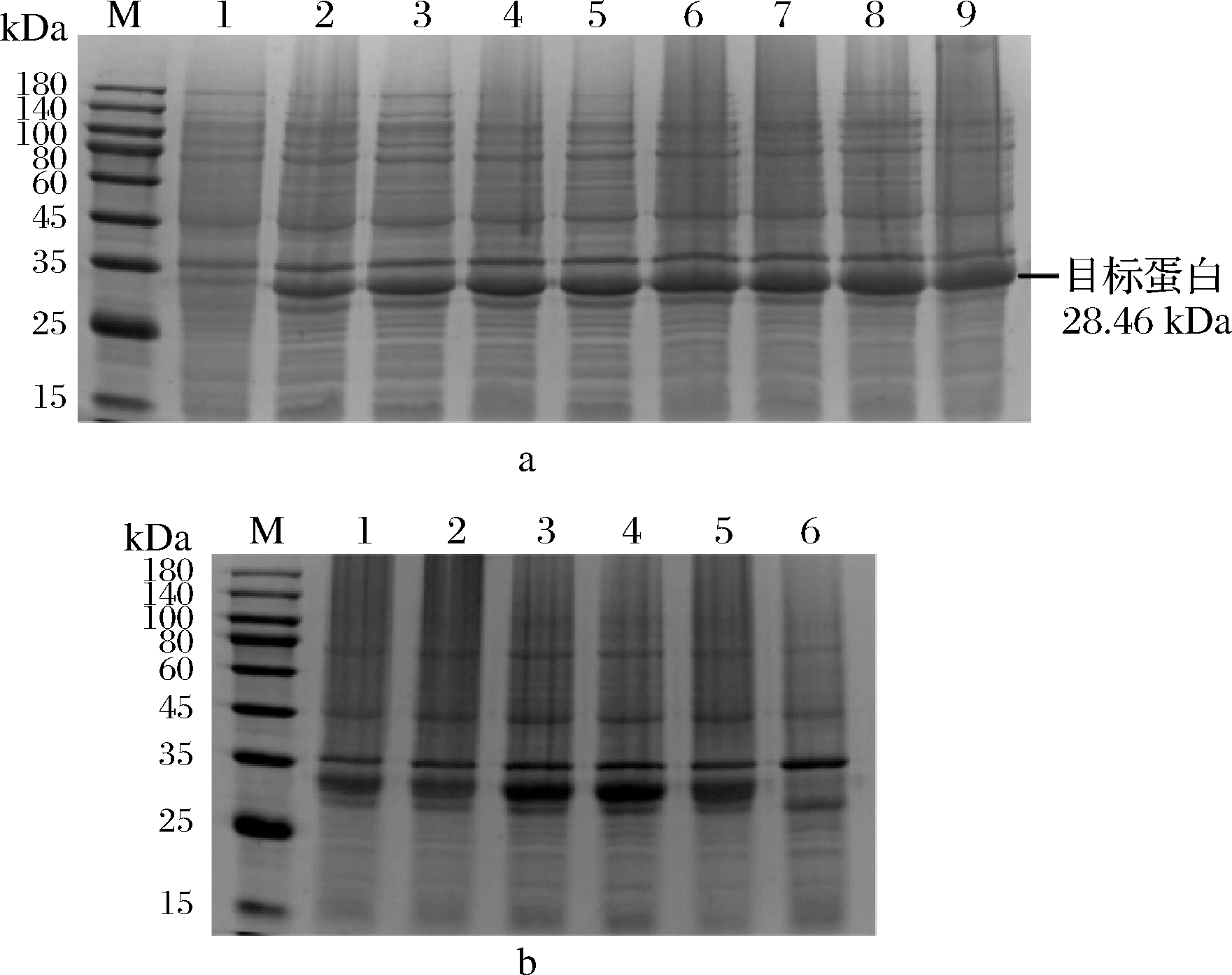
图5 不同诱导时间(a)和IPTG浓度(b)
对Lys 9表达量的影响
Fig.5 Effect of different induced time (a) and IPTG
concentration (b) on the amount of expression of Lys 9
注:M为marker;图a中:1-9分别代表诱导时间0 h到8 h,
其中时间间隔为1 h;图b中,1-5分别代表浓度为0.1、0.5、
1、2、5 mmol/L的IPTG诱导,6为不含内溶酶Lys 9的空质粒
2.4.2 内溶酶Lys 9的纯化
采用超声破碎法破碎重组大肠杆菌BL21(DE3),将获得的沉淀、上清液和镍柱纯化收集的所有液体进行SDS-PAGE电泳。如图6所示,内溶酶Lys 9主要以可溶性蛋白的形式存在上清液中,且在33 kDa到26 kDa左右出现明显条带,目的蛋白被200 mmol/L咪唑大量洗脱,洗脱液中不含杂蛋白。
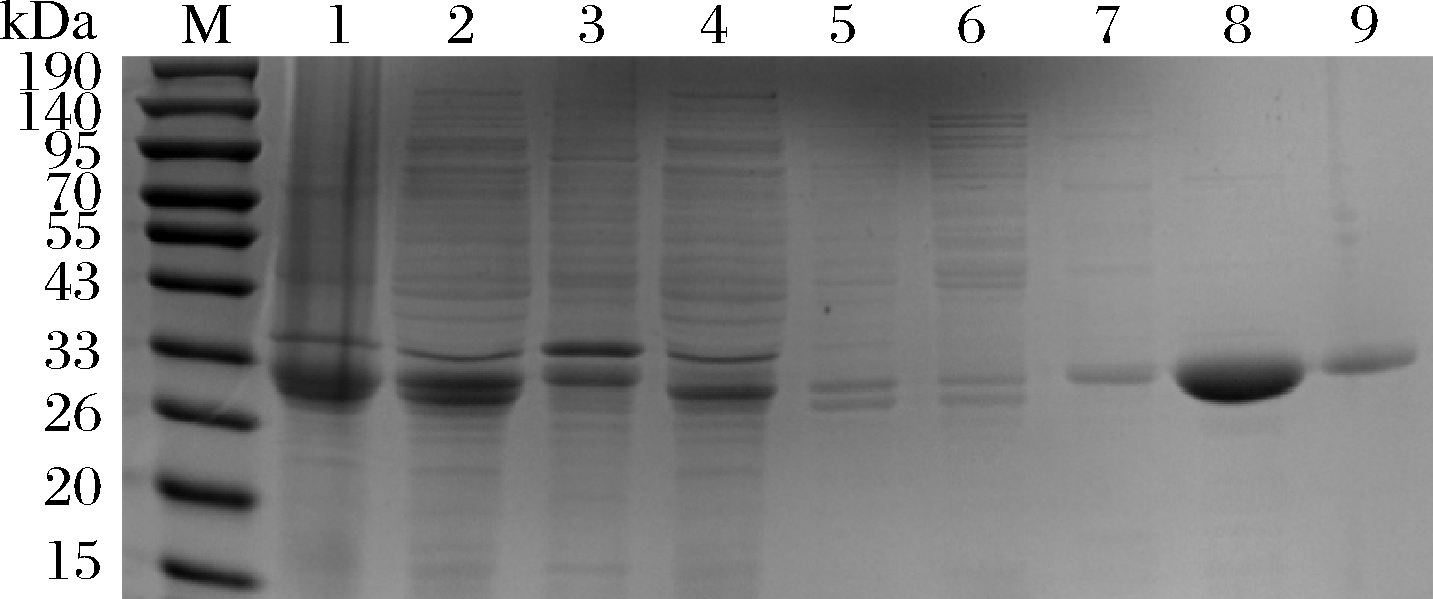
M-marker;1-菌体;2-超声破菌后的上清液;3-超声破
菌后的沉淀;4-上清液的穿过峰;5-缓冲液洗脱峰;6-9分别
为浓度为20、50、200、500 mmol/L的咪唑洗脱液
图6 内溶酶Lys 9的纯化
Fig.6 The purification of endolysin Lys 9
2.5 穿孔素的Hol 9表达纯化
2.5.1 穿孔素Hol 9表达对表达感受态大肠杆菌BL21(DE3)生长抑制分析
将含有pEASY-Hol 9的BL21(DE3)和含有pEASY-Blunt E1的BL21(DE3)在37 ℃、200 r/min的条件下培养5 h后,OD600值分别为0.411和0.626。在此基础上加入终浓度为1 mmol/L的IPTG诱导穿孔素表达。在诱导过程中,通过测定表达感受态细胞BL21(DE3)的浊度来监测穿孔素对表达蛋白的影响,从而确定表达时间,如图7所示。结果显示,在加入诱导剂诱导之前,pEASY-Hol 9的BL21(DE3)的OD600值比含有EASY-Blunt E1的BL21(DE3) OD600值低了0.2左右;含有pEASY-Hol 9质粒的BL21(DE3)诱导20 min后,细菌的浓度最大,其OD600值为0.427。之后随着诱导时间的延长,pEASY-Hol 9质粒的BL21(DE3)的OD600值逐渐降低,在120 min后低至0.280。而含有pEASY-Blunt E1质粒的BL21(DE3)菌液浓度随着诱导时间的增加而增加。因此,穿孔素Hol 9的最佳表达时间为20 min。

图7 内溶酶Lys 9和穿孔素Hol 9的表达对BL21生长的影响
Fig.7 Effect of expression of endolysin Lys 9 and
holin Hol 9 on growth of BL21
2.5.2 穿孔素Hol 9表达的最佳IPTG浓度和穿孔素的纯化

图8 不同IPTG浓度对穿孔素Hol 9表达量的影响(a)
和穿孔素Hol 9的纯化(b)
Fig.8 Effect of different IPTG concentrations on amount of
expression of holin Hol 9 (a) and the purification of holin Hol 9 (b)
注:M为marker;图a中1-5分别代表浓度为0.1、0.5、1、2、5 mmol/L
的IPTG诱导,6为不含穿孔素Hol 9的空质粒;图b中,
1为上清液,2为穿过峰,3为洗脱液,4-7分别为浓度为
20、50、200、500 mmol/L的咪唑洗脱液
由图8-a可见,不同浓度的IPTG诱导对穿孔素Hol 9表达量没有明显差异,与空质粒相比穿孔素的表达导致了在分子质量为35 kDa处的蛋白缺失。如图8-b所示,重组蛋白在26 kDa左右出现明显条带,用200 mmol/L咪唑洗涤镍柱时,目的蛋白被大量洗脱,且洗脱液不含杂蛋白。
2.6 内溶酶Lys 9和穿孔素Hol 9的浓度测定
利用微量紫外分光光度计对纯化的内溶酶Lys 9和穿孔素Hol 9的质量浓度进行测定,内溶酶Lys 9溶液的质量浓度为2.49 g/L;穿孔素Hol 9溶液的质量浓度为0.95 g/L。
3 讨论
大肠杆菌O157∶H7是一种严重危害公共卫生安全的食源性致病菌,能在食品加工和贮藏中的相关胁迫诱导下发生交叉适应,使细菌在后续杀菌或抑菌处理中得以存活[15]。耐药性大肠杆菌的出现也增加了人类大肠杆菌的风险。噬菌体内溶酶和穿孔素作为新型抑菌物质能用于控制对人体健康造成威胁的病原菌。本研究中,对筛选的噬菌体EC-p9进行了初步鉴定,发现其与大肠杆菌噬菌体PE37 tRNA簇的相识最高为81.20%。根据NCBI提供的信息可知,噬菌体PE37属于dsDNA肌尾科噬菌体。因而,噬菌体EC-p9可能是dsDNA肌尾科噬菌体,其裂解体系为“穿孔素-内溶酶”。“穿孔素-内溶酶”裂解体系是dsDNA噬菌体的经典的裂解系统,如λ和 T4 等[16]。
穿孔素和内溶酶作为广谱抑菌剂,在控制食源性致病菌中表现出巨大的潜力。YU等[12]和SONG等[17]分别研究了内溶酶LysSAP8和穿孔素GH15对金黄色葡萄球菌抑制能力。本研究利用生物信息学分析了EC-p9的内溶酶Lys 9和穿孔素Hol 9。革兰氏阴性菌噬菌体的内溶酶通常为球形结构,并且缺乏细胞结合域[18-20]。但噬菌体EC-p9的内溶酶Lys 9具备两个结构域,其催化活性结构域属于N-乙酰胞壁酸酶,能裂解β-1,4-糖苷键;另外,还具有一个肽聚糖结合域。穿孔素Hol 9是典型Ⅲ型穿孔素[21],只有一个跨膜结构,N端在胞内,C端在胞内,主要作用是破坏细胞膜,传递信息,控制噬菌体裂解细菌的时间。
本研究利用大肠杆菌表达体系获得内溶酶Lys 9和穿孔素Hol 9。内溶酶Lys 9的最佳表达条件是在37 ℃、1 mmol/L IPTG诱导表达5 h。在该条件下,利用镍柱纯化获得为2.49 mg/mL的内溶酶Lys 9溶液。但穿孔素Hol 9的表达对大肠杆菌BL21(DE3)具有毒害作用[18,21]。在加入IPTG诱导表达前,含有pEASY-Hol 9的大肠杆菌BL21(DE3)的生长速度比含有空质粒和pEASY-Lys 9的BL21(DE3)的生长速度慢。这可能是穿孔素Hol 9在不含诱导剂的情况下少量表达,导致BL21(DE3)裂解死亡。在IPTG表达20 min后菌液浓度达到最高点,因此穿孔素Hol 9的最佳表达时间是20 min。且不同浓度的IPTG对穿孔素Hol 9的表达量没有影响。利用镍柱纯化穿孔素Hol 9获得质量浓度为0.95 mg/mL的穿孔素Hol 9溶液。
总之,本研究利用随机引物初步鉴定了噬菌体EC-p9,并利用生物信息学分析该噬菌体的内溶酶和穿孔素,并成功表达了噬菌体EC-p9的内溶酶和穿孔素。该研究为后续内溶酶和穿孔素的抑菌特性的研究以及噬菌体EC-p9的裂解机制的研究奠定了基础。
[1] 樊晓洁. 食源性致病菌大肠杆菌O157∶H7检测方法的研究进展[J].食品安全质量检测学报,2020,11(7):2 144-2 149.
FAN X J.Research progress on detection methods of foodborne pathogenic Escherichia coli O157∶H7[J].Journal of Food Safety and Quality,2020,11(7):2 144-2 149.
[2] 黄冠南.大肠杆菌O157∶H7在中国东北部地区砂砾梯度土壤中的存活行为及其影响因素[D].吉林:吉林大学,2020.
HUANG G L.Survival and the influence factors of Escherichia coli O157∶H7 in soils over a sandy gradient in northeastern China[D].Jilin:Jilin University,2020.
[3] SABOURI S,SEPEHRIZADEH Z,AMIRPOUR-ROSTAMI S,et al.A minireview on the in vitro and in vivo experiments with anti-Escherichia coli O157∶H7 phages as potential biocontrol and phage therapy agents[J].International Journal of Food Microbiology,2017,243:52-57.
[4] WONG C S,MOONEY J C,BRANDT J R,et al.Risk factors for the hemolytic uremic syndrome in children infected with Escherichia coli O157∶H7:A multivariable analysis[J].Clinical Infectious Diseases,2012,55(1):33-41.
[5] 王磊, 曹巍.全球抗生素耐药性现状分析及对策建议[J].军事医学,2017,41(5):329-333.
WANG L,CAO W.Current global antimicrobial resistance and countermeasures[J].Military Medical Sciences,2017,41(5):329-333.
[6] LU Z,BREIDT F.Escherichia coli O157∶H7 bacteriophage Φ241 isolated from an industrial cucumber fermentation at high acidity and salinity[J].Frontiers in Microbiology,2015,6:67.
[7] 胡颖, 李洪军,贺稚非.噬菌体防控食源性致病菌的研究进展[J].食品与发酵工业,2019,45(1):246-251.
HU Y,LI H J,HEN Z F.Research progress on bacteriophages for preventing and controlling foodborne pathogens[J].Food and Fermentation Industries,2019,45(1):246-251.
[8] LU N,SUN Y,WANG Q,et al.Cloning and characterization of endolysin and holin from Streptomyces avermitilis bacteriophage phiSASD1 as potential novel antibiotic candidates[J].International Journal of Biological Macromolecules,2020,147:980-989.
[9] 韩晗, 李雪敏,程博幸,等.dsDNA噬菌体裂解系统作用机制的研究进展[J].畜牧与兽医,2019,51(7):132-139.
HAN H,LI X M,CHEN BX,et al.Progress in research on the lysis mechanism of dsDNA bacteriophage[J].Animal Husbandry and Veterinary Medicine,2019,51(7):132-139.
[10] WON G,KIM B,LEE J H.A novel method to generate Salmonella typhi Ty21a ghosts exploiting the lambda phage holin-endolysin system[J].Oncotarget,2017,8(29):48 186-48 195.
[11] SHANNON R,RADFORD D R,BALAMURUGAN S.Impacts of food matrix on bacteriophage and endolysin antimicrobial efficacy and performance[J].Critical Reviews in Food Science & Nutrition,2020,60(10):1 631-1 640.
[12] YU J H,LIM J A,CHANG H J,et al.Characteristics and lytic activity of phage-derived peptidoglycan hydrolase,LysSAP8,as a potent alternative biocontrol agent for Staphylococcus aureus[J].Journal of Microbiology and Biotechnology 2019,29(12):1 916-1 924.
[13] SPRINGER K,REUTER S,KNUPFER M,et al.Activity of a holin-endolysin system in the insecticidal pathogenicity island of Yersinia enterocolitica[J].Journal of Bacteriology,2018,200(16).DOI.10.1128/JB.00180-18.
[14] MAHENTHIRALINGAM E,CAMPBELL M E,FOSTER J,et al.Random amplified polymorphic DNA typing of Pseudomonas aeruginosa isolates recovered from patients with cystic fibrosis[J].Journal of Clinical Microbiology,1996,34(5):1 129-1 135.
[15] 陈欣, 胡玲萍,应宇斌,等.食源性致病菌交叉适应现象及分子机制的研究进展[J].食品科学,2020,41(23):243-254.
CHEN X,HU L P,YIN Y B,et al.A review of cross-adaptation and its molecular mechanism of foodborne pathogens[J].Food Science,2020,41(23):243-254.
[16] WON G,HAJAM I A,LEE J H.Improved lysis efficiency and immunogenicity of Salmonella ghosts mediated by co-expression of lambda phage holin-endolysin and X174 gene E[J].Scientific Reports,2017,7:45 139.
[17] SONG J, XIA F,JIANG H Y,et al.Identification and characterization of HolGH15:The holin of Staphylococcus aureus bacteriophage GH15[J].Journal of General Virology,2016,97:1 272-1 281.
[18] WALMAGH M,BOCZKOWSKA B,GRYMONPREZ B,et al.Characterization of five novel endolysins from Gram-negeative infecting baceriophage[J].Applied Microbiology & Biotechnology,2013,97(10):4 369-4 375.
[19] LOOD R,WINER B Y,PELZEK A J,et al.Novel phage lysin capable of killing the multidrug-resistant gram-negative bacterium Acinetobacter baumannii in amouse bacteremia model[J].Antimicrob Agents Chemother,2015,59(4):1 983-1 991.
[20] 程梦珺. 粪肠球菌噬菌体EF-P10及其裂解酶生物学特性与实验治疗的研究[D].吉林:吉林大学,2019.
CHEN M J.The biological characteristics of Enterococcus faecalis phage EF-P10 and its lysin and therapeutic experiment study of the lysin[D].Jilin:Jilin University,2019.
[21] 陈杰. 水稻细菌性褐条病菌噬菌体AP1新穿孔素-裂解素双组分裂解系统的鉴定和功能研究[D].杭州:浙江大学,2019.
CHEN J.Research on identification and function ofa new type of holin-endolysin lysis system in Acidovorax oryzae phage AP1[D].Zhejiang:Zhejiang University,2019.