皮肤中的胶原蛋白主要包括I型(collagen I,COL I)和III型(collagen III,COL III),为皮肤提供强度和支撑。人类年轻皮肤中COL I和COL III分别占总胶原蛋白的80%和15%,随年龄增长,COL I明显丢失,同时合成速度减慢,导致COL I和COL III的比值逐渐降低,引起皮肤老化,故COL I是维持皮肤丰盈饱满的重要蛋白[1]。胶原蛋白的主要合成场所在成纤维细胞(fibroblast,FB),FB首先合成带有氨基(N-)端和羧基(C-)端的无活性胶原前体,其N-和C-端经过相关蛋白酶切割(翻译后加工)释放出成熟的三股螺旋胶原蛋白,最终形成胶原纤维,发挥其生物学功能。研究发现,骨形态发生蛋白1(bone morphogenetic protein 1,BMP-1)参与细胞外基质(extracellar matrix,ECM)中的多种蛋白质肽链的切割,包括胶原蛋白、小型富含亮氨酸蛋白聚糖(small leucine-rich proteoglycans,SLRPs)、SIBLING(small integrin binding ligand,N-linked glycoprotein)蛋白、赖氨酸氧化酶(the enzyme lysyl oxidase,LOXs)等[2]。其中,BMP-1参与胶原蛋白前体C端水解过程,促使胶原蛋白功能化[3],如图1所示。

图1 胶原蛋白成熟过程
Fig.1 Collagen maturation process
草莓叶是草莓种植过程中最主要的副产品,其富含多种生物活性成分,如有机酸、槲皮素和山柰酚衍生物等黄酮类化合物,咖啡酸和绿原酸等酚酸,鞣花单宁、萜类化合物等[4-5]。此外,草莓叶提取物具有抑制胶原酶活性,可改善因胶原蛋白流失引起的皮肤衰老[6];抑制炎症介质释放,表现出潜在的抗过敏性[7];对胰脂肪酶有微弱的抑制作用,表现出潜在的抗肥胖活性[7]。法国植物专家BERKEM曾将一种高多酚含量的草莓叶提取物用于化妆品中,可有效改善皮肤的光泽和质地[8]。本实验室前期针对草莓叶水提物(water extractions from strawberry leaves,SLWE)研究发现,其具有良好的提高胶原蛋白含量和抑制基质金属蛋白酶(matrix metalloproteinase,MMP-1)活性,进而减少胶原蛋白降解的功效,而SLWE是否存在促进胶原蛋白成熟的功效未知。
本文通过测SLWE主成分和抗氧化活性酶酶活力,分析SLWE对HFF-1中COL I和BMP-1含量的影响,探究SLWE作为开发延缓衰老功效性原料的可能性,为提高草莓废弃物综合利用效率提供理论基础。
1 材料与方法
1.1 主要材料、试剂与仪器
1.1.1 试验材料与试剂
人包皮成纤维细胞(human foreskin fibroblasts,HFF-1),由中国科学院干细胞库提供;新鲜红颜草莓叶,北京市欣宝莱科技股份有限公司。DMEM(dulbecco’s modified eagle medium)培养基、磷酸盐缓冲液(phosphate buffered saline,PBS),Hyclone;胰酶、胎牛血清(fetal bovine serum,FBS)、链霉素/青霉素,gibco;CCK-8试剂盒,碧云天生物技术公司;COL I试剂盒,南京建成生物研究所;BMP-1试剂盒,北京安迪华泰科技有限公司;维生素C,北京奥拓达科技有限公司;人参皂苷Rb1、芦荟多糖,上海源叶生物科技有限公司。
1.1.2 仪器
206471-6608型恒温培养箱,Thermo;Centrifuge 5810 R台式冷冻离心机,Eppendorf;Infinite M200 PRO酶标仪,TECAN;LGJ-18冷冻干燥机,北京松原华兴科技发展有限公司。
1.2 实验方法
1.2.1 SLWE制备
新鲜红颜草莓叶冷冻干燥24 h,打磨成粉,过100目筛,料液比1∶25(g∶mL),超声30 min,8 000 r/min离心10 min,取上清液,即为SLWE。用HFF-1培养基稀释SLWE至体积分数为12.5%、6.25%、3.125%、1%、0.5%、0.25%、0.125%、0.062 5%,备用。
1.2.2 HFF-1培养、计数、铺板
当HFF-1生长率达到80%以上时进行传代培养,传代流程如下:弃去培养基废液,用1 mL PBS溶液清洗2次,加入1 mL胰酶,在37 ℃、5%CO2培养箱中消化3 min,当细胞消化至80%以上,加入2 mL培养基终止消化。细胞转移至离心管中,1 000 r/min、25 ℃下离心4 min。弃去培养基,加入1 mL培养基吹打悬浮,按照一分二原则于5 mL培养基的培养瓶中传代培养。
按照传代方法,将细胞吹打成单细胞悬液,取10 μL沿盖玻片打入血球计数板中,于显微镜下计数,遇到边框上的细胞,按照数上不数下,数左不数右原则计数,按公式(1)计算:
细胞数量![]() 个/mL
个/mL
(1)
依据实际需要,将已知密度的细胞悬液稀释至密度为5×104 个/mL,每100 μL细胞悬液接到96孔板中。
1.2.3 SLWE主要成分和酶活性分析
以SLWE原液为研究对象,参照陈金娥等[9]方法,利用钼酸铵比色法测定还原型Vc含量;可溶性糖含量参照南京建成试剂盒说明书进行测定;蛋白质提取、含量测定,参照全式金BCA蛋白测定试剂盒说明书;原花青素含量采用香草醛-浓盐酸法[10];总酚含量,参照CHAVAN等[11]采用的Folin-酚法;总黄酮含量测定,采用NaNO2-AlCl3-NaOH法[12];超氧化物歧化酶(superoxide dismutase,SOD)和过氧化物酶(peroxidase,POD)提取及含量,参照魏彦珍[13]等方法进行测定。
1.2.4 SLWE安全浓度筛选
参考CCK-8试剂盒说明书,以正常培养HFF-1为阴性对照组,不铺细胞只有培养基为空白对照,以1.2.1小节制备8个浓度梯度SLWE为测试样品,以HFF-1存活率大于80%为标准,确定SLWE对HFF-1的安全浓度,通过公式(2)计算细胞存活率:
细胞存活率![]()
(2)
式中:在450 nm处测定OD值。
1.2.5 SLWE对HFF-1合成COL I的影响
以0.01% Vc为阳性对照组,更换培养基为阴性对照,用培养基稀释SLWE体积分数至0.2%、1.5%、2%、6.25%作为试验组,分别作用于HFF-1培养24 h后取上清液,COL I试剂盒说明书进行测定。
1.2.6 SLWE对HFF-1分泌BMP-1的影响
铺板的HFF-1培养72 h后弃去培养基,用无血清的DMED处理12 h。研究表明HFF-1培养24 h后是BMP-1含量的最适检测时间点[14],所以,更换培养基为阴性对照,100 μg/mL Vc、200 μg/mL芦荟多糖、10 ng/mL TNF-α、40 ng/mL人参皂苷Rb1、100 μg/mL人参皂苷Rb1为预选的阳性对照,培养基稀释SLWE体积分数至0.5%、1%、2%、3.125%作为试验组,分别作用于处理好的HFF-1培养24 h,取上清液,按BMP-1试剂盒说明书进行测定。
1.2.7 数据处理与统计分析
采用SPSS软件进行独立样本t检验,0.01<P<0.05,用“*”表示,0.001<P<0.01,用“**”表示,P<0.001,用“***”表示。
2 结果与分析
2.1 SLWE主要成分及抗氧化酶SOD、POD分析
Vc、原花青素、多糖类、黄酮类化合物和多酚类化合物的抗氧化活性主要通过清除自由基而体现出现,同时活性成分之间具有协同增效的作用,从而提高抗氧化活性[15-18]。由表1可知,SLWE中Vc含量为(0.88±0.025)mg/mL,约是新鲜叶片Vc含量的11倍[19];SLWE中的原花青素含量为(0.28±0.027)mg/mL,约是山葡萄籽中原花青素的含量(水提:0.075 mg/mL)的4倍[20];SLWE中多糖类、黄酮类化合物和多酚类化合物含量分别达到(10.00±0.28)、(1.47 ±0.05)和(2.05 ±0.03)mg/mL,故SLWE具有一定的抗氧化能力。此外,SLWE有一定SOD和POD酶活力,SOD是生物体内存在的一种抗氧化金属酶,能催化超氧阴离子自由基(·O2-)歧化生成O2和H2O2[21],进而被POD彻底还原生成H2O排出体外。
表1 SLWE活性成分和主要酶活力
Table 1 Contents of active components and activities of
main antioxidant enzymes in SLWE
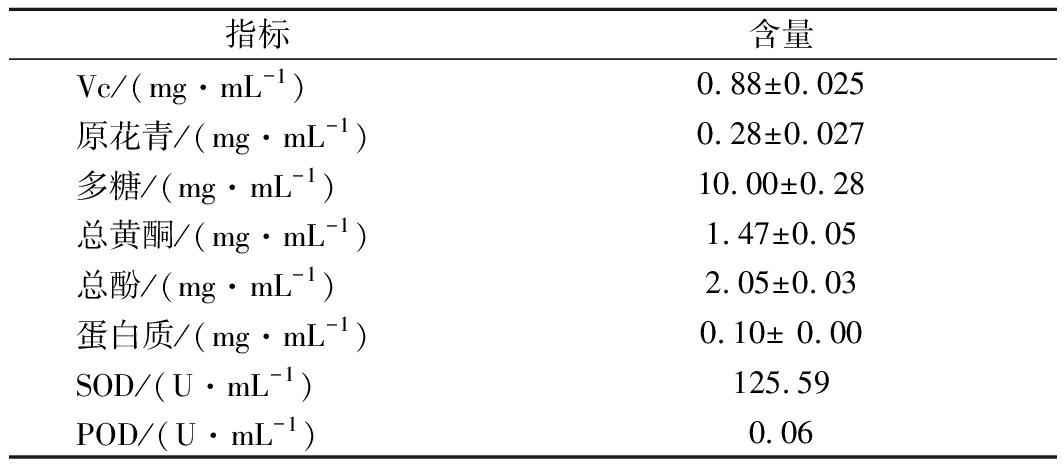
指标含量Vc/(mg·mL-1)0.88±0.025原花青/(mg·mL-1)0.28±0.027多糖/(mg·mL-1)10.00±0.28总黄酮/(mg·mL-1)1.47±0.05总酚/(mg·mL-1)2.05±0.03蛋白质/(mg·mL-1)0.10± 0.00SOD/(U·mL-1)125.59POD/(U·mL-1)0.06
人体正常新陈代谢会产生活性氧自由基(reactive oxygen species,ROS),主要以·OH、·O2-以及H2O2的形式存在[22],是造成肌肤老化最主要的原因;SLWE中的活性成分和酶可以通过清除新陈代谢产生的氧自由基,从而起到抗氧化的作用,延缓皮肤衰老。
2.2 SLWE对HFF-1活性影响
由图2可知,SLWE在体积分数0.062 5%~12.5%范围内对HFF-1没有明显细胞毒性,且与阴性对照相比,不同体积分数的SLWE对细胞无明显增殖作用。
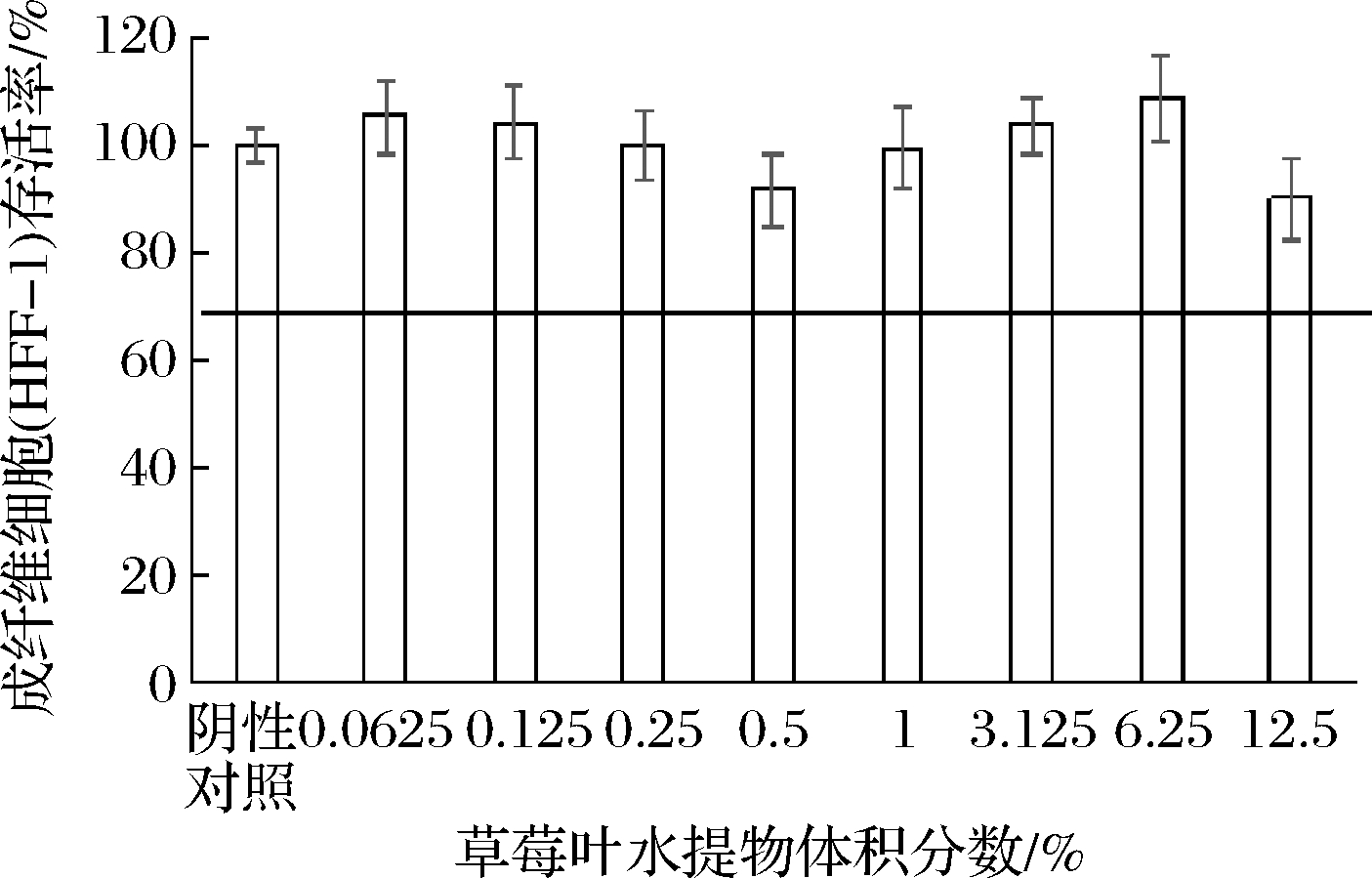
图2 SLWE对HFF-1存活率的影响
Fig.2 Effect of SLWE on HFF-1 viability
注:细胞存活率≥80%,没有明显细胞毒性;
细胞存活率<80%,存在细胞毒性[14]
2.3 SLWE对HFF-1合成COL I的影响
结合上述试验结果,选取了4个SLWE体积分数(0.2%、1.5%、2%、6.25%)考察其对HFF-1合成COL I的影响,结果如图3所示。SLWE在0.2%~6.25%体积分数范围内,能显著促进HFF-1分泌COL I。此外,结果表明SLWE对HFF-1无明显增殖作用(图2),说明SLWE不是通过增加细胞数量促进COL I的含量,而是具有促进HFF-1细胞中COL I表达的作用。

图3 SLWE对HFF-1合成COL I影响
Fig.3 Effect of SLWE on the synthesis of COL Ⅰ by HFF-1
Vc具有羟基化前胶原多肽的脯氨酸和赖氨酸残基[23-24]、抑制MMP-1基因的转录[25]以及促进和维持细胞外基质(extracellular matrix,ECM)中I型胶原的合成的作用,此外,SLWE中活性成分及酶能有效清除氧自由基。所以推测SLWE可通过促进阻断因ROS激活的丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路引起的胶原蛋白的降解,从而维持胶原蛋白含量。综上,SLWE中的活性成分通过减少胶原蛋白降解及促进COL I合成2种途径来增加胶原蛋白的含量。但HFF-1合成的只是胶原蛋白前体,而生物体内只有成熟的胶原蛋白才能发挥其生物学功能,所以本文又进行了SLWE能否促进COL I成熟过程中最关键的C端蛋白酶BMP-1的表达。
2.4 SWEL对HFF-1分泌BMP-1影响
2.4.1 阳性对照的筛选
理想阳性对照品可以确保试验的稳定性和可靠性。文献调研发现,Vc能促进COL I合成[26];芦荟多糖可促进人皮肤成纤维细胞增殖,促进COL I、COL III合成及表达[27];TNF-α可促进成纤维细胞分泌BMP-1[28];而人参皂苷Rb1在促进成纤维细胞增殖的同时,可促进I型前胶原蛋白表达[29]。故本文以VC、芦荟多糖、TNF-α以及人参皂苷Rb1作为预选阳性对照品,同时参照相应参考文献中的最适浓度进行试验[14],用BMP-1试剂盒检测其对HFF-1分泌BMP-1的影响。设定阴性对照组HFF-1分泌BMP-1的含量为100%,计算上述几种成分作用于HFF-1分泌BMP-1的相对生成率,结果如图4所示。

1-VC 100μg/mL;2-TNF-α 10 ng/mL;3-芦荟多糖 200μg/mL;
4-人参皂苷 40ng/mL;5-人参皂苷 100 μg/mL
图4 几种成分对HFF-1分泌BMP-1的影响
Fig.4 Effect of several components on the secretion
of BMP-1 by HFF-1
结果表明,100 μg/mL Vc与阴性对照组差异十分显著(0.001<P< 0.01),可促进HFF-1分泌BMP-1;芦荟多糖和TNF-α表现出一定促进作用,与阴性对照组相比,没有明显差异;人参皂苷Rb1没有明显促进效果,与阴性对照组相比,没有明显差异,推测人参皂苷Rb1虽然能促进I型前胶原蛋白表达,但是对前胶原蛋白功能化没有作用。另外,Vc是众所周知的良好的抗氧化剂,能促进COLI的合成,同时实验结果表明其能显著促进HFF-1分泌BMP-1(COLI成熟过程中的关键C端蛋白酶),故选取100 μg/mL Vc为阳性对照品。
2.4.2 SLWE对HFF-1分泌BMP-1的影响
由图5可知,SLWE体积分数为2%时,与阴性对照组差异十分显著(0.001<P<0.01);体积分数为0.5%和3.125%时,与阴性对照组差异显著(0.01<P<0.05),表明SLWE体积分数在0.5%~3.125%范围内,对HFF-1分泌BMP-1有显著促进效果,且均与阳性对照组(0.01% Vc)作用相当。表明SLWE具有促进成纤维细胞分泌BMP-1的作用,有助于COL I剪切,生成有活性的COL I,即SLWE具有促进胶原蛋白成熟的功效。

1-SLWE 0.5%;2-SLWE 1%;3-SLWE 2%;4-SLWE 3.125%
图5 SLWE对HFF-1分泌BMP-1的影响
Fig.5 Effect of SLWE on BMP-1 secretion by HFF-1
SWEL中Vc含量为(0.88±0.025)mg/mL(表1),则体积分数为1% SLWE中的Vc含量为8.8 μg/mL,其对HFF-1分泌BMP-1的相对生成率(157.77%)与阳性对照100 μg/mL Vc的作用(143.26%)相当,如表2所示,说明SLWE对HFF-1分泌BMP-1的促进作用相当于Vc的10多倍,这可能与SLWE中其他活性成分(如原花青素、多糖、黄酮类化合物多酚等)密切相关,可能是多种活性成分的协同增效作用,明确的机理有待研究。
表2 SLWE与阳性对照组中Vc浓度及促进BMP-1作用的对比
Table 2 Comparison of Vc content and BMP-1 promoting
effect between SLWE and positive control

样品名称其中Vc质量浓度(μg·mL-1)BMP-1相对生成率%SLWE(1%)8.8157.77Vc100143.26
3 结论
(1)SLWE富含多糖、酚类化合物、黄酮类化合物、Vc、原花青素和蛋白质,以及一定的SOD和POD酶活力,为SLWE促进COL I合成和BMP-1分泌提供了物质基础。
(2)SLWE在0.2%~6.25%(体积分数)范围内没有促进HFF-1增殖作用,但可以促进HFF-1合成COL I,0.5%~3.125%范围内促进HFF-1分泌BMP-1。SLWE可以通过促进胶原蛋白合成和成熟(功能化),如图6所示,为SLWE作为延缓皮肤衰老化妆品功效成分提供理论基础。

图6 SLWE对HFF-1合成COLI及分泌BMP-1的影响
Fig.6 Effects of SLWE on COL I synthesis and
BMP-1 secretion by HFF-1
注:加粗实线表示本试验结果;细实线表示文献调研结果
(3)草莓叶作为草莓产业的副产物,存在处理费时费力及其污染环境的问题,开发SLWE作为化妆品原料,有助于植物资源废弃物的再利用,促进农村二三产业发展,提高草莓产业。
[1] 王佳曼,兰海梅.胶原及其产物在皮肤老化及皮肤修复中的应用[J].中国美容医学,2012,21(1):176-178.
WANG J M,LAN H M.The application of collagen and collagen hydrolysates in skin aging and skin repairing [J].Chinese Journal of Aesthetic Medicine,2012,21(1):176-178.
[2] 周聪,常新.骨形态发生蛋白-1的研究进展[J].大连医科大学报,2011,33(2):182-186.
ZOU C,CHANG X.Research progress of bone morphogenetic protein-1[J].Journal of Dalian Medical University,2011,33(2):182-186.
[3] HOPKINS D R,KELES S,GREENSPAN D S.The bone morphogenetic protein 1/Tolloid-like metalloproteinases[J].Matrix Biology,2007,26(7):508-523.
[4] 翟文丽,何聪芬,董坤.草莓叶中主要活性成分及其生物活性研究进展[J].北方园艺,2019(19):114-121.
ZHAI W L,HE C F,DONG K.Research progress in main active components and biological activities of strawberry leaves [J].Northern Horticulture,2019(19):114-121.
[5] KÅRLUND A,HANHINEVA K,LEHTONEN M,et al.Non-targeted metabolite profiling highlights the potential of strawberry leaves as a resource for specific bioactive compounds[J].Journal of the Science of Food and Agriculture,2017,97(7):2 182-2 190.
[6] LEE D S,KIM K H,YOOK H S.Cosmetic effects of the fractional extracts from strawberry (Fragaria ananassa var.‘Seolhyang’) leaf[J].Journal of the Korean Society of Food Science and Nutrition,2018,47(3),271-278.
[7] ZHU Q C,NAKAGAWA T,KISHIKAWA A,et al.In vitro bioactivities and phytochemical profile of various parts of the strawberry (Fragaria ananassa var.Amaou)[J].Journal of Functional Foods,2015,13:38-49.
[8] ECHARD A.Strawberry extract for a radiant complexion[J].Pure Health Magazine,2012,18.
[9] 陈金娥,李冬梅,赵戌利,等.10种生、熟蔬菜中Vc含量及抗氧化性对比研究[J].食品科技,2012,37(4):57-59;64.
CHEN J E,LI D M,ZHAO X L,et al.Comparative of vitamin C detecting and antioxidant capability on 10 kinds of raw and cooked vegetables [J].Food Science and Technology,2012,37(4):57-59;64.
[10] 杨雪.草莓保鲜方法与茎叶中原花青素提取工艺的研究[D].成都:四川师范大学,2014.
YANG X.Study on strawberry preservation and extraction methods of proanthoc vanidins from stems and leaves [D].Chengdu:Sichuan Normal University,2014.
[11] CHAVAN J J,GAIKWAD N B,KSHIRSAGAR P R,et al.Total phenolics,flavonoids and antioxidant properties of three Ceropegia species from Western Ghats of India[J].South African Journal of Botany,2013,88(5):273-277.
[12] AL-GHUDANI M K N,HOSSAIN M A.Determination of total phenolics,flavonoids and antioxidant activity of root crude extracts of Adenium obesum traditionally used for the treatment of bone dislocations and rheumatism[J].Asian Pacific Journal of Tropical Disease,2015,5:S155-S158.
[13] 魏彦珍,邵兴锋,韦莹莹,等.茶树精油电辅助加热熏蒸处理对草莓品质和相关酶类的影响[J].食品与发酵工业,2017,43(4):135-140.
WEI Y Z,SHAO X F,WEI Y Y,et al.Effect of tea tree oil electric auxiliary heating fumigation on quality of strawberry fruit and its related enzymes[J].Food and Fermentation Industries,2017,43(4):135-140.
[14] 李慧,蒋丹丹,MORGAN D S,等.紫茉莉花提取物促进胶原蛋白功能化的功效研究[J].日用化学工业,2019,49(8):526-530.
LI H,JIANG D D,MORGAN D S,et al.Efficacy evaluation of Mirabilis jalapa flower extract on promoting collagen functionalization[J].China Surfactant Detergent & Cosmetics,2019,49(8):526-530.
[15] 高静.天然抗氧化剂及其协同作用[J].食品安全质量检测学报,2020,11(6):1 859-1 864.
GAO J.Natural antioxidants and synergistic effects[J].Journal of Food Safety and Quality,2020,11(6):1 859-1 864.
[16] 黄晓辉,茹晶晶,罗五魁,等.葡萄籽中原花青素的抗氧化性能的研究[J].宁德师范学院学报(自然科学版),2015,27(2):136-139.
HUANG X H,RU J J,LUO W K,et al.The study of antioxidation on procyanidins from grape seeds [J].Journal of Ningde Normal University (Natural Science),2015,27(2):136-139.
[17] 余正萍,陈林.天然产物银杏类黄酮的抗氧化活性研究[J].广东化工,2020,47(12):74-75.
YU Z P,CHEN L.The activity of antioxidant of natural product gingko flavonoids[J].Guangdong Chemical Industry,2020,47(12):74-75.
[18] 张慧.原花青素与维生素C的协同抗氧化作用的研究[J].山东化工,2016,45(9):24-25.
ZHANG H.Study on synergistic effect of the original anthocyanin and vitamin C combination on antioxidant activity[J].Shandong Chemical Industry,2016,45(9):24-25.
[19] 罗学兵,贺良明.草莓的营养价值与保健功能[J].中国食物与营养,2011,17(4):74-76.
LUO X B,HE L M.Nutritional value and health function of strawberry[J].Food and Nutrition in China,2011,17(4):74-76.
[20] 桑雅丽,李晓春,王欣宇,等.山葡萄籽中原花青素的提取及其含量测定[J].赤峰学院学报(自然科学版),2018,34(9):40-42.
SANG Y L,LI C X,WANG X Y,et al.Extraction and determination of proanthocyanidin from grape seeds[J].Journal of Chifeng University(Natural Science Edition),2018,34(9):40-42.
[21] 孙丽平,李鹏程,庄永亮,等.辣木叶多酚提取物对光老化小鼠皮肤的保护作用[J].食品与发酵工业,2020,46(18):67-71.
SUN L P,LI P C,ZHUANG Y L,et al.Protective effects of Moringa oleifera leaves polyphenol extracts on photoaging mice skin [J].Food and Fermentation Industries,2020,46(18):67-71.
[22] 张兵兵. 葡萄籽原花青素的提取、精制及性质研究[D].广州:华南理工大学,2017.
ZHANG B B.Study on extraction,purification and properties of proanthocyanidins from grape seeds[D].Guangzhou:South China University of Technology,2017.
[23] GEESIN J C,DARR D,KAUFMAN R,et al.Ascorbic acid specifically increases type I and type III procollagen messenger RNA levels in human skin fibroblasts[J].Journal of Investigative Dermatology,1988,90:420-424.
[24] 张娜娜,曹洪战,芦春莲.营养物质维生素C对基因表达的调控[J].饲料博览,2016(9):15-17.
ZHANG N N,CAO H Z,LU C L.Nutrients vitamin C effect on the regulation of gene expression [J].Feed Review,2016(9):15-17.
[25] 范丽云.维生素C对体外培养的人皮肤成纤维细胞HAS-2,MMP-1基因表达的影响[D].天津:天津医科大学,2009.
FAN L Y.Effects of vitamin C on the expression of hyaluronic acid synthetase-2 gene matrix metalloproteinase-1 gene in human dermal fibroblasts in vitro[D].Tianjin:Tianjin Medical university,2009.
[26] VIOUX-CHAGNOLEAU C,LEJEUNE F,SOK J,et al.Reconstructed human skin:From photodamage to sunscreen photoprotection and anti-aging molecules[J].Journal of Dermatological Science Supplement,2006,2(1):S1-S12.
[27] 刘玲英.芦荟多糖对体外培养人成纤维细胞增殖及胶原合成与分泌影响[D].福州:福建医科大学,2009.
LIU L Y.Influence of the aloe vera polysaccharide on both proliferation and collagen synthesis and secretion cultured human fibroblast cells in vitro[D].Fuzhou:Fujian:Fujian Medical University,2009.
[28] VOLOSHENVUK T G,FOURNETT A C,GARDNER J D.PI3K/Akt signaling mediates increased BMP-1 expression in response to TNF-α and TGF-β1 in cardiac fibroblasts[J].Federation of American Societies for Experimental Biology,2011,25:1.
[29] 李金燕,沈洁凤.人参皂苷Rb1对皮肤胶原代谢的影响[J].海峡药学,2017,29(10):21-23.
LI J Y,SHEN J F.Skin collagen metabolism regulated by ginsenoside Rb1[J].Strait Pharmaceutical Journal,2017,29(10):21-23.