低聚半乳糖是一类重要的膳食益生元,作为肠道有益菌的发酵底物,可以抑制有害菌增殖,促进肠道内乳杆菌属和双歧杆菌属的生长繁殖,使有益菌处于优势状态[1]。膳食补充低聚半乳糖已被证明可以排除体内毒素,减轻肝脏负担,提高机体免疫力,从而缓解重金属铅对机体的损害[2]。张家超等的研究发现小鼠摄入植物乳杆菌的同时外源补充低聚半乳糖可以减少益生菌导致的肠道菌群适应性突变,从而改善肠道菌群的整体稳定性[3]。因此,益生元和益生菌的联用可能更有利于维护宿主健康[4]。在前期实验中,江南大学食品生物技术中心筛选到的植物乳杆菌(Lactobacillus plantarum)CCFM8661已被证明可有效降低机体铅蓄积并缓解铅暴露造成的氧化应激损伤,对机体具有较好的保护效果[5-6]。然而,L.plantarum CCFM8661和低聚半乳糖复配的膳食补充剂的开发仍存在空白。
目前,市场上的益生菌膳食补充剂形式主要为粉剂、片剂和胶囊等,产品种类单一,且在经胃肠等消化系统后益生菌存活率低,功效减弱[7-8]。因此,益生菌膳食补充剂的活菌数与储藏时间及成分之间的相互作用是其发挥益生功效的关键,也是膳食补充剂产品品质的重要评价指标[9]。研究表明巧克力的水分含量低、油脂含量高,可以使菌体在长时间的保存后仍能保持其生物活性和功能特性,是益生菌膳食补充剂的优良载体[10]。
综上所述,本研究拟开发一种以巧克力作为载体复合L.plantarum CCFM8661和低聚半乳糖的缓解铅毒性的膳食补充剂,探究巧克力制作过程中益生菌加入温度、搅拌时间、结晶温度、结晶时间以及回温时间对巧克力品质的影响,并对其储藏特性进行评价。
1 材料与方法
1.1 材料与试剂
可可液块和可可脂,无锡上可食品有限公司;脱脂奶粉,内蒙古伊利实业集团股份有限公司;大豆卵磷脂,上海善优生物科技有限公司;MRS培养基,中国国药化学试剂公司;低聚半乳糖,百思特天骄优品。
1.2 实验方法
1.2.1 菌种活化及制备
将L.plantarum CCFM8661的二级纯化培养液以2%的接种量接种于MRS液体培养基中,37 ℃培养18 h。培养物经离心(4 ℃、5 000×g)后去上清液,洗涤后,菌体沉淀用10%的脱脂乳重悬后冷冻干燥。冻干菌粉(活菌数1012 CFU/g)保藏于-20 ℃备用。
1.2.2 以巧克力为载体的膳食补充剂的制作流程
以巧克力为载体的膳食补充剂由28%可可液块、40%白砂糖、16%脱脂奶粉、15%可可脂和0.3%大豆卵磷脂组成(以上含量均为质量百分比)[11]。将称取的可可液块及可可脂在40 ℃下熔化后[12],加入白砂糖、脱脂奶粉,混合均匀后制得巧克力浆,将巧克力匀浆置于60 ℃的环境下,精炼36 h[13]。在精炼结束前,将大豆卵磷脂加入其中,并继续混合30 min。精炼结束后,在一定温度下将L.plantarum CCFM8661冻干菌粉(108 CFU/g巧克力)及低聚半乳糖(6 g/100 g巧克力)[14]加入到制备的样品中,搅拌一定时间后,进行3阶段的调温。第1阶段,将物料冷却至29 ℃;第2阶段,从29 ℃冷却至结晶温度并结晶一定时间;第3阶段,回温至29~30 ℃[15]。浇注成型后置于8 ℃下冷却25 min,脱模,包装后储存。
1.2.3 以巧克力为载体的膳食补充剂的工艺优化
1.2.3.1 单因素试验
按照1.2.2小节的方法制作巧克力,设置精炼结束后,设置益生菌接种温度为32、35、37和40 ℃,搅拌时间为2.5、5、10和15 min,结晶温度22、24、26、28和30 ℃,结晶时间10、15、20、25和30 min,回温时间5、10、15、20和25 min,测定巧克力中的活菌数、水分含量及水分活度。
1.2.3.2 正交试验
以单因素试验为基础,设计4因素3水平正交试验(表1和表2),并测定各组巧克力中的活菌数、水分活度以及水分含量,以确定最佳的工艺优化方案。
表1 正交试验因素表
Table 1 Orthogonal experiment factors and levels
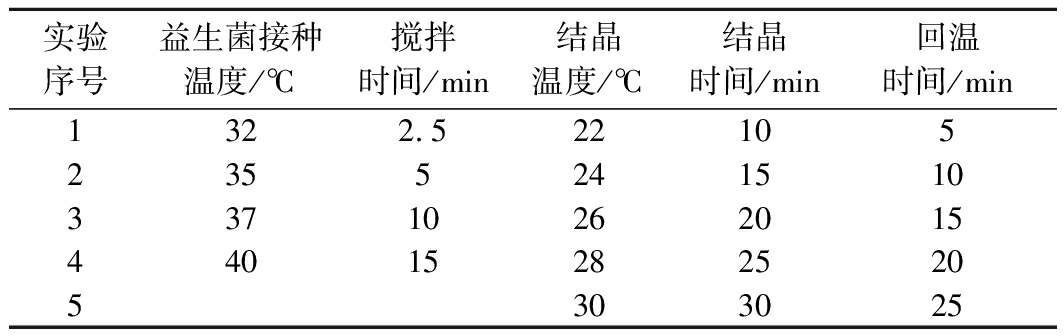
实验序号益生菌接种温度/℃搅拌时间/min结晶温度/℃结晶时间/min回温时间/min1322.522105235524151033710262015440152825205303025
表2 正交试验设计
Table 2 Orthogonal experiment design
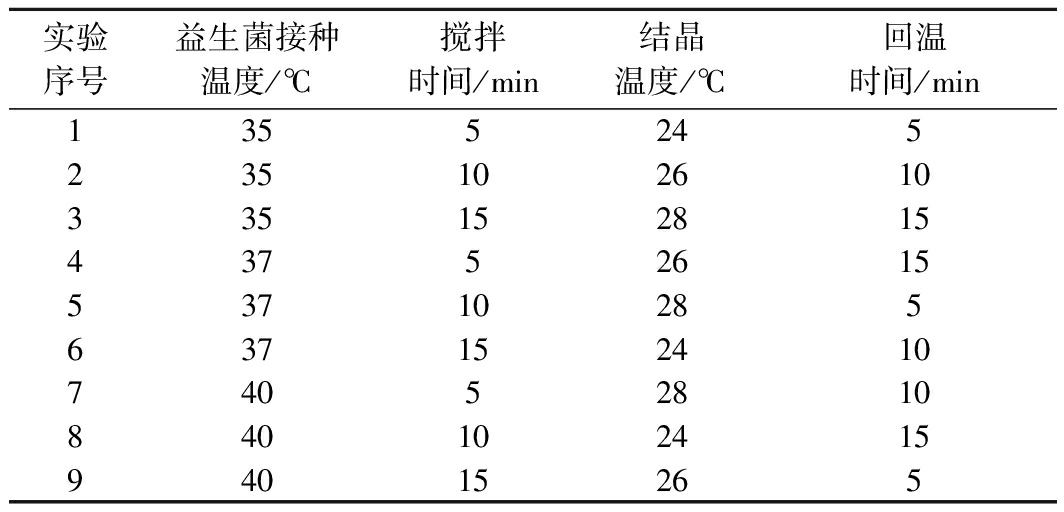
实验序号益生菌接种温度/℃搅拌时间/min结晶温度/℃回温时间/min135524523510261033515281543752615537102856371524107405281084010241594015265
1.2.4 巧克力中活菌数、水分活度和水分含量的测定方法
活菌数:称取20 g巧克力,与180 mL蛋白胨水溶液(0.1%)混合。混合物熔化后(40 ℃,15 min),振荡均匀进行平板计数[16];水分活度:参考KONAR等[17]的方法;水分含量:使用水分含量仪测定。均为1式3份测量。
1.2.5 以巧克力为载体的膳食补充剂储藏期的特性研究
根据正交试验确定的最佳工艺条件,重新制作以巧克力为载体的膳食补充剂,在-20、4和25 ℃的条件下储存,并在第0、30、60和90天时测定巧克力及复配菌粉对照的活菌数,评价其对模拟胃肠液的耐受能力。
1.2.6 储藏期巧克力中活菌数和模拟胃肠液的耐受能力的测定
活菌数:按照1.2.4小节的方法。模拟胃肠液的耐受能力:称取4 g巧克力加入到300 mL模拟胃液(3 g胃蛋白酶/L无菌生理盐水,pH 3.0)中溶解,取1 mL溶液活菌计数,其余部分在37 ℃培养3 h;然后取1 mL溶液进行活菌计数,同时吸取9 mL溶液离心弃上清液,用9 mL模拟肠液(1 g/L胰蛋白酶和3 g/L胆盐)重悬,37 ℃培养4 h,耐受肠液结束后取1 mL活菌计数,并计算菌体存活率[18]。
1.2.7 巧克力的感官评定方法
参考DESHPANDE等[19]的感官评定方法。评定在相对安静卫生的独立空间内进行,评定小组人数为8人,评分标准如表3所示。评分以8个人评分的平均值表示。
表3 巧克力感官评分标准
Table 3 Standard for sensory evaluation of chocolate
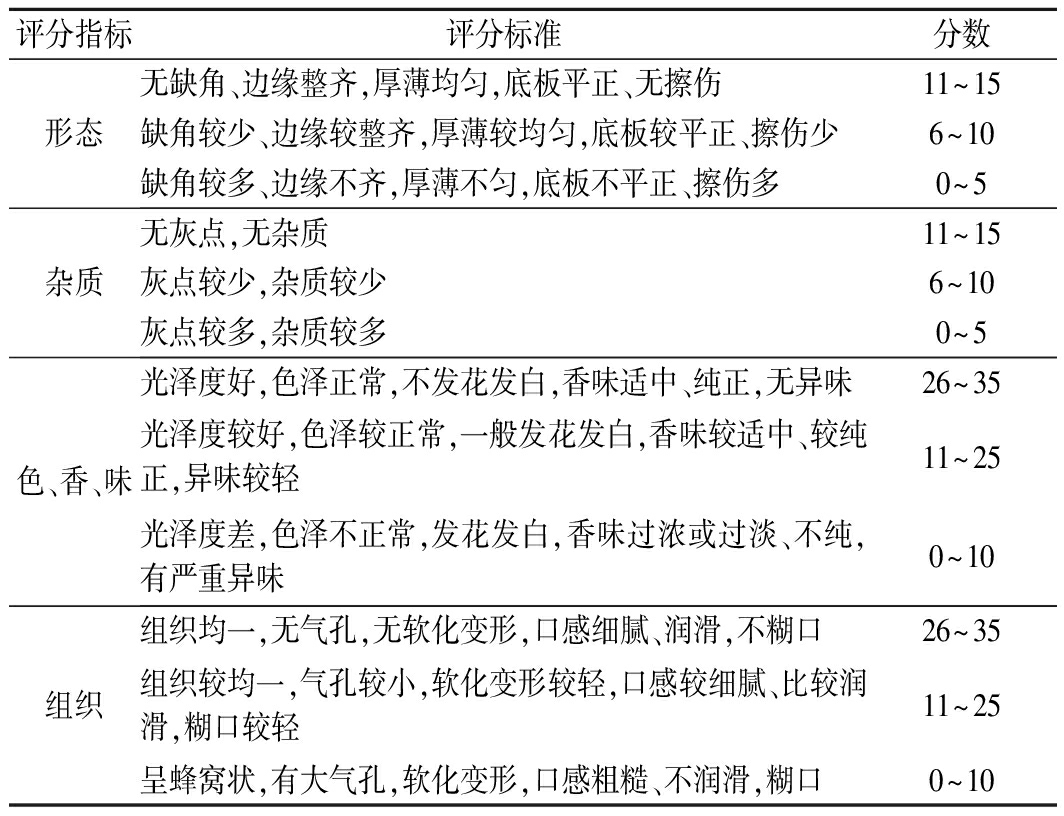
评分指标评分标准分数形态无缺角、边缘整齐,厚薄均匀,底板平正、无擦伤11~15缺角较少、边缘较整齐,厚薄较均匀,底板较平正、擦伤少6~10缺角较多、边缘不齐,厚薄不匀,底板不平正、擦伤多0~5杂质无灰点,无杂质11~15灰点较少,杂质较少6~10灰点较多,杂质较多0~5色、香、味光泽度好,色泽正常,不发花发白,香味适中、纯正,无异味26~35光泽度较好,色泽较正常,一般发花发白,香味较适中、较纯正,异味较轻11~25光泽度差,色泽不正常,发花发白,香味过浓或过淡、不纯,有严重异味0~10组织组织均一,无气孔,无软化变形,口感细腻、润滑,不糊口26~35组织较均一,气孔较小,软化变形较轻,口感较细腻、比较润滑,糊口较轻11~25呈蜂窝状,有大气孔,软化变形,口感粗糙、不润滑,糊口0~10
1.2.8 数据处理及结果分析
实验数据应用SPSS 19.0进行统计分析,结合GraphPad Prism 6作图,所有数据均以“平均值±标准差”表示,每项实验至少3次平行重复,通过单因素方差分析(ANOVA)和Duncan事后检验进行分析,P<0.05为差异有统计学意义。
2 结果与分析
2.1 单因素试实验结果
2.1.1 益生菌接种温度的影响
实验结果表明,接种温度略有提高利于保持益生菌的存活率,但温度过高会使益生菌存活率下降(图1-a)。37 ℃时,巧克力样品中的活菌数最高,且水分活度及水分含量显著最低(图1-b和图1-c)。因此,最佳接种温度选择为37 ℃。
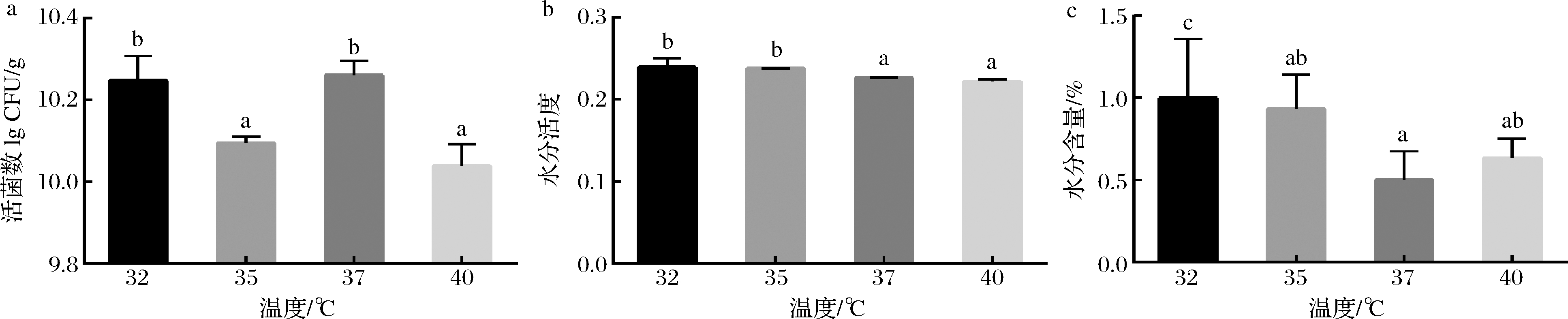
a-巧克力中的活菌数;b-巧克力的水分活度;c-巧克力的水分含量
图1 益生菌接种温度对巧克力中活菌数、水分活度和水分含量的影响
Fig.1 Effects of inoculation temperature on viable count,water activity and moisture content in chocolate
注:柱形图上的a~c表示不同组之间的显著性差异(P<0.05)(下同)
2.1.2 搅拌时间的影响
如图2所示,随着搅拌时间增加,巧克力中的活菌数先上升后下降,而水分含量与水分活度则表现出相反的趋势。较于其他搅拌时间,搅拌10 min时,巧克力中的活菌数显著提高,且样品中水分活度和水分含量显著降低,因此最佳搅拌时间确定为10 min。

a-巧克力中的活菌数;b-巧克力的水分活度;c-巧克力的水分含量
图2 搅拌时间对巧克力中的活菌数、水分活度和水分含量的影响
Fig.2 Effects of stirring time on viable count,water activity and moisture content in chocolate
2.1.3 结晶温度的影响
如图3所示,当结晶温度为26 ℃时,活菌数最高(1.58×1010 CFU/g)。此外,随着结晶温度升高,巧克力浆形成大量结晶,水分活度和水分含量下降。因此,结晶温度定为26 ℃。
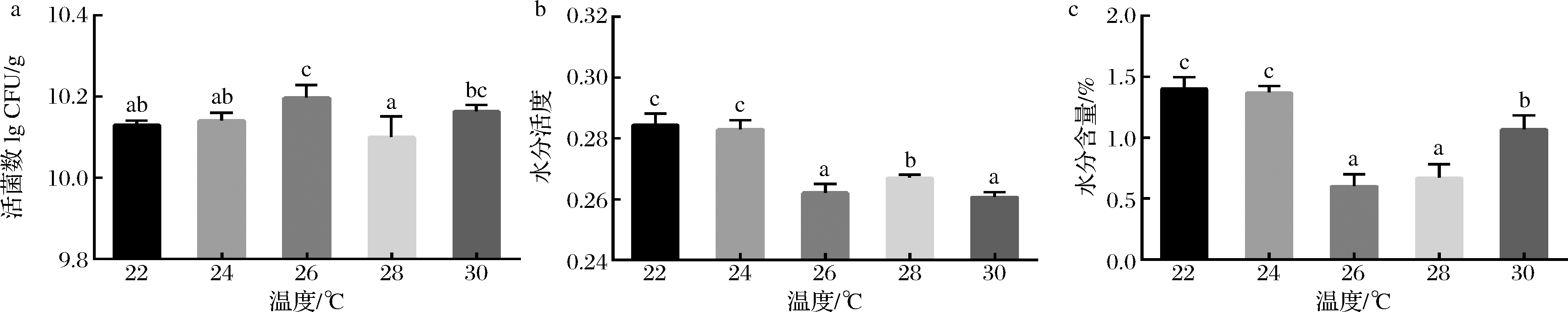
a-巧克力中的活菌数;b-巧克力的水分活度;c-巧克力的水分含量
图3 结晶温度对巧克力中的活菌数、水分活度和水分含量的影响
Fig.3 Effects of crystallization temperature on viable count,water activity and moisture content in chocolate
2.1.4 结晶时间的影响
如图4所示,随着结晶时间的增加,巧克力的水分活度和水分含量表现出先下降后升高的趋势。因此,结晶时间确定为20 min。
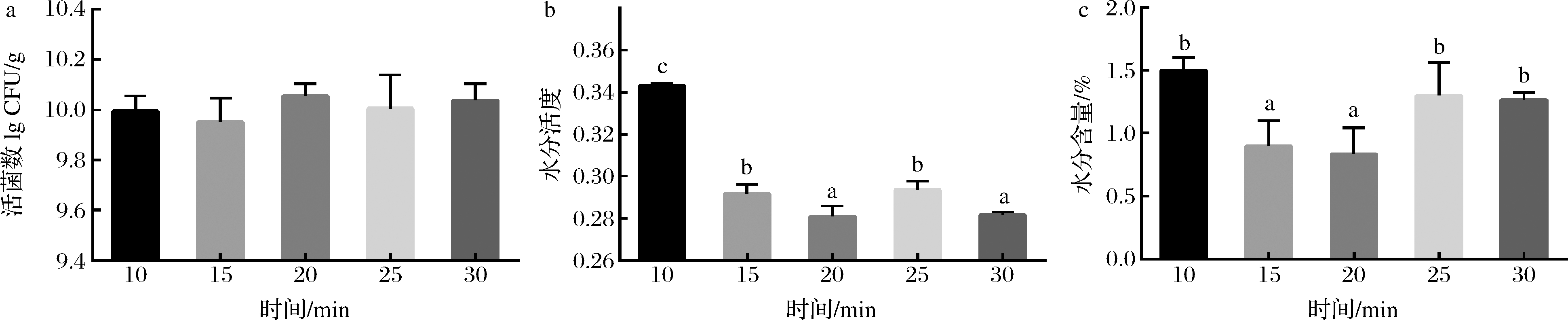
a-巧克力中的活菌数;b-巧克力的水分活度;c-巧克力的水分含量
图4 结晶时间对巧克力中的活菌数、水分活度和水分含量的影响
Fig.4 Effects of crystallization time on viable count,water activity and moisture content in chocolate
2.1.5 回温时间的影响
如图5所示,回温10 min时巧克力样品的活菌数最高,并伴随着最低水平的水分活度和水分含量。因此,回温时间应挑选10 min最为适宜。

a-巧克力中的活菌数;b-巧克力的水分活度;c-巧克力的水分含量
图5 回温时间对巧克力中的活菌数、水分活度和水分含量的影响
Fig.5 Effects of rewarming time on viable count,water activity and moisture content in chocolate
2.2 正交试验
在9个正交实验组中,第2组和第9组的巧克力样品的活菌数较高,其中第2组最高。水分活度较低组为第1组、第2组和第9组巧克力样品,其中第2组最低。同时第2组、第5组、第7组和第9组的水分含量最低(图6)。综合以上研究结果,并把巧克力的活菌数和水分活度作为主要评价指标,第2组巧克力品质为最佳条件,即巧克力制作过程中在35 ℃接入L.plantarum CCFM8661和低聚半乳糖,搅拌10 min,26 ℃下结晶,最后回温10 min。
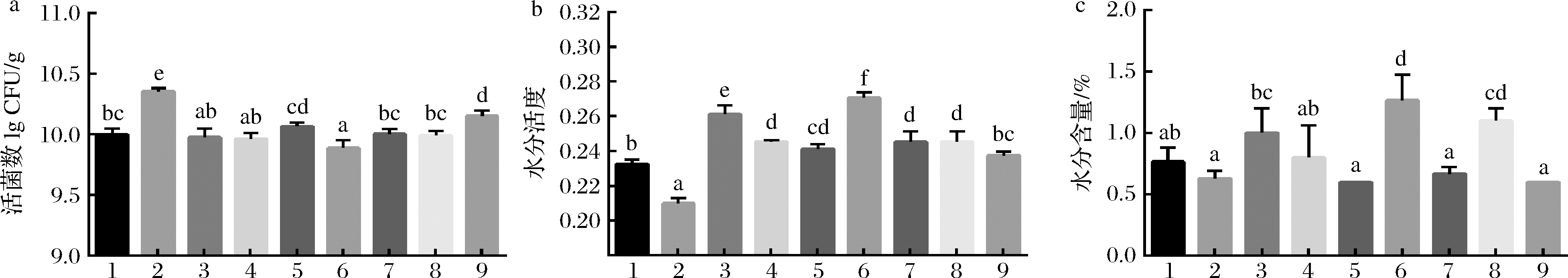
a-巧克力中的活菌数;b-巧克力的水分活度;c-巧克力的水分含量
图6 不同正交实验组巧克力中的活菌数、水分活度和水分含量
Fig.6 Viable count,water activity and moisture content of chocolate in different orthogonal experimental groups
2.3 以巧克力为载体的益生菌膳食补充剂的储藏特性
2.3.1 储存期间巧克力活菌数的变化
如图7所示,储存时间和温度的上升均会导致巧克力产品中活菌数下降。此外当储藏温度和时间一致时,巧克力产品中的活菌数显著高于菌粉对照组。这表明巧克力包裹可以明显提高益生菌在储藏期间的活菌数,并且储藏温度越低,时间越短活菌数越高。
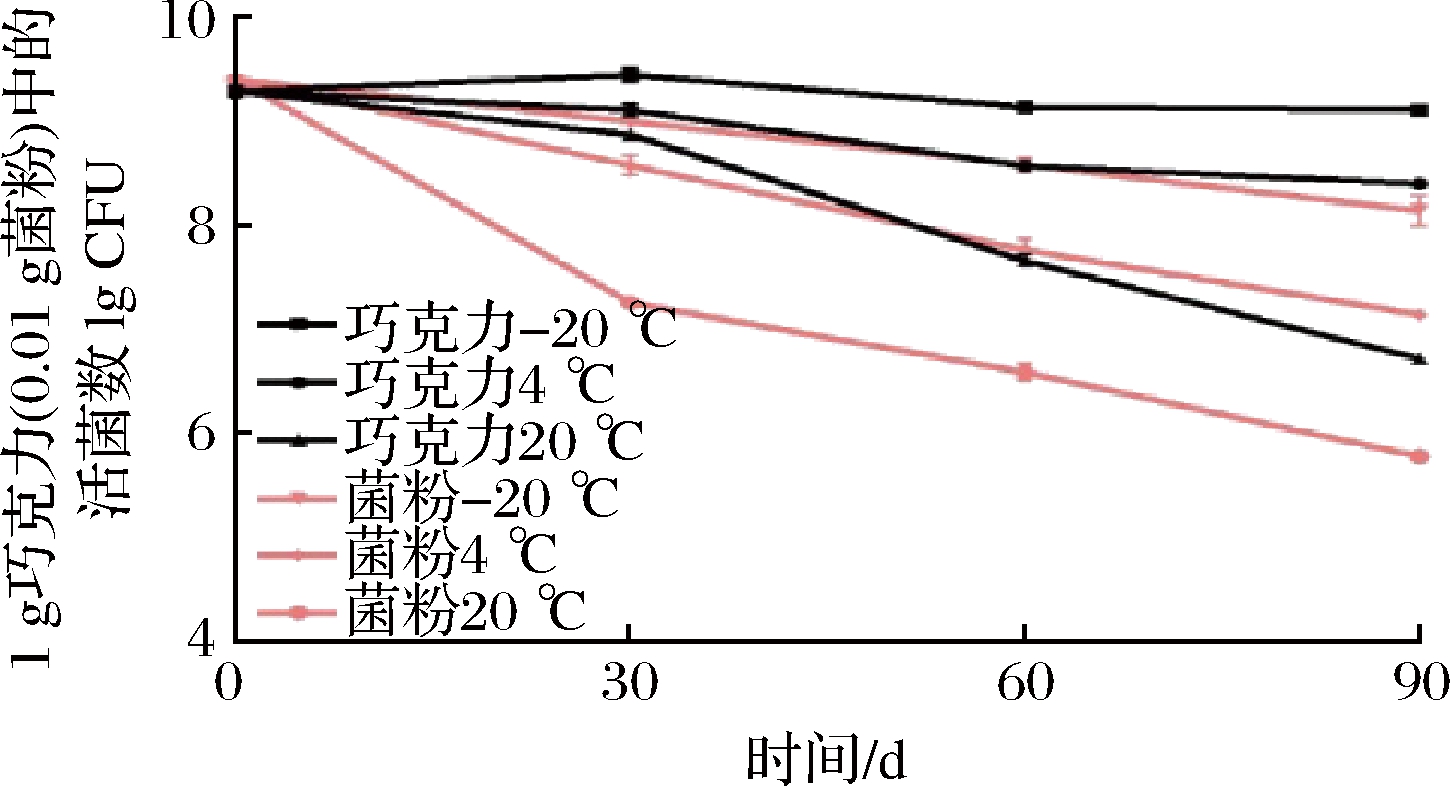
图7 储藏期间巧克力中L.plantarum CCFM8661
活菌数的变化
Fig.7 Changes of viable counts of L.plantarum CCFM8661
in chocolate during storage
2.3.2 储存期间巧克力益生菌对模拟胃肠液的耐受能力
模拟胃肠液中培养7 h后,以巧克力为载体的膳食补充剂中的活菌数明显高于菌粉(表4)。巧克力作为载体可以保护益生菌在经过模拟胃液和肠液后仍保持较高存活率[20-21]。
表4 巧克力及菌粉中益生菌对模拟胃肠液的耐受能力
Table 4 Tolerance of probiotics to simulated gastrointestinal
fluids in chocolate and powder
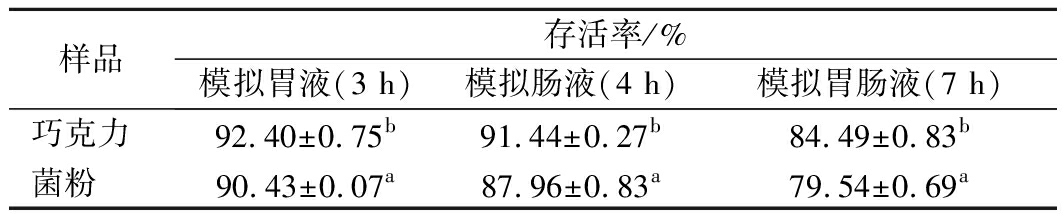
样品存活率/%模拟胃液(3 h)模拟肠液(4 h)模拟胃肠液(7 h)巧克力92.40±0.75b91.44±0.27b84.49±0.83b菌粉90.43±0.07a87.96±0.83a79.54±0.69a
2.3.3 巧克力的感官评价
感官评价结果表明包埋益生菌复合膳食补充剂对巧克力的形态、杂质色香味以及组织形态并无显著影响(表5)。这可能是由于益生菌被巧克力均匀包裹后,菌体处于休眠状态。此外,感官结果显示,添加低聚半乳糖不会影响巧克力的感官品质,与前人的结论一致[22]。
表5 巧克力的感官评定
Table 5 The sensory evaluation of the chocolate
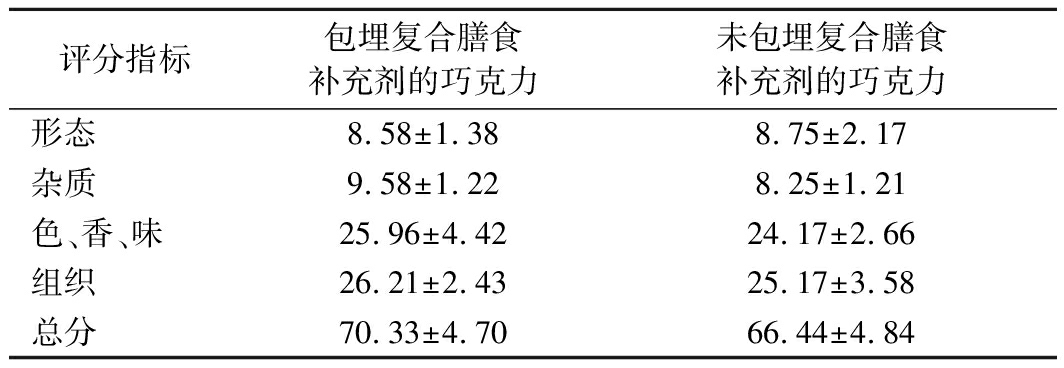
评分指标包埋复合膳食补充剂的巧克力未包埋复合膳食补充剂的巧克力形态8.58±1.388.75±2.17杂质9.58±1.228.25±1.21色、香、味25.96±4.4224.17±2.66组织26.21±2.4325.17±3.58总分70.33±4.7066.44±4.84
3 结论
本研究通过单因素试验和正交试验探究以巧克力作为载体的复合L.plantarum CCFM8661和低聚半乳糖膳食补充剂的最佳工艺条件。研究发现,以巧克力为载体的复合膳食补充剂制作的最佳工艺条件为益生菌加入温度35 ℃、搅拌时间10 min,结晶温度26 ℃,回温时间10 min。与复配菌粉相比,以巧克力为载体的复合膳食补充剂的货架期更长,其最佳储藏温度为-20 ℃。同时,巧克力包埋的益生菌比未包埋的益生菌具有更强的耐酸耐胆盐能力,且包埋益生菌膳食补充剂并不会影响巧克力的感官品质。
[1] GIBSON G R,HUTKINS R,SANDERS M E,et al.Expert consensus document:The international scientific association for probiotics and prebiotics (ISAPP) consensus statement on the definition and scope of prebiotics[J].Nature Reviews Gastroenterology and Hepatology,2017,14(8):491-502.
[2] ZHAI Q,WANG J,CEN S,et al.Modulation of the gut microbiota by a galactooligosaccharide protects against heavy metal lead accumulation in mice[J]. Food Function,2019,10(6):3 768-3 781.
[3] MA C,WASTI S,HUANG S,et al.The gut microbiome stability is altered by probiotic ingestion and improved by the continuous supplementation of galactooligosaccharide[J]. Gut Microbes,2020:1-13.
[4] FEMIA A P,LUCERI C,Dolara P,et al.Antitumorigenic activity of the prebiotic inulin enriched with oligofructose in combination with the probiotics Lactobacillus rhamnosus and Bifidobacterium lactis on azoxymethane-induced colon carcinogenesis in rats[J]. Carcinogenesis,2002,23(11):1 953-1 960.
[5] TIAN F,ZHAI Q,ZHAO J,et al.Lactobacillus plantarum CCFM8661 alleviates lead toxicity in mice[J].Biological Trace Element Research,2012,150(1-3):264-271.
[6] YIN R,ZHAI Q,YU L,et al.The binding characters study of lead removal by Lactobacillus plantarum CCFM8661[J].European Food Research and Technology,2016,242(10):1 621-1 629.
[7] MORTAZAVIAN A,RAZAVI S H,EHSANI M R,et al.Principles and methods of microencapsulation of probiotic microorganisms[J].Iranian Journal of Biotechnology,2007,5(1):1-18.
[8] KRASAEKOOPT W,BHANDARI B.Deeth.Evaluation of encapsulation techniques of probiotics for yoghurt[J].International Dairy Journal,2003,13(1):3-13.
[9] MEYBODI N M,MORTAZAVIAN A M.Probiotic supplements and food products:A comparative approach[J].Biochemistry & Pharmacology,2017,6(2):1-7.
[10] KONAR N,TOKER,O S,OBA S,et al.Improving functionality of chocolate:A review on probiotic,prebiotic,and/or synbiotic characteristics[J].Trends in Food Science and Technology,2016,49:35-44.
[11] NAMBIAR R B,SELLAMUTHU P S,PERUMAL A B.Development of milk chocolate supplemented with microencapsulated Lactobacillus plantarum HM47 and to determine the safety in a Swiss albino mice model[J].Food Control,2018,94:300-306.
[12] KONAR N,PALABIYIK I,TOKER OS,et al.Conventional and sugar-free probiotic white chocolate:Effect of inulin DP on various quality properties and viability of probiotics[J].Journal of Functional Foods,2018,43:206-213.
[13] GÜLTEKIN-ÖZGÜVEN M,BERKTA
![]() B.Influence of processing conditions on procyanidin profiles and antioxidant capacity of chocolates:Optimization of dark chocolate manufacturing by response surface methodology[J].LWT-Food Science and Technology,2016,66:252-259.
B.Influence of processing conditions on procyanidin profiles and antioxidant capacity of chocolates:Optimization of dark chocolate manufacturing by response surface methodology[J].LWT-Food Science and Technology,2016,66:252-259.
[14] AIDOO R P,AFOAKWA E O,DEWETTINCK K.Rheological properties,melting behaviours and physical quality characteristics of sugar-free chocolates processed using inulin/polydextrose bulking mixtures sweetened with stevia and thaumatin extracts[J].LWT-Food Science and Technology,2015,62(1):592-597.
[15] JOACHIM D.Temperature treatment process for chocolate mass,branches off side stream and returns it to main flow a different location in the process.Germany Document Laid open (First Publication) DE20031029177[P].2003-06-29.
[16] ![]()
![]() M L,RAKIN M B,et al.Functional,rheological and sensory properties of probiotic milk chocolate produced in a ball mill[J].RSC Advances,2016,6(17):13 934-13 941.
M L,RAKIN M B,et al.Functional,rheological and sensory properties of probiotic milk chocolate produced in a ball mill[J].RSC Advances,2016,6(17):13 934-13 941.
[17] KONAR N.Influence of conching temperature and some bulk sweeteners on physical and rheological properties of prebiotic milk chocolate containing inulin[J].European Food Research and Technology,2013,236(1):135-143.
[18] AZUMA Y,ITO K,SATO M.Simulated digestive juice tolerance and inhibitory effect on harmful intestinal bacteria of Lactobacillus gasseri NY0509 and Lactobacillus casei NY1301[J].Nippon Shokuhin Kogyo Gakkaishi,2001,48(9):656-663.
[19] DESHPANDE H W,KHARAT V T,KATKE S D.Studies on process standardization and sensory evaluation of probiotic chocolate[J].International Journal of Current Microbiology and Applied Sciences,2019,8(8):1 527-1 534.
[20] GUO Z,WANG J,YAN L,et al.In vitro comparison of probiotic properties of Lactobacillus casei Zhang,a potential new probiotic,with selected probiotic strains[J].LWT-Food Science and Technology,2009,42(10):1 640-1 646.
[21] SUCCI M,TREMONTE P,REALE A,et al.Bile salt and acid tolerance of Lactobacillus rhamnosus strains isolated from Parmigiano Reggiano cheese[J]. FEMS Microbiology Letters,2005,244(1):129-137.
[22] SUTER A N.The effect of galactooligosaccharide addition to a chocolate system[D].Columbus:The Ohio State University,2010.