脂肪氧合酶(lipoxygenases,LOXs)属于结构相关的非血红素铁双加氧酶家族,广泛分布于动植物界。它能催化含一个或多个(1Z,4Z)-戊二烯结构的多不饱和脂肪酸(polyunsaturated fatty acid,PUFA),如亚油酸、花生四烯酸的氢发生过氧化反应,PUFA的氧化作用是形成具有多种生物功能的活性脂类的过程[1]。LOXs底物特异性广泛,可利用性高,已在食品、纺织、造纸等众多生物技术领域被商业化开发应用[2-6]。近年来,利用硫酸铵沉淀法、柱层析法、制备电泳法等传统方法对不同来源的LOXs进行纯化和表征的研究报道较多,然而这些分离技术大多成本高并且耗时长,很难规模化应用[4,7-9]。商品化的 LOXs主要通过大豆粉浸提后结合柱层析法获得,价格较为昂贵。
三相分离技术(three phase partitioning,TPP)是近年发展起来的一种简单、高效的非色谱技术,主要用于从粗原料或发酵液中分离和浓缩蛋白质。TPP法是指在粗提物中加入硫酸铵(盐)和叔丁醇(有机溶剂),以使目的蛋白在界面相沉淀,而杂质主要分配在叔丁醇(顶相)和水相(底相)中[10]。这种技术因易于操作、可规模化和成本低而颇受关注。已有报道称,TPP法是过氧化物酶[11-14]、蛋白酶[15-16]、黄瓜素[17]、多酚氧化酶[18-19]、血清肽酶[20]、漆酶[21]、过氧化氢酶[22]等多种酶的有效提取和纯化技术,但尚未见应用TPP法一步纯化大豆粉中LOXs的相关报道。
本文利用TPP技术建立了一种有效的纯化LOXs的方法。所有的TPP实验都是用脱脂豆粉中提取的粗LOXs酶液进行的,目的是利用TPP法从脱脂大豆粉中分离、浓缩LOXs并达到最大的纯度和提取率。实验中考察了硫酸铵饱和度、粗酶液与叔丁醇的比例、温度和pH值等工艺参数对提取效率的影响。用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析法对得到的LOXs酶的纯度进行了评价。
1 材料与方法
1.1 材料与试剂
大豆, 2019年产于黑龙江;亚油酸、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、考马斯亮蓝G-250,Sigma公司;(NH4)2SO4、叔丁醇、吐温-20、甲醇等,德国默克公司。
1.2 仪器与设备
LD4-2型离心机,北京医用离心机厂;TU-1901型双光束紫外-可见分光光度计,北京普析通用仪器有限公司;CG001机械干磨机,广东德尔有限公司;PHS-3B精密PH计,上海雷磁仪器厂;Hitachi S-4800扫描电子显微镜,德国蔡司公司;XH-D快速混匀器,无锡市莱浦仪器设备有限公司。
1.3 实验方法
1.3.1 脂氧酶粗提物的制备
用蒸馏水清洗大豆,于干净的托盘中干燥。称取约10 g大豆,物理去皮后,用石油醚脱脂直到溶剂不变色。然后将脱脂大豆粉碎成小块,过50目筛网进行筛分。
用100 mL 0.1 mol/L磷酸盐缓冲液(pH 7)将脱脂豆粉搅拌浸泡混合1 h后,4 000 r/min离心20 min,收集所得上清液用于进一步的TPP纯化研究。
1.3.2 脂氧酶的三相分离
在设定的温度下,涡流条件下用适量的(NH4)2SO4将LOXs粗提液饱和,注意尽量避免起泡。待(NH4)2SO4完全溶解后,逐滴加入适量的叔丁醇。然后将混合物彻底涡流混合,并静置60 min。在4 000 r/min条件下低速离心10 min,实现3种不同相(上部有机相、中间界面沉淀相和底层水相)的完全相分离。收集含LOXs的中间界面蛋白沉淀,并溶解在2 mL 2 mol/L磷酸盐缓冲溶液(pH 9.0)中,进一步分析蛋白质含量和酶活性,计算纯化倍数和活性回收率。
以初加粗提液的活性为100%,分析了包括(NH4)2SO4饱和度(20%~70%)、LOXs粗提液样品与叔丁醇的体积比(1∶1~1∶4)、温度(0~40 ℃)和pH (5~10)在内的各工艺参数对LOXs分离效果的影响。
1.3.3 脂氧酶活性的测定
LOXs的活性测定是通过234 nm处吸光度的增加来监测的[23]。在恒温25 ℃下,量取0.2 mL脂氧酶酶液加入至1.5 mL的底物亚油酸溶液中,静置3 min后,加入5 mL无水乙醇使反应结束,然后加入5 mL的蒸馏水,充分摇匀后,在234 nm处测定反应液的吸光度。空白实验是在酶液中先加5 mL无水乙醇灭活,再加1.5 mL底物溶液静置3 min,最后加入5 mL的蒸馏水。脂氧合酶的一个单位被定义为在总体积为3 mL的情况下,1 min内在234 nm处产生0.001光密度的活性。
1.3.4 蛋白质的浓度测定
用Bradford法测定蛋白浓度[24],标准蛋白为牛血清白蛋白。
1.3.5 数据分析处理
所有实验分2次进行,数据用平均值±标准差表示。比酶活力、纯化倍数和活力回收率分别按公式(1)、(2)、(3)进行计算:
比活酶力![]()
(1)
纯化倍数![]()
(2)
活力回收率![]()
(3)
1.3.6 扫描电镜
将粗酶液、三相分离法得到的中间沉淀相进行透析处理,真空冷冻干燥24 h,采用高分辨场发射扫描电镜对蛋白沉淀的形貌和微观结构进行观测及分析。
1.3.7 SDS-PAGE凝胶电泳分析
对蛋白质样品进行SDS-PAGE分析,按稍作修改的Laemmli方法进行[25]。电泳凝胶由5%的堆积凝胶和12%的分离凝胶组成,其电压分别为160和200 V。电泳后,用考马斯亮蓝G-250在体积分数为45.4%甲醇和体积分数为9.2%乙酸的混合溶液中将样品凝胶染色1 h,然后用体积分数为7.5%乙酸和体积分数为5%甲醇的混合溶液脱色3 h。所用分子质量为BioRad低分子质量标记 (低范围SDS-PAGE标准)。
2 结果与分析
2.1 有机溶剂类型对脂氧酶分配的影响
有机溶剂不仅影响体系的极性和介电常数,而且影响三相的形成和分离。本文测定了正丁醇、异丙醇、叔丁醇、正戊醇和乙醇这5种有机溶剂对脂氧酶分配过程的影响。其他条件设定为:盐饱和度(60%)、粗提液与有机溶剂的体积比(1∶2)、pH 7,20 ℃下静置60 min。结果如图1所示,与其他溶剂相比,叔丁醇更为有效,脂氧酶的纯化倍数和活力回收率分别为7.2倍和68.8%,可能是因为叔丁醇可以通过与沉淀蛋白结合来增加浮力,从而使其漂浮在密度更高的水盐层之上。
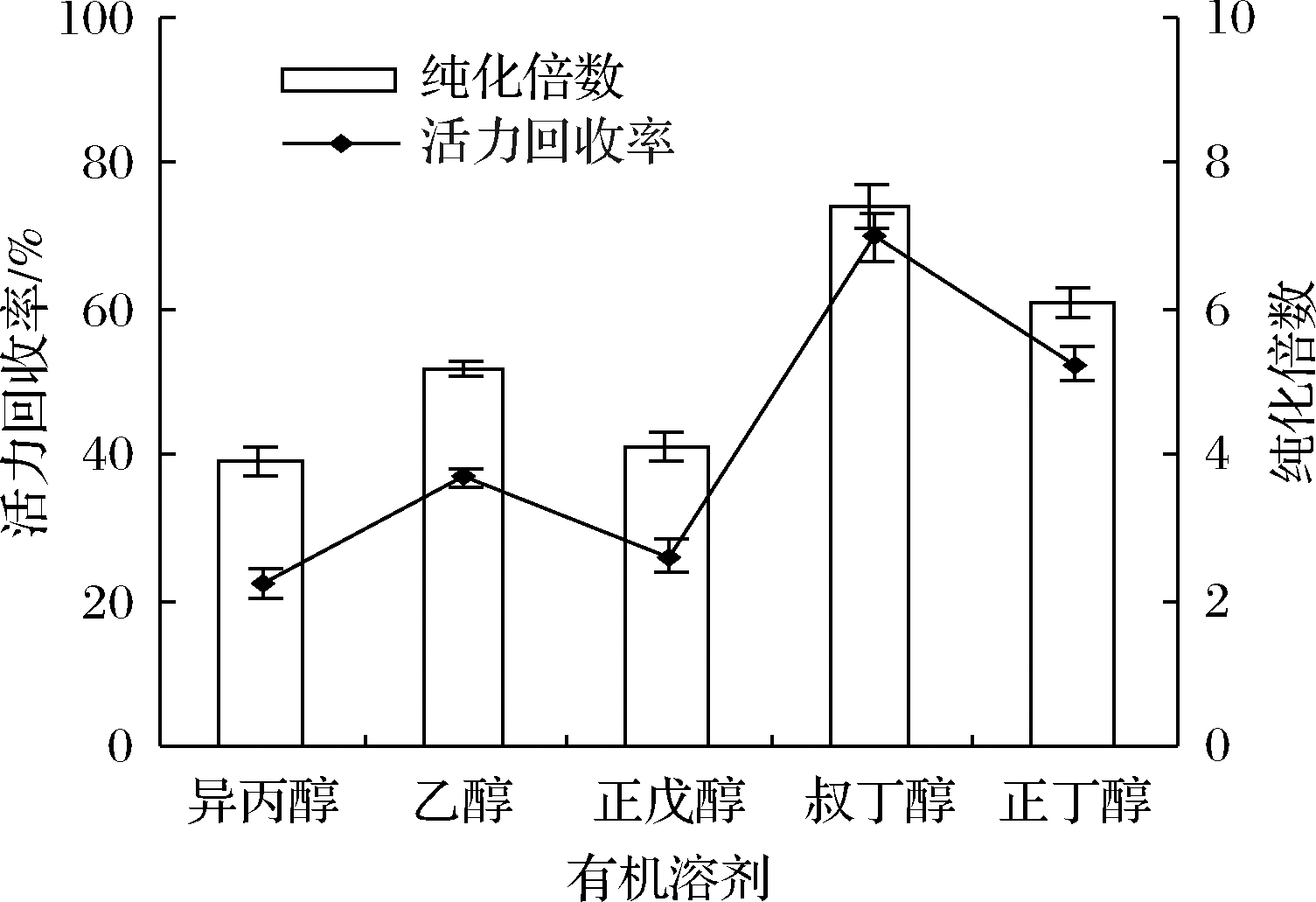
图1 有机溶剂类型对脂氧酶纯化倍数和活力回收率的影响
Fig.1 Effect of organic solvent types on purification
and activity recovery of LOXs
此外,由于其较高的分子质量,不能渗透到折叠的蛋白质三维结构中,因此不会引起分离酶的变性。在20~30 ℃下,还表现出明显的渗透和拥挤效应,提高了LOX的分配效率。
2.2 (NH4)2SO4饱和度对脂氧酶分配的影响
(NH4)2SO4通过改变TPP过程中溶液的离子强度而起着重要作用。盐分饱和度通过盐析作用影响蛋白质的溶解度,是蛋白质沉淀的主要原因。将(NH4)2SO4加入到粗提液中,获得20%~70%的最终饱和度,并在20 ℃、pH 7、粗提液与叔丁醇的体积比为1∶2的条件下优化60 min,以获得界面沉淀中所需酶的最大量。如图2所示,增加(NH4)2SO4饱和度可提高LOXs的回收率,在 (NH4)2SO4饱和度为60%时可获得最大纯度(7.13)和回收率(67.89%)。进一步增加(NH4)2SO4饱和度将减少LOXs选择性分配到中间相中,这可能是由于LOXs酶的不可逆变性。根据这些结果,选择60% (NH4)2SO4饱和度作为后续实验的最佳条件。

图2 硫酸铵饱和度对脂氧酶纯化倍数和活力回收率的影响
Fig.2 Effect of (NH4)2SO4 saturation on purification
fold and activity recovery of LOXs
2.3 粗酶液与叔丁醇比例对脂氧酶分配的影响
研究了粗酶液与叔丁醇的体积比在1∶1~1∶4范围内对脂氧酶分配的影响,结果如图3所示。在粗提液与叔丁醇的体积比为1∶2.5时,其他实验参数设置为:(NH4)2SO4达60%饱和,pH 7、20 ℃下静置60 min,LOXs的最大纯化倍数和回收率分别达到7.95%和75.2%。当叔丁醇用量在1∶1~1∶2范围时,其用量越少,则与(NH4)2SO4的协同作用越弱,萃取效率相应越低。相反,如果叔丁醇含量高于1∶2.5,LOXs蛋白的变性更频繁,LOXs酶的纯度和活力回收率降低。因此,选择粗提物与叔丁醇的比例为1∶2.5,进一步考察其他因素对脂氧酶分配的影响。
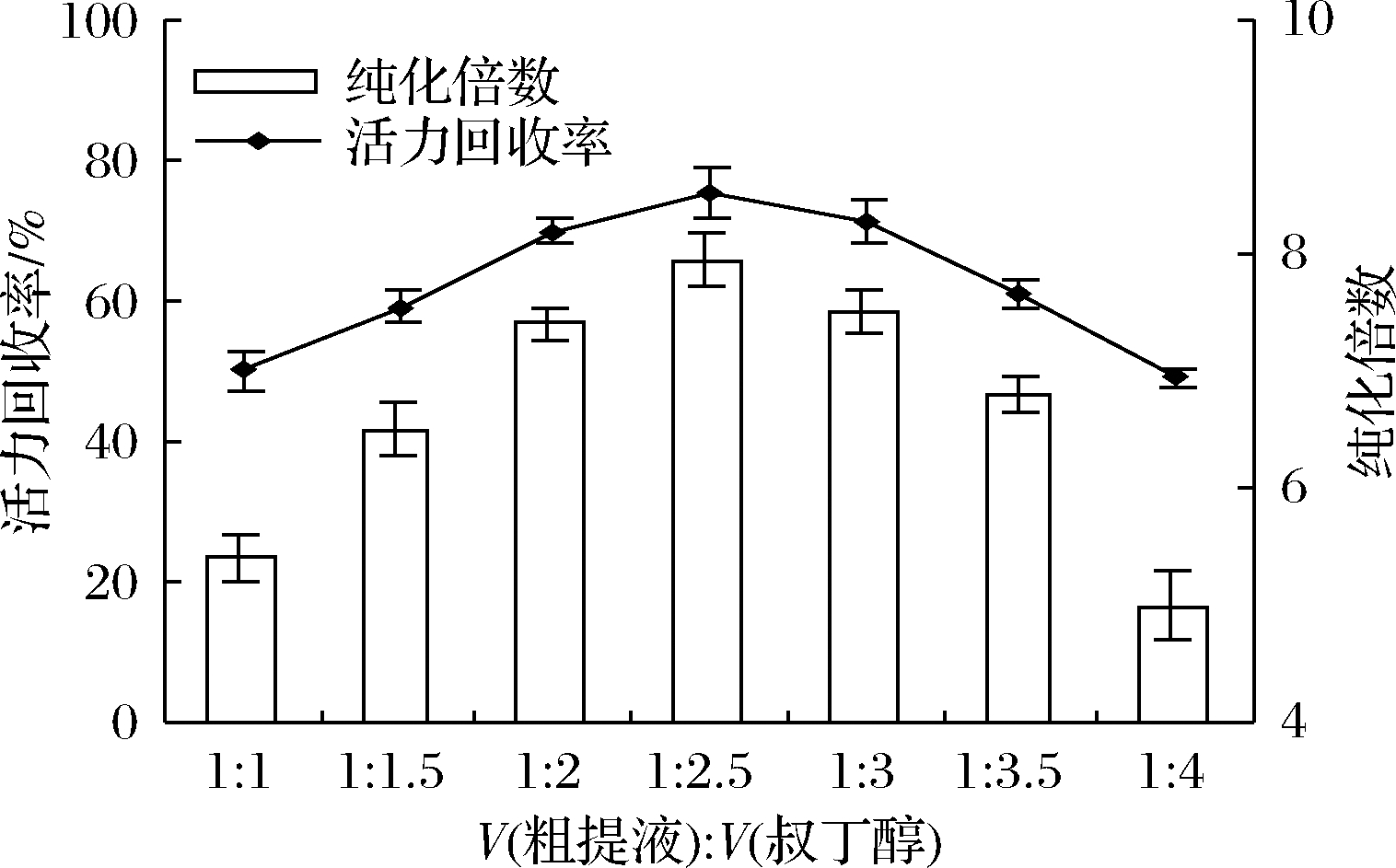
图3 叔丁醇用量对脂氧酶纯化倍数和活力回收率的影响
Fig.3 Effect of broth to t-butanol ratios on purification
fold and activity recovery of LOXs
2.4 温度对脂氧酶分配的影响
温度是TPP过程中的一个重要参数,影响着酶的结构和整体稳定性。在保持(NH4)2SO4饱和度60%、pH 7、粗提液与叔丁醇比例为1∶2.5、萃取时间为60 min等参数不变的情况下,通过在0~40 ℃范围内改变水浴温度来研究温度对脂氧酶分配的影响。由图4可知,在20 ℃下,酶的纯度随着温度的升高而增加,这是因为温度的升高降低了溶剂的粘度和密度,从而导致传质强化,提高了提取率。在温度高于20 ℃时萃取效率的降低可能是由于LOXs酶的热失活。因此,为保持天然酶结构,后续的优化实验在室温20 ℃下进行。

图4 温度对脂氧酶纯化倍数和活力回收率的影响
Fig.4 Effect of temperature on purification fold
and activity recovery of LOXs
2.5 pH值对脂氧酶分配的影响
TPP过程中的另一个重要的影响因素是pH值,它能改变氨基酸的电离状态。通过调节pH值,蛋白质的净电荷会改变,体系中酶的分配效率也会受影响。在整个实验过程中保持其他实验条件不变:60%的(NH4)2SO4饱和度,粗酶液与叔丁醇的比例1∶2.5,在25 ℃下保持60 min,考察pH在5~10之间时LOX分配效率的变化,结果如图5所示。随着pH值从5增加到8,LOXs的纯化倍数和活力回收率增加,这可解释为LOXs在pH 8时对叔丁醇具有较好的构象稳定性。在酸性pH下LOXs的回收率较中性范围低,这可能是因为酸性pH提供了更多的H+来竞争LOXs和叔丁醇之间的相互作用。TPP提纯LOXs在pH 8条件下得到了最大纯度(8.2)和活力回收率(78.2%)。
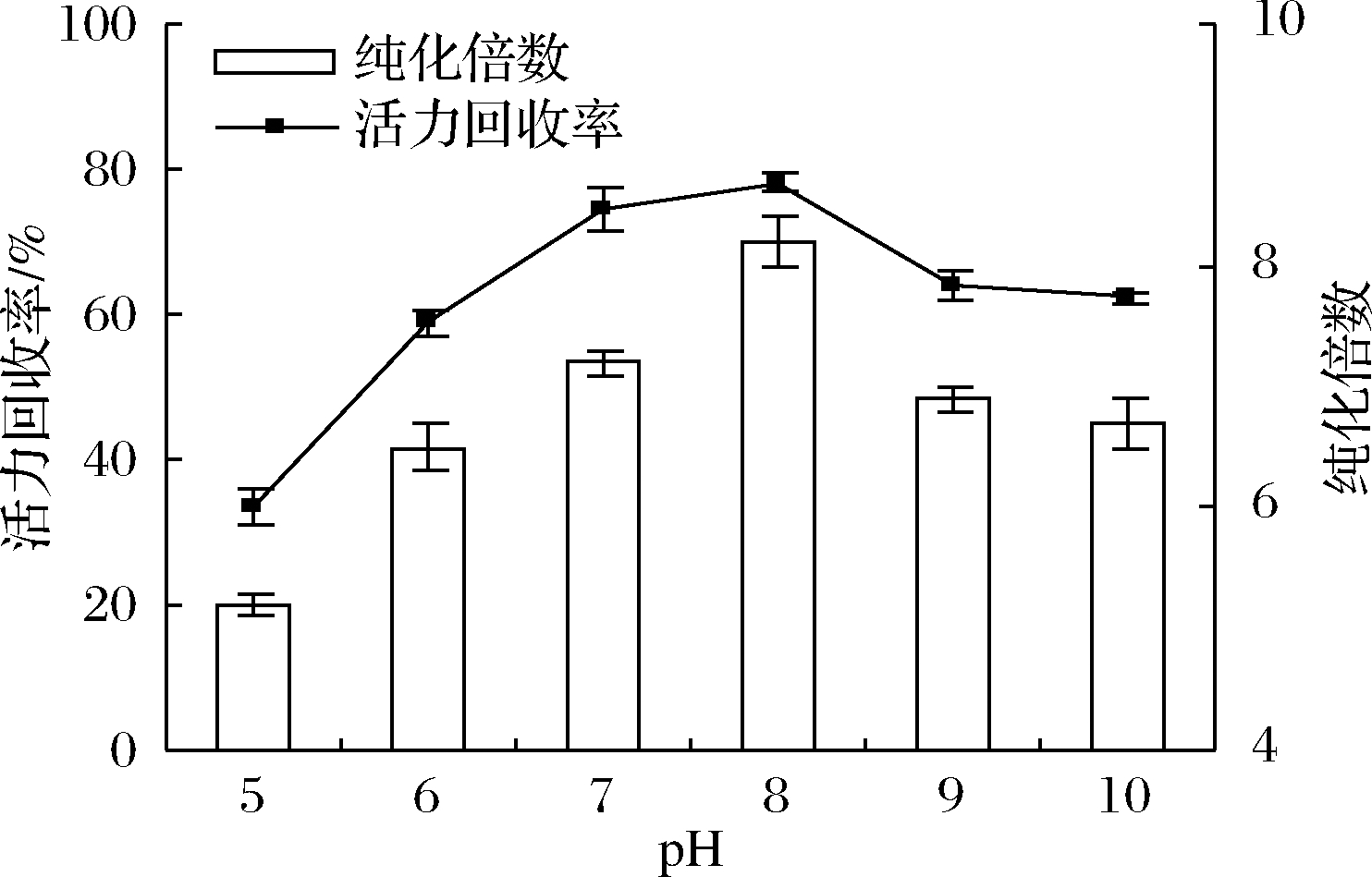
图5 pH对脂氧酶纯化倍数和活力回收率的影响
Fig.5 Effect of pH on purification fold and
activity recovery of LOXs
2.6 扫描电镜
分别用水提取法和TPP法获得的LOXs酶蛋白的SEM图像如图6所示。由图6可知,2种方法得到的脂氧酶形貌完全不同。LOXs酶蛋白在粗提物中的微观结构表现为聚集在一起的絮状沉淀。TPP法制备的LOXs酶可能是由于(NH4)2SO4和叔丁醇的共同作用,受各种力的影响,形成较为明显的光滑片状结构,呈结晶状沉淀。

a.粗提的脂氧酶;b.三相纯化的脂氧酶
图6 粗提法和三相法所得脂氧酶的SEM图
Fig.6 SEM images of the interfacial precipitate and crude LOXs
2.7 SDS-PAGE分析
分别对粗提和TPP纯化的LOXs酶进行SDS-PAGE分析,以估计该酶的分子质量,检查其分离纯度,结果如图7所示。值得注意的是,TPP法得到的LOXs纯度有较大提高。泳道2的酶带较少,比泳道1清晰很多,表明LOXs酶得到了部分纯化,分子质量约为97 kDa,与文献报道的结果相当[7-8]。
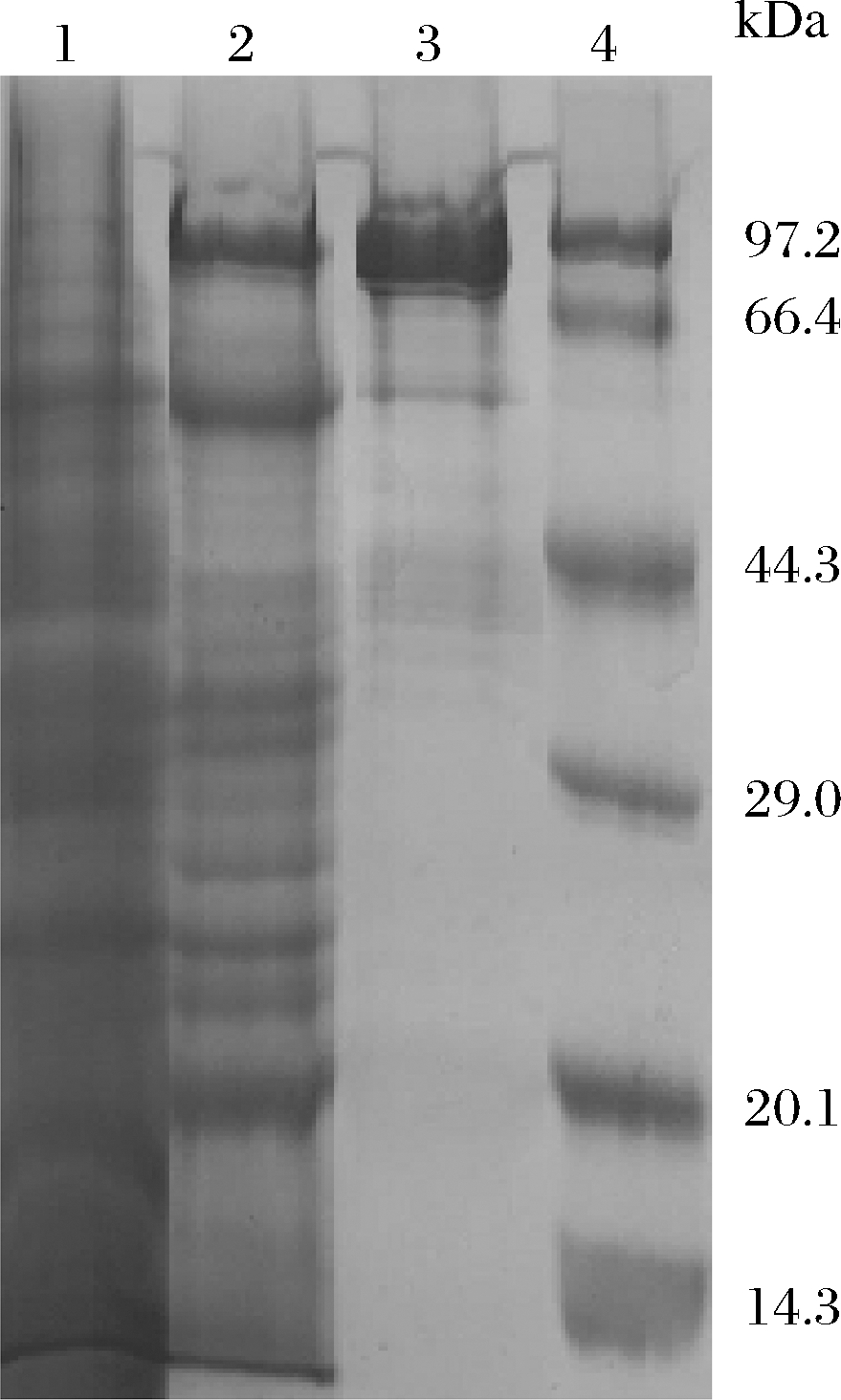
1-粗提酶;2-三相纯化的脂氧酶;3-商品脂氧酶;4-标准蛋白
图7 脂氧酶的SDS-PAGE电泳图谱
Fig.7 SDS-PAGE analysis of recovered and purified
LOXs from soy flours
3 结论
在pH 8和25 ℃条件下,采用60%(NH4)2SO4饱和度、粗酶液与叔丁醇比例为1∶2.5的TPP体系从大豆粉中提取LOXs,活性回收率为78.2%,纯化倍数为8.2倍,首次证明了TPP用于脱脂大豆粉部分纯化LOXs的可行性。这种TPP技术在降低操作成本、简化操作步骤等方面对获得LOXs蛋白有一定的帮助。
[1] TAYBA H S,HUBBE M,ORLANDO J R.Lipoxygenase-mediated peroxidation of model plant extractives[J].Industrial Crops and Products,2017,104:253-262.
[2] XIE D S,WU B,SUN H F,et al.Correlation between the flavor and quality of Radix astragali:The extraction and characterization of lipoxygenase in radix astragali[J].World Science and Technology,2009,11(3):375-381.
[3] LARISA C,ANDREW L H,DARRY M S.Measurement of lipoxygenase in Australian white wheat flour:The effect of lipoxygenase on the quality properties of white salted noodles[J].Journal of the Science of Food and Agriculture,2006,86:1 670-1 678.
[4] QIAN H,XIA B J,HE Y J,et al.Expression,purification,and characterization of a novel acidic lipoxygenase from Myxococcus xanthus[J].Protein Expression and Purification,2017,138:13-17.
[5] MARQUES G,MOLINA S,BABOT E D.Exploring the potential of fungal manganese-containing lipoxygenase for pitch control and pulp delignification[J].Bioresource Technology,2011,102(2):1 338-1 343.
[6] GUTIERREZ J,RIO C D, MARTINEZ A T.Microbial and enzymatic control of pitch in the pulp and paper industry[J].Applied Microbiology & Biotechnology,2009,82(6):1 005-1 018.
[7] PATEL D D,PATEL R R,THAKKAR V R.Purification,characterization and application of lipoxygenase isoenzymes from Lasiodiplodia theobromae[J].Applied Biochemistry and Biotechnology,2015,175:513-525.
[8] DANIEL A J,CARMEN H B,LUIS C Z,et al.Partial purification and enzymatic characterization of avocado (Persea americana Mill,cv.Hass) lipoxygenase[J].Food Research International,2010,43(4):1 079-1 085.
[9] SHARMA B,CHUGH L K.Two isoforms of lipoxygenase from mature grains of pearl millet [Pennisetum glaucum (L.) R.Br.]:Purification and physico-chemico-kinetic characterization[J].Journal of Food Science and Technology-Mysore,2017,54 (6):1 577-1 584.
[10] CHEW K W,LING T C,PAU L.Recent Developments and applications of three-phase partitioning for the recovery of proteins[J].Separation and Purification Reviews,2019,48(1):52-64.
[11] MANGESH D V,VIRENDRA K R.Three phase partitioning a novel technique for purification of peroxidase from orange peels (Citrus sinenses)[J].Food and Bioproducts Processing,2015,94:284-289.
[12] DHANASHREE C P,VIRENDRA K R.Extraction of peroxidase from bitter gourd (Momordica charantia) by three phase partitioning with dimethyl carbonate (DMC) as organic phase[J].Process Biochemistry,2017,61:195-201.
[13] KARAKUS Y Y,ACEMI A,ISIK S.Purification of peroxidase from Amsonia orientalis by three-phase partitioning and its biochemical characterization[J].Separation Science and Technology,2018,53:756-766.
[14] CHEW K W,LING T C,SHOW P L.Recent developments and applications of three-phase partitioning for the recovery of proteins[J].Separation and Purification Reviews,2019,48(1):52-64.
[15] RAJAGOPALN A,SUKUMARAN B O.Three phase partitioning to concentrate milk clotting proteases from Wrightia tinctoria R.Br and its characterization[J].International Journal of Biological Macromolecues,2018,111:279-288.
[16] KAHINA H,JAMES J,TAHA M S,et al.One-step recovery of latex papain from Carica papaya using three phase partitioning and its use as milk-clotting and meat-tenderizing agent[J].International Journal of Biological Macromolecules,2020,146:798-810.
[17] GAGAOUA M,ZIANE F,NAIT R S,et al.Three phase partitioning,a scalable method for the purification and recovery of cucumis in,a milk-clotting enzyme,from the juice of Cucumis melo var.reticulatus[J].International Journal of Biological Macromolecules,2017,102:515-525.
[18] ESMA HA,GULNUR A.Purification of polyphenol oxidase from borage (Trachystemon orientalis L.) by using three-phase partitioning and investigation of kinetic properties[J].International Journal of Biological Macromolecules,2016,93:1 051-1 056.
[19] SAKI N,AKIN M, ALICI E H.Partial purification and characterization of polyphenol oxidase from the wild edible mushroom Lepiota procera using three-phase partitioning[J].International Journal of Food Engineering,2018,14:9-10.
[20] SWAPNIL V P,SUNIL S B.Purification of serratiopeptidase from Serratia marcescens NRRL B 23112 using ultrasound assisted three phase partitioning[J].Ultrasonics Sonochemistry,2016,31:532-538.
[21] PATIL P D, YADAV G D.Application of microwave assisted three phase partitioning method for purification of laccase from Trametes hirsuta[J].Process Biochemistry,2018,65:220-227.
[22] SHARMA S,DAS N.Comparison of catalase activity in different organs of the potato (Solanum tuberosum L.) cultivars grown under field condition and purification by three-phase partitioning[J].Acta Physiologiae Plantarum,2020,42(1):.DOI:10.1007/s11738-019-3002-y.
[23] SURRY K.Spectrophotometric method for determination of lipoxygenase activity[J].Plant Physiology,1964,65-70.
[24] BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principles of protein dye binding[J].Analytical Biochemistry,1976,72:248-254.
[25] LAEMMLLI U K.Cleavage of structural proteins during assembly of head of bacteriophage-T4[J].Nature,1970,227:680-685.