γ-氨基丁酸(γ-aminobutyric acid,GABA)是广泛存在于植物、动物和微生物中的一种非蛋白质氨基酸[1]。在哺乳动物脑组织中,GABA是一种重要的抑制性递质,具有降血压、镇静神经、利尿、改善脑机能、增进脑活力等功能活性[2-3]。此外,还具有抗热应激和提高饲料利用率等作用[4]。因此GABA被广泛应用到食品、医药、保健品及农业等行业[5]。目前,合成GABA主要有化学合成法、植物富集法和微生物合成法,其中微生物合成法具有条件温和、安全性好、耗能低等优点[6-8],因此近年来微生物合成法制备GABA受到国内外广泛关注。微生物发酵生产GABA是由谷氨酸脱羧酶(glutamate decarboxylase,GAD)催化谷氨酸,其中对红曲霉、酿酒酵母、乳酸菌等[9]研究较为深入,特别是大家公认的食品级细菌乳酸菌用于合成GABA受到人们的青睐。然而微生物合成法制备GABA产量较低,因此提升GABA产量成为了目前研究的热点。
近年来,共培养作为一种新颖的培养技术,由于具有能够获得某些纯培养技术无法获得的产物及有效提高产率和转化率的优点,已在食品、农业、医药和环保等领域得到广泛应用[9]。YAN等[10]将肠膜明串珠菌(Leuconostoc mesenteroides)和戊糖乳杆菌(Lactohacillus pentosus)接种于泡菜中进行共发酵,发酵后的泡菜中腐败微生物的数量相对减少且亚硝酸盐的浓度也降低,此外风味有所改善;KWON等[11]通过肠膜明串珠菌与植物乳杆菌共发酵水芹菜,其中GABA含量得到明显的提高;LEE等[12]将2株乳酸菌进行共发酵来提高GABA的产量;ZHANG等[13]将利用酿酒酵母和植物乳杆菌共培养来提升发酵桑葚饮品中GABA的产量。屎肠球菌是存在于哺乳动物肠道中且对人体具有益生作用的乳酸菌,目前以屎肠球菌和植物乳杆菌共培养发酵来提高GABA产量的研究尚未见报道。
本研究以从四川泡菜中分离筛选获得的产GABA屎肠球菌AB157和不产GABA植物乳杆菌BC112为发酵菌株,探讨采用共培养发酵提升GABA产量,利用响应面分析法对共培养条件进行优化,分析谷氨酸脱羧酶的酶活,旨在为采用共培养发酵提高GABA产量及后续对菌株共培养发酵机理探讨提供理论参考。
1 材料与方法
1.1 材料与试剂
产GABA的屎肠球菌AB157(Enterococcus faecium AB157,NCBI登录号MH578625)、不产GABA的植物乳杆菌(Lactobacillus plantarum BC112,NCBI登录号为KU761835),西华大学古法发酵(酿造)生物技术研究所保藏。
丹磺酰氯,成都华夏化学试剂有限公司;γ-氨基丁酸,上海金穗生物科技有限公司;L-谷氨酸钠,成都市科龙化工试剂厂。
MRS液体培养基:葡萄糖20 g,蛋白胨10 g,牛肉膏10 g,酵母粉5 g,乙酸钠5 g,KH2PO4 2 g,柠檬酸铵2 g,吐温-80 1 mL,硫酸镁0.5 g,硫酸锰0.25 g,用蒸馏水定容至1 L,pH 6.2,121 ℃灭菌15 min备用。改良MRS液体培养基:以含有0.5% L-谷氨酸钠的MRS液体培养基为基础培养基,根据不同需要进行优化,培养基成分进行相应的变动。
1.2 仪器与设备
FA1104电子分析天平,上海舜宇恒平有限公司;pHS-3C酸度计,成都方舟科技公司;Allerga X-15R冷冻离心机,美国Thermos scientific公司;JY98-IIIDN超声波细胞破碎机,宁波新芝生物科技有限公司;SpectraMax i3X酶标仪,美国分子仪器有限公司;GM-0.33AL隔膜真空泵,天津津腾试验设备有限公司;Waters2695高效液相色谱仪,美国Waters公司。
1.3 试验方法
1.3.1 GABA含量测定
参照谭霄等[14]利用邻苯二甲醛衍生的方法测定发酵液GABA产量,HPLC色谱条件:色谱柱为岛津-GL INERTSIL ODS-3(4.6 mm×150 mm,5 μm);紫外检测波长254 nm;柱温30 ℃;进样量10 μL;流动相A为甲醇,流动相B为醋酸钠(pH 6.2)-甲醇-四氢呋喃(84∶15∶1,体积比);流速为1 mL/min;梯度洗脱时,流动相B比例为:0~6 min,80%~50%;6~9 min,50%~20%;9~10 min,20%~0%;10~11 min,维持0%;11~15 min,返回80%。
1.3.2 共培养的优化实验
根据查阅文献及前期试验筛选[15],以MRS液体培养基为基础培养基,按屎肠球菌AB157、植物乳杆菌BC112各4%的接种量,培养温度为30 ℃,分别以不同体积比的比例接种(1∶1、1∶2、1∶3、2∶1、3∶1);不同底物质量浓度(3、6、9、12、15、18 g/L);不同发酵时间(12、24、36、48、60、72、84、96 h)为影响因素进行单因素试验。
在单因素试验的基础上,选取相应的响应面设计中心点,利用Design-Expert 8.0.6软件,以GABA产量为响应值,采用Box-Behnken中心组合设计响应面试验。对试验数据进行回归分析,确定共培养发酵产GABA的最佳条件。因素水平见表1。
表1 因素水平表
Table 1 Factors and levels of response suface methodology
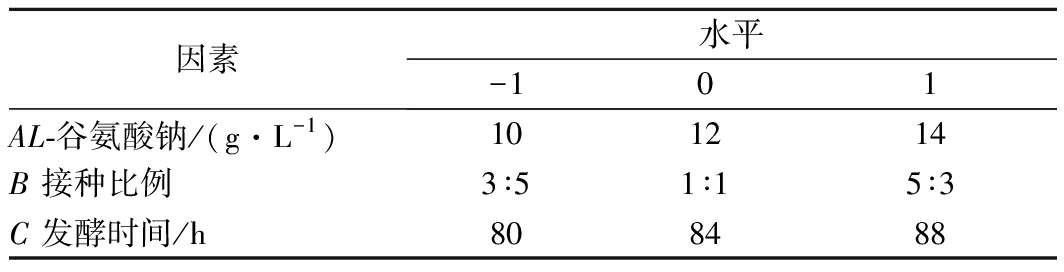
因素水平-101AL-谷氨酸钠/(g·L-1)101214B 接种比例3∶51∶15∶3C 发酵时间/h808488
1.3.3 GAD酶活力测定
1.3.3.1 GAD粗酶液制备
参照赵伟睿[16]的试验方法。取发酵液5 mL,6 000 r/min,4 ℃离心10 min,PBS溶液洗涤3次;加入Na2HPO4-柠檬酸钠缓冲液悬浮菌体;冰浴细胞破碎。破碎条件:功率为220 W,时间10 min,超声时间20 s,间隔时间20 s。
1.3.3.2 GAD酶活力测定
取谷氨酸脱羧酶酶液400 μL,与等体积L-MSG(10 g/L,用Na2HPO4-柠檬酸缓冲液配制)混合,加入1 mmol/L的磷酸吡哆醛,37 ℃反应20 h。
GABA的HPLC分析:将反应液13 000 r/min离心10 min,取上清液煮沸10 min,再离心20 min取上清液进行HPLC分析。HPLC条件同1.3.1小节。
酶活力单位定义:在37 ℃条件下,每毫升粗酶液1 h产生1 μmol GABA定义为一个酶活单位,单位U,即1个活力单位=1.0 μmol/(mL·h)。酶活力计算如公式(1):
酶活力=(ρ×V×1 000)·(MGABA×0.4×20)-1
式中:ρ为GABA质量浓度,mg/L;V为酶反应总体积,mL;0.4为测定时所取酶液量,mL;20为反应时间,h。
1.4 数据分析
试验数据采用IBM SPSS statistics 20统计软件进行单因素方差分析(ANOVA)和多重比较(LSD:最小显著差数法),柱状图Origin 8.5进行绘制。每组试验设置3个平行,所有结果用平均值±标准差表示。
2 结果与分析
2.1 共培养发酵单因素试验结果
2.1.1 底物浓度对共培养产GABA的菌体数量的影响
底物质量浓度对GABA产量和菌体生长影响结果如图1所示,共培养能够提高GABA的质量浓度。L-谷氨酸钠添加量为12 g/L时,共培养GABA含量达3.86 g/L,此时单菌发酵GABA产量为1.60 g/L,提高了2.41倍。由菌体量分析可知,单菌株发酵过程中随着底物浓度的增加,细胞渗透压增大影响微生物生长;而共培养体系中,随着底物质量浓度增加,菌体量呈现先增加后降低的趋势,共培养体系微生物能够耐受更高底物浓度,微生物之间的关系复杂,包括互惠共生、竞争及信号分子等都可以对体系中微生物生长及目标产物生成有影响[17-20],具体机制有待进一步分析。

a-底物质量浓度对GABA产量的影响;b-底物质量浓度对菌体数量的影响
图1 底物质量浓度对GABA产量及菌体数量的影响
Fig.1 Effect of sodium substrate concentration
on the content of GABA and cell density
2.1.2 接种比例对共培养产GABA和菌体数量的影响
不同接种比例对GABA产量和菌体生长影响结果如图2所示。

图2 屎肠球菌与植物乳杆菌接种比例对
GABA产量和菌体数量的影响
Fig.2 Effect of strain ratio (E.faecium∶L.plantarum)
on the content of GABA and cell density
当屎肠球菌AB157和植物乳杆菌BC112的接种比例为1∶1时,GABA产量最高,达4.02 g/L。一种细菌的代谢产物可能会影响其他细菌的生长代谢[21],在共培养体系中,植物乳杆菌BC112的代谢产物可提高屎肠球菌AB157产GABA的能力。
2.1.3 发酵时间对共培养产GABA和菌体数量的影响
发酵时间对GABA产量和菌体数量影响结果如图3所示。共培养的GABA产量随时间延长而增加,在发酵84 h时GABA产量达到最大为4.13 g/L,随后趋于稳定,而单菌发酵GABA产量为1.26 g/L。因此,选择84 h为最优发酵时间。
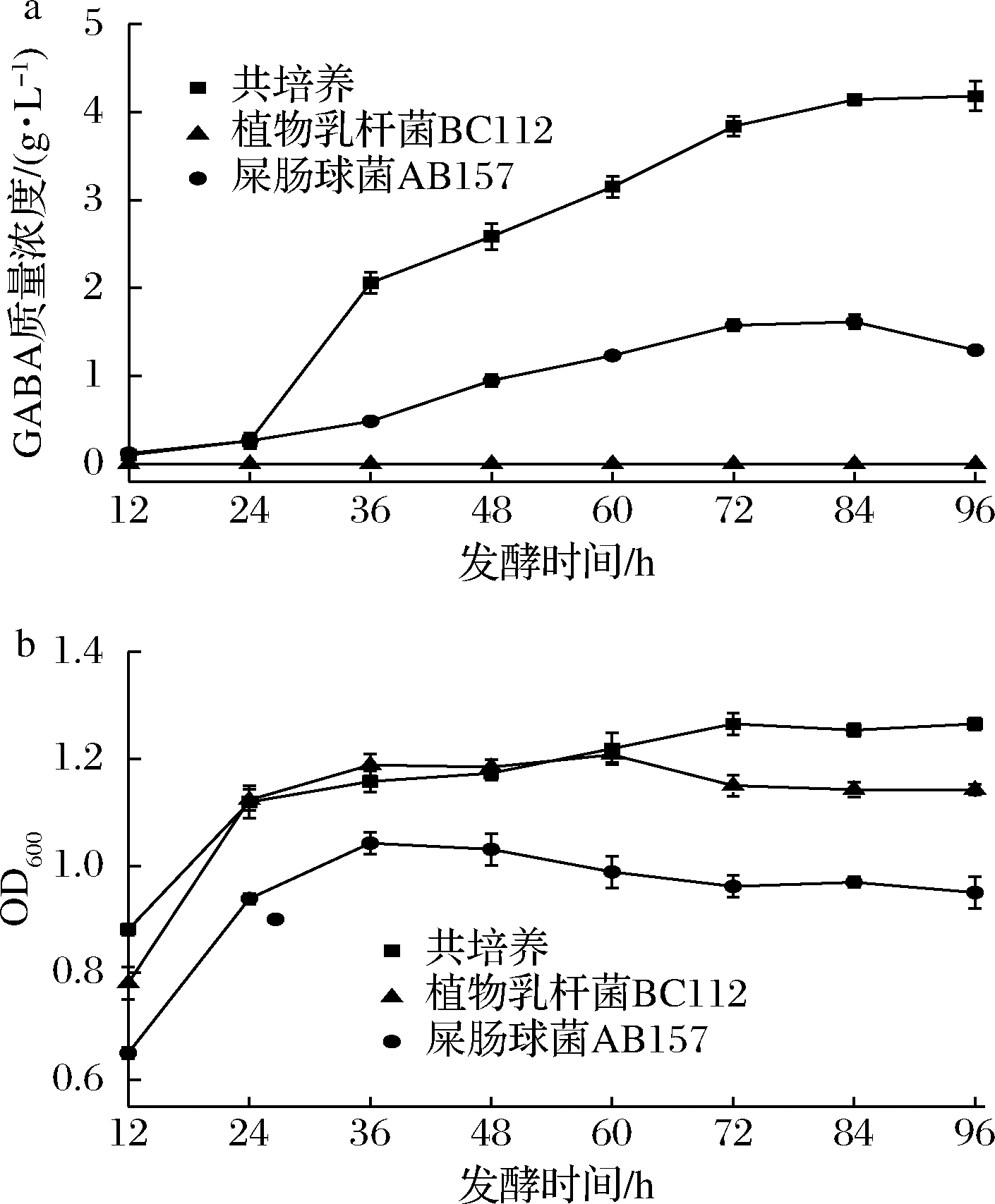
a-发酵时间对GABA产量的影响;b-发酵时间对菌体数量的影响
图3 发酵时间对GABA产量及菌体数量的影响
Fig.3 Effects of fermentation time on the content of
GABA and cell density
2.2 响应面试验结果
在单因素试验分析的基础上,采用Box-Behnken响应面试验设计,以L-谷氨酸钠(A)、接种比例(B)和发酵时间(C)作为自变量,GABA产量(Y)为响应值。以L-谷氨酸钠质量浓度12 g/L、接种比例1∶1(体积比)和发酵时间84 h为响应面分析中心点进行响应面试验,如表2所示。采用Design-Expert 8.0.6软件对试验数据进行多项式回归分析建立二次响应回归模型,拟合得到回归方程:
Y=6.35+0.29A+0.20+0.092C-0.011AB+0.066AC-0.39A2-0.16B2-0.49C2
回归模型方差分析结果见表3,模型P值达到了极显著水平,说明该模型显著回归。模型失拟项P<0.05,差异不显著,说明回归模型与实际试验拟合较好,试验误差小,相关系数R2=0.998 2,表明采用响应面法设计所得的回归模型有效,适用于共培养发酵GABA优化条件试验的理论预测。
表2 响应面试验设计方案与响应值
Table 2 Treatment incorporations and responses of
response surface methodology
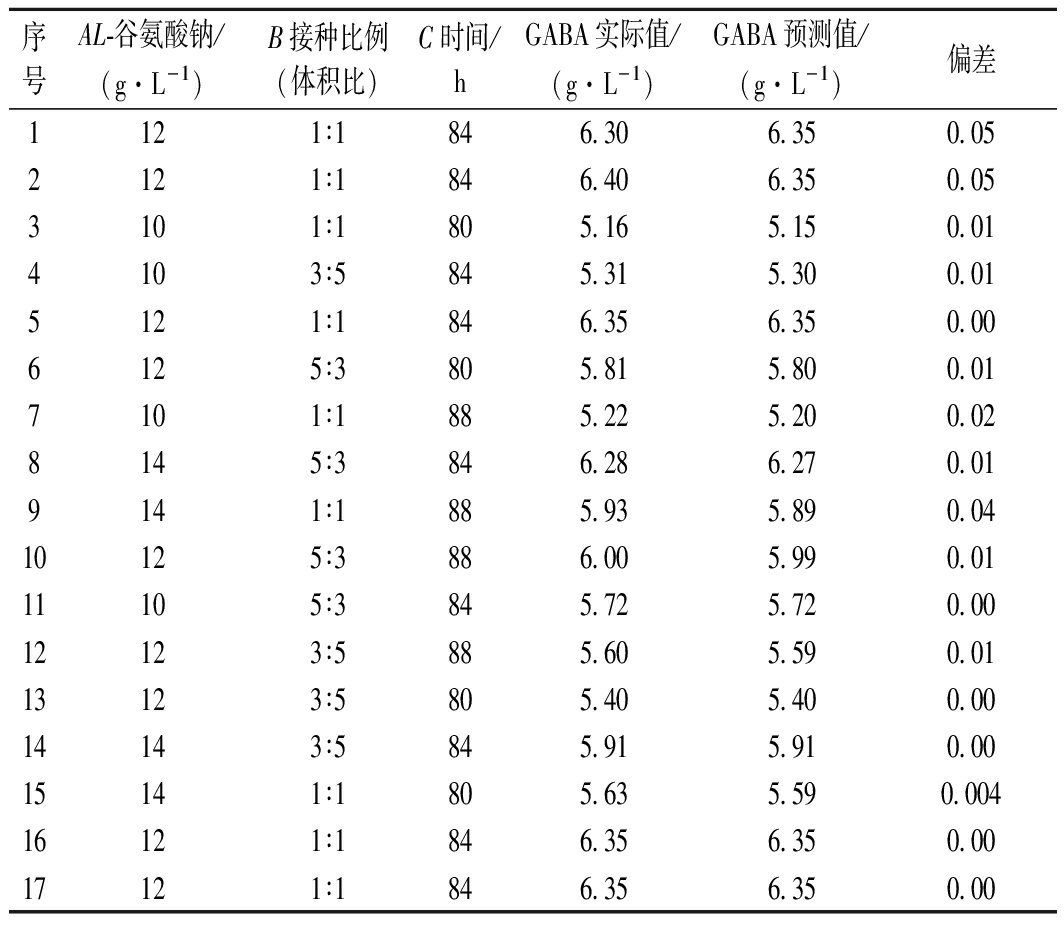
序号AL-谷氨酸钠/(g·L-1)B接种比例(体积比)C时间/hGABA实际值/(g·L-1)GABA预测值/(g·L-1)偏差1121∶1846.306.350.052121∶1846.406.350.053101∶1805.165.150.014103∶5845.315.300.015121∶1846.356.350.006125∶3805.815.800.017101∶1885.225.200.028145∶3846.286.270.019141∶1885.935.890.0410125∶3886.005.990.0111105∶3845.725.720.0012123∶5885.605.590.0113123∶5805.405.400.0014143∶5845.915.910.0015141∶1805.635.590.00416121∶1846.356.350.0017121∶1846.356.350.00
表3 响应面设计的回归方程系数显著性检验及方差分析
Table 3 Analysis of statistical significance of each
regression coefficient in the RSM model and
variance for the experimental results of RSM design
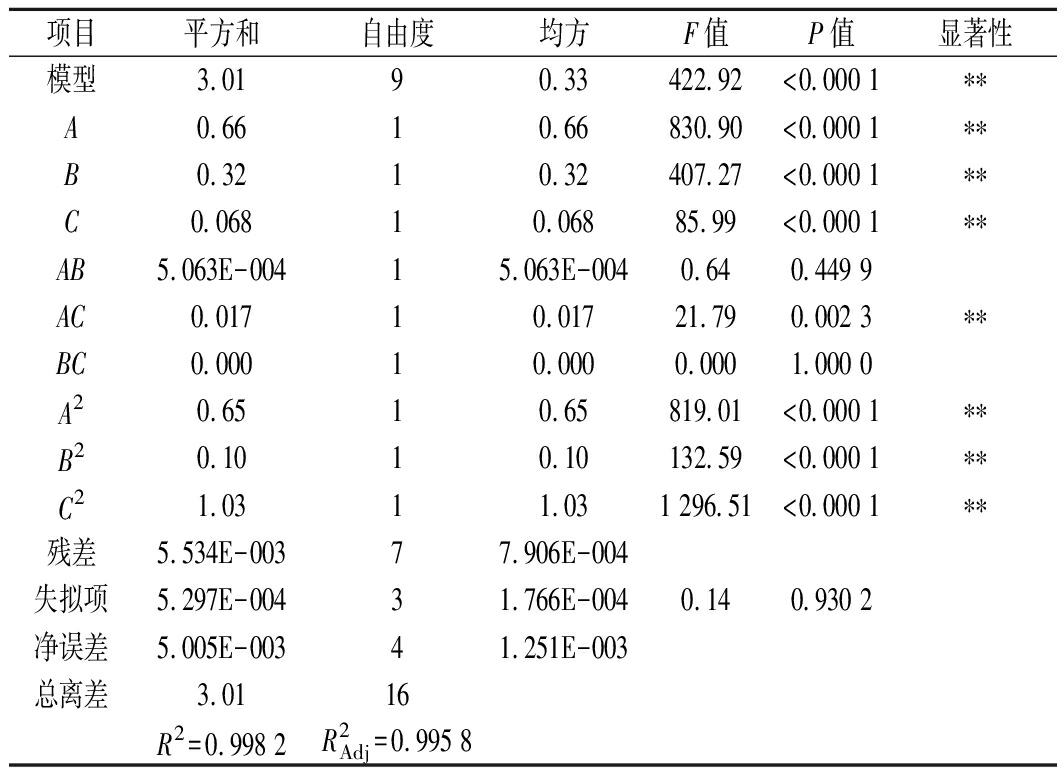
项目平方和自由度均方F值P值显著性模型3.0190.33422.92<0.000 1∗∗A0.6610.66830.90<0.000 1∗∗B0.3210.32407.27<0.000 1∗∗C0.06810.06885.99<0.000 1∗∗AB5.063E-00415.063E-0040.640.449 9AC0.01710.01721.790.002 3∗∗BC0.00010.0000.0001.000 0A20.6510.65819.01<0.000 1∗∗B20.1010.10132.59<0.000 1∗∗C21.0311.031 296.51<0.000 1∗∗残差5.534E-00377.906E-004失拟项5.297E-00431.766E-0040.140.930 2净误差5.005E-00341.251E-003总离差3.0116R2=0.998 2R2Adj=0.995 8
在交互项中,L-谷氨酸钠质量浓度和发酵时间对GABA产量的影响极显著。图4直观地反映了底物质量浓度和发酵时间的交互作用对GABA产量的影响。等高线沿发酵时间轴变化较L-谷氨酸钠质量浓度变化相对密集,曲面较陡,说明发酵时间的影响较显著。

a-发酵时间和L-谷氨酸钠质量浓度交互影响的响应面图;
b-酵时间和L-谷氨酸钠质量浓度交互影响的等高线图
图4 发酵时间和L-谷氨酸钠质量浓度交互影响的
响应面图和等高线图
Fig.4 Response surface and contour plots for the interactive
effects of ermentation time,L-glutamate concentration
对二次回归方程分析,可得最优的发酵条件为L-谷氨酸钠质量浓度为12.73 g/L、屎肠球菌AB157和植物乳杆菌BC112的接种体积比为23∶17、发酵时间为84.47 h,该条件下GABA产量的理论预测为6.47 g/L。
2.3 响应面模型的验证和优化
为了验证方程的准确性,按照回归方程的最优值并根据实际应用确定优化条件为:L-谷氨酸钠质量浓度12.7 g/L、接种和发酵时间85 h。结果显示,优化条件下GABA的产量为6.35 g/L,与模型的预测值接近。且GABA产量与单菌发酵(1.60 g/L)相比,提高了3.9倍。
2.4 GAD酶活力分析结果
微生物合成GABA是通过GAD催化L-谷氨酸脱羧而成,因此GAD酶活力与GABA的产量密切相关。发酵过程中GAD酶活力分析结果如图5所示。

图5 谷氨酸脱羧酶酶活力测定结果
Fig.5 Activity of glutamic acid decarboxylase
在共培养发酵过程中,GAD酶活力明显高于单菌发酵,48 h前酶活力的增长较为迅速,这一现象与共发酵时GABA产量和菌体增长数量的情况相一致。酶活力在48 h时达到最高,为1.223 U,此时GABA处于稳定增长期;同时单菌的GAD酶活力为0.39 U。
表明共培养体系有利于提升GAD酶活力,可能是植物乳杆菌BC112的代谢物促进屎肠球菌AB157生长,使谷氨酸脱羧酶高表达,提高了GABA产量。
3 结论
本研究对屎肠球菌AB157和植物乳杆菌BC112采用共培养提高GABA产量及关键酶GAD进行分析。以MRS为基础培养基,采用单因素试验结合响应面分析优化共培养条件,在菌株接种量为4%,发酵温度为30 ℃时,确定共培养条件为L-谷氨酸钠质量浓度12.7 g/L、屎肠球菌AB157与植物乳杆菌BC112接种体积比为5∶3、发酵时间85 h。在此优化条件下,与单菌发酵相比,GABA生成量为6.35 g/L,产量提高3.9倍;同时,共培养GAD酶活力明显高于单菌发酵。结果表明,共培养能显著提高GABA的产量,但2株菌共培养高产GABA的机制有待进一步研究。
[1] DIANA M,QUILEZ J,RAFECAS M.Gamma-aminobutyric acid as a bioactive compound in foods:A review[J].Journal of Functional Foods,2014,10(3):407-420.
[2] WALLS A B,WAAGEPETERSEN H S,BAK L K,et al.The glutamine-glutamate/GABA cycle:Function,regional differences in glutamate and GABA production and effects of interference with GABA metabolism[J].Neurochemical Research,2015,40(2):402-409.
[3] 曾林,刘波,许小艳,等.四川泡菜中产γ-氨基丁酸微生物的系统发育与表达能力评估[J].食品科学,2017,38(2):87-91.
ZENG L,LIU B,XU X Y,et al.Phylogeny and performance assessment of γ-aminobutyric acid-producing microorganisms from Sichuan pickles[J].Food Science,2017,38(2):87-91.
[4] SANCHART C,RATTANAPORN O,HALTRICH D,et al.Technological and safety properties of newly isolated GABA-producing Lactobacillus futsaii strains[J].Journal of Applied Microbiology,2016,121(3):734-745.
[5] VO T D L,KIM T W,HONG S H.Effects of glutamate decarboxylase and gamma-aminobutyric acid (GABA) transporter on the bioconversion of GABA in engineered Escherichia coli[J].Bioprocess and Biosystems Engineering,2012,35(4):645-648.
[6] BHANWAR S,BAMNIAA M,GHOSH M,et al.Use of Lactococcus lactis to enrich sourdough bread with γ-aminobutyric acid[J].International Journal of Food Sciences and Nutrition,2013,64(1):77-81.
[7] CHO Y R,CHANG J Y,CHANG H C.Production of gamma-aminobutyric acid (GABA) by Lactobacillus buchneri isolated from kimchi and its neuroprotective effect on neuronal cells[J].Journal of Microbiology and Biotechnology,2007,17(1):104-109.
[8] 曾林,谭霄,张庆,等.四川泡菜中产γ-氨基丁酸植物乳杆菌BC114发酵条件优化[J].食品与发酵工业,2017,43(3):116-122.
ZENG L,TAN X,ZHANG Q,et al.Optimization of γ-aminobutyric acid production by Lactobacillus plantarum BC114 from Sichuan pickle[J].Food and Fermentation Industries,2017,43(3):116-122.
[9] KHWANCHAI P,CHINPRAHAST N,PICHYANGKURA R,et al.Gamma-aminobutyric acid and glutamic acid contents,and the GAD activity in germinated brown rice:Effect of rice cultivars[J].Food Science and Biotechnology,2014,23(2):373-379.
[10] YAN P M,XUE0 W T,TAN S S,et al.Effect of inoculating lactic acid bacteria starter cultures on the nitrite concentration of fermenting Chinese paocai[J].Food Control,2008,19(1):50-55.
[11] KWON S Y,GARCIA C V,SONG Y C,et al.GABA-enriched water dropwort produced by co-fermentation with Leuconostoc mesenteroides SM and Lactobacillus plantarum K154[J].LWT-Food Science and Technology,2016,73(1):233-238.
[12] LEE E J,LEE S P.Novel bioconversion of sodium glutamate to γ-amino butyric acid by co-culture of Lactobacillus plantarum K154 in Ceriporia lacerata culture broth[J].Food Science and Biotechnology,2014,23(6):1 997-2 005.
[13] ZHANG Q,SUN Q,TAN X,et al.Characterization of gamma-aminobutyric acid (GABA)-producing Saccharomyces cerevisiae and coculture with Lactobacillus plantarum for mulberry beverage brewing[J].Journal of Bioscience and Bioengineering,2019,129(4):447-453.
[14] 谭霄,孙擎,曾林,等.一株产γ-氨基丁酸植物乳杆菌谷氨酸脱羧酶基因的克隆和表达[J].食品科学,2018,39(18):159-165.
TAN X,SUN Q,ZENG L,et al.Cloning and expressing of glutamate decarboxylase gene from Lactobacillus plantarum producing γ-aminobutyric acid[J].Food Science,2018,39(18):159-165.
[15] 郑鸿雁,赵炜彤,昌妍希.响应面法优化假丝酵母Y6产γ-氨基丁酸发酵工艺[J].食品科学,2015,36(9):130-135.
ZHENG H Y,ZHAO W T,CHANG Y X.Optimization of medium components and culture conditions for enhanced yield of γ-aminobutyric acid by Candida sp.Y6 by response surface methodology[J].Food Science,2015,36(9):159-165.
[16] 赵伟睿.微生物细胞催化合成γ-氨基丁酸效能强化的研究[D].杭州:浙江大学,2015.
ZHAO W R.Improvement of γ-aminobutyric acid biosynthesis ability of microbial cells[D].Hangzhou:Zhejiang University,2015.
[17] 段小果,李博,贺银凤,等.乳酸菌与酵母菌共生机理的研究进展[J].微生物学通报,2017,44(8):1 988-1 995.
Duan X G,LI B,HE Y F,et al.Progress in symbiotic mechanism between lactic acid bacteria and yeast[J].Microbiology China,2017,44(8):1 988-1 995.
[18] 蔡针华,程娜,贾震虎,等.群体感应信号分子AI-2高产乳酸菌株筛选及特性研究[J].食品与发酵工业,2018,44(1):66-71.
CAI Z H,CHENG N,JIA Z H,et al.Screening and characterization research of quorum sensing signaling molecule AI-2 high-yield Lactobacillus strains[J].Food and Fermentation Industries,2018,44(1):66-71.
[19] 张腾,贺银凤.基于LuxS的群体感应系统在乳酸菌共培养中的研究[J].食品与发酵工业,2012,38(8):119-124.
ZHANG T,HE Y F.Resent progresses on LuxS-mediated quorum sensing system in co-culture among lactic acid bacteria[J].Food and Fermentation Industries,2012,38(8):119-124.
[20] 满丽莉,孟祥晨,王辉,等.群体感应系统在乳酸菌产细菌素中的应用[J].食品科学,2011,32(13):360-364.
MAN L L,MENG X C,WANG C,et al.Regulation of bacteriocin synthesis by quorum sensing in lactic acid bacteria:A Review[J].Food Science,2011,32(13):360-364.
[21] SAHOO T K,JAVARAMAN G.Co-culture of Lactobacillus delbrueckii and engineered Lactococcislactis enhances stoichiomeyric yield of dlactic acid from whey permeate[J].Biotechnological Products and Progress Engineering,2019,20(5):5 653-5 662.