小麦麸皮是小麦面粉加工中的主要副产物,每年产量有3 000万t以上,除了具有较高的纤维含量外,还含有黄酮类化合物、多酚等多种活性物质[1]。但由于小麦麸皮口感差,不易食用,在加工中大多被作为饲料或被丢弃[2]。若能从中提取黄酮类化合物,则可以提高小麦副加值。
自然界中的黄酮类化合物大多是多羟基化合物,其溶解度与分子结构及取代基的种类有关[3]。游离的黄酮类化合物一般难溶或不溶于水,易溶于甲醇、乙醇、乙醚等有机溶剂中[4]。其中平面型分子结构中存在交叉共轭体系,分子间排列紧密,引力较大,因而难溶于水,如黄酮醇、查尔酮类等。而非平面型分子分子间排列不紧密,可以引入较多的羟基,有利于增加亲水性,因而水溶性相应加大,如黄酮苷、二氢黄酮醇等[5]。目前常用的黄酮类化合物提取主要依据相似相溶性,按化合物结构来选择相似极性的溶剂进行提取[6]。荞麦麸皮中的黄酮类化合物大多为黄酮苷元及黄酮苷。此外,黄酮类化合物的羟基糖苷化后,水溶解度增加,易溶强极性溶剂[7],如水、甲醇、乙醇等,且结构中引入的糖苷链越长,在水中的溶解度就越大[8]。
常用作抗氧化剂的黄酮类化合物包括黄酮醇、黄酮苷、异黄酮、槲皮素、儿茶素等[9]。黄酮类化合物的抗氧化活性机制与酮类物质抗氧化的机制相同,但黄酮类物质在抗氧化反应中不仅能清除链引发阶段的自由基,而且可以直接捕获自由基反应链中的自由基,起到预防和断链双重作用[10]。小麦麸皮乙醇提取物对1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、羟基自由基(·OH)和超氧阴离子自由基![]() 清除能力最强[11-12]。孙道勇[13]以VE作阳性对照,在相同和不同浓度条件下,小麦麸皮的11种提取物中有3种化合物对自由基清除率均超过了80%,其中2种化合物的IC50值高于VE。
清除能力最强[11-12]。孙道勇[13]以VE作阳性对照,在相同和不同浓度条件下,小麦麸皮的11种提取物中有3种化合物对自由基清除率均超过了80%,其中2种化合物的IC50值高于VE。
本文以河南地区种植提取的小麦(豫教5号、郑麦7698、西农979)麸皮为原料,采用不同有机溶剂(乙醇、甲醇、丙酮)分别提取小麦麸皮中的总黄酮,测定不同溶剂提取的小麦麸皮总黄酮含量,并考察小麦麸皮总黄酮类化合物的总还原力和自由基清除能力,以及对细胞内活性氧水平的影响。
1 材料与方法
1.1 材料与仪器
3种小麦麸皮(豫教5号、郑麦7698、西农979)来源于河南省;芦丁标准品,安徽酷儿尔生物工程有限公司;无水乙醇、甲醇,辽宁泉瑞试剂有限公司;丙酮,天津市科密欧化学试剂有限公司;DPPH,美国Sigma公司;2′,7′-dichlorofluorescein diacetate(DCFH-DA),上海碧云天生物技术有限公司;所有分离用有机溶剂均为国产分析纯。
高速万能粉碎机,天津市秦斯特仪器有限公司;BN0283电子天平,上海民桥精密仪器有限公司;HH-1数显恒温水浴锅,江苏省荣华仪器制造有限公司;TD4A台式离心机,长沙英泰仪器有限责任公司;V5 100型可见分光光度计,上海元析仪器有限公司;DGG-9140B型电热鼓风干燥箱,上海森信实验仪器有限公司;CytoFLEX流式细胞分析仪,美国Beckman Coulter公司。
1.2 试验方法
1.2.1 原材料预处理
将3种小麦麸皮放入50 ℃干燥箱中,烘干12 h后收集。经粉碎后的麦麸粉末过60目筛,称重备用。
1.2.2 总黄酮提取工艺
1.2.2.1 乙醇对3种小麦麸皮总黄酮的提取工艺
按孟丽媛等[14]提取西兰花多酚的工艺参数稍作修改,3个装有60 mL 体积分数为80%的乙醇溶液的蒸馏瓶,依次向其中加入4 g不同品种的麦麸粉末,然后进行冷凝回流,60 ℃提取2 h。将过滤后的滤液备用,滤渣按上述方法再提取1次,2次滤液合并,3 600 r/min下离心15 min,取上清液置于4 ℃冰箱中待用。将上清液放于大烧杯内,置于45 ℃水浴锅中,挥发掉有机溶剂,待滤液颜色变深且黏稠后,从水浴锅中取出,置于50 ℃干燥箱内烘干至恒重,置于4 ℃冰箱中待用[15]。
1.2.2.2 甲醇对3种小麦麸皮总黄酮的提取工艺
取3个装有60 mL 体积分数为80%的甲醇溶液的蒸馏瓶,依次向其加入4 g不同品种的麦麸粉末,实验步骤同1.2.2.1小节中的方法。
1.2.2.3 丙酮对3种小麦麸皮总黄酮的提取工艺
取3个装有60 mL 体积分数为80%的丙酮溶液的蒸馏瓶,依次向其加入4 g不同品种的麦麸粉末,实验步骤同1.2.2.1小节中的方法。
1.2.3 总黄酮得率计算
1.2.3.1 芦丁标准曲线的制作
按陕西苦菜叶总黄酮含量测定方法稍作修改,最后用体积分数为80%的乙醇定容,得到质量浓度为0.1 mg/mL芦丁标准溶液[16]。选取6个洁净干燥的10 mL容量瓶,分别向其中移取0、1.0、2.0、3.0、4.0和5.0 mL芦丁标准溶液,然后按照罗俊等[17]的方法进行测定,最后用30%乙醇定容,振荡并静置15 min后,于510 nm波长处测定吸光度值A510 nm,绘制芦丁标准曲线。
1.2.3.2 总黄酮的测定及得率的计算
用体积分数为80%乙醇溶液充分溶解0.01 g小麦麸皮总黄酮并定容至100 mL,取1.0 mL的黄酮样液,选取6个洁净干燥的10 mL容量瓶,分别向其中移取0、1.0、2.0、3.0、4.0和5.0 mL上述所制的溶液。最后用体积分数为30%乙醇定容,振荡并静置15 min后,然后对吸光度进行测定,通过公式(1)计算总黄酮得率:
总黄酮得率![]()
(1)
式中:ρ,根据吸光度值计算出的溶液质量浓度,mg/mL;D,溶液稀释倍数;V,供试品溶液体积,mL;m,小麦麸皮取样量,mg。
1.2.4 小麦麸皮总黄酮提取物体外抗氧化活性测定
1.2.4.1 小麦麸皮中总黄酮的总还原力的测定
配制质量浓度为0.3、0.6、0.9、1.2和1.5 mg/mL的不同溶剂样品提取液,最后用30%乙醇定容,振荡并静置15 min后,于700 nm处测定吸光度[18]。
1.2.4.2 小麦麸皮总黄酮对·OH的清除作用
以PAN[19]的实验参数为基础稍作修改。取3支试管按照表1加入9 mmol/L的FeSO4,提取液和0.5%的H2O2等试剂,将其混合均匀后,在室温条件下静置10 min,接着都加入9 mmol/L的水杨酸-乙醇,将混匀后的溶液置于25 ℃下,水浴30 min,以蒸馏水作为空白对照,在510 nm处测定吸光度值,通过公式(2)计算·OH清除率:
·OH清除率![]()
(2)
式中:A1,测试液1(2.0 mL水杨酸-乙醇+2.0 mL FeSO4+2.0 mL SDF+2.0 mL H2O2)的吸光度值;A2,测试液2(2.0 mL FeSO4+2.0 mL SDF+2.0 mL H2O+2.0 mL H2O2)的吸光度值;A3,测试液3(2.0 mL水杨酸-乙醇+2.0 mL FeSO4+2.0 mL H2O+2.0 mL H2O2)的吸光度值。
1.2.4.3 小麦麸皮总黄酮对DPPH自由基的清除作用
参考ADHIKARI等[20]的实验参数,取1.0 mL的黄酮样液,选取6个洁净干燥的10 mL容量瓶,分别向其中移取0、1.0、2.0、3.0、4.0和5.0 mL上述所制的溶液。定容后,用移液管分别移取0.2 mL总黄酮提取液置于10 mL棕色比色管中,加人6 mL,0.06 mmol/L DPPH溶液,定容至10 mL,振荡摇匀,将混匀后的溶液置于25 ℃条件下,水浴30 min。以蒸馏水作为空白对照,在510 nm处测定吸光度值,通过公式(3)计算DPPH自由基清除率:
DPPH自由基清除率![]()
(3)
式中:A1,总黄酮的DPPH自由基溶液反应吸光度;A2,待测总黄酮吸光度;A3,未加总黄酮的DPPH自由基溶液反应吸光度。
1.2.4.4 小麦麸皮总黄酮对人胃癌细胞内活性氧水平的调控作用
指数生长期阶段的胃癌细胞接种到直径为3.5 cm培养皿中,于37 ℃、体积分数为5% CO2的细胞培养箱内培养一昼夜,每孔分别加入浓度梯度小麦麸皮总黄酮处理,收集细胞悬液到离心管内,离心后弃去上清液,加入1 mL PBS溶液,重悬细胞,加入DCFH-DA。恒温水浴锅中37 ℃闭光孵育20 min,置于流式管,通过流式细胞仪检测细胞凋亡数量。DCFH-DA是一种通用的氧化应激指示剂,具细胞膜渗透性,一旦进入细胞后,会与细胞液中的酯酶水解生成2′,7′-二氯二氢荧光素并被氧化生成强荧光的2′,7′-二氯荧光素,因此可用此特性来检测细胞氧化还原过程[20]。
1.3 数据处理
数据以均数±标准差表示,统计学分析利用SPDD软件。组间的多重比较采用单因素方差分析和Tukey事后检验。所有实验重复3次。
2 结果与分析
2.1 小麦麸皮提取物中总黄酮含量的测定
2.1.1 芦丁标准曲线绘制
由实验结果可知,芦丁标准曲线回归方程为:y=0.428 9x+0.002 6(R2=0.999 5)。该结果表明芦丁在0~0.5 mg/mL的质量浓度范围内吸光值与浓度呈现良好的线性关系。
2.1.2 不同小麦麸皮的总黄酮含量
为了研究不同有机溶剂对小麦麸皮中总黄酮提取率的影响,采用乙醇、甲醇、丙酮分别提取小麦麸皮(豫教5号、郑麦7 698、西农979)中的总黄酮。结果如图1所示,在3种溶剂中乙醇溶液的提取量最高,表明在乙醇溶液中溶出黄酮类物质最多。且在3种小麦麸皮中,乙醇提取的郑麦7 698总黄酮质量分数为2.20 mg/g,这可能与不同品种的小麦麸皮总黄酮中各黄酮类化合物组分不同有关。研究表明,黄酮类化合物在植物体中通常与糖苷键结合成苷类[22],因而荞麦麸皮中的黄酮类化合物大多为黄酮苷元及黄酮苷,易溶于强极性溶剂[23]。实验中所用的溶剂极性大小为甲醇>乙醇>丙酮,分子间作用力降低,极性相似相溶[24],因此植物的甲醇提取物中的极性成分应该比乙醇提取率更高。但结果出现乙醇提取3种小麦麸皮的总黄酮提取率大于甲醇,可能是由于小麦麸皮中含酚羟基多的黄酮苷类数量较少[25-26],溶解于甲醇中的黄酮类化合物量降低,此外小麦麸皮总黄酮提取液中还存在一些含有叶绿素,胡萝卜素等脂溶性色素,这类色素难溶于甲醇,易溶于乙醇[27]。

图1 三种小麦麸皮不同溶剂提取物总黄酮含量
Fig.1 Total flavonoid content of three wheat bran
extracted by different solvents
2.2 小麦麸皮总黄酮提取物的总还原力
2.2.1 小麦麸皮总黄酮甲醇提取物的总还原力
研究表明,样品的还原能力与其抗氧化活性之间有显著的正相关性,还原力的高低可以反映抗氧化能力的强弱[28]。如图2所示,以VC作阳性对照时,用甲醇溶剂分别提取3种小麦麸皮总黄酮,在0.3~1.5 mg/mL范围内吸光度随小麦麸皮总黄酮质量浓度的增加而增加。
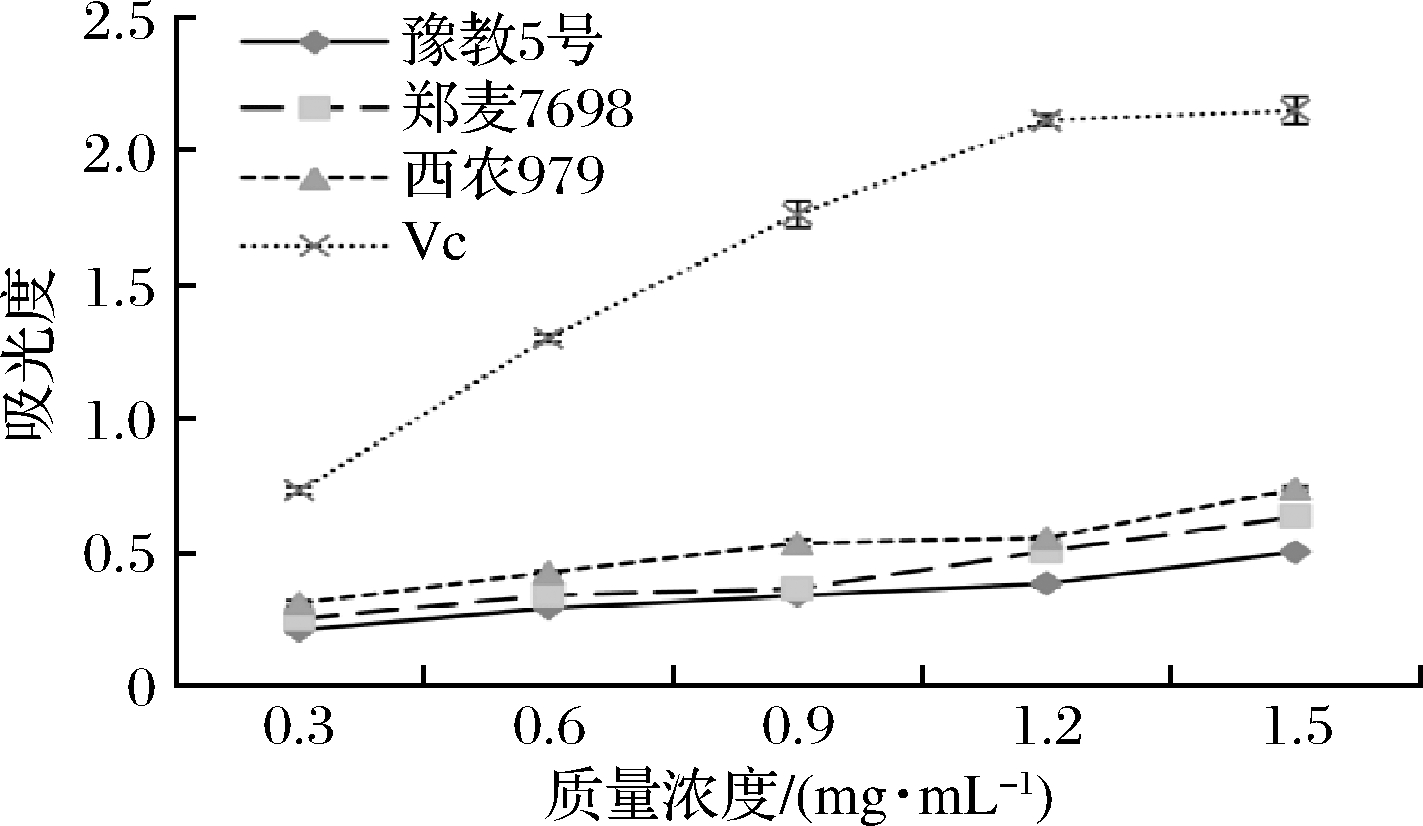
图2 甲醇提取的3种小麦麸皮总黄酮的总还原力
Fig.2 Total reducing power of total flavonoids from
three wheat brans extracted by methanol
在1.5 mg/mL时,甲醇提取的3种小麦麸皮总黄酮和Vc总还原力作用大小为:Vc>西农979小麦麸皮>郑麦7698小麦麸皮>豫教5号小麦麸皮,四者均呈现良好的线性关系。其中西农979小麦麸皮总黄酮与郑麦7698小麦麸皮总还原力相近,其原因可能是西农979小麦与郑麦7698小麦属于多穗型,而豫教5号属于重穗型,不同穗型小麦的根系活力和生长对不同水氮耦合的响应是不同的,氮素供应增加能够提高多穗型小麦植株中超氧化物歧化酶和酚过氧化物酶的活性[22]。
2.2.2 小麦麸皮总黄酮乙醇提取物的总还原力
如图3所示,以VC作为阳性对照,3种小麦麸皮乙醇提取液在0.3~1.5 mg/mL范围内,其吸光度与质量浓度呈正相关。提取液质量浓度在0.3和1.2 mg/mL时,豫教5号小麦麸皮中总黄酮的吸光度略大于郑麦7698小麦麸皮;质量浓度为1.5 mg/mL时,乙醇提取的3种小麦麸皮总黄酮和Vc总还原力作用大小依次为:Vc>西农979小麦麸皮>郑麦7698小麦麸皮>豫教5号小麦麸皮,四者均呈现良好的线性关系。小麦麸皮的总黄酮还原力大小会由于小麦种类、生长环境条件等的不同而有所差异。其中耐旱性品种的西农979小麦麸皮的还原力较强,可能与西农979小麦具有较高的抗氧化和活性氧调控能力相关[22]。

图3 三种小麦麸皮总黄酮乙醇提取物的总还原力
Fig.3 Total reducing power of total flavonoids from
three wheat brans extracted by ethanol
2.2.3 小麦麸皮总黄酮丙酮提取物的总还原力
如图4所示,以Vc作为阳性对照,丙酮提取3种小麦麸皮总黄酮,质量浓度在0.3~1.5 mg/mL范围内,随着质量浓度的增加,3种小麦麸皮总黄酮的吸光度随之增强。在1.5 mg/mL时,Vc的吸光度为2.281,郑麦7698小麦麸皮中总黄酮的吸光度为0.593。在0.3~0.9 mg/mL质量浓度范围内,丙酮提取的3种小麦麸皮总黄酮和Vc总还原力作用大小为:Vc>西农979小麦麸皮>郑麦7698小麦麸皮>豫教5号小麦麸皮。在0.9~1.5 mg/mL质量浓度范围内,丙酮提取的3种小麦麸皮总黄酮和Vc总还原力作用大小为:Vc>郑麦7698小麦麸皮>西农979小麦麸皮>豫教5号小麦麸皮,四者均呈现良好的线性关系。由图4可知,丙酮提取的西农979小麦麸皮总黄酮与郑麦7698小麦麸皮吸光度相近,与图3、图2结果不同的原因,可能是由于丙醇提取郑麦7698小麦麸皮过程中溶出少量酚酸[23],造成测定差异。不同剂量下小麦麸皮总黄酮的还原力还与其丙酮提取过程中溶出的总酚酸含量存在正相关,也可能是造成郑麦7698小麦麸皮总黄酮还原力略高于西农979小麦麸皮的误差原因。

图4 三种麦麸丙酮提取物的总还原力
Fig.4 Total reducing power of total flavonoids from
three wheat brans extracted by acetone
2.3 小麦麸皮总黄酮提取物对·OH的清除作用
2.3.1 小麦麸皮总黄酮甲醇提取物对·OH的清除作用
如图5所示,3种小麦麸皮总黄酮甲醇提取物对·OH清除率与质量浓度呈正相关。质量浓度为0.10~0.20 mg/mL时,西农979小麦麸皮中总黄酮的·OH清除率略高于郑麦7698。在0.25 mg/mL时,Vc、豫教5号、郑麦7698、西农979小麦麸皮中总黄酮的·OH清除率分别为93.58%、62.23%、71.49%和68.02%。

图5 三种小麦麸皮总黄酮甲醇提取物对·OH的清除作用
Fig.5 Scavenging effects of three wheat bran methanol
extracts on hydroxyl radicals
由此可知,用甲醇提取的3种小麦麸皮总黄酮和Vc对·OH清除能力依次为:Vc>郑麦7698小麦麸皮>西农979小麦麸皮>豫教5号小麦麸皮,四者均呈现较好的线性关系。小麦麸皮总黄酮清除·OH能力的大小不仅与其中总黄酮的含量有关,而且与小麦种类有关。虽然在不同质量浓度条件下,7698小麦麸皮总黄酮清除·OH能力与西农979小麦麸皮存在不同,但是,无论是郑麦7698还是西安979,品种之间清除·OH能力差异较小。
2.3.2 小麦麸皮总黄酮乙醇提取物对·OH的清除作用
由图6可知,在研究3种小麦麸皮总黄酮乙醇提取物对·OH清除率时,随着提取物质量浓度的增加,·OH清除率随之增加。以Vc作为阳性对照,在0.20 mg/mL时,Vc、豫教5号、郑麦7698、西农979小麦麸皮中总黄酮的·OH清除率分别为90.08%、48.23%、61.10%和60.20%;在0.25 mg/mL时,Vc、豫教5号、郑麦7698、西农979小麦麸皮中总黄酮的清除率分别为94.89%、62.32%、72.04%和75.04%。由此可知,质量浓度小于0.20 mg/mL时,采用乙醇提取的3种小麦麸皮中总黄酮和Vc对·OH清除能力依次为:Vc>郑麦7698>西农979>豫教5号小麦麸皮;在质量浓度大于0.20 mg/mL时,采用乙醇提取的3种小麦麸皮总黄酮和Vc对·OH清除能力依次为:Vc>西农979小麦麸皮>郑麦7698小麦麸皮>豫教5号小麦麸皮,四者均呈现较好的线性关系。其中7698小麦麸皮与979小麦麸皮品种之间的·OH清除率差异较小,可能是由于品种相似的原因。
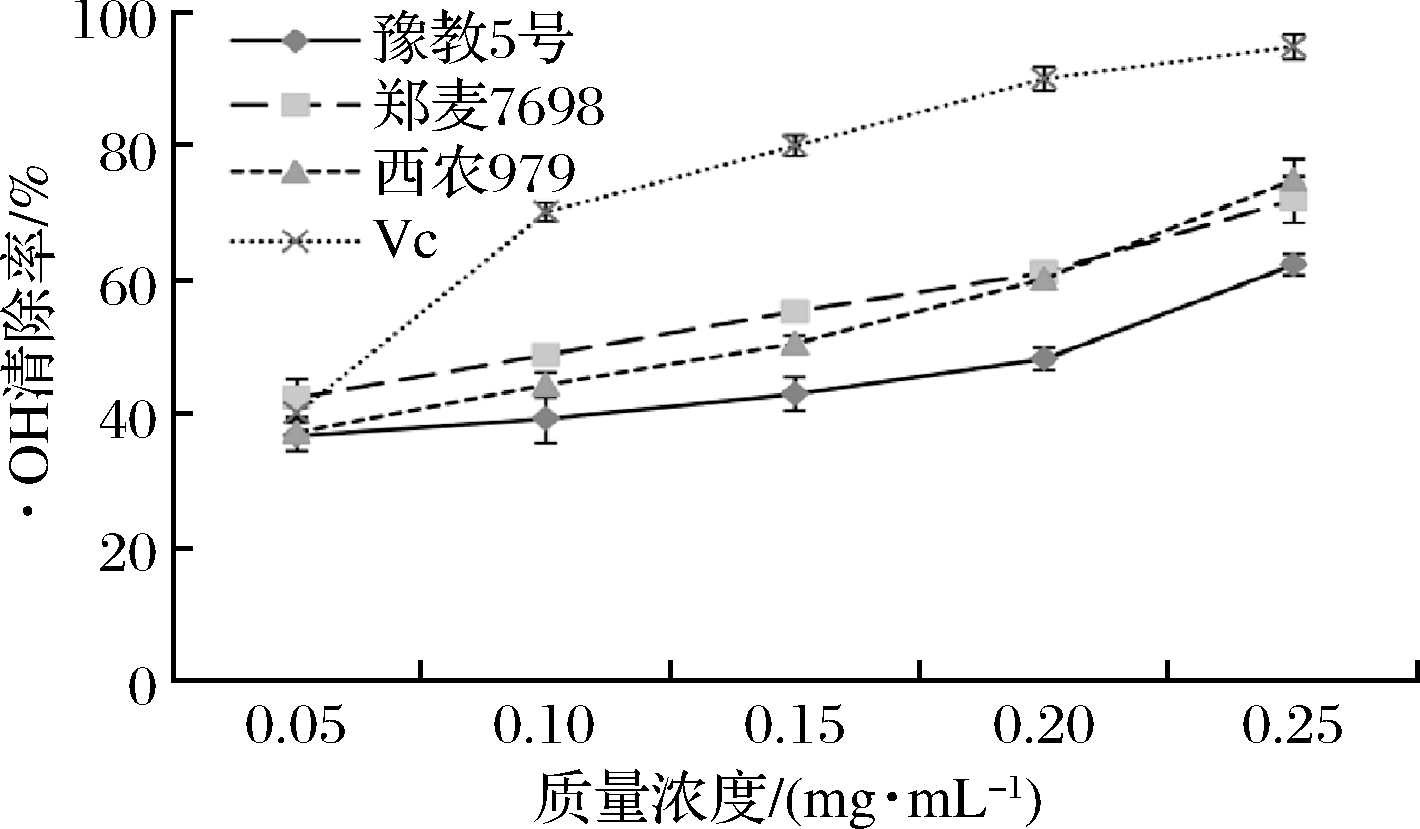
图6 三种小麦麸皮总黄酮乙醇提取物对
·OH的清除作用
Fig.6 Scavenging effects of three wheat bran ethanol
extracts on hydroxyl radicals
2.3.3 小麦麸皮总黄酮丙酮提取物对·OH的清除作用
由图7可知,在0.05~0.25 mg/mL质量浓度范围内,3种小麦麸皮总黄酮的丙酮提取液对·OH清除率呈质量浓度依赖性。在0.25 mg/mL时,Vc、豫教5号小麦麸皮、郑麦7698小麦麸皮、西农979小麦麸皮中总黄酮的·OH清除率分别为90.10%、58.48%、65.00%和64.57%。由此可知,丙酮提取的3种小麦麸皮中总黄酮和Vc对·OH清除能力依次为:Vc>郑麦7698小麦麸皮>西农979小麦麸皮>豫教5号小麦麸皮,四者均呈现良好的线性关系。总的来说,7698小麦麸皮与979小麦麸皮总黄酮对·OH的清除率近似,可能与2种小麦种类特征相似有关。

图7 三种小麦麸皮总黄酮丙酮提取物对·OH的清除作用
Fig.7 Scavenging effects of three wheat bran acetone
extracts on hydroxyl radicals
2.4 小麦麸皮总黄酮提取物对DPPH自由基的清除作用
2.4.1 小麦麸皮总黄酮甲酮提取物对DPPH自由基的清除作用
由图8可知,随着样品质量浓度的增加,采用甲醇提取的3种小麦麸皮总黄酮对DPPH自由基的清除率也随之增强。在0.6~1.2 mg/mL质量浓度范围内,郑麦7698总黄酮的DPPH自由基清除率略高于另外2种小麦麸皮。低于0.6 mg/mL或是高于1.2 mg/mL时,甲醇提取的3种小麦麸皮总黄酮和Vc对DPPH自由基清除能力依次为:Vc>西农979小麦麸皮>郑麦7698小麦麸皮>豫教5号小麦麸皮,均成明显的剂量依赖性与线性关系。

图8 三种小麦麸皮总黄酮甲醇提取物对
DPPH自由基的清除作用
Fig.8 Scavenging effects of three wheat bran methanol
extracts on DPPH free radicals
2.4.2 小麦麸皮总黄酮乙醇提取物的DPPH自由基清除作用
由图9可知,采用乙醇提取3种小麦麸皮总黄酮对DPPH自由基的清除率呈质量浓度依赖性,并且同质量浓度下,Vc的清除率明显高于3种小麦麸皮总黄酮的清除率。在1.5 mg/mL时,Vc、豫教5号小麦麸皮、郑麦7698小麦麸皮、西农979小麦麸皮中总黄酮的DPPH自由基清除率分别为90.54%、52.34%、62.42%和68.72%。由此可知,用乙醇提取的3种小麦麸皮总黄酮和Vc对DPPH自由基清除能力依次为:Vc>西农979小麦麸皮>郑麦7698小麦麸皮>豫教5号小麦麸皮。总的来说,7698小麦麸皮与979小麦麸皮总黄酮对DPPH自由基清除率差异较小,这可能与相似种类小麦的遗传特性存在差异有关。

图9 三种小麦麸皮总黄酮乙醇提取物对
DPPH自由基的清除作用
Fig.9 Scavenging effects of three wheat bran ethanol
extracts on DPPH free radicals
2.4.3 小麦麸皮总黄酮丙酮提取物的DPPH自由基清除作用
由图10可知,3种小麦麸皮总黄酮丙酮提取液对DPPH自由基的清除率随着样品质量浓度的增加而增加。在0.3~0.9 mg/mL质量浓度范围内,郑麦7698小麦麸皮总黄酮的DPPH自由基清除率略低于另外2种。因此在该质量浓度下,丙酮提取的3种小麦麸皮黄酮和Vc对DPPH自由基清除能力依次为:Vc>西农979小麦麸皮>郑麦7698小麦麸皮>豫教5号小麦麸皮。在0.9~1.5 mg/mL质量浓度下,用丙酮提取的3种小麦麸皮总黄酮和Vc对DPPH自由基清除能力依次为:Vc>郑麦7698小麦麸皮>西农979小麦麸皮>豫教5号小麦麸皮。不同剂量下小麦麸皮总黄酮清除DPPH能力与其丙酮提取过程中溶出的少量总酚酸相关,也可能是由于丙酮提取条件下郑麦7698小麦麸皮溶出黄酮化合物结构类型存在差异。

图10 三种小麦麸皮总黄酮丙酮提取物对
DPPH自由基的清除作用
Fig.10 Scavenging effects of three wheat bran acetone
extracts on DPPH free radicals
2.5 小麦麸皮总黄酮乙醇提取物对人胃癌细胞内活性氧水平的调控
活性氧是含有氧原子并且氧化或还原能力很强的数十种物质的总称,其中有代表性的为超氧阴离子自由基、羟自由基、过氧脂基和一氧化氮等,它们属自由基,另外一些活性氧例如过氧化氢、脂过氧化物、次氯酸和过氧亚硝酸等是普通分子[30]。通过前面结果可知,3种不同的有机溶剂对小麦麸皮的总黄酮提取能力顺序为:乙醇>甲醇>丙酮。且各项能力测定结果均反映采用乙醇提取的总黄酮的总还原力和清除·OH能力最强。为了进一步探究乙醇溶剂对不同品种小麦麸皮中黄酮类物质对细胞内活性氧水平的影响,用浓度梯度的小麦麸皮总黄酮孵育人胃癌AGS细胞24 h。DCFH-DA是一种非标记性的氧化敏感的荧光探针,在自然环境下不产荧光,但在进入细胞膜后会在细胞内被酯酶水解生成DCFH,生成的探针DCFH不能自由通过细胞膜被装载到细胞内。因此,利用非标记性的DCFH-DA探针和流式细胞术可有效监测小麦麸皮总黄酮对AGS细胞内活性氧水平的影响。如图11所示,用乙醇提取的3种小麦麸皮总黄酮处理细胞后,特征峰随质量浓度向左移动,通过定量分析发现,3种小麦麸皮均使细胞内活性氧水平下降,呈质量浓度梯度依赖性,且西农979使细胞内活性氧水平下降作用明显强于郑麦7698和西农979。3种小麦麸皮总黄酮乙醇提取物诱导细胞内活性氧水平下降与其抗氧化活性有关。
3 结论
本研究采用不同有机溶剂(乙醇、甲醇、丙酮)分别提取小麦麸皮(豫教5号、郑麦7698、西农979)中的总黄酮。3种有机溶剂提取总黄酮的能力顺序为:乙醇>甲醇>丙酮。从体外抗氧化实验结果综合来看,3种小麦麸皮的总黄酮均有抗氧化活性,乙醇提取物的总还原力和清除·OH的能力比其他两者要高,而甲醇提取物清除DPPH自由基的能力略大于乙醇,但总的来说乙醇提取的西农979小麦麸皮的总黄酮的抗氧化能力最好。乙醇提取物总还原力依次为:西农979小麦麸皮>郑麦7698小麦麸皮>豫教5号小麦麸皮;乙醇提取物对·OH清除能力依次为:郑麦7698小麦麸皮>西农979小麦麸皮>豫教5号小麦麸皮;乙醇提取物清除DPPH自由基能力依次为:西农979小麦麸皮>郑麦7698小麦麸皮>豫教5号小麦麸皮。各项能力测定结果均反映乙醇提取物的总黄酮的总还原力和清除羟基自由基的能力最强。乙醇提取的3种小麦麸皮总黄酮能够有效诱导胃癌细胞内活性氧水平下降,能力依次为:西农979小麦麸皮>郑麦7698小麦麸皮>豫教5号小麦麸皮。研究结果为西农979小麦麸皮中总黄酮在抗氧化剂的开发提供了参考。

图11 三种小麦麸皮总黄酮乙醇提取物对细胞内活性氧水平的影响
Fig.11 The effects of reactive oxygen species on three wheat bran acetone extracts-induced gastric cancer cells
[1] 马玉静,何荣香,陈福,等.发酵小麦麸皮及其在动物生产中的应用[J].中国饲料,2019(13):96-100.
MA Y J,HE R X,CHEN F,et al.The application of fermented wheat bran in animal production[J].China Feed,2019(13):96-100.
[2] 李治.不同处理方式对小麦麸皮理化性质影响的研究[D].天津:天津科技大学,2018.
LI Z.Effects of different treatment methods on the physicochemical properties of wheat bran[D].Tianjin:Tianjin University of Science & Technology,2018.
[3] 汪巍,李明,艾纯芝,等.天然黄酮类化合物抑制CYP3A4的构效关系研究(英文)[J].遵义医学院学报,2017,40(1):6-16.
WANG W,LI M,AI C Z,et al.Inhibition of CYP3A4 by natural accurring flavonoids:A SAR and 3D-QSAR study[J].Journal of Zunyi Medical University,2017,40(1):6-16.
[4] 初鑫宇.酶法提取银杏叶中黄酮类化合物的研究[D].石家庄:河北科技大学,2015.
CHU X Y.Study on extraction of flavonoids in Ginkgo biloba leaves by enzymatic method[D].Shijiazhuang:Hebei University of Science and Technology,2015.
[5] KUBANIK M,TU J K Y,SÖHNEL T,et al.Expanding on the structural diversity of flavone-derived RutheniumII(η6-Arene) anticancer agents[J].Metallodrugs,2015,1(1).DOI:10.1515/medr-2015-0001.
[6] 康凯,李鑫,王婉婷.黄酮类物质的提取方法研究现况[J].黑龙江科技信息,2016(22):3.
KANG K,LI X,WANG W T.Research status on extraction methods of flavonoids[J].Heilongjiang Science and Technology Information,2016(22):3.
[7] 刘敏,管福琴,王海婷,等.小麦麸皮总黄酮的体外抗氧化活性研究[J].食品研究与开发,2012,33(4):5-8.
LIU M,GUAN F Q,WANG H T,et al.Study on antioxidant properties of total flavonoids from wheat bran in vitro[J].Food Research and Development,2012,33(4):5-8.
[8] ZHU M Z,LIU T,ZHANG C Y,et al.Flavonoids of Lotus (Nelumbo nucifera) seed embryos and their antioxidant potential[J].Journal of Food Science,2017,82(8):1 834-1 841.
[9] 俞文英,张欢欢,吴月国,等.黄酮类化合物的构效关系及其在肺部炎症疾病中的应用[J].中草药,2018,49(20):4 912-4 918.
YU W Y,ZHANG H H,WU Y G,et al.Structure-activity relationship of flavonoids and its application in pulmonary inflammatory diseases[J].Chinese Traditional and Herbal Drugs,2018,49(20):4 912-4 918.
[10] HAN R M,ZHANG J P,SKIBSTED L H.Reaction dynamics of flavonoids and carotenoids as antioxidants[J].Molecules (Basel,Switzerland),2012,17(2):2 140-2 160.
[11] 任顺成,王玮.超微粉碎对小麦麸皮功能特性的影响研究[J].粮食与油脂,2016,29(12):36-41.
REN S C,WANG W.Effect of superfine grinding on functional properties of wheat bran[J].Cereals & Oils,2016,29(12):36-41.
[12] 张璟,欧仕益,张宁.麦麸酶解产品清除自由基的体外实验研究[J].营养学报,2005,27(1):25-29.
ZHANG J,OU S Y,ZHANG N.The scavenging capacity of free radicals by enzyme-hydrolyzed wheat bran in vitro[J].Acta Nutrimenta Sinica,2005,27(1):25-29.
[13] 孙道勇.结合型小麦麸皮化学成分及抗氧化活性研究[D].南京:南京农业大学,2015.
SUN D Y.Studies on chemical composition and antioxidant activity of bonded wheat bran[D].Nanjing:Nanjing Agricultural University,2015.
[14] 孟丽媛,王凤舞.西兰花多酚提取工艺及其抗氧化活性研究[J].中国食品学报,2013,13(5):62-68.
MENG L Y,WANG F W.Extraction technology and antioxidant activity of polyphenols from broccoli[J].Journal of Chinese Institute of Food Science and Technology,2013,13(5):62-68.
[15] DAI X.Study on extraction technology of total flavonoids from vitex rotundifolia[J].Agricultural Biotechnology,2015,2015(1):31-35.
[16] 周劝娥,田呈瑞,关为,等.陕西苦菜叶总黄酮的提取及抗氧化活性的测定[J].食品工业科技,2013,34(9):97-102.
ZHOU Q E,TIAN C R,GUAN W,et al.Optimization for ultrasonic-assisted extraction of total flavonoids from wild Patrinia villosa in Shaanxi and its antioxidant activity determination in vitro[J].Science and Technology of Food Industry,2013,34(9):97-102.
[17] 罗俊,张妮,王道平,等.黔产钩藤不同部位中总黄酮的含量测定[J].贵州科学,2019,37(2):15-18.
LUO J,ZHANG N,WANG D P,et al.Determination oftotal flavonoids in different parts of Uncaria rhynchophylla(Miq.) Miq.ex Havil[J].Guizhou Science,2019,37(2):15-18.
[18] KEFFOUS F,BELBOUKHARI N,SEKKOUM K,et al.Determination of the antioxidant activity of Limoniastrum feei aqueous extract by chemical and electrochemical methods[J].Cogent Chemistry,2016,2(1).DOI:10.1080/23312009.2016.1186141.
[19] 王盼,王毅红,方玉梅.金荞麦总黄酮提取物抗氧化作用研究[J].安徽农学通报,2017,23(8):23-24.
WANG P,WANG Y H,FANG Y M.Study on anti-oxidantion activity of the total flavone extract from Fagopyrum dibotrys(D.Don)Hara[J].Anhui Agricultural Science Bulletin,2017,2017:1-10.
[20] ADHIKARI L,KOTIYAL R,PANDEY M,et al.Effect of geographical location and type of extract on total phenol/flavon contents and antioxidant activity of different fruits extracts of Withania somnifera[J].Current Drug Discovery Technologies,2020,17(1):92-99.
[21] ZANG Y Q,FENG Y Y,LUO Y H,et al.Glycitein induces reactive oxygen species-dependent apoptosis and G0/G1 cell cycle arrest through the MAPK/STAT3/NF-κB pathway in human gastric cancer cells[J].Drug Development Research,2019,80(5):573-584.[LinkOut]
[22] 王秀波.干旱下氮素营养对不同穗型小麦苗期耐旱性的影响机制[D].北京:中国科学院大学,2018.
WANG X B.Effects of nitrogen on drought tolerance in different genotypes of wheat at seedling stage under drought stress[D].Beijing:University of Chinese Academy of Sciences,2018.
[23] 李耀光.不同粒色小麦籽粒抗氧化物质积累机理及氮磷肥调控效应研究[D].郑州:河南农业大学,2016.
LI Y G.Studies on the accumulation mechanism of antioxidant substances in wheat grains with different grain colors and the regulatory effect of Nitrogen and Phosphorus fertilizer[D].Zhengzhou:Henan Agricultural University,2016.
[24] 张美芸.分光光度法测定还原性物质的研究[D].新乡:河南师范大学,2010.
ZHANG M Y.Study of visible spectrophotometric in determination of reductive substances[D].Xinxiang:Henan Normal University,2010.
[25] 赵春燕,龚加顺,杨磊帮,等.梁王茶叶及其速溶茶粉的化学成分分析和抗氧化研究[J].食品研究与开发,2020,41(3):173-179.
ZHAO C Y,GONG J S,YANG L B,et al.Study on chemical composition and antioxidant activity of Liangwang tea leaves and its instant tea powder[J].Food Research and Development,2020,41(3):173-179.
[26] 张平静.低共熔溶剂在黄酮类化合物苷元制备与分析中的应用[D].杭州:浙江工商大学,2018.
ZHANG P J.Application of low eutectic solvent in the preparation and analysis of glycogen of flavonoid compounds[D].Hangzhou:Zhejiang Gongkong University,2018.
[27] 李艳琴,周凤超,陕方,等.荞麦麸皮提取物对α-葡萄糖苷酶活性的影响[J].食品科学,2010,31(17):10-13.
LI Y Q,ZHOU F C,SHAN F,et al.Effects of different solvent extracts from buckwheat bran on α-glucosidase activity[J].Food Science,2010,31(17):10-13.
[28] 贺文浩,高彦祥.栀子提取物不同极性组分自由基清除活性的研究[J].天然产物研究与开发,2010,22:170-173.
HE W H,GAO Y X.Study on free radical scavenging activities of different polar fractions on the extract from Gardenia (Gardenia jasminoides Ellis) fruit[J].Natural Product Research and Development,2010,22:170-173.
[29] 李琴,祝媛媛,吴绍艳,等.脂溶性茶色素的提取及其稳定性的研究[J].化学与生物工程,2012,29(12):51-53.
LI Q,ZHU Y Y,WU S Y,et al.Extraction of fat-soluble tea pigment and study on its stability[J].Chemistry & Bioengineering,2012,29(12):51-53.
[30] 张晨.p21对活性氧水平的影响及机制研究[D].济南:山东大学,2017.
ZHANG C.Regulation of reactive oxygen species by p21[D].Jinan:Shandong University,2017.