黄酒是以稻米、黍米等为主要原料,经加曲、酵母等糖化发酵剂酿制而成的一种发酵酒。传统黄酒发酵由细菌、霉菌、酵母菌等多种微生物参与完成,风味成分主要包括酸类、酯类、高级醇和醛类等[1-4]。酒药是黄酒酿造中使用的重要糖化发酵剂,而酒药中的酵母主要包括酿酒酵母、扣囊复膜孢酵母和隐球酵母等,其作为发酵黄酒的主要微生物,对黄酒风味特征的影响一直是黄酒酿造研究的热点[4-6]。
早期研究认为,非酿酒酵母与酿酒酵母混合发酵时,非酿酒酵母的早衰现象会对酒的风味和口感产生不利影响,但随着研究的深入,发现非酿酒酵母的加入有助于改善酒的香气和风味[7-12]。马克斯克鲁维酵母是食品安全级酵母,广泛存在于酸奶、水果、酸乳酒等环境中 [13],具有耐高温能力强、安全性好、底物利用范围广等特性[14-15],并具有产乙酸乙酯等多种风味物质的能力[16]。马克斯克鲁维酵母基于上述优点,一些研究人员开始尝试将马克斯克鲁维酵母应用于酿酒生产中。L PEZ-ALVAREZ等[17]将马克斯克鲁维酵母应用于龙舌兰酒发酵中,制备出了具有较高乙醇浓度和芳香化合物的龙舌兰酒。GARAVAGLIA等[18]将马克斯克鲁维酵母应用于葡萄汁发酵中,发酵产物富含β-苯乙醇。马克斯克鲁维酵母在乳清酒发酵[19]、稀奶油发酵[20]等方面均表现出良好的发酵性能。此外,国内已有研究者开展了将马克斯克鲁维酵母应用于奶啤发酵的研究中[21]。
PEZ-ALVAREZ等[17]将马克斯克鲁维酵母应用于龙舌兰酒发酵中,制备出了具有较高乙醇浓度和芳香化合物的龙舌兰酒。GARAVAGLIA等[18]将马克斯克鲁维酵母应用于葡萄汁发酵中,发酵产物富含β-苯乙醇。马克斯克鲁维酵母在乳清酒发酵[19]、稀奶油发酵[20]等方面均表现出良好的发酵性能。此外,国内已有研究者开展了将马克斯克鲁维酵母应用于奶啤发酵的研究中[21]。
本实验室分离并报道了1株高产乙醇和乙酸乙酯的马克斯克鲁维酵母菌株HY32[22-23],在此基础上,采用液态法黄酒发酵工艺,对HY32菌株与酿酒酵母混合发酵对黄酒的效果进行了研究,从微生物数量、酒精度、各风味物质的成分和含量以及酒样的感官评定等方面来探索以HY32与酿酒酵母混合发酵制备黄酒的可行性。
1 材料与方法
1.1 材料
1.1.1 菌株来源
马克斯克鲁维酵母(Kluyveromyces marxianus)HY32,本实验室分离保存;酿酒酵母(Sacchromyces cerevisiae)TRADY,某酵母股份有限公司。
1.1.2 试剂
糯米,市售;耐高温α-淀粉酶、糖化酶,枣庄杰诺生物酶有限公司;葡萄糖、乳酸(分析纯),天津科密欧化学试剂有限公司。
1.1.3 培养基
酵母种子培养基(YPD,g/L):葡萄糖20、蛋白胨20、酵母粉10,115 ℃灭菌30 min。固体YPD培养基需加入20 g/L琼脂。
马丁孟加拉红固体培养基(g/L):葡萄糖10、蛋白胨5、KH2PO4 1、MgSO4·7H2O 0.5、孟加拉红33.4 mg、琼脂20,115 ℃灭菌30 min。
糯米糖化发酵培养基:称取一定量的糯米粉,按料液比1∶2.5(g∶mL)加入蒸馏水,加液化酶(15 U/g)进行液化(95 ℃,90 min),加糖化酶(150 U/g)进行糖化(65 ℃,30 min),冷却后即为糖化发酵培养基。
1.2 仪器
ZWYR-2102C恒温培养振荡器,上海智城分析仪器制造公司;DNP-9082恒温培养箱,上海精宏实验设备有限公司;HH-6恒温水浴锅,国华电器有限公司;UV-5900PC紫外可见分光光度计,上海元析仪器有限公司;7890A气相色谱仪,美国安捷伦公司。
1.3 实验方法
1.3.1 黄酒发酵工艺流程
糯米→粉碎→液化→糖化→接种→主发酵→后发酵→过滤→巴氏杀菌→成品
工艺要点:将糯米粉碎后过40目筛,称取糯米粉71.4 g于500 mL三角瓶中,按料液比1∶2.5(g∶mL)加入178.5 mL蒸馏水。混匀后按15 U/g干糯米加入耐高温α-淀粉酶,于95 ℃水浴锅中液化90 min,冷却后用乳酸调pH至4.5~5.0,再按150 U/g干糯米加入糖化酶,于65 ℃水浴锅中糖化30 min,期间用玻璃棒不断搅拌,使糯米粉充分液化、糖化。冷却后接种,28 ℃进行发酵。
1.3.2 酵母菌种子液的培养
先将酵母菌HY32和TRADY分别划线接种于YPD固体平板上活化24 h,然后再接种于YPD液体培养基中摇床培养14~16 h,最后采用血球计数板法分别测定菌液浓度以确定接种体积。
1.3.3 发酵温度对HY32发酵糯米产黄酒的影响
按1.0×107个/mL接种发酵培养基,接种完成后分别置于28和37 ℃进行静置发酵,绘制生长曲线,比较2种情况下的酒精度和风味物质的含量。
1.3.4 通气量对HY32发酵糯米黄酒的影响
按1.0×107个/mL接种量接种糯米发酵培养基,分别于28 ℃,100 r/min的摇床和28 ℃静置发酵,不同时间取样,绘制生长曲线并测定酒精度和风味物质的含量。
1.3.5 不同比例的HY32与TRADY混合发酵方法
将TRADY与HY32分别按种不同的总菌数比(1∶1、2.5∶1、5∶13)接种,计算不同比例混合发酵所需菌液的体积,接种后于28 ℃下静置发酵7 d。
1.3.6 HY32纯种及混合发酵酵母活菌数的测定方法
采用稀释平板涂布法测定:每隔24 h对发酵液取样,经无菌水系列稀释后,纯种发酵液的稀释样直接涂布于YPD平板上计数;混合发酵液的稀释样涂布于孟加拉红平板上计数,由于HY32酵母菌落在孟加拉红平板上显白色,而TRADY显红色,因此可根据酵母菌落的颜色差异来区分2种酵母。
1.3.7 还原糖测定方法
还原糖采用3,5-二硝基水杨酸法进行测定[24]。
1.3.8 乙醇含量及风味物质的测定
取发酵液和蒸馏水各100 mL于500 mL蒸馏瓶中蒸馏,收集前100 mL蒸出液,用气相色谱仪测定。检测器:氢火焰离子化检测器(FID);色谱柱:J&W CP-Wax 57 CB Acidic(50 m×0.25 mm,0.2 μm);载气:N2;仪器参数为:进样量1 μL,分流比10∶1,H2流速为30 mL/min,空气流速为400 mL/min,N2流速为25 mL/min,进样口温度220 ℃,检测器温度为200 ℃,初始温度为60 ℃,维持5 min,以10 ℃/min的上升速率升至160 ℃,维持5 min,总运行时间20 min。
1.3.9 主成分分析方法
主成分分析应用SPSS软件进行[25]。
1.3.10 酒样的感官评定方法
感官品评人员由14名经培训的感官品评人员组成,感官评定指标及各指标得分参照表1进行,感官评定操作参照GB/T 13662—2018《黄酒》[26]进行。
表1 黄酒感官评分等级表
Table 1 Sensory rating scales of rice wine

项目/权重标准等级色泽/4澄清、透明,无明显悬浮物5澄清,无明显悬浮物4微浑3香气/6醇香清雅,无异香5醇香较清雅,无异香4醇香尚清雅,无异香3醇香欠清雅,无异香2有异香1口感/10柔和、鲜爽、无异味5柔和、较鲜爽、无异味4柔和、尚鲜爽、无异味3欠柔和鲜爽2酒体中涩、苦等味明显1
2 结果和分析
2.1 HY32菌株纯种发酵结果
2.1.1 发酵温度对HY32发酵活菌数及黄酒组分的影响
2种温度下HY32在糯米发酵培养基中的生长曲线如图1所示。HY32活菌数均在发酵初期24 h内快速增长并达到最大值,37 ℃下的最大活菌数高于28 ℃,分别为1.15×108和0.81×108个/mL。此后,活菌数均开始下降,在48~120 h保持稳定或稍有上升,发酵120 h后,活菌数开始减少。从整体来看,HY32在37 ℃下发酵的活菌数要高于28 ℃,这可能与HY32本身是耐热酵母菌有关。
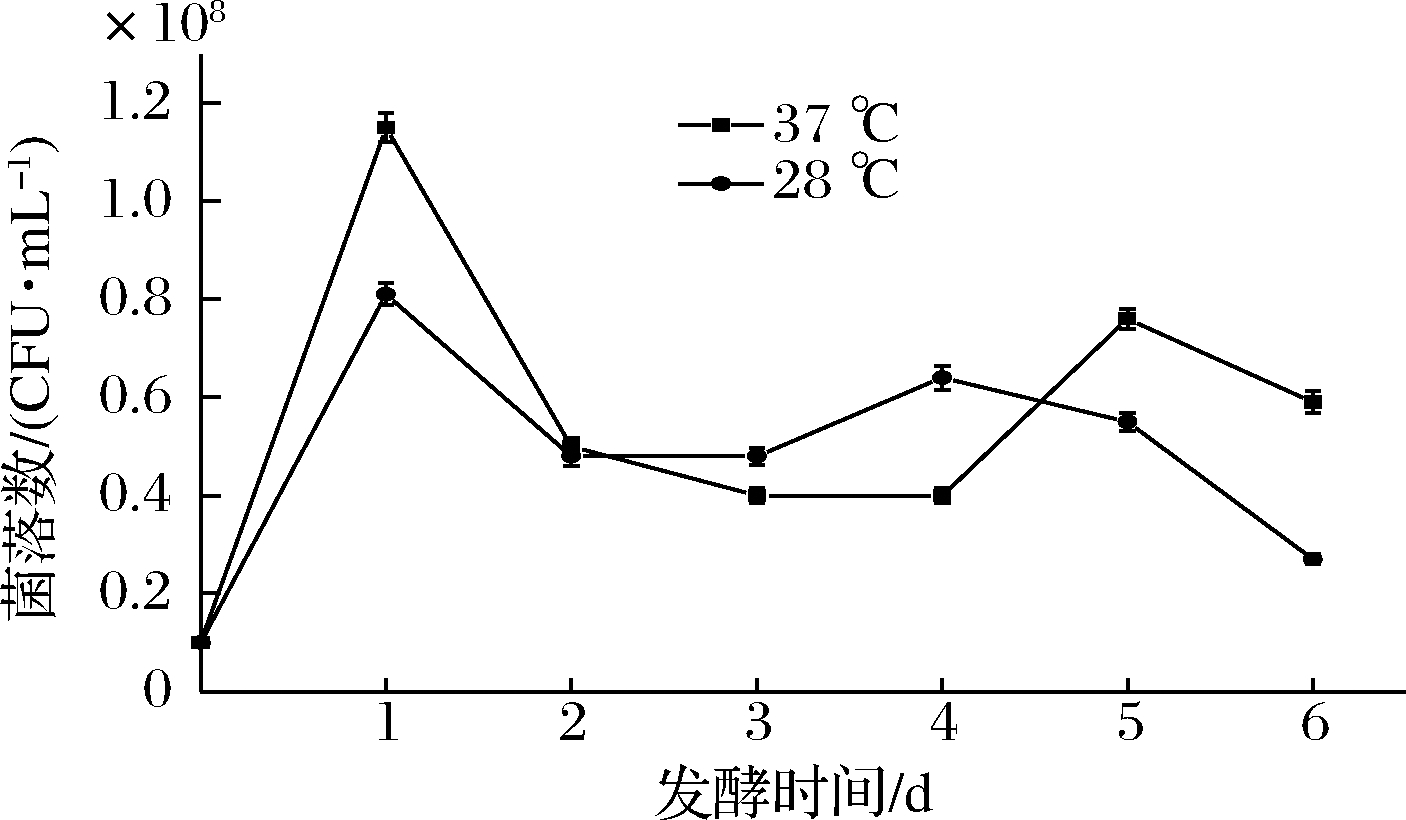
图1 不同发酵温度下HY32的生长曲线
Fig.1 Growth curves of HY32 at different fermentation temperatures
2种温度下的黄酒发酵产物的气相色谱分析结果如表2所示。37 ℃发酵条件下,HY32发酵黄酒的乙醇体积分数达7.13%,比28 ℃发酵时的乙醇体积分数(3.25%)高出2.2倍。37 ℃下发酵产生的乙酸乙酯、异丁醇、异戊醇、β-苯乙醇和醋嗡含量分别是28 ℃下发酵产生量的1.96、2.47、3.73、3.27和7.48倍,而37 ℃下发酵产酸能力有明显降低,其中乙酸、异戊酸、己酸含量分别只有28 ℃下发酵的81.95%、22.50%和66.46%。
表2 HY32发酵产物的气相色谱分析结果 单位:mg/mL
Table 2 GC results of HY32 fermented culture

项目28 ℃37 ℃酒精度(体积分数)/%3.25±0.217.13±0.33乙醛19.78±0.55108.81±1.54乙酸乙酯79.73±3.49156.61±5.65正丙醇25.79±1.4730.77±1.18异丁醇32.02±4.0579.10±3.24异戊醇31.02±2.41115.73±4.58正戊醇8.28±0.128.28±0.39醋嗡2.52±0.1318.86±0.27乳酸乙酯-3.72±0.06乙酸472.87±18.33387.52±12.21丙酸30.27±0.83-2,3-丁二醇(左旋)-21.59±1.13异丁酸6.72±0.378.93±0.222,3-丁二醇(内消旋)3.83±0.5311.31±0.86丁酸8.55±0.326.68±0.17异戊酸10.22±0.552.30±0.11戊酸4.50±0.143.04±0.12己酸25.43±0.5216.90±0.77β-苯乙醇4.38±0.2814.33±0.81
注:-表示未检测到(下同)
2.1.2 通气量对HY32发酵乙醇含量及风味物质的影响
摇床和静置发酵2种情况下的HY32生长情况如图2所示。发酵24 h时,摇床和静置2种发酵条件下的活菌数均达到最大值,分别为1.3×108和0.81×108个/mL,摇床培养的最大活菌数高于静置培养。此后,两者活菌数均开始下降,在48~120 h保持在相对稳定水平,发酵120 h后,酵母活菌数开始减少。
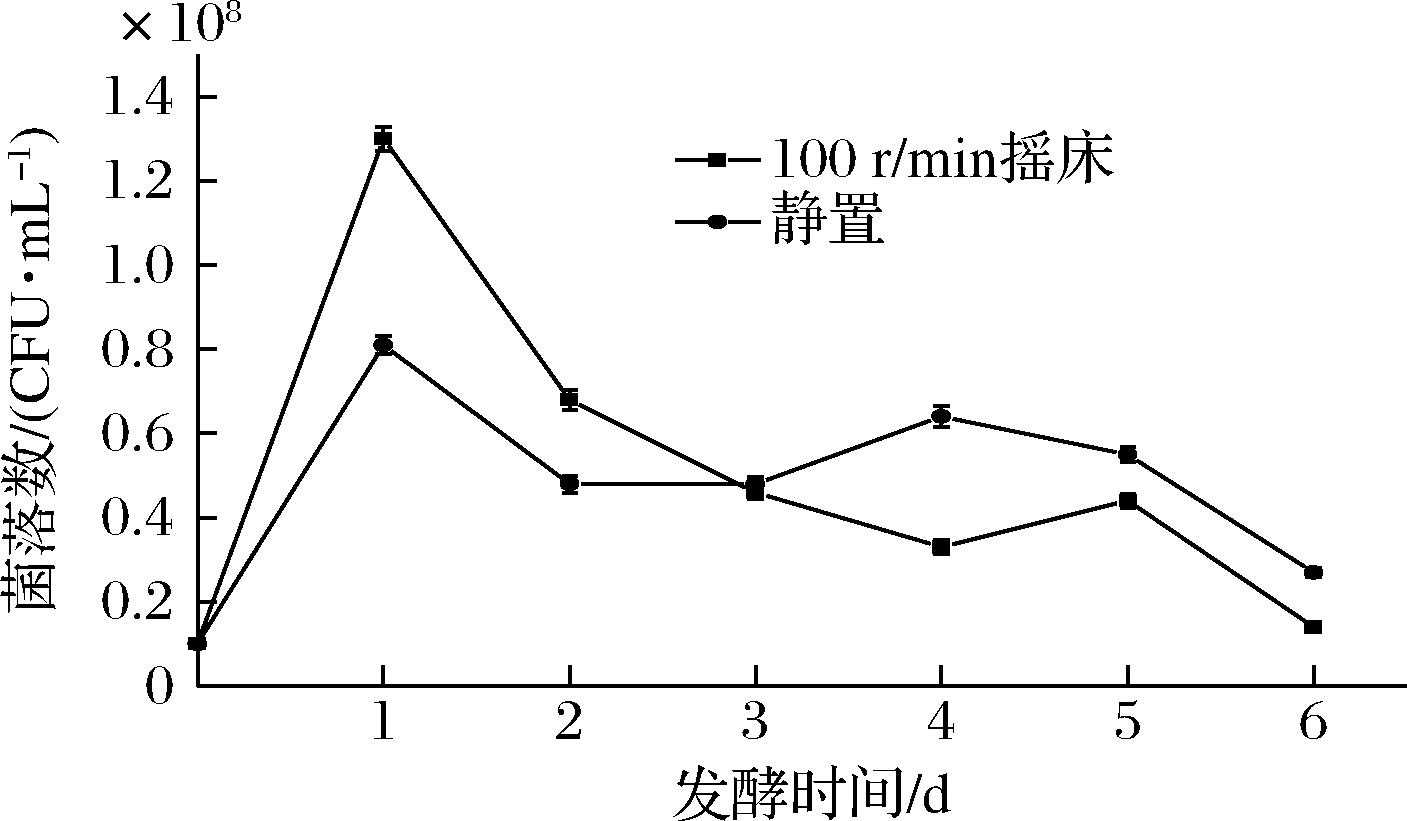
图2 不同通气条件下HY32的生长曲线
Fig.2 Growth curves of HY32 under different aeration conditions
发酵完成后,发酵产物气相色谱分析结果如表3所示。100 r/min摇床发酵的酒精度为3.29%(体积分数),与静置发酵的酒精度无显著差别;而乙酸乙酯含量达1 369.69 mg/L,是静置发酵样品的乙酸乙酯含量的9.66倍。有研究表明,乙酸乙酯的合成是好氧代谢[16],随着摇瓶转速增加培养液中溶氧也增大,乙酸乙酯产量呈上升趋势[27]。
表3 不同通气条件下发酵产物的气相色谱分析结果 单位:mg/mL
Table 3 GC results of HY32 fermented culture under
different aeration conditions
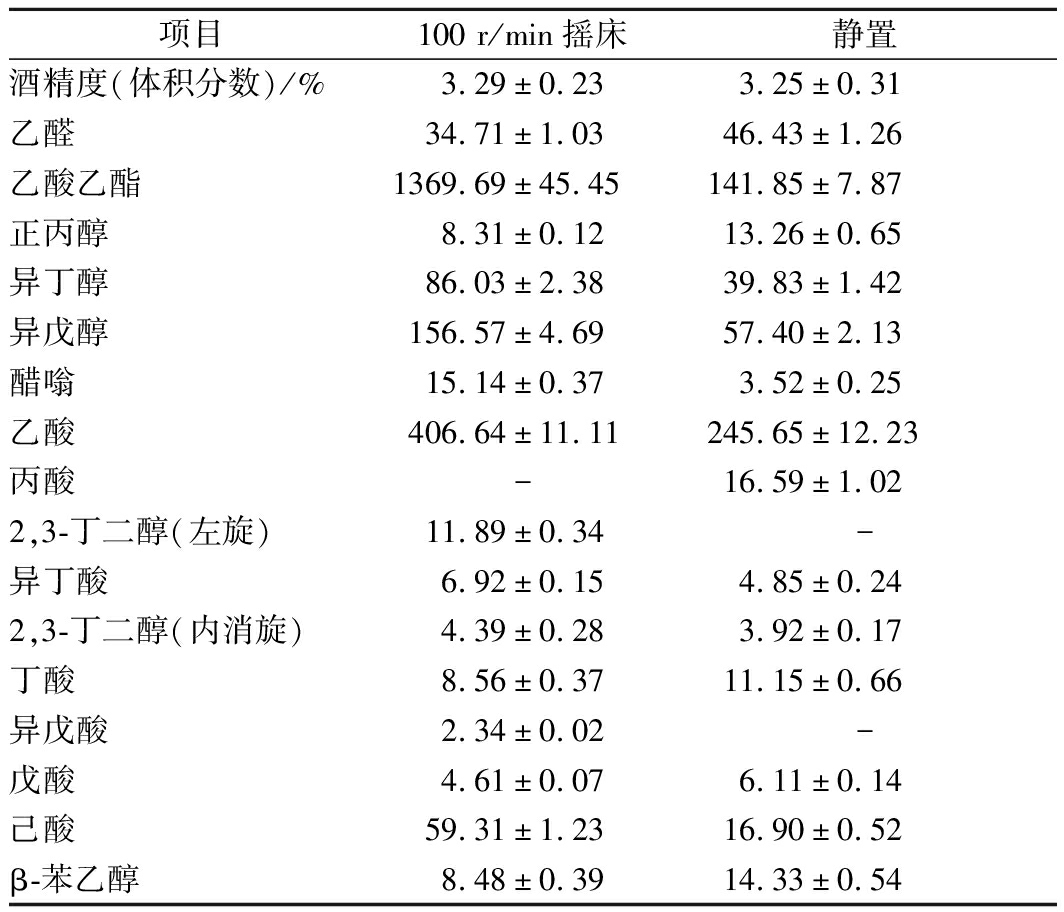
项目100 r/min摇床静置酒精度(体积分数)/%3.29±0.233.25±0.31乙醛34.71±1.0346.43±1.26乙酸乙酯1369.69±45.45141.85±7.87正丙醇8.31±0.1213.26±0.65异丁醇86.03±2.3839.83±1.42异戊醇156.57±4.6957.40±2.13醋嗡15.14±0.373.52±0.25乙酸406.64±11.11245.65±12.23丙酸-16.59±1.022,3-丁二醇(左旋)11.89±0.34-异丁酸6.92±0.154.85±0.242,3-丁二醇(内消旋)4.39±0.283.92±0.17丁酸8.56±0.3711.15±0.66异戊酸2.34±0.02-戊酸4.61±0.076.11±0.14己酸59.31±1.2316.90±0.52β-苯乙醇8.48±0.3914.33±0.54
除乙酸乙酯外,100 r/min摇床发酵下的异丁醇、异戊醇、醋嗡、乙酸和己酸的含量均显著高于静置发酵,但乙醛、正丙醇、丙酸、丁酸、戊酸的含量均有所降低。
2.2 HY32与TRADY混合发酵结果
2.2.1 HY32与TRADY按不同比例混合发酵结果
将酒精度、β-苯乙醇和乙酸乙酯的含量作为确定混菌发酵最佳混合比例的3个标准。HY32与TRADY按不同比例混合发酵结果如表4所示。在保证接种总菌数不变的情况下,HY32与TRADY按不同比例混合发酵时,酒精度随TRADY的比例增加无明显变化,3种比例下的酒精度都在10%(体积分数)左右。乙酸乙酯含量随HY32比例的减小而逐渐降低,β-苯乙醇含量随HY32比例的减小而逐渐增加,但增加量较小。结果表明,当混菌发酵比例为1∶1时,酒精度为10.76%(体积分数)、乙酸乙酯含量为77.62 mg/L、β-苯乙醇含量为62.25 mg/L,三者均在较佳状态。因此,后续混菌发酵实验均采用1∶1的比例混合。
表4 HY32与TRADY按不同比例混合发酵气相色谱结果
Table 4 GC results of HY32 and TRADY co-fermented
culture with different proportions
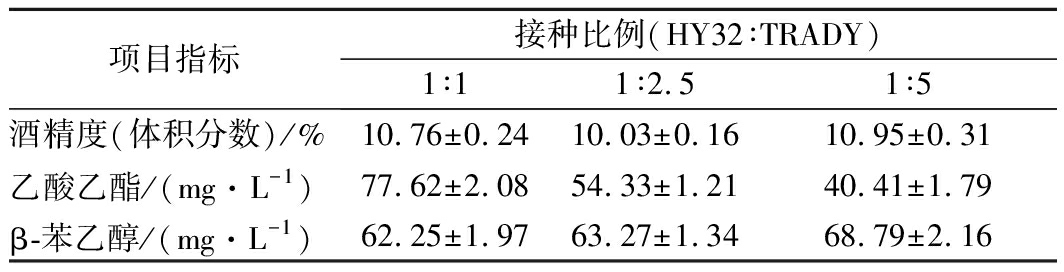
项目指标接种比例(HY32∶TRADY)1∶11∶2.51∶5酒精度(体积分数)/%10.76±0.2410.03±0.1610.95±0.31乙酸乙酯/(mg·L-1)77.62±2.0854.33±1.2140.41±1.79β-苯乙醇/(mg·L-1)62.25±1.9763.27±1.3468.79±2.16
2.2.2 1∶1混合发酵的酵母生长曲线
HY32与TRADY按1∶1混合发酵的生长曲线如图3所示。2种酵母在发酵初期的前24 h菌数快速增长并且数量相当,分别为0.35×108和0.33×108个/mL,此时的HY32活菌数达到最大。在发酵24 h后,HY32活菌数开始下降,到72 h时降至0.02×108个/mL,而TRADY在发酵24 h后反而处于缓慢上升状态。这表明HY32与TRADY混合发酵时,按相同接种量接种,前期两者菌数相当,后期TRADY占绝对优势,这可能与酿酒酵母具有较好的乙醇耐受能力有关。
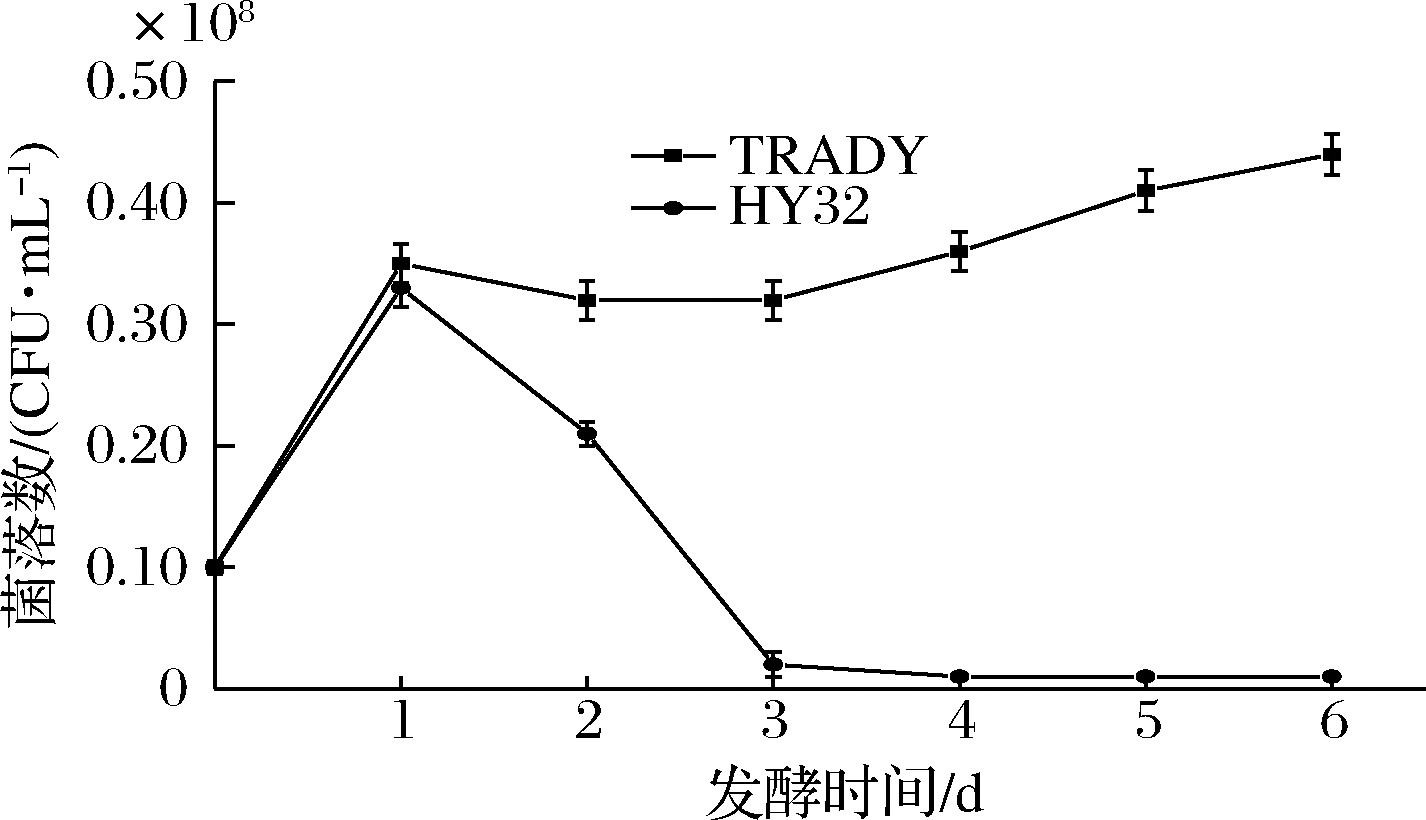
图3 按1∶1混合发酵酵母生长曲线
Fig.3 Growth curves of HY32 and TRADY under
mixed fermentation(ratio 1∶1)
2.2.3 1∶1混合发酵过程的动态变化曲线
发酵过程中酒精度及残糖的动态变化曲线如图4所示。随着发酵时间的延长,酒精度逐渐增加,残糖量逐渐降低。1∶1混合发酵的酒精度和残糖量变化曲线与纯种TRADY的酒精度和残糖量变化曲线大体相同,纯种HY32的酒精度则偏低,残糖量则偏高。

图4 纯种及混合发酵过程中酒精度与残糖的动态变化曲线
Fig.4 Curves of ethanol and sugar content under
monoculture and co-culture
发酵过程中乙酸乙酯含量的动态变化曲线如图5所示。1∶1混合发酵样的乙酸乙酯的产生主要发生在发酵前3 d。第3天以后,乙酸乙酯的含量基本保持不变。这与混合发酵时2种酵母的生长曲线结果相符,因为HY32是乙酸乙酯的主要产生者,其在混合发酵时的第3天基本已经死亡。与纯种HY32相比,混合发酵样的乙酸乙酯含量有所降低,但仍比纯种酿酒酵母高许多。
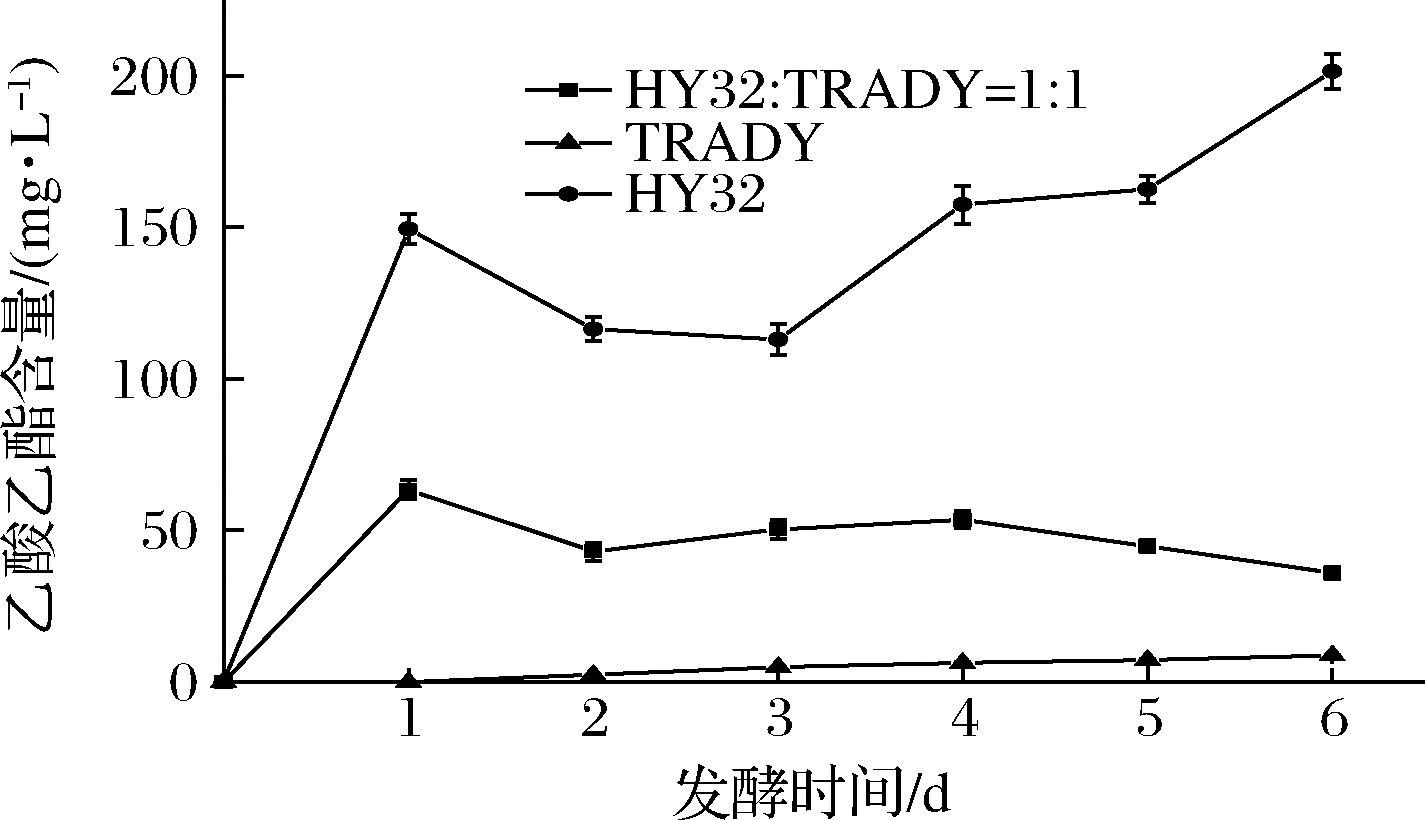
图5 发酵过程中乙酸乙酯含量的变化曲线
Fig.5 Variations of ethyl acetate content under
monoculture and co-culture
发酵过程中β-苯乙醇含量的动态变化曲线如图6所示。在整个发酵过程中,β-苯乙醇的含量基本都处于上升状态,1∶1混合发酵样的β-苯乙醇含量介于纯种TRADY和纯种HY32之间,更接近纯种TRADY。由此可知,1∶1混合发酵与纯种TRADY发酵相比,β-苯乙醇含量略有降低,但影响不大。

图6 发酵过程中β-苯乙醇含量的变化曲线
Fig.6 Variations of β-phenethyl alcohol content
under monoculture and co-culture
2.2.4 按1∶1混合发酵酒样的气相色谱分析结果
混菌发酵黄酒完成后的发酵产物气相色谱分析结果如表5所示。混菌发酵与TRADY纯种发酵的黄酒酒精度相近,均在14%(体积分数)左右,与TRADY纯种发酵相比,混合发酵的乙酸乙酯、乙酸含量分别由21.43、284.09 mg/L增至52.79、371.90 mg/L,己酸乙酯、醋嗡、2,3-丁二醇、丁酸、戊酸、己酸等风味物质的含量均高于纯种TRADY发酵。
表5 HY32和TRADY单独发酵及1∶1混合发酵的
气相色谱分析结果 单位:mg/mL
Table 5 GC results of pure and mixed fermentation
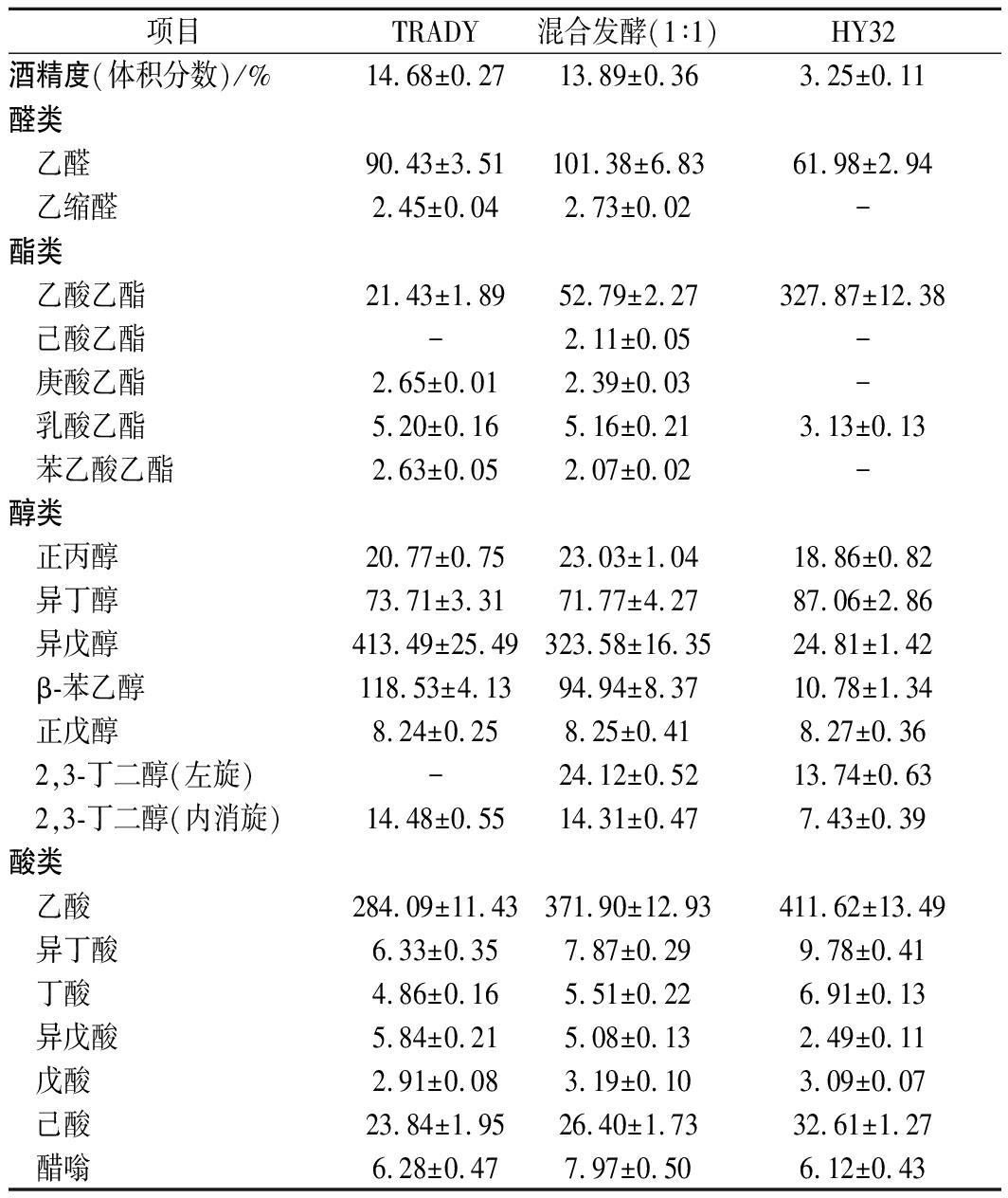
项目TRADY混合发酵(1∶1)HY32酒精度(体积分数)/%14.68±0.2713.89±0.363.25±0.11醛类乙醛90.43±3.51101.38±6.8361.98±2.94乙缩醛2.45±0.042.73±0.02-酯类乙酸乙酯21.43±1.8952.79±2.27327.87±12.38己酸乙酯-2.11±0.05-庚酸乙酯2.65±0.012.39±0.03-乳酸乙酯5.20±0.165.16±0.213.13±0.13苯乙酸乙酯2.63±0.052.07±0.02-醇类正丙醇20.77±0.7523.03±1.0418.86±0.82异丁醇73.71±3.3171.77±4.2787.06±2.86异戊醇413.49±25.49323.58±16.3524.81±1.42β-苯乙醇118.53±4.1394.94±8.3710.78±1.34正戊醇8.24±0.258.25±0.418.27±0.362,3-丁二醇(左旋)-24.12±0.5213.74±0.632,3-丁二醇(内消旋)14.48±0.5514.31±0.477.43±0.39酸类乙酸284.09±11.43371.90±12.93411.62±13.49异丁酸6.33±0.357.87±0.299.78±0.41丁酸4.86±0.165.51±0.226.91±0.13异戊酸5.84±0.215.08±0.132.49±0.11戊酸2.91±0.083.19±0.103.09±0.07己酸23.84±1.9526.40±1.7332.61±1.27醋嗡6.28±0.477.97±0.506.12±0.43
HY32与TRADY按1∶1混合发酵黄酒样的乙酸乙酯和乙酸含量分别比单一酿酒酵母提高了2.46倍和1.31倍,而高级醇(正丙醇、异丁醇、异戊醇、β-苯乙醇)总量为513.3 mg/L,是单一酿酒酵母发酵酒样高级醇含量(626.5 mg/L)的81.9%。此外,混合发酵还增加了一些新的风味成分,如己酸乙酯、2,3-丁二醇(左旋),有效改善了黄酒的质量和风味。
2.2.5 主成分分析结果
将混合发酵的气相色谱结果进行主成分分析,以寻求各风味物质与各酵母菌株的关系,其结果如图7所示。第一、二主成分各占77.21%和22.16%,2个主成分可以反映全部信息的99.37%,提取较为完全。分析的风味成分可分为3组,组1包括3种醇类、3种酯类、2种醛类以及异戊酸,这些组份含量越高,样本在主成分一上的载荷就越大;组2包括4种酸类、乙酸乙酯和异丁醇,这些组份含量越高,样本在主成分一上的载荷就越小;组3包括戊酸、丁二醇、乙酸乙酯以及醋翁,这些组份含量越高,样本在主成分二上的载荷就越高。组1和组2所包含的成分分别分布在坐标轴的两端,说明HY32和TRADY所产生的风味物质相差较大,组1所含成分主要由TRADY贡献,组2所含成分主要由HY32贡献。组3所含成分在TRADY或HY32单独发酵时含量很低甚至不产生,当两者混合发酵时就会产生较高的组3成分。

图7 混合发酵酒样风味物质的主成分分析图
Fig.7 Principal component analysis of mixed fermentation
2.3 混菌发酵成品黄酒的理化指标及感官评定结果
由表6可知,HY32与TRADY按1∶1混合发酵的黄酒成品各理化指标适宜,符合国家清爽型半甜黄酒的标准(GB/T 13662—2018)。
发酵酒样感官评定结果如表7所示,感官加权评分值为各指标等级得分与相应权重乘积的总和。由表7可知,按1∶1混合发酵酒样的加权评分高于TRADY纯种发酵。2种酒样在色泽上没有太大差别,均透明,呈淡黄色。在香气、口感和风格上,1∶1混合发酵酒样的口感更加爽口柔和,醇香更为浓郁,具有黄酒应有的风格。相比之下,TRADY纯种发酵酒样的口感较单薄,略带涩。
表6 按1∶1混合发酵酒样理化结果
Table 6 Physical and chemical analysis of 1∶1 mixed fermentation

指标酒精度体积分数/%总糖/(g·L-1)总酸/(g·L-1)pHβ-苯乙醇/(mg·L-1)GB/T 13662—20188.0~16.040.1~1003.8~8.03.5~4.6≥30.0混合发酵(1∶1)13.89±0.3662.12±5.224.8±0.23.78±0.1094.94±8.37
表7 黄酒样的感官评定
Table 7 Sensory evaluation of Huangjiu samples

指标色泽香气口感感官加权评分值HY32∶TRADY=1∶14.04.54.588纯种TRADY4.04.04.080
3 结论与讨论
目前,酵母菌的混合发酵已成为改善酒类产品风味和开发新产品的重要研究方向[28-29]。一般认为非酿酒酵母与酿酒酵母混合发酵时,非酿酒酵母由于受到酿酒酵母代谢物的抑制作用和在厌氧低糖条件下对酒精的不耐受性,其数量会迅速下降[30]。虽然混菌发酵时非酿酒酵母后期数量很少,但在前期可以积累各种风味物质。本研究结果表明,当HY32与TRADY菌株按相同接种量接种时,发酵前期两者菌数相当,后期HY32菌株受到抑制。
乙酸是黄酒中主要的酸类物质之一,是生成酯类的前驱物质。酸类含量过低,则酒味短淡、发苦,优质酒类酸含量均较高。酯类是黄酒中的重要香味成分,酵母菌主要通过酯酶合成途径将醇和酸转化为酯。HY32与TRADY混合发酵黄酒样的乙酸乙酯和乙酸含量分别比单一酿酒酵母提高了2.46和1.31倍,这可能是由于马克斯克鲁维酵母的产乙酸能力高于酿酒酵母所导致的。混合发酵不仅提高了发酵液的酸类、酯类、醛类含量,降低了高级醇含量,同时还产生了己酸乙酯和2,3-丁二醇这2种新的风味物质。己酸乙酯是一种具有菠萝香型香气的风味成分,是浓香型白酒的主体香气之一;2,3-丁二醇在酒类中主要起缓冲作用,使酒增加绵甜、回味和醇厚感,因此混合发酵有效改善了黄酒的质量和风味。经感官评定,混合发酵酒样醇香浓郁,口感柔和,成分协调,具有黄酒应有的风格。
本研究表明发酵温度对马克斯克鲁维酵母发酵特性具有明显影响。本研究曾测定过发酵结束后2种不同发酵温度下酒样的残糖量,发现28 ℃发酵比37 ℃发酵酒样的残糖量要高,因此推测马克斯克鲁维酵母在较低温度下产乙醇能力下降可能是由于其乙醇脱氢酶等与乙醇生成有关的酶活力下降导致的。马克斯克鲁维酵母在较低的温度下产酒精能力显著下降,同时产酸能力显著提高,可以利用这一特点酿造低醇酒类。高级醇是黄酒的重要风味物质成分,能够赋予黄酒酒体特殊的香气,但高级醇含量过高时会造成“上头”、“宿醉”等作用。因此,适度降低黄酒中高级醇的含量具有重要价值[31]。本研究还发现马克斯克鲁维酵母在较低温度下发酵黄酒产异戊醇等高级醇的能力显著降低,为了控制黄酒中高级醇的含量,发酵过程中应选择较低的发酵温度。
[1] 汪建国,沈玉根,陆伟杰,等.我国黄酒研究现状与发展趋势[J].中国酿造,2012,31(11):15-20.
WANG J G,SHEN Y G,LU W J,et al.Situation and development trend of Chinese rice wine research[J].China Brewing,2012,31(11):15-20.
[2] 刘芸雅,毛健,孟祥勇,等.绍兴黄酒麦曲及发酵过程中细菌群落结构分析[J].中国食品学报,2017,17(1):201-208.
LIU Y Y,MAO J,MENG X Y,et al.Exploring bacterial community in wheat qu and their changes during Shaoxing rice wine fermentation[J].Journal of Chinese Institute of Food Science and Technology,2017,17(1):201-208.
[3] 李路,吕燕霖,郭伟灵,等.红曲黄酒传统酿造用曲中的微生物菌群及挥发性风味组分分析[J].食品科学,2019,40(2):79-84.
LI L,LYU Y L,GUO W L,et al.Analysis of microbial flora and volatile flavor components in traditional fermentation starters for Hongqu glutinous rice wine[J].Food Science,2019,40(2):79-84.
[4] 臧威, 谢广发,孙剑秋,等.绍兴黄酒酒药中酵母菌的物种资源[J].菌物学报,2015,34(6):1 078-1 084.
ZANG W,XIE G F,SUN J Q,et al.Yeast species in the fermentation starter of Shaoxing ricewine[J].Mycosystema,2015,34(6):1 078-1 084.
[5] 陈佳楠, 陈双,徐岩.不同酿酒酵母(Saccharomyces cerevisiae)对黄酒挥发性香气物质的影响[J].工业微生物,2013,43(1):30-35.
CHEN J N,CHEN S,XU Y.Influences of different yeast strains on producing volatile compounds in production of yellow rice wine[J].Industrial Microbiology,2013,43(1):30-35.
[6] 陈玉香, 叶汶坤,何冬萍,等.酵母菌对红曲黄酒风味物质形成的影响[J].中国食品学报,2015,15(7):218-224.
CHEN Y X,YE W K,HE D P,et al.The influence of yeast strains on the flavour compounds of Hongqu glutinous rice wine[J].Journal of Chinese Institute of Food Science and Technology,2015,15(7):218-224.
[7] GARDE-CERD N T,ANC
N T,ANC N-AZPILICUETA C.Contribution of wild yeasts to the formation of volatile compounds in inoculated wine fermentations[J].European Food Research and Technology,2006,222(1-2):15-25.
N-AZPILICUETA C.Contribution of wild yeasts to the formation of volatile compounds in inoculated wine fermentations[J].European Food Research and Technology,2006,222(1-2):15-25.
[8] JOLLY N P,VARELA C,PRETORIUS I S.Not your ordinary yeast:Non-Saccharomyces yeasts in wine production uncovered[J].FEMS Yeast Research,2014,14(2):215-237.
[9] WHITENER M E B,STANSTRUP J,PANZERI V,et al.Untangling the wine metabolome by combining untargeted SPME-GC×GC-TOF-MS and sensory analysis to profile Sauvignon Blanc co-fermented with seven different yeasts[J].Metabolomics,2016,12:53.
[10] 唐洁, 王海燕,徐岩.酿酒酵母和异常毕赤酵母混菌发酵对白酒液态发酵效率和风味物质的影响[J].微生物学通报,2012,39(7):921-930.
TANG J,WANG H Y,XU Y.Effect of mixed culture of Saccharomyces cerevisiae and Pichia anomala on fermentation efficiency and flavor compounds in Chinese liquor[J].Microbiology China,2012,39(7):921-930.
[11] ANDORR I,BERRADRE M,ROZÉS N,et al.Effect of pure and mixed cultures of the main wine yeast species on grape must fermentations[J].European Food Research and Technology,2010,231(2):215-224.
I,BERRADRE M,ROZÉS N,et al.Effect of pure and mixed cultures of the main wine yeast species on grape must fermentations[J].European Food Research and Technology,2010,231(2):215-224.
[12] 王玉华, 盛文军,李敏,等.耐热克鲁维酵母和粟酒裂殖酵母顺序接种发酵对美乐干红葡萄酒品质的影响[J].食品科学,2019,40 (8):102-111.
WANG Y H,SHENG W J,LI M,et al.Effect of sequential fermentation with Lachancea thermotolerans and Schizosaccharomyces pombe on the quality of merlot dry red wine[J].Food Science,2019,40 (8):102-111.
[13] 莫文娟, 郭超,吕红.马克斯克鲁维酵母的遗传与生理特征[J].中国科学:生命科学,2016,46(4):413-419.
MO W J,GUO C,LV H.Review of Kluyveromyces marxianus’ genetic and physiological features[J].Scientia:Sinica(Vitae),2016,46(4):413-419.
[14] LANE M M,MORRISSEY J P.Klueromyces marxianus:a yeast emerging from its sister’s shadow[J].Fungal Biology Reviews,2010,24(1-2):17-26.
[15] FONSECA G G,HEINZLE E,WITTMANN C,et al.The yeast Kluyveromyces marxianus and its biotechnological potential[J].Applied Microbiology and Biotechnology,2008,79(3):339-354.
[16] L SER C,URIT T,BLEY T.Perspectives for the biotechnological production of ethyl acetate by yeasts[J].Applied Microbiology and Biotechnology,2014,98(12):5 397-5 415.
SER C,URIT T,BLEY T.Perspectives for the biotechnological production of ethyl acetate by yeasts[J].Applied Microbiology and Biotechnology,2014,98(12):5 397-5 415.
[17] L PEZ-ALVAREZ A,D
PEZ-ALVAREZ A,D AZ-PÉREZ A L,SOSA-AGUIRRE C,et al.Ethanol yield and volatile compound content in fermentation of agave must by Kluyveromyces marxianus UMPe-1 comparing with Saccharomyces cerevisiae baker’s yeast used in tequila production[J].Journal of Bioscience and Bioengineering,2012,113(5):614-618.
AZ-PÉREZ A L,SOSA-AGUIRRE C,et al.Ethanol yield and volatile compound content in fermentation of agave must by Kluyveromyces marxianus UMPe-1 comparing with Saccharomyces cerevisiae baker’s yeast used in tequila production[J].Journal of Bioscience and Bioengineering,2012,113(5):614-618.
[18] GARAVAGLIA J,FL RES S H,PIZZOLATO T M,et al.Bioconversion of L-phenylalanine into 2-phenylethanol by Kluyveromyces marxianus in grape must cultures[J].World Journal of Microbiology and Biotechnology,2007,23(9):1 273-1 279.
RES S H,PIZZOLATO T M,et al.Bioconversion of L-phenylalanine into 2-phenylethanol by Kluyveromyces marxianus in grape must cultures[J].World Journal of Microbiology and Biotechnology,2007,23(9):1 273-1 279.
[19] 陈成.克鲁维酵母发酵乳清蛋白水解液生产乳清营养酒的研究[J].酿酒,2010,37(2):53-55.
CHEN C.Kluyveromyces yeast fermentation of whey protein hydrolysates produced wine whey nutrition research[J].Liquor Making,2010,37(2):53-55.
[20] 王丹,李伟,芮昕,等.马克斯克鲁维酵母Y51-6发酵稀奶油工艺优化及挥发性风味成分分析[J].食品科学,2015,36(15):112-117.
WANG D,LI W,RUI X,et al.Optimization of fermentation parameters for dilute cream by Kluyveromyces marxianus Y51-6 and its volatile flavor components analyzed by SPME-GC-MS[J].Food Science,2015,36(15):112-117.
[21] 胡曼,王亮,巩小芬,等.优质奶啤乳源酵母菌的筛选及发酵性能的研究[J].中国乳品工业,2017,45(7):27-32.
HU M,WANG L,GONG X F,et al.Study on screening of high quality dairy yeast for milk beer producing and fermentation characteristics[J].China Dairy Industry,2017,45(7):27-32.
[22] 陈文静,柏永昊,杨团元,等.一株马克斯克鲁维酵母菌的生长及酒精发酵特性分析[J].中国酿造,2013,32(7):77-81.
CHEN W J,BAI Y H,YANG T Y,et al.Growth and ethanol fermentation characteristics of a strain of Kluyveromyces marxianus[J].China Brewing,2013,32(7):77-81.
[23] 陈瑾,闫振丽,缪礼鸿,等.马克斯克鲁维酵母木薯乙醇发酵工艺研究[J].中国酿造,2016,35(2):39-42.
CHEN J,YAN Z L,MIAO L H,et al.Ethanol fermentation technology with cassava by Kluyveromyces marxianus[J].China Brewing,2016,35(2):39-42.
[24] WANG Y,YUAN B,JI Y C,et al.Hydrolysis of hemicellulose to produce fermentable monosaccharides by plasma acid[J].Carbohydrate Polymers,2013,97(2):518-522.
[25] MENG X,WU Q,WANG L,et al.Improving flavor metabolism of Saccharomyces cerevisiae by mixed culture with Bacillus licheniformis for Chinese Maotai-flavor liquor making[J].Journal of Industrial Microbiology & Biotechnology,2015,42:1 601-1 608.
[26] 中华人民共和国国家质量监督检验检疫总局.GB/T 13662—2018黄酒 [S].北京:中国标准出版社,2018.
General Administration of Quality Supervision,Inspection and Quarantine of the People’s Republic of China.GB/T 13662—2018 Huangjiu [S].Beijing:China Standard Press,2018.
[27] 陈维新,李静,王瑶,等.一株乙酸乙酯高产酵母的筛选及其特性研究[J].食品与发酵工业,2015,41(9):87-90.
CHEN W X,LI J,WANG Y,et al.Screening and characterization of a high ethyl acetate-producing yeast[J].Food and Fermentation Industries,2015,41(9):87-90.
[28] 白梦洋,吴祖芳,李若云,等.果酒酵母菌多菌种混合培养的生长规律及挥发性风味物质的差异性分[J].中国食品学报,2019,19(5):214-221.
BAI M Y,WU Z F,LI R Y,et al.The growth law of wine yeasts in a mixed culture and difference analysis of volatile flavor compounds[J].Journal of Chinese Institute of Food Science and Technology,2019,19(5):214-221.
[29] 张文静,杨诗妮,杜爽,等.本土毕赤克鲁维酵母与酿酒酵母混合发酵葡萄酒的增香潜力研究[J].食品科学,2020,41(12):84-90.
ZHANG W J,YANG S N,DU S,et al.Potential application of mixed starter cultures of indigenous Pichia kluyveri and Saccharomyces cerevisiae to wine aroma enhancement[J].Food Science,2020,41(12):84-90.
[30] ALBERGARIA H,FRANCISCO D,GORI K,et al.Saccharomyces cerevisiae CCMI 885 secretes peptides that inhibit the growth of some non-Saccharomyces wine-related strains[J].Applied Microbiology and Biotechnology,2010,86(3):965-972.
[31] 吴丹丽,李高磊,王明月,等.低产尿素与高级醇黄酒酵母菌株的筛选、鉴定与发酵[J].食品科学,2019,40(6):100-105.
WU D L,LI G L,WANG M Y,et al.Screening,identification and fermentation characteristics of yeast strains for low concentrations of urea and fusel alcohol in Chinese rice wine[J].Food Science,2019,40(6):100-105.