新疆高海拔的优良天然牧场,赋予畜产品肉质细嫩、适口性好、绿色无污染的特性。此外,牛肉具有高蛋白、低脂、低胆固醇、富含维生素及矿物质等营养特性。依托新疆优质牛肉资源,借鉴传统发酵肉制品加工技术制得的干腌牛肉肉质鲜美、风味独特且贮藏性好。然而,目前干腌牛肉的加工过分依赖自然环境,产品品质不稳定且风味差异大,安全性得不到保障。
干腌肉制品加工过程中的品质变化涉及肌肉组织中多种物质的氧化、合成、降解、相互作用等,具有复杂的合成-代谢网络和调控-互作网络。蛋白质作为原料肉的主要化学成分,在干腌肉制品加工中通过水解、氧化、产物互作等多种途径影响发酵和成熟过程中产品的风味、色泽和质构。腌腊肉制品加工过程中因蛋白质水解、氧化及其结构的改变,产生多种有助于品质形成的低分子质量风味前体物质[1-2]。肌浆蛋白和肌原纤维蛋白通过内源酶的水解作用产生的肽、氨基酸等化合物参与产品滋味、风味的形成过程[3-4]。刘肖等[5]研究发现蛋白质降解生成的肽及游离氨基酸对酸肉产品滋味及风味的形成有一定促进作用。马艳梅[6]证实了蛋白质变化对羊肉火腿感官和风味品质的影响作用。
目前,新疆牛肉资源丰富,然而干腌牛肉加工过程中蛋白质变化对品质影响研究鲜有报道。鉴于此,本实验以不同加工阶段的干腌牛肉为研究对象,借助色度、质构评价产品品质,并对加工过程中游离氨基酸、蛋白质氧化指标、降解程度及结构变化进行研究,以期明确蛋白质变化对干腌牛肉品质的影响,为干腌牛肉产品进一步品质研究提供理论参考。
1 材料与方法
1.1 材料与试剂
新鲜牛后腿,石河子市农贸市场;2,4-二硝基苯肼(2,4-dinitrophenylhydrazine,DNPH)、过硫酸铵、考马斯亮蓝 R-250、盐酸胍、甘氨酸、尿素等,分析纯,麦克林试剂有限公司。
1.2 仪器与设备
Multifuge X1R 高速冷冻离心机,赛默飞世尔科技(中国)有限公司;Neofuge-15R酶标仪,美国伯爵仪器有限公司;YS3060色差仪,深圳三恩时科技有限公司;TA.XTplus质构仪,英国Stable Micro Systems公司;S3500激光粒度仪,美国麦克仪器公司;Bruker Senterra 拉曼光谱仪,德国布鲁克公司;Mini-protein Ⅲ凝胶成像仪,美国Bio-Rad公司
1.3 实验方法
1.3.1 样品制备
工艺流程:新鲜牛肉→修整→腌制→风干→发酵→成熟→成品
工艺条件:鲜牛肉于4 ℃下预冷放置48 h,修整定型后,按原料质量的6.5%食盐量揉搓并于8 ℃、65%条件下腌制30 d;腿肉清洗后于10 ℃、相对湿度 60%风干30 d;20 ℃、相对湿度70%发酵30 d后调整温度至25 ℃、相对湿度75%,继续发酵30 d,最后于28 ℃、相对湿度70%成熟30 d即得成品。
分别于原料期(0 d)、腌制期(30 d)、风干期(60 d)、发酵中期(90 d)、发酵后期(120 d)、成熟期(150 d)6个阶段进行样品采集,-20 ℃冷藏备用。
1.3.2 色度的测定
在室温条件下选择各时期的牛肉切片,使用色差仪进行色度测定,测量之前进行系统校正。测定样品的亮度(L*)、红度(a*)、黄度(b*)。每个时期的样品均进行3次测定。饱和度(c)、彩度(h)、总色差(ΔE)计算如下:
(1)
c=(a*×2*+b×2)×0.5
(2)
(3)
1.3.3 质构的测定
将各时期牛肉样品切成小块(3 cm×3 cm×2 cm),使用质构仪测定。测定参数为:探头类型为P/50,使用2个35压缩的连续循环,循环间隔为5 s,测前速度为3 mm/s、测试速度为1 mm/s、测后速度为2 mm/s,触发力为10 g。
1.3.4 肌浆蛋白和肌原纤维蛋白的提取
参考冉丽丹等[7]的方法提取干腌牛肉中蛋白质。剔除肉样表面肉眼可见脂肪并破碎。称取5.00 g样品于离心管中,加入10 mL磷酸盐缓冲液(A液,pH 6.5)匀浆混匀,于4 ℃、5 000 r/min离心15 min后,过滤收集上清液,此步骤重复2次,上清液即为肌浆蛋白溶液(SP)。向上述所得沉淀中加入10 mL磷酸盐缓冲液(B液,pH 6.5),匀浆混匀于4 ℃、5 000 r/min离心15 min后,过滤收集上清液,此步骤重复2次,上清液即为肌原纤维蛋白溶液(MP),双缩脲法测定蛋白浓度。
1.3.5 羰基含量的测定
将肌浆蛋白和肌原纤维蛋白溶液稀释至1 mg/mL 与DNPH溶液反应并于370 nm处测定吸光值,采用摩尔消光系数22 000 L/(mol·cm)计算羰基含量[9]。
1.3.6 总巯基含量的测定
将质量浓度为1 mg/mL肌浆蛋白和肌原纤维蛋白溶液与5,5′-二硝基(2-硝基苯甲酸)反应并于412 nm处测定吸光值,采用摩尔消光系数为13 600 L/(mol·cm)计算总巯基含量[9]。
1.3.7 SDS-PAGE
参照邓小蓉等[10]的方法:选用10%的分离胶和5%的浓缩胶进行电泳,各时期的上样量为5 μL,电泳初始电压为75 V,当样品进入分离胶后上调电压至120 V。电泳结束后,将胶片剥出,考马斯亮蓝R-250染色30 min,再用脱色液进行3次脱色,直至胶片透明,根据标准蛋白Marker的相对迁移率获得蛋白质分子质量。
1.3.8 拉曼光谱的测定
将各加工时期的蛋白溶液进行真空冷冻干燥后,通过拉曼显微系统进行数据采集,分辨率为5~9 cm-1,激发波长为785 nm,激光功率为100 mW,每个样品扫描3次,记录100~3 000 cm-1频率范围内的拉曼信号光谱[11],并进行数据分析。
1.3.9 粒径的测定
将肌浆蛋白和肌原纤维蛋白溶液超声30 min,使用激光散射器测定蛋白质的粒径。以去离子水作为分散剂,颗粒折射率1.414,颗粒吸收率为0.001,每个样品重复测定3次,记录数据并进行分析[12]。
1.3.10 游离氨基酸的测定
游离氨基酸的测定参照GB 5009.124—2016的方法:准确称取各时期肉样50 mg于水解管,加入10 mL 6 mol/L HCl溶液及苯酚3滴。放入冷冻剂冷冻5 min,于110 ℃水解24 h。准确吸取1.0 mL水解滤液于50 ℃减压干燥,残留物溶解于1 mL蒸馏水,蒸干后加入1 mL柠檬酸钠缓冲溶液溶解,过0.22 μm微孔滤膜,衍生化后测定各时期氨基酸含量。分析条件:分离柱柱温55 ℃;反应柱柱温135 ℃;流速0.4 mL/min;波长570 nm (除Pro)和440 nm (Pro)。
1.4 数据统计与分析
实验中每个指标重复测定3次,其值用MEAN±SD表示。SPSS Statistics 25.0统计软件进行数据ANOVA分析,Origin 2018软件用于图表绘制,相关性热图及主成分分析图使用R 3.6.1软件绘制。
2 结果与分析
2.1 干腌牛肉加工过程中色度的变化
色泽影响消费者对肉制品喜好程度,是判定肉制品新鲜度的重要指标。干腌牛肉加工过程中的色泽变化如表1所示,表征产品色度的各指标整体呈现显著下降趋势(P<0.05)。L*的持续下降可能与脂肪氧化的加剧、食盐的渗透、水分含量的降低有关[13]。a*从原料期到发酵中期不断降低,从发酵后期开始逐渐回升,这可能是在有氧环境中肌红蛋白被氧化成高铁肌红蛋白导致牛肉红度下降,而酸性环境中产生的NO与肌红蛋白螯合生成亚硝基肌红蛋白导致红度逐渐回升[14]。b*呈现波动变化,这可能与水分的减少、氯化物的作用、脂肪的氧化以及细胞膜的破坏导致铁离子的释放等有关[15]。本研究中干腌牛肉色度变化规律与ROBERTO等[16]对猪肉火腿色度变化的研究结果相同。饱和度、彩度变化与红度和黄度变化趋势相似,总色差随着加工时间的延长而降低,在发酵中期之前下降最显著,可能与干腌牛肉在加工过程中脂肪和蛋白质氧化降解有关。
表1 不同加工时期干腌牛肉色度的变化
Table 1 Changes of color in dry-cured beef during different processing periods
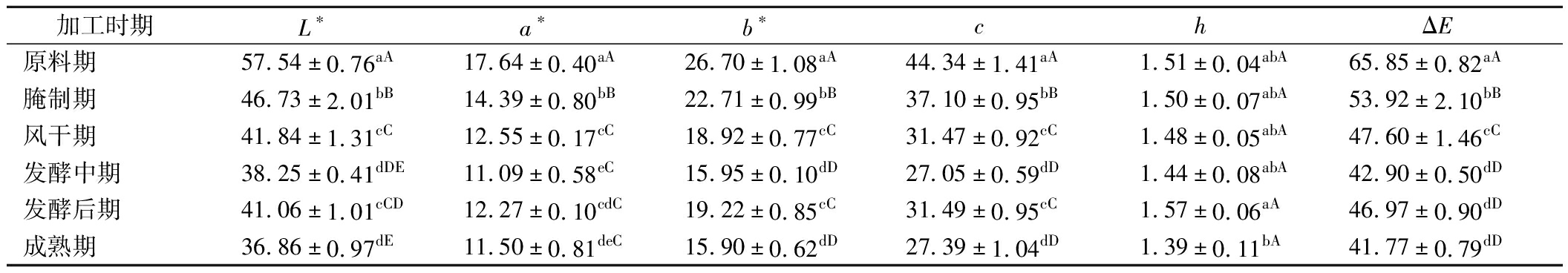
加工时期L∗a∗b∗chΔE原料期57.54±0.76aA17.64±0.40aA26.70±1.08aA44.34±1.41aA1.51±0.04abA65.85±0.82aA腌制期46.73±2.01bB14.39±0.80bB22.71±0.99bB37.10±0.95bB1.50±0.07abA53.92±2.10bB风干期41.84±1.31cC12.55±0.17cC18.92±0.77cC31.47±0.92cC1.48±0.05abA47.60±1.46cC发酵中期38.25±0.41dDE11.09±0.58eC15.95±0.10dD27.05±0.59dD1.44±0.08abA42.90±0.50dD发酵后期41.06±1.01cCD12.27±0.10cdC19.22±0.85cC31.49±0.95cC1.57±0.06aA46.97±0.90dD成熟期36.86±0.97dE11.50±0.81deC15.90±0.62dD27.39±1.04dD1.39±0.11bA41.77±0.79dD
注:同列不同小写字母表示差异显著P<0.05,不同大写字母表示差异极显著P<0.01(下同)
2.2 干腌牛肉加工过程中质构的变化
质构与原料肉加工过程中的组织结构和状态变化密切相关,实验结果表明,干腌牛肉各加工时期的质构变化显著(P<0.05),除弹性、黏聚性外,其他指标均表现出显著增加的趋势(表2)。硬度与蛋白质结构的变化密切相关,蛋白质分子的伸展及聚集导致其结构改变,从而在一定程度上影响产品质地[15,17]。干腌牛肉硬度、咀嚼性、胶着性的增加可能与水分含量的降低、食盐和发酵作用共同导致的蛋白变性以及氯化物含量升高有关。加工过程中干腌牛肉的弹性先降后升以及回弹性增加可能是肌纤维被食盐破坏及蛋白质凝胶形成的作用结果。肌肉在酶和微生物代谢的共同作用导致黏聚性、黏性的变化[18]。干腌牛肉的咀嚼性与硬度、黏聚性和弹性有关,黏聚性越高,咀嚼时越细腻[19]。经发酵成熟后的牛肉肉质紧实,咀嚼性和口感有所改善,进而提升了干腌牛肉的食用品质。
表2 不同加工时期干腌牛肉质构的变化
Table 2 Changes of texture of dry-cured beef during different processing periods

加工时期硬度黏聚弹性胶着性咀嚼性黏性回弹性原料期906.586±77.792fF0.444±0.021cC0.561±0.033bcAB527.955±42.714fF236.410±39.318fF-137.665±7.384fF0.112±0.006eD腌制期1 184.474±151.483eE0.469±0.019bB0.556±0.063bcAB697.668±48.504eE628.053±93.430eE-116.259±10.854eE0.129±0.008deCD风干期3 227.553±284.466dD0.488±0.010bB0.497±0.082cB1 216.379±229.920dD1 118.460±160.485dD-82.048±10.838dD0.140±0.007cdCD发酵中期4 473.253±213.869cC0.540±0.012aA0.644±0.041abA2 193.804±98.810cC1 493.599±44.671cC-65.565±3.982cC0.161±0.006cC发酵后期5 712.389±210.983bB0.522±0.008aA0.668±0.023aA3 323.634±271.549bB1 798.018±55.506bB-54.158±4.217bB0.202±0.004bB成熟期6 630.819±294.306aA0.498±0.007bB0.680±0.025aA4 623.676±521.444aA2 193.395±263.265aA-40.410±5.504aA0.256±0.026aA
2.3 干腌牛肉加工过程中蛋白质氧化规律
羰基含量对蛋白质的氧化程度具有重要的指示作用。干腌牛肉加工过程中羰基含量变化如图1所示,肌原纤维蛋白羰基含量是肌浆蛋白羰基含量的2倍左右,干腌牛肉加工过程中羰基含量呈现逐渐增长趋势且差异显著(P<0.05),至加工结束的其含量分别增长了53.51%、36.83%。一方面可能是原料蛋白质的侧链上带有NH-或![]() 部分的氨基酸与脂解产生的氧化自由基反应,转化为羰基;另一方面在金属催化氧化、α-酰胺化作用及其他因素作用下产生羰基衍生物[20-21]。加工过程中的蛋白质氧化能够改变蛋白质二、三级结构,进而影响干腌牛肉的感官和营养品质。这与LI等[17]报道的羟自由基诱导下鲤鱼肌原纤维蛋白羰基含量变化结果一致。
部分的氨基酸与脂解产生的氧化自由基反应,转化为羰基;另一方面在金属催化氧化、α-酰胺化作用及其他因素作用下产生羰基衍生物[20-21]。加工过程中的蛋白质氧化能够改变蛋白质二、三级结构,进而影响干腌牛肉的感官和营养品质。这与LI等[17]报道的羟自由基诱导下鲤鱼肌原纤维蛋白羰基含量变化结果一致。

图1 干腌牛肉加工过程中羰基和巯基含量的变化
Fig.1 Changes of carbonyl and sulfhydryl content of dry-cured
beef during the processing
由图1得知,干腌牛肉加工过程中肌浆蛋白和肌原纤维蛋白的巯基含量显著下降(P<0.05),成熟期的含量相对原料期分别下降了40.70%、49.27%。巯基含量的降低可能是由于氧化破坏蛋白质空间结构,使巯基转化为分子之间、分子内二硫键或氧化成次磺酸,亚磺酸和磺酸[9];也可能是随着加工温、湿度的升高,氧化促进蛋白质表面聚集,从而使能检测到的巯基含量降低。肉品加工中蛋白质表面的半胱氨酸中的游离硫醇基被氧化成二硫键,使蛋白质与水分结合的能力减弱,导致了持水能力的降低,对产品品质产生间接影响。崔文斌等[22]发现牦牛肉肌原纤维蛋白的巯基含量同样呈现显著下降趋势。
2.4 SDS-PAGE分析
由图2-a可知,干腌牛肉加工过程中肌浆蛋白发生一定程度的降解。肌浆蛋白主要由肌酸激酶(100 kDa)、磷酸化酶(90 kDa)、磷酸果糖激酶(82.4 kDa)、磷酸葡糖异构酶(60 kDa)、肌酸激酶(30~40 kDa)以及磷酸三糖异构酶(28 kDa)等组成。35 kDa蛋白片段从腌制期开始颜色加深,之后新增1条蛋白片段,30 kDa以下及70、140 kDa从腌制期开始有新的蛋白片段出现,这可能是蛋白质变性或小分子蛋白重新聚合成大分子蛋白质所导致的。40、55、90 kDa蛋白条带在整个加工过程中都存在;60、70 kDa蛋白条带在腌制期随着加工颜色逐渐加深至成熟期变浅;31 kDa条带在原料期颜色深,之后变浅消失。说明加工过程中食盐渗透及生化反应使肌浆蛋白发生显著降解形成牛肉的滋味和风味前体物质[23]。
由图2-b可知,肌原纤维蛋白主要有副肌球蛋白(100 kDa)、α-肌动蛋白(94 kDa)、原肌球蛋白(80 kDa)、肌钙蛋白(75 kDa)、肌动蛋白(43 kDa)、肌球蛋白轻链(20 kDa)等组成。随着加工的进行,蛋白片段发生了不同的变化,40 kDa左右可能是辅肌动蛋白,从原料期蛋白条带颜色深且宽随着加工逐渐变浅,43、60 kDa蛋白条带在整个加工过程中存在,这与SUN等[24]研究广式香肠在加工过程中蛋白质的变化有相似的结果。70 kDa从加工至风干期的蛋白条带颜色浅,之后颜色加深;80 kDa从发酵中期出现新的蛋白片段;130、135 kDa蛋白条带在原料期和腌制期颜色较深,之后颜色变浅,甚至有的条带完全消失;30 kDa以蛋白下条带加工过程中有的变浅,同时也有新的蛋白条带出现。说明蛋白质降解成小分子片段,使原有的蛋白质结构发生变化,进而间接影响干腌牛肉的组织结构。

M-标准蛋白;1-原料期;2-腌制期;3-风干期;
4-发酵中期;5-发酵后期;6-成熟期
a-肌浆蛋白;b-肌原纤维蛋白
图2 干腌牛肉加工过程中蛋白质 SDS-PAGE电泳图
Fig.2 SDS-PAGE ofproteins during the processing of
dry-cured beef
2.5 干腌牛肉加工过程中蛋白粒径的分析
粒径可反映蛋白质颗粒大小及蛋白质分子间的聚集情况。干腌牛肉加工过程中肌浆蛋白和肌原纤维蛋白粒径的变化如图3所示,蛋白质整体朝着大粒径方向聚集。与原料期相比,成熟期的干腌牛肉肌浆蛋白和肌原纤维蛋白在加工过程中粒径有所增加,说明干腌牛肉蛋白质变性导致蛋白质聚集体形成。然而,整个加工过程中肌浆蛋白和肌原纤维蛋白粒径呈现波动增加状态,此结果表明干腌牛肉加工中不仅出现蛋白质变性聚集,与之相伴的可能还有蛋白质降解、蛋白聚集体的逐渐形成及蛋白聚集体的解离现象[24],该实验结果与ZHOU等[25]报道的蛋白质修饰和水分分布对金华火腿粒径影响的结果相似。此外,粒径的增加可能与蛋白质氧化有关,蛋白质氧化有助于二硫键的形成及蛋白质的聚集,导致蛋白质结构变化,促进加工中干腌牛肉品质形成。

a-肌浆蛋白;b-肌原纤维蛋白
图3 干腌牛肉加工过程中蛋白质粒度变化
Fig.3 Changes of particle size of protein during
the processing of dry-cured beef
2.6 干腌牛肉加工过程中蛋白拉曼光谱分析
干腌牛肉加工过程中蛋白质二级结构堆积条形图变化如图4所示,肌浆蛋白二级结构改变对α-螺旋(30.13%)和β-折叠(28.3%)含量的影响较大,即α-螺旋含量增加,β-折叠含量先降低后升高,β-转角含量下降,而无规卷曲含量呈波动变化。这可能与加工过程中食盐的渗透或成熟使蛋白质发生变性或聚集有关。肌原纤维蛋白二级结构发生显著变化,在原料期β-折叠(23.55%)、β-转角(21.66%)影响最大,其次是α-螺旋(20.34%),而无规卷曲的含量最低(17.26%)。经发酵成熟后,α-螺旋含量和β-折叠含量呈现波动变化,而β-转角和无规卷曲含量呈无规则变化。其原因可能是α-螺旋解旋生成了β-折叠或无规卷曲,β-转角和β-折叠相互转化。蛋白质构象直接决定了蛋白质二级结构之间的变化与转换,通过影响风味吸附特性,间接影响产品感官品质[26]。

1-原料期;2-腌制期;3-风干期;4-发酵后期;5-;6-成熟期
图4 干腌牛肉加工过程中蛋白质二级结构变化
Fig.4 Changes of protein secondary structure during the
processing of dry-cured beef
2.7 干腌牛肉加工过程中游离氨基酸的变化
游离氨基酸主要由蛋白质和多肽水解形成,是挥发性芳香化合物的来源,对改善制品的特征风味具有重要作用[27]。干腌牛肉加工过程中游离氨基酸的变化如表3所示,游离氨基酸总量增长显著(P<0.05),成品中游离氨基酸总量约为原料的2倍,说明蛋白质降解贯穿于干腌牛肉的整个加工过程,对产品滋味和风味的形成具有重要贡献作用。必需氨基酸与非必需氨基酸的比例为25∶39,必需氨基酸与总氨基酸的比例为25∶64,非必需氨基酸与总氨基酸的比例为25∶41。成熟期结束时以Glu、Asp、Leu、Ala、Lys含量较多,这些氨基酸在物质呈味方面起着关键性的作用[28],Glu、Asp呈鲜味,Ala、Lys具有一定的甜味,而Leu呈苦味。大部分游离氨基酸的含量随着加工进程都有不同程度增加,这与ZHANG等[29]报道的氧化作用下猪肉游离氨基酸变化趋势一致。检测出的游离氨基酸中Ser、Tyr、Leu的含量随着加工时间延长呈上升趋势,而Ala、Phe、Lys、His、Met等呈现波动变化。各游离氨基酸的相互作用有助于形成产品特有的滋味,有研究表明,Val、Leu、Ile、Phe和Met在香肠中相互作用可显著加强滋味强度[30]。同时,Val、Ile、Leu、Met、Cys通过Strecker降解生成2-甲基丙醛、2-甲基丁醛、3-甲基丁醛、含硫化合物、吡嗪[31],这些物质有助于产品特征性风味的形成。Glu、Thr、Met、Ala、His、Val等氨基酸通过α-酮酸代谢生成醛,进而促进相应的羧酸和醇的形成,对干腌牛肉的整体香气和滋味产生重要影响[32]。
表3 不同加工时期干腌牛肉中游离氨基酸含量变化 单位:mg/(100 g)
Table 3 Changes of free amino acid content of dry-cured beef during different processing periods

氨基酸加工阶段原料期腌制期风干期发酵中期发酵后期成熟期天冬氨酸(Asp)1 975.13±47.21dD2 748.57±61.07cC2 872.53±72.87bB3 402.30±78.51aA3 502.83±17.96aA3 432.93±7.18aA谷氨酸(Glu)3 224.83±110.33fF5 005.03±111.36eE5 306.13±16.42dD6 289.00±30.79bB6 153.70±16.93cC6 632.80±6.16aA半胱氨酸(Cys)164.37±6.67dD377.70±1.54cC788.00±122.43bB762.07±102.29bB416.10±4.62cC998.97±18.99aA丝氨酸(Ser)997.70±78.51eE1 556.13±60.55dD1 633.23±9.75cC1 888.63±22.07bB1 925.03±3.59aA1 953.63±6.67aA甘氨酸(Gly)936.67±0.58fF1 325.53±4.11eE1 569.67±10.26cC1 865.70±13.86bB1 492.23±5.64dD1 941.67±10.26aA组氨酸(His)739.87±1.03eE1 347.27±2.05cC1 267.83±2.57dD1 487.00±15.39bB1 668.13±1.03aA1 266.53±4.11dD精氨酸(Arg)1 152.10±10.78eE1 566.20±9.24dD1 587.60±18.47dD1 937.97±42.59bB1 841.23±5.64cC2 041.50±23.09aA苏氨酸(Thr)769.23±36.43eE1 242.83±135.99dD1 365.67±51.32cC1 588.43±61.02bB1 558.83±12.83bB1 694.63±6.67aA丙氨酸(Ala)1 463.13±1.03dD2 211.37±8.72cC2 269.37±6.67cC2 747.60±12.32aA2 618.63±8.72bB2 795.60±12.32aA脯氨酸(Pro)747.37±6.67eE1 077.93±7.18dD1 153.90±79.77cC1 578.07±8.21bB1 203.63±52.86cC1 710.40±27.71aA酪氨酸(Tyr)483.87±16.42fF837.83±12.83eE864.73±2.05dD942.87±14.37cC980.40±3.08bB1 006.47±19.50aA缬氨酸(Val)670.67±102.63cC1 061.47±4.11bB1 117.13±1.03bB1 200.37±22.07aA1 267.27±13.34aA1 212.13±1.03aA甲硫氨酸(Met)1 077.50±115.46eE1 230.67±10.26dD1 378.40±67.11cC1 440.17±83.53bB1 521.53±26.68aA1 440.03±3.59bB异亮氨酸(Ile)574.10±10.78fF1 061.20±6.16eE1 103.47±11.29dD1 146.47±4.11cC1 251.60±27.71aA1 206.93±7.18bB亮氨酸(Leu)1 610.57±15.91fF2 660.97±11.80eE2 720.73±2.05dD3 053.93±22.58cC3 132.87±1.03bB3 238.17±33.36aA苯丙氨酸(Phe)1 185.73±17.45dD1 677.57.±31.30cC1 720.27±13.34cC2 114.17±187.30aA1 915.80±6.16bB1 869.77±5.64bB赖氨酸(Lys)1 424.50±161.65dD1 987.17±17.96cC2 007.10±20.01cC2 406.17±43.62abB2 348.00±1.00bB2 489.03±11.80aA必需氨基酸8 052.17±60.23eE9 604.41±44.83dD12 680.60±24.78cC14 436.71±59.49bB15 482.90±10.31aA14 417.22±10.27bB非必需氨基酸11 145.17±39.44fF16 706.29±38.23eE18 045.16±42.98dD21 414.21±33.09bB20 604.96±12.57cC22 513.97±7.91aA总量19 197.34±50.54fF28 297.87±40.16eE30 725.76±35.56dD35 850.92±46.80cC36 087.86±11.21bB36 931.19±9.24aA
2.8 干腌牛肉加工中品质形成与蛋白质降解的相关性关系
图5-a为干腌牛肉加工过程中色度、质构与蛋白质变化的主成分分析图,由第1主成分66.5%和第2主成分15.4%解释了总变异81.9%,表明PC1、PC2提取了干腌牛肉加工中蛋白质降解变化与品质的主要特征。由图5-a可知,硬度、咀嚼性、黏聚性、黏性、巯基、羰基主要位于PC1上,而肌浆蛋白β-折叠,肌原纤维蛋白β-转角、β-折叠、α-螺旋主要在PC2上。干腌牛肉加工过程中品质贡献率最大的是成熟期的硬度、咀嚼性、肌浆蛋白羰基和腌制期的肌浆蛋白β-转角,而发酵中期的黏聚性、肌浆蛋白无规卷曲贡献率次之。此外,6个聚类分布在不同的区域表明色泽、质构及蛋白质降解变化在干腌牛肉加工的不同时期具有显著差异性。

a-主成分分析;b-相关性分析
图5 干腌牛肉加工中品质与蛋白质降解指标主成分分析和相关性分析
Fig.5 Principal component analysis and correlation analysis of quality and protein degradation indexes
during the processing of dry-cured beef
干腌牛肉加工过程中色度、质构与蛋白质氧化指标、结构变化间相关性关系如图5-b所示,干腌牛肉加工中的品质形成过程与蛋白质变化具有显著相关性。产品色度与黏性、巯基含量、SP β-转角呈极显著正相关(P<0.01),而与硬度、咀嚼性、黏聚性、胶着性、回弹性、羰基含量、MP α-螺旋呈极显著负相关(P<0.01),表明加工过程中蛋白质氧化改变了蛋白质结构,使产品的光散射作用以及肌红蛋白存在状态改变,色泽发生变化,进而影响干腌牛肉的感官品质。硬度与咀嚼性、胶着性、回弹性、羰基含量、SP α-螺旋呈极显著正相关(P<0.01),与色度、黏性、巯基含量、SP β-转角呈极显著负相关(P<0.01),咀嚼性的相关性变化与硬度相似,说明在加工过程中蛋白质降解使干腌牛肉的质构发生了复杂的变化,使肌肉的咀嚼性和口感有所提升,进而影响产品的食用品质。因此,干腌牛肉品质与蛋白质氧化及结构变化密切相关。
3 结论
本研究证实了干腌牛肉加工过程中品质变化及蛋白质氧化、变性和聚集现象。与原料期相比,干腌牛肉加工过程中蛋白质氧化持续加深,由变性聚集导致的蛋白质颗粒朝大粒径方向迁移,蛋白质二级结构向无序转变,肌浆蛋白和肌原纤维蛋白在加工过程中均发生显著降解;品质分析表明干腌牛肉硬度、咀嚼性、回复性升高增加了产品质构品质,游离氨基酸持续增加促进产品风味和滋味的形成。相关性分析说明加工中蛋白质持续氧化显著影响产品色泽的形成过程,蛋白质降解使干腌牛肉的质构发生了复杂的变化,使肌肉的咀嚼性和口感有所提升,进而提升产品的食用品质。综上,蛋白质变化对干腌牛肉品质具有密切相关性,对干腌牛肉质构、滋味、风味及色泽均产生积极促进作用。本研究为深入探讨干腌牛肉加工过程中的品质变化机理提供理论基础,为实现干腌牛肉工业化进程提供助力。
[1] SUWANDY V,CARNE A,VAN D V R,et al.Effect of pulsed electric field on the proteolysis of cold boned beef M.Longissimus lumborum and M.Semimembranosus[J].Meat Science,2015,100:222-226.
[2] LI F,YAN Q,ZOU Y F,et al.Effect of flavourzyme on proteolysis,antioxidant capacity and sensory attributes of chinese sausage[J].Meat Science,2014,98(1):34-40.
[3] PREDRAG I,TATJANA T,LJILJANA P,et al.Proteolysis and biogenic amines formation during the ripening of petrovská klobása,traditional dry-fermented sausage from northern serbia[J].Food Control,2013,30(1):69-75.
[4] ÜLKÜ D,AYLA S.Effect of processing methods and starter culture (Staphylococcus xylosus and Pediococcus pentosaceus) on proteolytic changes in Turkish sausages (sucuk) during ripening and storage[J].Meat Science,2008,80(2):345-354.
[5] 刘肖,韦诚,周才琼.发酵对酸肉蛋白质降解及酸鲜品质特征的影响[J].食品与发酵工业,2018,44(12):129-136.
LIU X,WEI C,ZHOU C Q.The effects of fermentation on protein degradation and sour and umami quality of Za-pork[J].Food and Fermentation Industries,2018,44(12):129-136.
[6] 马艳梅.羊肉火腿中蛋白质的变化规律及对其品质的影响[D].石河子:石河子大学,2014.
MA Y M.Study on the protein degradation and its impact on the quality of the dry-cured mutton ham during the processing[D].Shihezi:Shihezi University,2014.
[7] 冉丽丹,李文慧,钟媛媛,等.茶多酚-β-环糊精包合物对羊肚冷藏期间肌原纤维蛋白氧化的影响[J].食品科学,2021,42(3):227-235.
RAN L D,LI W H,ZHONG Y Y,et al.Effect of hp-β-cd/tp Inclusion complex on myofibrillar protein oxidation of lamb tripe during refrigerated storage[J].Food Science,2021,42(3):227-235.
[8] ZHANG B,FANG C D,HAO G J,et al.Effect of kappa-carrageenan oligosaccharides on myofibrillar protein oxidation in peeled shrimp (Litopenaeus vannamei) during long-term frozen storage[J].Food Chemistry,2018,245:254-261.
[9] JIA D,YOU J,HU Y,et al.Effect of CaCl2 on denaturation and aggregation of silver carp myosin during setting[J].Food Chemistry,2015,185:212-218.
[10] 邓小蓉,雷用东,卢士玲,等.蛋白质氧化对高白鲑肌浆蛋白理化特性的影响[J].食品科学,2019,40(18):22-27.
DENG X R,LEI Y D,LU S L,et al.Effect of protein oxidation on biochemical properties of coregonus peled sarcoplasmic proteins[J].Food Science,2019,40(18):22-27.
[11] 侯然,赵伟,卢士玲,等.二次杀菌对贮藏期间酱卤羊肚肌原纤维蛋白氧化、特性及结构的影响[J].食品科学,2021,42(1):124-131.
HOU R,ZHAO W,LU S L,et al.Effect of secondary pasteurization on oxidation,characterization and structures of myofibrillar proteins about sauce brine sheep stomach during storage[J].Food Science,2021,42(1):124-131.
[12] 孙为正.广式腊肠加工过程中脂质水解、蛋白质降解及风味成分变化研究[D].广州:华南理工大学,2011.
SUN W Z.Studies on lipolysis,protelysis and flavor compounds during processing of Cantonese sausage[D].Guangzhou:South China University of Technology,2011.
[13] 沙坤.新疆风干牛肉质量特征及风味形成机制的研究[D].北京:中国农业科学院,2015.
SHA K.Study on the quality characteristics and eormation mechanism for flavourin xinjiang dry cured beef[D].Beijing:Chinese Academy of Agricultural Sciences,2015.
[14] 韦诚.发酵过程中酸肉蛋白质的变化及其对食用品质的影响[D].重庆:西南大学,2018.
WEI C.Changes of sour meat protein and its effect on edible quality during fermentation[D].Chongqing:Southwest University,2018.
[15] 王嫒嫡.不同成熟时期宣威火腿品质及营养的研究[D].大连:大连工业大学,2016.
WANG Y D.Analysis on quality changes and nutritional components during Xuanwei ham ripening[D].Dalian:Dalian Polytechnic University,2016.
[16] ROBERTO B,RUBEN D,MIRIAN P,et al.Physicochemical changes of semimembranosus muscle during the processing of dry-cured ham from celta pig.Effect of crossbreeding with duroc and landrace genotypes[J].Animal Production Science,2018,58(10):1 958-1 965.
[17] LI Y Q,KONG B H,XIA X F,et al.Structural changes of the myofibrillar proteins in common carp (Cyprinus carpio) muscle exposed to a hydroxyl radical-generating system[J].Process Biochemistry,2013,48(5-6):863-870.
[18] SPAZIANI M,TORRE M D,STECCHINI M L.Changes of physicochemical,microbiological,and textural properties during ripening of Italian low-acid sausages.Proteolysis,sensory and volatile profiles[J].Meat Science,2009,81(1):77-85.
[19] 彭聪.不同成熟时期干腌火腿的品质变化及安全性研究[D].大连:大连工业大学,2015.
PENG C.The changes during dry-cured ham ripening and their potential effects on human health[D].Dalian:Dalian Polytechnic University,2015.
[20] YANG J Y,XIONG Y L.Comparative time-course of lipid and myofibrillar protein oxidation in different biphasic systems under hydroxyl radical stress[J].Food Chemistry,2018,243:231-238.
[21] AI S G,TANABE S,NISHIMURA T.Antioxidant activity of peptides obtained from porcine myofibrillar proteins by protease treatment[J].Journal of Agricultural and Food Chemistry,2003,51(12):3 661-3 667.
[22] 崔文斌,王惠惠,刘小波,等.羟自由基氧化对牦牛肉肌原纤维蛋白生化特性的影响[J].核农学报,2019(6):1 165-1 172.
CUI W B,WANG H H,LIU X B,et al.Effect of hydroxyl radical oxidation on the biochemical characteristics of myofibrillar protein of yak meat[J].Journal of Nuclear Agriculture,2019(6):1 165-1 172.
[23] SHI Y N,LI X,HUANG A X.A metabolomics-based approach investigates volatile flavor formation and characteristic compounds of the dahe black pig dry-cured ham[J].Meat Science,2019,158:107 904.
[24] SUN W Z,CUI C,ZHAO M M,et al.Effects of composition and oxidation of proteins on their solubility,aggregation and proteolytic susceptibility during processing of cantonese sausage[J].Food Chemistry,2010,124(1):336-341.
[25] ZHOU C Y,WANG C,CAI J H,et al.Evaluating the effect of protein modifications and water distribution on bitterness and adhesiveness of jinhua ham[J].Food Chemistry,2019,293:103-111.
[26] 申辉. 猪肉肌原纤维蛋白与特定风味化合物的相互作用机制研究[D].广州:华南理工大学,2019.
SHEN H.The interaction mechanism of porcine myofibrillar proteins with typical flavor compounds[D].Guangzhou:South China University of Technology,2019.
[27] ZHANG S Y,ZHANG C Y,QIAO Y,et al.Effect of flavourzyme on proteolysis,antioxidant activity and sensory qualities of cantonese bacon[J].Food Chemistry,2017,237:779-785.
[28] LIU S Y,WANG G Y,XIAO Z C,et al.1H-NMR-based water-soluble low molecular weight compound characterization and free fatty acid composition of five kinds of Yunnan dry-cured hams[J].LWT,2019,108:174-182.
[29] ZHANG D,LI H J EMARA A M,et al.Effect of in vitro oxidation on the water retention mechanism of myofibrillar proteins gel from pork muscles[J].Food Chemistry,2020,315:126 226.
[30] BALAMURUGAN S,GEMMELL C,YIN L A T,et al.High pressure processing during drying of fermented sausages can enhance safety and reduce time required to produce a dry fermented product[J].Food Control,2020,113:107 224.
[31] 穆建稳,董全,李洪军.中性蛋白酶对腊牛肉加工中蛋白质影响的研究[J].食品研究与开发,2012,33(8):14-17.
MU J W,DONG Q,LI H J.Study on effect of neutral protease to protein in the processing of dry-cured beef[J].Food Research and Development,2012,33(8):14-17.
[32] CHEN Q,LIU Q,SUN Q X,et al.Flavour formation from hydrolysis of pork sarcoplasmic protein extract by a unique LAB culture isolated from Harbin dry sausage[J].Meat Science,2015,100:110-117.