L-异亮氨酸(L-isoleucine)又称“异白氨酸”,因具有分支的甲基基团,故与L-缬氨酸和L-亮氨酸通称为“分支链氨基酸”[1]。L-异亮氨酸属于高附加值氨基酸,具有修复肌肉的功能,常被制成氨基酸输液或口服液,用于治疗肝硬化、肥胖症、昏迷等病症[2-4]。近年来,L-异亮氨酸作为抗血糖药物4-羟基异亮氨酸的合成前体受到广泛关注[5-6]。L-异亮氨酸的生产方法主要包括化学合成法、毛发提取法和发酵法[7-9],目前发酵法是其工业化生产的主要方法,生产菌株通常为谷氨酸棒杆菌,大肠杆菌亦有研究报道[10]。本文从L-异亮氨酸的生物合成途径及其代谢调控机制、L-异亮氨酸及其衍生物的代谢工程改造策略进展进行了综述,旨在为其代谢工程研究提供参考。
1 L-异亮氨酸的生物合成途径及其代谢调控机制
1.1 L-异亮氨酸的生物合成途径
由于L-异亮氨酸、L-苏氨酸、L-甲硫氨酸、L-赖氨酸等氨基酸均来源于L-天冬氨酸,故合称为天冬氨酸族氨基酸[2]。L-异亮氨酸的生物合成途径涵盖了中心代谢和分支代谢途径:葡萄糖进入细胞后经糖酵解途径(Embden-Meyerhof-Parnas pathway,EMP)和磷酸戊糖途径(hexose monophophate pathway,HMP)生成磷酸烯醇式丙酮酸和丙酮酸,在磷酸烯醇式丙酮酸羧化酶或(和)丙酮酸羧化酶的作用下发生羧化反应,生成草酰乙酸;后者在转氨酶的作用下生成L-天冬氨酸;L-天冬氨酸经10步催化反应生成L-异亮氨酸,其中涉及5个限速酶(天冬氨酸激酶、高丝氨酸脱氢酶、高丝氨酸激酶、苏氨酸脱氢酶和乙酰羟基酸合成酶);合成的L-异亮氨酸经运输载体输出至胞外,具体合成和运输途径如图1所示。由图1可知,合成1 mol L-异亮氨酸的需要1 mol L-天冬氨酸、1 moL丙酮酸、2 mol 腺嘌呤核苷三磷酸(adenosine triphosphate, ATP)和4 mol 还原力还原型辅酶Ⅱ(nicotinamide adenine dinucleotide phosphate,NADPH)。
1.2 L-异亮氨酸代谢调控
尽管谷氨酸棒杆菌和大肠杆菌的L-异亮氨酸合成途径相同,但其相关酶及其编码基因具有多样性(表1)。如前所述,草酰乙酸是合成L-异亮氨酸的前体物质,但谷氨酸棒杆菌和大肠杆菌的草酰乙酸来源有所差异:大肠杆菌中草酰乙酸主要来源于三羧酸循环及乙醛酸循环,但亦可通过磷酸烯醇式丙酮酸羧化酶的回补反应获得;而在谷氨酸棒杆菌中草酰乙酸主要通过丙酮酸羧化酶和磷酸烯醇式丙酮酸羧化酶的回补反应获得,其中丙酮酸羧化酶为主要羧化酶[11]。值得注意的是,丙酮酸羧化酶以生物素为辅酶。因此,在L-异亮氨酸发酵过程中常需要添加玉米浆、酵母粉等富含生物素的有机氮源以保证丙酮酸羧化酶的高效催化活性,同时降低L-丙氨酸、乳酸等以丙酮酸为前体的副产物[12]。

图1 L-异亮氨酸的生物合成途径及代谢调控机制
Fig.1 Biosynthesis pathway and metabolic regulation metabolism of L-isoleucine
注:Glucose,葡萄糖;Glucose-6-P,葡萄糖-6-磷酸;PEP,磷酸烯醇式丙酮酸;Pyr,丙酮酸;OAA,草酰乙酸;Asp,天冬氨酸;Asp-P,天冬氨酸磷酸;ASA,天冬氨酸-β-半醛;Hom,高丝氨酸;Hom-P,高丝氨酸磷酸;Thr,苏氨酸;α-KB,α-酮基丁酸;AHB,α-乙酰基-α-羟基丁酸;DMV,α-β-二羟基-β-甲基戊酸;KMV,α-酮基-β-甲基戊酸;AL,α-乙酰乳酸;DIV,α-β-二羟基异戊酸;KIV,α-酮基异戊酸;Ile,异亮氨酸;Val,缬氨酸;Leu,亮氨酸;Lys,赖氨酸;Met,甲硫氨酸;PHBV,3-羟基丁酸-3-羟基戊酸酯;ppc,磷酸烯醇式丙酮酸羧化酶编码基因;pyc,丙酮酸羧化酶编码基因;lysC,天冬氨酸激酶编码基因;asd,天冬氨酸半醛脱氢酶编码基因;hom,高丝氨酸脱氢酶编码基因;thrB,高丝氨酸激酶编码基因;thrC,苏氨酸合成酶编码基因;ilvA,苏氨酸脱氢酶编码基因;ilvBN,乙酰羟基酸合成酶编码基因;ilvC,二羟酸还原异构酶编码基因;ilvD,二羟酸脱水酶编码基因;ilvE,支链氨基酸转氨酶编码基因;leuA,α-异丙基苹果酸合成酶编码基因;leuB,β-异丙基苹果酸脱氢酶编码基因;leuCD;α-异丙基苹果酸异构酶编码基因;ATP,腺嘌呤核苷三磷酸;ADP,腺嘌呤核苷二磷酸;NADPH,还原型辅酶Ⅱ;NADP+,烟酰胺腺嘌呤二核苷磷酸;propionyl-coA,丙酰辅酶A;
phaABC,PHBV合成途径中的基因簇(下同)
表1 大肠杆菌和谷氨酸棒杆菌中L-异亮氨酸分支合成途径相关酶
Table 1 Enzymes involved in L-isoleucine biosynthesis in Escherichia coli and Corynebacterium glutamate
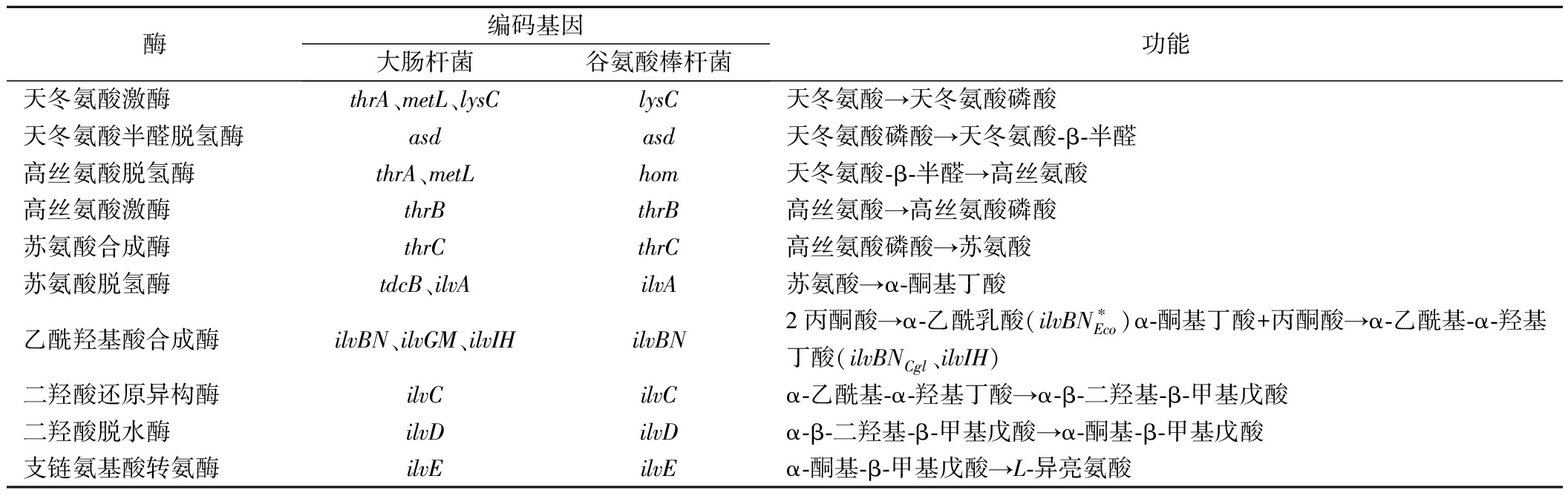
酶编码基因大肠杆菌谷氨酸棒杆菌功能天冬氨酸激酶thrA、metL、lysClysC天冬氨酸→天冬氨酸磷酸天冬氨酸半醛脱氢酶asdasd天冬氨酸磷酸→天冬氨酸-β-半醛高丝氨酸脱氢酶thrA、metLhom天冬氨酸-β-半醛→高丝氨酸高丝氨酸激酶thrBthrB高丝氨酸→高丝氨酸磷酸苏氨酸合成酶thrCthrC高丝氨酸磷酸→苏氨酸苏氨酸脱氢酶tdcB、ilvAilvA苏氨酸→α-酮基丁酸乙酰羟基酸合成酶ilvBN、ilvGM、ilvIHilvBN2丙酮酸→α-乙酰乳酸(ilvBN∗Eco)α-酮基丁酸+丙酮酸→α-乙酰基-α-羟基丁酸(ilvBNCgl、ilvIH)二羟酸还原异构酶ilvCilvCα-乙酰基-α-羟基丁酸→α-β-二羟基-β-甲基戊酸二羟酸脱水酶ilvDilvDα-β-二羟基-β-甲基戊酸→α-酮基-β-甲基戊酸支链氨基酸转氨酶ilvEilvEα-酮基-β-甲基戊酸→L-异亮氨酸
注:*,ilvBNEco和 ilvBNCgl分别为来源于大肠杆菌和谷氨酸棒杆菌的ilvBN
除L-异亮氨酸外,L-天冬氨酸还可用于合成L-赖氨酸等多种氨基酸,这些氨基酸无疑与L-异亮氨酸的合成竞争代谢流。天冬氨酸激酶(aspartate kinase,AK)是L-异亮氨酸分支合成途径中的第一个关键酶酶,该酶催化的反应需要ATP。在大肠杆菌中,存在该酶的3种同工酶,分别为AK I、AK II和AK III(分别由thrA、metL和 lysC基因编码);其中AK I和AK II为双功能酶,同时具有天冬氨酸激酶和高丝氨酸脱氢酶活性,且AK I起主要作用。此外,在大肠杆菌中thrA与高丝氨酸激酶编码基因thrB及苏氨酸合成酶编码基因thrC共同组成thrABC操纵子,该操纵子上游含有弱化子编码基因thrL。当环境中或胞内L-苏氨酸或(和)L-异亮氨酸的浓度过高时,ThrL对thrABC操纵子有弱化作用[13]。AK I和AK III受到L-苏氨酸和L-赖氨酸的协同反馈抑制,而AK II受L-甲硫氨酸的反馈阻遏[10]。然而,在谷氨酸棒杆菌中,仅含有1个天冬氨酸激酶(由lysC基因编码),该酶受到L-赖氨酸和L-苏氨酸的协同反馈抑制[9]。
高丝氨酸脱氢酶是L-异亮氨酸分支合成途径第2个关键酶,该酶需要还原力NADPH。大肠杆菌中含有由thrA和metL编码的高丝氨酸脱氢酶。而在谷氨酸棒杆菌中,仅含1个高丝氨酸脱氢酶编码基因hom,与高丝氨酸激酶编码基因thrB构成hom-thrB基因簇。该基因簇受到L-苏氨酸的反馈抑制作用和L-甲硫氨酸的反馈阻遏[14]。有报道称,thrB(A20G)可解除L-苏氨酸反馈抑制作用[15]。
苏氨酸脱氢酶和乙酰羟基酸合酶(acetohydroxyacid synthase,AHAS)是L-异亮氨酸合成途径中最关键的2个酶。其中苏氨酸脱氢酶催化L-苏氨酸合成α-酮基丁酸,往往受到L-异亮氨酸的反馈抑制[16]。大肠杆菌含有ilvA、tdcB编码的2个同工酶,而谷氨酸棒杆菌中仅含1个有由ilvA编码的苏氨酸脱氢酶。
由图1所示,L-异亮氨酸和L-缬氨酸合成均需AHAS、二羟酸还原异构酶、二羟酸脱水酶和支链氨基酸转氨酶。AHAS受L-异亮氨酸的反馈抑制作用。在大肠杆菌内共含有AHAS的3个同工酶(AHAS I、AHAS II和AHAS III,分别由ilvBN,ilvGM和ilvIH所编码)。其中AHAS I对丙酮酸的特异性较α-酮基丁酸强,因此更有利于L-缬氨酸和L-亮氨酸的合成。而编码AHAS II的ilvGM基因存在移码突变,故该酶不表达。AHAS III对α-酮基丁酸的特异性高于丙酮酸,故研究者认为该酶更有利于L-异亮氨酸的合成[10]。
而在谷氨酸棒杆菌中仅含有1种ilvBN编码的乙酰羟酸合酶[4],ilvBN与二羟酸还原异构酶编码基因ilvC组成ilvBNC操纵子。α-酮基丁酸对该操纵子有诱导作用,故当α-酮基丁酸积累时ilvBNC操纵子启动转录[17]。此外,ilvBNC操纵子上游还含有弱化子,该弱化子能够感受L-异亮氨酸、L-缬氨酸和L-亮氨酸浓度,当其积累时,弱化子对ilvBNC操纵子的转录起到弱化作用[18],其弱化调控机制如图2所示。
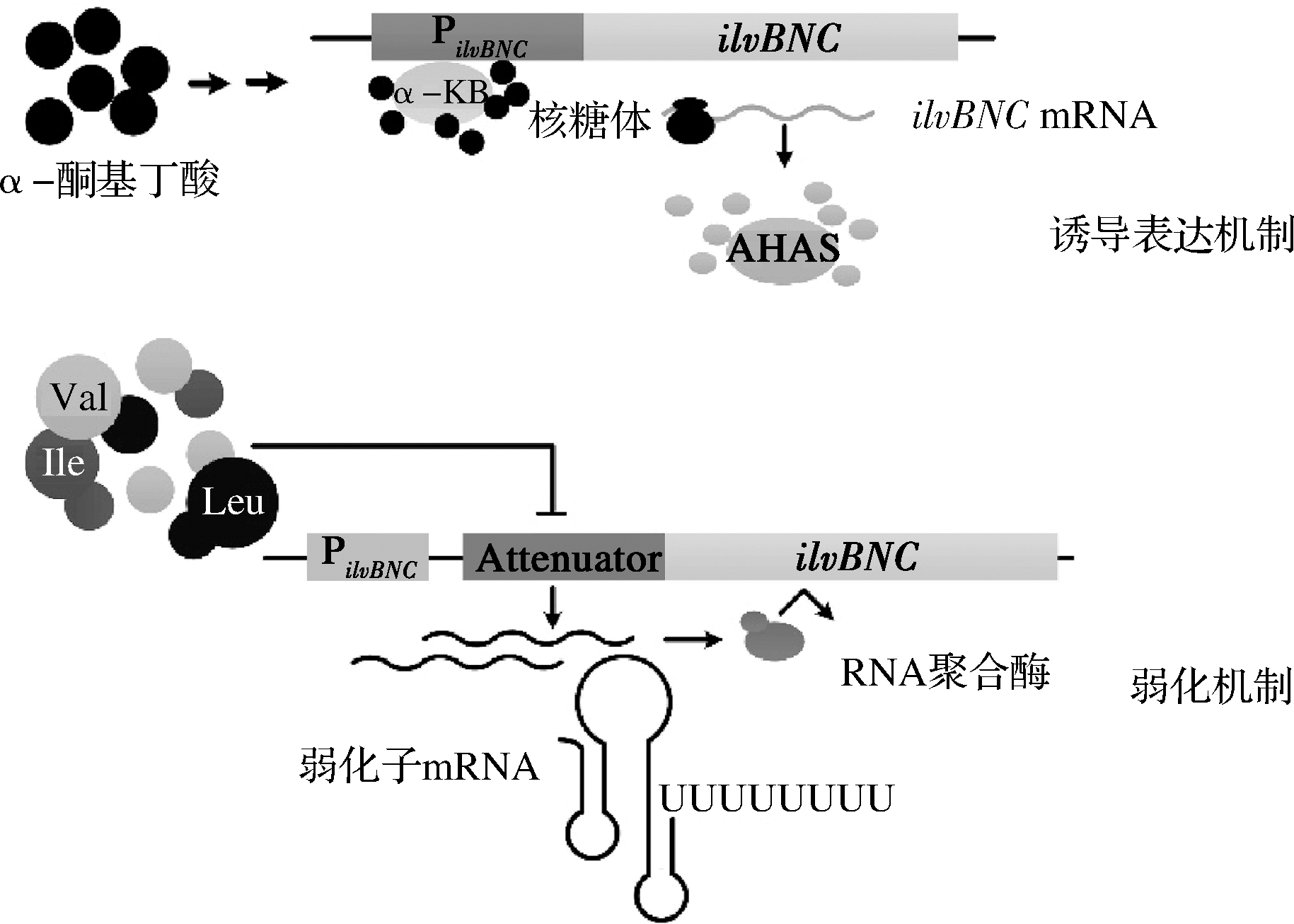
图2 谷氨酸棒杆菌ilvBNC基因的表达调控机制
Fig.2 Regulation mechanism for ilvBNC
expression in C.glutamicum
在大肠杆菌和谷氨酸棒杆菌中仅含1种ilvC编码的二羟酸还原异构酶,该酶需要还原力NADPH。此外,在大肠杆菌中二羟酸脱水酶编码基因ilvD和支链氨基酸转氨酶编码基因ilvE以及ilvGM和ilvA组成操纵子ilvGMEDA;而在谷氨酸棒杆菌中ilvD和ilvE独立存在。
L-异亮氨酸的摄入和输出均需要运输载体。在大肠杆菌中,其输出载体为ygaZH编码的YgaZH,其摄入载体分别为livJ和brnQ编码的LivJ和BrnQ[2]。而谷氨酸棒状杆菌中L-异亮氨酸的摄入和输出载体分别为brnQ和brnFE编码的BrnQ和BrnFE。除L-异亮氨酸外,BrnFE还可识别并输出L-缬氨酸和L-亮氨酸[19]。brnFE的转录受亮氨酸应答调控蛋白(leucine responsive regulatory protein,Lrp)和上述3种氨基酸的调控,当其中1种氨基酸积累时,该氨基酸可介导Lrp激活brnFE的转录。
2 L-异亮氨酸合成途径的代谢工程改造
依据L-异亮氨酸的生物合成途径及其代谢调控机制,其代谢工程改造策略主要包括:(1) 解除代谢物对关键酶的反馈作用;(2) 切断或弱化支路代谢途径;(3) 修饰转运系统;(4) 增强辅助因子的供应(表2)。
2.1 解除代谢物对关键酶的反馈作用
天冬氨酸激酶、高丝氨酸脱氢酶、高丝氨酸激酶、苏氨酸脱氢酶及乙酰羟基酸合成酶是L-异亮氨酸合成途径的关键酶,受相应代谢物的反馈抑制或(和)反馈阻遏。故欲过量积累L-异亮氨酸,首先应解除代谢物对关键酶的反馈作用,以疏通其合成代谢流。
表2 L-异亮氨酸代谢途径改造策略汇总
Table 2 Summary of L-isoleucine metabolic pathway modification strategies

底盘细胞方法发酵规模(周期)L-异亮氨酸产量/(g·L-1)转化率/%生产强度/[g·(L·h)-1]参考文献C.glutamicum过表达lysCA279T、homG378S-thrB、ilvBNP176S/D426E/L575 W、ilvAF383V摇瓶 (72 h)3.5-0.049[9]过表达ilvAV323A和homG378E3 L罐 (78 h)14.313.70.183[20]敲除Δala基因、过表达thrABC操纵子3 L罐 (72 h)15.4-0.214[21]过表达ilvBNI47Y、ppnKP57/P117S、lrp及 brnFE5 L罐 (72 h)32.118.10.446[24]过表达全局调控因子Lrp及输出载体BrnEF3 L罐 (72 h)26.912.20.374[28]敲除ΔbrnQ、过表达 brnFE5 L罐 (60 h)29.024.00.483[29]过表达核糖体延伸因子FusA和循环因子Frr编码基因3 L罐 (72 h)28.513.90.360[30]过表达gnd、fbp、pgl基因3 L罐 (96 h)29.013.80.302[32]E.coli过表达thrABC、ilvA、ilvIH、ygaZH、ilvCED及lrp6.6L罐 (60 h)9.514.00.158[10]过表达thrABC、lysC、ilvGMEDA基因摇瓶 (24 h)12.0-0.500[42]
注:-,未见报道
天冬氨酸激酶受L-赖氨酸和L-苏氨酸的反馈抑制,1 mmol L-苏氨酸可抑制酶活力41%、1 mmol L-赖氨酸可抑制酶活力45%,当二者同时存在时可抑制酶活力82%[9]。lysC突变体(lysCA279T)可解除该反馈抑制作用,过表达突变体可使L-苏氨酸的产量增加80%[9]。此外,亦有文献报道通过减弱L-赖氨酸的积累部分解除其对天冬氨酸激酶的反馈抑制作用[20]。高丝氨酸脱氢酶受L-苏氨酸反馈抑制,目前已报道多个解除该反馈抑制作用的高丝氨酸脱氢酶突变体。如homG378S和homG378E均可不同程度地解除反馈抑制作用,过表达homG378S和homG378E使L-苏氨酸产量由0.09 g/L和0 g/L分别提高至3.62 g/L和4.6 g/L[9,20]。WANG等[21]利用L-异亮氨酸生产菌C.glutamicum YILW 过表达来源于大肠杆菌解除反馈抑制作用的thrABC操纵子后,L-异亮氨酸产量达到13.8 g/L,提高5.3%。GUILLOUET等[22]通过过表达解除反馈抑制的高丝氨酸激酶和苏氨酸脱氢酶使得L-异亮氨酸产量达到2.2 g/L,提高5倍。
苏氨酸脱氢酶受L-异亮氨酸的反馈抑制,目前已报道的多个突变体ilvAV140M、ilvAF383A、ilvAV140M/F383A均可不同程度地解除其反馈抑制,过表达这些突变体可使L-异亮氨酸产量(0.55、0.63和0.73 g/L)分别提高17%、34%、55.3%[16]。过表达ilvAV323A突变体使L-异亮氨酸提高到1.18 g/L[20]。此外,异源表达苏氨酸脱氢酶也可解除L-异亮氨酸的反馈抑制作用。GUILLOUET等[23]在谷氨酸棒杆菌中过表达来源于大肠杆菌tdcB基因,当反应体系中L-异亮氨酸浓度达到26.2 g/L时仍保留60%的初始酶活,L-异亮氨酸产量达到2.5 g/L,较出发菌株提高50倍。
乙酰羟基酸合成酶受L-异亮氨酸反馈抑制作用,已发现的突变体ilvBNI47Y和ilvBNP176S/D426E/L575 W均可不同程度地解除其反馈抑制作用。过表达ilvBNI47Y和ilvBNP176S/D426E/L575 W可使L-异亮氨酸产量分别达到22.7和4.17 g/L,提高10%和67.5%[24-25]。
2.2 切断或弱化支路代谢途径
天冬氨酸族氨基酸生物合成途径中,代谢流在经天冬氨酸-β-半醛和L-高丝氨酸后分别流向L-赖氨酸和L-甲硫氨酸等分支途径。切断或弱化L-赖氨酸和L-甲硫氨酸等分支途径,可有效提高L-异亮氨酸产量和转化率并降低副产物的积累。敲除L-丙氨酸合成基因alaT可降低L-丙氨酸的积累并促使丙酮酸流向草酰乙酸。WANG等[21]敲除该基因使得L-异亮氨酸产量达到15.4 g/L,提高17.6%,L-丙氨酸浓度有所降低[24]。ZHANG等[24]敲除该基因L-异亮氨酸产量达到18.8 g/L,提高1.6%。DONG等[26]敲除二氢二醇脱氢酶编码基因ddh后使得L-赖氨酸积累量降低30%,L-异亮氨酸产量达3.81 g/L,提高8%。
2.3 修饰转运系统
当胞内L-异亮氨酸积累达到一定浓度后,由输出载体运输至胞外。L-异亮氨酸合成的最后一步转氨反应为可逆反应,因此将积累的L-异亮氨酸及时输出可促进该转氨反应,并可解除其对关键酶的反馈抑制作用[27]。此外,摄入载体BrnQ可将胞外的L-异亮氨酸运输至胞内,不利于其高效积累[19]。
YIN等[28]通过在谷氨酸棒杆菌中过表达转录调控因子Lrp和输出载体BrnFE编码基因使得L-异亮氨酸产量达到26.9 g/L,增加63%。XIE等[29]过表达brnFE使得L-异亮氨酸产量达到25.9 g/L,提高24.9%,在此基础上敲除摄入载体编码基因brnQ使得L-异亮氨酸产量达到29.0 g/L,提高28%。然而,ZHANG等[24]敲除brnQ基因后L-异亮氨酸产量达到20 g/L,提高6%。PARK等[10]在大肠杆菌内中过表达输出载体编码基因ygaZH,使得L-异亮氨酸产量达到1.11 g/L,较出发菌株(0.322 g/L)提高2.45倍。
另外,研究表明核糖体延伸因子(由fusA编码)和循环因子(由frr编码)可促进转运蛋白合成。单独过表达或共表达这2种因子后,L-异亮氨酸产量分别达到10.4(过表达fusA)、10.1(过表达frr)和10.9 g/L(过表达fusA-frr),较出发菌株提高了40.5%、36.4%、47.2%[30]。
2.4 增强辅助因子的供应
合成1 mol L-异亮氨酸需要4 mol NADPH,该途径中hom、asd、ilvC和ilvE等基因编码的酶均需要NADPH作为辅酶。增加NADPH的供应常用策略是增强NADPH相关合成酶的表达水平,如葡萄糖-6-磷酸脱氢酶(由zwf编码)和NAD激酶(由ppnk编码)等。SHI等[31]分别单独过表达及共表达zwf和ppnk,发现均能提高胞内NADPH的浓度和L-异亮氨酸产量,而二者共表达效果最佳,使得L-异亮氨酸产量达到4.10 g/L,提高85.9%。ZHANG等[24]通过过表达ppnk使得L-异亮氨酸产量达到21.6 g/L,提高4.9%。MA等[32]通过过表达HMP途径关键酶编码基因gnd、pgl和fbp增强该途径代谢流以增加NADPH的供应,经发酵L-异亮氨酸产量达到28.97 g/L,提高24.9%。
3 L-异亮氨酸衍生物的生物合成
常见L-异亮氨酸衍生物包括4-羟基异亮氨酸(4-hydroxyisoleucine,4-HIL)和3-羟基丁酸-3-羟基戊酸酯(3-hydroxybutyrate-co-3-hydroxyvalerate,PHBV),目前均已实现其生物合成。
3.1 4-HIL的生物合成
4-HIL具有葡萄糖浓度依赖的促进胰岛素分泌的活性,对I型和II型糖尿病动物均具有治疗效果[33]。此外,4-HIL还具有增强肌细胞对血糖吸收、促进脂肪代谢、降血脂以及保护肝功能等作用[34]。4-HIL生物合成是以L-异亮氨酸、α-酮戊二酸和O2为底物,由异亮氨酸羟化酶(isoleucine dioxygenase,IDO,由ido基因编码)催化生成[35]。KIVERO等[36]将ido转化至大肠杆菌并在发酵过程中添加L-异亮氨酸,实现前体物添加法合成4-HIL,优化条件下产量为163.0 mmol/L。SHI等[37-38]利用谷氨酸棒杆菌过表达ido,在优化条件下经144 h发酵,最高产量达到95.7 mmol/L。ZHANG等[39]在L-异亮氨酸生产株C.glutamicum YI内构建4-HIL合成途径,通过增强羧化途径和三羧酸循环代谢流,并弱化乙醛酸循环以及丙酮酸和谷氨酸合成代谢流,显著提高了4-HIL的产量。同时,采用基于L-异亮氨酸浓度的α-酮戊二酸脱氢酶活性动态调控策略调节三羧酸循环代谢流量,实现了α-酮戊二酸和L-异亮氨酸代谢的动态平衡以及4-HIL的高效合成。经64 h发酵后4-HIL产量、单位菌体产量、转化率及发酵强度分别达到34.21 g/L、1.87 g/g DCW、15%和0.53 g/(L·h)。
3.2 PHBV的生物合成
PHBV由3-羟基戊酸辅酶A和3-羟基丁酸辅酶A缩合而成,具有短时间内可降解性,被公认为“绿色塑料”。其中3-羟基戊酸辅酶A前体物丙酰辅酶A主要来源于L-异亮氨酸合成前体α-酮基丁酸[40]。MA等[41]通过在L-异亮氨酸生产菌C.glutamicum WM001中表达关键酶编码基因phaA、phaB和phaC构建了PHBV合成途径。获得的重组菌株WM001/pDXW-8-phaCAB实现L-异亮氨酸和PHBV联产,产量分别为15和29.8 g/L。
4 展望
L-异亮氨酸作为8种必需氨基酸之一,在医药、化妆品、食品等领域应用广泛,其衍生物种类和应用也在不断拓展。尽管L-异亮氨酸已实现大规模生产,但与L-色氨酸等必需氨基酸相比成本较高,限制了其在饲料等领域的应用。究其原因主要是菌种产量和转化率低、发酵周期长、菌株遗传稳定性差、发酵过程控制精细程度不高等问题。针对上述问题,今后的工作应聚焦于以下方面:(1) 采用适应性进化或常压室温等离子体诱变结合高通量筛选等技术,选育稳定性和环境耐受性强等性状优良的底盘细胞;(2) 基于多组学手段分析L-异亮氨酸代谢流量,根据系统生物学及合成生物学理论和技术,筛选解除反馈抑制且活性无损失或低损失的关键酶突变体,挖掘和运用底物或(中间)产物偶联的基因回路动态调节关键节点,实现高效产酸和生长的平衡;(3) 基于代谢流定量分析,结合生产菌株代谢特性,进一步挖掘影响L-异亮氨酸合成的限制因子,优化L-异亮氨酸发酵条件和过程控制,同时深入了解L-异亮氨酸发酵参数和生理状态的联系,实现发酵过程的智能控制,提高发酵的稳定性。
[1] 陈宁.氨基酸工艺学[M].第二版.北京:中国轻工业出版社,2020.
CHEN N.Amino acid technology[M].Second Edition.Beijng:China Light Industry Press,2020.
[2] LI Y J,WEI H B,WANG T,et al.Current status on metabolic engineering for the production of L-aspartate family amino acids and derivatives[J].Bioresource Technology,2017,245(Pt B):1 588-1 602.
[3] GU C S,MAO X B,CHEN D W,et al.L-isoleucine plays an important role for maintaining immune function[J].Current Protein Peptide Science,2019,20(7):644-651.
[4] BECKER J,GIESSELMANN G,HOFFMANN S L,et al.Corynebacterium glutamicum for sustainable bioproduction:From metabolic physiology to systems metabolic engineering[J].Advances Biochemical Engineer Biotechnology,2018,162:217-263.
[5] KORTHIKUNTA V,PANDEY J,SINGH R,et al.In vitro anti-hyperglycemic activity of 4-hydroxyisoleucine derivatives[J].Phytomedicine,2015,22(1):66-70.
[6] ZHANG C L,MA J,LI Z X,et al.A strategy for L-isoleucine dioxygenase screening and 4-hydroxyisoleucine production by resting cells[J].Bioengineered,2018,9(1):72-79.
[7] D’ESTE M,ALVARADO-MORALES M,ANGELIDAKI I.Amino acids production focusing on fermentation technologies-A review[J].Biotechnology Advances,2018,36(1):14-25.
[8] YAMAMOTO K,TSUCHISAKA A,YUKAWA H.Branched-chain amino acids[J].Advances Biochemical Engineer Biotechnology,2017,159:103-128.
[9] DONG X Y,ZHAO Y,ZHAO J X,et al.Characterization of aspartate kinase and homoserine dehydrogenase from Corynebacterium glutamicum IWJ001 and systematic investigation of L-isoleucine biosynthesis[J].Journal of Industrial Microbiology and Biotechnology,2016,43(6):873-885.
[10] PARK J H,OH J E,LEE K H,et al.Rational design of Escherichia coli for L-isoleucine production[J].ACS Synthetic Biology,2012,1(11):532-540.
[11] YOKOTA A,SAWADA K,WADA M.Boosting anaplerotic reactions by pyruvate kinase gene deletion and phosphoenolpyruvate carboxylase desensitization for glutamic acid and lysine production in Corynebacterium glutamicum[J].Advances in Biochemical Engineering-Biotechnology,2017,159:181-198.
[12] 朱福周, 芦楠,李宇虹.增强回补途径对谷氨酸棒状杆菌合成L-异亮氨酸的影响[J].食品与发酵工业,2020,46(2):11-17.
ZHU F,LU N,LI Y.Comparing effects of enhancing anaplerotic pathways on L-isoleucine production performance by Corynebacterium glutamicum YI[J].Food and Fermentation Industries,2020,46(2):11-17.
[13] ZHAO L,LU Y,YANG J,et al.Expression regulation of multiple key genes to improve L-threonine in Escherichia coli [J].Microbial Cell Factories,2020,19(1):46.
[14] QIN T,HU X Q,HU J Y,et al.Metabolic engineering of Corynebacterium glutamicum strain ATCC13032 to produce L-methionine[J].Biotechnology and Applied Biochemistry,2015,62(4):563-573.
[15] PETIT C,KIM Y,LEE S K,et al.Reduction of feedback inhibition in homoserine kinase (ThrB) of Corynebacterium glutamicum enhances L-threonine biosynthesis[J].ACS Omega,2018,3(1):1 178-1 186.
[16] GUO Y,XU J,HAN M,et al.Generation of mutant threonine dehydratase and its effects on L-isoleucine synthesis in Corynebacterium glutamicum[J].World Journal of Microbiology and Biotechnology,2015,31(9):1 369-1 377.
[17] 张海灵, 李颜颜,王小元.代谢工程改造谷氨酸棒状杆菌合成及分泌途径生产L-缬氨酸[J].生物工程学报,2018,34(10):1 606-1 619.
ZHANG H,LI Y,WANG X.Metabolic engineering of L-valine synthesis and secretory pathways in Corynebacterium glutamicum for higher production[J].Chinese Journal of Biotechnology,2018,34(10):1 606-1 619.
[18] MORBACH S,JUNGER C,SAHM H,et al.Attenuation control of ilvBNC in Corynebacterium glutamicum:evidence of leader peptide formation without the presence of a ribosome binding site[J].Journal of Bioscience and Bioengineering,2000,90(5):501-507.
[19] ZHANG H L,LI Y Y,WANG C H,et al.Understanding the high L-valine production in Corynebacterium glutamicum VWB-1 using transcriptomics and proteomics[J].Scientific Reports,2018,8(1):3 632.
[20] VOGT M,KRUMBACH K,BANG W G,et al.The contest for precursors:Channelling L-isoleucine synthesis in Corynebacterium glutamicum without byproduct formation[J].Applied Microbiology and Biotechnology,2015,99(2):791-800.
[21] WANG J,WEN B,WANG J,et al.Enhancing (L)-isoleucine production by thrABC overexpression combined with alaT deletion in Corynebacterium glutamicum[J].Applied Biochemistry and Biotechnology,2013,171(1):20-30.
[22] GUILLOUET S,RODAL A,AN G H,et al.Metabolic redirection of carbon flow toward L-isoleucine by expressing a catabolic threonine dehydratase in a threonine-overproducing Corynebacterium glutamicum [J].Applied Microbiology and Biotechnology,2001,57(5-6):667-673.
[23] GUILLOUET S,RODAL A A,AN G,et al.Expression of the Escherichia coli catabolic threonine dehydratase in Corynebacterium glutamicum and its effect on L-isoleucine production[J].Applied and Environmental Microbiology,1999,65(7):3 100-3 107.
[24] ZHANG Y,LIU Y,ZHANG S,et al.Metabolic engineering of Corynebacterium glutamicum WM001 to improve L-isoleucine production[J].Biotechnology and Applied Biochemistry,2020.DOI:10.1002/bab.1963.
[25] YIN L,HU X,XU D,et al.Co-expression of feedback-resistant threonine dehydratase and acetohydroxy acid synthase increase L-isoleucine production in Corynebacterium glutamicum [J].Metabolic Engineering,2012,14(5):542-550.
[26] DONG X Y,ZHAO Y,HU J Y,et al.Attenuating L-lysine production by deletion of ddh and lysE and their effect on L-threonine and L-isoleucine production in Corynebacterium glutamicum[J].Enzyme and Microbial Technology,2016,93-94:70-78.
[27] MA W J,WANG J L,LI Y,et al.Cysteine synthase A overexpression in Corynebacterium glutamicum enhances L-isoleucine production[J].Biotechnology and Applied Biochemistry,2019,66(1):74-81.
[28] YIN L,SHI F,HU X,et al.Increasing L-isoleucine production in Corynebacterium glutamicum by overexpressing global regulator Lrp and two-component export system BrnFE[J].Journal of Applied Microbiology,2013,114(5):1 369-1 377.
[29] XIE X X,XU L L,SHI J M,et al.Effect of transport proteins on L-isoleucine production with the L-isoleucine-producing strain Corynebacterium glutamicum YILW[J].Journal of Industrial Microbiology and Biotechnology,2012,39(10):1 549-1 556.
[30] ZHAO J X,HU X Q,LI Y,et al.Overexpression of ribosome elongation factor G and recycling factor increases L-isoleucine production in Corynebacterium glutamicum[J].Applied Microbiology and Biotechnology,2015,99(11):4 795-4 805.
[31] SHI F,LI K,HUAN X J,et al.Expression of NAD(H) kinase and glucose-6-phosphate dehydrogenase improve NADPH supply and L-isoleucine biosynthesis in Corynebacterium glutamicum ssp. lactofermentum[J].Applied Biochemistry and Biotechnology,2013,171(2):504-521.
[32] MA W J,WANG J L,LI Y,et al.Enhancing pentose phosphate pathway in Corynebacterium glutamicum to improve L-isoleucine production[J].Biotechnology and Applied Biochemistry,2016,63(6):877-885.
[33] SHI F,ZHANG S P,LI Y F,et al.Enhancement of substrate supply and ido expression to improve 4-hydroxyisoleucine production in recombinant Corynebacterium glutamicum ssp.lactofermentum[J].Applied Microbiology and Biotechnology,2019,103(10):4 113-4 124.
[34] TAN S,SHI F,LIU H,et al.Dynamic control of 4-hydroxyisoleucine biosynthesis by modified L-isoleucine biosensor in recombinant Corynebacterium glutamicum[J].ACS Synthetic Biology,2020,9(9):2 378-2 389.
[35] SHI F,ZHANG M L,LI Y F,et al.Sufficient NADPH supply and pknG deletion improve 4-hydroxyisoleucine production in recombinant Corynebacterium glutamicum[J].Enzyme and Microbial Technology,2018,115:1-8.
[36] KIVERO A D,NOVIKOVA A E,SMIRNOV S V.Modification of E.coli central metabolism to optimize the biotransformation of L-isoleucine into 4-hydroxyisoleucine by enzymatic hydroxylation[J].Applied Microbiology and Biotechnology,2012,48(7):639-644.
[37] SHI F,NIU T F,FANG H M.4-Hydroxyisoleucine production of recombinant Corynebacterium glutamicum ssp.lactofermentum under optimal corn steep liquor limitation[J].Applied Microbiology and Biotechnology,2015,99(9):3 851-3 863.
[38] SHI F,FANG H M,NIU T F,et al.Overexpression of ppc and lysC to improve the production of 4-hydroxyisoleucine and its precursor L-isoleucine in recombinant Corynebacterium glutamicum ssp. lactofermentum[J].Enzyme and Microbial Technology,2016,87-88:79-85.
[39] ZHANG C L,LI Y J,MA J,et al.High production of 4-hydroxyisoleucine in Corynebacterium glutamicum by multistep metabolic engineering[J].Metabolic Engineering,2018,49:287-298.
[40] JEON J M,KIM H J,BHATIA S K,et al.Application of acetyl-CoA acetyltransferase (AtoAD) in Escherichia coli to increase 3-hydroxyvalerate fraction in poly (3-hydroxybutyrate-co-3-hydroxyvalerate)[J].Bioprocess and Biosystems Engineering,2017,40(5):781-789.
[41] MA W J,WANG J L,LI Y,et al.Poly (3-hydroxybutyrate-co-3-hydroxyvalerate) co-produced with L-isoleucine in Corynebacterium glutamicum WM001[J].Microbial Cell Factory,2018,17(1):93.
[42] HASHIGUCHI K,MATSUI H,KURAHASHI O.Effects of a feedback-resistant aspartokinase III gene on L-isoleucine production in Escherichia coli K-12[J].Bioscience Biotechnology and Biochemistry,1999,63(11):2 023-2 024.