金柑(Fortunella),属芸香科(Rutaceae)柑橘亚科(Aurantioideae)柑橘族(Citreae)柑橘亚族(Citrinae)真正柑橘类植物(true citrus fruit trees),原产于我国,在广西融安、阳朔,福建尤溪,湖南浏阳、蓝山等地广泛种植,包括山金柑(F.hindsii Swingle)、罗浮(F.margarita Swingle)、罗纹(F.japonica Swingle)、长叶金柑(F.polyandra Tanaka)、金弹(F.crassifolia Swingle)和长寿金柑(F.obovata Tanaka)等品种。其中,金弹、罗浮、罗纹和山金柑常用于鲜食和加工,长寿金柑多用于盆景观赏[1-3]。金柑果实味道香甜,皮肉可同食,含有丰富的维生素、矿物质、有机酸等营养物质及类黄酮、酚酸等次生代谢产物[4-5]。金柑具有健胃理气、止咳化痰的功效,果实提取物具有抗氧化、消炎、抗癌、抗菌等生理功能[6-10]。这些健康功能与次生代谢产物有着密切的联系。
金柑虽为柑橘族植物,但是在类黄酮的种类和含量上与柚、橙、宽皮柑橘等柑橘具有明显的差异[11-12],除橙皮苷、野漆树苷等常见类黄酮,金柑还含有独特的类黄酮,如金柑苷、根皮素-3′,5′-二-C-葡萄糖苷等。LOU等[13]在未熟金柑的水提取物中鉴定出7种类黄酮,郑洁[14]检测了金柑果实中的9种类黄酮,但这些研究中涉及的类黄酮种类较少。此外,香豆素和生物碱也是柑橘中重要的次生代谢产物[15-17],柚类黄皮层和白皮层中的香豆素,枳实、枳壳中的生物碱也常被研究鉴定[18],不同种类金柑中香豆素、生物碱的筛查与研究却不多。柠檬苦素和诺米林作为柑橘中2种重要的类柠檬苦素,也是影响柑橘苦味的重要物质[19],孟鹏[20]曾在研究中优化了提取、纯化和检测柠檬苦素的方法。综上所述,现阶段对金柑中的次生代谢产物测定的种类和数量偏少,需要更全面与系统的研究。
为进一步探索不同种类金柑的价值,本研究基于超高效液相色谱串联三重四级杆质谱法(ultra-performance liquid chromatography tandem triple quaternary mass spectrometry, UPLC-QqQ-MS/MS)对金柑果实中次生代谢产物进行筛查和定量,次生代谢产物包括31种类黄酮,8种酚酸,3种类柠檬苦素,5种生物碱和19种香豆素。通过统计、聚类分析对6种金柑中的66种次生代谢产物进行综合分析,研究不同种类金柑间次生代谢产物的差异,为金柑果实在食品加工、医药等领域的深入研究提供参考和依据。
1 材料与方法
1.1 样品材料
本研究中采用的金柑果实均于2019年12月上旬采摘自中国农业科学院柑橘研究所国家柑橘种质资源圃(29°83′N,106°43′E)。在长势相近的果树的不同方位均匀地采摘成熟、大小适宜、无病虫害的金柑果实。采摘后的金柑果实用超纯水清洗,擦干,制备鲜样,密封避光存于 -20 ℃冰箱备用。样品信息和图片如表1和图1所示。
表1 6种金柑果实信息
Table 1 Information of six kumquat fruits

序号材料名称种名资源圃编号1温州罗浮罗浮F.margarita (Lour.) SwingleLF00022融安金弹金弹F.crassifolia SwingleLF00063宁波罗纹罗纹F.japonica SwingleLF00304金豆山金柑F.hindsii SwingleLF00205长寿金柑长寿金柑F.obovata TanakaLF00106金柑杂种长寿金柑F.obovata TanakaLF0032

a- 温州罗浮;b- 融安金弹;c- 宁波罗纹;
d- 金豆;e- 长寿金柑;f- 金柑杂种
图1 六种金柑果实的样品图
Fig.1 Pictures of six kumquat fruits
1.2 标准物质与试剂
甲酸(色谱纯),上海吉至生化科技有限公司。
本研究使用66种标准物质,包括31种类黄酮、8种酚酸、3种类柠檬苦素、5种生物碱、19种香豆素。标准物质的纯度和供应商信息如下:牡荆素鼠李糖苷(98.07%)、野漆树苷(98.48%)、金合欢素(99.44%)、甜橙黄酮(98%)、川陈皮素(99.71%)、桔皮素(98.49%)、芦丁(99.05%)、芸香柚皮苷(99.38%)、柚皮苷(98.55%)、橙皮苷(97.06%)、新橙皮苷(98.76%)、香蜂草苷(99.3%)、枸橘苷(98.4%)、橙皮素(98.6%)、根皮素(98.9%)、原儿茶酸(98.12%)、对羟基苯甲酸(99.9%)、咖啡酸(99.28%)、香草酸(98.8%)、p-香豆酸(99.84%)、芥子酸(98%)、阿魏酸(99.95%),上海安谱实验科技股份有限公司;半齿泽兰素-5-甲醚(95%)、异橙皮内酯(98%)、欧前胡素(99%)、异欧前胡素(99%),上海源叶生物技术有限公司;维采宁-2、斯皮诺素、地奥司明、新地奥司明、香叶木素、5,7,3′,4′-四甲氧基黄酮、3′,4′,5,5′,6,7-六甲氧基黄酮、蔓荆子黄素、5-降甲基蜜桔黄素、5-羟基-7,8,4′-三甲氧基黄酮、香蒲新苷、异鼠李素-3-O-新橙皮苷、新圣草枸橼苷、甲基橙皮苷、柚皮素、柠檬苦素、诺米林、甜菜碱、东莨菪亭、异补骨脂素,纯度均大于98%,成都克洛玛生物科技有限公司;黄柏酮、绿原酸、柠檬内酯(98.2%)、香柑醇、花椒毒素、佛手柑内酯,纯度均大于98%,北京金谛泽浩科技有限公司;大麦芽碱(97.5%)、酪胺(98.5%)、橙皮内酯水合物(90%)、橙皮油素(98.5%)、6′,7′-二羟基香柠檬亭(97.8%)、6′,7′-环氧香柠檬亭(95.1%)、甲醇、乙腈(色谱纯),Sigma-Aldrich (USA);N-甲基酪胺(99.5%)、滨蒿内酯(95%)、5-牻牛儿醇基-7-甲氧基香豆素(99.9%)、8-牻牛儿醇基补骨脂素(98.5%)、香柠檬素(96.9%)、补骨脂素(99.1%),ChromaDex (USA);章鱼胺(99.3%)、伞形花内酯(99%),Dr.Ehrenstorfer GmbH (Germany)。所有标准物质均使用甲醇配制,存于 -80 ℃冰箱。标准物质混合溶液(下文中简称“混标”)中所有酚酸类物质的质量浓度为400 μg/L,章鱼胺的质量浓度为1 000 μg/L,其他标准物质质量浓度为100 μg/L。
1.3 仪器设备
KQ5200DE 超声波清洗仪,昆山市超声仪器有限公司;Milli-Q Advantage A10 超纯水机,Millipore (USA);3K15 高速冷冻离心机,Sigma-Aldrich (USA);PB3002-S/FACT 分析天平,Mettler Toledo (Switzerland);有机相针式滤器 (13 mm,0.22 mm),上海安谱实验科技股份有限公司;Acquity UPLC HSS T3色谱柱,Waters (USA);Nexera X2 UPLC,Shimadzu (Japan);QTrap® 6500+,AB SCIEX (USA)。
1.4 UPLC-QqQ-MS/MS测定
1.4.1 次生代谢产物的提取
将5.0 g待测样品置于离心管,加入15.0 mL甲醇后摇匀,超声提取30 min(25 ℃,200 W),10 000 r/min下离心5 min,取上清液移至50.0 mL容量瓶。上述提取和离心步骤重复1次,将2次提取的上清液合并,用甲醇定容至50.0 mL。上机前使用0.22 mm有机相针式滤器过滤提取液并将其置于进样小瓶。
1.4.2 UPLC-QqQ-MS/MS设备及条件
本研究测定次生代谢产物使用的设备为Shimadzu Nexera X2超高效液相色谱与SCIEX QTrap® 6500+联用。色谱柱为ACQUITY UPLC HSS T3(2.1 mm×100 mm,1.8 mm,Waters),色谱柱温度为40 ℃,流速为0.3 mL/min,进样量为1.0 μL,样品室温度为15 ℃,流动相A为含有体积分数0.1%甲酸的纯水,流动相B为乙腈,梯度洗脱程序如下:0~3 min:10%B~30%B;3~8 min:30%B~80%B;8~8.5 min:80%B~95%B;8.5~12 min:95%B~95%B;12~12.1 min:95%B~10%B;12~15 min:10%B~10%B。进样前后,使用500.0 μL 50%甲醇水冲洗进样针。
质谱离子化模式为电喷雾离子源(turbo spray),正离子模式(ESI+)和负离子模式(ESI-),采集模式为程序多反应监测模式(scheduled multiple reaction monitoring, sMRM),离子源温度500.0 ℃,气帘气(CUR)35.0 psi,雾化气(GS1)50.0 psi,辅助气(GS2)50.0 psi,喷雾电压(IS)+5 500.0 V和-4 500.0 V。入口电压(EP)和碰撞室出口电压(CXP)为10.0 V和15.0 V。化合物的MRM参数,包括离子种类,前体离子,产物离子,去簇电压(DP)和碰撞能量(CE),定量MRM离子对等参照GUO等[21]和ZHAO等[22]的方法。
1.4.3 方法学验证
每种标准物质使用至少5个适宜浓度的溶液进行实验,通过对每种标准物质的含量及其MRM定量离子对所对应的峰面积进行线性拟合得到线性回归方程,其线性相关系数均大于0.99;日间差是采用连续3 d对同一标准溶液测定的实际浓度的相对标准偏差表示,日内差则是同一天对同一标准溶液连续3次进样测定的实际浓度的相对标准偏差表示,各物质的日内差和日间差分别小于5.60%和5.80%;检出限指信噪比≥3时对应的物质的浓度,定量限则为信噪比≥10时对应的物质的浓度,所有物质的检出限范围为0.001~9.57 μg/L,定量限范围为0.004~21.85 μg/L;本研究采用金柑杂种进行回收率实验,将适宜浓度的标准品注入金柑杂种果实的提取液中,通过计算提取前后浓度差值与实际注入浓度的比值得到回收率,各物质的回收率均在70%~120%。
1.5 数据采集与分析
LC-MS/MS操作和数据采集在Analyst®软件(SCIEX)上进行,使用软件MultiQuant®(SCIEX)进行定量。每种样品均重复测定3次,数据结果表示为“平均值±标准差”。使用Excel 2019、SPSS 22.0和Origin 2019b进行分析和绘图。
2 结果与分析
2.1 六种金柑果实中次生代谢产物的靶向筛查
采用UPLC-QqQ-MS/MS方法对6种金柑果实的甲醇提取物中的类黄酮、酚酸、类柠檬苦素、生物碱和香豆素进行筛查,6种金柑中定量的次生代谢产物数量如表2所示,金柑杂种果实中物质最为丰富,高达48种,相较之下,融安金弹和宁波罗纹的物质较少,只有33种。混标和6种金柑果实的甲醇提取物的总离子流图如图2所示,6种金柑的次生代谢产物的种类和含量具有明显的不同。6种金柑中均定量了17种类黄酮、4种香豆素、1种酚酸、3种生物碱和2种类柠檬苦素,分别为:枸橘苷、香蜂草苷、柚皮苷、橙皮苷、新橙皮苷、新圣草枸橼苷、川陈皮素、异鼠李素-3-O-新橙皮苷、芦丁、金合欢素、牡荆素鼠李糖苷、野漆树苷、维采宁-2、新地奥司明、地奥司明、香叶木素、斯皮诺素、滨蒿内酯、橙皮内酯水合物、异橙皮内酯、橙皮油素、芥子酸、酪胺、N-甲基酪胺、甜菜碱、柠檬苦素和诺米林。
表2 六种金柑果实中定量的次生代谢产物的数量
Table 2 The number of secondary metabolites
quantitated in six kumquat fruits
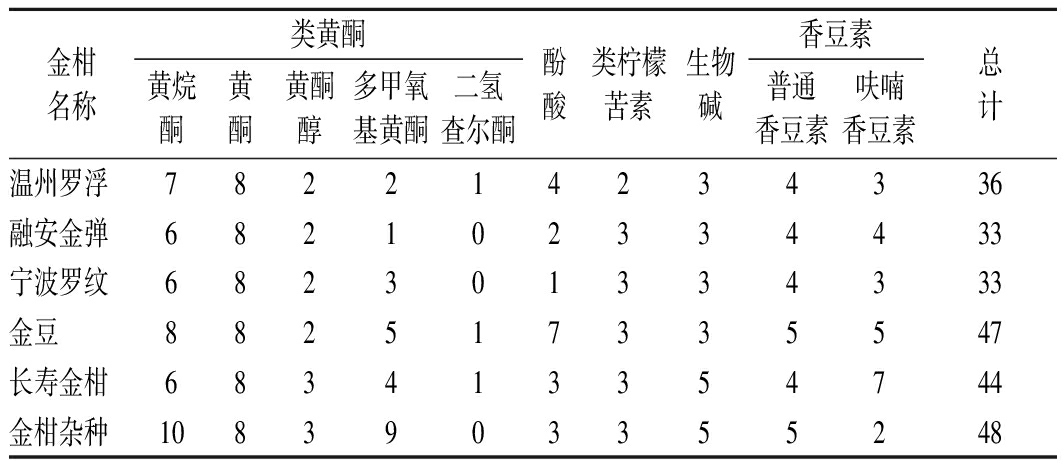
金柑名称类黄酮黄烷酮黄酮黄酮醇多甲氧基黄酮二氢查尔酮酚酸类柠檬苦素生物碱香豆素普通香豆素呋喃香豆素总计温州罗浮782214234336融安金弹682102334433宁波罗纹682301334333金豆882517335547长寿金柑683413354744金柑杂种1083903355248

标准物质混合液中1-维采宁-2;2-斯皮诺素;3-牡荆素鼠李糖苷;4-野漆树苷;5-地奥司明;6-新地奥司明;7-香叶木素;8-金合欢素;9-半齿泽兰素-5-甲醚;10-5,7,3′,4′-四甲氧基黄酮;11-甜橙黄酮;12-3′,4′,5,5′,6,7-六甲氧基黄酮;13-蔓荆子黄素;14-川陈皮素;15-桔皮素;16-5-降甲基蜜桔黄素;17-5-羟基-7,8,4′-三甲氧基黄酮;18-香蒲新苷;19-芦丁;20-异鼠李素-3-O-新橙皮苷;21-新圣草枸橼苷;22-芸香柚皮苷;23-柚皮苷;24-橙皮苷;25-新橙皮苷;26-甲基橙皮苷;27-香蜂草苷;28-枸橘苷;29-柚皮素;30-橙皮素;31-根皮素;32-柠檬苦素;33-诺米林;34-黄柏酮;35-章鱼胺;36-甜菜碱;37-N-甲基酪胺;38-大麦芽碱;39-酪胺;40-原儿茶酸;41-绿原酸;42-对羟基苯甲酸;43-咖啡酸;44-香草酸;45-p-香豆酸;46-芥子酸;47-阿魏酸;48-伞形花内酯;49-橙皮内酯水合物;50-滨蒿内酯;51-柠檬内酯;52-异橙皮内酯;53-橙皮油素;54-东莨菪亭;55-5-牻牛儿醇基-7-甲氧基香豆素;56-香柑醇;57-补骨脂素;58-异补骨脂素;59-花椒毒素;60-佛手柑内酯;61-6′,7′-二羟基香柠檬亭;62-欧前胡素;63-异欧前胡素;64-6′,7′-环氧香柠檬亭;65-8-牻牛儿醇基补骨脂素;66-
香柠檬素
图2 混标及6种金柑果实的甲醇提取物的总离子流图
Fig.2 Total ion chromatograms from mixed standards and
methanol extracts of six kumquat fruits
郑洁[14]在研究中检测了15种金柑中9种类黄酮、4种酚酸和2种类柠檬苦素的含量,其中5种金柑品种与本研究一致,所检测的5种类黄酮、4种酚酸和2种类柠檬苦素与本研究一致,而在郑洁研究中未检出的物质,如宁波罗纹、温州罗浮、融安金弹和长寿金柑中的牡荆素鼠李糖苷、宁波罗纹中的诺米林等,本研究中均有检出。OGAWA等[23]在研究中检测了5种金柑果皮和汁胞中的橙皮油素,只有香港野生金柑中含有此物质,其他金柑中均未检出,而本研究的金柑果实中均检出橙皮油素。这些研究中只对金柑中的某一种或某几类物质进行测定和比较,分析不够全面,本研究共检测了31种类黄酮,8种酚酸,3种类柠檬苦素,5种生物碱和19种香豆素,采用的UPLC-QqQ-MS/MS方法定量限低,检测的物质较多,更有利于对金柑中的次生代谢产物进行全面、系统的分析。
2.2 金柑果实中类黄酮含量的差异
共测定了31种类黄酮,包括8种黄酮,9种多甲氧基黄酮,3种黄酮醇,10种黄烷酮和1种二氢查尔酮。6种金柑定量类黄酮的数量如表2所示,金柑杂种中类黄酮最多,其中多甲氧基黄酮显著多于其他5种金柑,融安金弹、温州罗浮和宁波罗纹中类黄酮较少。
6种金柑中定量的17种类黄酮中平均含量高于20 μg/g的物质从高到低依次为杜荆素鼠李糖苷、金合欢素、维采宁-2、新橙皮苷、橙皮苷和枸橘苷。由图3可知,6种金柑的类黄酮组成差异较大。

图3 六种金柑果实中类黄酮的含量
Fig.3 The contents of flavonoids in six kumquat fruits
注:柱状图中物质顺序按箭头所示方向排列;
不同的小写字母表示差异显著(P<0.05)(下同)
金柑杂种中的新橙皮苷含量最高(269.60±22.23) μg/g,牡荆素鼠李糖苷、维采宁-2、橙皮苷次之,含量均大于200.00 μg/g,只有根皮素未检出;金豆中金合欢素含量最高为(294.27±18.08) μg/g,牡荆素鼠李糖苷、野漆树苷、枸橘苷和维采宁-2次之,含量均大于10.00 μg/g,芸香柚皮苷和甲基橙皮苷虽有检出但含量低于定量限,无法定量;温州罗浮中含量最高的为枸橘苷(61.55±1.76) μg/g,金合欢素、牡荆素鼠李糖苷、野漆树苷、维采宁-2次之,含量均大于10.00 μg/g,甜橙黄酮、桔皮素、5-羟基-7,8,4′-三甲氧基黄酮、芸香柚皮苷、甲基橙皮苷和橙皮素虽有检出但含量低于定量限,无法定量;长寿金柑中牡荆素鼠李糖苷含量最高为(108.37±6.30) μg/g,维采宁-2、枸橘苷、野漆树苷和金合欢素次之,含量均大于2.00 μg/g,芸香柚皮苷、甲基橙皮苷、柚皮素、甜橙黄酮、橙皮素和5-羟基-7,8,4′-三甲氧基黄酮也有检出,但是含量低于定量限,无法准确定量;融安金弹中含量最高的为牡荆素鼠李糖苷为(35.08±4.52) μg/g,枸橘苷、野漆树苷、维采宁-2、金合欢素次之,含量均大于2.00 μg/g,甜橙黄酮、桔皮素、5-羟基-7,8,4′-三甲氧基黄酮、芸香柚皮苷、甲基橙皮苷、橙皮素、柚皮素和5-降甲基蜜桔黄素也有检出,但是含量低于定量限,无法准确定量;宁波罗纹中牡荆素鼠李糖苷含量最高为(29.99±0.78) μg/g,其他含量大于2.00 μg/g的包括枸橘苷、维采宁-2、野漆树苷和金合欢素,还检出甜橙黄酮、5-羟基-7,8,4′-三甲氧基黄酮、芸香柚皮苷、甲基橙皮苷、橙皮素和柚皮素,但含量低于定量限,无法定量。
从类黄酮的种类来看,大部分柑橘以黄烷酮为主,占比可达81%[11],如橘、甜橙、柠檬中的橙皮苷,柚、酸橙中的柚皮苷含量都极为丰富[24-27],本研究中金柑与橘、橙、柚等的类黄酮组成具有较大差异,6种金柑中黄酮含量占31种类黄酮总含量的比例最高,金豆、长寿金柑、融安金弹、宁波罗纹、温州罗浮和金柑杂种中黄酮含量的占比分别为91.20%、89.68%、72.67%、67.55%、64.31%和49.61%。此外,黄烷酮也是金柑中重要的类黄酮物质,金柑杂种、温州罗浮、宁波罗纹和融安金弹中的黄烷酮占比较高,分别为43.31%、35.44%、32.03%和26.84%,长寿金柑和金豆中黄烷酮占比较低,为9.51%和8.53%。值得注意的是,在其他柑橘中含量较为丰富的柚皮苷、芸香柚皮苷、橙皮素在6种金柑中含量较低,新橙皮苷和橙皮苷在金柑杂种中的含量较高,在其他金柑中含量较低,其他金柑中含量最高的黄烷酮为枸橘苷。金柑杂种中9种多甲氧基黄酮的含量占类黄酮总含量的比例为6.75%,而其他5种金柑中多甲氧基黄酮的含量极低,占比均低于0.02%。
在以往的研究中,郑洁[14]检测了温州罗浮、融安金弹、宁波罗纹、长寿金柑和金柑杂种果实干样中的橙皮苷、新橙皮苷、野漆树苷、牡荆素鼠李糖苷和枸橘苷。研究发现金柑杂种中的枸橘苷含量显著低于其他金柑,与本研究结果一致;温州罗浮、融安金弹、宁波罗纹和长寿金柑中未检出牡荆素鼠李糖苷,而本研究在同种类的金柑果实鲜样中均检出牡荆素鼠李糖苷,含量均大于20.00 μg/g;野漆树苷只在温州罗浮、融安金弹和长寿金柑中检出,而本研究还在宁波罗纹和金柑杂种中准确定量了野漆树苷;5种金柑中新橙皮苷含量最高为(211.62~1 771.03) μg/g DW,本研究中除金柑杂种外,其他金柑中的新橙皮苷含量较低,均小于1.00 μg/g。WANG等[28]在四季橘果皮干样中检出了地奥司明、甜橙黄酮、柚皮苷、橙皮苷、新橙皮苷、芦丁,本研究在所有金柑中也检出这6种物质,因样品、检测方法不同,含量具有一定的差异。KAWAII等[29]在研究中测定了罗纹、金弹和罗浮中的24种类黄酮,其中芸香柚皮苷含量最高,而在本研究中罗纹、金弹和罗浮中虽检出芸香柚皮苷,但低于定量限无法准确定量,样品、提取方法和检测方法的不同可能是造成这种差异的原因。维采宁-2、香蜂草苷、异鼠李素-3-O-新橙皮苷、斯皮诺素和香叶木素是首次在金柑果实中检出。相较于前人的研究,本研究采用的测定方法定量限更低,测定的物质更多也更加准确,更有利于全面分析金柑果实中的类黄酮组成。
2.3 金柑果实中酚酸含量的差异
研究共测定了8种酚酸,其中香草酸、对羟基苯甲酸和原儿茶酸属于苯甲酸型(C6—C1),p-香豆酸、咖啡酸、阿魏酸和芥子酸属于肉桂酸型(C6—C3),绿原酸属于简单酚酸聚合物。本研究提取的酚酸为游离态酚酸,这8种酚酸在6种金柑中均有检出,但由于部分游离态酚酸在果实内含量低于定量限,无法定量。
如图4所示,6种金柑的酚酸组成有所不同:温州罗浮、长寿金柑、融安金弹和宁波罗纹中的酚酸都以芥子酸为主,含量分别为(12.61±0.33)、(1.59±0.052)、(0.28±0.006 8)和(0.23±0.010) μg/g,所占比例均在80%以上,金豆和金柑杂种中芥子酸的占比较低,分别为0.79%和6.89%;金豆中的酚酸以阿魏酸为主,为(9.67±0.18) μg/g,占所测酚酸总量的74.56%,其他5种金柑中阿魏酸的占比均在11.00%以下;金柑杂种以绿原酸为主为(2.19±0.34) μg/g,占比为89.86%,长寿金柑中的绿原酸可以定量,占比为12.46%,其他金柑中绿原酸含量低于定量限,无法定量。温州罗浮的酚酸总含量最高,与金豆差异不显著,与其他金柑差异显著;金柑杂种的酚酸总含量与长寿金柑的差异不显著,与其他4种金柑差异显著;融安金弹和宁波罗纹的酚酸总含量较低,均在0.50 μg/g以下,且两者差异显著。

图4 六种金柑果实中酚酸的含量
Fig.4 The contents of phenolic acids in six kumquat fruits
在郑洁[14]的研究中,温州罗浮和长寿金柑中芥子酸的含量最高,与本研究的结果一致;宁波罗纹和融安金弹中的酚酸以芥子酸和p-香豆酸为主,而本研究中只有金豆中的p-香豆酸可以被定量,含量为(1.25±0.017) μg/g,其他金柑果实中p-香豆酸可被检出,但含量小于定量限,无法定量。造成差异的原因是提取方法不同,郑洁提取的为结合态酚酸,而本研究提取的为游离态酚酸。WANG等[28]在四季橘果皮干样中检出绿原酸、阿魏酸、芥子酸、p-香豆酸和咖啡酸,其中绿原酸含量最高,这与本研究中金柑杂种的测定结果一致。
2.4 金柑果实中香豆素含量的差异
研究共测定了8种普通香豆素和11种呋喃香豆素。每种金柑所含的香豆素种类和含量都不同。如图5所示,从香豆素类物质总含量来看,最高的是金豆,为(47.60±4.06) μg/g;金柑杂种和长寿金柑的总含量均低于3.50 μg/g,且两者差异不显著;融安金弹、宁波罗纹和温州罗浮的香豆素类物质总含量均低于0.50 μg/g。从金柑品种来看,每种金柑的香豆素组成各有不同:温州罗浮中的滨蒿内酯含量最高为(0.058±0.007 2) μg/g,6′,7′-二羟基香柠檬亭和异欧前胡素也有检出,5-牻牛儿醇基-7-甲氧基香豆素、花椒毒素、伞形花内酯有检出,但低于定量限,无法定量;融安金弹的橙皮油素含量最高,为(0.099±0.014) μg/g,6′,7′-二羟基香柠檬亭、花椒毒素和香柑醇也有检出,5-牻牛儿醇基-7-甲氧基香豆素和异欧前胡素有检出,但低于定量限,无法定量;宁波罗纹中的橙皮油素含量最高,为(0.076±0.009 9) μg/g,6′,7′-二羟基香柠檬亭和花椒毒素也有检出,5-牻牛儿醇基-7-甲氧基香豆素含量低于定量限,无法定量;金豆含量最高的为橙皮油素(32.68±3.41) μg/g,花椒毒素、伞形花内酯、异欧前胡素、佛手柑内酯和补骨脂素也有检出,异补骨脂素含量低于定量限,无法定量;长寿金柑中的6′,7′-二羟基香柠檬亭含量最高,为(0.63±0.18) μg/g,香柠檬素、6′,7′-环氧香柠檬亭、花椒毒素、香柑醇和异欧前胡素也有检出,5-牻牛儿醇基-7-甲氧基香豆素含量低于定量限,无法定量;金柑杂种中滨蒿内酯含量最高,为(2.19±0.17) μg/g,异欧前胡素、伞形花内酯和6′,7′-二羟基香柠檬亭也有检出,5-牻牛儿醇基-7-甲氧基香豆素和欧前胡素含量低于定量限,无法定量。

图5 六种金柑果实中普通香豆素和呋喃香豆素的含量
Fig.5 The contents of coumarins and furanocoumarins
in six kumquat fruits
注:金豆的香豆素含量对应左轴,其他金柑的香豆素含量对应右轴;柱状图中物质顺序按箭头所示方向排列;柠檬内酯、东莨菪亭、5-牻牛儿醇基-7-甲氧基香豆素、异补骨脂素和8-牻牛儿醇基补骨脂素在6种金
柑中未检出或低于定量限无法被准确定量,故未统计在图中
6种金柑中均检出5种香豆素:滨蒿内酯、欧前胡素、异橙皮内酯、橙皮内酯水合物和橙皮油素。滨蒿内酯在金柑杂种中的含量较高,大于2.00 μg/g,占香豆素总含量的67.96%,其他金柑中其含量均低于0.10 μg/g。欧前胡素在金豆中含量最高,为(10.83±0.47) μg/g,占金豆中香豆素总含量的22.76%,而在其他5种金柑中含量均低于0.01 μg/g。异橙皮内酯在6种金柑中含量范围为2.56~22.79 ng/g,占比均小于3.00%。橙皮内酯水合物在金豆中含量最低,为(6.87±0.52) ng/g,长寿金柑中含量最高,为(144.63±5.20) ng/g。金豆、宁波罗纹、融安金弹、长寿金柑、金柑杂种和温州罗浮中的橙皮油素占香豆素总含量的比例分别为68.66%、35.25%、30.72%、22.81%、22.50%和12.84%。MERCOLINI等[30]在罗浮果实干样中检出橙皮油素和伞形花内酯,OGAWA等[23]检测了香港野生金柑、金弹、罗浮、Marumi金柑和Malayan金柑,橙皮油素只在香港野生金柑的果皮和汁胞中有检出,含量为0.130和0.014 mg/g DW,本研究在6种金柑中均检测到橙皮油素,与香港野生金柑同种的金豆中橙皮油素含量为(32.68±3.41) μg/g,显著高于其他5种金柑,因此,本研究推测山金柑中的橙皮油素含量显著高于其他金柑种类。以往的研究对柚果实中的香豆素测定较多,聂嘉琳等[15]测定了6种柚果实中11种香豆素的含量,而本研究首次测定了金柑果实中19种香豆素的含量,滨蒿内酯、欧前胡素、异橙皮内酯、橙皮内酯水合物等均是首次在金柑中检出。
2.5 金柑果实中类柠檬苦素含量的差异
本研究共测定了柠檬苦素、诺米林和黄柏酮3种类柠檬苦素,具体含量如表3所示。6种金柑的柠檬苦素含量均高于5.00 μg/g,金柑杂种中的柠檬苦素含量最高,为金豆中的16倍,且与其他5种金柑差异显著,金豆中的柠檬苦素含量最低,与其他5种金柑差异显著,融安金弹、宁波罗纹和长寿金柑之间差异不显著;长寿金柑中诺米林的含量最高,是温州罗浮的848倍,温州罗浮中诺米林的含量最低,除宁波罗纹和金豆之间差异不显著外,其他金柑之间差异均显著;6种金柑中的黄柏酮含量较低且均在0.10 μg/g以下。
除枸橼的果皮和果肉中诺米林含量大于柠檬苦素外[31],大部分柑橘中的柠檬苦素含量均大于诺米林。孟鹏[20]测定了尤溪金柑、赣州脐橙、琯溪蜜柚和广元柑橘干样中柠檬苦素和诺米林的含量,除赣南脐橙外,其他3种样品中柠檬苦素的含量均高于诺米林,本研究测定的6种金柑中类柠檬苦素的含量从高到低依次为:柠檬苦素、诺米林、黄柏酮,可以推测金柑全果中柠檬苦素和诺米林含量与柚、橘等中的规律一致:柠檬苦素>诺米林。
表3 六种金柑果实的类柠檬苦素组分及含量 单位:μg/g
Table 3 The components and contents of limonoids in six kumquat fruits

物质名称温州罗浮融安金弹宁波罗纹金豆长寿金柑金柑杂种柠檬苦素26.93±2.30b12.27±1.20c12.57±0.86c5.27±0.11d10.10±0.60c85.00±5.63a诺米林0.015±0.003 2e0.16±0.006 5d0.29±0.007 3c0.29±0.010c8.48±0.82a1.85±0.19b黄柏酮00.026±0.007 1bc0.034±0.001 7b0.025±0.001 4c0.086±0.004 1a0.033±0.006 0bc
注:同一行不同的小写字母表示差异显著(P<0.05)
2.6 金柑果实中生物碱含量的差异
研究共测定了5种生物碱,分别为章鱼胺、甜菜碱、N-甲基酪胺、大麦芽碱和酪胺。6种金柑中均检出这5种生物碱,其中甜菜碱、N-甲基酪胺、酪胺均被准确定量,但在温州罗浮、融安金弹、宁波罗纹和金豆中,章鱼胺和大麦芽碱含量低于定量限,无法准确定量。
如图6所示,长寿金柑中的生物碱含量最高,与其他5种金柑差异显著;融安金弹、宁波罗纹和金柑杂种的生物碱总含量之间差异不显著,与其他3种金柑差异显著;金豆和温州罗浮的生物碱总含量差异不显著,与其他4种金柑差异显著。金柑杂种中的主要生物碱为N-甲基酪胺、酪胺和章鱼胺,占比分别为74.67%、13.56%和9.79%,甜菜碱和大麦芽碱的含量均低于0.20 μg/g;长寿金柑中酪胺含量最高,占生物碱总含量的74.01%,N-甲基酪胺次之,占比为24.64%,章鱼胺、甜菜碱和大麦芽碱的含量均在0.50 μg/g以下;融安金弹中的酪胺和N-甲基酪胺的含量分别为(8.61±1.14)和(3.71±0.34) μg/g,占比为68.30%和29.43%;宁波罗纹中酪胺和N-甲基酪胺的占比为72.22%和24.85%,含量分别为(8.57±0.83)和(2.95±0.22) μg/g;温州罗浮中的酪胺、N-甲基酪胺占比分别为62.44%、32.98%。融安金弹、宁波罗纹、温州罗浮中的甜菜碱的含量均低于0.50 μg/g;金豆中酪胺、N-甲基酪胺和甜菜碱的占比为61.79%、24.48%和13.73%,含量分别为(3.92±0.23)、(1.55±0.04)和(0.87±0.081) μg/g。综上所述,金柑杂种含量最高的生物碱为N-甲基酪胺,其他5种金柑中含量最高的生物碱均为酪胺。ZHANG等[32]在研究中测定了宽皮柑橘和甜橙中生物碱的含量,结果表明,除辛弗林外,N-甲基酪胺是主要的生物碱,其次是章鱼胺,金柑杂种是金柑与宽皮柑橘杂交所得,故与宽皮柑橘的生物碱组成相似,其他金柑与宽皮柑橘和橙类组成差异较大。
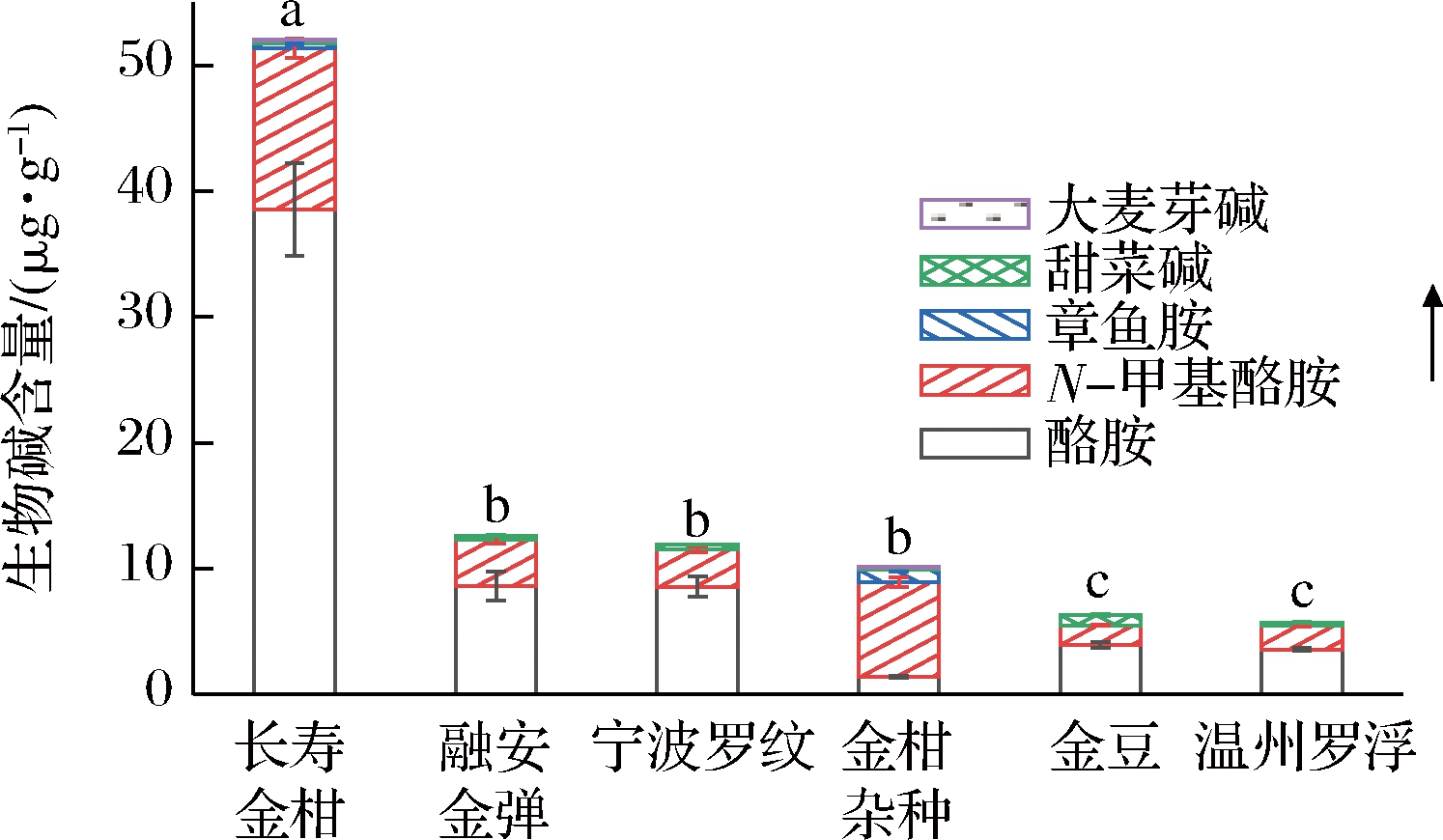
图6 六种金柑果实中生物碱的含量
Fig.6 The contents of alkaloids in six kumquat fruits
2.7 金柑果实中类黄酮、酚酸、生物碱、类柠檬苦素和香豆素5类物质的比较与分析
对6种金柑果实中类黄酮、酚酸、生物碱、类柠檬苦素和香豆素类物质的含量进行聚类分析,结果如图7所示。

图7 类黄酮、酚酸、类柠檬苦素、生物碱和香豆素在
不同的金柑果实中的积累规律
Fig.7 Accumulation patterns of flavonoids, phenolic acids,
limonoids, alkaloids and coumarins in different kumquat fruits
注:图中物质的含量进行了归一化处理。如图例所示,
物质含量从红到绿依次递减
6种金柑的酚酸、类黄酮、生物碱、类柠檬苦素和香豆素类物质的代谢具有多样性,融安金弹和宁波罗纹的代谢积累模式相近,因此这2个品种在聚类分析中被归为一类,这2种金柑依次与温州罗浮、长寿金柑、金豆和金柑杂种聚类之后组成更高的分类单元,后面4种金柑中的类黄酮、酚酸、生物碱、类柠檬苦素和香豆素的代谢积累模式之间差异较大。
长寿金柑中的10种次生代谢产物的含量显著高于其他5种金柑,包括N-甲基酪胺和酪胺2种生物碱,黄柏酮和诺米林2种类柠檬苦素,橙皮内酯水合物和异橙皮内酯2种香豆素,香柑醇、6′,7′-环氧香柠檬亭、6′,7′-二羟基香柠檬亭和香柠檬素4种呋喃香豆素;金豆中21种次生代谢产物的含量显著高于其他5种金柑,包括斯皮诺素、香蜂草苷、柚皮素、异鼠李素-3-O-新橙皮苷、野漆树苷、香叶木素、金合欢素和根皮素8种类黄酮,香草酸、阿魏酸、对羟基苯甲酸、p-香豆酸、咖啡酸、原儿茶酸6种酚酸,伞形花内酯、橙皮油素2种香豆素,花椒毒素、欧前胡素、补骨脂素、佛手柑内酯4种呋喃香豆素和甜菜碱1种生物碱;金柑杂种的27种次生代谢产物的含量显著高于其他5种金柑,包括21种类黄酮、2种生物碱、1种酚酸、1种类柠檬苦素、1种香豆素和1种呋喃香豆素,这些物质中包括了9种多甲氧基黄酮,分别为半齿泽兰素-5-甲醚、3′,4′,5,5′,6,7-六甲氧基黄酮、5,7,3′,4′-四甲氧基黄酮、川陈皮素、甜橙黄酮、桔皮素、5-降甲基蜜桔黄素、5-羟基-7,8,4′-三甲氧基黄酮、蔓荆子黄素。
根据《中国果树志·柑橘卷》中的描述,SWINGLE给予金弹种的地位,之后又认为金弹是罗浮和罗纹的种间杂种,但是从形态特征、种子、过氧化物同工酶、GOT等位基因分析又很难证明这种说法,故仍然承认金弹种的地位[2]。王炯等[33]基于COS Marker构建的UPGMA聚类树中金弹和罗纹具有高度一致的遗传组成,这2种金柑再与罗浮、金豆、四季橘聚类之后组成较高级的分类单元。
本研究和王炯等[33]的研究均显示金弹和罗纹代谢积累模式和遗传组成相似,故推测金弹与罗纹之间存在一定的关系。此外,本研究中长寿金柑和金柑杂种均为金柑和柑橘属的杂交,但代谢积累模式相差较大,其母本可能不同。综上所述,以本研究所检测的66种次生代谢产物进行对比,6种金柑中宁波罗纹和融安金弹代谢积累模式相近,温州罗浮、金豆、金柑杂种和长寿金柑差异较大,长寿金柑的差异物质主要为生物碱,金豆的差异物质主要为类黄酮、酚酸和香豆素,而金柑杂种的差异物质多为类黄酮。本研究推测金柑属的金弹和罗纹之间代谢积累模式相近,罗浮、山金柑和长寿金柑之间差异较大,不同种类的长寿金柑因其母本不同也存在一定的差异。
3 结论
本研究采用UPLC-QqQ-MS/MS方法对6种金柑果实的酚酸、类黄酮、类柠檬苦素、生物碱和香豆素类物质进行靶向筛查和定量分析,得到了31种类黄酮、8种酚酸、3种类柠檬苦素、5种生物碱、19种香豆素的具体含量。金柑杂种中检出物质最多,温州罗浮游离态酚酸总含量最高,长寿金柑生物碱总含量最高,金豆的香豆素总含量最高,金柑杂种类黄酮总含量和类柠檬苦素总含量最高;6种金柑的31种类黄酮中,黄酮占比最高,黄烷酮次之,牡荆素鼠李糖苷、野漆树苷和维采宁-2为6种金柑中含量较高的类黄酮;宁波罗纹、温州罗浮、融安金弹和长寿金柑中的酚酸都以芥子酸为主,金豆、金柑杂种则分别以阿魏酸、绿原酸为主;金柑中类柠檬苦素含量大小均为:柠檬苦素>诺米林>黄柏酮;本研究首次对不同金柑中的生物碱和香豆素进行了定量分析,酪胺、N-甲基酪胺、甜菜碱、章鱼胺、大麦芽碱、滨蒿内酯、橙皮内酯水合物、异橙皮内酯等均有检出,其中香豆素含量最高的是金豆中的橙皮油素,金柑杂种中含量最高的生物碱为N-甲基酪胺,其他5种金柑中含量最高的生物碱为酪胺。采用聚类分析对6类金柑中66种次生代谢产物进行分析,结果表明,金柑属的金弹和罗纹(融安金弹和宁波罗纹)代谢积累模式相近,罗浮(温州罗浮)、山金柑(金豆)和长寿金柑之间差异较大。本研究证实了金柑种间和种内果实次生代谢产物具有差异性,研究结果为金柑果实在食品加工和鲜食提供参考,同时也为金柑果实在医药领域的应用提供数据支持。
[1] RODRIGUES S,DE OLIVEIRA SILVA E,DE BRITO E S.Exotic fruits[M].Pittsburgh:Academic Press,2018.
[2] 周开隆,叶荫民.中国果树志.柑橘卷[M].北京:中国林业出版社,2010.
ZHOU K L,YE Y M.Fruit trees of China,Citrus[M].Beijing:China Forestry Publishing House,2010.
[3] 叶荫民.中国金柑种质资源[J].作物品种资源,1983,4(1):2-5.
YE Y M.Germplasm resources of kumquat in China[J].Crop Germplasm Resources,1983,4(1):2-5.
[4] 马张正,马巧利,辜青青,等.滑皮金柑和融安金柑外观、风味及营养成分比较[J].浙江农业学报,2019,31(4):654-660.
MA Z Z,MA Q L,GU Q Q,et al.Comparative study of fruit appearance,flavor and nutritional components in Huapi and Rong’an kumquat[J].Acta Agriculturae Zhejiangensis,2019,31(4):654-660.
[5] 李俊,傅曼琴,徐玉娟,等.融安金桔不同生长期果实品质特性比较[J].现代食品科技,2021,37(2):1-9.
LI J,FU M Q,XU Y J,et al.Comparison of fruit quality and characteristics at different growth stages of kumquat from Rongan[J].Modern Food Science and Technology,2021,37(2):1-9.
[6] JAYAPRAKASHA G K,CHIDAMBARA MURTHY K N,ETLINGER M,et al.Radical scavenging capacities and inhibition of human prostate (LNCaP) cell proliferation by Fortunella margarita[J].Food Chemistry,2012,131(1):184-191.
[7] 黎继烈,刘宗敏,钟海雁,等.金柑总黄酮对小鼠胃肠吸收功能的影响[J].中南林业科技大学学报,2007,27(2):79-82.
LI J L,LIU Z M,ZHONG H Y,et al.Effects of kumquat total flavone on the absorption function of mice’s stomach and intestine[J].Journal of Central South University of Forestry & Technology,2007,27(2):79-82.
[8] 史文景,游双红,胡佳羽,等.金柑多酚提取与抗氧化活性分析[J].农产品加工,2020(6):48-51.
SHI W J,YOU S H,HU J Y,et al.Research of kumquat polyphenols extraction and antioxidant activity[J].Farm Products Processing,2020(6):48-51.
[9] 段宙位,窦志浩,何艾,等.青金桔皮中多酚的提取及其抗氧化性研究[J].食品工业科技,2015,36(10):244-248.
DUAN Z W,DOU Z H,HE A,et al.Extraction and antioxidant activity of polyphenols from green kumquat peel[J].Science and Technology of Food Industry,2015,36(10):244-248.
[10] 朱雅雯,王洋,肖航,等.金柑结合多酚的制备及其对RAW 264.7巨噬细胞免疫调节活性[J/OL].精细化工:1-11[2021-04-21].https://doi.org/10.13550/j.jxhg.20200956.
ZHU Y W, WANG Y, XIAO H, et al.Preparation of non-extractable polyphenols from Kumquat and its immunomodulatory effect inRAW 264.7 macrophage cells[J/OL].Fine Chemicals:1-11[2021-04-21].https://doi.org/10.13550/j.jxhg.20200956.
[11] ABAD-GARC A B,GARM
A B,GARM N-LOBATO S,S
N-LOBATO S,S NCHEZ-IL
NCHEZ-IL RDUYA M B,et al.Polyphenolic contents in citrus fruit juices:Authenticity assessment[J].European Food Research and Technology,2014,238(5):803-818.
RDUYA M B,et al.Polyphenolic contents in citrus fruit juices:Authenticity assessment[J].European Food Research and Technology,2014,238(5):803-818.
[12] GATTUSO G,BARRECA D,GARGIULLI C,et al.Flavonoid composition of citrus juices[J].Molecules,2007,12(8):1 641-1 673.
[13] LOU S,LAI Y,HUANG J,et al.Drying effect on flavonoid composition and antioxidant activity of immature kumquat[J].Food Chemistry,2015,171:356-363.
[14] 郑洁.我国不同品种金柑主要营养及功能成分研究[D].重庆:西南大学,2015.
ZHENG J.Nutritional and functional compounds of major varieties of kumquat (Fortunella swing) in China[D].Chongqing:Southwest University,2015.
[15] 聂嘉琳,赵希娟.六种柚果实不同部位次生代谢产物的靶向筛查及其差异研究[J].陕西师范大学学报(自然科学版),2021,49(3):60-71.
NIE J L,ZHAO X J.Targeted screening of secondary metabolites in different parts of six pummelo (Citrus grandis (L.) Osbeck) fruits and their difference investigation[J].Journal of Shanxi Normal University (Natural Science Edition),2021,49(3):60-71.
[16] NELSON B C,PUTZBACH K,SHARPLESS K E,et al.Mass spectrometric determination of the predominant adrenergic protoalkaloids in bitter orange (Citrus aurantium)[J].Journal of Agricultural and Food Chemistry,2007,55(24):9 769-9 775.
[17] 张文娟,陶缘,王亚军,等.柑橘属中生物碱辛弗林生理活性的研究进展[J].食品工业科技,2013,34(22):331-334.
ZHANG W J,TAO Y,WANG Y J,et al.Research progress in biological activity of p-synephrine in citrus fruits[J].Science and Technology of Food Industry,2013,34(22):331-334.
[18] SEGUN P A,ISMAIL F M D,OGBOLE O O,et al.Acridone alkaloids from the stem bark of Citrus aurantium display selective cytotoxicity against breast,liver,lung and prostate human carcinoma cells[J].Journal of Ethnopharmacology,2018,227:131-138.
[19] DEA S,PLOTTO A,MANTHEY J A,et al.Interactions and thresholds of limonin and nomilin in bitterness perception in orange juice and other matrices[J].Journal of Sensory Studies,2013,28(4):311-323.
[20] 孟鹏.金柑柠檬苦素类化合物的提取纯化、结构鉴定及生物活性研究[D].福州:福建农林大学,2013.
MENG P.Study on extraction,purification,structural identification and biological activities of limonoids from kumquat[D].Fuzhou:Fujian Agriculture and Forestry University,2013.
[21] GUO P M,PANG W H,ZHAO X J,et al.A rapid UPLC-QqQ-MS/MS method for targeted screening and quantitative analysis of secondary metabolites in satsuma mandarin[J/OL].European Food Research and Technology,[2021-04-30].https://doi.org/10.1007/s00217-021-03742-w.
[22] ZHAO X J,GUO P M,PANG W H,et al.A rapid UHPLC-QqQ-MS/MS method for the simultaneous qualitation and quantitation of coumarins,furocoumarins,flavonoids,phenolic acids in pummelo fruits[J].Food Chemistry,2020,325:126 835.
[23] OGAWA K,KAWASAKI A,YOSHIDA T,et al.Evaluation of auraptene content in citrus fruits and their products[J].Journal of Agricultural and Food Chemistry,2000,48(5):1 763-1 769.
[24] CHEN J J,ZHANG H Y,PANG Y B,et al.Comparative study of flavonoid production in lycopene-accumulated and blonde-flesh sweet oranges (Citrus sinensis) during fruit development[J].Food Chemistry,2015,184:238-246.
[25] BLUNDER M,ORTHABER A,BAUER R,et al.Efficient identification of flavones,flavanones and their glycosides in routine analysis via off-line combination of sensitive NMR and HPLC experiments[J].Food Chemistry,2017,218:600-609.
[26] FRYDMAN A,WEISSHAUS O,BAR-PELED M,et al.Citrus fruit bitter flavors:Isolation and functional characterization of the gene Cm1,2 RhaT encoding a 1,2 rhamnosyltransferase,a key enzyme in the biosynthesis of the bitter flavonoids of citrus[J].Plant Journal,2004,40(1):88-100.
[27] DE ANCOS B,CILLA A,BARBERA R,et al.Influence of orange cultivar and mandarin postharvest storage on polyphenols,ascorbic acid and antioxidant activity during gastrointestinal digestion[J].Food Chemistry,2017,225:114-124.
[28] WANG Y C,CHUANG Y C,HSU H W.The flavonoid,carotenoid and pectin content in peels of citrus cultivated in Taiwan[J].Food Chemistry,2008,106(1):277-284.
[29] KAWAII S,TOMONO Y,KATASE E,et al.Quantitation of flavonoid constituents in citrus fruits[J].Journal of Agricultural and Food Chemistry,1999,47(9):3 565-3 571.
[30] MERCOLINI L,MANDRIOLI R,FERRANTI A,et al.Quantitative evaluation of auraptene and umbelliferone,chemopreventive coumarins in citrus fruits,by HPLC-UV-FL-MS[J].Journal of Agricultural and Food Chemistry,2013,61(8):1 694-1 701.
[31] CAI H H,KHAREL G P,HASHINAGA F.Changes in the limonoid content during development of citron fruit (Citrus-medica L)[J].Journal of the Japanese Society for Horticultural Science,1993,62(1):215-220.
[32] ZHANG Y H,JIAO B N.Simultaneous determination of six protoalkaloids in Chinese local varieties of loose-skin mandarins and sweet oranges by strong cation exchange-high performance liquid chromatography[J].Food Analytical Methods,2019,12(3):677-686.
[33] 王炯,龚桂芝,彭祝春,等.基于COS Marker分析柑橘属及其近缘、远缘属植物的遗传与进化[J].中国农业科学,2017,50(2):320-331.
WANG J,GONG G Z,PENG Z C,et al.Genetic and phylogenetic relationships among citrus and its close and distant relatives based on cos marker[J].Scientia Agricultura Sinica,2017,50(2):320-331.