随着人类科技的不断进步,对太空的探索也日益频繁。自1960年苏联 Korabl-Sputnik 号和美国 Discover 号卫星发射以来,在外太空地球轨道上已进行多次微生物试验[1]。微生物是研究环境条件变化响应的理想生命形式,因为它们易于处理,在有限的环境条件变化(如温度、压力等)内具有稳定性和生命周期的快速性。太空中复杂的环境条件可为突变育种提供优质的突变源,这可以提高微生物突变率并产生许多不同的表型。故可利用太空独特的环境,对微生物进行航天诱变育种,以期获得性状优良的菌株并应用于生产实际中。但目前的研究缺乏对微生物航天诱变机制及效应的系统性认识。
发酵食品微生物是发酵食品中最重要的组成部分,对发酵食品的风味和质量至关重要。微生物航天育种能为发酵食品微生物的选育提供新的思路与方法,但目前相关育种研究甚少。
本文综述了国内外微生物太空诱变育种探索过程中,太空环境对微生物的诱变机制、对微生物生理生化特征的诱变效应,以及航天育种在发酵食品微生物中的应用及前景,为微生物航天育种与发酵食品在产学研的结合提供借鉴。
1 太空环境对微生物的诱变机制
1.1 太空环境的诱变源
太空环境具有高真空、温度极端、微重力等特点,充斥着紫外线辐射、电离辐射、交变磁场、流星体、空间碎片、电离层、离子体等影响生命体的复杂条件,从而诱导微生物表现出各种形态和生理变化,以适应太空环境的变化[1]。
微重力是影响微生物在太空环境中生存的一个重要因素,其是一种重力水平几乎为零但没有被中和的状态。在地球轨道上,微重力可能介于10-3~10-6 g,具体的值取决于航天器的位置和振动频率。微重力能改变作用在细胞及其环境上的物理力,例如对流质量与热传递的损失、机械剪切力的降低以及液体在空气或固体界面的行为改变,从而改变微生物与其周围环境之间气体、营养物、代谢副产物、代谢废物和信号分子的交换速率[2]。
太空环境还使微生物暴露于多种类型的辐射中,包括光子以及质量、电荷和能量不同的粒子。辐射场主要由两类组成:太阳宇宙辐射和银河宇宙辐射。在地球上,每个人每年都受到大约2 mSv 的背景辐射,在国际空间站(International Space Station,ISS)上,辐射剂量大约是地球上的80~160倍[3]。各类射线可传递足量的能量(线性能量传递)使中性原子或分子电离,或者至少逐出1个电子。辐射可对DNA造成可修复或不可修复的损害,这取决于辐射的类型和能量。这种损伤有可能通过突变来修改遗传密码,改变DNA的功能并将突变传递给下一代。并且,辐射损伤亦与自由基物质的产生有关,这些物质可直接或间接地靶向生物大分子,影响其完整性和功能,从而严重损害微生物的生存力[4]。
1.2 太空环境诱变微生物的分子机制
1.2.1 影响微生物 DNA的损伤与修复
太空中存在的大量电离辐射会损坏细胞内 DNA。质子与 DNA 分子的直接相互作用,会损伤 DNA 的碱基,并且通过与核糖部分的相互作用导致 DNA 链的断裂[5]。另外,微生物被暴露于外太空环境的紫外线时,DNA 酶与 RNA 酶的活性会被降低,当受到无法抵御的紫外线剂量时,则会丧失产生 DNA 酶的能力[6]。
暴露在太空环境中,微生物DNA 受到损伤的同时,相应地 DNA 修复作用也会被激活[7]。如将枯草芽孢杆菌孢子暴露在ISS外559 d,检测到与 DNA 损伤(SOS 反应,SPβ 噬菌体诱导),蛋白质损伤(CtsR/Clp 系统)有关的调节子的转录水平显著升高。recA 基因产物是枯草芽孢杆菌中经典SOS调节中的主要调节子,该试验 recA 基因的表达上升了7.5倍[8]。
但在太空中 DNA的修复作用与地面相比会出现差异。GUO 等[9]将金黄色葡萄球菌搭载于神舟10号中,发现与在地面上培养的菌株相比,经历过太空飞行的菌株表现出不同的突变位点定位模式。在太空菌株中,基因间隔区突变的数量远高于基因内突变的数量,而在地面菌株中则相反。基因内的突变位点位于蛋白质编码区内,预测功能包括编码转座酶、DNA 甲基化酶和 Mur 连接酶。这表明这些突变位点可能负责识别和修复DNA复制错配位点,并且修复更多地瞄准与生存相关的基本功能基因突变,而不是发生在基因间区域的突变。
综上,微生物在太空中,DNA受到损伤,并表现出与地面培养菌株不同的 DNA 修复机制,这可能是太空环境诱变微生物的重要分子机制[7-10]。
1.2.2 影响微生物代谢、抗氧化等基因的表达
微生物能够调节自身新陈代谢,从而在环境变化期间提高生存率,突变菌株在碳水化合物、蛋白质、脂类这些能源的利用上会出现一定的调节[11]。例如,沃氏葡萄球菌在太空上飞行64 d后,磷酸转移酶系统的基因表达显著上调,该系统调节糖的代谢,包括葡萄糖、甘露糖、果糖和纤维二糖[12]。肠炎沙门氏菌经太空飞行后,磷酸转移酶系统的基因表达也出现差异。其中,1个上调基因 (fucA) 和9个下调基因 (manX、manY、manZ、gutD、srlA、srlB、srlE、rfbK和cpsB2) 与“果糖和甘露糖代谢”途径相关,2个上调基因 (STY2572 和 treB) 和7个下调基因 (manX、manY、manZ、srlA、srlB、srlE、ptsG) 与“磷酸转移酶系统”途径相关[13]。另外,粘质沙雷氏菌经历398 h太空飞行后,蛋白质组学数据显示,与代谢功能相关的蛋白质水平发生变化,如糖酵解/糖异生、丙酮酸、精氨酸和脯氨酸代谢以及缬氨酸,亮氨酸和异亮氨酸的降解[14]。大肠杆菌经17 d太空飞行后,差异表达蛋白涉及磷脂生物合成、磷脂代谢、有机磷酸酯代谢、脂质生物合成、对化学刺激的响应、细胞脂质代谢和脂质代谢这些生物过程[15]。
据报道,真菌会产生黑色素以增强对电离辐射的抵抗力。从ISS表面分离的3种霉菌:黑曲霉 JSC-093350089[16]和烟曲霉 ISSFT-021、IF1SW-F4[17],发现它们不仅在与代谢相关的蛋白质表达上与地面试验菌株出现差异,而且参与 DHN-黑色素合成的关键酶丰度上升,分别是 AlbA 和 Arp1。
在太空飞行过程中,电离辐射可诱导微生物细胞内水解产生活性氧,从而可能对 DNA、蛋白质、脂质和其他细胞成分产生氧化损伤。CRABBÉ 等[18]发现白色念珠球菌 SC5314经太空飞行后,与抗氧化性有关的基因表达得到上调,包括氧化应激反应转录调节因子 cap1基因、编码谷胱甘肽过氧化物酶的 gpx1、gpx2基因和编码超氧化物歧化酶的 sod3基因。另外,从ISS表面分离出的黑曲霉和烟曲霉中也发现了与抗氧化应激相关的蛋白丰度增加[16-17]。
微生物在太空中受到诱变或者是对于环境的应激反应,会对基因的表达作出调整,这可能是太空环境诱变微生物的另一个重要分子机制[11]。在返回地球后,这种基因的表达差异我们可以通过转录组学和蛋白组学分析获知。
2 太空环境对微生物生理生化特征的诱变效应
表1是收集的近年发表的关于微生物太空试验报道,并将其试验菌种、航天器发射年份、搭载飞船或发射任务名称,菌株的太空飞行试验方式,以及诱变菌株的生理生化变化结果进行归纳总结。微生物的太空试验,多为航天器搭载菌株经太空飞行后,返回地面对菌株进行分离,然后再测试其性状变化[7,12,14-15,19-21]。有少部分试验为在太空飞行期间对微生物的生长状态进行观察[22]。
表1 太空环境对微生物生理生化特征的诱变
Table 1 Mutagenesis of physiological and biochemical characteristics of microorganisms induced by space environment

菌种年份搭载飞船/任务名称菌株试验方式诱变菌株试验结果参考文献铜绿假单胞菌2011STS-132/135 Atlantis号太空飞行14/15 d,地面分离细胞密度增加,生物膜变厚并首次出现柱-冠状结构[20]铜绿假单胞菌2011STS-135 Atlantis号太空飞行13 d期间培养细胞密度增加(营养限制条件下:低氧、低磷酸盐浓度);细胞密度不变(正常营养条件下:正常氧、正常磷酸盐浓度)[22]粘质沙雷氏菌2011神舟8号太空飞行16 d,地面分离生长速率不变,耐药性不变[14]大肠杆菌2011神舟8号太空飞行16 d,地面分离生长速率不变,耐药性不变,出现30个碳源单一利用差异[15]枯草芽孢杆菌2015SpaceX-6 CRS任务太空飞行1 d,地面分离比较72种抗生素和生长抑制化合物的敏感性,9种抑制物抗性存在差异,其中3种抗性提高[21]沃氏葡萄杆菌2016天宫2号/神舟11号太空飞行64 d,地面分离生长速率不变,生物膜形成能力增强,耐药性不变[12]肠炎沙门氏菌2016神舟11号太空飞行1 d,地面分离生长速率加快,对丁胺卡那霉素抗性提高[13]鲍曼不动杆菌2016神舟11号太空飞行1 d,地面分离生长速率下降,生物膜形成能力减弱,耐药性不变[22]白色念珠菌2016实践10号太空飞行12 d,地面分离生长速率、生物膜形成能力、抗氧化能力均提高[7]
2.1 太空环境对微生物生长动力学的诱变
经历太空飞行后,微生物的生长速率呈不定向变化[7,12,14-15,19]。例如,2016年神舟11号航天器将1株肠炎沙门氏菌带入太空,返回地球后分离菌株,并同时在类似温度条件下进行了地面试验作为对照,发现飞行菌株加速生长[13]。2011年神舟8号携带粘质沙雷氏菌在太空中飞行398 h,返回地面后筛选出2个突变体(LCT-SM166和LCT-SM262),与地面模拟菌株(LCT-SM213)对比,生长曲线没有变化[14]。神舟11号亦搭载有鲍曼不动杆菌,经历太空飞行返回地面后分离的菌株生长速率显著下降[19]。另外,对生长的促进作用亦可表现为细胞密度的上升[20]。这种对生长不定向的促进或抑制作用,有助于微生物航天育种筛选出高生长速率的优良菌株
2.2 太空环境对微生物细胞膜的诱变
微生物的生物膜形成能力是一种重要的生理特性,它与微生物的抗生素抗性、宿主免疫反应还有对压力环境的适应和耐受能力息息相关[23]。也有研究认为生物膜形成能力的变化可能与生长速率的变化有关[24]。太空微生物试验中关于细胞膜的研究并不多,从收集到的文章中能看出,经历长时间的太空飞行后(12/14/15/64 d),菌株返回地面后能发现其生物膜的形成能力增强[7,12,20],但经历短时间太空飞行(1 d)的菌株返回地面后其生物膜的形成能力会减弱[19],此推论需要未来有更多的文献进行支撑。另外,经历太空飞行返回地面的铜绿假单胞菌的细胞膜,首次出现了一种由覆盖有冠层的圆柱组成的结构,在地面上培养时生物膜仅显示出平坦的结构[20]。微生物能够在太空航行后出现在地球上无法获得的性状,这对微生物航天育种有重要的意义。
2.3 太空环境对微生物耐药性的诱变
若将航天育种的微生物作为益生菌使用在发酵食品上,有必要对其抗生素抗性基因以及它的转移性进行安全性评价,这些抗性基因会通过水平转移的方式转入到肠道菌群的病原菌中,一旦病原菌具有耐药性并引发疾病时,则无法利用抗生素进行治疗[25]。目前并无益生菌经太空诱变后进行的耐药性方面的报道,耐药性的报道均聚焦于经太空诱变后的致病菌[26]。经太空飞行后,返回地面进行试验的微生物中,鲍曼不动杆菌、沃氏葡萄杆菌、粘质沙雷氏菌和大肠杆菌对所测试的抗生素并没有产生变化的耐药性[12,14-15,22]。MORRISON 等[21]将枯草芽孢杆菌送往国际空间站,得到飞行 (FL) 菌株与地面培养 (GC) 菌株。使用 Omnilog 表型微阵列 (PM) 系统将 FL 和 GC 样品对72种抗生素和生长抑制化合物的敏感性进行了比较。通过 PM 筛查仅鉴定出9种化合物在 FL 和 GC 样品中存在差异。其中,FL 菌株对3种抗生素比 GC 菌株更具抗性,分别为依诺沙星,6-巯基嘌呤和三氟拉嗪。但只有对依诺沙星的耐药性出现 >50倍的差异,对其余8种抗生素耐药性差异非常小(50%以下)。总体上,微生物经太空飞行返回地面后,对抗生素的耐药性无大规模的变化,但仍有可能出现变化。因此若想将航天育种的菌株用于发酵食品,需要对微生物的耐药性进行检测。
3 航天育种在发酵食品微生物的应用及前景
3.1 发酵食品微生物的航天育种
表2收集了我国航天育种报道中,关于发酵食品微生物的报道,并将其搭载菌种/菌群,航天器发射年份、搭载的飞船/任务名称,以及航天诱变效果进行归纳总结。
表2 发酵食品微生物的航天育种效果
Table 2 Effects of space-flight breeding of fermented microorganisms
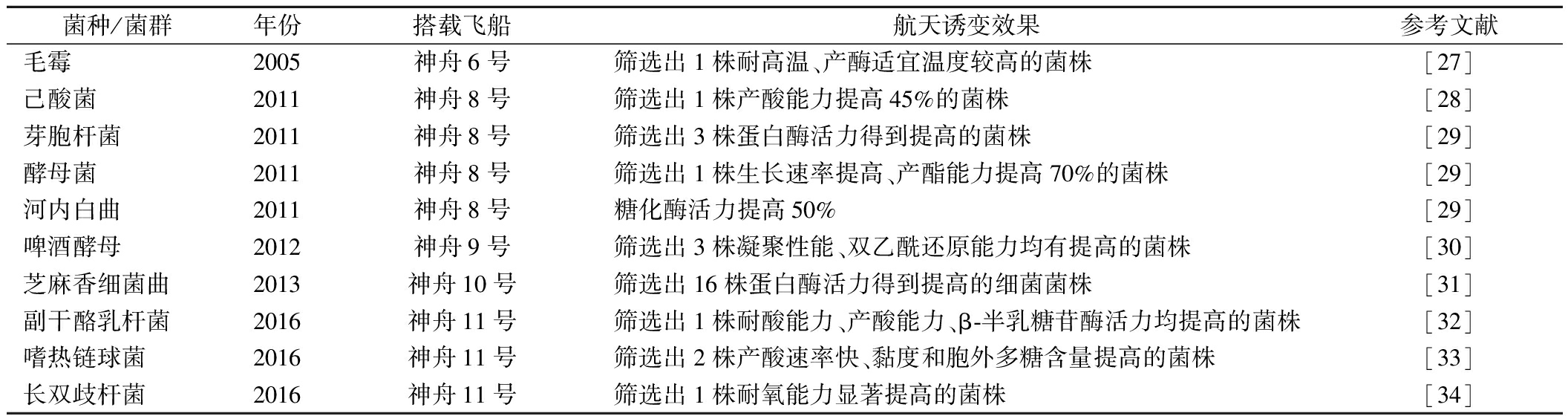
菌种/菌群年份搭载飞船航天诱变效果参考文献毛霉2005神舟6号筛选出1株耐高温、产酶适宜温度较高的菌株[27]己酸菌2011神舟8号筛选出1株产酸能力提高45%的菌株[28]芽胞杆菌2011神舟8号筛选出3株蛋白酶活力得到提高的菌株[29]酵母菌2011神舟8号筛选出1株生长速率提高、产酯能力提高70%的菌株[29]河内白曲2011神舟8号糖化酶活力提高50%[29]啤酒酵母2012神舟9号筛选出3株凝聚性能、双乙酰还原能力均有提高的菌株[30]芝麻香细菌曲2013神舟10号筛选出16株蛋白酶活力得到提高的细菌菌株[31]副干酪乳杆菌2016神舟11号筛选出1株耐酸能力、产酸能力、β-半乳糖苷酶活力均提高的菌株[32]嗜热链球菌2016神舟11号筛选出2株产酸速率快、黏度和胞外多糖含量提高的菌株[33]长双歧杆菌2016神舟11号筛选出1株耐氧能力显著提高的菌株[34]
在收集到的文献中,发酵食品微生物的航天育种方法均为搭载发酵微生物进行太空飞行,返回地面后通过传统平板筛菌技术初筛出具有潜力的诱变菌株,然后针对对应的发酵食品特性,对诱变菌株进行一系列的生理生化指标测定,从中筛选具有稳定优良性状的菌株。例如,刘雪等[31]从航天诱变得到的芝麻香细菌曲中初筛出34株生长快、菌落大的菌株,然后分别对它们的中性和碱性蛋白酶活力进行测定,最终筛选出16株细菌菌株,蛋白酶活力均有提高,最高可提升31.7倍。针对应用于不同发酵食品的微生物,筛选的性能指标也不相同。例如,应用于白酒酿造中的微生物,会以菌株的产酸能力、产酯能力、糖化酶活力、蛋白酶活力等为筛选指标,旨在提高白酒中的有机酸、酯类物质等功能物质以及对原料的利用率[28,29,31]。针对发酵乳产品的微生物,会以胞外多糖、产酸能力、耐酸能力、半乳糖苷酶活力等为筛选指标,旨在提高产品的黏度、风味以及益生功能[32-34]。
另外,表3收集了航天优良菌株应用于实际生产之中的相关报道,并将航天菌株/菌群,应用于的发酵食品种类,以及应用效果进行归纳总结。
表3 航天育种后的发酵微生物在发酵食品中的应用效果
Table 3 Application effects of fermented microorganisms after space-flight breeding in fermented food

菌种/菌群应用发酵食品种类效果参考文献毛酶腐乳氨基酸态氮和水溶性蛋白质含量均高于市售产品,风味突出[27]己酸菌浓香型白酒酒体中有机酸(己酸、乙酸、丁酸等)含量和酯类化合物(乙酸乙酯、丁酸乙酯、戊酸乙酯等)含量大幅提高,口味醇厚绵柔,典型性更为突出[28]芽孢杆菌、酵母菌、河内白曲芝麻香型白酒发酵时间缩减,曲用量减少,出酒率提高,四甲基吡嗪等杂环化合物含量提高,酒体丰满,香气幽雅,芝麻香风格典型[29,35]啤酒酵母啤酒啤酒中高级醇和酯类物质含量均高于市售产品,给啤酒带来独特的香蕉香气[30]根霉、黑曲霉、毛霉生抽蛋白酶和其他大分子物质酶活提高,中间产物丰富,产品香味协调,色、香、味、体俱佳[36]香醋大曲香醋产品中的无机盐含量的到大幅提升,并且风味优于传统产品[37]
目前在发酵食品领域上,航天微生物已在白酒、酱油、食用醋以及啤酒上的具有实际应用。例如,利用诱变后的优良己酸菌(己酸产量提高45%),与普通窖泥按一定比例混合制成的航天窖泥,用于发酵浓香型白酒。所得白酒中,各种有机酸(己酸、乙酸、丁酸等)含量和酯类化合物(乙酸乙酯、丁酸乙酯、戊酸乙酯等)含量均有提高。其中,总酸含量和总酯含量各提升了300和1 000 mg/L,达到1 371和6 205 mg/L,提升最多的为乙酸乙酯,提高了500 mg/L [28]。利用经航天诱变的根酶、黑曲霉和毛酶,与原来使用的米曲霉混合制曲,制得生抽色、香、味、体俱佳,达到高品质生抽的要求,并且产量提高[36]。3株航天啤酒酵母HT-1、HT-2、HT-3酿造的啤酒,高级醇和酯类物质的含量均高于市售啤酒,双乙酰的含量控制在0.08 mg/L 左右。经专家品审,航天酵母酿造的啤酒具有典型的啤酒风味与特点,并且HT-2能给啤酒带来明显的香蕉风味[30]。
但目前航天诱变微生物在发酵食品上的应用甚少,并且许多诱变菌株成果也仅停留在实验室试验阶段,还没有将其应用于实际生产中[32-34]。例如,嗜热链球菌G2航天诱变菌株能为发酵乳带来更高的酸度、黏度和胞外多糖含量,从而提高产品的品质,但仅停留于实验室阶段的试验,并未进一步应用到发酵乳产品中[33]。
目前,国内外对于微生物航天诱变育种的研究也主要集中于医学领域[3,26],在发酵食品微生物领域涉及不多。除我国外,其他发展中国家尚不具备对微生物航天诱变的基础和条件。开展发酵微生物航天育种的相关研究,能够填补此方面的空白。
3.2 航天育种在发酵食品的应用前景
航天育种能够提高发酵食品微生物的各项性能,对发酵食品具有优良的生产应用前景。但目前对于食品发酵微生物航天育种的研究甚少,在已报道的文献中,国外暂时还没有这方面的研究,国内至今也仅有本文收集的报道,发酵食品微生物的航天育种研究仍处于起步阶段。微生物航天诱变技术目前多用于医学研究中,在食品发酵和酿造中的应用较少。研究主要集中于诱变菌株的DNA、基因表达、生理生化特性的变化,选取的菌株亦多为医用菌株。
酿造微生物是发酵食品中最重要的组成部分,对发酵食品的风味、品质和安全至关重要。广式传统发酵食品包括广式发酵肉制品、广式调味品(酱油、腐乳、豆豉、豆酱等)、广东米酒、广东客家黄酒、岭南特色果酒、广式米糕等。品种繁多,量大面广,深蕴文化传承。但部分广式传统发酵食品受制于自身品质问题,未能在全国范围内推广。例如,广东黄酒中的残糖含量过高,会导致口感过于甜腻、并且易产生酸败,但酿造过程中的高糖环境致使酵母处于低活性状态,无法充分利用残糖[38]。广东米香型白酒的酿造工艺简单、发酵周期短、采用半固态发酵的方式导致其酯类物质与有机酸物质含量较少、香气不足,并且杂醇油含量普遍较高[39]。广式豆制品如腐乳、豆豉、豆酱在制作过程中必须经历浸豆过程,该过程中脂肪氧化酶被活化,催化油脂产生氢过氧化物,再降解生成小分子醇、醛、酮、酸和胺等豆腥味成分,至其市场接受度不高[40]。
微生物航天育种技术可为广式传统发酵食品微生物的筛选及应用开辟新的途径,以期用太空独特的环境为广式传统发酵食品微生物带来性能的优化。例如,提高酒曲中微生物的产酸、产酯、耐高糖能力,使发酵更加充分,酒风味及功能成分得到提高,降低杂醇油的含量。培养能够利用豆腥味成分的发酵菌株,降低豆制品中不愉悦的豆腥味。微生物航天育种技术可解决广式传统发酵食品在发酵过程中的存在的问题,提升其品质与价值,该技术具有广阔的应用前景。
4 讨论与展望
在太空中,微生物会出现一系列的应激反应。多年来,国内外许多科研组对微生物进行了多项太空试验。证实了太空环境会影响微生物的生长情况、生物膜形成能力、对抗生素的耐药性、毒性、基因的表达、DNA 的损伤与修复等。此外,太空中的微重力和太空辐射等环境条件可为微生物诱变育种提供优秀的诱变源,筛选得到的优良菌株可应用于实际生产中,也可为日后在太空中进行的微生物试验提供合适的菌株。
微生物航天诱变育种技术目前多用于医学研究中[3,26],如表1中提到的铜绿假单胞菌和大肠杆菌是条件性致病菌,在太空中宇航员会有几率被感染[15,20],肠炎沙门氏菌会引起人和动物的肠胃和系统性疾病[13]。而其在食品发酵和酿造中的研究甚少。广式传统发酵食品品种繁多,量大面广,深蕴文化传承,而酿造微生物对发酵食品的风味和质量至关重要,微生物航天育种技术可为广式传统发酵食品酿造微生物的筛选及应用开辟新的途径,具有广阔的应用前景。
[1] WANG J F,LIU C T,LIU J Y,et al.Space mutagenesis of genetically engineered bacteria expressing recombinant human interferon α1b and screening of higher yielding strains[J].World Journal of Microbiology and Biotechnology,2014,30(3):943-949.
[2] HORNECK G,KLAUS D M and MANCINELLI R L.Space microbiology[J].Microbiology and Molecular Biology Reviews,2010,74(1):121-156.
[3] MIDDELEER G D,LEYS N,SAS B,et al.Fungi and mycotoxins in apace—a review[J].Astrobiology,2019,19(7):915-926.
[4] SRIDHARAN D M,ASAITHAMBY A,BAILEY S M,et al.Understanding cancer development processes after HZE-particle exposure:Roles of ROS,DNA damage repair and inflammation[J].Radiation Research,2015,183(1):1-26.
[5] FRIEDBERG E C.A history of the DNA repair and mutagenesis field:I.The discovery of enzymatic photoreactivation[J].DNA Repair (Amst),2015,33:35-42.
[6] NOVIKOVA N,DESHEVAYA E,LEVINSKIKH M,et al.Study of the effects of the outer space environment on dormant forms of microorganisms,fungi and plants in the ‘Expose-R’ experiment[J].International Journal of Astrobiology,2015,14(1):137-142.
[7] WANG J P,LIU Y,ZHAO G X,et al.Integrated proteomic and metabolomic analysis to study the effects of spaceflight on Candida albicans[J].BMC Genomics,2020,21:57.
[8] NICHOLSON W L,MOELLER R and HORNECK G.Transcriptomic responses of germinating Bacillus subtilis spores exposed to 1.5 years of space and simulated martian conditions on the EXPOSE-E experiment PROTECT[J].Astrobiology,2012,12(5):469-486.
[9] GUO J,HAN N,ZHANG Y,et al.Use of genome sequencing to assess nucleotide structure variation of Staphylococcus aureus strains cultured in spaceflight on Shenzhou-X,under simulated microgravity and on the ground[J].Microbiol Res,2015,170:61-68.
[10] FAJARDO-CAVAZOS P,SCHUERGER A C,NICHOLSON W L.Exposure of DNA and Bacillus subtilis spores to simulated martian environments:use of quantitative PCR (qPCR) to measure inactivation rates of DNA to function as a template molecule[J].Astrobiology,2010,10(4):403-411.
[11] SENATORE G,MASTROLEO F,LEYS N,et al.Effect of microgravity & space radiation on microbes[J].Future Microbiology,2018,13:831-847.
[12] BAI P,ZHANG B,ZHAO X,et al.Decreased metabolism and increased tolerance to extreme environments in Staphylococcus warneri during long-term spaceflight[J].Microbiology Open,2019,8(12):e917.
[13] ZHANG B,BAI P,ZHAO X,et al.Increased growth rate and amikacin resistance of Salmonella enteritidis after one-month spaceflight on China’s Shenzhou-11 spacecraft[J].Microbiology Open,2019,8(9):e00833.
[14] WANG Y J,YUAN Y T,LIU J W,et al.Transcriptomic and proteomic responses of Serratia marcescens to spaceflight conditions involve large-scale changes in metabolic pathways[J].Advances in Space Research,2014,53(7):1 108-1 117.
[15] LI T Z,CHANG D,XU H W,et al.Impact of a short-term exposure to spaceflight on the phenotype,genome,transcriptome and proteome of Escherichia coli[J].International Journal of Astrobiology,2015,14(3):435-444.
[16] ROMSDAHL J,BLACHOWICZ A,CHIANG A J,et al.Characterization of Aspergillus niger isolated from the International Space Station[J].mSystems,2018,3(5):e00 112-00 118.
[17] BLACHOWICZ A,CHIANG A J,ROMSDAHL J,et al.Proteomic characterization of Aspergillus fumigatus isolated from air and surfaces of the international space station[J].Fungal Genetics and Biology,2019,124:39-46.
[18] CRABBÉ A,NIELSEN-PREISS S M,WOOLLEY C M,et al.Spaceflight enhances cell aggregation and random budding in Candida albicans[J].PLoS One,2013,8(12):e80677.
[19] ZHAO X,YU Y,ZHANG X L,et al.Decreased biofilm formation ability of Acinetobacter baumannii after spaceflight on China’s Shenzhou 11 spacecraft[J].Microbiology Open,2019,8(6):e763.
[20] KIM W,TENGRA F K,YOUNG Z,et al.Spaceflight promotes biofilm formation by Pseudomonas aeruginosa[J].PLoS One,2013,8(4):e62437
[21] MORRISON M D,FAJARDO-CAVAZOS P,NICHOLSON W L.Cultivation in space flight produces minimal alterations in the susceptibility of Bacillus subtilis cells to 72 different antibiotics and growth-inhibiting compounds[J].Applied and Environmental Microbiology,2017,83(21).DOI:10.1128/AEM.01 584-17.
[22] KIM W,TENGRA F K,SHONG J,et al.Effect of spaceflight on Pseudomonas aeruginosa final cell density is modulated by nutrient and oxygen availability[J].BMC Microbiology,2013,13(1):241.
[23] LEE K W K,PERIASAMY S,MUKHERJEE M,et al.Biofilm development and enhanced stress resistance of a model,mixed-species community biofilm[J].ISME Journal,2014,8(4):894-907.
[24] FARSHADZADEH Z,TACHERI B,RAHIMI S,et al.Growth rate and biofilm formation ability of clinical and laboratory-evolved colistin-resistant strains of Acinetobacter baumannii[J].Frontiers in Microbiology,2018,9:153.
[25] SANDERS M E,AKKERMANS L M,HALLER D,et al.Safety assessment of probiotics for human use[J].Gut Microbes,2010,1(3):164.
[26] LIU C.The theory and application of space microbiology:China′s experiences in space experiments and beyond[J].Environmental Microbiology,2017,19(2):426-433.
[27] 马丽,魏海霞,汪倩倩,等.航天诱变毛霉ZY-3在腐乳生产中的应用研究[J].中国酿造,2015,34(4):62-65.
MA L,WEI H X,WANG Q Q,et al.Application of space mutation strain Mucor ZY-3 in sufu production[J].China Brewing,2015,34(4):62-65.
[28] 张彬,庄名扬,武金华,等.酿酒微生物太空育种及在生产中的应用研究(Ⅰ)己酸菌太空育种及在生产中的应用[J].酿酒,2014,41(5):35-38.
ZHANG B,ZHUANG M Y,WU J H,et al.Mutagting strains in space of brew microorganisms and application of them in production(Ⅰ)application of caproic acid bacteria of space mutant strains in production[J].Liquor Making,2014,41(5):35-38.
[29] 张彬,杨涛,管桂臻,等.酿酒微生物太空育种及在生产中的应用研究(Ⅱ)芝麻香型白酒酿造功能微生物的太空育种[J].酿酒,2014,41(6):45-50.
ZHANG B,YANG T,GUAN G Z,et al.Mutagting strains in space of brew microorganisms and application of them in production(Ⅱ)space mutation breeding of functional microorganisms in sesame flavor liquor[J].Liquor Making,2014,41(6):45-50.
[30] 蔡洋,靳华荣,周广田.空间诱变优良上面啤酒酵母发酵性能研究[J].酿酒科技,2014 (11):44-47.
CAI Y,JIN H R,ZHOU G T.The fermenting performance of top-fermenting mutant strains by space mutation[J].Liquor-Making Science & Technology,2014 (11):44-47.
[31] 刘雪,韩雪娟,曹建全,等.芝麻香细菌曲的太空诱变育种[J].酿酒,2015,42(4):95-98.
LIU X,HAN X J,CAO J Q,et al.Space mutation of bacterial species in sesame flavor-Fuqu[J].Liquor Making,2015,42(4):95-98.
[32] 文鹏程,隋馨瑶,孙二娜,等.航天诱变高产酸副干酪乳杆菌A-4-2性质与酶活性研究[J].农业机械学报,2019,50(1):346-353.
WEN P C,SUI X Y,SUN E N,et al.Characteristics and enzyme activity of Lactobacillus paracasei A-4-2 produced by space mutation[J].Transactions of the Chinese Society for Agricultural Machinery,2019,50(1):346-353.
[33] 王莹,孙二娜,隋馨瑶,等.航天搭载对嗜热链球菌G2的诱变作用及发酵性能评价[J].食品与发酵工业,2018,44(8):65-70.
WANG Y,SUI X Y,SUN E N,et al.Mutagenesis effect of space mutation on Streptococcus thermophilus and its fermentation performance evaluation[J].Food and Fermentation Industries,2018,44(8):65-70.
[34] 隋馨瑶,孙二娜,王莹,等.空间搭载长双歧杆菌BBMN68耐氧株筛选及其耐酸耐胆盐特性[J].甘肃农业大学学报,2019(3):186-192.
SUI X Y,SUN E N,WANG Y,et al.Screening of oxygen-tolerant strain of Bifidobacterium longum BMNC68 by space and study on its acid tolerace and bile salt-tolerance properties[J].Journal of Gansu Agricultural University,2019,(3):186-192.
[35] 张彬,庄名扬,武金华,等.酿酒微生物太空育种及在生产中的应用研究(Ⅲ)芝麻香型白酒太空菌种在生产中的应用[J].酿酒,2015,42(2):21-27.
ZHANG B,ZHUANG M Y,WU J H,et al.Mutagting strains in space of brew microorganisms and application of them in production(Ⅲ)research of application process in sesame flavor liquor′s brewed technology of space mutation functional microorganisms[J].Liquor Making,2015,42(2):21-27.
[36] 陈志梅,张宗舟,薛林贵,等.航天诱变混菌生抽发酵研究[J].甘肃农业大学学报,2011,46(3):104-108.
CHEN Z M,ZHANG Z Z,XUE L G,et al.Mixed fermentation of soy sauce with space mutant strains[J].Journal of Gansu Agricultural University,2011,46(3):104-108.
[37] 张宗舟,巩晓芳,薛林贵.航天香醋发酵工艺研究[J].中国酿造,2012,31(2):63-65.
ZHANG Z Z,GONG X F,XUE L G.Study on fermentation process of the aerospace vinegar[J].China Brewing,2012,31(2):63-65.
[38] 彭立影,刘功良,许莹莹,等.蜂蜜接合酵母协同传统曲种发酵广东黄酒的工艺研究[J].食品与发酵工业,2019,45(8):103-108.
PENG L Y,LIU G L,XU Y Y,et al.Fermentation process of Guangdong yellow rice wine using Zygosaccharomyces mellis and traditional brewing species[J].Food and Fermentation Industries,2019,45(8):103-108.
[39] 郭梅君,周世水,刘幼强,等.降低米香型白酒杂醇油的蒸馏方法研究[J].酿酒科技,2019(4):44-47.
GUO M J,ZHOU S S,LIU Y Q,et al.Research on the distillation method of Mixiang Baijiu to reduce fusel oil content[J].Liquor-Making Science & Technology,2019(4):44-47.
[40] 李理,冯静文,刘力,等.豆腐酸浆中酵母的分离鉴定及其在酸豆乳中的应用[J].现代食品科技,2016,32(5):173-179.
LI L,FENG J W,LIU L,et al.Isolation and identification of yeast from acidic tofu whey and its application to soy yogurt[J].Modern Food Science and Technology,2016,32(5):173-179.