Lactobacillus reuteri 121 GtfB是首个在糖苷水解酶70(glycoside hydrolase 70,GH70)家族中发现的对蔗糖无活性的4,6-α-葡萄糖基转移酶(4,6-α-glucanotransferase,4,6-α-GTase),能够作用于麦芽低聚糖和淀粉,断裂(α1→4)键并形成连续的(α1→6)键[1-2]。N端截断的GtfB(GtfBdN)不仅具有全活性,而且能够高表达,并且它的酶活力测定方法也已被建立[3]。另外,也已获得GtfBdNdV的晶体结构[4]。继Lactobacillus reuteri GtfB发现之后,来自Lactobacillus reuteri DSM 20016和ML1的GTFW和GTFML4的发现需要构建GH70一个新的亚家族[5],即GtfB-型酶。GtfC-型酶[6]和GtfD-型酶[7-8]与GtfB-型酶[9-11]一起构成了GH70中作用淀粉底物的3个新的亚家族。而Lactobacillus reuteri 121 GtfB是3个亚家族中研究最多的一个酶。
利用Lactobacillus reuteri 121 GtfBdN改性多种淀粉得到异麦芽/麦芽多糖(isomalto/malto-polysaccharide,IMMP),区分了IMMP中引入的线性(α1→6)键和淀粉中天然的(α1→4,6)分支点,表明(α1→4,6)分支点的存在会影响GtfBdN的转糖基活性[12]。以酶特异性降解的方式揭示IMMP的亚结构,并测定了新引入的(α1→6)连接的糖苷链及其(α1→4)连接的糖苷受体链的链长分布,表明对于(α1→4)连接的糖苷链,GtfBdN更倾向于使用线性(α1→6)连接的糖苷链作为受体[13]。对来自多种淀粉和麦芽糊精经GtfB改性得到的IMMP进行表征,表明其为一种水溶性膳食纤维,并且证明长链线性(α1→4)葡聚糖链的底物能够得到具有更高(α1→6)键百分比的产物[14]。将GtfB或GtfBdN作用于不同淀粉底物,得到含有不同(α1→6)键比例的IMMP,将其在体外发酵人粪便表征它的肠道发酵特性,结果表明在所有IMMP发酵过程中,总体微生物多样性以及双歧杆菌和乳杆菌的相对丰度显著增加,证明IMMP是具有益生元潜力的可缓慢发酵的纤维[15]。
基于以上研究现状,对Lactobacillus reuteri 121 GtfB的研究多集中于其改性淀粉的产物作为膳食纤维和益生元分析与结构的关联方面,缺乏与应用相关的产物本身理化性质的测定。前人研究中,红薯淀粉和马铃薯淀粉经Lactobacillus reuteri 121 GtfBdN改性后产物与对照相比,在结构上具有比较明显的差别[12-13]。因此,本研究选择薯类淀粉作为底物,包括红薯淀粉、木薯淀粉和马铃薯淀粉,利用Lactobacillus reuteri 121 GtfBdN进行改性,并对改性后的产物进行结构和理化性质测定,以期为4,6-α-GTase改性薯类淀粉在食品体系中的应用提供基础。
1 材料与方法
1.1 主要试剂与设备
红薯淀粉(直链淀粉质量分数为29%)、木薯淀粉(直链淀粉质量分数为23%)、马铃薯淀粉(直链淀粉质量分数为34%),杭州普罗星淀粉有限公司;GtfBdN,实验室储藏;异淀粉酶(EC3.2.1.68),爱尔兰Megazyme公司;直链淀粉,美国Sigma Aldrich公司;其他试剂均为分析纯,国药集团化学试剂有限公司。
Avance Ⅲ 400 MHZ全数字化核磁共振波谱仪,德国布鲁克公司;DAWN HELEOS Ⅱ 高效尺寸排阻色谱仪-多角度激光光散射-折光检测器,美国怀雅特技术公司;ICS—5000+ 高效阴离子交换色谱仪-脉冲安培检测器,美国赛默飞世尔科技公司;RVA 4500快速黏度分析仪,波通澳大利亚公司;DHR-3流变仪,美国沃特世公司;X-DSC7000差示扫描量热仪,日本精工电子纳米科技有限公司。
1.2 GtfBdN的表达、纯化及酶活力测定
参考BAI等[3]酶的表达、纯化和酶活力测定方法,并稍作修改。从实验室保藏菌种中挑取菌液接种于含有100 μg/mL氨苄青霉素的LB液体培养基中,于37 ℃、200 r/min的条件下培养10 h得到种子液。以体积分数1%的接种量,将种子液接种于含有100 μg/mL氨苄青霉素的LB液体培养基中,37 ℃、200 r/min条件下扩大培养,直至OD600值为0.4~0.6。之后取出冰浴15 min,加入异丙基硫代半乳糖苷至终浓度为1 mmol/L,于18 ℃、160 r/min培养24 h诱导产酶。在4 ℃、10 000 r/min的条件下离心10 min,收集菌体。按照1 g菌体溶于5~6 mL 20 mmol/L Tris-HCl(250 mmol/L NaCl,pH 7.5)将菌体重悬,于冰浴中超声破壁20 min。破壁后的菌液在4 ℃、10 000 r/min的条件下离心30 min,收集上清液即为粗酶液。利用镍亲和层析对粗酶液进行纯化,依次用20 mmol/L Tris-HCl(250 mmol/L NaCl,pH 7.5)和含有不同浓度咪唑的20 mmol/L Tris-HCl(250 mmol/L NaCl,pH 7.5)进行洗脱,收集每部分的流穿液,进行聚丙烯酰胺凝胶电泳条带验证。将得到的纯酶进行酶活力测定,用于后续试验。
1.3 GtfBdN改性薯类淀粉
将红薯淀粉、木薯淀粉和马铃薯淀粉分别分散于醋酸钠缓冲液(25 mmol/L,pH 5)中配制成50 mg/mL的淀粉乳,沸水浴30 min充分糊化。稍作冷却后40 ℃保温15 min,分别添加GtfBdN(1.32 U/g干基淀粉)反应24 h,沸水浴15 min停止反应。反应样品冷却至室温后加入2倍体积无水乙醇醇沉12 h,于4 ℃、8 000 r/min条件下离心20 min,收集沉淀置于40 ℃烘箱中烘干,研磨过100目筛备用。改性前的对照为不添加酶经过上述相同处理的薯类淀粉。
1.4 键型比例测定
将1.3中所述样品以质量浓度20 mg/mL分别分散于重水中,沸水浴1 h,每隔10 min涡旋振荡一次使其均匀分散。于-80 ℃冷冻过夜,真空干燥2 d。上述操作循环2次,测定时复溶于重水中。在400 MHz全数字化核磁共振(nuclear magnetic resonance,NMR)波谱仪上记录一维核磁共振光谱,谱宽为8 000 Hz。所有光谱均使用MestReNova 12.0.3处理。
1.5 相对分子质量测定
参考JI等[16]的样品处理方法和测试条件并稍作修改。流动相流速为0.5 mL/min,在上样前以8倍体积无水乙醇醇沉2 h,收集沉淀复溶于流动相中,煮沸至澄清透明,在高效尺寸排阻色谱(high performance size exclusion chromatography,HPSEC)上进样。利用Astra 5.3.4对数据进行分析。
1.6 链长分布测定
测试条件参考CHANG等[17]的方法,样品前处理方法如下,将1.3中所述样品分别分散于醋酸钠缓冲液(50 mmol/L,pH 4.5)中配制成2 mg/mL的淀粉乳,煮沸30 min充分糊化。取1.5 mL糊化的样品在42 ℃保温15 min,加入2 U异淀粉酶脱支,充分反应24 h。反应结束后在95 ℃灭酶10 min,5 000 r/min离心2 min,将上清液稀释10倍后过0.22 μm水膜。
1.7 糊化特性测定
将1.3中所述样品各3 g加入25 g去离子水制成悬浮液,置于快速黏度分析仪 (rapid visco-analyzer,RVA)专用的测试铝盒中,并用配套的塑料搅拌桨不停搅拌防止淀粉颗粒沉降。参考BHAT等[18]的测试条件,按照设定的程序进行测定。
1.8 黏弹特性测定
将1.3中所述样品分别以去离子水配制成质量浓度为50 mg/mL的淀粉乳,沸水浴30 min完全糊化,冷却至室温。固定温度为25 ℃,间隙为1 mm,平板直径为4 cm,将样品置于流变仪上,对样品进行动态流变测试。在进行动态流变测试前,首先测定各个样品的线性黏弹区,在0.001%~1 000%的应变范围内以1 Hz的恒定频率进行应变扫描,得到各样品线性黏弹区域的范围。然后固定应变,在0.1~100 rad/s的角频率范围内进行频率扫描,获得弹性模量(elastic modulus,G′)、黏性模量(viscous modulus,G″)随角频率变化的关系曲线。
1.9 回生特性测定
将1.3中所述样品各2~4 mg置于差示扫描量热仪(differential scanning calorimetry,DSC)配套的坩埚中,按照1∶2(g∶mL)的比例加入去离子水,压片密封。室温平衡12 h以上,以空坩埚为参比,将各样品放入DSC中进行糊化。温度扫描范围20~95 ℃,升温速率10 ℃/min。糊化后的样品立即放入4 ℃冰箱中贮存1、3、5、7、14和21 d用于测定回生焓。
1.10 数据处理
采用SPSS 22.0软件对实验数据进行分析,实验结果为3次平行实验的平均值,以![]() 表示。
表示。
2 结果与分析
2.1 GtfBdN改性对淀粉分子结构的影响
2.1.1 键型比例分析
图1为一维核磁共振氢谱测得的(α1→4)键和(α1→6)键含量的谱图。化学位移在5.4 ppm左右处的峰对应于(α1→4)键,化学位移在5.0 ppm左右处的峰对应于(α1→6)键。未经改性的淀粉中(α1→6)键含量均低于5.0%[12,19],而经GtfBdN改性的红薯淀粉、木薯淀粉和马铃薯淀粉中(α1→6)键所占比例分别为20.7%、19.5%和26.6%,表明GtfBdN改性使3种薯类淀粉中均引入了新的(α1→6)键。根据前人的研究,产物中新形成的(α1→6)键是线性(α1→6)键[12]。
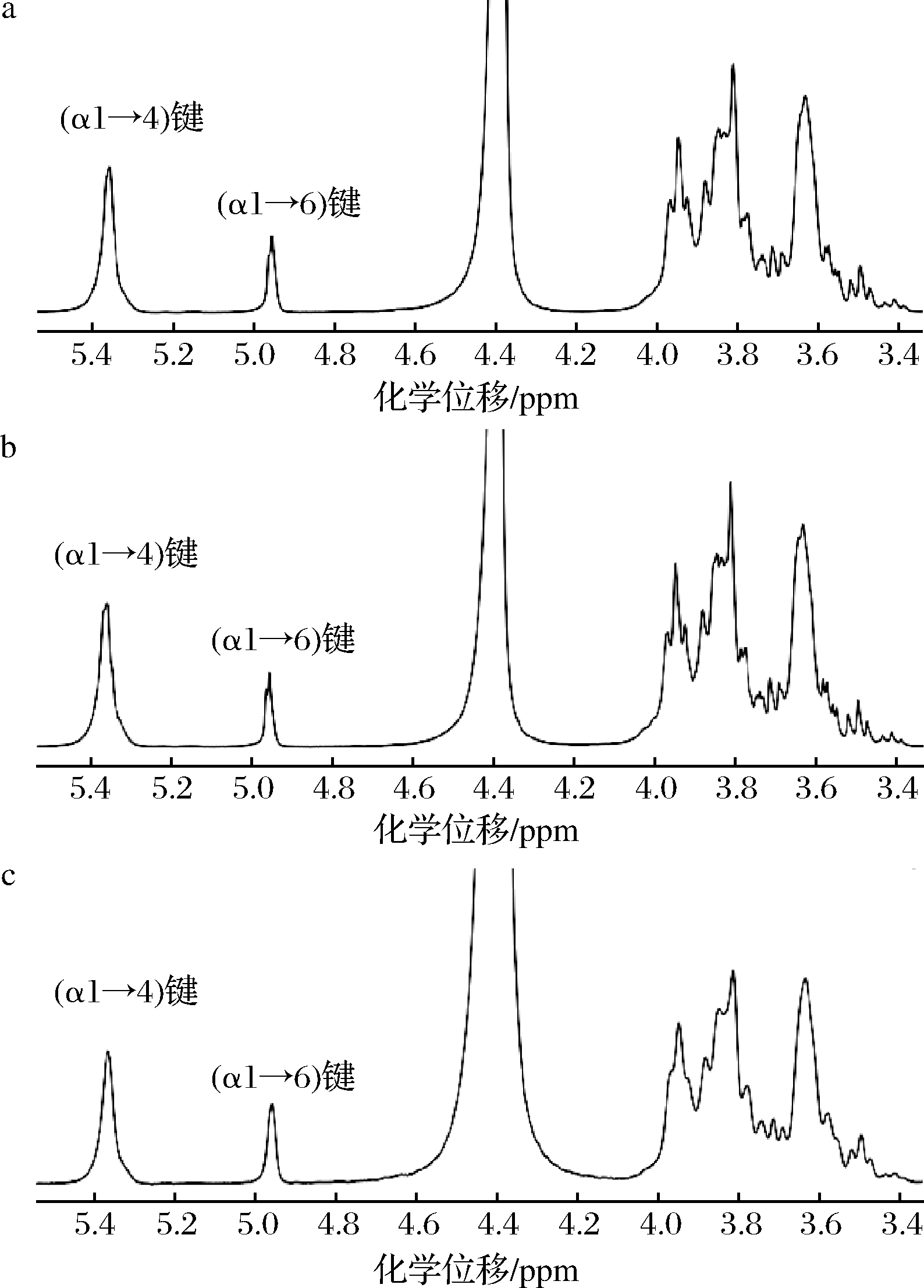
a-红薯淀粉;b-木薯淀粉;c-马铃薯淀粉
图1 三种薯类淀粉经GtfBdN改性后的核磁共振波谱图
Fig.1 The NMR spectra of three kinds of tuber
starches modified by GtfBdN
2.1.2 相对分子质量分析
糊化后的3种薯类淀粉与其各自对应的GtfBdN改性产物在HPSEC上的洗脱曲线如图2所示。改性前淀粉的洗脱表面积均小于其对应的GtfBdN改性产物的洗脱表面积,并且改性前淀粉的出峰时间早于GtfBdN改性产物的出峰时间。BELLO-PEREZ等[20]研究了处理方法对于淀粉样品溶解度的影响,发现一般的处理方法均会使所得样品受到损失。由于改性前淀粉与GtfBdN改性产物的处理方式与上样量均相同,洗脱表面积的不同表明两者被洗脱的程度不同。因此,改性前淀粉本身的溶解度以及能够被流动相洗脱的程度与GtfBdN改性产物之间存在差异可能是导致两者洗脱表面积不同的原因。红薯淀粉和木薯淀粉均在洗脱体积为12.5 mL左右出现第1个峰,其各自对应的GtfBdN改性产物均在14.0 mL左右出现第1个峰。而马铃薯淀粉的第1个出峰时间约为13.5 mL,其经GtfBdN改性后产物的第1个出峰时间约为16.0 mL。可以看出,以上3种薯类淀粉在经过GtfBdN改性后,出峰时间发生较为明显的右移。这表明GtfBdN改性产物分子质量变小,且GtfBdN可以修饰底物中的支链淀粉部分。从图2中还观察到马铃薯淀粉经GtfBdN改性后产物的洗脱曲线与另外2种淀粉改性后产物的洗脱曲线形状不同,猜测可能与马铃薯淀粉具有较高的平均支链淀粉链长有关[12]。

a-红薯淀粉;b-木薯淀粉;c-马铃薯淀粉
图2 三种薯类淀粉经GtfBdN改性前后的示差折光信号色谱图
Fig.2 Chromatograms of differential refractive signal of three kinds of tuber starches before and after modification by GtfBdN
糊化后3种薯类淀粉与其各自对应的GtfBdN改性产物的分子质量分布信息如表1所示。由表1可以看出,改性前3种薯类淀粉分子质量Mw数量级均为107,旋转半径(radius of gyration,Rw)较大,多分散系数(polydispersity index,PDI)较小,与前人的文献报道相一致[21-22]。而经GtfBdN改性后产物的Mw数量级变为105,Rw减小,PDI增加。这表明糊化的3种薯类淀粉均被GtfBdN水解成为较小的分子,这些分子在溶液中占据的当量球体体积减小,体系中分子种类增多,分子质量分布变广。
表1 三种薯类淀粉经GtfBdN改性前后的分子质量分布
Table 1 The molecular weight distribution of three kinds of
tuber starches before and after modification by GtfBdN
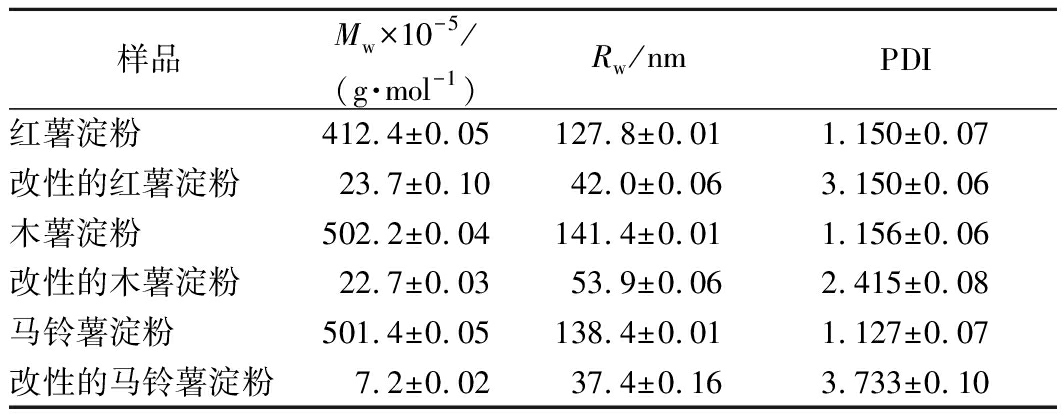
样品Mw×10-5/(g·mol-1)Rw/nmPDI红薯淀粉412.4±0.05127.8±0.011.150±0.07改性的红薯淀粉23.7±0.1042.0±0.063.150±0.06木薯淀粉502.2±0.04141.4±0.011.156±0.06改性的木薯淀粉22.7±0.0353.9±0.062.415±0.08马铃薯淀粉501.4±0.05138.4±0.011.127±0.07改性的马铃薯淀粉7.2±0.0237.4±0.163.733±0.10
2.1.3 链长分布分析
表2为糊化后的3种薯类淀粉及其各自对应的GtfBdN改性产物的链段变化情况。将链长根据聚合度(degree of polymerization,DP)分为以下4个部分:DP 6~12为A链,DP 13~24为B1链,DP 25~36为B2链,DP ≥37为B3链[23]。由表2可知,各样品B1链的相对含量最高。GtfBdN改性后产物均表现出B2和B3链相对含量降低,A链相对含量增加的现象。红薯淀粉和木薯淀粉经GtfBdN改性后B1链相对含量增加,而马铃薯淀粉经GtfBdN改性后B1链的相对含量略有降低。红薯淀粉经GtfBdN改性后B2链的相对含量减少了39.6%,B3链的相对含量减少了40.5%,A链的相对含量增加了150.0%,B1链的相对含量增加了9.9%。木薯淀粉经GtfBdN改性后B2链的相对含量减少了50.3%,B3链的相对含量减少了46.2%,A链的相对含量增加了162.2%,B1链的相对含量增加了18.1%。马铃薯淀粉经GtfBdN改性后B2链的相对含量减少了23.1%,B3链的相对含量减少了33.8%,A链的相对含量增加了200.0%,B1链的相对含量减少了2.7%。比较3种薯类淀粉利用GtfBdN改性后产物与改性前淀粉的链段分布模式可知,GtfBdN倾向于水解B2链和B3链,从而使这2个链段的相对含量减少。淀粉分子的结构变化将不可避免的影响淀粉的理化性质。
表2 三种薯类淀粉经GtfBdN改性前后的链段变化
Table 2 Chain segment changes of three kinds of tuber
starches before and after modification by GtfBdN
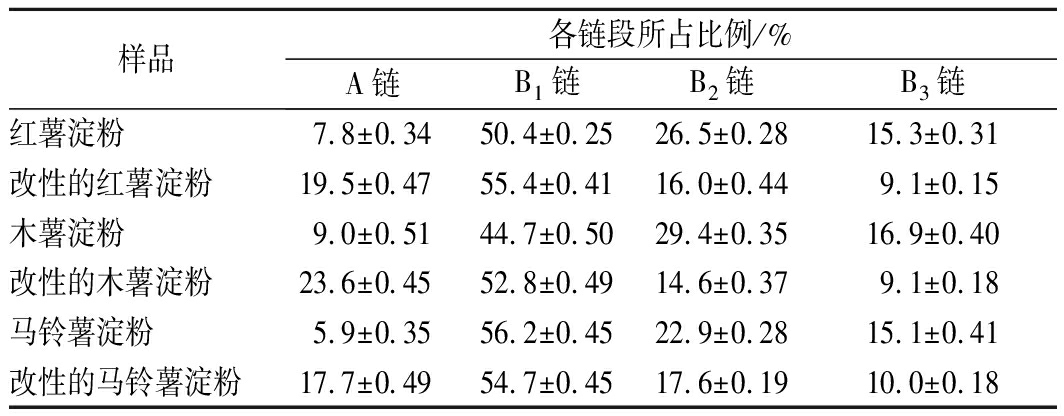
样品各链段所占比例/%A链B1链B2链B3链红薯淀粉7.8±0.3450.4±0.2526.5±0.2815.3±0.31改性的红薯淀粉19.5±0.4755.4±0.4116.0±0.449.1±0.15木薯淀粉9.0±0.5144.7±0.5029.4±0.3516.9±0.40改性的木薯淀粉23.6±0.4552.8±0.4914.6±0.379.1±0.18马铃薯淀粉5.9±0.3556.2±0.4522.9±0.2815.1±0.41改性的马铃薯淀粉17.7±0.4954.7±0.4517.6±0.1910.0±0.18
2.2 GtfBdN改性对淀粉理化性质的影响
2.2.1 糊化特性分析
图3为糊化后的3种薯类淀粉及其各自对应的GtfBdN改性产物的RVA曲线。由图3可知,改性前的淀粉均呈现典型的RVA曲线,存在峰值黏度、谷值黏度、终值黏度、糊化温度、崩解值和回生值。但经过GtfBdN改性后产物的RVA曲线中这些特征值消失,均表现出黏度大幅下降的现象。峰值黏度与水的结合能力有关。GtfBdN改性产物峰值黏度的消失,表明其与水结合的能力减弱,加热期间不易溶胀[24],这可能是淀粉分子的结构发生变化所引起的。终值黏度和谷值黏度的差值为回生值,可以作为短期回生的参考,短期回生的快慢主要取决于直链淀粉的含量与聚集速度[25]。GtfBdN改性产物回生值消失,表明其短期不易回生。而改性前淀粉中直链淀粉含量比较高,有利于在淀粉回生的初始阶段直链淀粉间的聚集,因此改性前淀粉的短期回生较快。而GtfBdN能够水解直链淀粉中的(α1→4)键,使得经GtfBdN改性后产物中直链淀粉含量减少,进而使得改性产物中直链淀粉的聚集速度变慢,能够延缓短期回生。因此,可将改性后的产物应用于饮料等流体食品中,既能满足流体食品低黏度的特质,又能使其不易沉淀,更加均一稳定。
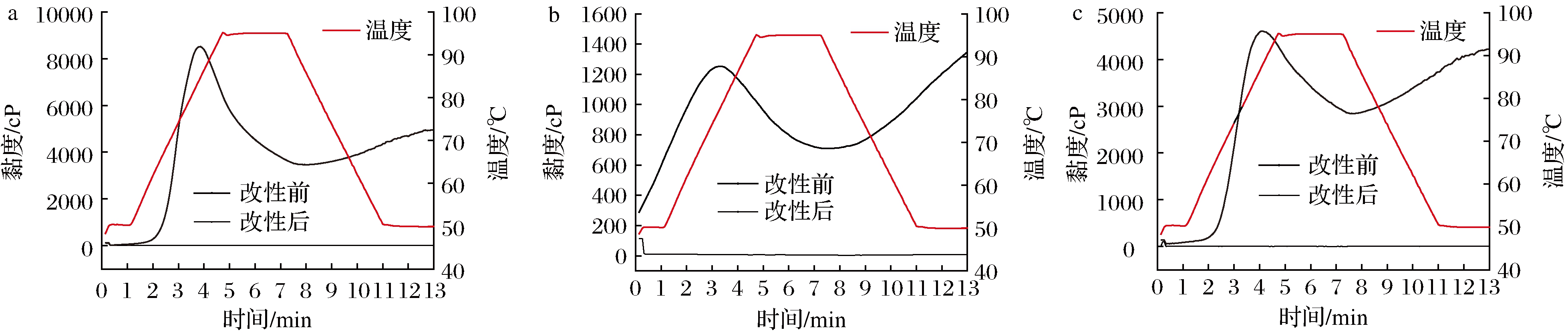
a-红薯淀粉;b-木薯淀粉;c-马铃薯淀粉
图3 三种薯类淀粉经GtfBdN改性前后的RVA曲线
Fig.3 RVA curves of three kinds of tuber starches before and after modification by GtfBdN
2.2.2 黏弹特性分析
图4为糊化后的3种薯类淀粉及其各自对应的GtfBdN改性产物的动态流变曲线。G′为弹性模量,表示样品在形变中具有的能量,能够反映样品在形变后恢复原样的能力;G″为黏性模量,表示样品在形变中因抵抗外力而损失的能量,能够反映样品的抗流动能力[26]。由图4可知,改性前3种薯类淀粉的G′和G″均随角频率的增加而增加。在整个测试范围内,红薯淀粉和马铃薯淀粉改性前的G′均高于G″,表明它们均趋向于形成固态的凝胶。而木薯淀粉改性前G″高于G′,表现为类液体行为。对于3种经GtfBdN改性后的产物而言,在测试范围内G′和G″均存在交叉,这表明它们存在过渡黏弹性[27]。在交叉频率以下G′<G″,表明在它们较大的时间尺度上呈流体状。在较高频率下G′>G″,表明弹性行为仅在短时间内占主导地位。在整个测试范围内,未改性淀粉的G′和G″均大于其对应的GtfBdN改性产物。3种薯类淀粉经GtfBdN改性后动态流变行为的转变可能与淀粉分子的结构改变,其被降解为较小的分子有关[28]。

a-红薯淀粉;b-木薯淀粉;c-马铃薯淀粉
图4 三种薯类淀粉经GtfBdN改性前后的动态流变曲线
Fig.4 Dynamic rheological curves of three kinds of tuber starches before and after modification by GtfBdN
2.2.3 回生特性分析
糊化后的3种薯类淀粉及其各自对应的GtfBdN改性产物在4 ℃储藏不同时间后回生焓的变化情况见表3。在回生过程中,淀粉的直链淀粉主要负责短期回生,而长期回生则由支链部分主导,但是直链淀粉在后期也参与直链淀粉和支链淀粉双螺旋的聚集,对回生起协同作用[29]。由表3可知,所有样品的回生焓值都随储藏时间的增加而增加,表明样品在储藏期间发生了重结晶,样品重结晶程度的不同,导致最终的回生焓值不同。对比改性前后淀粉的回生焓发现,GtfBdN改性后产物在不同储藏时间下的回生焓值减小。表明在长期回生中,GtfBdN改性产物能够延缓回生。这个现象可在侧链分布的结果中得到证实,DP>24的链段相对含量减少,DP 6~12的链段相对含量大大增加,不利于双螺旋的形成,因而能够延缓长期回生[30]。因此,将改性后的产物应用于面包等烘焙食品中,可改善因淀粉回生引起的不良感官品质。
表3 三种薯类淀粉经GtfBdN改性前后的回生焓值
Table 3 The retrogradation enthalpy of three kinds of
tuber starches before and after modification by GtfBdN

样品回生焓ΔHr/(J·g-1)1 d3 d5 d7 d14 d21 d红薯淀粉4.38±0.404.85±1.065.73±0.305.78±0.196.38±0.186.74±0.38改性的红薯淀粉4.35±0.144.71±0.534.93±0.335.13±0.086.06±0.446.35±0.13木薯淀粉-2.07±0.103.20±0.193.94±0.424.15±0.174.95±0.55改性的木薯淀粉-1.45±0.333.16±0.243.67±0.423.81±0.514.69±0.03马铃薯淀粉4.16±0.185.84±1.066.50±0.187.55±0.627.94±1.018.11±0.29改性的马铃薯淀粉3.97±0.084.89±0.255.05±0.946.86±0.166.97±0.717.17±0.37
注:“-”表示未检测到
3 结论
将红薯淀粉、木薯淀粉和马铃薯淀粉3种薯类淀粉利用GtfBdN进行改性,测定产物的结构和理化性质。GtfBdN改性使产物中均引入了新的(α1→6)键,产物的相对分子质量减小,体系中分子种类增多,GtfBdN倾向于水解比较长的外侧链,导致长链所占比例降低,短链所占比例增加。这些结构的变化使其理化性质也发生改变。GtfBdN改性后产物的黏度大幅下降,短期回生变慢。改性后的产物更接近于流体,GtfBdN改性能够延缓长期回生。因此,经GtfBdN改性后的产物可以应用于饮料、米糊、面包等食品中,在符合原有应用场景的前提下,还能够起到减缓回生的效果,使食品品质得到改善和提高。这将为4,6-α-GTase改性薯类淀粉在食品体系中的应用提供一定基础。
[1] KRALJ S,GRIJPSTRA P,VAN LEEUWEN S S,et al.4,6-α-Glucanotransferase,a novel enzyme that structurally and functionally provides an evolutionary link between glycoside hydrolase enzyme families 13 and 70[J].Applied and Environmental Microbiology,2011,77(22):8 154-8 163.
[2] DOBRUCHOWSKA J M,GERWIG G J,KRALJ S,et al.Structural characterization of linear isomalto-/malto-oligomer products synthesized by the novel GTFB 4,6-α-glucanotransferase enzyme from Lactobacillus reuteri 121[J].Glycobiology,2012,22(4):517-528.
[3] BAI Y X,VAN DER KAAIJ R M,LEEMHUIS H,et al.Biochemical characterization of the Lactobacillus reuteri glycoside hydrolase family 70 GTFB type of 4,6-α-glucanotransferase enzymes that synthesize soluble dietary starch fibers[J].Applied and Environmental Microbiology,2015,81(20):7 223-7 232.
[4] BAI Y X,GANGOITI J,DIJKSTRA B W,et al.Crystal structure of 4,6-α-glucanotransferase supports diet-driven evolution of GH70 enzymes from α-amylases in oral bacteria[J].Structure,2017,25(2):231-242.
[5] LEEMHUIS H,DIJKMAN W P,DOBRUCHOWSKA J M,et al.4,6-α-Glucanotransferase activity occurs more widespread in Lactobacillus strains and constitutes a separate GH70 subfamily[J].Applied Microbiology and Biotechnology,2013,97(1):181-193.
[6] GANGOITI J,PIJNING T,DIJKHUIZEN L.The Exiguobacterium sibiricum 255-15 GtfC enzyme represents a novel glycoside hydrolase 70 subfamily of 4,6-α-Glucanotransferase enzymes[J].Applied and Environmental Microbiology,2016,82(2):756-766.
[7] GANGOITI J,VAN LEEUWEN S S,VAFIADI C,et al.The Gram-negative bacterium Azotobacter chroococcum NCIMB 8003 employs a new glycoside hydrolase family 70 4,6-α-glucanotransferase enzyme (GtfD) to synthesize a reuteran like polymer from maltodextrins and starch[J].Biochimica et Biophysica Acta-General Subjects,2016,1860(6):1 224-1 236.
[8] GANGOITI J,LAMOTHE L,VAN LEEUWEN S S,et al.Characterization of the Paenibacillus beijingensis DSM 24997 GtfD and its glucan polymer products representing a new glycoside hydrolase 70 subfamily of 4,6-α-glucanotransferase enzymes[J].Plos One,2017,12(4).DOI:10.1371/journal.pone.0172622.
[9] GANGOITI J,VAN LEEUWEN S S,MENG X,et al.Mining novel starch-converting glycoside hydrolase 70 enzymes from the Nestlé culture collection genome database:The Lactobacillus reuteri NCC 2613 GtfB[J].Scientific Reports,2017,7(1).DOI:10.1038/s41 598-017-07190-z.
[10] MENG X F,GANGOITI J,DEKOK N,et al.Biochemical characterization of two GH70 family 4,6-α-glucanotransferases with distinct product specificity from Lactobacillus aviarius subsp.aviarius DSM 20655[J].Food Chemistry,2018,253:236-246.
[11] GANGOITI J,VAN LEEUWEN S S,GERWIG G J,et al.4,3-α-Glucanotransferase,a novel reaction specificity in glycoside hydrolase family 70 and clan GH-H[J].Scientific Reports,2017,7.DOI:10.1038/srep39761.
[12] VAN DER ZAAL P H,SCHOLS H A,BITTER J H,et al.Isomalto/malto-polysaccharide structure in relation to the structural properties of starch substrates[J].Carbohydrate Polymers,2018,185:179-186.
[13] VAN DER ZAAL P H,KLOSTERMANN C E,SCHOLS H A,et al.Enzymatic fingerprinting of isomalto/malto-polysaccharides[J].Carbohydrate Polymers,2019,205:279-286.
[14] LEEMHUIS H,DOBRUCHOWSKA J M,EBBELAAR M,et al.Isomalto/malto-polysaccharide,a novel soluble dietary fibre made via enzymatic conversion of starch[J].Journal of Agricultural and Food Chemistry,2014,62(49):12 034-12 044.
[15] GU F J,BOREWICZ K,RICHTER B,et al.In vitro fermentation behaviour of isomalto/malto-polysaccharides using human faecal inoculum indicates prebiotic potential[J].Molecular Nutrition and Food Research,2018,62(12):1800232.DOI:10.1002/mnfr.201800232.
[16] JI H Y,BAI Y X,LI X X,et al.Structural and property characterization of corn starch modified by cyclodextrin glycosyltransferase and specific cyclodextrinase[J].Carbohydrate Polymers,2020,237:116137.DOI:10.1016/j.carbpol.2020.116137.
[17] CHANG R R,TIAN Y Q,LU H,et al.Effects of fractionation and heat-moisture treatment on structural changes and digestibility of debranched waxy maize starch[J].Food Hydrocolloids,2020,101.DOI:10.1016/j.foodhyd.2019.105488.
[18] BHAT N A,WANI I A,HAMDANI A M,et al.Effect of extrusion on the physicochemical and antioxidant properties of value added snacks from whole wheat (Triticum aestivum L.) flour[J].Food Chemistry,2019,276:22-32.
[19] BAI Y X,BÖGER M,VAN DER KAAIJ R M,et al.Lactobacillus reuteri strains convert starch and maltodextrins into homoexopolysaccharides using an extracellular and cell-associated 4,6-α-Glucanotransferase[J].Journal of Agricultural and Food Chemistry,2016,64(14):2 941-2 952.
[20] BELLO-PEREZ L A,ROGER P,BAUD B,et al.Macromolecular features of starches determined by aqueous high-performance size exclusion chromatography[J].Journal of Cereal Science,1998,27(3):267-278.
[21] YE F Y,XIAO L,LIANG Y N,et al.Spontaneous fermentation tunes the physicochemical properties of sweet potato starch by modifying the structure of starch molecules[J].Carbohydrate Polymers,2019,213:79-88.
[22] 于轩.不同来源淀粉的分子结构对其酶解性能影响的研究[D].无锡:江南大学,2013.
YU X.The effect of molecular structure on enzymatic properties of starches from various sources[D].Wuxi:Jiangnan University,2013.
[23] LI H,CUI B,JANASWAMY S,et al.Structural and functional modifications of kudzu starch modified by branching enzyme[J].International Journal of Food Properties,2019,22(1):952-966.
[24] 廖卢艳,吴卫国.不同淀粉糊化及凝胶特性与粉条品质的关系[J].农业工程学报,2014,30(15):332-338.
LIAO L Y,WU W G.Relationship between gelatinization and gel properties of different starch and their noodles[J].Transactions of the Chinese Society of Agricultural Engineering,2014,30(15):332-338.
[25] DURA A,BTASZCZAK W,ROSELL C M.Functionality of porous starch obtained by amylase or amyloglucosidase treatments[J].Carbohydrate Polymers,2014,101:837-845.
[26] 黄峻榕,董贝贝,刘树兴,等.3种薯类淀粉的流变与凝胶特性研究[J].粮食与油脂,2017,30(4):25-29.
HUANG J R,DONG B B,LIU S X,et al.Study of rheological and gel properties of three tuber starches[J].Cereals & Oils,2017,30(4):25-29.
[27] YUAN D,LI C,HUANG Q,et al.Ultrasonic degradation effects on the physicochemical,rheological and antioxidant properties of polysaccharide from Sargassum pallidum[J].Carbohydrate Polymers,2020,239.DOI:10.1016/j.carbpol.2020.116230.
[28] GUJRAL H S,ROSELL C M.Modification of pasting properties of wheat starch by cyclodextrin glycosyltransferase[J].Journal of the Science of Food and Agriculture,2010,84(13):1 685-1 690.
[29] AUH J H,CHAE H Y,KIM Y R,et al.Modification of rice starch by selective degradation of amylose using Alkalophilic Bacillus Cyclomaltodextrinase[J].Journal of Agricultural and Food Chemistry,2006,54(1):2 314-2 319.
[30] GREWAL N,FAUBION J,FENG G H,et al.Structure of waxy maize starch hydrolyzed by maltogenic α-amylase in relation to its retrogradation[J].Journal of Agricultural and Food Chemistry,2015,63(16):4 196-4 201.