磷脂酰丝氨酸是一类新资源食品,可作为营养强化剂添加在酸奶、奶粉、面包、粉末饮料等食品中,具有增加脑突刺数目、提高脑细胞的流动性及促进脑细胞中葡萄糖代谢等功效,进而预防及辅助治疗阿尔茨默氏症、抑郁症等神经性疾病[1]。由于磷酯酰丝氨酸具有重要的医疗保健功能,如何制备品质高、价格低的磷酯酰丝氨酸产品是食品及医药领域的重点关注方向。研究发现,通过磷脂酶D生物转化能够生产高品质磷脂酰丝氨酸。因此,磷脂酶D的高效获得成为生物转化合成磷酯酰丝氨酸的关键,已报道的产磷脂酶D的微生物种类主要有链霉菌[2]、棒状杆菌[3]、大肠杆菌[4]、假单胞菌[5]、沙门氏杆菌[6]、蜡状芽孢杆菌[7]、不动杆菌[8]等。经过菌株诱变、基因工程改造等方式,逐步提高了磷脂酶D活性,但目前仍然无法满足磷酯酰丝氨酸工业化生产的要求[9]。因此,如何获得高活性磷脂酶D仍是实现磷酯酰丝氨酸生物合成的关键。
实验室前期在油厂附近的土壤中,筛选获得1株产磷脂酶D的蜡状芽孢杆菌(Bacillus cereus)ZY12[10-11]。为确定发酵条件与产酶量的关系,进一步提高菌株ZY12磷脂酶D酶活性,本研究对金属离子、不同来源卵磷脂及小分子糖等多种化合物进行筛选,并对培养温度、pH等条件进行优化,进而确定蜡状芽孢杆菌ZY12的最佳产酶条件,为相似产酶菌株发酵条件的选择提供理论依据。
1 材料与方法
1.1 菌株
蜡状芽孢杆菌ZY12分离自油厂附近土壤中,实验室保藏。
1.2 培养基
LB培养基(g/L):蛋白胨 10,NaCl 5,酵母浸粉 5,调至pH至7。
蛋黄培养基IL(g/L):蛋黄 10,MgSO4·7H2O 0.5,CaCl21,调pH至7。
蛋白胨+葡萄糖+IL培养基PGIL(g/L):蛋白胨 10,葡萄糖5,蛋黄 10,MgSO4·7H2O 0.5,CaCl21,调pH至7。
蛋白胨+IL培养基PIL(g/L):蛋白胨 10,蛋黄 10,MgSO4·7H2O 0.5,CaCl21,调pH至7。
蛋白胨培养基PEP(g/L):蛋白胨 10,CaCl21,MgSO4·7H2O 0.5,调pH至7。
卵磷脂+蛋白胨培养基PESO;PEPE;PEPS;PPC(g/L):卵磷脂(大豆卵磷脂;花生卵磷脂;葵花卵磷脂;水溶性卵磷脂)5,蛋白胨 10,MgSO4·7H2O 0.5,CaCl21,调pH至7。
糖类+PPC培养基GPPC;FPPC;MPPC(g/L):糖类(葡萄糖、果糖、麦芽糖)5,蛋白胨 10,水溶性卵磷脂 5,MgSO4·7H2O 0.5,CaCl21,调pH至7。
1.3 实验方法
1.3.1 种子培养
取500 μL甘油管保藏的菌株ZY12加入50 mL IL培养基中,30 ℃、200 r/min摇床培养。
1.3.2 发酵培养
取1 mL培养24 h的种子液(接种量体积比2%)加入50 mL IL培养基中,30 ℃、200 r/min摇床培养。
1.3.3 磷脂酶D活性测定
酶联比色法[12]:反应体系包括为100 μL PC乙醚(称取0.5 g卵磷脂,加1 mL 乙醚,制成500 mg/mL的溶液,加水至10 mL,冰浴振荡)、100 μL 酶液、100 μL 柠檬酸-柠檬酸钠(0.1 mol/L,pH 6)、50 μL 0.1 mol/L CaCl2、150 μL 7.5% Triton X-100。37 ℃水浴摇床反应10 min。沸水浴3 min 终止酶反应,冷却至室温,加入4 mL Tris-HCl溶液(包含2 mg 4-氨基安替比林、4 U 胆碱氧化酶、4 U 过氧化物酶、1 mg 苯酚和20 mg Triton X-100), 37 ℃水浴摇床反应20 min,500 nm处测吸光值。
1.3.4 菌株ZY12磷脂酶D分布情况的测定
取10 mL发酵液10 000 r/min离心20 min,离心后,上清液也为胞外酶液。
取10 mL发酵液于10 000 r/min离心20 min,离心后的菌体用质量分数0.9% NaCl溶液洗涤3次,将洗净的菌体重悬于10 mL PBS缓冲液中,超声破碎,设置程序:功率300 W,模式为每超声1 s间歇3 s,时间10 min。超声时菌液处于冰浴中,保持低温防止酶失活。破碎后处理条件与胞外酶相同,离心后上清液为胞内酶液。离心后沉淀用质量分数0.9% NaCl 溶液洗涤3次,10 mL PBS缓冲液重悬,悬液为胞壁酶液。
1.3.5 pH对菌株ZY12产酶的影响
配制不同pH值的缓冲液,其中pH 5、6为柠檬酸-磷酸氢钠缓冲液,pH 7、8、9为Tris-HCl缓冲液,pH 10为甘氨酸-NaOH缓冲液。在30 ℃条件下,菌体在上述缓冲液配制的蛋黄培养基中200 r/min摇床培养36 h。培养结束后,测定不同pH下磷脂酶D活性。
1.3.6 金属离子对磷脂酶D活性的影响
向IL培养基中加入含有不同金属离子的盐,包括NaCl、KCl、CaCl2、MgSO4·7H2O、BaCl2、FeCl3、FeSO4·7H2O、CuSO4·5H2O、ZnSO4·H2O和MnSO4·H2O等,使得金属离子的终浓度为2 mmol/L。在30 ℃条件下,菌体在添加了不同金属离子的IL培养基(pH 7)中200 r/min摇床培养36 h。培养结束后,测定不同金属离子存在下磷脂酶D活性。
向IL培养基中加入MgSO4·7H2O,使得金属离子的终浓度为0.5、1、2、4、8、16 mmol/L,培养条件同上,培养结束后,测定不同浓度Mg2+存在下磷脂酶D活性。
2 结果与分析
2.1 蜡状芽孢杆菌 ZY12培养基碳氮源的优化
2.1.1 培养基组成对磷脂酶D活性和蜡状芽孢杆菌ZY12细胞形态的影响
菌株ZY12在蛋黄为唯一碳氮源的平板中能够产生透明圈,将该菌种培养在蛋黄为唯一碳氮源的液体培养基IL中,36 h发酵结束后,在胞外检测到磷脂酶D活性,如图1所示。

图1 蛋黄培养基中胞外、胞壁、胞内磷脂酶D活性对比
Fig.1 Activity of PLD in different position of strain
Bacillus cereus ZY12 growing in IL medium
由于IL培养基中蛋黄为唯一碳氮源,营养相对单一,可能影响菌体生长及产酶。因此将培养基更换为适合细菌生长的LB培养基,或在IL培养基中添加不同类型碳氮源,以期通过丰富培养基营养组分提高菌株的生物量及磷脂酶D活性。当菌株ZY12在PGIL培养基、PIL培养基、LB培养基中发酵培养36 h后,胞外均检测不到磷脂酶D活性。镜检结果显示,菌株ZY12芽孢较小、菌体呈短杆状,整体形态规则,未相互缠绕聚集。而培养在IL培养基具有磷脂酶D活性的菌株ZY12芽孢部分明显突出、位于菌体中心,菌体形态较粗短,部分菌体相互连接成长链状、缠绕聚集,如图2所示。酶活性检测结果表明,菌株ZY12只有在IL培养基中进行发酵培养方可检测到磷脂酶D活性,当培养基中不含蛋黄或除蛋黄外含有其他碳氮源时,菌株ZY12无法检测到磷脂酶D活性。由此推测蛋黄中某些成分能够诱导菌株ZY12产生磷脂酶D。

图2 不同培养基中培养条件及菌体形态的差异
Fig.2 The different of the Morphology of strain
B.cereus ZY12 growing in different mediums
2.1.2 不同来源卵磷脂对蜡状芽孢杆菌ZY12诱导产酶的影响
菌株ZY12在IL培养基中培养可检测到磷脂酶D活性,蛋黄中比率最高的磷脂类物质为卵磷脂(PC)[13],同时PC又是磷脂酶D的作用底物,因此推测出PC是诱导菌株ZY12产生磷脂酶D的关键物质。在不同来源的PC培养基中[大豆卵磷脂(PESO)、花生卵磷脂(PEPE)、葵花卵磷脂(PEPS)、水溶性卵磷脂中(PPC)],菌株ZY12发酵培养36 h后,均能检测到磷脂酶D活性,如图3所示。不同来源PC均能够诱导菌株ZY12产磷脂酶D,但在IL培养基中发酵的菌体酶活性最高。推测是由于蛋黄中卵磷脂具有更好的水溶性及细胞膜穿透性,因此在蛋黄卵磷脂的诱导下,菌株ZY12磷脂酶D活性更高。
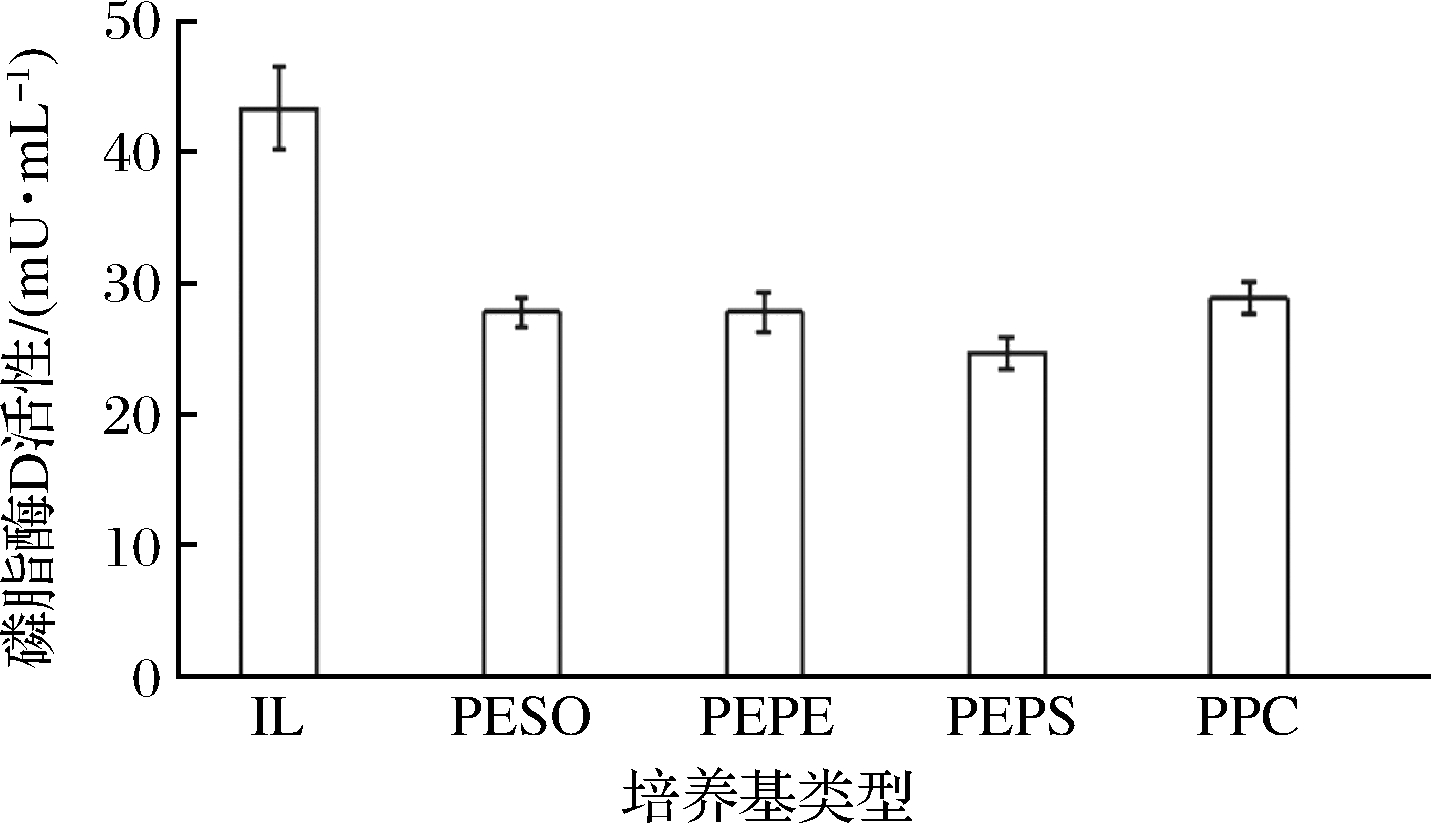
图3 不同来源卵磷脂对磷脂酶D活性的影响
Fig.3 PLD activities of strain B.cereus ZY12
growing in different PC mediums
2.1.3 小分子糖在PPC培养基中对蜡状芽孢杆菌ZY12产酶的影响
前期试验结果显示,当IL培养基中存在葡萄糖时,菌株无磷脂酶D活性。为检测不同小分子糖对菌株ZY12产磷脂酶D的影响,采用成分单一的水溶性卵磷脂作为培养基(PPC)主要成分,通过添加葡萄糖、果糖、麦芽糖,检测ZY12在培养基GPPC、FPPC、MPPC中发酵培养36 h后磷脂酶D活性。由图4可知,只有在未添加小分子糖类物质的PPC培养基中,菌株ZY12发酵结束后才具有磷脂酶D活性。当培养基中存在葡萄糖、果糖以及麦芽糖等小分子糖类时,卵磷脂的诱导作用均被抑制,在胞外检测不到磷脂酶D活性。结果证实某些碳源(如葡萄糖、果糖、麦芽糖)会抑制磷脂酶D的表达。目前,文献中筛选磷脂酶D产生菌所用的培养基中均添加有小分子糖[14-17],这种筛选方法会阻碍诱导型磷脂酶D产生菌的获得。即使培养基中添加诱导物,但与葡萄糖、果糖或麦芽糖等碳源同时存在时,诱导物不能产生诱导作用,进而限制产磷脂酶D菌株的获得。
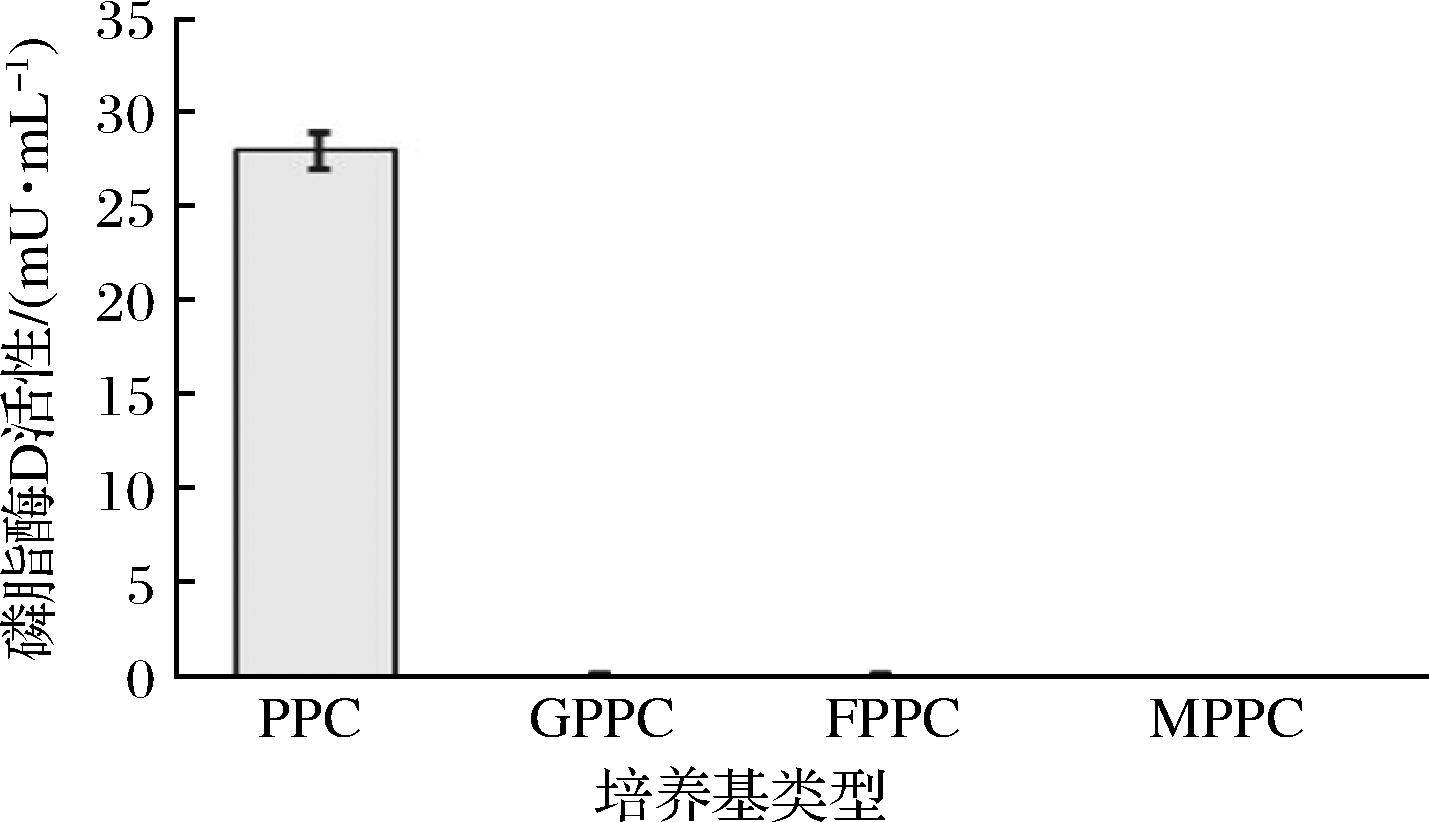
图4 水溶性卵磷脂培养基中不同碳源对磷脂酶D活性的影响
Fig.4 PLD activities of strain B.cereus ZY12 growing
in water-soluble PC with different carbon sources mediums
2.1.4 蛋黄质量浓度对蜡状芽孢杆菌ZY12产酶的影响
蛋黄做为唯一碳氮源能够使菌株ZY12产生更高的磷脂酶D活性,将菌株ZY12培养在不同蛋黄质量浓度(1、5、10、15、20、25、30 g/L)下的IL培养基中,30 ℃发酵培养36 h,测定胞外磷脂酶D活性。如图5所示,蛋黄质量浓度在10~30 g/L,磷脂酶D活性无显著差异,由于在吸取蛋黄过程中,可能混入少量蛋清,且存在一定误差,因此选择20 g/L,进行后期实验。

图5 蛋黄浓度对磷脂酶D活性的影响
Fig.5 Effects of different yolk concentration on PLD activities of
strain B.cereus ZY12 adding in IL medium
2.2 pH、温度对蜡状芽孢杆菌ZY12产酶的影响
2.2.1 pH对蜡状芽孢杆菌ZY12产酶的影响
如图6所示,当pH介于6~8之间时,酶活性较高;pH为8时,酶活性最高;随着pH继续增大,酶活性急剧下降。通常情况下,芽孢杆菌属的菌体对pH有较强的耐受能力,不会出现产酶能力急剧下降的现象。但菌株ZY12所处环境pH大于8后,酶活性急剧下降,可能是由于碱性条件下,ZY12产生的磷脂酶D水解活性增强,菌体生存环境进一步恶化,导致了菌体在较高pH值环境下耐受性降低、产酶量下降。由于在菌株ZY12发酵中,某些代谢产物会改变培养环境的pH,为防止培养环境碱性化后酶活性的急剧下降,因此,发酵过程中pH最终确定为7。
2.2.2 温度对蜡状芽孢杆菌ZY12产酶的影响
在pH 7的条件下,30 ℃时的酶活性最高;随着温度的升高,酶活性下降并不显著(图6),说明菌体对温度的耐受能力较强。依据上述结果,将菌株ZY12培养在pH为7的蛋黄培养基中,30 ℃发酵培养36 h后可在发酵液中获得较高的磷脂酶D活性。
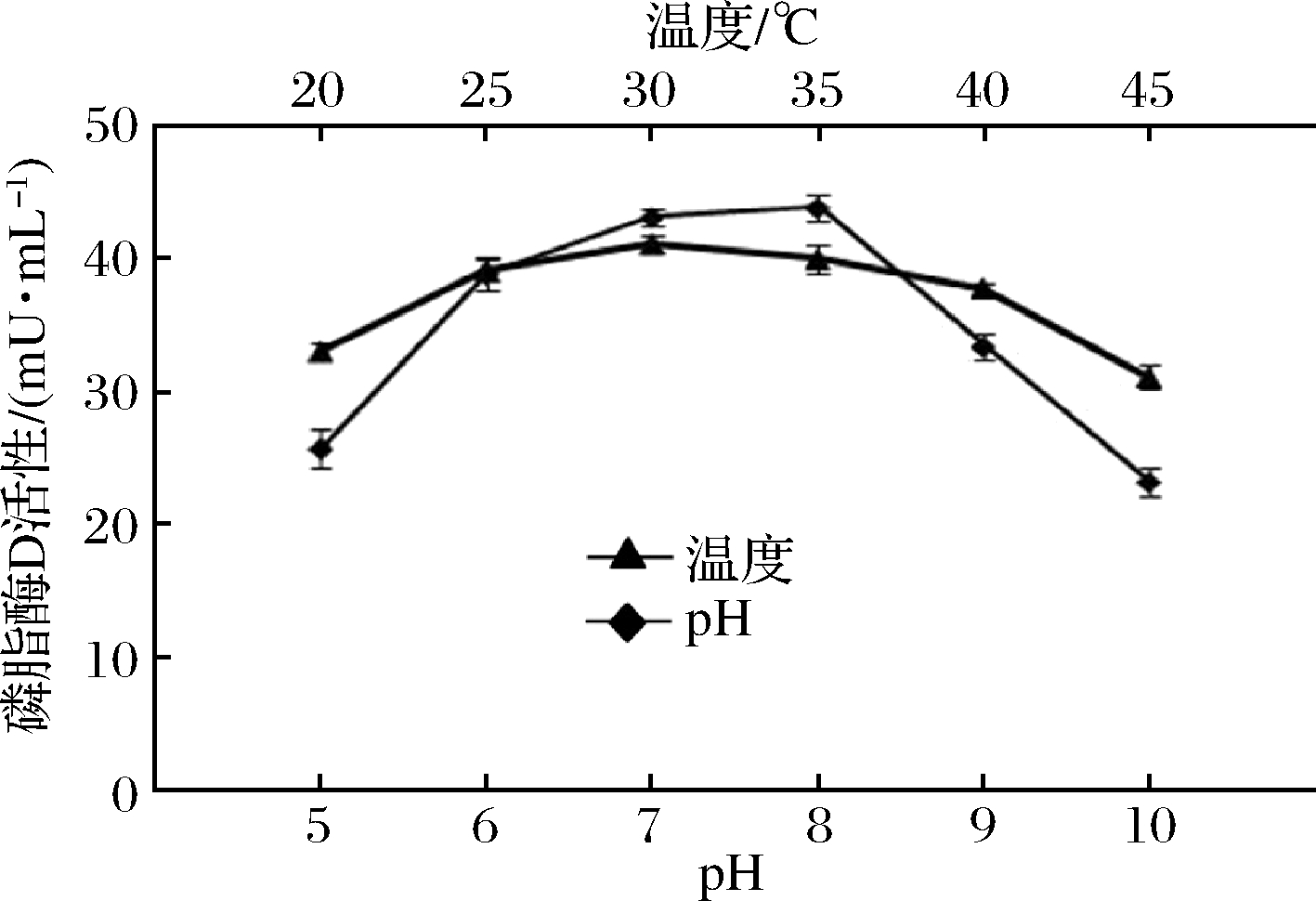
图6 蛋黄培养基中不同pH、温度条件下产酶曲线
Fig.6 Effects of pH and temperature on PLD activities of
strain B.cereus ZY12 growing in IL medium
2.3 金属离子对蜡状芽孢杆菌ZY12磷脂酶D活性的影响
多数磷脂酶D产生活性时需要Ca2+的参与,同时部分二价离子能够提高磷脂酶D活性[18]。如图7所示,通过在培养基中添加不同单一金属离子,发现在添加了Mg2+、Na+、Ca2+的发酵液中均能够检测到磷脂酶D活性。实验结果显示,不同金属离子增加磷脂酶D催化活性强度如下:Mg2+>Ca2+>Na+>(二价金属离子、Fe3+无催化活性)。

图7 蛋黄培养中添加不同金属离子对磷脂酶D活性的影响
Fig.7 Effects of different metal ions on PLD activities of strain B.cereus ZY12 adding in IL medium
为确定金属离子添加最优配比,将以上3种离子(Mg2+、Na+、Ca2+)分别添加到最初实验中测试的单一离子(Mg2+、Na+、Ca2+、Ba2+、Zn2+、Fe2+、Cu2+、Fe3+)中,确定最优组合。结果显示,任何离子与Ca2+共同添加在培养基中,菌株磷脂酶D活性与单一Ca2+接近;除Ca2+外,Mg2+与其他金属离子共同添加的培养基中的磷脂酶D活性与单一Mg2+接近且活性最高。而Na+只能增加Fe3+培养基中酶活性使其与添加单一Na+的磷脂酶D活性相似。实验结果显示,不同金属离子与磷脂酶D的结合有强弱差别,结合强度依次为:Ca2+>Mg2+>二价金属离子>Na+>Fe3+。虽然Mg2+能够使磷脂酶D具有更高的催化活性,但磷脂酶D优先与催化活性低于Mg2+的Ca2+结合,并表现出单一Ca2+参与的催化活性。这一结果与多数磷脂酶D表现出的Ca2+添加后催化活性最高的研究结果不同。菌株ZY12产生的磷脂酶D添加Ca2+后,具有催化活性,但酶活性低于添加Mg2+后的磷脂酶D。因此在培养基中填加单一Mg2+能够获得更高的酶活性,共同添加其他金属离子对酶活性无正向影响。在培养基中添加不同浓度单一Mg2+,结果如图8所示,Mg2+添加浓度为2 mmol/L时,磷脂酶D活性最大。
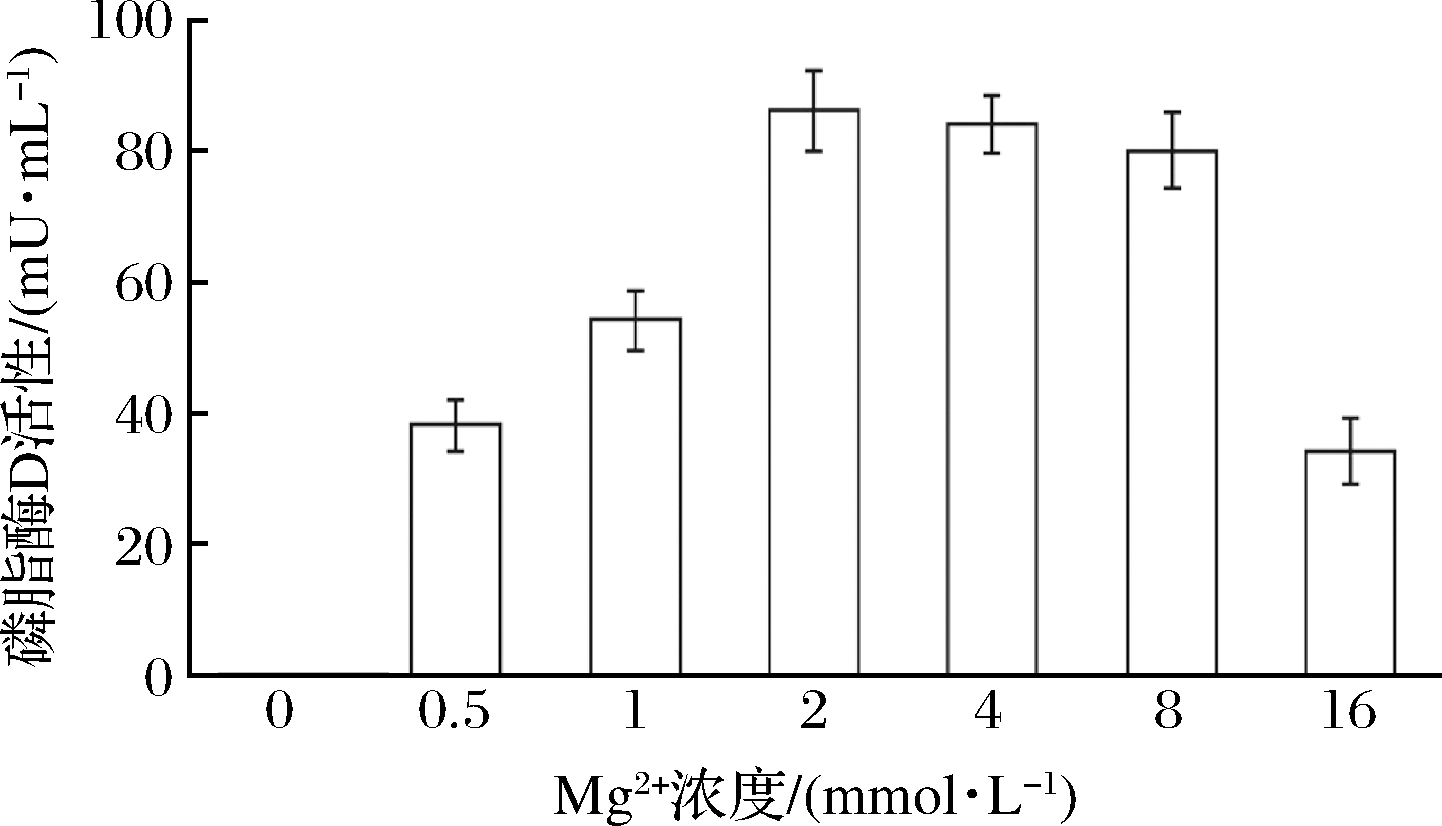
图8 Mg2+浓度对磷脂酶D活性的影响
Fig.8 Effects of different Mg2+concentration on PLD activities
of strain B.cereus ZY12 adding in IL medium
3 结论
本文以前期筛选到的产磷脂酶D的蜡状芽孢杆菌ZY12出发,通过单因素试验,确定了菌株ZY12最适产酶培养基为:20 g/L蛋黄、2 mmol/L MgSO4·7 H2O、pH为7、培养温度30 ℃、培养时间36 h,磷脂酶D活性最高。菌株ZY12能够在蛋黄、大豆卵磷脂、花生卵磷脂、葵花卵磷脂、水溶性卵磷脂的诱导下产生磷脂酶D,但当培养基中添加葡萄糖、果糖、麦芽糖则会抑制磷脂酶D的产生。
实验研究表明,Mg2+的添加能够使菌株具有更高的磷脂酶D活性,但共同添加Ca2+会降低酶活性。说明菌株ZY12产生的磷脂酶D与前期研究的其他类型磷脂酶D在催化离子的种类选择上有较大差别。菌株ZY12只有在特定物质诱导,且无小分子糖存在的条件下,才能产生磷脂酶D。但目前文献中关于筛选磷脂酶D产生菌所用培养基,均添加有小分子糖类[14-17]。由于小分子糖类会抑制诱导型磷脂酶D的产生,导致筛选过程中,许多诱导型磷脂酶D产生菌被遗漏,造成筛选结果单一,阻碍了高效磷脂酶D产生菌的获得。通过本研究确定了一种新型的筛选培养基,能够筛选获得某些诱导型磷脂酶D产生菌,为磷脂酶产生菌的筛选提供理论基础及方法创新。
[1] ZAMANIAN G,PARTOAZAR A,TAVANGAR S M,et al.Effect of phosphatidylserine on cirrhosis-induced hepatic encephalopathy: Response to acute endotoxemia in cirrhotic rats[J].Life Sciences,2020,253.DOI:10.1016/j.lfs.2020.117606.
[2] HUANG L,MA J Y,SANG J C,et al.Enhancing the thermostability of phospholipase D from Streptomyces halstedii by directed evolution and elucidating the mechanism of a key amino acid residue using molecular dynamics simulation[J].International Journal of Biological Macromolecules,2020,164:3 065-3 074.
[3] MAHMOOD Z K,JIN Z A M,JESSE F F,et al.Relationship between the Corynebacterium pseudotuberculosis,phospholipase D inoculation and the fertility characteristics of crossbred Boer Bucks[J].Livestock Science,2016,191:12-21.
[4] JEUCKEN A,HELMS J B,BROUWERS J F.Cardiolipin synthases of Escherichia coli have phospholipid class specific phospholipase D activity dependent on endogenous and foreign phospholipids[J].Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids,2018,1863(10):1 345-1 353.
[5] ZHANG Z X,CHEN M,XU W,et al.Microbial phospholipase D: Identification,modification and application[J].Trends in Food Science & Technology,2020,96:145-156.
[6] YAO Y F,LI J X,LIN Y Y,et al.Structural insights into phospholipase D function[J].Progress in Lipid Research,2021,81:101 070.
[7] ZHAO Y,XU Y F,YU F,et al.Identification of a novel phospholipase D gene and effects of carbon sources on its expression in Bacillus cereus ZY12[J].Journal of Microbiology,2018,56(4):264-271.
[8] MAO X Z,LIU Q Q,QIU Y Q,et al.Identification of a novel phospholipase D with high transphosphatidylation activity and its application in synthesis of phosphatidylserine and DHA-phosphatidylserine[J].Journal of Biotechnology,2017,249:51-58.
[9] MAO S H,ZHANG Z H,MA X Y,et al.Efficient secretion expression of phospholipase D in Bacillus subtilis and its application in synthesis of phosphatidylserine by enzyme immobilization[J].International Journal of Biological Macromolecules,2021,169:282-289.
[10] ZHAO Y,SUI S S,YU F,et al.Improved expression of Bacillus cereus phospholipase D in E.coli [J].Arch Latinoam Nutr,2019,69(4):137-143.
[11] 徐银凤,赵雨,孙迪,等.蜡状芽孢杆菌磷脂酶D的活性形式及HKD活性区域的分子改造对其活性的影响[J].中国生物化学与分子生物学报,2017,33(11):1 161-1 167.
XU Y F,ZHAO Y,SUN D,et al.The active form of phospholipase D from Bacillus cereus and the effect of molecular modification of HKD active region on its activity[J].Chinese Journal of Biochemistry and Molecular Biology,2017,33(11):1 161-1 167.
[12] 张红宇,万嗣宝,尹京苑.低温贮藏中桃果实磷脂酶D活性的测定[J].食品科技,2012,37(5):22-25.
ZHANG H Y,WAN S B,YIN J Y.Improved method for detecting phospholipase D activity of peach fruit during cold storage[J].Food Science and Technology,2012,37(5):22-25.
[13] 王庆玲,金永国,卢士玲,等.不同禽蛋蛋黄甘油三酯的脂质组学比较研究[J].现代食品科技,2017,33(2):210-216.
WANG Q L,JIN Y G,LU S L,et al.Lipidomic analysis of egg yolk triglycerides in different poultry eggs[J].Modern Food Science and Technology,2017,33(2):210-216.
[14] CARREA G,D’ARRIGO P,PIERGIANNI V,et al.Purification and properties of two phospholipases D from Streptomyces sp.[J].Biochimica et Biophysica Acta (BBA)-Lipids and Lipid Metabolism,1995,1 255(3):273-279.
[15] HAGISHITA T,NISHIKAWA M,HATANAKA T.Isolation of phospholipase D producing microorganisms with high transphosphatidylation activity[J].Biotechnology Letters,2000,22(20):1 587-1 590.
[16] 石创,张薇,王一丁.磷脂酶D产生菌株的筛选及其转磷脂化反应特性[J].四川大学学报(自然科学版),2016,53(1):215-220.
SHI C,ZHANG W,WANG Y D.Screening of a phospholipase D producing strain and its transphosphatidylation activity[J].Journal of Sichuan University (Natural Science Edition),2016,53(1):215-220.
[17] 杨学利,张璐,王一丁.高产磷脂酶 D 菌株的筛选、鉴定及发酵条件优化[J].江苏农业科学,2016,44(12):521 -525.
YANG X L,ZHANG L,WANG Y D.Screening,identification and fermentation conditions optimization of high activity phospholipase D strain [J].Jiangsu Agricultural Sciences,2016,44(12):521-525.
[18] HOU H J,GONG J S,DONG Y X,et al.Phospholipase D engineering for improving the biocatalytic synthesis of phosphatidylserine[J].Bioprocess and Biosystems Engineering,2019,42(7):1 185-1 194.