化石燃料过度使用导致的土地坍塌、温室效应及环境污染问题日益严重,开发新型能源成为近年来研究的热点[1]。生物柴油具有碳中和、闪点高、可再生等优点,被视为化石能源的理想替代品。而微藻因其结构简单、光合效率高且生长周期短等优势,被视为生物柴油的第三代原料[2]。但在传统养殖条件下,油脂产率低、生产成本高等问题限制了微藻生物柴油的商业化进程[3]。
微藻的生物量积累与油脂合成受诸多环境因素影响。强光、缺氮、高盐及重金属离子等非生物胁迫条件被证明可直接促进微藻油脂的合成[4]。在诸多胁迫条件中,盐胁迫被证明是促进微藻产油的有效方式[5-6]。另外,植物激素可调控微藻生物量的积累和代谢物的合成[7-8]。近期研究表明,在非生物胁迫条件下,植物激素能够通过调节氧化应激反应来促进油脂合成[9-10]。因此,盐胁迫联合植物激素可能是促进微藻油脂产率的有效策略。
褪黑素(melatonin,MT),是一种具有抗氧化活性的内源性植物激素,可以消除活性氧(reactive oxygen species,ROS)、提高植物抗胁迫能力等[11-12]。而这些作用近似于黄腐酸,在非生物胁迫下黄腐酸被证明可以促进微藻的油脂含量[13]。由此推测,盐胁迫下,外源添加 MT可能会进一步促进微藻中油脂的合成。
本实验探索了MT对盐胁迫下富油微藻单针藻Monoraphidium sp.QLY-1油脂合成及相关生理生化指标的影响,并探讨了MT对胞内ROS含量及抗氧化剂谷胱甘肽(glutathione,GSH)活性的影响,分析了外源MT调控藻细胞中ROS水平和油脂合成之间的关系,为促进微藻产油提供了新的思路。
1 材料与方法
1.1 实验材料
1.1.1 原料与试剂
单针藻Monoraphidium sp.QLY-1由本实验组筛选、保存;BG-11培养基购自青岛海博生物技术有限公司;植物激素(褪黑素),生工生物工程有限公司;TRIzol试剂、逆转录试剂盒、荧光定量试剂盒,宝 (TaKaRa) 生物工程(大连)有限公司;活性氧(reactive oxygen species,ROS)测定试剂盒,上海碧云天生物技术有限公司;谷胱甘肽(GSH)测定试剂盒,南京建成生物技术有限公司。本文所用试剂均为分析纯级,鼎国试剂公司。
1.1.2 仪器与设备
分析天平(FA2004 N),上海箐海仪器有限公司;恒温(恒湿)振荡摇床(TS-2011GZ),上海百典仪器设备有限公司;高速离心机(5804R),Eppendorf;灭菌锅(LDZX-50KBS)上海申安医疗器械厂;紫外可见分光光度计(Ultrospec 2100 pro),Amersham Biosciences;真空冷冻干燥机(FD5-12),上海一恒科学仪器有限公司;qPCR仪(ABI-7500),江苏天瑞精准医疗科技有限公司;超净工作台(VS-840-1),上海博迅医疗生物仪器股份有限公司。
1.2 实验方法
1.2.1 微藻培养
采用BG-11培养基,添加葡萄糖至质量浓度为10 g/L,将单针藻Monoraphidium sp.QLY-1接种于含有250 mL培养基的500 mL锥形瓶中,用摇床(温度25 ℃,转速150 r/min)异养培养11 d至对数期末端。将异养种子液接种到含有20 g/L NaCl的BG-11培养基(初生物量约为0.9 g/L),作为对照组;同时添加MT(1、10、100 μmol/L)作为实验组,在摇床中培养3 d,光强30 μmol/(m2·s)、温度25 ℃、转速150 r/min,,每组设置3个平行样。
1.2.2 生物量和油脂含量的测定
取10 mL的培养液(V),5 000 r/min离心10 min后去除上清液并收集生物质,放于真空冷冻干燥机48 h,称取干藻粉质量(m1),按公式(1)计算生物量:
生物量![]()
(1)
微藻油脂含量的检测采用BLIGH等[14]的方法。向研钵中加入3 mL氯仿-甲醇溶液(体积比为2∶1)来提取油脂,在150 r/min摇床中晃动提取30 min,5 000 r/min离心10 min,取上清液。重复以上步骤2~3次,将上清液移至预先称质量的管(m2)中。将管放置于40 ℃干燥箱中处理至质量恒定(m3),按照公式(2)计算油脂含量:
油脂含量![]()
(2)
1.2.3 碳水化合物和蛋白质的测定
按照BERGES等[16]的方法提取并测定总蛋白的含量。根据MA等[17]的方法测定总碳水化合物含量。
1.2.4 油脂合成相关基因表达分析
采用TRIzol法提RNA,用逆转录试剂盒合成cDNA,具体操作参考CHE等[18]的方法。
以cDNA为模板,利用TB Green荧光染料,通过荧光定量 PCR 仪进行RT-PCR扩增,具体步骤参照ZHAO等[15]的方法。酶基因荧光定量引物me和accD序列参照文献[9]。依据扩增曲线,根据2-△△T法计算各基因相对表达量[19]。
1.2.5 ROS和GSH的测定
ROS和GSH的测定,按照试剂盒说明书进行测定。
1.2.6 脂肪酸组成检测
向提取的油脂中加入2 mL 体积分数为3%的 硫酸-甲醇(V∶V=3∶97)混合溶液,在70 ℃水浴中回流4 h进行脂肪酸甲酯化,加入2 mL正己烷振动提取4 h,取正己烷相进行气相色谱-质谱分析[15]。
1.3 数据处理
试验均设置3个平行样,数据表示为平均值±标准差,通过SPSS 19.0软件中ANOVA分析实验数据。最小显著性差异进行多重比较,检验试验的组间差异。*P<0.05表示差异显著,**P<0.01表示差异极显著。
2 结果与讨论
2.1 盐胁迫下MT对单针藻QLY-1细胞生长的影响
在盐质量浓度20 g/L时,测定了不同浓度MT下单针藻QLY-1的生长情况。如图1所示,所有组的生物量在3 d的培养时间中都有所增加。在20 g/L NaCl作用下,微藻生物量从1.05 g/L下降到0.96 g/L,比对照组降低了9.14%。另外,10 μmol/L MT单独处理对微藻的生物量没有显著影响。在盐胁迫下,浓度1~100 μmol/L的MT处理对单针藻QLY-1的生长情况也没有显著影响。LI等[7]也发现1~100 μmol/L的MT处理对单针藻QLY-1的生物量影响不具显著性。因此,可初步断定,低浓度(<1 mmol/L)的MT处理对单针藻QLY-1生物量不会造成显著影响。此外,DING等[10]发现10 μmol/L MT处理会抑制雨生红球藻(Haematococcus pluvialis)在高光和氮缺陷条件下的细胞生长,但可显著提高虾青素的积累量。在植物中,MT可以通过提高光合作用效率、消除ROS、提高抗氧化系统酶活性等方式来降低不良环境带来的氧化损伤,提高种子的发芽率和幼苗生长速率[20,31]。
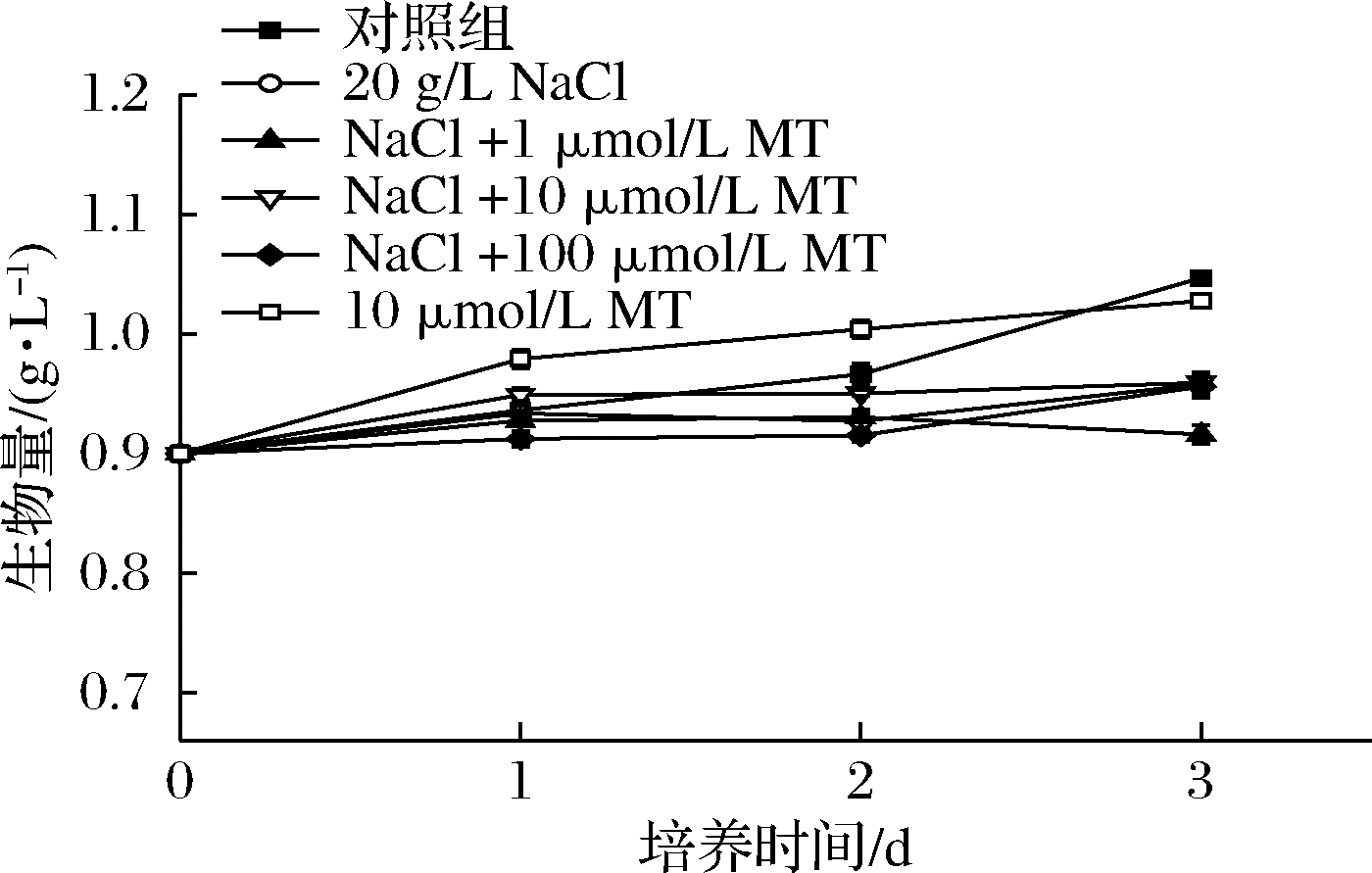
图1 盐胁迫下不同浓度MT对单针藻QLY-1生物量的影响
Fig.1 Effect of MT concentrations on the biomass
of Monoraphidium sp.QLY-1 under salinity stress
而在非生物胁迫下,外源褪黑素可能更多地参与调控微藻中次级代谢产物的合成。此外,响应MT的分子串扰网络需要进一步的研究。
2.2 盐胁迫下MT对单针藻QLY-1油脂积累的影响
如图2所示,培养过程中,微藻油脂含量逐渐上升,并在第2天达到峰值。20 g/L NaCl 胁迫下,单针藻中油脂含量最大值由37.65%提高到42.92%。微藻在盐胁迫下大量积累油脂可能归因于NaCl处理对藻细胞造成氧化胁迫及ROS积累,是微藻在渗透压增加下为保持细胞流动性和完整性的一种适应性机制[32]。10 μmol/L MT联合20 g/L NaCl处理下的微藻油脂积累量达到最大(51.74%),相较于对照组(37.65%)、10 μmol/L MT处理组(45.76%)及20 g/L NaCl处理组(42.93%)分别提高了37.42%、13.07%和20.52%,并且在盐胁迫下其他MT处理组油脂含量也有不同程度的提升。上述结果显示,MT能够与NaCl产生协同效应,进一步提高单针藻QLY-1在盐胁迫下的油脂积累。另外,近期研究显示,外源添加MT能够促进缺氮条件下单针藻QLY-1的油脂合成[21]。由此可知,在非生物胁迫下,外源添加MT可进一步提高微藻中油脂的积累。因此,选取浓度为10 μmol/L MT进行单针藻QLY-1在盐胁迫下油脂合成机理的进一步研究。

图2 盐胁迫下不同浓度MT对单针藻QLY-1油脂积累的影响
Fig.2 Effect of MT concentrations on the lipid content
of Monoraphidium sp.QLY-1 under salinity stress
2.3 盐胁迫下MT对单针藻QLY-1生理生化指标的影响
微藻通过光合作用固定的碳可用于合成能量物质,如脂质、蛋白质和碳水化合物。在外源MT处理下,微藻中碳水化合物量逐渐下降,并在培养周期的最后1 d低于对照组。同时,在培养过程中,MT的添加抑制了盐胁迫下的蛋白质含量。类似地,在光诱导下,MT处理后单针藻细胞中碳水化合物含量相比于对照显著下降[7]。另外,SONG等[8]的研究指出,在植物激素独脚金内酯处理下,单针藻QLY-1中油脂含量显著提高,而碳水化合物和蛋白含量相较于对照组显著下降。蛋白质含量的降低,可能因为MT诱导的藻细胞膜上蛋白质发生降解[23]。因此,MT可能通过参与微藻中蛋白质和碳水化合物的降解来改变碳代谢流,从而促进油脂的积累。

a-碳水化合物;b-蛋白质
图3 盐胁迫下MT对单针藻QLY-1碳水化合物和
蛋白质含量的影响
Fig.3 Effect of MT on the carbohydrate and protein
contents of Monoraphidium sp.QLY-1 under salinity stress
2.4 盐胁迫下MT对单针藻QLY-1油脂合成相关基因的影响
苹果酸在NADP依赖型苹果酸酶(malic enzyme,me)的催化下发生不可逆的脱羧反应,产出丙酮酸、NADPH和CO2,从而参与微藻中多种代谢途径,如油脂合成及光合作用。因此,me并被认为是脂肪酸合成过程中的关键酶[24]。乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACCase)的β碳基转移酶(beta-carboxyltransferase,accD)编码ACCase的β亚基,而ACCase催化乙酰辅酶A(acetyl-CoA)生成丙二酰辅酶A(malonyl-CoA),是脂肪酸合成的第一步反应。10 μmol/L MT诱导对me和accD基因相对表达量的影响如图4所示。me和accD基因分别在第2天和第3天相对表达量达到最高,是盐胁迫组的1.75和1.40倍。有研究发现,通过过表达accD基因能够显著增强大肠杆菌(Escherichia coli)中脂肪酸的合成[24]。此外,多个研究证明[8,13,25],微藻中me和accD基因的转录水平与脂质合成情况正相关。结果显示,MT能够通过上调油脂合成相关基因的表达从而提高微藻的产油能力。
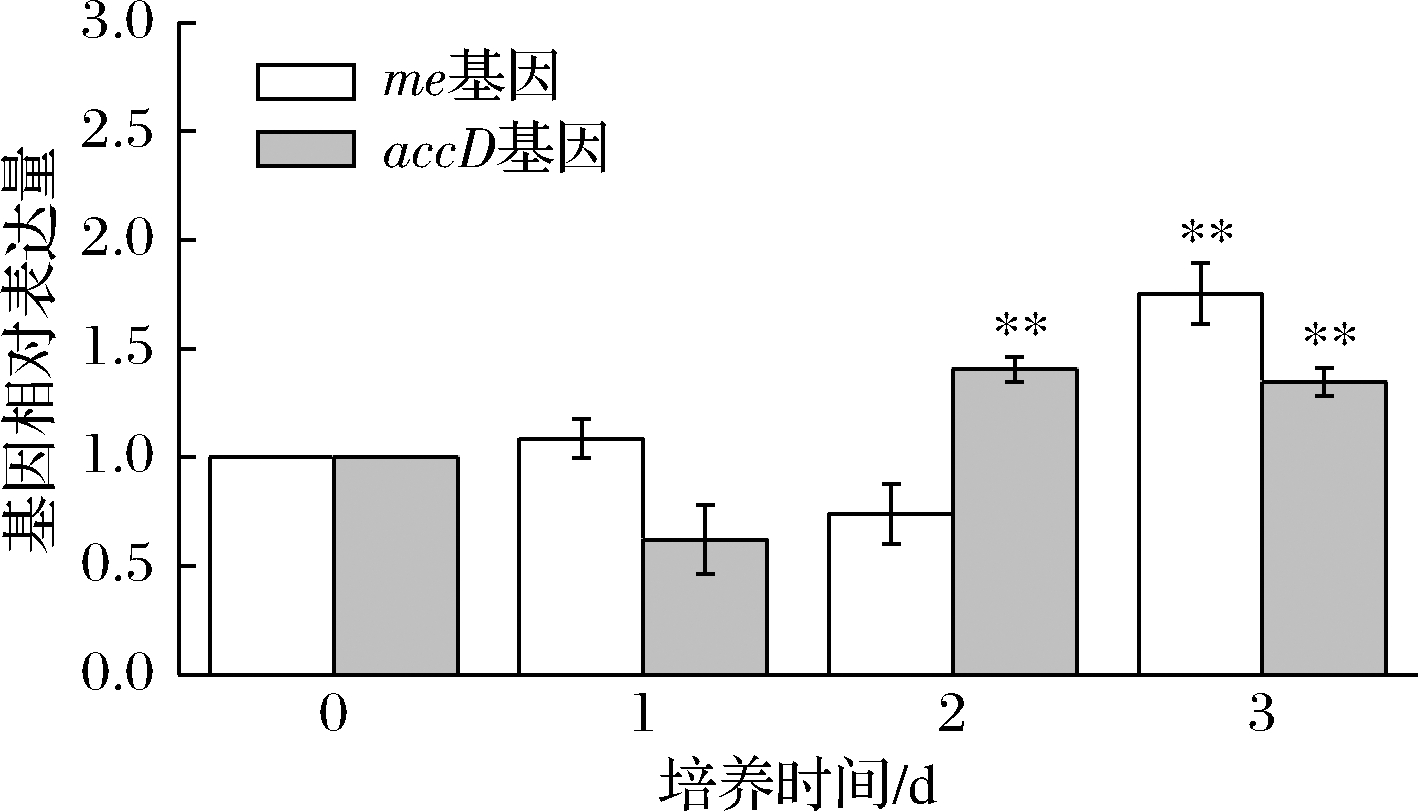
图4 盐胁迫下MT对单针藻QLY-1油脂合成相关基因的影响
Fig.4 Effect of MT on the lipogenic genes of
Monoraphidium sp.QLY-1 under salinity stress
2.5 盐胁迫下MT对单针藻QLY-1细胞内ROS、GSH的影响
ROS作为重要的第二信使,关联多种代谢途径及免疫反应,并在油脂合成过程中扮演重要角色,其信号传导途径是近年来的研究热门[26]。图5显示,在高盐条件下,ROS水平随培养时间逐渐上升。而MT处理显著地抑制了ROS水平,在第3天仅是盐胁迫组的55.95%。GSH作为细胞中关键的抗氧化剂,对减轻非生物胁迫引起的氧化应激反应起重要作用[27]。与ROS变化水平一致,在高盐条件下,GSH含量逐渐上升。而MT显著抑制了GSH含量,在培养第3天仅是盐胁迫对照组的74.04%。

a-ROS;b-GSH
图5 盐胁迫下MT对单针藻QLY-1 ROS和GSH水平的影响
Fig.5 Effect of MT on the levels of ROS and GSH
in Monoraphidium sp.QLY-1 under salinity stress
MT作为一种有效的抗氧化剂,能够有效地清除胞内由于缺氮引起过量积累的ROS以及细胞损伤[7]。此外,MT可通过提高红球藻中抗氧化酶活性从而缓解由高光照及缺氮导致的氧化损伤[28]。因此,外源MT能够有效地降低藻细胞内的ROS含量,使微藻细胞避免因环境胁迫造成的氧化损伤,从而保持细胞的正常代谢。
2.6 盐胁迫下MT对单针藻QLY-1脂肪酸组成的影响
油脂的脂肪酸组成是衡量油脂是否作为生物柴油原料的重要指标。与盐胁迫处理组相比, 1 μmol/L MT处理组中,C16∶0值有所下降而C18∶1含量上升,从而使饱和脂肪酸(saturated fatty acid,SFA)含量上升,单不饱和脂肪酸(monounsaturated fatty acid,MUFA)含量下降,而多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)含量几乎不变(表1)。相反地,10 μmol/L MT处理下的C18∶1和C20∶1含量分别提高了29.91%和94.85%,而C18∶2下降了16.03%,从而使得实验组中MUFA含量相比于对照组升高了27.76%,PUFA含量下降了11.89%,SFA含量几乎不变。100 μmol/L MT处理组的脂肪酸变化与10 μmol/L MT处理组相似。提高脂肪酸中MUFA的含量,尤其是C18∶1,可以提高生物柴油的质量[29]。此外,MT处理下脂肪酸的不饱和度(degree of unsaturation,DU)与对照组差异不显著,且均小于137(欧盟生物柴油标准UNE-EN14214)。因此,基于DU值和MUFA含量分析,微藻油脂可作为生产生物柴油的原料,而通过添加适宜浓度的MT可获得更具有市场价值的生物柴油。
与一些典型的可作为生物柴油生产原料的植物油相比,单针藻QLY-1所产油脂脂肪酸具有更高的C16∶0和C18∶3值以及更低的C18∶1含量,这就使得藻油的SFA值高于植物油,而PUFA含量和DU值较低。脂肪酸的SFA值越高则碳链越长,同时具有更高的十六烷值(cetane number,CN)[30]。柴油的CN值越高表明燃烧的发火性能好,燃烧均匀且滞燃期短。同时,偏低的DU值和更长的脂肪酸碳链使微藻油脂比传统植物油具有更好的稳定性。因此,单针藻QLY-1可作为一种具有市场前景的生物柴油生产原料。
2.7 物料成本分析
上述结果表明,植物激素MT对盐胁迫下培养的微藻的适应性和脂质积累有一定的改善作用。在不考虑人工成本情况下,根据本文数据进行产量转化,表2列出了对照组、盐胁迫及盐胁迫联合MT三种培养模式下微藻油脂的物料生产成本。显然,在BG-11培养基中添加NaCl和MT用于微藻油脂生产比单纯使用BG-11培养基更加经济,成本仅为BG-11的80.40%。这为植物激素耦合非生物胁迫进行藻类生物燃料生产的概念奠定了基础。此外,以MT联合NaCl生物质生产物料成本为例,生产1 kg微藻生物质需要158.88元,而BG-11培养基成本为156.38元,占总物料成本的98.43 %。由此可见,培养基的成本是限制微藻生物能源大规模发展的重要因素,因此,寻求廉价替代培养基对微藻生物能源发展进程至关重要。
表1 不同培养条件下单针藻与典型生物柴油生产原料的植物油的脂肪酸组成比较
Table 1 Comparison of the fatty acid profile in Monoraphidium sp.QLY-1 under
different growth conditions and vegetable oils typically used to produce biodiesel

脂肪酸单针藻Monoraphidium sp.QLY-1NaClNaCl+1 μmol/L MTNaCl+10 μmol/L MTNaCl+100 μmol/L MT橄榄油[30]菜籽油[30]花生油[30]C12∶00.43±0.010.27±0.010.40±0.010.39±0.010.00.00.0C14∶00.83±0.010.76±0.020.77±0.020.51±0.040.00.00.1C16∶040.53±0.7045.95±0.6038.03±1.1037.33±0.5211.64.98.0C16∶10.59±0.020.64±0.010.58±0.010.50±0.011.00.00.0C18∶01.99±0.021.91±0.011.97±0.021.75±0.023.11.61.8C18∶121.13±0.4617.25±0.3326.49±0.7627.12±0.9275.033.053.3C18∶215.95±0.1814.71±0.2713.75±0.3513.51±0.357.820.428.4C18∶314.62±0.2414.96±0.1813.07±0.6813.44±0.120.67.90.3C20∶00.38±0.070.33±0.020.70± 0.080.78±0.100.30.00.9C20∶10.18±0.040.19±0.010.39±0.010.43±0.010.09.32.4C22∶00.39±0.120.35±0.050.55±0.150.66±0.080.10.03.0C22∶10.77±0.040.51±0.030.69±0.030.80±0.020.023.00.0C24∶01.49±0.031.60±0.021.56±0.051.87±0.120.50.01.8C24∶10.36±0.03 0.20±0.050.33±0.020.38±0.060.00.00.0SFA46.78±0.5751.16±1.3444.11±1.2543.34±0.9915.76.515.6MUFA22.74±0.4118.79±0.5228.47±0.8329.23±0.2676.065.355.7PUFA30.71±0.4229.67±0.9826.82±0.3327.21±0.898.428.328.7DU83.84±0.4378.13±1.7282.11±1.4983.64±1.2492.7121.9113.1
表2 不同培养条件下单针藻生物质和油脂物料成本分析比较
Table 2 Comparison of the material cost analysis of Monoraphidium sp.QLY-1 biomass and
lipid production under different growth conditions
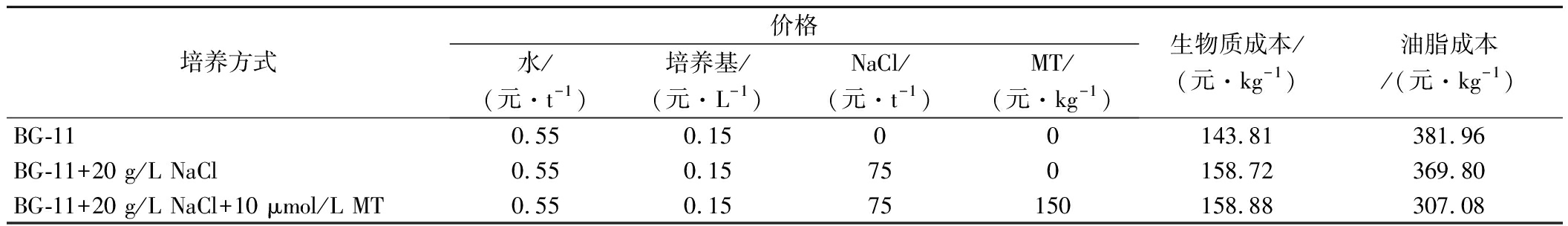
培养方式价格水/(元·t-1)培养基/(元·L-1)NaCl/(元·t-1)MT/(元·kg-1)生物质成本/(元·kg-1)油脂成本/(元·kg-1)BG-110.550.1500143.81381.96BG-11+20 g/L NaCl0.550.15750158.72369.80BG-11+20 g/L NaCl+10 μmol/L MT0.550.1575150158.88307.08
3 结论
外源MT上调了油脂合成相关基因的表达量,进一步提高了单针藻Monoraphidium sp.QLY-1在盐胁迫下的油脂含量。在MT诱导下,胞内蛋白质和碳水化合物含量下降。且MT能够通过改变GSH含量,有效地去除盐胁迫下胞内过量积累的ROS。随着MT诱导微藻脂质合成机制的进一步研究,外源添加MT联合盐胁迫有望成为提高微藻油脂合成的有效策略。
[1] 赵永腾,李涛,徐军伟,等.微藻碳水化合物生产生物燃料的研究进展[J].化工进展,2014,33(4):878-882;920.
ZHAO Y J,LI T,XU J W,et al.Research progress of microalgae-based carbohydrates for biofuel production[J].Chemical Industry and Engineering Progress,2014,33(4):878-882;920.
[2] 熊伟,黄云,付乾,等.微藻生物膜营养环境对微藻生长和油脂积累影响[J].中国环境科学,2016,36(8):2 463-2 469.
XIONG W,HUANG Y,FU Q,et al.Effect of nutrient solution content of biofilm on algal growth and lipid accumulation[J].China Environmental Science,2016,36(8):2 463-2 469.
[3] WANG Y C,HE B,SUN Z L,et al.Chemically enhanced lipid production from microalgae under low sub-optimal temperature[J].Algal Research,2016,16:20-27.
[4] ZHAO Y T,WANG H P,HAN B Y,et al.Coupling of abiotic stresses and phytohormones for the production of lipids and high-value by-products by microalgae:A review[J].Bioresource Technology,2019,274:549-556.
[5] PRAKASH R M,TRISHNAMONI G,NIKUNJ S.Effect of salinity,pH,light intensity on growth and lipid production of microalgae for bioenergy application[J].Online Journal of Biological Sciences,2015,15(4):260-267.
[6] LI X M,LI X Y,HAN B Y,et al.Improvement in lipid production in Monoraphidium sp.QLY-1 by combining fulvic acid treatment and salinity stress[J].Bioresource Technology,2019,294:122 179.
[7] LI D F,ZHAO Y T,DING W,et al.A strategy for promoting lipid production in green microalgae Monoraphidium sp.QLY-1 by combined melatonin and photoinduction[J].Bioresource Technology,2017,235:104-112.
[8] SONG X,ZHAO Y,LI T,et al.Enhancement of lipid accumulation in Monoraphidium sp.QLY-1 by induction of strigolactone[J].Bioresource Technology,2019,288:121 607.
[9] ZHAO Y T,SONG X T,ZHONG D B,et al.γ-Aminobutyric acid (GABA) regulates lipid production and cadmium uptake by Monoraphidium sp.QLY-1 under cadmium stress[J].Bioresource Technology,2020,297:122 500.
[10] DING W,ZHAO P,PENG J,et al.Melatonin enhances astaxanthin accumulation in the green microalga Haematococcus pluvialis by mechanisms possibly related to abiotic stress tolerance[J].Algal Research,2018,33:256-265.
[11] SARROU E,CHATZOPOULOU P,DIMASSI-THERIOU K,et al.Effect of melatonin,salicylic acid and gibberellic acid on leaf essential oil and other secondary metabolites of bitter orange young seedlings[J].Journal of Essential Oil Research,2015,27(6):487-496.
[12] SHI H T,CHEN Y H,TAN D X,et al.Melatonin induces nitric oxide and the potential mechanisms relate to innate immunity against bacterial pathogen infection in Arabidopsis[J].Journal of Pineal Research,2015,59(1):102-108.
[13] LI X,ZHANG X,ZHAO Y,et al.Cross-talk between gama-aminobutyric acid and calcium ion regulates lipid biosynthesis in Monoraphidium sp.QLY-1 in response to combined treatment of fulvic acid and salinity stress[J].Bioresource Technology,2020,315:123 833.
[14] BLIGH E G,DYER W J.A rapid method of total lipid extraction and purification[J].Canadian Journal of Biochemistry and Physiology,1959,37(8):911-917.
[15] ZHAO Y,LI D,DING K,et al.Production of biomass and lipids by the oleaginous microalgae Monoraphidium sp.QLY-1 through heterotrophic cultivation and photo-chemical modulator induction[J].Bioresource Technology,2016,211:669-676.
[16] BERGES J A,FISHER A E,HARRISON P J.A comparison of Lowry,Bradford and Smith protein assays using different protein standards and protein isolated from the marine diatom Thalassiosira pseudonana[J].Marine Biology,1993,115(2):187-193.
[17] MA X N,LIU J,LIU B,et al.Physiological and biochemical changes reveal stress-associated photosynthetic carbon partitioning into triacylglycerol in the oleaginous marine alga Nannochloropsis oculate[J].Algal Research,2016,16:28-35.
[18] CHE R,HUANG L,XU J W,et al.Effect of fulvic acid induction on the physiology,metabolism,and lipid biosynthesis-related gene transcription of Monoraphidium sp.FXY-10[J].Bioresource Technology,2017,227:324-334.
[19] SCHMITTGEN T D,LIVAK K J.Analyzing real-time PCR data by the comparative C(T) method[J].Nature Protocols,2018,3(6):1 101-1 108.
[20] 杜卓,侯雯,王丽,等.外源褪黑素对干旱胁迫下玉米幼苗的影响[J].中国农学通报,2020,36(27):14-19.
DU Z,HOU W,WANG L,et al.Effects of exogenous melatonin on maize seedlings under drought stress[J].Chinese Agricultural Science Bulletin,2020,36(27):14-19.
[21] 李喜明,赵永腾,余旭亚.褪黑素调控缺氮胁迫下单针藻中油脂积累的影响[J].食品与发酵工业,2019,45(2):39-44.
LI X M,ZHAO Y T,YU X Y.Effects of melatonin on regulating lipid accumulation in Monoraphidium sp.QLY-1 under nitrogen deficiency stress[J].Food and Fermentation Industries,2019,45(2):39-44.
[22] ZHAO Y T,LI D F,XU J W,et al.Melatonin enhances lipid production in Monoraphidium sp.QLY-1 under nitrogen deficiency conditions via a multi-level mechanism[J].Bioresource Technology,2018,259:46-53.
[23] SHI L X,THEG S M.The chloroplast protein import system:From algae to trees[J].Biochimica Et Biophysica Acta (BBA)-Molecular Cell Research,2013,1833(2):314-331.
[24] DAVIS M S,SOLBIATI J,CRONAN J E.Overproduction of acetyl-CoA carboxylase activity increases the rate of fatty acid biosynthesis in Escherichia coli[J].Journal of Biological Chemistry,2000,275(37):28 593-28 598.
[25] 董训赞,车绕琼,赵永腾,等.黄腐酸对单针藻Monoraphidium sp.FXY-10油脂积累及me、pepc、accD基因表达量的影响[J].中国油脂,2018,43(7):108-112.
DONG X Z,CHE R Q,ZHAO Y T,et al.Effects of fulvic acid on lipid accumulation and genes (me,pepc,accD) expression of Monoraphidium sp.FXY-10[J].China Oils and Fats,2018,43(7):108-112.
[26] SHI K,GAO Z,SHI T Q,et al.Reactive oxygen species-mediated cellular stress response and lipid accumulation in oleaginous microorganisms:The state of the art and future perspectives[J].Frontiers in Microbiology,2017,8:793.
[27] ZHAO Y T,SONG X T,YU L,et al.Influence of cadmium stress on the lipid production and cadmium bioresorption by Monoraphidium sp.QLY-1[J].Energy Conversion and Management,2019,188:76-85.
[28] DING W,ZHAO Y T,XU J W,et al.Melatonin:a multifunctional molecule that triggers defense responses against high light and nitrogen starvation stress in Haematococcus pluvialis[J].Journal of Agricultural and Food Chemistry,2018,66(29):7 701-7 711.
[29] 王盛林, 赵震宇,刘平怀.10种热带富油微藻生物量、总脂含量及脂肪酸组成分析[J].中国油脂,2017,42(8):93-97.
WANG S L,ZHAO Z Y,LIU P H.Biomass,total lipid content and fatty acid composition of ten tropical oil-rich microalgae[J].China Oils and Fats,2017,42(8):93-97.
[30] RAMOS M J,FERNANDEZ C M,CASAS A,et al.Influence of fatty acid composition of raw materials on biodiesel properties[J].Bioresource Technology,2009,99(1):261-268.
[31] 徐向东,孙艳,郭晓芹,等.褪黑素对高温胁迫下黄瓜幼苗抗坏血酸代谢系统的影响[J].应用生态学报,2010,21(10):2 580-2 586.
XU X D,SUN Y,GUO X Q,et al.Effects of exogenous melatonin on ascorbate metabolism system in cucumber seedlings under high temperature stress[J].Chinese Journal of Applied Ecology,2010,21(10):2 580-2 586.
[32] JI X,CHENG J,GONG D H,et al.The effect of NaCl stress on photosynthetic efficiency and lipid production in freshwater microalga—Scenedesmus obliquus XJ002[J].Science of the Total Environment,2018,633:593-599.