氨基甲酸乙酯(ethyl carbamate,EC),是一种具有遗传毒性及较强致癌性的物质[1],天然存在于多种发酵食品(如酱油、食醋、泡菜)和酒精饮料(如黄酒、白酒、葡萄酒、日本清酒、白兰地)中[2-4]。2007年国际癌症研究机构(International Agency for Research on Cancer,IARC)将EC归类为2A类致癌物[5],引起人们对长期饮用酒精饮料安全性的担忧。
研究发现,黄酒中的尿素是EC的主要前体物质,90%左右的EC是由尿素和乙醇经化学反应生成的[6],因此控制黄酒中的尿素含量对于控制EC的生成具有重要意义。关于黄酒中尿素的控制,目前已有许多方法报道,其中利用脲酶是较为直接、简便的方法。由于黄酒的酸性环境(pH 4.0左右),大部分研究者将酸性脲酶应用于黄酒中尿素的减除。早期主要是将游离酸性脲酶直接加入黄酒中进行尿素的降解[7-9];为提高脲酶的重复使用性,近些年来不少研究者将酸性脲酶固定化后处理酒样[10-13]。
虽然酸性脲酶对黄酒中尿素的降解有一定的效果,但酸性脲酶目前只有在日本和美国的少数企业实现工业化生产,其进口和使用在国内有一定的限制[14]。而国内对酸性脲酶的研究还停留在实验阶段,尚无商业化酸性脲酶供应,这大大限制了酸性脲酶处理黄酒的工业化应用。我国目前市售的脲酶基本上是植物来源的中性脲酶,其价格便宜、来源广泛,但该酶在中性条件下活性高,而在酸性条件下酶活力很低,一般认为这种中性脲酶不适合用于黄酒中尿素的降解[15]。近几年国内外对脲酶的固定化研究表明,固定化可以提高脲酶的稳定性和利用效率[16-18],但关于中性脲酶的研究很少。有研究利用固定化中性脲酶处理黄酒,需将黄酒pH调至4.8以降低其中的尿素含量[19]。但中性脲酶固定化后是否可以在不改变黄酒特性的条件下用于黄酒中尿素的降解,目前鲜有相关研究报道。
本研究以市售中性脲酶为实验对象,以酸性脲酶作为对照,对游离酶部分酶学性质进行测定分析,探究中性脲酶应用于黄酒中尿素处理的可行性;并将中性脲酶通过共价结合法进行固定化,考察其应用于黄酒中尿素降解的效果,为中国黄酒EC的控制提供一种可行的方法。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
中性脲酶(来源于Canavalia ensiformis),Sigma公司;酸性脲酶(来源于Lactobacillus fermentum),武田药品工业株式会社;黄酒,市售。
1.1.2 实验试剂
尿素、乳酸、乙醇、乙酸钠、壳聚糖、海藻酸钠、高碘酸钠、三氯乙酸,国药集团化学试剂公司;甲醇、乙腈,均为色谱级,北京百灵威科技有限公司。
1.1.3 仪器与设备
DK-S34型水浴锅,上海森信实验仪器有限公司;Five Easy Plus型pH计,梅特勒-托利多仪器有限公司;SB25-12DT型超声波清洗仪,宁波新芝生物科技股份有限公司;HYL-C型摇床,太仓市强乐实验设备有限公司;Agilent 1260 Infinity型高效液相色谱仪,美国安捷伦科技公司。
1.2 实验方法
1.2.1 游离酶性质测定
1.2.1.1 pH对脲酶活力和稳定性的影响
最适pH:称取一定量的中性脲酶和酸性脲酶,分别溶于不同pH(3.0、4.0、5.0、6.0、7.0、8.0)的缓冲液中,其中pH为3.0、4.0、5.0、6.0的缓冲液用0.1 mol/L的柠檬酸和柠檬酸三钠配制,pH为7.0、8.0的缓冲液用0.1 mol/L的K2HPO4和KH2PO4配制。测定不同pH下的酶活力,以最高酶活力为100%,计算相对酶活力。
pH稳定性:分别将中性脲酶和酸性脲酶置于pH为3.5、4.0、5.0、6.0、7.0的缓冲液中,室温放置24 h后测定酶活力,以初始酶活力为100%,计算残余酶活力。
1.2.1.2 温度对脲酶活力和稳定性的影响
最适温度:称取一定量的中性脲酶和酸性脲酶,分别溶于pH为4.0和7.0的缓冲液中,在不同温度(4、14、30、37、50、60、80 ℃)下测定酶活力,以最高酶活力为100%,计算相对酶活力。
温度稳定性:将中性脲酶和酸性脲酶分别溶于pH为7.0和4.0的缓冲液中,置于温度为4、30、50、80 ℃的环境中保温24 h后测定酶活力,以初始酶活力为100%,计算残余酶活力。
1.2.1.3 酒精对脲酶活力和稳定性的影响
酒精对酶活力的影响:称取一定量中性脲酶溶于酒精体积分数为0%、8%、12%、16%、20%、24%的pH为7.0的缓冲液中;称取一定量酸性脲酶溶于酒精体积分数为0%、8%、12%、16%、20%、24%的pH为4.0的缓冲液中,测定不同酒精体积分数下的酶活力,以最高酶活力为100%,计算相对酶活力。
酒精耐受性:分别将中性脲酶和酸性脲酶溶于酒精体积分数为0%、8%、14%、20%、30%的缓冲液中,室温放置24 h后测定酶活力,以初始酶活力为100%,计算残余酶活力。
1.2.2 固定化酶的制备
制备方法参考文献[20]。其中壳聚糖质量浓度为30 g/L,交联剂为自制且无毒性的氧化海藻酸钠,交联剂质量浓度为1 g/L,交联时间4 h,加酶量0.2 mg/mL,固定化时间6 h。
1.2.3 游离、固定化中性脲酶酶学性质测定比较
固定化中性脲酶的最适pH、最适温度以及酒精对其活力的影响,测定方法同游离酶。对稳定性进行测定时,为了考察酶在不同时间的酶活力变化情况,在0~24 h之间取样测定。
1.2.4 固定化中性脲酶处理黄酒
1.2.4.1 固定化中性脲酶单批次处理黄酒
在pH为7.0,37 ℃的条件下测定酶活力,称取一定量的酶活力为20 U的游离脲酶和固定化脲酶装入50 mL三角瓶,加入20 mL酒样,在30 ℃下200 r/min振荡处理,于2、4、8、12、24 h取滤液测定尿素含量,计算尿素去除率。空白对照为不加酶的固定化载体微球。并对处理后的黄酒进行基本理化指标的测定。
1.2.4.2 固定化中性脲酶的重复利用
为了考察固定化脲酶的重复使用性,按上述条件处理黄酒4 h,处理3个批次,分析不同批次的尿素降解效果及黄酒中基本理化指标的变化情况。
1.2.5 测定分析方法
脲酶酶活力通过靛酚蓝反应比色法[21]测定。1个酶活力单位即为1 min水解底物尿素产生1 μmol 氨所需的酶量。黄酒中的尿素含量通过高效液相色谱法[22]测定,样品处理方法和色谱条件参照文献[23]。黄酒总酸、氨基酸态氮的测定方法参照GB/T 13662—2018《黄酒》[24]。还原糖含量采用3,5-二硝基水杨酸比色法进行测定[25]。乙醇含量采用高效液相色谱法进行测定[26]。
2 结果与分析
2.1 游离中性脲酶和酸性脲酶酶学性质比较
为了研究中性脲酶应用于黄酒中尿素处理的可行性,首先对游离中性脲酶的酶学性质进行测定分析,并与酸性脲酶进行比较。
2.1.1 最适pH及其稳定性
脲酶在不同pH 缓冲液中的相对活力测定结果如图1柱状图所示。中性脲酶最适pH为7.0,在pH 3.0时失活,pH 4.0时表现出微弱活性。酸性脲酶最适pH为4.0,且在酸性条件下均保留较高酶活力。pH稳定性测定结果如图1折线图所示。中性脲酶在酸性条件下的稳定性较差,pH<5.0时放置24 h后仅有微弱的酶活力保留;而酸性脲酶在酸性条件下的稳定性较好。由于黄酒的pH一般为3.5~4.8[26],因此,脲酶的酸性酶活力及酸稳定性是影响其在黄酒中应用的主要因素之一,这也是中性脲酶难以在黄酒中应用的主要原因。

图1 游离脲酶最适pH及其稳定性
Fig.1 Optimal pH and the stability pH in free neutral
and acid ureases
2.1.2 最适温度及其稳定性
脲酶在不同温度下的相对酶活力测定结果如图2柱状图所示。中性脲酶和酸性脲酶的最适作用温度均为37 ℃左右,中性脲酶在中低温表现出相对较高的酶活力。温度稳定性测定结果如图2折线图所示。中性和酸性脲酶对温度的稳定性类似,均在低温下稳定性好,随着温度的升高,稳定性逐渐降低。

图2 游离脲酶最适温度及其稳定性
Fig.2 Optimal temperature and temperature stability of
free neutral and acid ureases
2.1.3 酒精对脲酶活力的影响及其耐受性
黄酒属于酒精性饮料,酒精体积分数在8%~14%左右,发酵过程中甚至更高。本文测定了不同体积分数酒精对脲酶活性的影响,测定结果如图3柱状图所示。中性脲酶在8%~24%酒精体积分数下均有相对较高的酶活,其中在酒精体积分数为16%时,酶活力可达最高酶活性的85%左右,酸性脲酶在不同酒精体积分数下的酶活力变化规律基本和中性脲酶相同,但酶活力受高酒精浓度的影响更为明显。酒精耐受性测定结果如图3折线图所示。中性和酸性脲酶对酒精的耐受性均较强,在酒精溶液中放置24 h后均能保留60%以上的初始酶活力。

图3 酒精对游离脲酶活力的影响及其耐受性
Fig.3 Effect of alcohol on free neutral and acid
ureases activity and their tolerance
综上所述,对应用于黄酒中的两大限制条件,即酸性条件和一定含量的酒精,中性脲酶表现出较好的酒精耐受性,但对于酸性条件较为敏感,限制了中性脲酶在黄酒中的应用。改变中性脲酶的应用pH活性及稳定性才有应用于黄酒中的可能。
2.2 固定化中性脲酶酶学性质分析
为改善中性脲酶在黄酒中的应用效果,采用较为安全的壳聚糖载体和氧化海藻酸钠交联剂,对其进行固定化,并对固定化中性脲酶的酶学性质进行测定分析,通过与游离中性脲酶进行比较,考察其在黄酒中的适用性。
2.2.1 最适pH及其稳定性
中性脲酶在不同pH 缓冲液中的相对活力测定结果如图4-a所示。经固定化后,中性脲酶的最适pH由7.0变为5.0,出现明显的酸性偏移,在pH 4左右也表现出较高的酶活力,有利于对黄酒的处理。中性脲酶在不同pH下的稳定性数据如图4-b所示。相对于游离酶在pH为3.5时迅速失活,pH 4.0时放置2 h后基本失活,固定化酶表现出较强的稳定性。在pH 3.5时放置1.5 h后才基本丧失活性,在pH 4.0时失活时间也提高到8 h,耐酸性有显著提高。在其他pH条件下固定化酶稳定性均有显著提高。

a-最适pH;b-pH稳定性
图4 游离和固定化中性脲酶最适pH及其稳定性比较
Fig.4 Comparison of optimum pH and stability of free
and immobilized neutral ureases
2.2.2 最适温度及其稳定性
中性脲酶在不同温度下的相对活力测定结果如图5-a所示。经固定化后,脲酶的最适温度由37 ℃提高到50 ℃。脲酶在不同温度下的稳定性数据如图5-b所示。固定化酶与游离酶的温度稳定性基本类似,在不同温度下,固定化酶稳定性略强于游离酶。在高温条件下(80 ℃),游离酶和固定化酶均在4 h后基本失活。

a-最适温度;b-温度稳定性
图5 游离和固定化中性脲酶最适温度及其稳定性比较
Fig.5 Comparison of optimum temperature and stability
of free and immobilized neutral ureases
2.2.3 酒精对脲酶活力的影响及其耐受性
中性脲酶对酒精的耐受性测定结果如图6-a所示。游离中性脲酶本身有较好的酒精耐受性,固定化后基本保持了较好的酒精耐受性,其中在酒精体积分数为16%的条件下活性是最高酶活力的80%左右,与游离酶相差不大。脲酶在不同酒精体积分数下的稳定性结果如图6-b所示。游离酶在较宽的酒精体积分数范围(0%~30%)内的稳定性变化基本相同,放置24 h后均可保留69%以上酶活力。固定化酶在酒精体积分数为8%、14%、20%的稳定性高,24 h后均能保留80%左右的初始酶活力。在30%的酒精体积分数下稳定性要差一些,但24 h后依然能保留60%左右的初始酶活力。相对而言,固定化酶对酒精的稳定性又有一定的改善。

a-酒精对酶活力的影响;b-酒精耐受力
图6 不同体积分数酒精对游离和固定化中性
脲酶活力及其耐受性的影响
Fig.6 Effect of alcohol on the activity and tolerance
of free and immobilized neutral ureases
2.3 固定化中性脲酶处理黄酒
将固定化中性脲酶处理尿素含量较高(24.86 mg/L)的黄酒,其尿素的降解结果如图7所示。固定化酶处理黄酒4 h,尿素降解较快,降解率超过60%;处理24 h后,黄酒中尿素含量低于1 mg/L,降低了98.15%。而在相同加酶量的条件下,游离酶对黄酒中尿素基本没有降解作用。固定化载体(空白微球)在该处理条件下对黄酒中尿素含量的影响也很小(<10%),因此,固定化中性脲酶降解黄酒中尿素的作用效果比较显著。
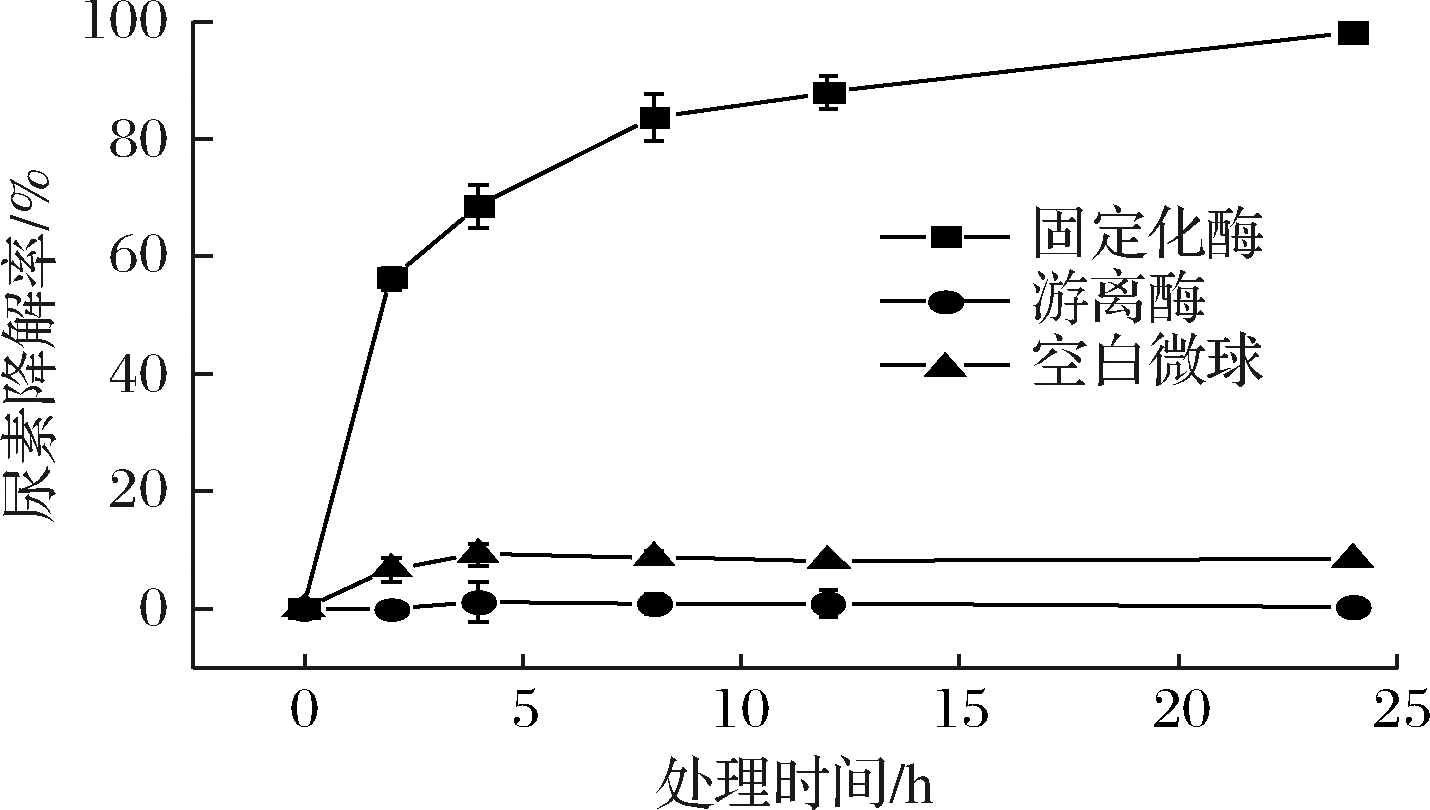
图7 固定化中性脲酶处理黄酒
Fig.7 Treatment of Huangjiu with immobilized neutral urease
注:酒样pH 3.90,尿素初始质量浓度24.86 mg/L
同时,对上述处理过的黄酒主要理化指标进行测定,测定结果如表1所示。固定化中性脲酶处理对黄酒中还原糖、氨基酸态氮和酒精含量的影响不大(变化率在10%左右),这些指标略有下降主要是因为固定化酶颗粒有较高含水量(93.08%),对酒样有一定的稀释作用。总酸下降率稍高,除稀释作用外,微球本身偏中性的pH环境也对总酸含量变化有一定影响。但总体来说,经固定化酶处理后黄酒的各项基本理化指标均符合黄酒国标要求。
表1 固定化中性脲酶处理对黄酒主要理化指标的影响
Table 1 Effect of treatment with immobilized neutral
urease on the primary parameters of Huangjiu

理化指标原酒样固定化酶单批次处理固定化酶重复处理批次123还原糖/(g·L-1)23.6720.4920.8722.4323.09总酸/(g·L-1)6.034.324.055.675.88氨基酸态氮/(g·L-1)0.270.250.250.260.27酒精体积分数/%15.2013.2413.1014.7015.11尿素/(mg·L-1)24.860.469.7616.0724.70
进一步将固定化酶重复利用多批次处理黄酒,每批处理时间为4 h,考察其对黄酒中尿素降解的效果。处理后酒样中尿素及主要理化指标的变化情况如表1所示。重复利用固定化中性脲酶,第1次处理黄酒,尿素降解率可达60%左右;第2次处理,尿素降解率降低至不足40%;第3次使用该固定化酶,基本无尿素降解,这主要是由于固定化中性脲酶长时间处于黄酒的酸性环境中,对酶活力有严重影响,降低了其催化效率。黄酒主要理化指标,除第1次处理由于固定化酶中残留的缓冲体系对酒样有一定的影响外,后续2批酒样主要理化指标没有明显变化(基本在5%以内)。这些结果表明,固定化中性脲酶可用于黄酒中尿素的降解,但酶的使用效率受到了其稳定性的影响。
通过进一步提高固定化酶的pH稳定性,并结合填充柱连续处理黄酒,缩短处理时间,有可能在降低黄酒中尿素的工业应用中得到较好的效果,相关研究还需进一步开展。
3 结论
本研究主要考察了来源于植物的市售中性脲酶及其固定化酶应用于黄酒中降解尿素的可行性。研究结果表明,与酸性脲酶相比,游离中性脲酶的一些性质,如温度和耐酒精特性都较为相似,但耐酸特性相对较差,限制了其在黄酒中的应用。将中性脲酶以壳聚糖为载体进行固定化后,脲酶的耐酸特性有了显著改善,有应用于黄酒中的可能性。将此固定化中性脲酶处理黄酒,处理24 h后基本可降解95%以上的尿素。该固定化中性脲酶不仅安全有效,且处理黄酒易于和酒液分离,便于应用。重复利用固定化酶也有一定的效果,但酶的稳定性仍需进一步提高。本研究结果为酶法降解黄酒中的尿素提供了一种现实可行的方法。
[1] FORKER T P G.Mechanisms of lung tumorigenesis by ethyl carbamate and vinyl carbamate[J].Drug Metabolism Reviews,2010,42(2):355-378.
[2] WEBER J V,SHARYPOV V I.Ethyl carbamate in foods and beverages:A review[J].Environmental Chemistry Letters,2009,7(3):233-247.
[3] ZHAO X R,DU G C,ZOU H J,et al.Progress in preventing the accumulation of ethyl carbamate in alcoholic beverages[J].Trends in Food Science&Technology,2013,32(2):97-107.
[4] GOWD V,SU H M,KARLOVSKY P,et al.Ethyl carbamate:An emerging food and environmental toxicant[J].Food Chemistry,2018,248:312-321.
[5] LACHENMEIER D W.Consequences of IARC re-evaluation of alcoholic beverage consumption and ethyl carbamate on food control[J].Deutsche Lebensmittel-Rundschau,2007,103(7):307-311.
[6] JIAO Z H,DONG Y C,CHEN Q H.Ethyl carbamate in fermented beverages:presence,analytical chemistry,formation mechanism,and mitigation proposals[J].Comprehensive Reviews in Food Science and Food Safety,2014,13(4):611-626.
[7] FAN J,LEI J,WANG L,et al.Rapid and high-capacity immobilization of enzymes based on mesoporous silicas with controlled morphologies[J].Chemical Communications,2003,(17):2 140-2 141.
[8] LIU J,XU Y,NIE Y,et al.Optimization production of acid urease by Enterobacter sp.in an approach to reduce urea in Chinese rice wine[J].Bioprocess and Biosystems Engineering,2012,35(4):651-657.
[9] YANG Y Q,KANG Z,ZHOU J L,et al.High-level expression and characterization of recombinant acid urease for enzymatic degradation of urea in rice wine[J].Applied Microbiology and Biotechnology,2015,99(1):301-308.
[10] ANDRICH L,ESTI M,MORESI M.Urea degradation in model wine solutions by free or immobilized acid urease in a stirred bioreactor[J].Journal of Agricultural and Food Chemistry,2009,57(9):3 533-3 542.
[11] ANDRICH L,ESTI M,MORESI M.Urea degradation kinetics in model wine solutions by acid urease immobilised onto chitosan-derivative beads of different sizes[J].Enzyme and Microbial Technology,2010,46(5):397-405.
[12] 查小红,杨广明,田亚平.一种天然材料复合体系固定化酒用双功能酶的研究[J].食品工业科技,2014,35(14):186-191;196.
ZHA X H,YANG G M,TIAN Y P.Study on an immobilized bifunctional enzyme applied in rice wine with natural materials[J].Science and Technology of Food Industry,2014,35(14):186-191;196.
[13] YANG L,LIU X,ZHOU N,et al.Characteristics of refold acid urease immobilized covalently by graphene oxide-chitosan composite beads[J].Journal of Bioscience and Bioengineering,2019,127(1):16-22.
[14] 范文来,王栋.近10年我国传统饮料酒白酒和黄酒品质安全研究现状与展望[J].食品安全质量检测学报,2019,10(15):4 811-4 829.
FAN W L,WANG D.Current practice and future trends of alcoholic beverages safety of China traditional Baijiu and Huangjiu in recent decades[J].Journal of Food Safety & Quality,2019,10(15):4 811-4 829.
[15] LIU Q T,CHEN Y Q,YUAN M L,et al.A Bacillus paralicheniformis iron-containing urease reduces urea concentrations in rice wine[J].Applied and Environmental Microbiology,2017,83(17).DOI:10.1128/aem.01258-17.
[16] MONIER M,EL-SOKKARY A M A.Modification and characterization of cellulosic cotton fibers for efficient immobilization of urease[J].International Journal of Biological Macromolecules,2012,51(1-2):18-24.
[17] LV M M,MA X F,ANDERSON D P,et al.Immobilization of urease onto cellulose spheres for the selective removal of urea[J].Cellulose,2018,25(1):233-243.
[18] ALATAWI F S,MONIER M,ELSAYED N H.Amino functionalization of carboxymethyl cellulose for efficient immobilization of urease[J].International Journal of Biological Macromolecules,2018,114:1 018-1 025.
[19] 高雅.黄酒中氨基甲酸乙酯降低措施研究[D].合肥:合肥工业大学,2017.
GAO Y.Study on reduction measures of ethyl carbamate in Chinese rice wine[D].Hefei:Hefei University of Technology,2017.
[20] KUMAR S,DWEVEDI A,KAYASTHA A M.Immobilization of soybean (Glycine max) urease on alginate and chitosan beads showing improved stability:Analytical applications[J].Journal of Molecular Catalysis B-Enzymatic,2009,58(1-4):138-145.
[21] WEATHERBURN M W.Phenol-hypochlorite reaction for determination of ammonia[J].Analytical Chemistry,1967,39(8):971-974.
[22] CLARK S,FRANCIS P S,CONLAN X A,et al.Determination of urea using high-performance liquid chromatography with fluorescence detection after automated derivatisation with xanthydrol[J].Journal of Chromatography A,2007,1 161(2):207-213.
[23] 郭双丽.中国黄酒贮存过程中尿素对氨基甲酸乙酯形成的影响及其物理减除技术研究[D].无锡:江南大学,2016.
GUO S L.The effect of urea on ethyl carbamate formation during rice wine storage and its removal by resin adsorption[D].Wuxi:Jiangnan University,2016.
[24] 国家市场监督管理总局,中国国家标准化管理委员会.GB/T 13662—2018 黄酒[S].北京:中国标准出版社,2018.
State Administration for Market Regulation,Standardization Administration.GB/T 1366—2018 Huangjiu[S].Beijing:China Standards Press China Standards Press,2018.
[25] 赵凯,许鹏举,谷广烨.3,5-二硝基水杨酸比色法测定还原糖含量的研究[J].食品科学,2008,29(8):534-536.
ZHAO K,XU P J,GU G Y.Study on determination of reducing sugar content using 3,5-dinitrosalicylic acid method[J].Food Science,2008,29(8):534-536.
[26] NARENDRANATH N V,THOMAS K C,INGLEDEW W M.Effects of acetic acid and lactic acid on the growth of Saccharomyces cerevisiae in a minimal medium[J].Journal of Industrial Microbiology and Biotechnology,2001,26(3):171-177.