自由基是指任何包含未成对电子并能单独存在的原子或基团,如羟自由基(·OH)、超氧阴离子自由基![]() 过氧化氢(H2O2)等活性氧簇(reactive oxygen species,ROS)和源于一氧化氮(NO)的活性氮簇(reactive nitrogen species,RNS)[1]。研究表明,不仅人体正常代谢会产生自由基[2],压力、紫外线辐射、环境污染等也会诱导自由基的产生。体内过量的自由基会与生物分子结合,对机体造成损伤[3-4]。抗氧化剂由于具有清除自由基和减少活性氧的作用被广泛用于减少氧化损伤。作为抗氧化剂重要来源的生物体具有复杂的代谢途径,可产生多种代谢产物。当从生物体中制备抗氧化剂时,由于目标产物与某些组分(特别是结构类似物)具有相似的化学结构和物理性质,即使采用最先进的分离纯化技术,提取的抗氧化剂通常也是目标组分及其结构类似物的混合物。结构类似物的存在可能影响目标成分的抗氧化活性。因此,研究生物体中天然抗氧化剂的共存组分对天然抗氧化剂的影响具有重要的意义。
过氧化氢(H2O2)等活性氧簇(reactive oxygen species,ROS)和源于一氧化氮(NO)的活性氮簇(reactive nitrogen species,RNS)[1]。研究表明,不仅人体正常代谢会产生自由基[2],压力、紫外线辐射、环境污染等也会诱导自由基的产生。体内过量的自由基会与生物分子结合,对机体造成损伤[3-4]。抗氧化剂由于具有清除自由基和减少活性氧的作用被广泛用于减少氧化损伤。作为抗氧化剂重要来源的生物体具有复杂的代谢途径,可产生多种代谢产物。当从生物体中制备抗氧化剂时,由于目标产物与某些组分(特别是结构类似物)具有相似的化学结构和物理性质,即使采用最先进的分离纯化技术,提取的抗氧化剂通常也是目标组分及其结构类似物的混合物。结构类似物的存在可能影响目标成分的抗氧化活性。因此,研究生物体中天然抗氧化剂的共存组分对天然抗氧化剂的影响具有重要的意义。
法夫酵母因是天然虾青素(3,3′-二羟基-4,4′-二酮基-β,β′-胡萝卜素)的重要来源而受到广泛关注[5-9]。研究报道虾青素具有抗氧化[10]、抗炎[11]、抗癌[12]以及预防心血管疾病等多种生理活性[13]。法夫酵母具有类胡萝卜素合成的复杂途径[14-16]。在之前的研究中,从法夫酵母提取物中鉴定出虾青素、β-胡萝卜素、玉米黄质、β-隐黄素和番茄红素等多种类胡萝卜素[17]。这些类胡萝卜素由于结构相似很难分离。目前,它们生理活性之间的相互作用还不清楚。本文采用DPPH自由基清除率、ABTS阳离子自由基清除率、·OH清除率、铁离子还原能力、抗油脂过氧化能力和ORAC法评价虾青素和β-胡萝卜素的抗氧化能力,并以DPPH自由基、ABTS阳离子自由基、·OH清除率为指标研究虾青素和β-胡萝卜素以不同浓度组合的抗氧化效果,为利用法夫酵母开发高效的抗氧化剂提供理论依据。
1 材料与方法
1.1 材料与试剂
虾青素(100%,USP级)、β-胡萝卜素(≥95%,(HPLC级),美国Sigma-Aldrich公司;2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸[2,2′-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS]、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH),梯希爱(上海)化成工业发展有限公司;甲醇、水杨酸、过硫化钾、K2HPO4、FeSO4·7H2O、FeCl3, 均为分析纯,国药集团化学试剂有限公司;荧光素钠、2,2-偶氮二(2-甲基丙基咪)二盐酸盐(AAPH)、水溶性维生素E(Trolox),均为分析纯,北京索莱宝科学技术有限公司。
1.2 仪器与设备
Mettler Toledo电子天平,顺迪嘉奥有限公司;BMG全波长自动多功能酶标仪微孔板检测仪,广州伯齐生物科技有限公司。
1.3 实验方法
1.3.1 DPPH自由基清除率的测定
用甲醇将8.00 mg DPPH配成浓度为0.2 mmol/L的DPPH自由基溶液,用甲醇制备质量浓度为2、4、8、16、32、64 μg/mL的虾青素或β-胡萝卜素的待测液。在96孔酶标板中依次加入50 μL DPPH自由基溶液和50 μL待测液,30 ℃反应30 min,于517 nm波长下测定吸光度值。维生素E(VE)作为阳性对照,3次平行实验,清除率由公式(1)计算[18]:
DPPH自由基清除率![]()
(1)
式中:A0,待测液用甲醇替代,加入DPPH自由基的吸光度;AX,添加待测液和DPPH自由基的吸光度;A1,加入待测液,DPPH自由基用甲醇替代的吸光度。
1.3.2 ABTS阳离子自由基清除率的测定
用蒸馏水分别配制7 mmol/L的ABTS阳离子自由基溶液和2.45 mmol/L的K2S2O8溶液,均匀混合,常温避光15 h,之后将混合液用甲醇制成734 nm波长下吸光度为(0.70±0.02)的工作液。将10 μL 1.3.1所述待测液和200 μL ABTS阳离子自由基工作液依次加入96孔酶标板中,30 ℃反应6 min,测定734 nm波长处吸光度。以VE作为阳性对照,3次平行实验,清除率由公式(2)计算[19]:
ABTS阳离子自由基清除率![]()
(2)
式中:A0,待测液用甲醇替代,加入ABTS阳离子自由基的吸光度;AX,添加待测液和ABTS阳离子自由基的吸光度。
1.3.3 ·OH清除率的测定
将50 μL 2.25 mmol/L FeSO4水溶液、50 μL 9 mmol/L水杨酸甲醇溶液、50 μL 1.3.1所述待测液依次加入96孔酶标板中,再加入50 μL 8.80 mmol/L H2O2甲醇溶液启动反应,37 ℃反应30 min,测定510 nm波长处吸光度A。以VE作为阳性对照,3次平行实验,清除率由公式(3)计算[20]:
·OH清除率![]()
(3)
式中:Ax,添加待测液时的吸光度;A0,待测液用甲醇替代时的吸光度;A1,水杨酸甲醇溶液和H2O2甲醇溶液均用甲醇替代时的吸光度。
1.3.4 铁离子还原能力测定
参考BENZIE等[21]的方法并略加修改。以pH 3.6醋酸钠缓冲溶液∶20 mmol/L FeCl3水溶液∶10 mmol/L 2,4,6-三吡啶基三嗪盐酸溶液(10∶1∶1,体积比)混合制成铁离子还原/抗氧化能力(ferric ion reducing antioxidant power,FRAP)工作液。在96孔酶标板中依次加入5 μL不同浓度的FeSO4溶液(50、100、200、400、800、1 600 μmol/L)、150 μL FRAP工作液和15 μL 蒸馏水,混匀,37 ℃避光,每隔10 min测定595 nm波长处吸光度。横坐标为FeSO4溶液浓度,纵坐标为吸光度,得到标准曲线y=0.269 2x+0.014 1,R2=0.999 4。测定铁离子还原能力:将5 μL 64 μg/mL待测液、150 μL FRAP工作液和15 μL 蒸馏水依次加入96孔酶标板中,混匀,37 ℃避光,每隔10 min测定595 nm波长处吸光度。阳性对照为VE,3次平行实验,以达到相同吸光度所需FeSO4浓度表示待测液的铁离子还原能力。
1.3.5 抗油脂过氧化能力测定
实验分成4组,空白组(35 mL橄榄油)、虾青素组(0.007 5 g虾青素+35 mL橄榄油)、β-胡萝卜素组(0.007 5 g β-胡萝卜素+35 mL橄榄油)和VE组(0.007 5 g VE+35 mL橄榄油)。所有实验3个平行,密封,60 ℃放置,每天根据GB 5009.227—2016《食品安全国家标准 食品中过氧化值的测定》中滴定法测定过氧化值。过氧化值以每千克中活性氧的毫克当量(meq/kg)表示。
1.3.6 氧自由基吸收能力(oxygen-radical absorbance capacity,ORAC)法评价抗氧化能力
按照徐维盛等[22]报道ORAC法评价抗氧化能力。荧光素钠、自由基产生剂2,2-偶氮二(2-甲基丙基咪)二盐酸盐(2,2′-azobis-2-methyl-propanimidamide,dihydrochlori,AAPH)、抗氧化标准物质Trolox均用75 mmol/L磷酸盐缓冲液溶解并稀释到适当浓度。设置空白孔、对照孔、不同浓度的标准溶液孔(Trolox)和样品孔。在96孔黑色酶标板中依次加入25 μL待测样、150 μL 86.1 nmol /L荧光素钠溶液,37 ℃温育10 min,迅速加入25 μL 153 mmol/L AAPH溶液启动反应。以激发波长485 nm,发射波长538 nm连续测定荧光强度,每隔2 min 测定1次荧光值,每次测定前中速振动孔板10 s。荧光衰减呈基线后停止测定,将每次测定的值与初始荧光强度的比值记为fn。根据公式(4)计算各孔荧光强度曲线下的面积(area under the curve,AUC),减掉空白孔的AUC,即得到各孔的Net AUC,根据不同浓度Trolox的Net AUC做标准曲线,计算各样品的ORAC值,待测样品的ORAC值以μmol TE/g表示,具体按公式(5)计算:
AUC=2×(f0+f1+f2+…fn-1+fn)-f0-fn
(4)
ORAC值![]()
(5)
1.4 协同抗氧化活性的测定
1.4.1 DPPH自由基清除率的测定
以2、4、8、16 μg/mL 4个剂量对虾青素和β-胡萝卜素进行两两组合,方法同1.3.1。
1.4.2 ABTS阳离子自由基清除率的测定
以2、4、8、16 μg/mL 4个剂量对虾青素和β-胡萝卜素进行两两组合,方法同1.3.2。
1.4.3 ·OH清除率的测定
以2、4、8、16 μg/mL 4个剂量对虾青素和β-胡萝卜素进行两两组合,方法同1.3.3。
1.5 数据分析
用SPSS 17.0软件对数据进行统计分析,结果以平均值±标准差表示。
2 结果与分析
2.1 DPPH自由基清除率及协同作用
由图1可知,质量浓度2~64 μg/mL时,虾青素、β-胡萝卜素和VE均具有DPPH自由基清除能力,并且呈剂量依赖性。16~64 μg/mL时,虾青素对DPPH自由基清除能力显著强于β-胡萝卜素和VE(P<0.05);当虾青素为64 μg/mL时,虾青素对DPPH自由基的清除率为(71.61±3.01)%。虾青素对DPPH自由基的半最大效应浓度(EC50)值为(29.95±3.01)μg/mL,而在试验浓度范围内未计算出β-胡萝卜素和VE的EC50值。

图1 不同质量浓度虾青素、β-胡萝卜素和VE对
DPPH自由基清除能力
Fig.1 DPPH scavenging ability of different concentration
of astaxanthin,β-carotene and VE
由表1可知,不同质量浓度的β-胡萝卜素与虾青素(16 μg/mL除外)组合对DPPH自由基清除率有协同作用,8 μg/mL虾青素与8 μg/mL β-胡萝卜素组合协同作用最强,协同作用值为16.78%。但16 μg/mL的虾青素与任意浓度的β-胡萝卜素组合均表现为拮抗。
表1 不同质量浓度虾青素和β-胡萝卜素组合的DPPH
自由基清除能力的值及相互作用关系
Table 1 DPPH radical scavenging capacity value and
interaction effect of astaxanthin and β-carotene at
different concentration

质量浓度/(μg·mL-1)清除率/%虾青素β-胡萝卜素协同值预期值协同-预期相互作用226.130.066.07协同作用47.842.695.15协同作用814.227.167.06协同作用1619.4912.876.62协同作用426.740.616.13协同作用417.103.2413.86协同作用817.137.719.42协同作用1620.4413.427.02协同作用828.467.730.73协同作用414.3610.364.00协同作用831.6114.8316.78协同作用1627.6220.547.08协同作用1627.4818.22-10.74拮抗作用418.2320.85-2.62拮抗作用820.4425.32-4.88拮抗作用1628.2531.03-2.78拮抗作用
注:协同值:2种单体混合后清除自由基能力的真实检测值;预期值:2种单体混合前清除自由基能力的真实检测值之和;协同-预期:真实检测值与预期值的差值,协同-预期>0,表示协同作用,协同-预期<0,表示拮抗作用(下同)
进一步分析发现当β-胡萝卜素质量浓度较高(8或16 μg/mL)时,增大虾青素的质量浓度(2~8 μg/mL)有促进协同作用的趋势;当β-胡萝卜素质量浓度较低(2或4 μg/mL)时,协同作用随虾青素浓度的增加(2~8 μg/mL)呈先上升后下降的趋势。结果表明,DPPH自由基抗氧化组合中,高质量浓度虾青素(16 μg/mL)与β-胡萝卜素组合不利于两者产生协同抗氧化作用。
2.2 ABTS阳离子自由基清除率及协同作用
由图2可知,虾青素、β-胡萝卜素和VE在试验浓度范围(2~64 μg/mL)内,除β-胡萝卜素在16 μg/mL时对ABTS阳离子自由基清除率略有下降,其余对ABTS阳离子自由基清除率均呈现出剂量依赖性。虾青素的EC50值为(61.21±4.17)μg/mL,而β-胡萝卜素和VE在试验浓度范围内未计算出EC50值。此外,在8~64 μg/mL的试验浓度范围内,虾青素清除ABTS阳离子自由基能力强于β-胡萝卜素和VE,当质量浓度为64 μg/mL时,虾青素对ABTS阳离子自由基的清除率最高,为(51.17±1.17)%。

图2 虾青素、β-胡萝卜素、VE的ABTS阳离子自由基清除能力
Fig.2 ABTS cationic radical scavenging ability of
astaxanthin,β-carotene and VE
由表2可知,除16 μg/mL虾青素与2 μg/mL β-胡萝卜素的组合外,虾青素与任意浓度的β-胡萝卜素组合均对ABTS阳离子自由基清除率有协同作用;协同作用最强为8 μg/mL虾青素与8 μg/mL β-胡萝卜素组合,协同作用值为63.64%;而16 μg/mL虾青素与2 μg/mL β-胡萝卜素的拮抗作用值为11.39%。总体来看,当β-胡萝卜素质量浓度为2 μg/mL时,增大虾青素的浓度有促进拮抗作用的趋势;当虾青素质量浓度为16 μg/mL时,协同作用随β-胡萝卜素浓度的增加而增强。结果表明,ABTS阳离子自由基抗氧化组合中,高质量浓度的虾青素(16 μg/mL)与低质量浓度的β-胡萝卜素(2 μg/mL)组合不利于两者产生抗氧化协同作用。
表2 不同浓度虾青素和β-胡萝卜素组合的ABTS阳离子
自由基清除率的值及相互作用关系
Table 2 ABTS cationic radical scavenging capacity value
and interaction effect of astaxanthin and β-carotene
at different concentrations

质量浓度/(μg·mL-1)清除率/%虾青素β-胡萝卜素协同值预期值协同-预期相互作用2229.811.2628.55协同作用48.272.116.16协同作用814.011.5712.44协同作用1611.734.517.22协同作用427.721.346.38协同作用462.302.1960.11协同作用812.441.6510.79协同作用1615.674.5911.08协同作用825.234.90.33协同作用415.675.579.92协同作用868.855.2163.64协同作用1616.598.158.44协同作用1625.9317.32-11.39拮抗作用418.4318.170.26协同作用817.9717.630.34协同作用1672.9520.5752.38协同作用
2.3 ·OH清除率及协同作用
由图3可知,在2~64 μg/mL的质量浓度范围内,虾青素、β-胡萝卜素和VE具有·OH清除活性。虾青素的·OH清除率显著高于β-胡萝卜素和VE,当虾青素质量浓度为64 μg/mL时,其对·OH的清除率最高,为(69.82±1.72)%。虾青素的EC50值为(26.12±5.14)μg/mL,VE和β-胡萝卜素在试验浓度范围内均未计算出EC50值。虾青素和VE的·OH清除率随浓度的增加均呈现上升的趋势,且表现出明显的量效关系,β-胡萝卜素的·OH清除率在试验浓度范围内变化不大,且呈现出波动趋势,无明显的量效关系。
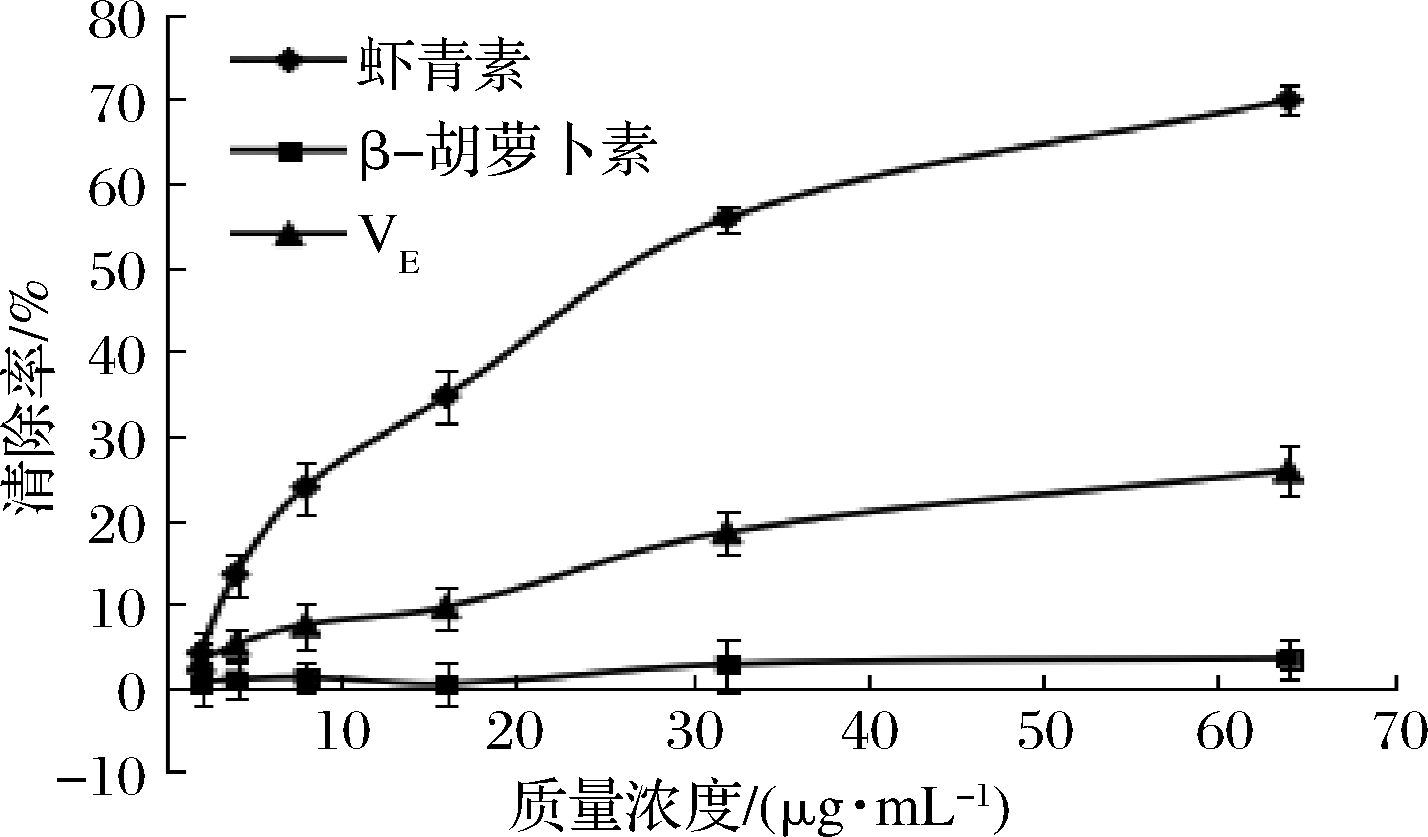
图3 虾青素、β-胡萝卜素、VE的·OH清除率
Fig.3 ·OH free radical scavenging ability of
astaxanthin,β-carotene and VE
由表3可知,样品在2~16 μg/mL,虾青素与β-胡萝卜素组合的·OH抗氧化活性相互作用情况复杂。低质量浓度β-胡萝卜素(2或4 μg/mL)与不同浓度虾青素的组合对·OH清除能力有协同作用,16 μg/mL虾青素与2 μg/mL β-胡萝卜素的协同作用最大,为9.03%。但是,高质量浓度β-胡萝卜素(8或16 μg/mL)与不同质量浓度虾青素(2 μg/mL虾青素除外)的组合有拮抗作用,最强为16 μg/mL β-胡萝卜素与8 μg/mL虾青素组合,拮抗作用值为9.33%。·OH抗氧化组合中,较高质量浓度的虾青素(4~16 μg/mL)与较高质量浓度的β-胡萝卜素(8或16 μg/mL)结合不利于两者产生协同抗氧化作用。
表3 不同浓度虾青素和β-胡萝卜素组合的·OH
清除能力的值及相互作用关系
Table 3 ·OH radical scavenging capacity value and
interaction effect of astaxanthin and β-carotene
at different concentrations
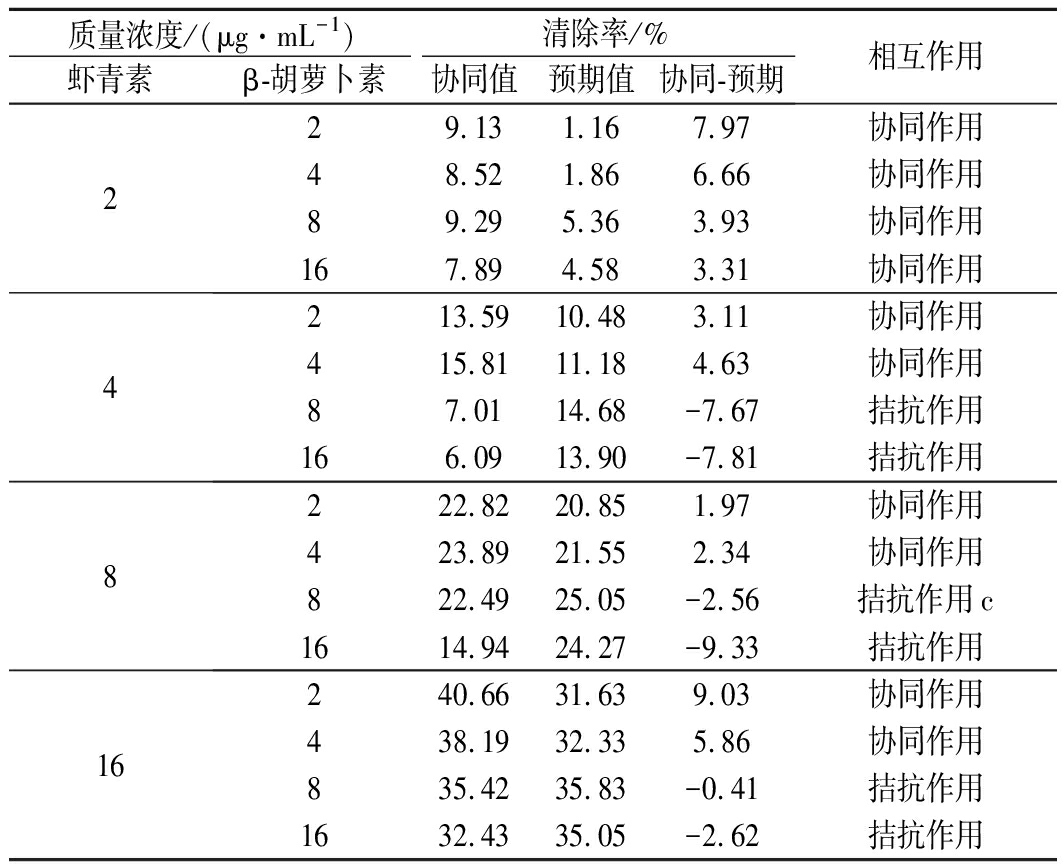
质量浓度/(μg·mL-1)清除率/%虾青素β-胡萝卜素协同值预期值协同-预期相互作用229.131.167.97协同作用48.521.866.66协同作用89.295.363.93协同作用167.894.583.31协同作用4213.5910.483.11协同作用415.8111.184.63协同作用87.0114.68-7.67拮抗作用166.0913.90-7.81拮抗作用8222.8220.851.97协同作用423.8921.552.34协同作用822.4925.05-2.56拮抗作用c1614.9424.27-9.33拮抗作用16240.6631.639.03协同作用438.1932.335.86协同作用835.4235.83-0.41拮抗作用1632.4335.05-2.62拮抗作用
2.4 铁离子还原能力
由图4可知,β-胡萝卜素、虾青素和VE均具有铁离子还原能力。当质量浓度为64 μg/mL时,β-胡萝卜素、虾青素和VE的FRAP值分别为(0.1200±0.011)、(0.2816±0.005)和(0.1020±0.0012)mmol/L。可见,虾青素的铁离子还原能力强于β-胡萝卜素和阳性对照VE,VE的铁离子还原能力最弱。

图4 β-胡萝卜素、虾青素和VE的铁离子还原能力
Fig.4 Iron ion reduction ability of β-carotene,astaxanthin and VE
2.5 抗油脂过氧化作用
由图5可知,所有组橄榄油的过氧化值均随着放置时间的增加而逐渐增大,添加虾青素、β-胡萝卜素和VE后橄榄油的过氧化值减小,说明它们具有一定的抗油脂过氧化作用。5 d后,虾青素、β-胡萝卜素和VE处理组的过氧化值分别为(3.50±0.10)、(7.60±0.11)和(5.34±0.02)meq/kg。可见,虾青素抗油脂的过氧化能力最强,β-胡萝卜素抗油脂的过氧化能力最弱。据文献报道,VE具有长链饱和烃基结构,而虾青素比VE具有更多的可置换结构和不饱和双键[23],这种可置换结构可能导致虾青素具有比VE更强的抗油脂过氧化作用[24]。

图5 虾青素、β-胡萝卜素、VE的抗油脂过氧化作用
Fig.5 Antiperoxide effects of astaxanthin,β-carotene and VE
2.6 ORAC法评价抗氧化能力
由图6可知,无抗氧化剂Trolox时,荧光衰退很明显;添加Trolox会抑制荧光衰退速度,并且抑制作用随Trolox浓度增大而逐渐增强。根据横坐标是Trolox浓度,纵坐标是净面积,得到Trolox标准溶液的标准曲线y=1.015 5x+0.095 6,R2=0.996。

图6 不同浓度Trolox标准溶液荧光随时间衰减曲线
Fig.6 Time course of the reaction of fluoresce with AAPH
in the presence of Trolox standard solution
无自由基的荧光素钠溶液荧光自然衰减对照;AAPH+:不含抗氧化剂的自由基对照;Trolox1~Trolox4:加入6.25、12.5、25.0、50.0 μmol/L Trolox标准溶液时荧光强度衰减的影响
图7为虾青素、β-胡萝卜素荧光随时间衰减曲线,根据衰减曲线计算出净面积。依据标准曲线得到虾青素的ORAC值为(4 325±11.79)μmol TE/g,β-胡萝卜素的ORAC值为(2 029±10.01)μmol TE/g,虾青素的ORAC值显著高于β-胡萝卜素的ORAC值,说明虾青素具有更强的抗氧化活性。
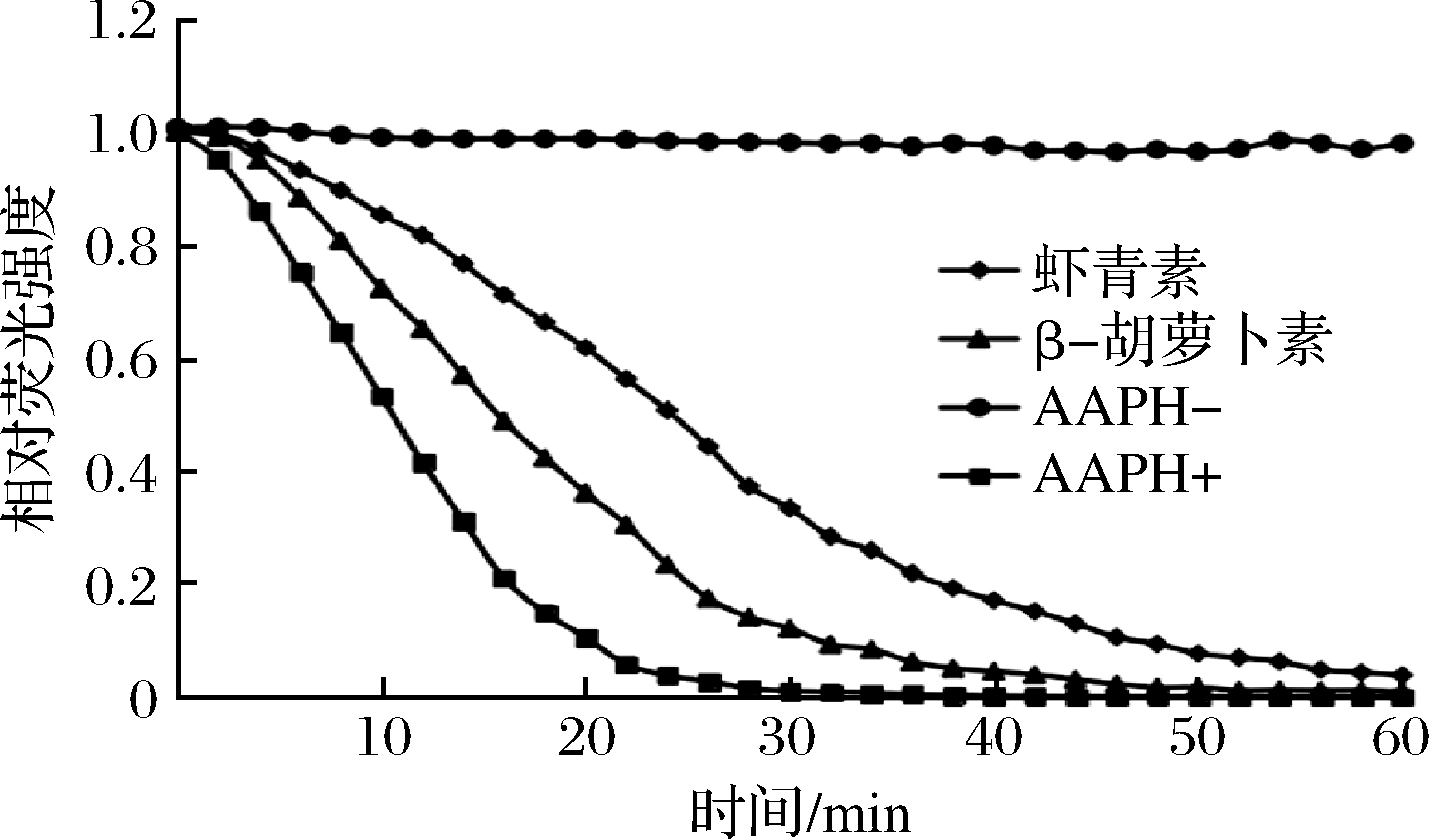
图7 虾青素、β-胡萝卜素荧光随时间衰减曲线
Fig.7 Time course of the reaction of fluoresce with AAPH
in the presence of astaxanthin and β-carotene
3 讨论
抗氧化体外评价方法因具有快速便捷的特点而被广泛应用。本文选择了6种抗氧化方法全面评价虾青素和β-胡萝卜素的抗氧化活性。结果表明,在6种抗氧化实验中,虾青素和β-胡萝卜素均具有抗氧化活性。其中虾青素对DPPH自由基、ABTS阳离子自由基和·OH清除率最强,其EC50值分别为(29.95±3.01)、(61.21±4.17)和(26.12±5.14)μg/mL;当AAPH-:质量浓度为64 μg/mL时,虾青素和β-胡萝卜素的FRAP值分别为(0.281 6±0.005)和(0.120 0±0.011)mmol/L;5 d后,虾青素和β-胡萝卜素的过氧化值分别为(3.50±0.10)和(7.60±0.11)meq/kg;在相同浓度下虾青素和β-胡萝卜素的ORAC值分别为(4 325±11.79)和(2 029±10.01)μmol TE/g。综上,虾青素的抗氧化能力优于β-胡萝卜素,此结果与LIU等[25]研究结果一致。虾青素具有独特的化学性质,虾青素骨架中的共轭双键及末端的不饱和酮基和羟基相互作用,加剧分子之间的摩擦力度,可以促进电子的自由移动,自由基负责提供电子与未配对电子相互吸引,能有效地淬灭附近的自由基及有害的活性氧[26]。据报道,虾青素除了不饱和多烯链在膜中捕获自由基外,其极性末端环部分能够通过分子间和分子内氢键捕获膜内和膜表面的自由基,从而在几种抗氧化体系中表现出比β-胡萝卜素更强的抗氧化能力[27-29]。
抗氧化剂组合的抗氧化能力大于相同剂量的单一抗氧化剂时,则抗氧化剂间存在协同作用,且抗氧化剂浓度和反应体系等会影响协同作用效果。低效的抗氧化剂黄芩苷与β-胡萝卜素组合后在由自由基引发的脂质氧化反应中表现出显著的协同作用[30]。黄芩苷的共轭基团有助于黄芩苷-β-胡萝卜素抗脂质过氧化协同作用的产生,其机制与葛根素-β-胡萝卜素的协同作用相似[31]。本文研究发现,虾青素和β-胡萝卜素组合对DPPH自由基、ABTS阳离子自由基和·OH清除率具有协同作用。此研究结果与LIANG等[32]报道虾青素与类胡萝卜素在脂相具有协同作用一致。这是由于类胡萝卜素的空间分布,虾青素固定在脂质/水界面,来自引发剂2,2′-偶氮双(2,4-二甲基戊腈)的初始自由基氧化虾青素生成自由基阳离子,与大豆卵磷脂氧化竞争,由于共振稳定作用,虾青素自由基阳离子中的单电子被重新定位到类胡萝卜素多烯链的中心,多烯链可以在细胞膜的亲脂性中心从还原性更强的类胡萝卜素β-胡萝卜素中提取一个电子,从而以β-胡萝卜素为代价再生虾青素。虾青素起着自由基桥的作用,将分子内部还原性更强的类胡萝卜素(β-胡萝卜素)的电子传递到具有高偶极矩自由基集中的界面。研究发现,高浓度虾青素与β-胡萝卜素组合不利于协同抗氧化作用的产生。许飒等[33]研究结果显示,当VC浓度较高,类胡萝卜素浓度较低时,两者组合具有较好的协同抗氧化作用;但是当类胡萝卜素增加至一定浓度时,两者组合没有表现出抗氧化协同作用。丁健等[34]研究表明,当VC为10 mg/mL,类胡萝卜素与VC质量浓度比值≤1.5时,或VE为0.384 mg/mL,类胡萝卜素与VE质量浓度比值≤1.5时,类胡萝卜素与VC或VE具有明显的助氧化作用;而当VC或VE浓度较低时,VC或VE将加速类胡萝卜素的降解。本研究结果显示,16 μg/mL虾青素与任意浓度β-胡萝卜素组合对DPPH自由基清除率比未混合前2种单体清除能力之和低,表现为拮抗作用;高浓度的虾青素与低浓度的β-胡萝卜素结合对ABTS阳离子自由基清除率以及较高浓度的虾青素与较高浓度的β-胡萝卜素结合对·OH清除率均表现出拮抗作用。抗氧化剂之间的拮抗现象可能是由于抗氧化剂自由基加合物的形成或抗氧化剂再生之间的竞争,以及一种抗氧化剂的微环境被另一种抗氧化剂改变所造成的[35]。
4 结论
本研究发现在多种抗氧化评价体系中,虾青素的抗氧化能力均强于β-胡萝卜素,并且虾青素和β-胡萝卜素组合对DPPH自由基、ABTS阳离子自由基和·OH清除率具有协同作用。因此可应用虾青素和β-胡萝卜素的抗氧化协同作用开发高效的抗氧化剂。同时可采用水溶性、成膜性、生物降解性良好的明胶和稳定性、溶解性、增稠性良好的麦芽糊精为微胶囊壁材,采用喷雾干燥法制备虾青素和β-胡萝卜素微胶囊,以避免光和氧等因素作用下类胡萝卜素的降解和异构化。综上,本文的研究结果为利用法夫酵母开发高效的抗氧化剂提供了理论依据。
[1] 逯阳. 几种植物多酚捕获体内自由基反应机理的理论研究[D].哈尔滨:哈尔滨理工大学,2017.
LU Y.A theoretical study on the reaction mechanisms of several plant polyphenols scavenging radicals in vivo[D].Harbin:Harbin University of Science and Technology,2017.
[2] PALANISWAMY R,PADMA P R.Free radical scavenging activity of Majorana hortensis leaves[J].Ancient Science of Life,2011,30(4):96-99.
[3] 翁雪梅, 李思惠.化学危害因素引起的疾病与自由基关系研究进展[J].职业卫生与应急救援,2009,27(2):77-79.
WENG X M,LI S H.Free radical and diseases caused by chemical hazards[J].Occupational Health and Emergency Rescue,2009,27(2):77-79.
[4] 韩静静, 田丹丹,高玉星,等.生育酚及其衍生物保护自由基诱导的生物大分子损伤和抑制HepG2细胞增殖的作用[J].食品科学,2018,39(13):144-152.
HAN J J,TIAN D D,GAO Y X,et al.Tocopheryl and derivatives protect against free radical-induced damage to biological macromolecules and inhibit the proliferation of HepG2 cells[J].Food Science,2018,39(13):144-152.
[5] 高岩, 邢丽红,孙伟红,等.不同来源虾青素提取、纯化及定量检测方法的研究进展[J].食品安全质量检测学报,2020,11(5):1 414-1 423.
GAO Y,XING L H,SUN W H,et al.Research progress on extraction,purification and quantitative detection methods of astaxanthin from different sources[J].Journal of Food Safety and Quality,2020,11(5):1 414-1 423.
[6] 张广伦, 肖正春,张锋伦,等.雨生红球藻中虾青素的研究与应用[J].中国野生植物资源,2019,38(2):72-77.
ZHANG G L,XIAO Z C,ZHANG F L,et al.Study and application of astaxanthin in Haematococcus pluvialis[J].Chinese Wild Plant Resources,2019,38(2):72-77.
[7] VISSER H,VANOOYEN A J J,VERDOES J C.Metabolic engineering of the astaxanthin-biosynthetic pathway of Xanthophyllomyces dendrorhous[J].FEMS Yeast Research,2003,4(3):221-231.
[8] HUSSEIN G,SANKAWA U,GOTO H,et al.Astaxanthin,a carotenoid with potential in human health and nutrition[J].Journal of Natural Products,2006,69(3):443-449.
[9] DU X P,DONG C C,WANG K,et al.Separation and purification of astaxanthin from Phaffia rhodozyma by preparative high-speed counter-current chromatography[J].Journal of Chromatography B,2016,1 029-1 030:191-197.
[10] HORMOZI M,GHOREISHI S,BAHARVAND P.Astaxanthin induces apoptosis and increases activity of antioxidant enzymes in LS-180 cells[J].Artificial Cells,Nanomedicine,and Biotechnology,2019,47(1):891-895.
[11] KUMAR S,SINGH S V.Influence of astaxanthin supplementation on attainment of puberty and lipid peroxidation in Sahiwal and Karan Fries (Holstein × Tharparkar) heifers during summer season[J].Biological Rhythm Research,2020,51(1):15-28.
[12] LI J J,GUO C Y,WU J Y.Astaxanthin in liver health and disease:A potential therapeutic agent[J].Drug Design,Development and Therapy,2020,14:2 275-2 285.
[13] ALIDADI M,JAMIALAHMADI T,CICERO A F G,et al.The potential role of plant-derived natural products in improving arterial stiffness:A review of dietary intervention studies[J].Trends in Food Science & Technology,2020,99:426-440.
[14] MISAWA N,SHIMADA H.Metabolic engineering for the production of carotenoids in non-carotenogenic bacteria and yeasts[J].Journal of Biotechnology,1998,59(3):169-181.
[15] OJIMA K,BREITENBACH J,VISSER H,et al.Cloning of the astaxanthin synthase gene from Xanthophyllomyces dendrorhous (Phaffia rhodozyma) and its assignment as a β-carotene 3-hydroxylase/4-ketolase[J].Molecular Genetics & Genomics,2006,275(2):148-158.
[16] VERDOES J C,SANDMANN G,VISSER H,et al.Metabolic engineering of the carotenoid biosynthetic pathway in the yeast Xanthophyllomyces dendrorhous (Phaffia rhodozyma)[J].Applied and Environmental Microbiology,2003,69(7):3 728-3 738.
[17] 王春, 杜希萍,姜泽东,等.法夫酵母虾青素高效液相色谱分析前处理方法改进研究[J].分析科学学报,2018,34(3):352-356.
WANG C,DU X P,JIANG Z D,et al.Improving the sample preparation for high performance liquid chromatography determination of astaxanthin from Phaffia rhodozyma[J].Journal of Analytical Science,2018,34(3):352-356.
[18] SOWMYA R,SACHINDRA N M.Evaluation of antioxidant activity of carotenoid extract from shrimp processing byproducts by in vitro assays and in membrane model system[J].Food Chemistry,2012,134(1):308-314.
[19] 张乃珣,尹红力,刘冉,等.茶黄素与真菌多糖联合清除ABTS自由基活性的比较[J].现代食品科技,2017,33(2):21-28;34.
ZHANG N X,YIN H L,LIU R,et al.ABTS radical scavenging activity of theaflavins combined with fungal polysaccharides[J].Modern Food Science and Technology,2017,33(2):21-28;34.
[20] VANIA U O,JOSELINA H O,ELIZABETH C M,et al.Component analysis and free radicals scavenging activity of Cicer arietinum L.husk pectin[J].Molecules,2010,15(10):6 948-6 955.
[21] BENZIE I F F,STRAIN J J.The ferric reducing ability of plasma (FRAP) as a measure of “antioxidant power”:The FRAP assay[J].Analytical Biochemistry,1996,239(1):70-76.
[22] 徐维盛, 李东,刘静,等.ORAC法对12种水果总抗氧化能力评价研究[J].食品工业,2014,35(1):247-250.
XU W S,LI D,LIU J,et al.Study on antioxidant activities of 12 kinds of fruit[J].The Food Industry,2014,35(1):247-250.
[23] 尹文娟. 载虾青素海藻酸钙微球的制备及性能研究[D].大连:大连理工大学,2016.
YI L J.Preparation and properties of astaxanthin-loaded calcium alginate microparticles[D].Dalian:Dalian University of Technology,2016.
[24] 钟先锋, 张继如,黄建锋,等.法夫酵母虾青素对油脂氧化稳定性的影响[J].粮油食品科技,2015,23(2):31-34.
ZHONG X F,ZHANG J R,HUANG J F,et al.Effects of astaxanthin from Phaffia rhodozyma on the oxidative stability of oil[J].Science and Technology of Cereals,Oils and Foods,2015,23(2):31-34.
[25] LIU X B,OSAWA T.Cis astaxanthin and especially 9-cis astaxanthin exhibits a higher antioxidant activity in vitro compared to the all-trans isomer[J].Biochemical and Biophysical Research Communications,2007,357(1):187-193.
[26] 钟雨彤. 虾青素的生理功能与应用领域[J].科技展望,2016,26(23):290.
ZHONG Y T.Physiological function and application of astaxanthin[J].Outlook of Science and Technology,2016,26(23):290.
[27] GOTO S,KOGURE K,ABE K,et al.Efficient radical trapping at the surface and inside the phospholipid membrane is responsible for highly potent antiperoxidative activity of the carotenoid astaxanthin[J].Biochimica et Biophysica Acta(BBA)-Biomembranes,2001,1 512(2):251-258.
[28] TERAO J.Antioxidant activity of β-carotene-related carotenoids in solution[J].Lipids,1989,24(7):659-661.
[29] LIM B P,NAGAO A,TERAO J,et al.Antioxidant activity of xanthophylls on peroxyl radical-mediated phospholipid peroxidation[J].Biochimica et Biophysica Acta,1992,1 126(2):178-184.
[30] LIANG R,HAN R M,FU L M,et al.Baicalin in radical scavenging and its synergistic effect with β-Carotene in antilipoxidation[J].Journal of Agricultural and Food Chemistry,2009,57(15):7 118-7 124.
[31] HAN R M,TIAN Y X,BECKER E M,et al.Puerarin and conjugate bases as radical scavengers and antioxidants:Molecular mechanism and synergism with β-Carotene[J].Journal of Agricultural and Food Chemistry,2007,55(6):2 384-2 391.
[32] LIANG J,TIAN Y X,YANG F,et al.Antioxidant synergism between carotenoids in membranes.Astaxanthin as a radical transfer bridge[J].Food Chemistry,2009,115(4):1 437-1 442.
[33] 许飒, 李忠,张声华.类胡萝卜素与VC的协同抗氧化性研究[J].食品科学,1999,20(2):22-26.
XU S,LI Z,ZHANG S H.Study of the synergistic antioxidative activities of carotenoids and VC[J].Food Science,1999,20(2):22-26.
[34] 丁健, 徐娟,张红艳.丙酮体系中柑橘皮中类胡萝卜素与VC及VE的协同抗氧化性研究[J].生物技术,2004,14(6):30-32.
DING J,XU J,ZHANG H Y.Study of the synergistic antioxidative activities of citrus peel carotenoids and VC or VE in acetone solution[J].Biotechnology,2004,14(6):30-32.
[35] CHOE E,MIN D B.Mechanisms of antioxidants in the oxidation of foods[J].Comprehensive Reviews in Food Science and Food Safety,2009,8(4):345-358.