葡萄酒酿造涉及到的酵母菌种主要包括酿酒酵母(Saccharomyces cerevisiae)和非酿酒酵母(non-Saccharomyces cerevisiae)[1]。酿酒酵母由于酒精转化率高、发酵彻底而被广泛用于葡萄酒酒精发酵。然而,酿酒酵母单独发酵常常会造成葡萄酒香气单一、风味同质化,地域风格欠缺等问题[2]。非酿酒酵母大量存在于葡萄酒酒精发酵的前期和中期,能够通过代谢、自溶等生化过程,参与酯类、醇类、萜烯类等挥发性香气物质的形成,提高葡萄酒的香气[3]。
粟酒裂殖酵母(Schizosaccharomyces pombe)是裂殖属的杆状酵母,曾被认为是腐败微生物,但近些年研究发现,S.pombe对葡萄酒生境耐受性较强,有较高的乙醇发酵能力,并能将L-苹果酸转化为乙醇[4],可以改善红葡萄酒颜色的稳定性,增加葡萄酒中香气化合物含量[5],降低影响产品质量安全的氨基甲酸乙酯的浓度[6],是极具酿酒潜力的非酿酒酵母,国外已将S.pombe应用于朗姆酒、棕榈酒和可可酒的酿造[7]。国际葡萄与葡萄酒组织(International Organisation of Vine and Wine, OIV)也批准了S.pombe作为生物降酸剂在葡萄酒发酵中使用[8]。目前葡萄酒行业对非酿酒酵母的使用多以混菌发酵方式进行,包括同时接种和顺序接种,其中顺序接种方式能够延长非酿酒酵母在发酵体系中的存活时间,更有效地改善葡萄酒的品质和感官特性[6],并缩短酒精发酵完成的时间[9],因此在混菌发酵中是一种有效利用非酿酒酵母的接种方式。黑比诺是西北地区主栽的早熟酿酒红葡萄品种,喜欢温和或冷凉的气候,葡萄皮薄,单宁含量低,带有成熟的红色水果的香气[10]。由于西北产区属于温带季风性气候,昼夜温差较大,气温偏低,酿酒葡萄成熟时间较短,使成品酒存在酸度过高、香气复杂性欠缺、产地特征不明显等问题[11]。
本试验以贺兰山东麓青铜峡市西鸽酒庄‘黑比诺’葡萄为原料,采用S.pombe和商业酿酒酵母顺序接种发酵,酿造‘黑比诺’干红葡萄酒,并对酒精发酵过程中菌种生长动态、苹果酸的变化趋势、成品酒的色泽及香气品质等进行分析,研究S.pombe与酿酒酵母顺序接种发酵对‘黑比诺’干红葡萄酒品质的影响,为提升西北产区葡萄酒品质提供参考依据。
1 材料与方法
1.1 材料与试剂
1.1.1 原料
‘黑比诺’葡萄,采摘于贺兰山东麓青铜峡市西鸽酒庄葡萄种植基地,糖含量226.8 g/L(以还原糖计),可滴定酸含量6.8 g/L(以酒石酸计),pH值3.67。
1.1.2 菌种与培养基
商业酿酒酵母(Saccharomyces cerevisiae)活性干粉(红佳酿Vintage Red),意大利Enartis公司;粟酒裂殖酵母(Schizosaccharomyces pombe),甘肃农业大学葡萄酒微生物实验室保藏;商业酒酒球菌(Oenococcus oeni)活性干粉(OMEGA),法国Lallemand公司。
YPD固体培养基(g/L):无水葡萄糖10,蛋白胨10,酵母浸粉5,琼脂10;YPD液体培养基(g/L):无水葡萄糖10,蛋白胨10,酵母浸粉5;WL培养基:购于青岛海博生物技术有限公司;葡萄汁培养基:葡萄汁与无菌水体积比为1∶1。
所有培养基均于121 ℃灭菌20 min。
1.1.3 主要试剂
偏重亚硫酸钠,上海源叶生物科技有限公司;EX-V果胶酶,法国Lallemand公司;L-苹果酸试剂盒,爱尔兰Megazyme公司;2-辛醇(色谱纯),SIGMA-ALDRICH(上海)贸易有限公司。
1.2 试验方法
1.2.1 发酵试验
1.2.1.1 菌株活化
将商业酿酒酵母活性干粉按0.2 g/L的添加量置于无菌水中,37 ℃水浴30 min后接种于YPD液体培养基中,于28 ℃培养48 h,以2%的接种量接种于葡萄汁培养基中,扩培2次后进行接种试验。
挑取S.pombe单菌落接种于液体培养基中,28 ℃培养48 h,再以2%的接种量(体积分数)接种于葡萄汁培养基中扩培,于28 ℃培养48 h后进行接种试验。
1.2.1.2 小容器发酵
黑比诺葡萄除梗破碎装罐,加入50 mg/L SO2(以偏重亚硫酸钠的形式)和20 mg/L果胶酶,16~18 ℃浸渍48 h,取葡萄汁装入2 L发酵罐中,装液量为70%,65 ℃水浴20 min[12],冷却至室温后接种酵母,发酵温度控制在25~28 ℃,当残糖低于4 g/L时添加50 mg/L SO2终止发酵,满罐于16~18 ℃酒窖贮存。每个处理设3组重复。
1.2.1.3 接种试验
对照组(CK):单独接种酿酒酵母于无菌葡萄汁中,使细胞浓度为107 CFU/mL,酒精发酵结束后,接种0.02 g/L酒酒球菌,18 ℃进行苹果酸-乳酸发酵。
处理组:在S.pombe接种后的第6、8、10、12天接入酿酒酵母,分别标记为SX1、SX2、SX3、SX4,接种后2种菌株的初始细胞浓度均为107 CFU/mL。所有试验均设置3组平行。
1.2.2 指标测定
1.2.2.1 菌株生物量测定
采用平板计数法进行菌落计数。发酵期间,每隔2 d取样,梯度稀释后涂布于YPD固体培养基,28 ℃培养箱恒温培养72 h,然后对S.pombe与酿酒酵母进行菌落计数,根据S.pombe、酿酒酵母分别在WL培养基上呈深绿色和奶油色带绿色的菌落形态进行区别统计。
1.2.2.2 葡萄酒理化指标测定
总糖、总酸、酒精度和挥发酸等含量参照国标GB/T 15038—2006《葡萄酒、果酒通用分析方法》测定;单宁含量测定参照农业标准NY/T 1600—2008《水果、蔬菜及其制品中单宁含量的测定分光光度法》中的方法;总花色苷参照史肖等[13]的方法测定;色度、色调参照庄惠婷等[14]的方法测定;苹果酸采用试剂盒法进行检测。
1.2.2.3 柔和指数的测定
柔和指数=酒精-(酸度+单宁)[15],其中酒精用体积百分数表示,单宁用g/L表示,酸度用g/L表示(以硫酸计)。
1.2.3 挥发性香气化合物测定
参照宋茹茹等[16]的方法进行测定。
1.2.4 感官分析
由10位葡萄酒品尝员进行感官评价,使用7分结构化数值尺度来量化,分别从外观(颜色)、口感(酸度、甜味、余味)、香气(浓郁度、优雅度、典型性)和综合品质(整体评分)4个方面对各葡萄酒样品进行评价。
1.3 数据分析
采用Excel 2010和Origin 9.0进行数据处理和图形绘制。使用SPSS 19.0绘制主成分分析图,并对数据进行差异显著性分析,采用Duncan检验进行多重比较,显著性水平P<0.05。
2 结果与分析
2.1 酒精发酵过程中的菌株生物量
不同顺序接种方式完成酒精发酵的时间不同(图1)。其中间隔12 d的SX4在第18天完成酒精发酵,其他顺序接种处理均在第16天完成酒精发酵,而对照CK在第8天完成酒精发酵,说明S.pombe与酿酒酵母的顺序接种使‘黑比诺’干红葡萄酒完成酒精发酵所需时间明显增加。
在酒精发酵过程中2种菌株生物量变化如图1所示。S.pombe和酿酒酵母菌株的起始细胞浓度均为107 CFU/mL,不同间隔天数的顺序接种完成酒精发酵后酿酒酵母菌株生物量与对照组基本一致,均保持在107 CFU/mL的水平;各处理组S.pombe菌株生长趋势基本一致,于2 d的指数生长期后进入稳定期,酿酒酵母菌株顺序接入后,S.pombe菌株细胞浓度迅速下降,酒精发酵结束后细胞浓度保持在105 CFU/mL的水平,酿酒酵母的细胞浓度基本都维持在107 CFU/mL左右。综上可知,S.pombe与酿酒酵母顺序接种发酵时,S.pombe的最终生物量基本一致,但随着接种间隔时间的增加,S.pombe在酒中发挥作用的时间增加。

a-SX1;b-SX2;c-SX3;d-SX4
图1 S.pombe和酿酒酵母顺序接种发酵过程中菌株生物量
Fig.1 Strain biomass during alcohol fermentation by the sequential inoculation of S.pombe and S.cerevisiae
注:图中实线代表菌株生物量,虚线代表葡萄酒中总糖含量;Gsc代表对照组的总糖含量,G代表处理组的总糖含量;Sp代表
Schizosaccharomyces pombe菌株,Sc代表Saccharomyces cerevisiae菌株
2.2 葡萄酒品质分析
2.2.1 主要理化指标的测定
表1显示了酒精发酵结束后‘黑比诺’干红葡萄酒的基本理化指标。各酒样中残糖含量为3.01~3.60 g/L,均能够完成酒精发酵。与对照组相比,处理组酒样中总酸含量均有降低,降低量为0.25~2.22 g/L,SX2的总酸含量显著低于其他处理组,说明SX2的降酸能力最好。
表1 S.pombe和酿酒酵母顺序接种酒样的理化指标
Table 1 Physical and chemical indexes under sequential inoculation of S.pombe and S.cerevisiae

理化指标CKSX1SX2SX3SX4残糖含量/(g·L-1)3.25±0.04a3.45±0.02b3.01±0.03a3.16±0.05a3.60±0.06b总酸含量/(g·L-1)5.27±0.11b4.57±0.12b3.05±0.13a4.22±0.35b5.02±0.37b挥发酸含量/(g·L-1)0.73±0.08a0.72±0.04a0.70±0.04a1.02±0.08b1.14±0.06b酒精体积分数/%12.15±0.15b11.04±0.1a11.20±0.07a11.01±0.01a10.87±0.06a单宁/(g·L-1)2.24±0.07a2.10±0.12a2.28±0.07a2.29±0.06a2.12±0.04a
注:不同字母代表差异性显著(P<0.05)(下同)
SX1和SX2与对照组相比挥发酸含量无显著差异,有研究表明,S.pombe菌株具有代谢产生乙酸的风险[6],本研究中处理组随着S.pombe菌株在酒样中作用时间的增加,挥发酸含量也逐渐增加,但均未超过国标限量值1.20 g/L。处理组酒精度与对照组相比显著降低,降低值在0.95%~1.28%,但各处理组之间没有显著差异。以上4个基本理化指标均符合国标GB 15037—2006《葡萄酒》的要求。单宁是影响葡萄酒质量的重要因素之一,赋予了葡萄酒独特的感官品质(收敛性),其含量与葡萄酒品质密切相关[17]。各处理组的单宁含量与对照组间差异不显著,含量在2.10~2.29 g/L。
2.2.2 对葡萄酒颜色的影响
色泽是评价干红葡萄酒品质的重要依据,是消费者选购和品评葡萄酒的重要参考因素[15]。酒精发酵结束后葡萄酒中色度值和色调值如图2-a所示,各处理组的色调值和色度值与对照组相比没有显著性差异,其色调值为0.77~0.85,色度值为1.00~1.05。总花色苷是影响葡萄酒颜色的重要指标之一。如图2-b所示,处理组酒样总花色苷含量与对照组之间无显著差异,表明S.pombe和酿酒酵母菌株不同间隔天数的顺序接种对葡萄酒中总花色苷含量无显著影响。

a-色度、色调;b-总花色苷
图2 S.pombe和酿酒酵母顺序接种的色度、
色调和总花色苷测定
Fig.2 Effect of sequential inoculation of S.pombe and
S.cerevisiae on chroma,hueand total anthocyanin content
注:不同小写字母表示差异显著(P<0.05)(下同)
2.2.3 对葡萄酒柔和指数的影响
柔和指数(suppleness index,IS)可以对红葡萄酒的味感平衡进行数字化衡量。IS<5的红葡萄酒瘦弱粗重;IS>5的红葡萄酒较为柔和;IS>6~7则表明红葡萄酒丰满圆润,口感平衡[15]。从图3可知,酒精发酵结束后,SX2酒样的IS为6.89,与对照组无显著差异,SX1、SX3和SX4的IS显著低于对照组,但SX1、SX3和SX4间没有显著差异,其值分别为5.89、5.91和5.40。上述结果表明,SX2和CK的酒样口感平衡协调。
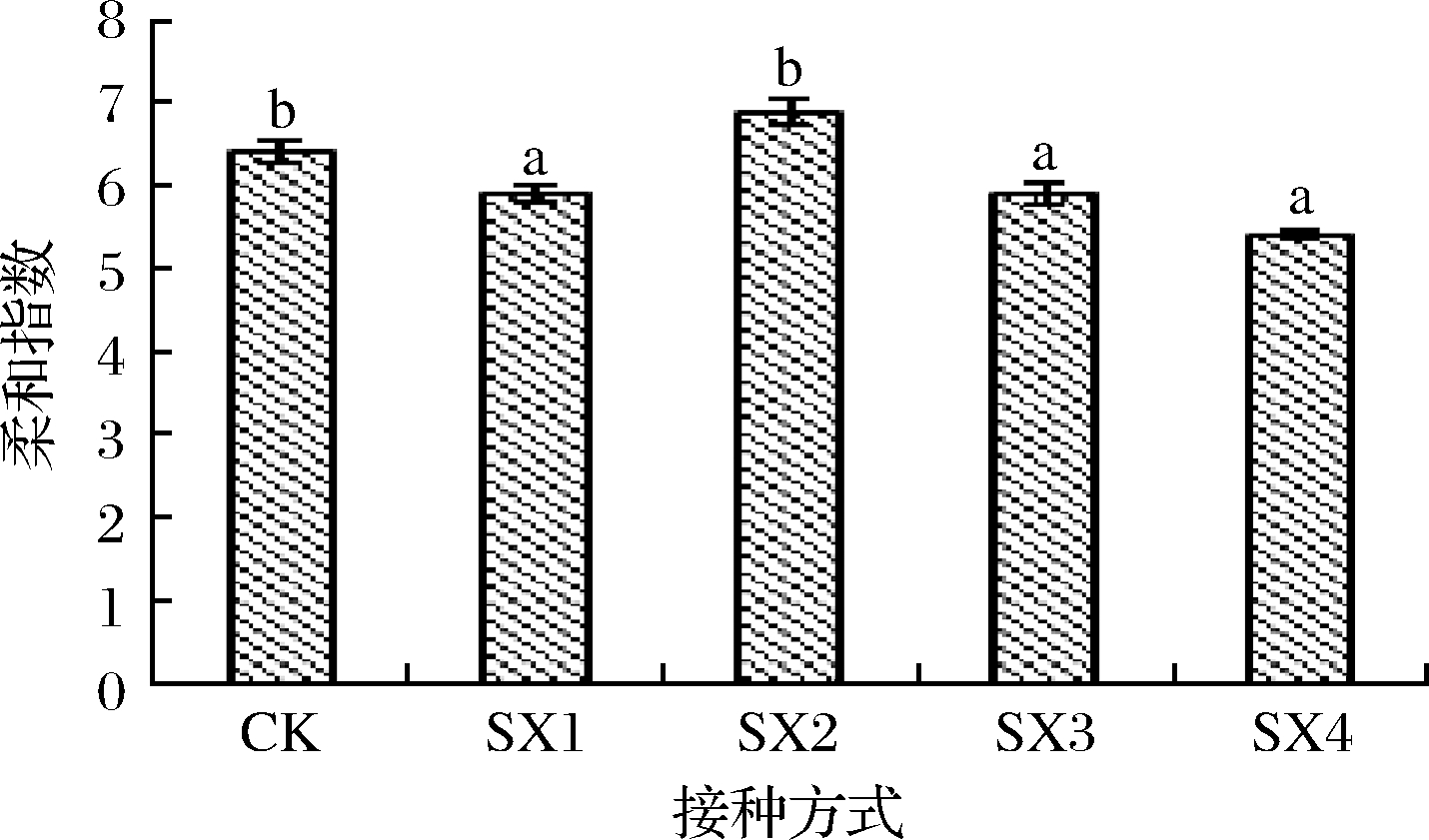
图3 S.pombe和酿酒酵母顺序接种的柔和指数分析
Fig.3 Effect of sequential inoculation of S.pombe and
S.cerevisiae on softness index
2.2.4 对葡萄酒苹果酸含量的影响
S.pombe在酒精发酵过程中不仅能降解葡萄糖,还能够降解苹果酸,相关研究发现,在S.pombe参与发酵的酒样中,苹果酸几乎能够被完全降解[4]。对各供试酒样苹果酸的含量分析表明(图4),不同间隔时间接种处理与经过苹果酸-乳酸发酵的对照酒样相比,苹果酸含量均显著降低,分别降低了20.00%、73.33%、40.00%、26.67%,其中SX2酒样中苹果酸含量(0.04 g/L)显著低于其他酒样,说明S.pombe与酿酒酵母菌株顺序接种发酵比酒酒球菌对苹果酸的降解更彻底。
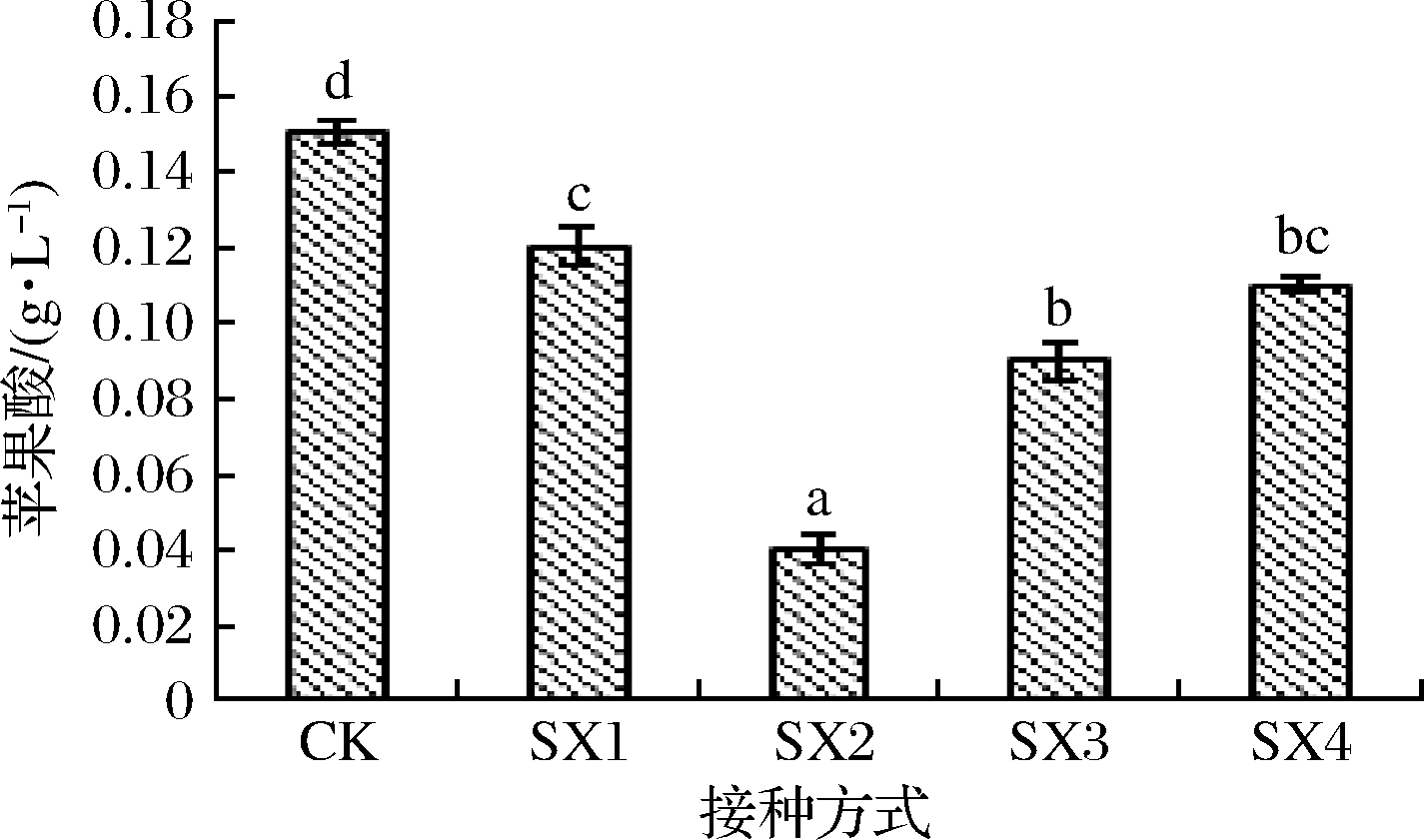
图4 S.pombe和酿酒酵母顺序接种的苹果酸含量分析
Fig.4 Effect of sequential inoculation of S.pombe and
S.cerevisiae on malic acid content
2.3 葡萄酒主要香气化合物分析
香气是葡萄酒感官品质的重要方面。通过顶空固相微萃取(headspace solid phase microextraction,HS-SPME)与气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)仪对供试酒样香气物质进行检测分析。试验酒样共检出52种主要挥发性香气物质。包括18种脂类,17种醇类,10种酸类,4种萜烯类,3种其他类。
2.3.1 酯类化合物
酯类是葡萄酒中重要的香气化合物,能为葡萄酒提供令人愉快的花香和果香[19]。酒精发酵结束后,与对照组相比,SX2酯类物质总量增加了73.58 μg/L,而其他3个处理组的酯类物质总量低于对照组。在检测到的18种酯类物质中,共有6种酯类物质的OAV>1,分别为乙酸异戊酯、己酸乙酯、辛酸甲酯、辛酸乙酯、癸酸乙酯、月桂酸乙酯。其中月桂酸乙酯具有花果香味和奶香味,该物质仅在处理组酒样中被检出,并在SX2和SX3酒样中的含量显著高于SX1和SX4;己酸乙酯、辛酸乙酯和癸酸乙酯的OAV值均>10,这几种物质具有浓郁的花果香气,而处理组中己酸乙酯含量显著高于对照组,是对照组的9.57~22.89倍;辛酸乙酯和癸酸乙酯在SX2中的含量显著高于其他组,分别比对照组增加了73.84%和40.01%。由此可以看出,间隔8 d的SX2处理能够增加月桂酸乙酯、己酸乙酯、辛酸乙酯和癸酸乙酯的含量,对葡萄酒花果香气具有积极影响。
2.3.2 醇类化合物
醇类物质产生于酒精发酵期间,是酵母菌的次生代谢物,当葡萄酒中的醇类物质含量低于300 mg/L时能够增加葡萄酒香气的复杂性。但当其总量超过400 mg/L时,会产生令人不愉快的气味,导致感官品质下降[20]。酒精发酵结束后,SX1、SX2和SX3醇类物质的总量高于对照组,分别比对照组增加了121.01%、90.18%和10.84%。所检测的17种醇类物质中,共有3种物质的OAV>1,分别为正辛醇、1-壬醇和正戊醇。正辛醇和正戊醇具有茉莉、柠檬和面包等香气,这2种物质仅在对照组、SX1和SX2中被检出,其中,SX1和SX2的正戊醇含量显著高于对照,分别是对照组的1.26倍和1.61倍。此外,苯乙醇能够为葡萄酒带来玫瑰、蜂蜜和蔷薇等香气,该物质仅在处理组中被检出,其中SX1的苯乙醇含量显著高于其他处理组。上述结果表明,SX1和SX2能够显著增加正戊醇和苯乙醇的含量,能够为葡萄酒带来明显的花香味。
2.3.3 酸类化合物
酸类物质能够增加葡萄酒香气的复杂性,其部分物质可以赋予葡萄酒果香、奶酪和脂肪等的风味[21]。所检测到的10种酸类物质中,对照组中异丁酸和己酸的OAV>1,增加了酒体中异味,但在各处理组中均低于阈值,能够增加酒样香气复杂性,降低不良风味的影响。
2.3.4 萜烯类化合物
萜烯类为葡萄酒提供花香和果香,且阈值较低,因此较低含量的萜烯也会在一定程度上影响葡萄酒的香气[22]。酒精发酵结束后,相比于对照组,处理组均能够显著增加萜烯类物质的总量,是对照组的1.60~7.18倍。SX2的香茅醇OAV>1,且含量显著高于其他组,是对照组的6.78倍,能够为葡萄酒带来青草香、丁香花香和蔷薇香等香气。上述结果表明,SX2能够增加香茅醇的含量,为葡萄酒带来比较浓郁的花香味。
2.3.5 其他类化合物
其他类化合物相对含量少。处理组的其他类化合物总量高于对照组,增加了37.23%~112.23%。所检测到的3种物质中,只有丁香酚的OAV>0.1,该物质具有丁香味和甘草香等香气,仅在处理组中被检出。
2.4 主要香气化合物的主成分分析
如图5-a所示,2个主成分(PC1和PC2)分别占总体方差的56.71%和26.29%,二者累计贡献率达到了83.00%。PC1主要反映了醇类和酸类的香气物质信息,PC2主要反映了酯类和萜烯类的香气物质信息。由图5-b可知,根据不同接种方式的葡萄酒发酵特性,可以将其聚为3类。其中SX2位于PC2的正向端,与辛酸乙酯(A6)、癸酸乙酯(A11)、甲酸苯乙酯(A18)、月桂酸乙酯(A13)、正戊醇(B11)和香茅醇(D1)等物质的相关性强,主要为葡萄酒香气贡献了比较浓郁的花香和果香。CK位于PC1正向端,与乙酸异戊酯(A3)、辛酸甲酯(A5)、癸酸甲酯(A10)、硬脂酸乙酯(A7)、壬酸乙酯(A9)、1-壬醇(B7)、庚醇(B5)、己酸(C5)、异丁酸(C3)和3-羟基月桂酸(C2)等物质有密切的联系,主要为葡萄酒香气贡献了果香和花香,但同时也增加了葡萄酒的不良风味。SX1、SX3和SX4位于PC1和PC2的负向端,说明这几种接种方式酿造的葡萄酒香气特征差,不适合用于高质量葡萄酒的酿造。通过主成分分析,可以看出不同间隔天数的顺序接种处理与对照组之间有较大的香气差异,其中SX2能够在一定程度上增加葡萄酒的香气。
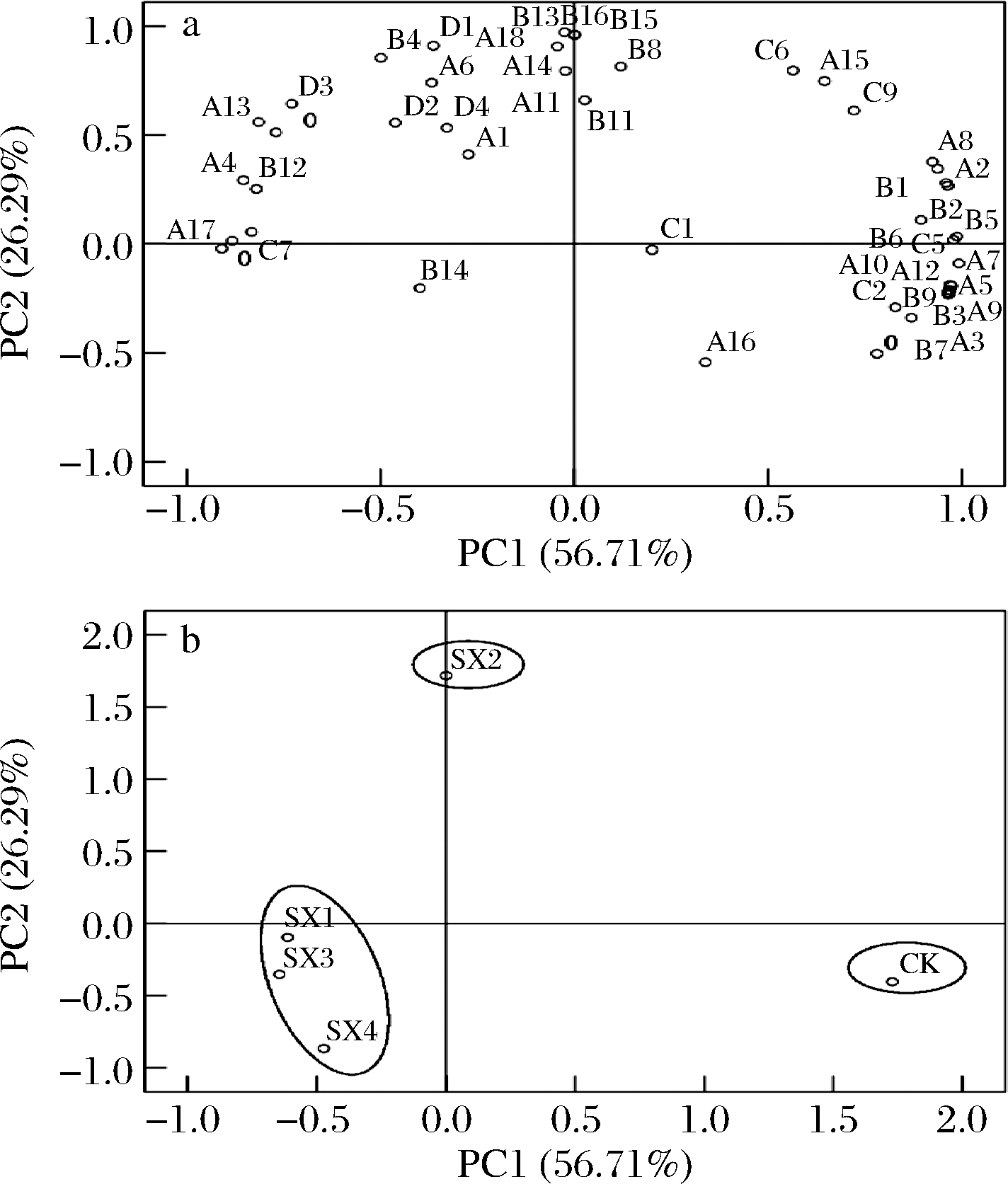
a中A1~A18为酯类物质;B1~B17为醇类物质;
C1~C10为酸类物质;D1~D4为萜烯物质
a-因子载荷图;b-样品分布图
图5 香气化合物主成分分析的因子载荷图和样品分布图
Fig.5 Loading plot and score plot from principal component
analysis of volatile aroma compounds
2.5 感官分析
对供试酒样进行感官分析(图6),各试验组在颜色、甜度、余味和优雅度方面的得分无明显差异。在口感方面,各处理组的酸度得分略低于对照组,SX2的得分略低于其他3个处理组,表明SX2的酒样降酸效果明显。

图6 感官分析雷达图
Fig.6 Radar map of sensory analysis
在香气方面,SX2和对照组之间的浓郁度没有显著差异,SX1、SX3和SX4的浓郁度略低于对照组,且SX1、SX3和SX4之间的浓郁度无差异,这与香气化合物主成分分析的结果一致,处理组的香气典型性略高于对照组,SX1、SX2和SX3的香气典型性略高于SX4,表明S.pombe和酿酒酵母顺序接种方式能够增加葡萄酒的典型性。
在整体评分方面,SX2酒样的分值略高于其他供试酒样,具有良好的口感和较为浓郁的花香和果香。
3 结论
粟酒裂殖酵母与商业酿酒酵母分别以间隔6、8、10、12 d顺序接种方式发酵‘黑比诺’干红葡萄酒,对苹果酸的降解能力显著高于酒酒球菌,间隔8 d的接种发酵方式降解苹果酸的能力显著高于6、10、12 d的接种发酵;其次,间隔8 d的顺序接种发酵与商业酿酒酵母单独接种并经过苹果酸乳酸发酵的酒样相比能够增加月桂酸乙酯、己酸乙酯、辛酸乙酯、癸酸乙酯、正戊醇、苯乙醇和香茅醇的含量,对葡萄酒花果香气具有积极影响,能够在一定程度上提升‘黑比诺’干红葡萄酒的感官品质。
[1] LIU W L,FAN M T,SUN S Y,et al.Effect of mixed fermentation by Torulaspora delbrueckii,Saccharomyces cerevisiae,and Lactobacillus plantarum on the sensory quality of black raspberry wines[J].European Food Research and Technology,2020,246(8):1 573-1 581.
[2] MA D,YAN X,WANG Q,et al.Performance of selected P.fermentans and its excellular enzyme in co-inoculation with S.cerevisiae for wine aroma enhancement[J].LWT-Food Science and Technology,2017,86:361-370.
[3] BENITO S,HOFMANN T,LAIER M,et al.Effect on quality and composition of Riesling wines fermented by sequential inoculation with non-Saccharomyces and Saccharomyces cerevisiae[J].European Food Research and Technology,2015,241(5):707-717.
[4] BENITO  ,CALDER
,CALDER N F,BENITO S.Schizosaccharomyces pombe biotechnological applications in winemaking[J].Methods in Molecular Biology,2018,1 721:217-226.
N F,BENITO S.Schizosaccharomyces pombe biotechnological applications in winemaking[J].Methods in Molecular Biology,2018,1 721:217-226.
[5] CHEN K,ESCOTT C,LOIRA I,et al.Use of non-Saccharomyces yeasts and oenological tannin in red winemaking:Influence on colour,aroma and sensorial properties of young wines[J].Food Microbiology,2018,69:51-63.
[6] MYLONA A E,DEL FRESNO J M,PALOMERO F,et al.Use of Schizosaccharomyces strains for wine fermentation-effect on the wine composition and food safety[J].International Journal of Food Microbiology,2016,232:63-72.
[7] BENITO S,PALOMERO F,MORATA A,et al.New applications for Schizosaccharomyces pombe in the alcoholic fermentation of red wines[J].International Journal of Food Science and Technology,2012,47(10):2 101-2 108.
[8] BENITO S,PALOMERO F,CALDERON F,et al.Selection of appropriate Schizosaccharomyces strains for winemaking[J].Food Microbiology,2014,42:218-224.
[9] LIU S X,LAAKSONEN O,YANG B R.Volatile composition of Bilberry wines fermented with non-Saccharomyces and Saccharomyces yeasts in pure,sequential and simultaneous inoculations[J].Food Microbiology,2019,80:25-39.
[10] 牛育林,何旺庄.‘黑比诺’干红葡萄酒酿造工艺优化及探讨[J].中外葡萄与葡萄酒,2020(3):45-49.
NIU Y L,HE W Z.Optimization and discussion about winemaking technology of ‘Pinot Noir’ dry red wine[J].Sino-Overseas Grapevine and Wine,2020(3):45-49.
[11] 白耀栋.甘肃河西走廊地区酿酒葡萄发展的优劣势分析[J].中外葡萄与葡萄酒,2016 (2):60-62.
BAI Y D.Analysis on the advantages and disadvantages of wine grape development in Hexi Corridor of Gansu Province[J].Sino-Overseas Grapevine and Wine,2016(2):60-62.
[12] BENITO A,CALDER N F,BENITO S.Mixed alcoholic fermentation of Schizosaccharomyces pombe and Lachancea thermotolerans and its influence on mannose-containing polysaccharides wine composition[J].AMB Express,2019,9(1):17
N F,BENITO S.Mixed alcoholic fermentation of Schizosaccharomyces pombe and Lachancea thermotolerans and its influence on mannose-containing polysaccharides wine composition[J].AMB Express,2019,9(1):17
[13] 史肖,张波,牛见明,等.甘肃武威地区不同成熟期‘黑比诺’葡萄中的多酚测定[J].食品与发酵工业,2020,46(4):258-265.
SHI X,ZHANG B,NIU J M,et al.Determination of polyphenols in ‘Pinot Noir’ grape at different ripening stages in Wuwei area of Gansu province[J].Food and Fermentation Industries,2020,46(4):258-265.
[14] 庄惠婷,杜金华,郭春宝,等.发酵石榴酒的色泽变化[J].食品与发酵工业,2011,37(3):113-117.
ZHUANG H T,DU J H,GUO C B,et al.Study on color changes of pomegranate wines[J].Food and Fermentation Industries,2011,37(3):113-117.
[15] 李华.葡萄酒品尝学[M].北京:科学出版社,2006.
LI H.Wine tasting[M].Beijing:Science Press,2006.
[16] 宋茹茹,段卫朋,祝霞,等.戴尔有孢圆酵母与酿酒酵母顺序接种发酵对干红葡萄酒香气的影响[J].食品与发酵工业,2019,45(24):1-9.
SONG R R,DUAN W P,ZHU X,et al.Effects of sequential inoculation with Torulaspora delbrueckii and Saccharomyces cerevisiae on aroma profile of dry red wine[J].Food and Fermentation Industries,2019,45(24):1-9.
[17] MASSIMILIANO A,FEDERICA G,NICOLA B,et al.Influence of vineyard altitude on Glera grape ripening (Vitis vinifera L.):Effects on aroma evolution and wine sensory profile[J].Journal of the Science of Food and Agriculture,2017,97(9):2 695-2 705
[18] 李斌斌,赵晓敏,周鹤,等.不同冷浸渍时间对干红葡萄酒酚类物质和色泽品质的影响[J].食品与发酵工业,2019,45(18):183-188;194.
LI B B,ZHAO X M,ZHOU H,et al.Effects of different cold maceration time on phenolic substances and color of dry red wine[J].Food and Fermentation Industries,2019,45(18):183-188;194.
[19] ZHANG B Q,LUNA Y,DUAN C H,et al.Use of Torulaspora delbrueckii co-fermentation with two Saccharomyces cerevisiae strains with different aromatic characteristic to improve the diversity of red wine aroma profile[J].Frontiers in Microbiology,2018,9:606.
[20] JOLLY N,AUGUSTYN O,PRETORIUS I.The role and use of non-Saccharomyces yeasts in wine production[J].South African Journal of Enology and Viticulture,2017,27(1):15-39.
[21] 原苗苗,姜凯凯,孙玉霞,等.戴尔有孢圆酵母对葡萄酒香气的影响[J].食品科学,2018,39(4):99-105.
YUAN M M,JIANG K K,SUN Y X,et al.Effects of Torulaspora debrueckii on wine aroma[J].Food Science,2018,39(4):99-105.
[22] 宿萌,李蕊蕊,王欢,等.戴尔有孢圆酵母对品丽珠和马瑟兰葡萄酒香气物质的影响[J].食品与发酵工业,2020,46(21):62-69.
SU M,LI R R,WANG H,et al.Effects of Torulaspora delbrueckii on the aroma compounds of Cabernet Franc and Marselan wines[J].Food and Fermentation Industries,2020,46(21):62-69.
[23] 祝霞,王媛,刘琦,等.混菌发酵对贵人香低醇甜白葡萄酒的香气影响[J].食品与发酵工业,2019,45(4):95-102.
ZHU X,WANG Y,LIU Q,et al.Effects of co-fermentation on the aroma of Italian Riesling low-alcohol sweet white wine[J].Food and Fermentation Industries,2019,45(4):95-102.
[24] 祝霞,刘琦,赵丹丹,等.酿造条件对酿酒酵母发酵香气的影响[J].食品科学,2019,40(16):115-123.
ZHU X,LIU Q,ZHAO D D,et al.Effect of different winemaking conditions on fermentation aroma production by Saccharomyces cerevisiae[J].Food Science,2019,40(16):115-123.