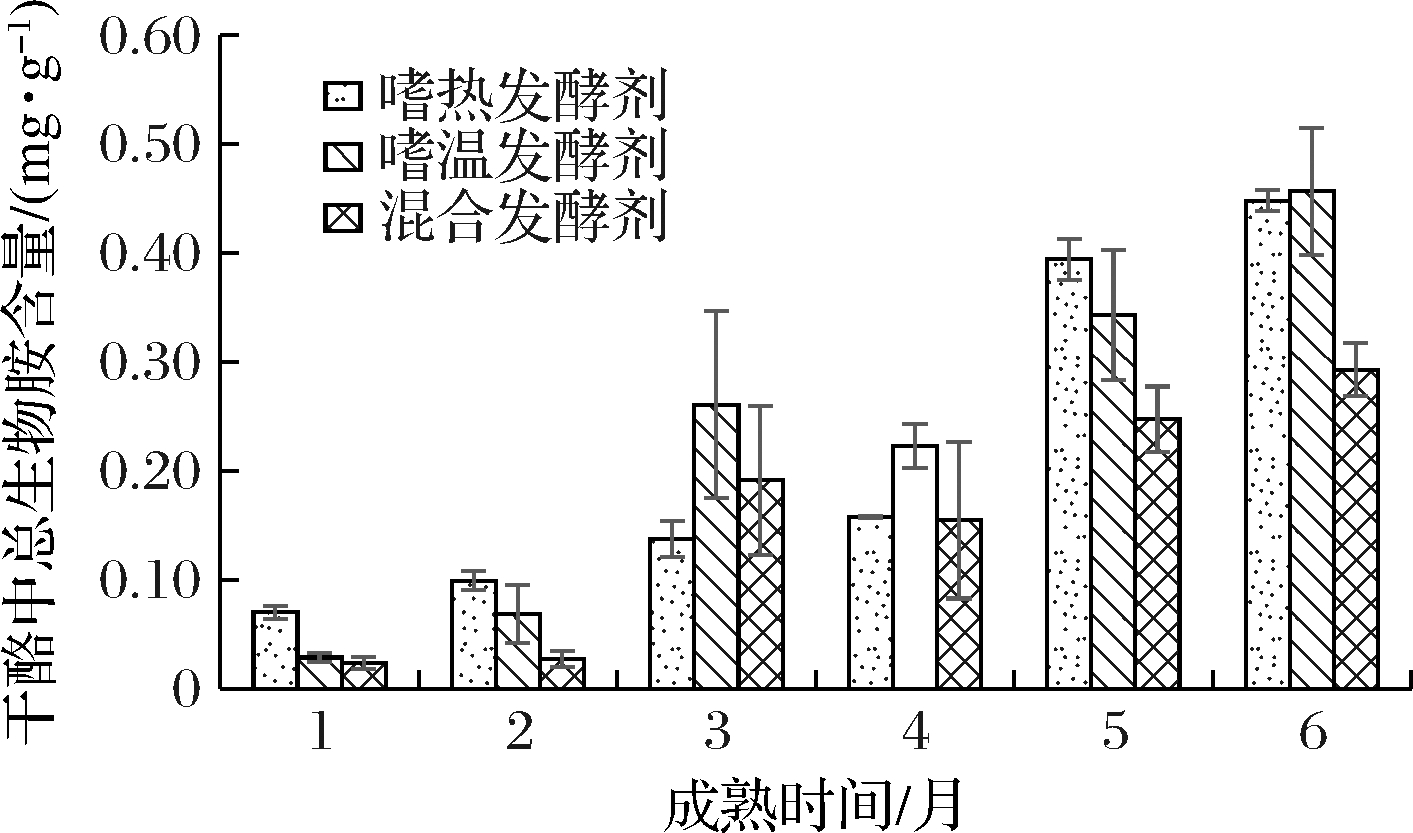
图1 发酵剂对牦牛乳硬质干酪成熟过程中
总生物胺含量的影响
Fig.1 Effect of starter cultures on the total biogenic amines
content during the ripening of cheese made from yak milk
全球每年大约35%牛乳用于干酪生产,年产量约1 900 万t。硬质干酪是主要干酪品种,为了获得良好食用品质,大部分需经历不同成熟期。蛋白质降解是干酪成熟过程中重要的生化反应之一,其蛋白质在凝乳酶、纤维溶酶、微生物蛋白酶、肽酶等作用下,逐步降解成各种多肽和氨基酸。氨基酸在干酪中氨基酸脱羧酶存在情况下,经脱羧产生生物胺。
生物胺是氨中1个、2个或3个氢被脂肪基团、芳香基团或杂环烃基基团取代的碱性、含氮低分子质量有机化合物,作为生物体正常生理成分,在活生物细胞中具有重要生理功能[1]。然而,当人体摄入过多时,将严重损害机体健康。大量组胺摄入能引起人呼吸窘迫和心悸。酪胺能够在单胺氧化酶抑制剂药物治疗病人身上引发高血压,也能在敏感性群体中引发偏头痛。干酪为生物胺形成提供了良好物质基础和环境,因此,易于形成生物胺。
干酪中生物胺含量受原料乳质量、原料乳是否热处理以及发酵剂[2-4]等众多因素影响。干酪生产中常用发酵剂为嗜温乳球菌、明串珠菌属、乳杆菌和嗜热链球菌等,除了快速发酵产酸使其pH值降低有助于凝乳外,也影响着成熟过程中蛋白质降解。干酪中氨基酸脱羧酶主要源于发酵剂或生产过程中杂菌[5]。乳酸菌是干酪中组胺和酪胺的主要产生者[6]。组胺源自乳酸链球菌和瑞士乳杆菌脱羧酶作用所产生的[7]。不同发酵剂对羊乳干酪中生物胺含量影响极显著(P<0.01)[8]。不同发酵剂和脂肪含量的Dutch型半硬质干酪中主要生物胺为酪胺、组胺和腐胺[9]。乳酸菌产生物胺的能力具有菌株特异性,即使相同种属乳酸菌,其产胺能力也不尽相同[10-12]。因此,科学、合理选择发酵剂,有助于控制干酪中生物胺。
牦牛乳硬质干酪成熟期长,风味浓郁,营养价值高。研究发现不同发酵剂牦牛乳硬质干酪蛋白质降解具有差异[13],但是蛋白质降解所产生的游离氨基酸变化是否影响生物胺产生和积累知之甚少。为此,本试验以此为切入点,研究不同发酵剂对牦牛乳硬质干酪成熟过程中生物胺的影响,以期为牦牛乳硬质干酪生产中发酵剂选择以及质量安全控制提供参考依据。
牦牛乳,天祝县抓喜秀龙乡;凝乳酶,北京多爱特生物科技有限公司;嗜热发酵剂(嗜热链球菌、保加利亚乳杆菌)、嗜温发酵剂(乳酸乳球菌乳脂亚种、乳酸乳球菌乳酸亚种)和混合发酵剂(混合嗜热发酵剂与嗜温发酵剂质量比1∶1),丹尼斯克公司;组胺二盐酸盐、2-苯乙胺盐酸盐、酪胺盐酸盐、腐胺二盐酸盐、尸胺二盐酸盐、丹磺酰氯、L-脯氨酸、1,7-二氨基庚烷等均为分析纯,Sigma公司;乙腈(色谱纯)、亮氨酸、水合茚三酮、氯化镉、乙醚、碳酸氢钠(分析纯)等均为国产试剂。
HWS26-电热恒温水浴锅,上海一恒科学仪器有限公司;真空包装机,温州市大江真空包装机械有限公司;TGL-20M高速台式冷冻离心机,长沙湘仪离心机仪器有限公司;2998 PDA四元梯度超快速液相色谱仪,美国Waters公司;WD-12氮吹仪,杭州奥盛仪器有限公司;PHS-3C精密pH计,上海仪电科学仪器股份有限公司;723型可见分光光度计,上海光谱仪器有限公司。
1.3.1 干酪制作和取样
参考刘兴龙等[14]的方法,适当修改后分别制作了3种不同发酵剂牦牛乳硬质干酪。主要操作要点如下:原料乳经63 ℃杀菌30 min后,冷却到35 ℃,按照1%添加活化发酵剂于牛乳中,发酵1 h。再加入氯化钙(0.3 g/L)缓慢搅拌均匀,10 min后,加入凝乳酶(0.67 g/L),凝乳约1 h。再经过切割、排乳清、搅拌、加盐、堆酿、压榨等环节,形成乳凝块,真空包装。4 ℃下分别成熟1、2、3、4、5、6 个月,然后将不同成熟阶段干酪贮藏在-80 ℃。成熟结束后,开展试验。
1.3.2 pH 测定
参考JIN等[15]的方法,测定pH。称取5 g干酪,加入10 mL蒸馏水混合、匀浆后,pH计测定。
1.3.3 游离氨基酸测定
参考FOLKERTSMA等[16]的方法,适当修改后测定。称取一定量切碎干酪,按照1∶9(g∶mL)加入蒸馏水,研钵研碎,40 ℃下放置1 h。3 000 r/min下离心30 min后,再用快速滤纸过滤。取其过滤液30 μL,蒸馏水稀释到1 mL,加入镉-茚三酮溶液2 mL,84 ℃反应5 min。冷却后,507 nm处测定吸光度。以亮氨酸为标准物,制作标准曲线,计算干酪中游离氨基酸含量。
1.3.4 生物胺测定
1.3.4.1 生物胺提取和衍生
参照INNOCENTE等[17]的方法,称取5 g研磨均匀的干酪于试管中,加入0.1 mol/L盐酸10 mL和1 mg/mL 1,7-二氨基庚烷100 μL,均质2 min后,干酪浆液在12 000 r/min、4 ℃下离心20 min。收集上清液,用同样方法浸提残余物,将浸提液混合后倒入容量瓶,用0.1 mol/L盐酸定容到25 mL。
吸取1 mL溶液,加入0.5 mL饱和碳酸氢钠和1 mL 50 mg/mL丹磺酰氯于带有密封的试管中,涡旋振荡30 s后,40 ℃反应60 min。之后,加入200 μL L-脯氨酸(100 mg/mL),涡旋1 min,在室温黑暗处反应15 min。再用1 mL乙醚萃取,4 ℃下离心3 min(3 000 r/min)。吸取上层有机溶液,重复离心后,将有机溶液层混合,用氮气吹干。将残留物溶解于1 mL乙腈中,经0.22 μm膜过滤后进行测定。以组胺、2-苯乙胺、酪胺、腐胺、尸胺为标准品,按照以上方法衍生,并制作标准曲线,计算干酪中各生物胺含量。
1.3.4.2 色谱条件
参照MORET等[18]的方法,利用HPLC适当调整后测定。色谱柱:Symmetry C18(5 μm,250 mm×4.6 mm),柱温30 ℃;流速1 mL/min;紫外检测波长254 nm;进样量10 μL;流动相A为水,流动相B为乙腈;梯度洗脱条件:0 min,65%B;1 min,65%B;10 min,80%B;14 min, 80%B;21 min,100%B;30 min,100%B。
每个处理重复3次,结果用平均值±标准偏差表示,SPSS 19.0对数据进行方差和相关性分析,WPS Office作图。
3种发酵剂牦牛乳硬质干酪中各生物胺含量总和,为其总生物胺含量。其总生物胺在干酪成熟过程中的变化规律如图1所示。

图1 发酵剂对牦牛乳硬质干酪成熟过程中
总生物胺含量的影响
Fig.1 Effect of starter cultures on the total biogenic amines
content during the ripening of cheese made from yak milk
由图1可知,3种发酵剂干酪在1~3个月成熟过程中,其生物胺总量增加较快。经过第4个月缓慢成熟,进入5~6个月成熟阶段时,又呈现较快增长态势。成熟6个月时,嗜温发酵剂干酪中总生物胺含量[(456.8±58.4)mg/kg]略高于嗜热发酵剂干酪[(448.3±9.6)mg/kg],但是两者差异不显著(P>0.05)。混合发酵剂干酪中生物胺总量[(293±24.5)mg/kg]仅占嗜温发酵剂干酪的64.15%,显著低于嗜热、嗜温发酵剂干酪中总生物胺含量(P<0.05)。方差分析显示,发酵剂类型和成熟时间对干酪中生物胺总量影响显著(P<0.05)。
由图2可知,3种发酵剂牦牛乳硬质干酪在1~3个月和4~6个月成熟期间,其2-苯乙胺呈现较快增长趋势。方差分析显示,发酵剂类型对干酪中2-苯乙胺含量影响不显著(P>0.05),但是混合发酵剂干酪中2-苯乙胺含量整体相对较低。
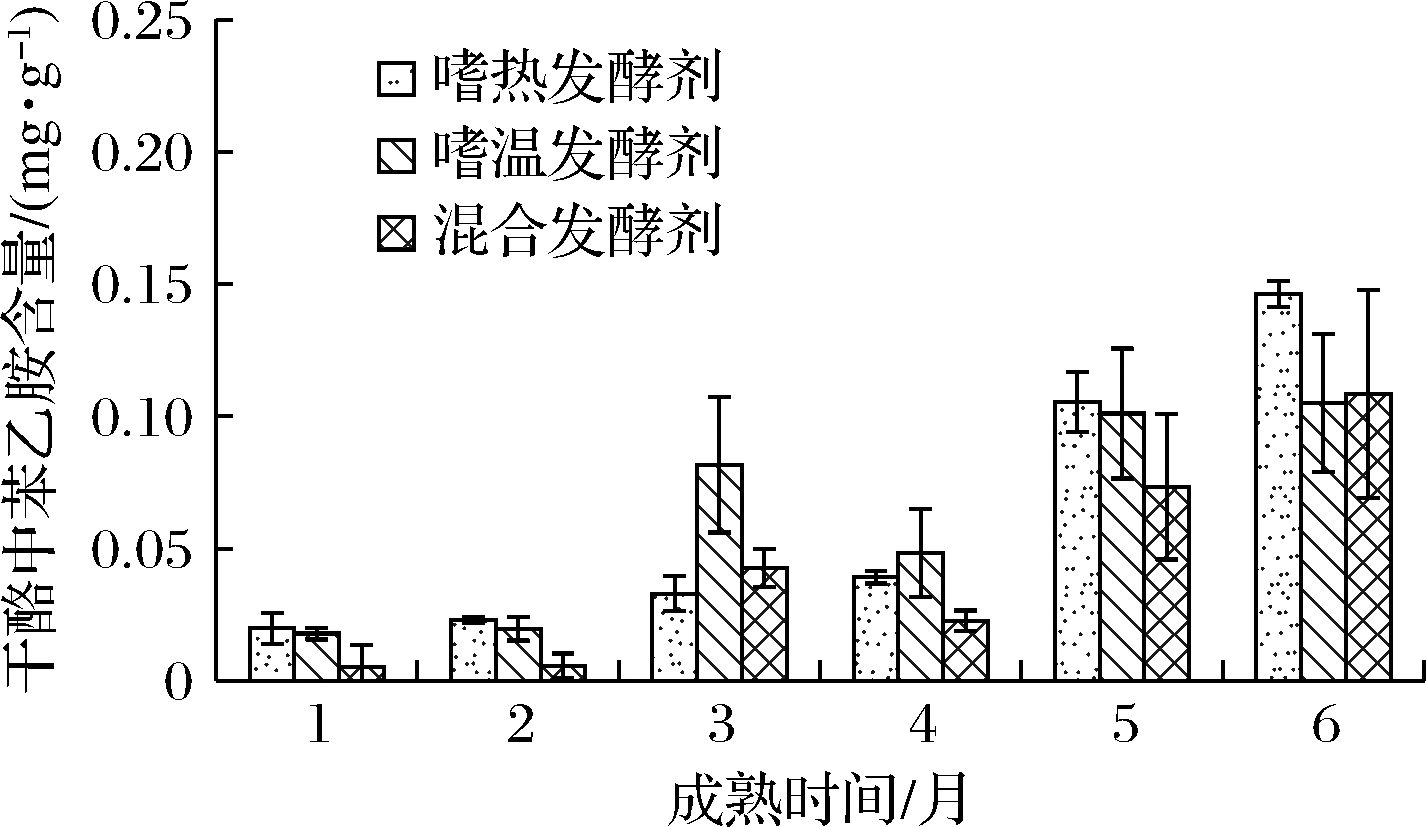
图2 发酵剂对牦牛乳硬质干酪成熟过程中
2-苯乙胺含量的影响
Fig.2 Effect of starter cultures on the 2-phenylethylamine
content during the ripening of cheese made from yak milk
由图3可知,嗜热发酵剂牦牛乳硬质干酪在1~4个月成熟过程中,其腐胺增加缓慢,之后,呈现明显增加趋势。嗜温、混合发酵剂干酪在1~3个月成熟过程中,其腐胺快速增加,之后增加缓慢。在1~2个月成熟过程中,嗜热发酵剂干酪中腐胺含量显著高于嗜温、混合发酵剂干酪(P<0.05)。成熟6个月时,嗜热、嗜温发酵剂干酪腐胺含量分别达到最高,且嗜温发酵剂干酪中腐胺高于嗜热发酵剂干酪,但两者差异不显著(P>0.05)。混合发酵剂干酪中腐胺含量为嗜温发酵剂干酪中腐胺的62.26%,显著低于嗜热和嗜温发酵剂干酪(P<0.05)。本试验所用嗜温发酵剂由乳酸乳球菌乳酸亚种、乳酸乳球菌乳脂亚种组成,FLASAROV 等[19]曾报道了以乳酸乳球菌乳脂亚种为发酵剂,成熟90 d的模拟Dutch型干酪中腐胺和酪胺含量分别达900、500 mg/kg,因此,嗜温发酵剂牦牛乳硬质干酪中腐胺和酪胺较高与其发酵剂属性有关。
等[19]曾报道了以乳酸乳球菌乳脂亚种为发酵剂,成熟90 d的模拟Dutch型干酪中腐胺和酪胺含量分别达900、500 mg/kg,因此,嗜温发酵剂牦牛乳硬质干酪中腐胺和酪胺较高与其发酵剂属性有关。

图3 发酵剂对牦牛乳硬质干酪成熟过程中
腐胺含量的影响
Fig.3 Effect of starter cultures on the putrescine content
during the ripening of cheese made from yak milk
由图4可知,混合发酵剂牦牛乳硬质干酪在1~3个月成熟过程中,未检测出尸胺,在4~6个月成熟过程中,其呈现增加态势,但是无显著差异(P>0.05)。成熟4个月嗜热发酵剂干酪中尸胺显著高于嗜温、混合发酵剂干酪(P<0.05)。嗜热发酵剂干酪在4~6个月成熟过程中,其尸胺含量变化较小,而嗜温发酵剂干酪中尸胺呈现急剧增加趋势,GUARCELLO 等[20]发现尸胺含量与乳球菌之间具有正相关性。成熟6个月时,混合发酵剂干酪中尸胺最低,只有嗜温发酵剂干酪中尸胺的0.37倍。

图4 发酵剂对牦牛乳硬质干酪成熟过程中尸胺
含量的影响
Fig.4 Effect of starter cultures on the cadaverine content
during the ripening of cheese made from yak milk
由图5可知,成熟1~3个月嗜温发酵剂牦牛乳硬质干酪中未检出组胺,成熟后期,组胺产生。在1~6个月成熟过程中,嗜热发酵剂干酪中组胺最高,嗜温发酵剂干酪次之,混合发酵剂干酪中未检测出组胺,但是嗜热发酵剂干酪中组胺最高含量[(20.8±7.9)mg/kg]远低于美国食品药品管理局规定的食品中组胺最大限值50 mg/kg。嗜热链球菌属的某些菌株具有产组胺能力[21]。酸性pH将诱导嗜热链球菌组氨酸脱羧酶活性增强[22]。本试验所用嗜热发酵剂含有嗜热链球菌,因此,嗜热发酵剂牦牛乳硬质干酪中组胺较高。

图5 发酵剂对牦牛乳硬质干酪成熟过程中
组胺含量的影响
Fig.5 Effect of starter cultures on the histamine content
during the ripening of cheese made from yak milk
由图6可知,牦牛乳硬质干酪在1~3个月成熟过程中,嗜热、嗜温和混合发酵剂干酪中酪胺呈现增加趋势,且三者无显著差异(P>0.05)。成熟5个月嗜温、嗜热发酵剂干酪中酪胺无显著差异(P>0.05),但是与混合发酵剂干酪具有显著性差异(P<0.05)。成熟6个月时,嗜温发酵剂干酪中酪胺含量[(92.9±6.7) mg/kg]显著高于嗜热、混合发酵剂干酪(P<0.05)。嗜温、混合发酵剂均含有乳酸乳球菌。某些乳酸乳球菌菌株含有酪氨酸脱羧酶基因[23],PINTADO等[24]发现乳球菌和酪胺之间具有较强相关性,因此,嗜温、混合发酵剂牦牛乳硬质干酪出现了酪胺含量较高的现象。

图6 发酵剂对牦牛乳硬质干酪成熟过程中酪胺
含量的影响
Fig.6 Effect of starter cultures on the tyramine content
during the ripening of cheese made from yak milk
乳酸菌在干酪成熟过程中由于自身所含肽酶和自溶度差异,以及生长繁殖过程中对氨基酸利用程度不同,使得干酪中游离氨基酸总量处于动态调整中。由图7可知,牦牛乳硬质干酪在1~6个月成熟过程中,其游离氨基酸呈现增加趋势。嗜热发酵剂干酪中游离氨基酸含量最高,嗜温发酵剂次之,混合发酵剂干酪中游离氨基酸含量最低。

图7 发酵剂对牦牛乳硬质干酪成熟过程中
游离氨基酸含量的影响
Fig.7 Effect of starter cultures on the content of free amino
acids during the ripening of cheese made from yak milk
pH通过调节氨基酸脱羧酶基因表达或者其活性影响生物胺形成与积累。从图8可知,3种发酵剂牦牛乳硬质干酪pH变化不同,在1~3个月成熟过程中,嗜热发酵剂干酪pH较高,嗜温发酵剂干酪pH较低。但是在4~6个月成熟过程中,混合发酵剂干酪pH较高,而嗜热、嗜温发酵剂干酪pH较低,且相近。

图8 发酵剂对牦牛乳硬质干酪成熟过程中pH的影响
Fig.8 Effect of starter cultures on pH during the
ripening of cheese made from yak milk
对不同发酵剂牦牛乳硬质干酪中游离氨基酸和生物胺进行了相关性分析,结果见表1。
表1 牦牛乳硬质干酪中各生物胺和游离氨基酸相关性分析
Table 1 Pearson correlation coefficients between the total free amino acid and biogenic amine content in the
hard cheese made in yak milk
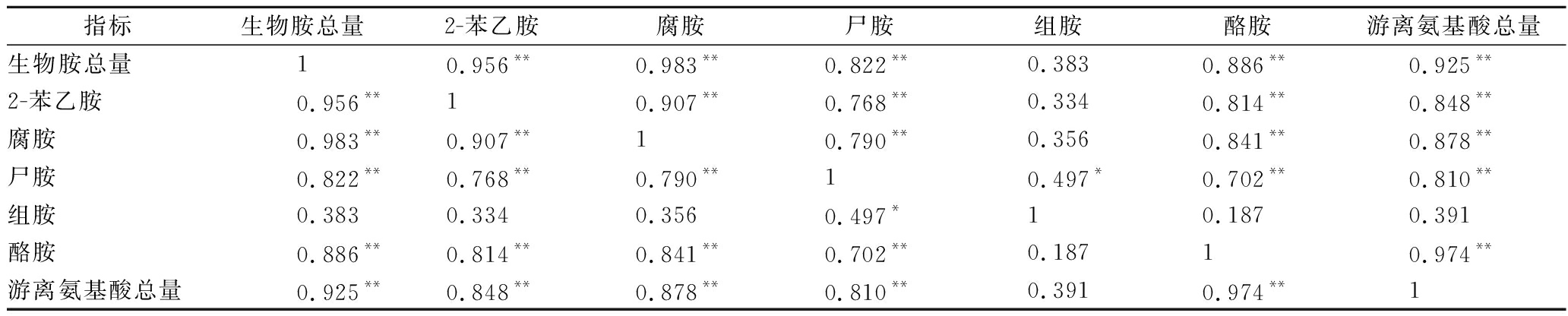
指标生物胺总量2-苯乙胺腐胺尸胺组胺酪胺游离氨基酸总量生物胺总量10.956**0.983**0.822**0.3830.886**0.925**2-苯乙胺0.956**10.907**0.768**0.3340.814**0.848**腐胺0.983**0.907**10.790**0.3560.841**0.878**尸胺0.822**0.768**0.790**10.497*0.702**0.810**组胺0.3830.3340.3560.497*10.1870.391酪胺0.886**0.814**0.841**0.702**0.18710.974**游离氨基酸总量0.925**0.848**0.878**0.810**0.3910.974**1
注:** 在0.01 水平(双侧)上显著相关,*在 0.05 水平(双侧)上显著相关
从表1可知,除了组胺之外,干酪中游离氨基酸与各生物胺呈极显著正相关性(P<0.01),说明游离氨基酸对生物胺形成具有重要作用。各生物胺之间也存在正相关性。腐胺和生物胺总量呈极显著正关性(P<0.01),其相关系数高达0.983,这与腐胺在3种发酵剂干酪中总生物胺含量占比较高有关。
干酪生物胺是一定环境条件下,微生物氨基酸脱羧酶作用于游离氨基酸所形成。本试验发现在1~6个月成熟过程中,牦牛乳硬质干酪中各生物胺含量整体呈现增加态势,这与3种发酵剂牦牛乳硬质干酪中游离氨基酸含量增加相一致。乳杆菌属、乳球菌属、明串珠菌属、链球菌属的某些菌株具有产胺能力[25],但是本试验发现3种发酵剂牦牛乳硬质干酪中总生物胺含量远低于TAYLOR推荐的安全剂量1 000 mg/kg[26]。组胺和酪胺是2种毒性相对高的生物胺,不同发酵剂牦牛乳硬质干酪中酪胺含量高于组胺。但3种发酵剂牦牛乳硬质干酪中酪胺含量未超过学者建议安全剂量100~800 mg/kg[27]。生物胺的产生是乳酸菌对环境pH较低的一种应激反应,混合发酵剂牦牛乳硬质干酪在成熟后期(4~6个月)pH较高,且混合发酵剂干酪中游离氨基酸含量也较低。另外,刘瑛等[28]报道嗜热发酵剂和混合发酵剂牦牛乳硬质干酪中盐含量较高,这对乳中某些具有产生物胺的外来菌如假单胞菌、肠杆菌、微球菌具有抑制作用。因此,混合发酵剂牦牛乳硬质干酪中生物胺含量相对较低。其他学者也报道了采用混合发酵剂如乳酸杆菌和葡萄球菌能够抑制不同来源发酵食品中生物胺形成[29]。
除了3种发酵剂牦牛乳硬质干酪理化性质不同导致生物胺差异外,干酪所包含的复杂的微生物系统(包含发酵剂和非发酵剂)自身以及在干酪成熟过程中微生物生长繁殖代谢也发挥着重要作用。发酵剂通过产细菌素或者竞争性生长繁殖对一些低浓度革兰氏阴性菌产生不同抑制[30]。乳酸菌在干酪成熟过程由于其理化性质改变导致自溶程度不同,释放的肽酶也不同,而且由于氮代谢物阻遏效应的存在,微生物对各种氨基酸和亚氨基酸的同化效果也不同[31],从而使得干酪中作为生物胺底物的游离氨基酸含量存在差异。另外,不同微生物种类决定了其产胺属性,如GEZGINC等[21]发现嗜热链球菌属的某些菌株具有产组胺能力,PERIN等[23]发现某些乳酸乳球菌菌株含有酪氨酸脱羧酶基因,牛乳中污染菌革兰氏阴性菌易于产组胺、腐胺和尸胺。不同发酵剂牦牛乳硬质干酪理化特性和所包含的微生物决定了其生物胺差异,但是3种发酵剂牦牛乳硬质干酪中生物胺差异形成的具体原因还有待于进一步深入研究。
嗜热、嗜温发酵剂牦牛乳硬质干酪中检测出2-苯乙胺、腐胺、尸胺、组胺和酪胺,混合发酵剂干酪中检测出2-苯乙胺、腐胺、尸胺和酪胺。各生物胺之间呈现正相关性。在1~6个月成熟过程中,干酪中各生物胺整体呈现增加态势,嗜热、嗜温和混合发酵剂干酪中总生物胺最高含量分别为(448.3±9.6)、(456.8±58.4)和(293±24.5)mg/kg。嗜热发酵剂干酪中组胺和嗜温发酵剂干酪中酪胺最高,其最高含量分别为(20.8±7.9)、(92.9±6.7)mg/kg,混合发酵干酪中未检测出组胺,酪胺含量次之,这为合理选择发酵剂和控制干酪中生物胺形成提供了依据。
[1] PREMONT R T, GAINETDINOV R R, CARON M G.Following the trace of elusive amines[J].Proceedings of the National Academy of Sciences of the United States of America, 2001, 98(17):9 474-9 475.
[2] PACHLOV V, CHAROUSOV
V, CHAROUSOV Z,
Z, ![]() K T.Effect of milk origin on proteolysis and accumulation of biogenic amine during ripening of Dutch-type cheese[J].Potravinarstvo Slovak Journal of Food Sciences, 2017, 11(1):363-367.
K T.Effect of milk origin on proteolysis and accumulation of biogenic amine during ripening of Dutch-type cheese[J].Potravinarstvo Slovak Journal of Food Sciences, 2017, 11(1):363-367.
[3] BONCZAR G, FILIPCZAK-FIUTAK M, PLUTA-KUBICA A, et al.Biogenic amines present in cheese-occurrence & threats[J].Medycyna Weterynaryjna, 2017, 73(3):136-143.
[4] COMBARROS-FUERTES P, FERN NDEZ D, ARENAS R, et al.Biogenic amines in Zamorano cheese:Factors involved in their accumulation[J].Journal of the Science of Food & Agriculture, 2016, 96(1):295-305.
NDEZ D, ARENAS R, et al.Biogenic amines in Zamorano cheese:Factors involved in their accumulation[J].Journal of the Science of Food & Agriculture, 2016, 96(1):295-305.
[5] MARTUSCELLI M, GARDINI F, TORRIANI S, et al.Production of biogenic amines during the ripening of Pecorino Abruzzese cheese[J].International Dairy Journal, 2005, 15(6-9):571-578.
[6] NOLLET L M L.Handbook of Dairy Food Analysis[M].Boca Raton:Taylor & Francis, 2009.
[7] SHALABY A R.Significance of biogenic amines to food safety and human health[J].Food Research International, 1996, 29(7):675-690.
[8] RENES E, DIEZHANDINO I, FERN NDEZ D, et al.Effect of autochthonous starter cultures on the biogenic amine content of ewe′s milk cheese throughout ripening[J].Food Microbiology, 2014, 44:271-277.
NDEZ D, et al.Effect of autochthonous starter cultures on the biogenic amine content of ewe′s milk cheese throughout ripening[J].Food Microbiology, 2014, 44:271-277.
[9] KOMPRDA T, BURDYCHOV R, DOHNAL V, et al.Some factors influencing biogenic amines and polyamines content in Dutch-type semi-hard cheese[J].European Food Research and Technology, 2008, 227(1):29-36.
R, DOHNAL V, et al.Some factors influencing biogenic amines and polyamines content in Dutch-type semi-hard cheese[J].European Food Research and Technology, 2008, 227(1):29-36.
[10] MARCOBAL A, DE LAS RIVAS B, MORENO-ARRIBAS M V, et al.Evidence for horizontal gene transfer as origin of putrescine production in Oenococcus oeni RM83[J].Applied and Environmental Microbiology, 2006, 72(12):7 954-7 958.
[11] COTON M, ROMANO A, SPANO G, et al.Occurrence of biogenic amine-forming lactic acid bacteria in wine and cider[J].Food Microbiology, 2010, 27(8):1 078-1 085.
[12] PESSIONE E, MAZZOLI R, GIUFFRIDA M G, et al.A proteomic approach to studying biogenic amine producing lactic acid bacteria[J].Proteomics, 2005, 5(3):687-698.
[13] 刘瑛, 梁琪, 宋雪梅, 等.发酵剂对牦牛乳硬质干酪蛋白降解和苦味关系的影响[J].食品科学, 2015, 36(19):112-117.
LIU Y, LIANG Q, SONG X M, et al.Effect of starter culture on the relationship between proteolysis and bitter taste of hard cheese made from yak milk[J].Food Science, 2015, 36(19):112-117.
[14] 刘兴龙, 甘伯中, 李帆, 等.白牦牛乳硬质干酪加工工艺技术研究[J].食品科学, 2009, 30(14):94-98.
LIU X L, GAN B Z, LI F, et al.Processing technology of hard cheese from milk of white yak[J].Food Science, 2009, 30(14):94-98.
[15] JIN Y K, PARK Y W.Effects of aging time and temperature on proteolysis of commercial goat milk[J].Journal of Dairy Science, 1995, 78(12):2 598-2 608.
[16] FOLKERTSMA B, FOX P F.Use of the Cd-ninhydrin reagent to assess proteolysis in cheese during ripenings[J].Journal of Dairy Research, 1992, 59(2):217-224.
[17] INNOCENTE N, BIASUTTI M, PADOVESE M, et al.Determination of biogenic amines in cheese using HPLC technique and direct derivatization of acid extract[J].Food Chemistry, 2007, 101(3):1 285-1 289.
[18] MORET S, CONTE L S.High-performance liquid chromatographic evaluation of biogenic amines in foods an analysis of different methods of sample preparation in relation to food characteristics[J].Journal of Chromatography A, 1996, 729(1-2):363-369.
[19] FLASAROV R, PACHLOV
R, PACHLOV V,
V, ![]() L, et al.Biogenic amine production by Lactococcus lactis subsp.cremoris strains in the model system of Dutch-type cheese[J].Food Chemistry, 2016, 194(MAR.1):68-75.
L, et al.Biogenic amine production by Lactococcus lactis subsp.cremoris strains in the model system of Dutch-type cheese[J].Food Chemistry, 2016, 194(MAR.1):68-75.
[20] GUARCELLO R, DIVICCARO A, BARBERA M, et al.A survey of the main technology, biochemical and microbiological features influencing the concentration of biogenic amines of twenty Apulian and Sicilian (Southern Italy) cheeses[J].International Dairy Journal, 2015, 43:61-69.
[21] GEZGINC Y, AKYOL I, KULEY E, et al.Biogenic amines formation in Streptococcus thermophilus isolated from home-made natural yogurt[J].Food Chemistry, 2013, 138(1):655-662.
[22] TABANELLI G, TORRIANI S, ROSSI F, et al.Effect of chemico-physical parameters on the histidine decarboxylase (HdcA) enzymatic activity in Streptococcus thermophilus PRI60[J].Journal of Food Science,2012, 77(4):M231-M237.
[23] PERIN L M, MIRANDA R O, TODOROV S D, et al.Virulence, antibiotic resistance and biogenic amines of bacteriocinogenic Lactococci and Enterococci isolated from goat milk[J].International Journal of Food Microbiology, 2014, 185:121-126.
[24] PINTADO A I E, PINHO O, FERREIRA I M P L V O, et al.Microbiological, biochemical and biogenic amine profiles of Terrincho cheese manufactured in several dairy farms[J].International Dairy Journal, 2008, 18(6):631-640.
[25] LOIZZO M R, SPIZZIRRI U G, BONESI M, et al.Influence of packaging conditions on biogenic amines and fatty acids evolution during 15 months storage of a typical spreadable salami (‘Nduja)[J] Food Chemistry, 2016, 213:115-122.
[26] TAYLOR S L.Histamine poisoning associated with fish, cheese, and other foods[J].Archivos de Medicine Veteinaia,1985.DOI:10.4067/S0301-732X2015000200003.
[27] TENBRINK B T, DAMINK C T, JOOSTEN H M L J, et al.Occurrence and formation of biologically active amines in foods[J].International Journal of Food Microbiology, 1990, 11(1):73-84.
[28] 刘瑛, 梁琪, 张炎, 等.不同发酵剂对牦牛乳硬质干酪品质的影响[J].食品工业科技, 2015, 36(21):157-162.
LIU Y, LIANG Q, ZHANG Y, et al.Influences of different starter cultures on quality of yak milk hard cheese[J].Science and Technology of Food Industry, 2015, 36(21):157-162.
[29] LU S L, JI H, WANG Q L, et al.The effects of starter cultures and plant extracts on the biogenic amine accumulation in traditional Chinese smoked horsemeat sausages[J].Food Control, 2015, 50:869-875.
[30] SUN Q X, CHEN Q, LI F F, et al.Biogenic amine inhibition and quality protection of Harbin dry sausages by inoculation with Staphylococcus xylosus and Lactobacillus plantarum[J].Food Control, 2016, 68:358-366.
[31] RAI R, DAUGHERTY J R, TATE J J, et al.Synergistic operation of four Cis-acting elements mediate high level DAL5 transcription in Saccharomyces cerevisiae[J].FEMS Yeast Research, 2004, 5(1):29-41.