玉米淀粉对麦醇溶蛋白凝胶特性的影响
于嘉淇1,王启明1,李薇雨1,徐洪峰1,雷小娟1,2,赵吉春1,2,雷琳1,2,明建1,2*
1(西南大学 食品科学学院,重庆,400715)2(食品科学与工程国家级实验教学示范中心(西南大学),重庆,400715)
摘 要 将6%、9%、12%、15%、18%(质量分数)的玉米淀粉添加到麦醇溶蛋白溶液中形成复合物,复合物加热形成凝胶后,测定其化学作用力、保水率、白度、溶胀率、质构特性、流变特性等性质。结果表明,随着玉米淀粉添加量的增加,蛋白-淀粉复合凝胶中离子键、氢键、疏水相互作用和二硫键含量均呈先增加后减小趋势(P<0.05);凝胶保水率先增加后趋于平缓(P>0.05),最大为99.515%(玉米淀粉18%)。但凝胶的白度值和溶胀率减小(P>0.05),硬度增加(P>0.05);体系的储能模量和损耗模量呈现先增加后减小的趋势,当玉米淀粉添加量为15%时,储能模量和损耗模量达到最大。保水率、流变特性、扫描电镜分析等表明,适量的淀粉对麦醇溶蛋白凝胶网络有很好的填充效果。反复冻融使复合凝胶的保水率下降,白度增加,硬度增加。该研究为麦醇溶蛋白在面食加工和药物凝胶缓释方面提供理论基础。
关键词 麦醇溶蛋白;淀粉;相互作用;质构特性;凝胶特性
DOI:10.13995/j.cnki.11-1802/ts.027190
引用格式:于嘉淇,王启明,李薇雨,等.玉米淀粉对麦醇溶蛋白凝胶特性的影响[J].食品与发酵工业,2022,48(2):131-138.YU Jiaqi,WANG Qiming,LI Weiyu, et al.Effect of corn starch on gelatin properties of gliadin[J].Food and Fermentation Industries,2022,48(2):131-138.
第一作者:本科生(明建教授为通信作者,E-mail:mingjian1972@163.com)
基金项目:国家重点研发计划课题(2016YFD0400203)
收稿日期:2021-02-28,改回日期:2021-04-27
麦醇溶蛋白是一种天然植物性蛋白,富含疏水性氨基酸,不溶于水,由于较强的疏水性和自身良好的延展性能交联聚合,并与其他物质(如多糖、多酚)形成复合凝胶。复合凝胶因生物相容性好,无毒性,是一种优良缓释载体,但产物易被降解。增强凝胶的稳定性和提高凝胶功能特性,成为研究热点。
玉米含有大量的淀粉,主要成分是直链淀粉和支链淀粉。玉米淀粉颗粒大小适中,且价格便宜,加工过程中具有凝胶、糊化、流变等特性,能改善蛋白凝胶的流变学特性、保水性等,具备赋形剂和填充剂的功能[1-3]。杨明等[4]研究发现随着马铃薯淀粉的添加量由1%增加到4%时,鲤鱼肌原纤维蛋白凝胶硬度和弹性增加,白度下降,持水性上升。栗俊广等[5]研究发现木薯淀粉能填充猪肉盐溶蛋白网络,使凝胶体系的凝胶成型温度提高。此外,有研究发现反复冻融(如冷链流通过程中)对麦醇溶蛋白和玉米淀粉的性质有影响。潘治利等[6]发现麦醇溶蛋白经反复冻融处理后,维持蛋白二级结构的氢键被破坏,蛋白溶解性降低,表面疏水性增加。宁吉英等[7]研究发现玉米淀粉凝胶经反复冻融处理后,保水率下降,回生率与冰晶熔化焓增大。
本文将不同质量分数的淀粉添加到麦醇溶蛋白中加热制成凝胶,通过对复合凝胶持水性、质构特性、流变特性和微观结构等进行分析,阐述淀粉对麦醇溶蛋白凝胶特性的影响,为淀粉在面团制品中的应用和复合凝胶在新型生物相容高分子药物载体运用上提供理论基础。
1 材料与方法
1.1 材料与试剂
麦醇溶蛋白、玉米淀粉,美国Sigma公司;无水乙醇、溴化钾,成都科龙化工试剂公司;其他试剂均为分析纯。
1.2 仪器与设备
TGL-18MS高速冷冻离心机,上海卢湘仪仪器有限公司;MiLLi-Qbiocel超纯水机,美国密理博公司;LGJ-10真空冷冻干燥机,北京松原华兴科技有限公司;Spectrum100傅里叶红外光谱仪,美国Perkin-Elmer公司;85-2A数显恒温磁力搅拌器、85-2A pH计,金坛市科析仪器有限公司;HH-6数显恒温水浴锅,金坛市富华仪器有限公司;MCR302流变仪,奥地利安东帕公司;SYNERGYH1MG全波长酶标仪,美国基因公司;MX-S漩涡混合器,美国SCILOGEX公司;Phenom Pro扫描电子显微镜(scanning electron microscope,SEM),荷兰Phenom Pro公司。
1.3 实验方法
1.3.1 凝胶制备
将麦醇溶蛋白溶于乙酸缓冲液(0.1 mol/L CH3COOH,pH 4.0),蛋白质量浓度调整到60 mg/mL,磁力搅拌至充分溶解,加入麦醇溶蛋白溶液总量的6%、9%、12%、15%、18%(质量分数)的玉米淀粉(预实验表明6%以下的淀粉添加量,样品不能形成复合凝胶)。待混合均匀后,置于封有保鲜膜的烧杯中,在磁力搅拌水浴锅中,以2 ℃/min的速率加热,90 ℃ 保温30 min,取出后立即冷却并置于4 ℃冰箱过夜。在测量凝胶特性前,将凝胶样品在室温(25±1) ℃下平衡30 min。
1.3.2 化学作用力测定
参照G MEZ-GUILLÉN等[8]的方法,略作修改。准确称取1 g凝胶样品,分别加入9 mL的0.05 mol/L NaCl溶液、0.6 mol/L NaCl溶液、0.6 mol/L NaCl+1.5 mol/L尿素溶液、0.6 mol/L NaCl+8 mol/L尿素溶液、0.6 mol/L NaCl+8 mol/L尿素+1.5 mol/L β-巯基乙醇溶液,振荡均匀后,4 ℃冰箱静置2 h,离心(10 000×g,10 min),取上清液。考马斯亮蓝法测定上清液中溶解的蛋白质的含量,用A、B、C、D、E表示:离子键为A-B;氢键为B-C;氢键相互作用为C-D;二硫键为E-D。
MEZ-GUILLÉN等[8]的方法,略作修改。准确称取1 g凝胶样品,分别加入9 mL的0.05 mol/L NaCl溶液、0.6 mol/L NaCl溶液、0.6 mol/L NaCl+1.5 mol/L尿素溶液、0.6 mol/L NaCl+8 mol/L尿素溶液、0.6 mol/L NaCl+8 mol/L尿素+1.5 mol/L β-巯基乙醇溶液,振荡均匀后,4 ℃冰箱静置2 h,离心(10 000×g,10 min),取上清液。考马斯亮蓝法测定上清液中溶解的蛋白质的含量,用A、B、C、D、E表示:离子键为A-B;氢键为B-C;氢键相互作用为C-D;二硫键为E-D。
1.3.3 反复冻融处理
参考潘治利等[6]的方法,略作修改。将凝胶置于-18 ℃冰箱冻藏24 h取出,室温下解冻,反复冻融3次,每次待样品融化后,用滤纸擦去表面水分,立即测定复合凝胶保水性、白度、质构指标。
1.3.4 保水性测定
将凝胶样品置于离心管中并离心(8 000×g,20 min),弃离心液体并计算前后样品质量差。按公式(1)计算凝胶保水性:
保水性
(1)
式中:m为离心管质量,g;m1为离心前凝胶和离心管总质量,g;m2为离心后凝胶和离心管总质量,g。
1.3.5 白度测定
采用色度测定仪测定凝胶样品的色差。参考PARK[9]的方法,计算如公式(2)所示:
白度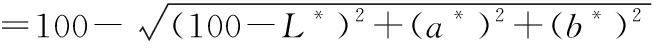
(2)
式中:L*为亮度值;a*为红度值;b*为黄度值。
1.3.6 凝胶质构测定
将样品切成直径30 mm,高20 mm的圆柱体,置于质构仪载物板上进行全质构分析。质构仪参数如下:探头型号:P/0.5,测试前速度:2.0 mm/s;测试速度:0.5 mm/s;测试后速度:2.0 mm/s;试样变型:50%;触发力:5 g;2次压缩中停顿 5 s,每个测试进行3个重复。得到凝胶的硬度、弹性和咀嚼性。
1.3.7 流变测定
对样品进行凝胶温度扫描,首先将样品用小刀切成2 mm高的圆柱体,置于直径为25 mm的平板夹具间,两平板间隔为0.106 mm。操作参数设置如下:从20 ℃开始以2 ℃/min的升温速率升温至90 ℃,频率为0.1 Hz,应变2%,测定指标为储能模量(G′)、损耗模量(G″)和tanδ值。
1.3.8 溶胀测定
参考王燕[10]的方法,略作修改。称取适量干燥凝胶加入乙酸缓冲液中,浸泡48 h。水中取出后,用滤纸擦去表面水分,称重。凝胶的平衡溶胀率计算如公式(3)所示:
溶胀率
(3)
式中:ms是溶胀平衡后水凝胶的质量,g;md为凝胶干重,g。
1.3.9 红外光谱分析
参考王启明[11]的方法,略作修改。称取干燥样品和干燥KBr在玛瑙研钵中研磨成粉,再压片成膜。操作参数设置为:扫描次数32次,分辨率4 cm-1,扫描范围400~4 000 cm-1。数据经基线校正、平滑、标准化处理后,使用Origin绘制一级结构图,Peakfit 4.12进行蛋白质酞胺I带(1 600~1 700 cm-1)二阶导数拟合,根据各子峰面积得到各个二级结构占的比例。
1.3.10 扫描电镜分析
取干燥样品在玛瑙研钵中研磨成粉,经过喷金处理在10 kV加速电压条件下,观察被测样品的微观结构差异,放大倍数为5 000倍。
2 结果与分析
2.1 玉米淀粉对麦醇溶蛋白凝胶化学作用力的影响
麦醇溶蛋白凝胶网络的形成是蛋白质间、蛋白质与溶剂之间作用力相互平衡的结果,离子键、氢键、疏水相互作用和二硫键等是形成和维持凝胶的主要作用力[12]。用不同试剂处理凝胶后,凝胶中作用力间的平衡被破坏。如图1所示,随着玉米淀粉量的增加,麦醇溶蛋白-淀粉复合凝胶中离子键、氢键、疏水相互作用和二硫键含量均呈显著先增加后减小趋势(P<0.05)。玉米淀粉添加量为9%和12%时,形成和维持凝胶的化学作用力较大,且凝胶稳定构象的化学作用力主要为疏水相互作用,这可能与麦醇溶蛋白中疏水氨基酸较多,蛋白分子头部缠绕和尾部聚集使疏水氨基酸暴露有关,与IWAMI等[13]研究一致。
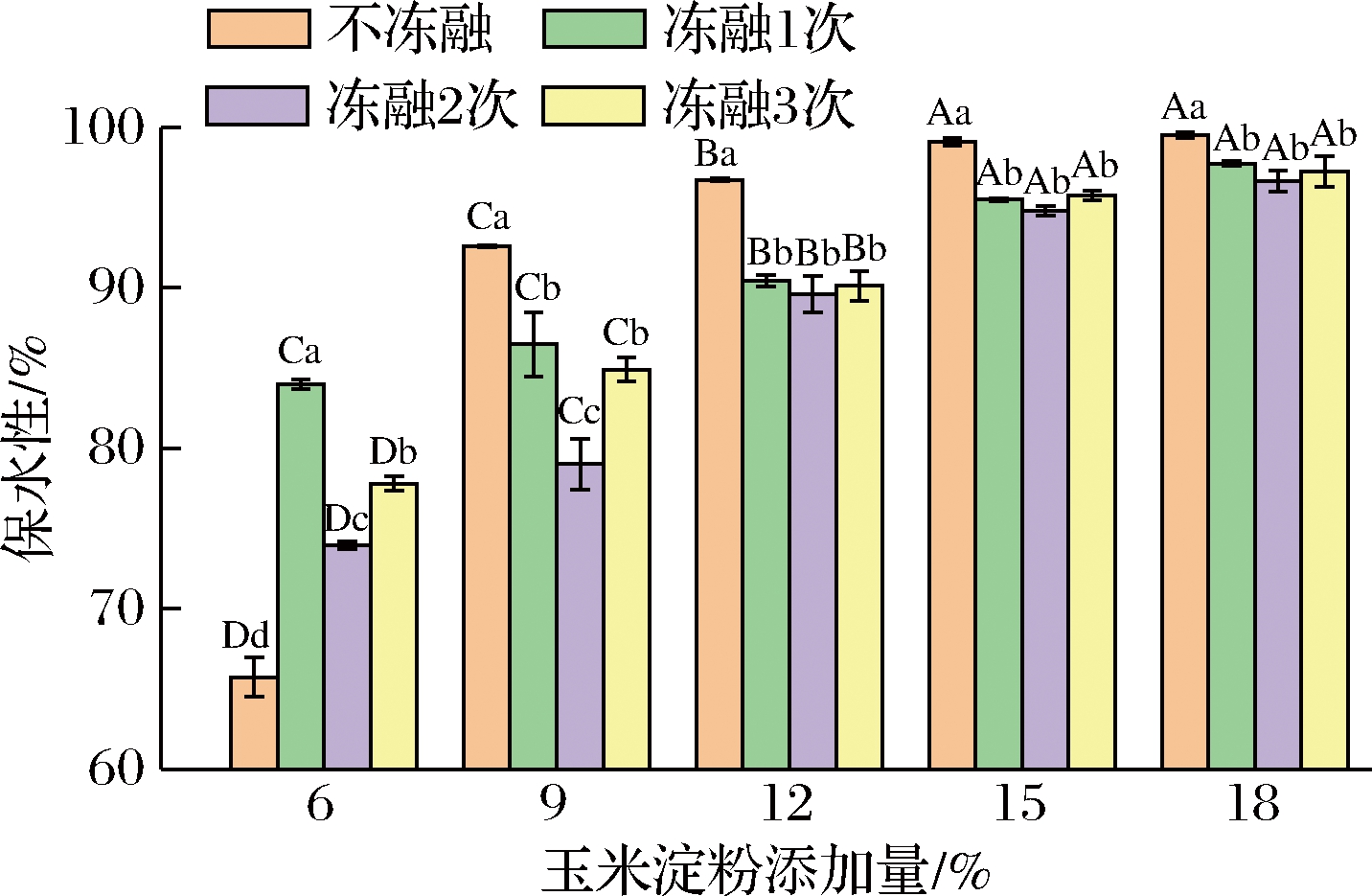
2.2 玉米淀粉对麦醇溶蛋白保水性的影响
保水性是评价凝胶品质的重要指标。如图2所示,复合凝胶保水性随着淀粉添加量的增大呈先增加后平缓的趋势(P>0.05)。玉米淀粉添加量达15%时,淀粉-蛋白复合物保水性趋于稳定;玉米淀粉添加量为18%时,保水性达到最大(99.515%)。结果表明,添加玉米淀粉可显著提高麦醇溶蛋白的保水性,但添加量超过15%对保水性无显著促进作用。主要原因是玉米淀粉达到糊化温度(75.3±0.3) ℃时,蛋白已经形成网络结构,玉米淀粉颗粒糊化吸收水分膨胀;淀粉添加量越大,吸收的水分越大,对蛋白网络结构的填充效应越好,使结构越来越紧密,增强了与水结合的能力,使保水性增加[14]。KONG等[15]指出相同条件下淀粉颗粒的溶胀程度远远高于在凝胶体系中,由此他假设“充填效应”:蛋白先形成凝胶网络,糊化的淀粉颗粒吸水膨胀支撑蛋白的网络体系。但是随着添加量的增大,可供玉米淀粉颗粒糊化吸收的水分减少,从而导致保水性的增加趋于平缓。
反复冻融的复合凝胶,随着玉米淀粉的添加,保水性增大,且呈一定的线性关系。原因可能是冻融处理使凝胶内部结构在冻藏和解冻因冰晶生长破坏,淀粉颗粒与水结合的能力变弱,形成的凝胶结构不紧密,水分易流失。添加量为18%时,凝胶结构紧密,抗破坏能力强。
随着反复冻融次数的增加,同一淀粉添加量的复合凝胶保水性总体出现下降-下降-上升的趋势。主要原因可能是不断冻融使得水分不断结晶与迁移,破坏了麦醇溶蛋白的网络结构,蛋白质-蛋白质相互作用小于蛋白质-水相互作用,蛋白网络展开,疏水性氨基酸暴露,结构稳定性变差,保水能力变弱。刘国琴等[16]发现冻藏时间的延长会使面筋蛋白表面的疏水性增加。冻融后保水性增强,原因可能是冻融过程使凝胶结构改变,伸展的蛋白质分子间相互作用形成了较为稳定的三维网络结构[6]。
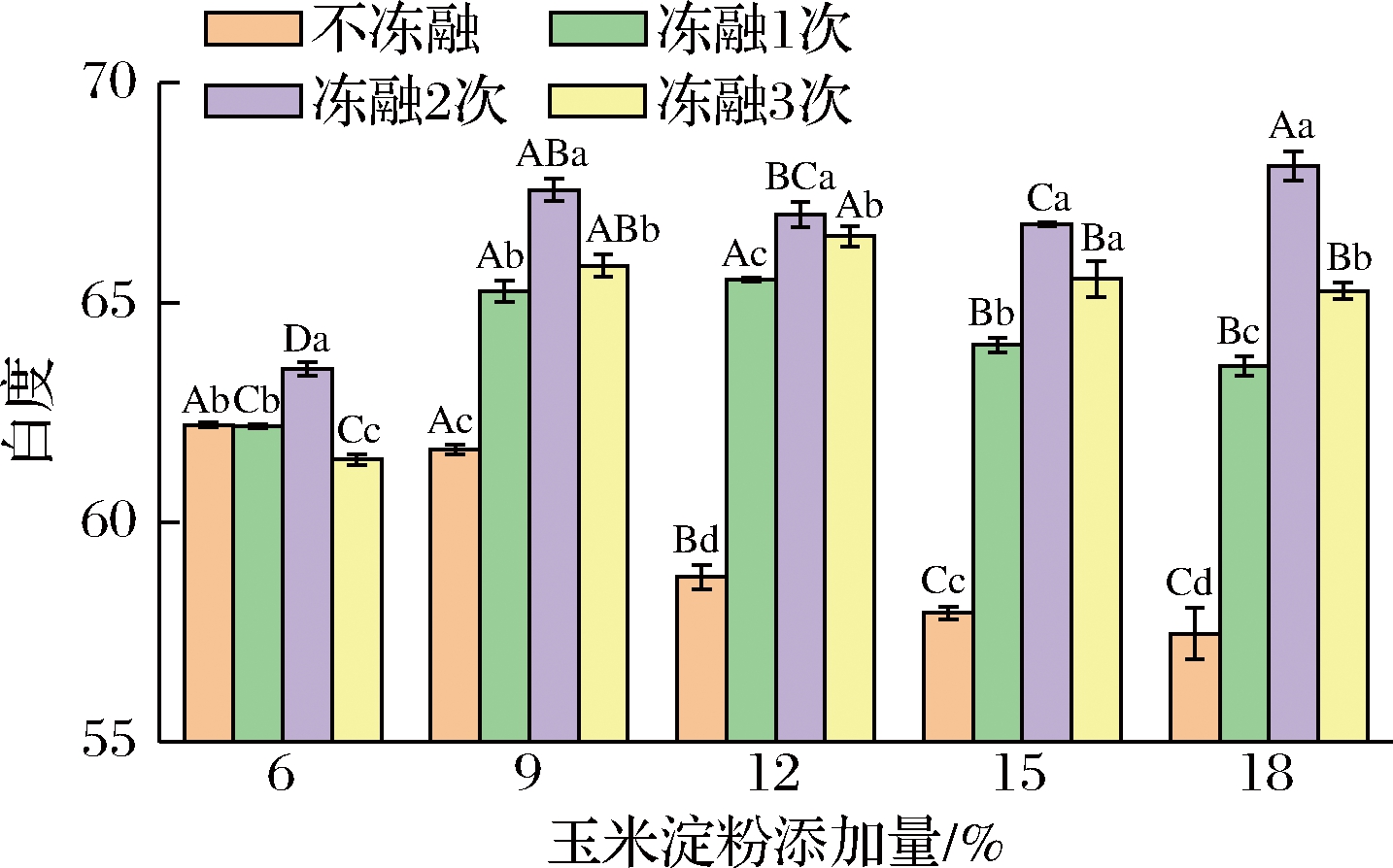
2.3 玉米淀粉对麦醇溶蛋白凝胶白度的影响
白度是表示物质表面白色的程度,反射率越高,白度越高。如图3所示,随着玉米淀粉添加量增加,复合凝胶白度值显著降低(P>0.05)。玉米淀粉添加量为12%、15%、18%的凝胶与6%的凝胶相比,白度值分别降低了3.47、4.28、4.75。杨明等[4]发现马铃薯淀粉的添加使淀粉-蛋白复合凝胶白度值降低(P>0.05)。这可能是淀粉颗粒糊化时吸水膨胀,减小了对光的反射率。此外,蛋白质变性交联作用形成的网络结构,由于不同淀粉量的“填充效应”造成结构的紧密度不同,对光反射也会有影响。因此淀粉糊化和蛋白网络结构共同造成白度降低。
如图3所示,冻融次数相同的复合凝胶,随着玉米淀粉的添加,白度呈现先增大后降低。原因可能是不同添加量形成的凝胶结构致密性不同,抗水分结晶和水分迁移的破坏能力不同[17]。
经反复冻融后,同一淀粉添加量的复合凝胶白度出现上升-上升-下降的趋势。冻融初期,蛋白网络破坏,麦醇溶蛋白中的氨基酸暴露在表面,使得光反射增大,因此白度上升。淀粉作为蛋白网络的内含物,促进蛋白网络结构破坏。反复冻融后期,伸展的蛋白质分子间相互作用又形成了较为稳定的三维网络结构,使得光反射减小,白度下降[7]。
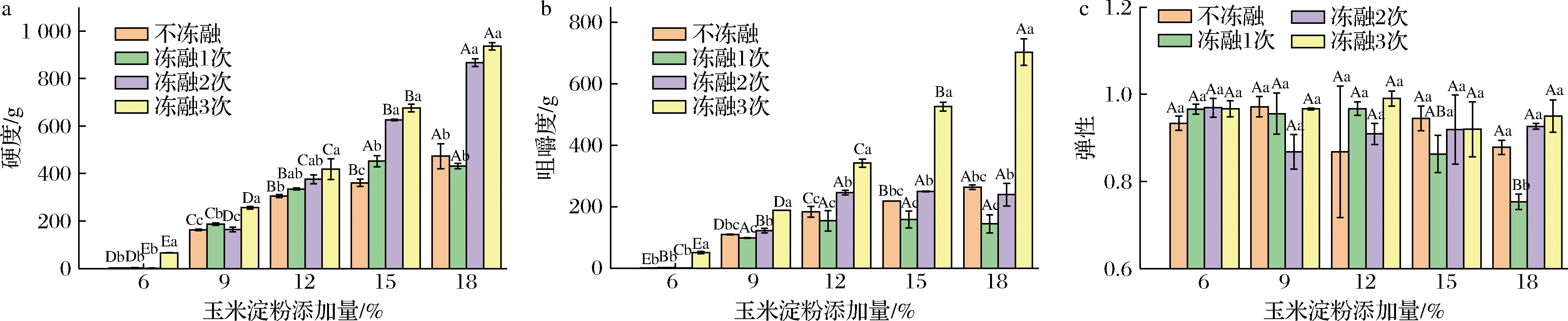
2.4 玉米淀粉对麦醇溶蛋白凝胶强度的影响
如图4所示,随着玉米淀粉添加量增加,复合凝胶硬度和咀嚼度显著增加(P>0.05),当添加量为18%时,硬度达到最大值473.2 g,但弹性没有显著影响。结果表明,玉米淀粉可增加复合凝胶硬度和咀嚼度,麦醇溶蛋白中的一些反应基团如—NH2、—OH和—SH与淀粉交联反应,起到很好的胶黏效果,使得淀粉-蛋白复合物在外界压力下不会轻易破裂[18]。有研究表明,淀粉粒在纯水中的吸水膨胀度比在凝胶复合物中大,推测淀粉颗粒受到凝胶网络的束缚,束缚与抗束缚使凝胶强度提升[19]。
冻融能显著提升凝胶的硬度和咀嚼度(P>0.05),冻融3次后的凝胶强度为:66.20、255.91、418.3、675.8、936.3 g,比没有冻融提高了35.12、1.57、1.37、1.87、1.97倍。与施帅等[20]的研究一致。
2.5 玉米淀粉对麦醇溶蛋白凝胶流变特性的影响
如图5-a所示,随着玉米淀粉添加量增加,体系的G′呈现先增加后减小趋势,当淀粉添加量为15%时,体系的G′最大。随着温度的升高,凝胶的G′增加,这与蛋白变性、淀粉糊化和淀粉与蛋白相互作用有关[21]。
通过测定试样G″能反映凝胶体的黏弹性变化,由图5-b可知,添加量为6%、9%的凝胶G″随温度升高持续增加,添加量为12%的凝胶G″先增加再趋于平稳,添加量为15%和18%的凝胶G″先稳步减小再增加。各凝胶G″分别于68、62、56、50和48 ℃时开始上升,表明玉米淀粉添加量的增加将麦醇溶蛋白的变性温度提前,这与ANDREA等[22]研究一致。蛋白变性时形成连续的、三维的蛋白网络结构,G″持续增加[18]。温度超过70 ℃时,淀粉的糊化,水分被淀粉颗粒吸收,造成G″不再增加。结果表明,添加适当淀粉可以提高G″,但添加量超过15%时,体系的G″减小,这与淀粉量过多造成可吸的水量变少有关[23]。
黏性流体的tanδ值大于1,凝胶的tanδ值小于1。如图5-c所示,tanδ始终小于1,并且在35~55 ℃呈上升趋势,从55 ℃后逐步开始下降,但添加量为6%、9%、18%时,在65 ℃之后持续上升并趋于平缓。淀粉添加量越大,tanδ变化温度越低,这说明添加淀粉的麦醇溶蛋白在55 ℃之前随着温度的升高蛋白结构膨胀使tanδ上升,在55~65 ℃蛋白质加速弹性网络的形成使tanδ下降,当温度超过65 ℃时,蛋白与淀粉作用,tanδ再次上升。
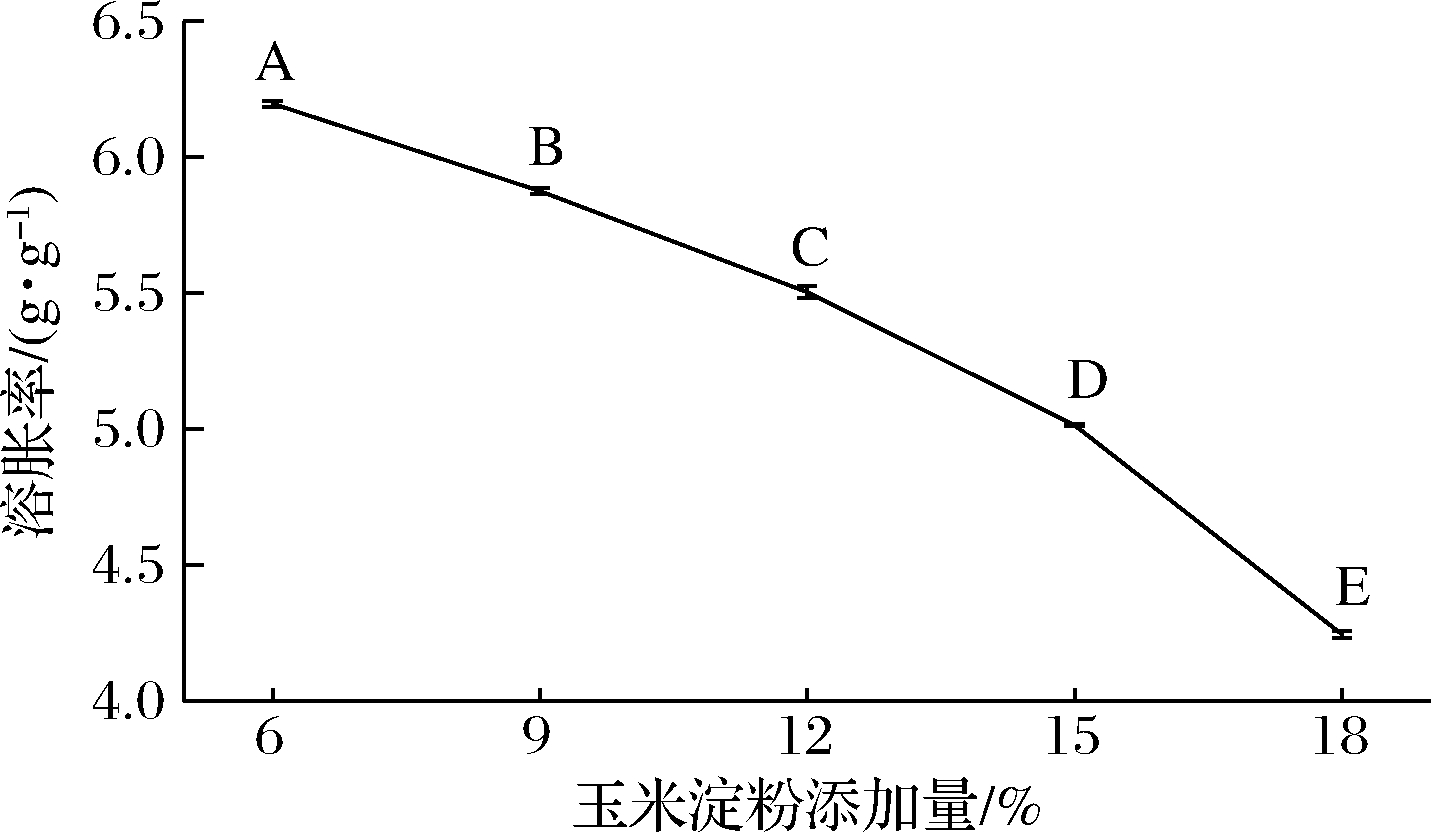
2.6 玉米淀粉对麦醇溶蛋白凝胶溶胀的影响
溶胀是高分子溶解时溶剂分子渗透进入高分子材料内部,使其体积增大。如图7所示,随着玉米淀粉添加,凝胶的溶胀率变小(P>0.05)。玉米淀粉添加量为18%时,溶胀率最小(4.24倍)。原因是淀粉添加量低的复合凝胶结构强度弱,结合得不紧密,溶剂分子更容易渗透到凝胶内部。王燕[10]制备的玉米醇溶蛋白基高分子复合凝胶,吸水溶胀作用较弱,利于药物的持续释放。因此,玉米淀粉添加量为18%的复合凝胶能够运用于药物缓释载体。
2.7 红外光谱分析
除了与―OH基团相对应的3 500~3 000 cm-1范围内的宽峰外,蛋白及其复合物在1 660 cm-1(酰胺I带,代表C O拉伸),1 540 cm-1(酰胺II带,代表C―N 伸缩与N―H弯曲)和1 110 cm-1(C―O基团的拉伸振动)附近显示出特征峰[24]。如图8所示,添加玉米淀粉诱导蛋白质构象变化。酰胺II带的峰位置显示从6%到18%的红移(蛋白的1 552 cm-1→1 558 cm-1),酰胺I带的峰位置显示从6%到18%的蓝移(蛋白的1 649 cm-1→1 648 cm-1),在1 110 cm-1处的峰位置显示从6%到18%的蓝移(蛋白的1 103 cm-1→1 099 cm-1),说明玉米淀粉的添加导致麦醇溶蛋白的C—N或N—H键、C
O拉伸),1 540 cm-1(酰胺II带,代表C―N 伸缩与N―H弯曲)和1 110 cm-1(C―O基团的拉伸振动)附近显示出特征峰[24]。如图8所示,添加玉米淀粉诱导蛋白质构象变化。酰胺II带的峰位置显示从6%到18%的红移(蛋白的1 552 cm-1→1 558 cm-1),酰胺I带的峰位置显示从6%到18%的蓝移(蛋白的1 649 cm-1→1 648 cm-1),在1 110 cm-1处的峰位置显示从6%到18%的蓝移(蛋白的1 103 cm-1→1 099 cm-1),说明玉米淀粉的添加导致麦醇溶蛋白的C—N或N—H键、C O键、C—O键发生了变化。蛋白的酰胺A带从3 410 cm-1(N—H拉伸)处移至3 433 cm-1,在2 960 cm-1(C―H拉伸振动与疏水相互作用)处的特征峰移到2 926 cm-1(添加量6%)、2 928 cm-1(添加量9%)、2 926 cm-1(添加量12%)、2 928 cm-1(添加量15%)、2 929 cm-1(添加量18%),这表明N—H键,C—H键和疏水相互作用参与了蛋白-淀粉复合物的形成。
O键、C—O键发生了变化。蛋白的酰胺A带从3 410 cm-1(N—H拉伸)处移至3 433 cm-1,在2 960 cm-1(C―H拉伸振动与疏水相互作用)处的特征峰移到2 926 cm-1(添加量6%)、2 928 cm-1(添加量9%)、2 926 cm-1(添加量12%)、2 928 cm-1(添加量15%)、2 929 cm-1(添加量18%),这表明N—H键,C—H键和疏水相互作用参与了蛋白-淀粉复合物的形成。
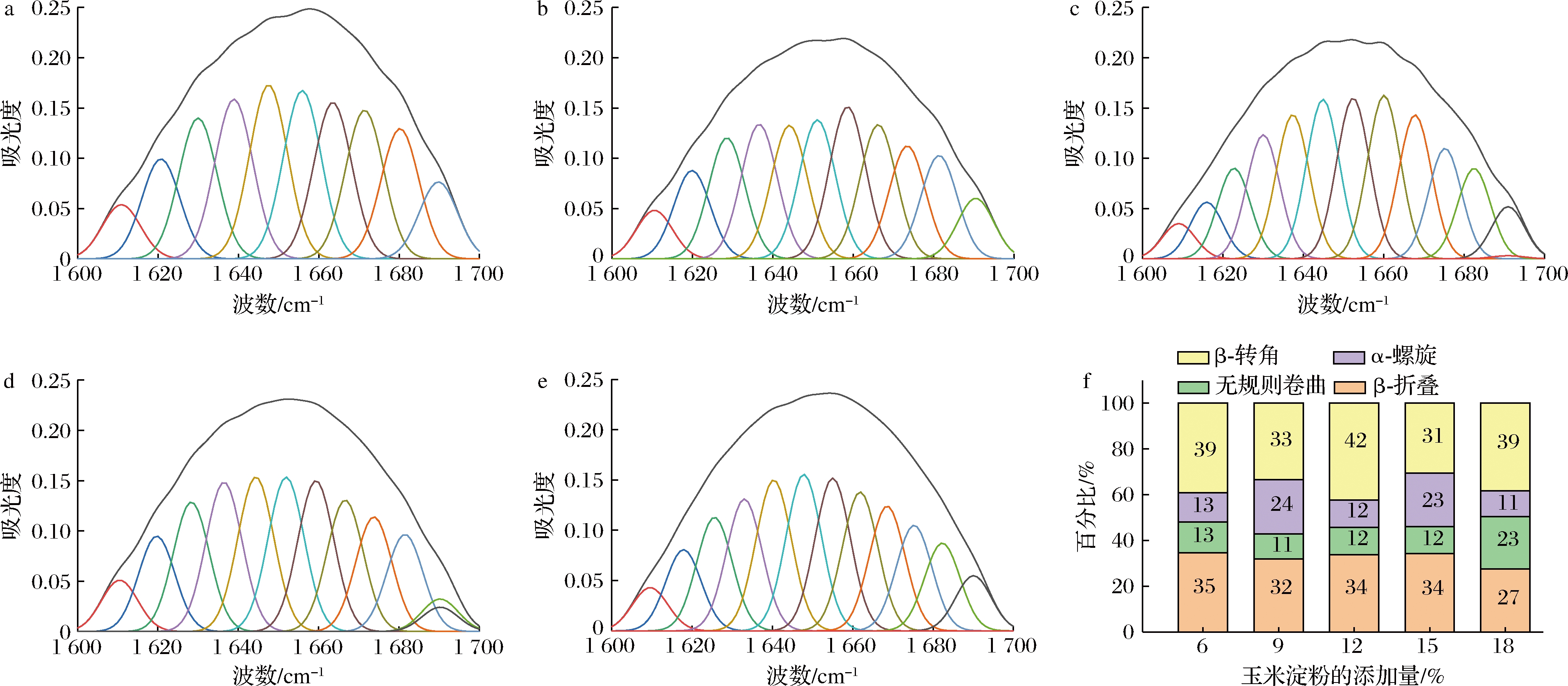
酰胺I带(1 600~1 700 cm-1)中蛋白质二级结构有β-折叠(1 600~1 639 cm-1),无规则卷曲(1 640~1 650 cm-1),α-螺旋(1 651~1 660 cm-1),β-转角(1 661~1 700 cm-1)[25]。如图9所示,随着玉米淀粉添加量增加,α-螺旋和β-转角含量上下波动,α-螺旋主要依靠C O和N―H之间形成的分子间氢键所维系,蛋白与淀粉相互作用会对氢键造成干扰,因而会对蛋白质的α-螺旋含量产生影响[26]。淀粉添加量为18%时,较高的无规则卷曲可能是由于淀粉的填充效应,蛋白形成更紧密的三维网络结构。
O和N―H之间形成的分子间氢键所维系,蛋白与淀粉相互作用会对氢键造成干扰,因而会对蛋白质的α-螺旋含量产生影响[26]。淀粉添加量为18%时,较高的无规则卷曲可能是由于淀粉的填充效应,蛋白形成更紧密的三维网络结构。
2.8 微观结构分析
经冷冻干燥后的麦醇溶蛋白样品会产生气孔和裂纹。如图10所示,添加6%淀粉的复合凝胶表面呈现致密多孔的蜂窝状结构,网络结构平整均匀,可能是玉米淀粉添加量少,散落在网络结构中,未得到很好的填充效果。添加9%和12%淀粉的复合凝胶,表面空隙变少,淀粉吸水膨胀,填补了蛋白之间的空隙。结构间存在斥力和支撑作用,促进蛋白与淀粉、蛋白与蛋白直接黏结,形成复杂的三维立体凝胶网络[5]。添加15%和18%淀粉的复合凝胶,表面观察不到较大孔洞,淀粉填补和埋藏蛋白网络结构,使其表面结构紧密有序。栗俊广等[5]发现添加木薯淀粉,使蛋白不均匀的三维立体网络结构更紧密。结果表明添加玉米淀粉改善了麦醇溶蛋白的凝胶网络结构。
3 结论
本文通过向麦醇溶蛋白溶液中添加玉米淀粉形成复合凝胶,发现蛋白先变性形成连续的三维网络结构,淀粉后糊化吸水作为对蛋白网络进行填充。反复冻融过程初期,水分不断结晶与迁移,破坏麦醇溶蛋白的网络结构,蛋白网络展开,疏水性氨基酸暴露,结构稳定性变差;后期伸展的蛋白质分子间相互作用又形成了较为稳定的三维网络结构。添加淀粉可以减小反复冻融保水率的损失和增大白度、硬度等凝胶特性。
玉米淀粉能提高麦醇溶蛋白凝胶特性,但支撑具有饱和性。添加18%的淀粉比15%的淀粉,凝胶保水性、白度、硬度、溶胀率变化不大,流变特性反而变差。因此,淀粉添加量在面团制品和凝胶药物载体运用应不超过20%。
参考文献
[1] 马先红, 张文露, 张铭鉴.玉米淀粉的研究现状[J].粮食与油脂, 2019, 32(2):4-6.
MA X H, ZHANG W L, ZHANG M J.Research status of corn starch[J].Cereals and Oils, 2019, 32(2):4-6.
[2] 马畅, 王小凤, 梁春艳, 等.不同淀粉对小麦面团流变学特性及馒头品质的影响[J].农业科技与装备, 2021, 1(1):45-48.
MA C, WANG X F, LIANG C Y, et al.Effects of different starches on rheological properties of wheat dough and quality of steamed bread[J].Agricultural Science and Technology and Equipment, 2021, 1(1):45-48.
[3] YU B, ZHENG L Y,CUI B, et al.The effects of acetylated distarch phosphate from tapioca starch on rheological properties and microstructure of acid-induced casein gel[J].International Journal of Biological Macromolecules, 2020, 159:1 132-1 139.
[4] 杨明, 孔保华, 董和亮, 等.马铃薯淀粉对鲤鱼肌原纤维蛋白功能特性的影响[J].食品工业科技, 2013, 34(14):169-172;186.
YANG M, KONG B H, DONG H L, et al.Effects of potato starches on the functional properties of common carp myofibrillar protein[J].Science and Techology of Food Industry, 2013, 34(14):169-172;186.
[5] 栗俊广, 蒋爱民, 白艳红, 等.木薯淀粉对猪肉盐溶蛋白凝胶特性的影响[J].现代食品科技, 2016, 32(11):123-127;55.
LI J G, JIANG A M, BAI Y H, et al.Effect of cassava starch on the gel properties of pork salt-soluble muscle proteins[J].Modern Food Science and Technology, 2016, 32(11):123-127;55.
[6] 潘治利, 邢仕敏, 张秀玲, 等.反复冻融对麦谷蛋白结构及其功能性质的影响[J].中国食品学报, 2015, 15(9):47-53.
PAN Z L, XING S M, ZHANG X L, et al.Effect of the freeze-thaw cycles on glutenin structure and functional properties[J].Journal of Chinese Institute of Food Science and Technology, 2015, 15(9):47-53.
[7] 宁吉英, 顾丰颖, 高萍萍, 等.蜡质玉米淀粉凝胶的冻融稳定性[J].中国农业科学, 2017, 50(8):1 514-1 524.
NING J Y, GU F Y, GAO P P, et al.Freeze-thaw stability of waxy corn starch gel[J].Journal of Chinese Institute of Food Science and Technology, 2017, 50(8):1 514-1 524.
[8] G MEZ-GUILLÉN M C, BOERER
MEZ-GUILLÉN M C, BOERER AS A J, MONTERO P.Chemical interactions of nonmuscle proteins in the network of sardine (Sardina pilchardus) muscle gels[J].LWT-Food Science and Technology, 1997, 30(6):602-608.
AS A J, MONTERO P.Chemical interactions of nonmuscle proteins in the network of sardine (Sardina pilchardus) muscle gels[J].LWT-Food Science and Technology, 1997, 30(6):602-608.
[9] PARK J W.Functional protein additives in surimi gels[J].Journal of Food Science, 1994, 59(3):525-527.
[10] 王燕. 玉米醇溶蛋白基复合凝胶的制备及其药物释放性能研究[D].兰州:西北师范大学, 2014.
WANG Y.Synthesis and release behavior of zein-based composite hydrogel[D].Lanzhou:Northwest Normal University, 2014.
[11] 王启明. 基于pH/氯化钠调控的麦醇溶蛋白-槲皮素复合物制备及其Pickering乳液特性研究[D].重庆:西南大学, 2020.
WANG Q M.Research on the fabrication of gliadin-quercetin complex and their characteristics of pickering emulsion based on pH/sodium chloride regulation[D].Chongqing:Southwest University, 2020.
[12] NI N, WANG Z, HE F, et al.Gel properties and molecular forces of lamb myofibrillar protein during heat induction at different pH values[J].Process Biochemistry, 2014, 49(4):631-636.
[13] IWAMI Y, OJIMA T, INOUE A, et al.Primary structure of myosin heavy chain from fast skeletal muscle of Chum salmon Oncorhynchus keta[J].Comparative Biochemistry and Physiology Part A:Molecular and Integrative Physiology, 2002, 133(2):257-267.
[14] 吴满刚, 熊幼翎, 陈洁.不同淀粉对肌纤维蛋白流变学性质和凝胶持水性的影响[J].食品工业科技, 2010, 31(10):92-94;97.
WU M G, XIONG Y L, CHEN J.Effects of starch characteristics on the rheologyand water holding capacity of myofibrillar protein gels[J].Science and Technology of Food Industry, 2010, 31(10):92-94;97.
[15] KONG C S, OGAWA H, ISO N.Compression properties of fish-meat gel as affected by gelatinization of added starch[J].Journal of Food Science, 1999, 64(2):283-286.
[16] 刘国琴, 柳小军, 李琳, 等.冻藏时间对小麦湿面筋蛋白结构和热性能的影响[J].河南工业大学学报(自然科学版), 2011, 32(5):1-5.
LIU G Q, LIU X J, LI L, et al.Effects of frozen storage time on structure and thermal properties of wet wheat gluten[J].Journal of Henan University of Technology (Natural Science Edition), 2011, 32(5):1-5.
[17] 夏秀芳, 孔保华, 郭园园, 等.反复冷冻-解冻对猪肉品质特性和微观结构的影响[J].中国农业科学, 2009, 42(3):982-988.
XIA X F, KONG B H, GUO Y Y, et al.Effect of freeze-thawing cycles on the quality properties and microstructure of pork muscle[J].Sciential Agricultura Sinica, 2009, 42(3):982-988.
[18] 王香玉. 馒头制作过程中蛋白交联行为及其对品质的影响[D].无锡:江南大学, 2016.
WANG X Y.Cross-linking of protein during production of Chinese steamed bread and its effect on quality thereof[D].Wuxi:Jiangnan University, 2016.
[19] 吴满刚, 熊幼翎, 陈洁.不同淀粉对肌纤维蛋白凝胶强度和微观结构的影响[J].食品工业科技, 2010,31(9):95-98.
WU M G, XIONG Y L, CHEN J.Effects of starch on the texture and microstructure of myofibrillar protein gels[J].Science and Technology of Food Industry, 2010, 31(9):95-98.
[20] 施帅, 李志方, 陈桃桃.反复冻融对泰州芋头淀粉品质特性的影响[J].食品工业科技, 2020, 41(13):9-13;21.
SHI S, LI Z F, CHEN T T.Effect of freezing and thawing treatment on the quality characteristics of taizhou taro starch[J].Science and Technology of Food Industry, 2020, 41(13):9-13;21.
[21] 吴香, 李新福, 李聪, 等.变性淀粉对肌原纤维蛋白凝胶特性的影响[J].食品科学, 2020, 41(2):22-28.
WU X, LI X F, LI C, et al.Effect of different modified starches on gel properties of myofibrillar protein[J].Food Science, 2020, 41(2):22-28.
[22] BERTOLINI A, CREAMER L K, EPPINK M, et al.Some rheological properties of sodium caseinate-starch gels[J].Journal of Agricultural and Food Chemistry, 2005, 53(6):2 248-2 254.
[23] VUDANG H V, LOISEL C, DESRYMAUX A, et al.Rheology and microstructure of cross-linked waxy maize starch/whey protein suspensions[J].Food Hydrocolloids, 2009, 23(7):1 678-1 686.
[24] LIU F G, MA C C, MCCLEMENTS D, et al.A comparative study of covalent and non-covalent interactions between zein and polyphenols in ethanol-water solution[J].Food Hydrocolloids, 2017, 63:625-634.
[25] 王丽颖. 多酚与麦醇溶蛋白复合物的形成机制及结构表征[D].重庆:西南大学, 2018.
WANG L Y.Fabrication mechanism and structure characterization of polyphenols and gliadin complexes[D].Chongqing:Southwest University, 2018.
[26] 唐瑜婉. 不同pH、CaCl2浓度下玉米醇溶蛋白-阿魏酸相互作用、结构表征及理化特性研究[D].重庆:西南大学, 2020.
TANG Y W.The interaction, structural characterization and physicochemical properties of zein-ferulic acid at different pH and CaCl2 concentrations[D].Chongqing:Southwest University, 2020.
Effect of corn starch on gelatin properties of gliadin
YU Jiaqi1,WANG Qiming1,LI Weiyu1,XU Hongfeng1,LEI Xiaojuan1,2,ZHAO Jichun1,2,LEI Lin1,2,MING Jian1,2*
1(College of Food Science, Southwest University, Chongqing 400715, China)2 (National Demonstration Center for Experimental Food Science and Technology Education (Southwest University), Chongqing 400715, China)
ABSTRACT The corn starch (6%, 9%, 12%, 15% and 18%) was added to gliadin solution to form a complex, and then the complex was heated to form a gel. The chemical forces, water holding capacity, whiteness, texture characteristics, rheological properties and swelling rate were determined. The results showed that, with the addition of corn starch, the ionic bond, hydrogen bond, hydrophobic interaction and disulfide bond content in the protein starch composite gel increased first and then decreased (P<0.05). The water holding capacity of the gel increased first and then levelled gently (P>0.05), and the maximum reached 99.515% (the corn starch was 18%). However, the whiteness and swelling rate of the gel decreased (P>0.05), and the hardness increased (P>0.05). The storage modulus and loss modulus increased first and then decreased. When the corn starch was 15%, the storage modulus and loss modulus reached the maximum. A suitable corn starch addition had a good filling effect on the gel network. Freezing-thawing cycles caused the decrease in water holding capacity, and the increase in the whiteness and hardness. This study provides a theoretical basis for gliadin in gel processing and drug gel release.
Key words gliadin;starch;interaction;texture characteristics;gel properties
 MEZ-GUILLÉN等[8]的方法,略作修改。准确称取1 g凝胶样品,分别加入9 mL的0.05 mol/L NaCl溶液、0.6 mol/L NaCl溶液、0.6 mol/L NaCl+1.5 mol/L尿素溶液、0.6 mol/L NaCl+8 mol/L尿素溶液、0.6 mol/L NaCl+8 mol/L尿素+1.5 mol/L β-巯基乙醇溶液,振荡均匀后,4 ℃冰箱静置2 h,离心(10 000×g,10 min),取上清液。考马斯亮蓝法测定上清液中溶解的蛋白质的含量,用A、B、C、D、E表示:离子键为A-B;氢键为B-C;氢键相互作用为C-D;二硫键为E-D。
MEZ-GUILLÉN等[8]的方法,略作修改。准确称取1 g凝胶样品,分别加入9 mL的0.05 mol/L NaCl溶液、0.6 mol/L NaCl溶液、0.6 mol/L NaCl+1.5 mol/L尿素溶液、0.6 mol/L NaCl+8 mol/L尿素溶液、0.6 mol/L NaCl+8 mol/L尿素+1.5 mol/L β-巯基乙醇溶液,振荡均匀后,4 ℃冰箱静置2 h,离心(10 000×g,10 min),取上清液。考马斯亮蓝法测定上清液中溶解的蛋白质的含量,用A、B、C、D、E表示:离子键为A-B;氢键为B-C;氢键相互作用为C-D;二硫键为E-D。




 MEZ-GUILLÉN M C, BOERER
MEZ-GUILLÉN M C, BOERER AS A J, MONTERO P.Chemical interactions of nonmuscle proteins in the network of sardine (
AS A J, MONTERO P.Chemical interactions of nonmuscle proteins in the network of sardine (