数字化时代改变着人们生活方式的同时,也让部分人群形成了不健康的饮食习惯,这无疑增加了消化道系统疾病患病风险。目前临床上常见的肠道疾病有便秘、炎症性肠病、坏死性小肠结肠炎、短肠综合征、大肠癌等[1]。其中便秘的患病率最高,大约30%的人在一生中会经历便秘,老年人和妇女受之影响更甚[2]。便秘会导致肠道内积累大量毒素,如3-甲基吲哚、吲哚等[3]。3-甲基吲哚俗称粪臭素(skatole, SK),它是由特定的细菌在肠道内发酵L-色氨酸形成,可经肝脏代谢后随粪便排出体外,广泛存在于废水和牲畜粪便中。如果3-甲基吲哚等肠道毒素长期在体内积蓄会影响肠道微生态环境,引起腐败菌和致病菌大量繁殖,它们分解食物、胆汁的过程又会产生3-甲基吲哚、吲哚、硫化氢和氨等肠道毒素,形成恶性循环,可能将导致机体发生病理变化[4]。
大量研究表明乳酸菌(lactic acid bacteria,LAB)除具有降低肿瘤发病率[5]、血清中的胆固醇含量[6]、抑制肠道致病菌[7]外,还可以降解食源性致癌物质如杂环胺、亚硝酸盐、多种霉菌毒素[8],降解肠道致癌代谢产物如吲哚、3-甲基吲哚、硫化氢、酚类、有机胺和氨等[9]。其降解机制是乳酸菌可产生分解有机物、内毒素、亚硝胺、脂肪酸的特殊酶系[10],嗜热链球菌是目前益生功能明确、应用范围最广的益生菌,常被用作乳制品发酵剂,因此本实验将它作为阳性对照菌株,评价来源于儿童肠道乳酸菌的益生功能。
目前所筛选的具有降解3-甲基吲哚的微生物非常有限,且主要来自于食品[10],而从人体肠道筛选乳酸菌用于降解3-甲基吲哚的研究很少。因此,本研究采集健康儿童肠道中的粪便,利用MRS培养基分离、纯化乳酸菌,通过过氧化氢酶实验和16S rRNA基因测序,确定其分类地位。在体外将乳酸菌培养于以3-甲基吲哚为唯一碳源、氮源的无机盐培养基中,通过测定3-甲基吲哚的残留量,筛选能够降解3-甲基吲哚的菌株。旨在从健康儿童肠道分离的乳酸菌中获得安全并具有益生作用的菌株,为今后降解肠道毒素、改善便秘提供更多的微生物资源。
乳酸菌:无菌采集8名3~8岁健康儿童粪便,并且这些儿童在3个月内未服用过抗生素,置于4 ℃冰箱冷藏备用,2 h内完成取样。
MRS液体培养基、革兰氏染色液、蛋白酶K、RNA酶,北京鼎国昌盛有限公司;PCR 程序所需的细菌通用引物、扩增试剂盒、细菌基因组DNA快速提取试剂盒,上海惠凌生物技术有限公司;PCR 产物检测所需的琼脂糖、DeRed 核酸染料等,北京泛博生物化学有限公司;溶菌酶,上海生工生物工程股份有限公司;3-甲基吲哚标准品,Aladdin工业公司;三氯甲烷(色谱纯),成都市科隆化学品有限公司;聚醚砜进口膜,天津市津腾实验设备有限公司。
电热恒温培养箱,上海博迅实业有限公司;PCR扩增仪、微量分光光度计、3001酶标仪,赛默飞世尔科技公司;电泳仪,北京市六一仪器厂;化学发光凝胶成像检测仪,Bio-Rad公司;HNY-2102C恒温振荡培养箱,天津欧诺仪器股份有限公司;Agilent 7890A-5977B气相色谱-质谱联用仪,安捷伦科技有限公司。
1.3.1 儿童肠道中乳酸菌的初步筛选
无菌取1 g新鲜儿童粪便悬于9 mL氯化钠溶液中,涡旋混匀,并用盐溶液连续10倍梯度稀释,涂布接种到MRS固体培养基中,37 ℃培养48~72 h,直至菌落生长。挑取表面光滑、凸圆、边缘完整、颜色呈乳白色的单个菌落反复分离纯化3次后,挑取疑似乳酸菌进行后续验证试验。并将疑似乳酸菌接种到斜面培养基中,于4 ℃冰箱贮存;一部分保存于25%甘油中,-80 ℃保藏。
1.3.2 菌株的细胞形态观察及分子生物学鉴定
对分离的疑似乳酸菌进行革兰氏染色,并在光学显微镜下观察细胞形态。再挑取固体培养基上单克隆菌落于洁净试管内,滴加3%过氧化氢溶液2 mL,观察结果。再根据分子生物学鉴定方法,按照细菌基因组DNA提取试剂盒的方法提取液体培养基中的菌株DNA。判定DNA提取纯度后,分别将8株菌的16S rRNA基因序列27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R (5′-GGTTACCTTGTTACGACTT-3′)进行扩增,引物由成都擎科梓熙生物技术有限公司合成。得到的PCR产物送成都擎科梓熙生物技术有限公司进行测序。最后将各菌的16S rRNA基因测序结果在GenBank中获取登录号,并与GenBank上所提交的细菌序列进行比对,通过Blast功能筛选出同源性较高的菌,使用MEGA 7.0进行系统发育分析,以自展数 (bootstrap)为1 000,邻接法构建系统发育树,确定所筛选菌株种属。
1.3.3 体外筛选具有降解3-甲基吲哚的乳酸菌
将0.03 g 3-甲基吲哚加入到300 mL无机盐培养基中,使其质量浓度为100 mg/L,高压灭菌后,将活化后的菌体以5%接种量接入无机盐培养基中,37 ℃恒温振荡避光培养。每个菌做3个重复。每隔12 h取样,使用酶标仪测定3-甲基吲哚降解菌的吸光度值(600 nm),了解菌株生长情况;使用GC-MS联用色谱仪测定3-甲基吲哚残留量,了解菌株对3-甲基吲哚的降解能力。并以嗜热链球菌(Streptococcus thermophiles)为阳性对照菌。
3-甲基吲哚降解率![]()
(1)
式中:A为3-甲基吲哚初始量,%;B为3-甲基吲哚残留量,%。
1.3.3.1 GC-MS联用条件
色谱条件:色谱柱:HP-5MS (30 m×0.25 μm,0.25 μm);载气:氦气(99.999%);流速:1.0 mL/min;进样口温度:250 ℃;进样量:1 μL;进样方式:分流进样;分流比:50∶1;程序升温:初始温度130 ℃,保持1 min,以30 ℃/min的速度升温到265 ℃,再以5 ℃/min的速度升温到300 ℃,保持1 min,最后以30 ℃/min的速度升温到265 ℃,再以20 ℃/min的速度升温到360 ℃,保持10 min。
质谱条件:接口温度280 ℃,离子源温度230 ℃,四级杆150 ℃,电子轰击能量70 eV;溶剂延迟2.5 min;扫描方式:全扫描模式,扫描范围为20~550[11]。质谱库:NIST2011。
1.3.3.2 3-甲基吲哚标准曲线的制定
称取0.01 g 3-甲基吲哚标准品置于50 mL容量瓶中,用三氯甲烷配制成200 mg/L的标准贮备液。测样品时移取贮备液置于加盖EP管中,用三氯甲烷稀释1倍配成100 mg/L的标准质量浓度,再吸取标准质量浓度100 mg/L的液体1.0、0.8、0.5、0.3、0.15 mL,用三氯甲烷配成质量浓度为100、80、50、30、15 mg/L的混合标准系列工作溶液。经0.45 μm滤膜过滤后上GC-MS联用仪检测。以保留时间定性,峰面积外标法定量,绘制标准曲线。以定性离子[质荷比(m/z),130]的峰面积为纵坐标,其浓度为横坐标,求出标准曲线方程,以此计算被测样品中3-甲基吲哚的残留量。
1.3.3.3 萃取
取2 mL培养的无机盐培养基,加入2 mL三氯甲烷,涡旋振荡混匀后,用超声波超声,再静置60 min,用一次性针管收集下层三氯甲烷萃取液。经0.45 μm滤膜过滤后加入进样瓶中,GC-MS联用仪测定无机盐培养基中3-甲基吲哚的残留量。
采用SPSS 22.0统计软件对各实验数据进行方差分析和显著性检验。每组实验数据以平均数±标准差(x±σ)表示,多组间比较采用单因素方差分析法,P<0.05为显著性差异,P>0.05为差异不显著。
通过平板涂布法和革兰氏染色、过氧化氢酶试验,对从儿童肠道中分离得到的菌株进行筛选,共计8株疑似乳酸菌,用LAB1、LAB2、LAB3、LAB4、LAB5、LAB6、LAB7和LAB8命名,革兰氏染色为紫色,为革兰氏阳性菌(图1)。镜检结果发现除LAB1为短杆状的规则杆菌外,其余7株菌均为球菌,因此可以初步鉴定LAB1为乳杆菌。8株菌的过氧化氢酶实验结果均为阴性,且溶钙圈为阳性,说明它们对过氧化氢具有耐受能力,具备一定的产酸能力,满足乳酸菌过氧化氢酶的特征。
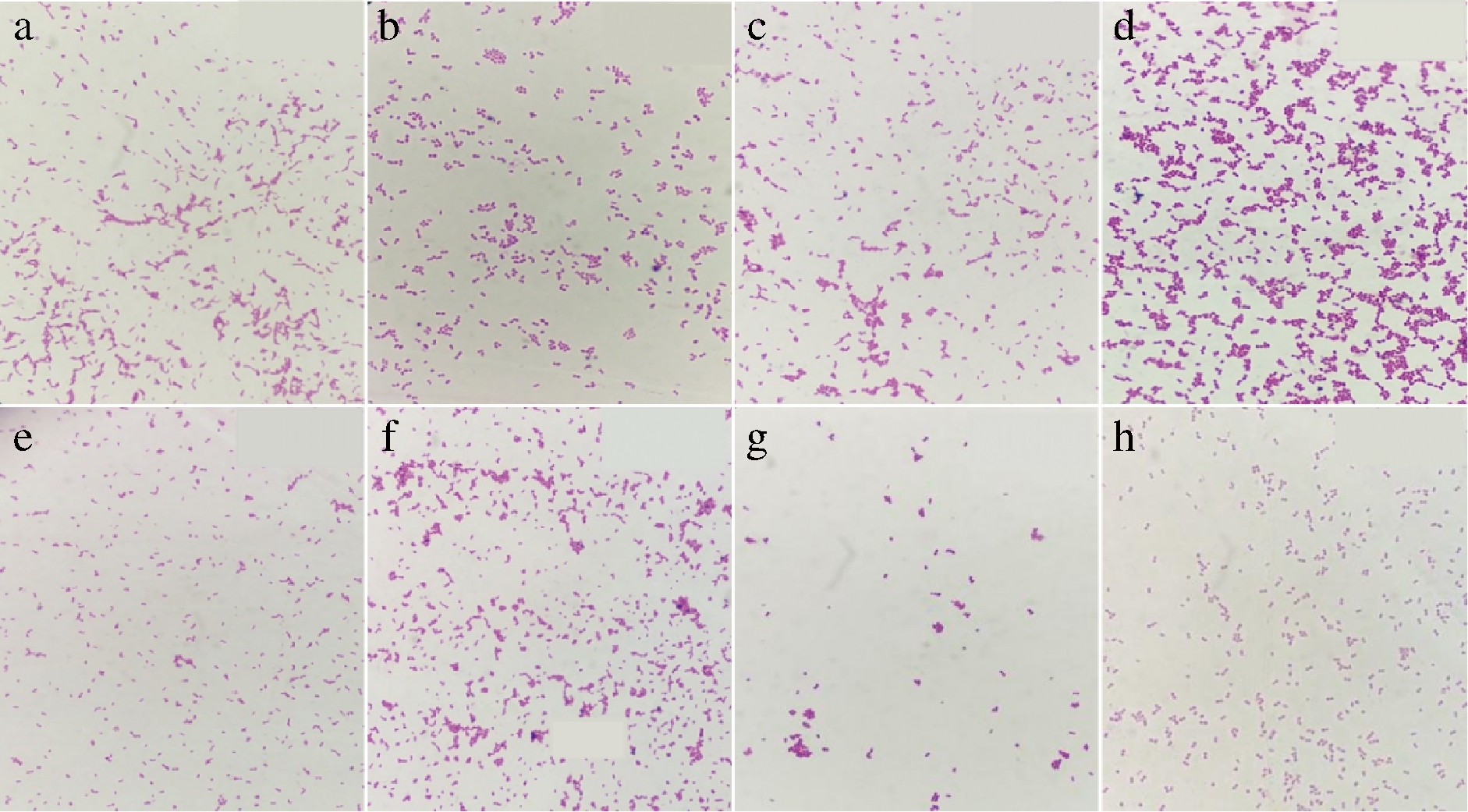
a-LAB1;b-LAB2;c-LAB3;d-LAB4;e-LAB5;f-LAB6;
g-LAB7;h-LAB8
图1 菌株镜检图(×1 000)
Fig.1 Microscopic image of the strains (×1 000)
通过CTAB法提取供试菌株的总基因组DNA,8株菌的DNA范围为51~141.1 g/mL,且8株菌的A260/A280值均在1.7~1.9,表明这8株菌DNA纯度较高,提取效果较好。如图2所示,8株菌扩增片段约为1 500 bp左右,符合预期大小。
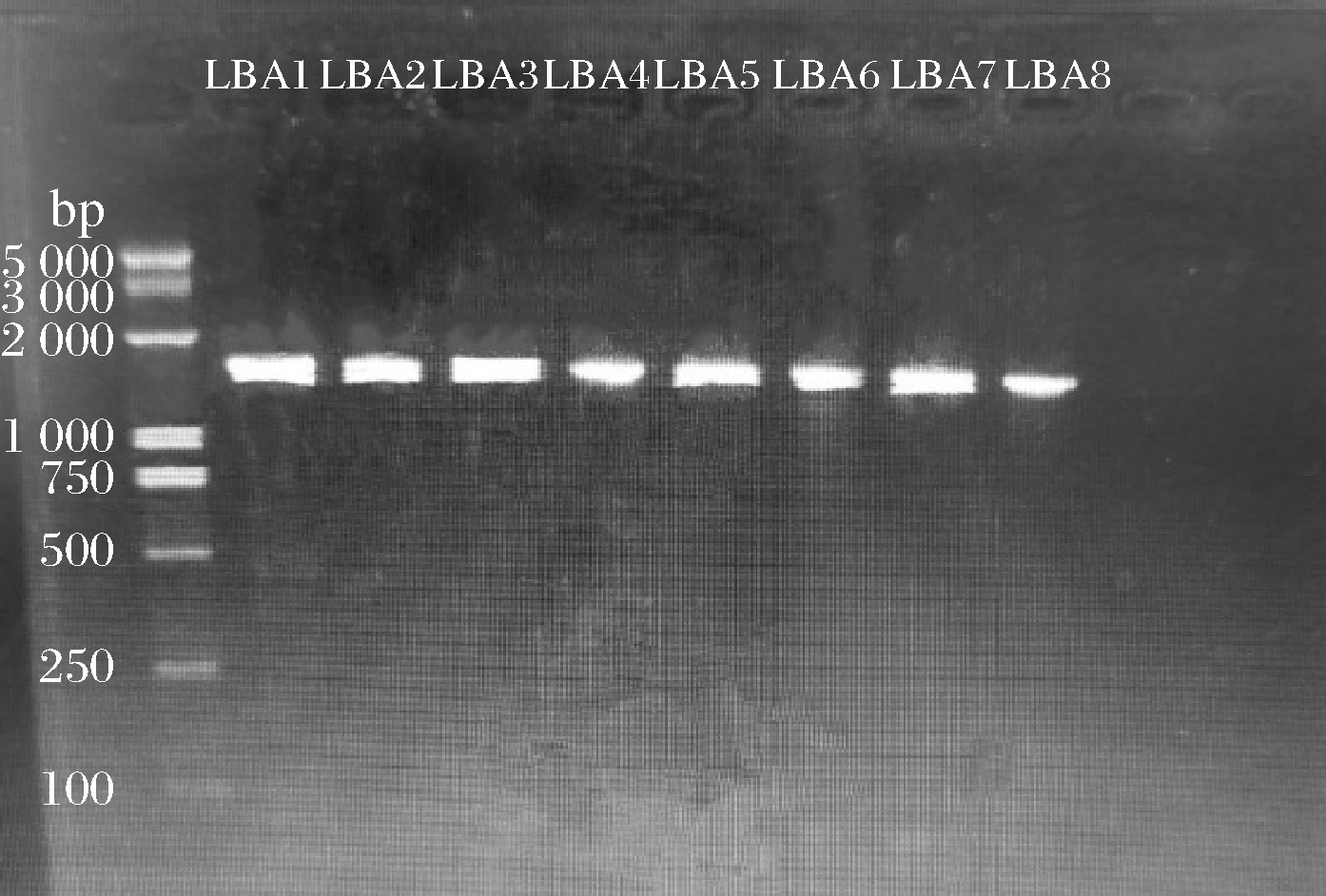
图2 菌株LAB1~LAB8 PCR扩增电泳图
Fig.2 LAB1-LAB8 strains PCR amplification electrophoresis
将获得的8株菌的16S rRNA序列向GenBank申请,并获得登录号,登录号为MN867654~MN867661,与GenBank相近的序列比对结果如表1所示。将16S rRNA测序结果与GenBank中BLAST比对,构建系统发育树(图3)。由图3可知,LAB1 (MN867660)与干酪乳杆菌属(Lactobacillus casei)的相似性达99%以上,隶属于干酪乳杆菌属。LAB2 (MN867661)与类肠膜魏斯氏菌属(Weissella paramesenteroides)的相似性达99%以上,隶属于类肠膜魏斯氏菌属。菌株LAB3(MN867654)、LAB5 (MN867659)、LAB6(MN867655)、LAB7(MN867656)和LAB8(MN867657)与肠膜明串珠菌属(Leuconostoc mesenteroides)的相似性均为100%,隶属于肠膜明串珠菌属。LAB4(MN867658)与格氏乳球菌属(Lactococcus garvieae)的相似性达100%,隶属于格氏乳球菌属。
表1 八株菌菌株16S rRNA基因序列Blast比对结果
Table 1 Eight lactic acid bacteria strains 16S rRNA
gene sequence alignment results blast
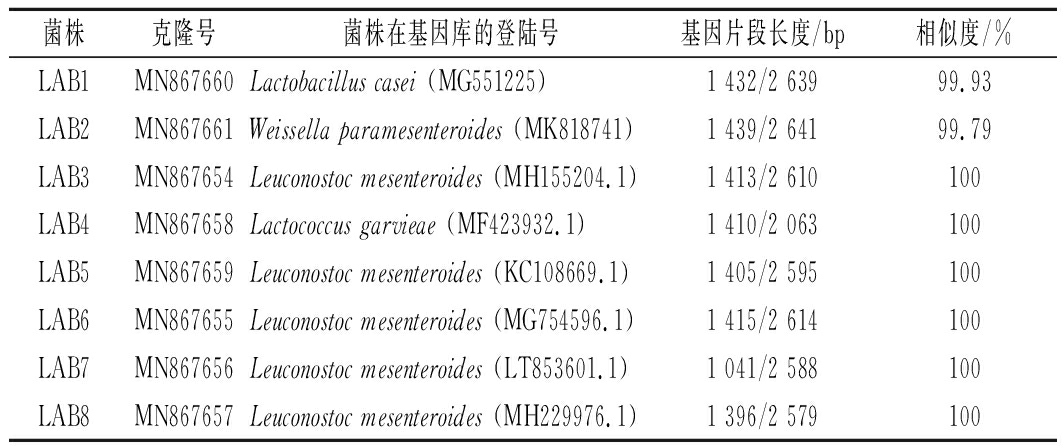
菌株克隆号菌株在基因库的登陆号基因片段长度/bp相似度/%LAB1MN867660Lactobacillus casei (MG551225)1 432/2 63999.93LAB2MN867661Weissella paramesenteroides (MK818741)1 439/2 64199.79LAB3MN867654Leuconostoc mesenteroides (MH155204.1)1 413/2 610100LAB4MN867658Lactococcus garvieae (MF423932.1)1 410/2 063100LAB5MN867659Leuconostoc mesenteroides (KC108669.1)1 405/2 595100LAB6MN867655Leuconostoc mesenteroides (MG754596.1)1 415/2 614100LAB7MN867656Leuconostoc mesenteroides (LT853601.1)1 041/2 588100LAB8MN867657Leuconostoc mesenteroides (MH229976.1)1 396/2 579100
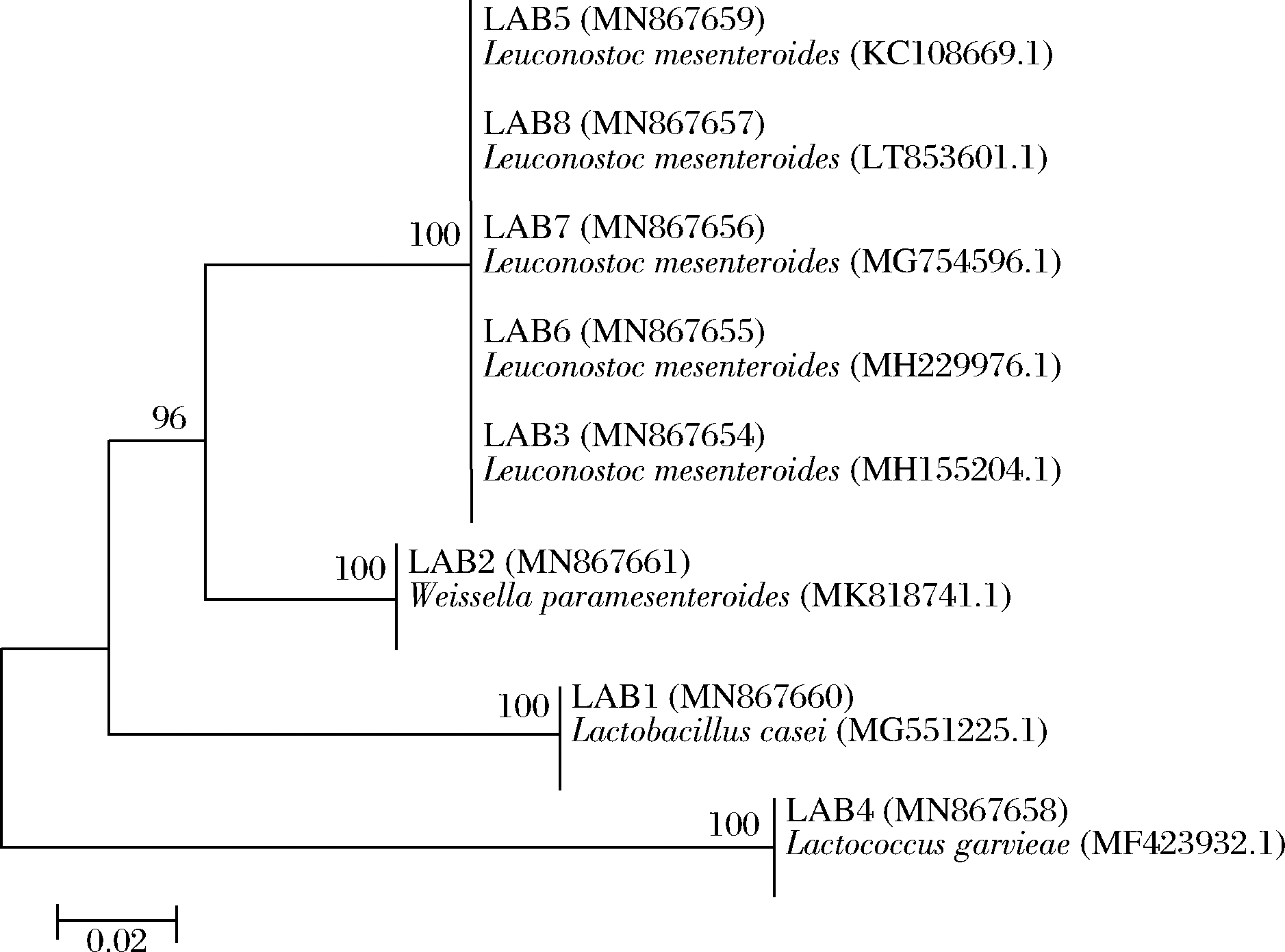
图3 菌株LAB1~LAB8基于16S rRNA基因
序列构建的系统发育树
Fig.3 The phylogenetic tree of strain LAB1-LAB8
based on 16S rRNA gene sequence
采用保留时间对照法比较标准样品和待测样品色谱图中的相对保留时间。标准样品3-甲基吲哚的保留时间即出峰时间约为14.012 min。采用全扫描方式,在20~550 u进行定性,3-甲基吲哚的定性离子m/z为130.0、103.0、77.0。
制定3-甲基吲哚的标准曲线,以峰面积为纵坐标,其浓度为横坐标,求出标准曲线方程,曲线方程为y=89 363x-877 234 (y是峰面积,x是浓度),R2=0.998 4。采用空白标样加入法测定方法回收率,将3-甲基吲哚标准品测定量与标准品加入量的比值作为回收率,结果如表2所示,3-甲基吲哚的回收率为90%~111%。
表2 3-甲基吲哚测定方法的回收率
Table 2 Recovery rate of testing method of 3-methylindole
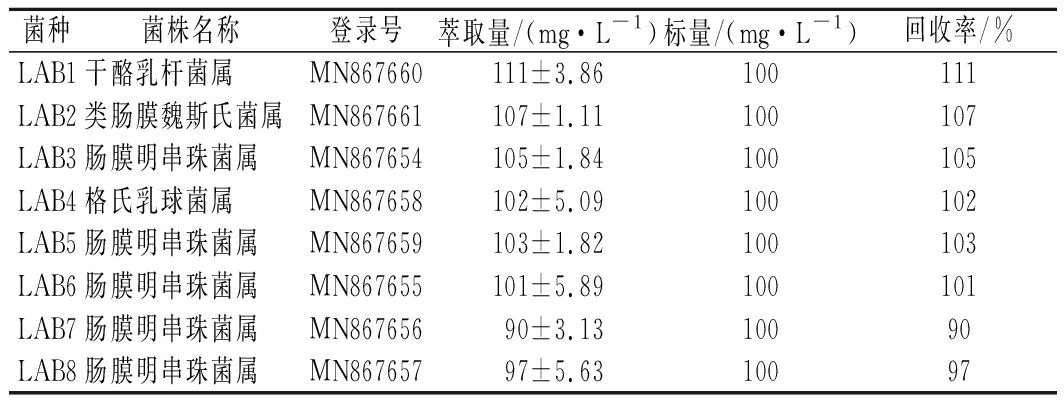
菌种菌株名称登录号萃取量/(mg·L-1)标量/(mg·L-1)回收率/%LAB1干酪乳杆菌属MN867660111±3.86100111LAB2类肠膜魏斯氏菌属MN867661107±1.11100107LAB3肠膜明串珠菌属MN867654105±1.84100105LAB4格氏乳球菌属MN867658102±5.09100102LAB5肠膜明串珠菌属MN867659103±1.82100103LAB6肠膜明串珠菌属MN867655101±5.89100101LAB7肠膜明串珠菌属MN86765690±3.1310090LAB8肠膜明串珠菌属MN86765797±5.6310097
以嗜热链球菌作为阳性对照菌,观察乳酸菌对3-甲基吲哚的降解能力。菌株的生长曲线及降解曲线如图4所示。乳酸菌在培养初期生长十分缓慢,LAB1、LAB2、LAB4、LAB6、LAB7和嗜热链球菌的迟缓期为24 h,LAB3和LAB8的迟缓期为36 h,LAB5的迟缓期为48 h。菌株LAB1 和LAB4在培养48 h后进入稳定期,菌株LAB2 和LAB5在72 h后进入稳定期,菌株LAB3 和LAB8在60 h后进入稳定期,菌株LAB6、LAB7和嗜热链球菌在36 h后进入稳定期。

a-LAB1;b-LAB2;c-LAB3;d-LAB4;e-LAB5;f-LAB6;g-LAB7;h-LAB8
图4 八株菌生长曲线和3-甲基吲哚降解曲线
Fig.4 Growth curve and 3-methylindole degradation curve of 8 strains
乳酸菌在培养初期,对3-甲基吲哚的降解率低,菌株适应环境后,随着培养时间的延长,乳酸菌利用3-甲基吲哚生长繁殖,对3-甲基吲哚的降解率也逐步升高。在为期168 h的培养时间内,8株菌对3-甲基吲哚的降解情况详细见表3。在菌株生长平稳后,LAB1~LAB8和嗜热链球菌对3-甲基吲哚的降解率分别为1.56%、18.18%、4.31%、14.67%、14.77%、17.60%、1.53%、6.65%、9.08%。当培养时间为168 h时,8株菌株降解率分别为62.21%、60.45%、52.50%、62.19%、61.91%、61.94%、55.34%、58.73%,LAB1(干酪乳杆菌,Lactobacillus casei)对3-甲基吲哚的降解率最高,且高于阳性对照菌嗜热链球菌(59.44%)。
表3 不同乳酸菌对3-甲基吲哚的降解率
Table 3 Degradation rate of 3-methylindole by
different lactic acid bacteria
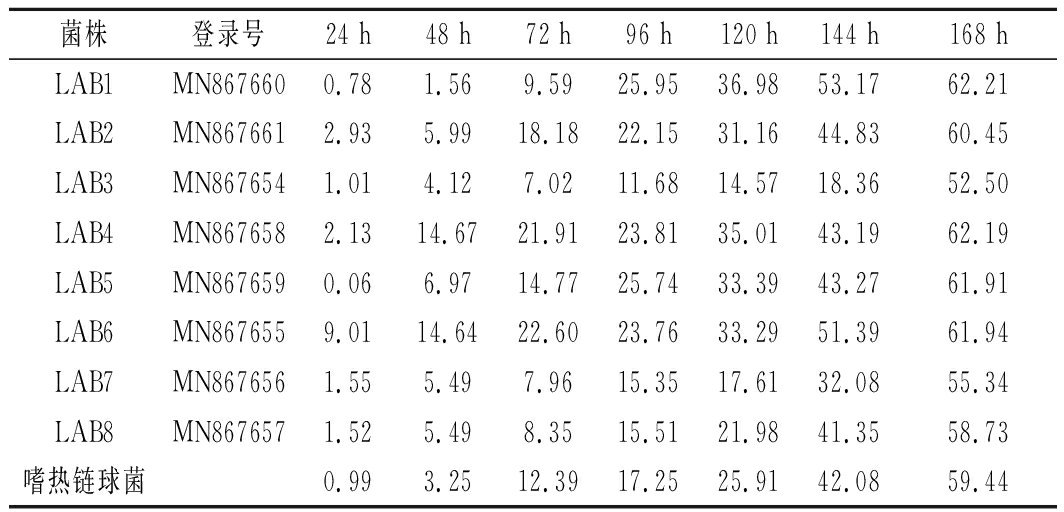
菌株登录号24 h48 h72 h96 h120 h144 h168 hLAB1MN8676600.781.569.5925.9536.9853.1762.21LAB2MN8676612.935.9918.1822.1531.1644.8360.45LAB3MN8676541.014.127.0211.6814.5718.3652.50LAB4MN8676582.1314.6721.9123.8135.0143.1962.19LAB5MN8676590.066.9714.7725.7433.3943.2761.91LAB6MN8676559.0114.6422.6023.7633.2951.3961.94LAB7MN8676561.555.497.9615.3517.6132.0855.34LAB8MN8676571.525.498.3515.5121.9841.3558.73嗜热链球菌0.993.2512.3917.2525.9142.0859.44
乳酸菌来源十分广泛,本实验从健康儿童肠道中筛选得到8株菌,归属为干酪乳杆菌属、类肠膜魏斯氏菌属、肠膜明串珠菌属、格氏乳球菌属。8株乳酸菌在整个培养周期,对3-甲基吲哚的降解趋势呈现相似的规律。菌体群体生长的迟缓期,开始适应新的培养环境,微生物的数量没有增加,3-甲基吲哚含量变化也不大;随着培养时间的延长,菌体快速生长,进入对数生长期,乳酸菌对3-甲基吲哚的降解速率逐渐增加;随后菌株生长到达稳定期,菌体数量达到最大,降解速率也开始快速升高。分析结果可知8乳酸菌在进入快速生长期过度到生长稳定期,3-甲基吲哚的降解率也随之增加,分析原因可能是菌体在适应3-甲基吲哚胁迫培养后,因自身生长利用了培养基中唯一的有机物3-甲基吲哚,使培养基中3-甲基吲哚的含量逐渐降低。
由于3-甲基吲哚具有生物毒性且很难去除,目前所筛选的具有降解3-甲基吲哚的微生物非常有限[11-12]。有研究报道伯克霍尔德菌IDO3在pH值4.0~9.0、转速0~250 r/min、温度30~35 ℃的条件下,有降解3-甲基吲哚的能力[12]。沼泽红假单胞菌 WKU-KDNS3在72 h内对浓度为1 mmol/L 的3-甲基吲哚去除率为48%[13]。铜绿假单胞菌Gs培养36 h时可完全去除浓度为0.5 mmol/L的3-甲基吲哚[14],不动杆菌NTA1-2A和不动杆菌 TAT1-6A 72 h内可去除65 mg/L的3-甲基吲哚[15]。来自海洋沉积物的产甲烷细菌联合体将3-甲基吲哚转化为3-甲氧基吲哚,而硫酸盐还原菌联合体完全通过3-甲氧基吲哚和α-甲基-2-氨基苯乙酸将3-甲基吲哚矿化[16]。BOROWSKI等[17]研究了含有假单胞菌、芽孢杆菌和乳酸菌的微生物矿物制剂去除鸡粪中令人不快的气味。其结果发现乳酸菌属、假单胞菌属和铜绿菌属都能够降解3-甲基吲哚。而直接将乳酸菌添加到猪粪尿中,厌氧发酵发现,乳酸菌可降低发酵后期3-甲基吲哚的含量[18]。
本实验获得的8株乳酸菌对3-甲基吲哚都具有一定的降解作用,降解率在52.50%~62.21%。我们发现从儿童肠道微生物中筛选的干酪乳杆菌属、类肠膜魏斯氏菌属、肠膜明串珠菌属、格氏乳球菌属的乳酸菌均能够降解3-甲基吲哚,其中降解能力最强的是干酪乳杆菌,降解率达62.21%,且高于阳性对照菌嗜热链球菌的降解率(59.44%)。有学者研究了短乳杆菌1.12、植物乳杆菌102、干酪乳杆菌6103和植物乳杆菌ATCC8014对质量浓度为0.1 μg/mL的3-甲基吲哚的降解能力差异,结果显示短乳杆菌1.12的降解能力最强,去除率为(65.35±0.3)%,干酪乳杆菌6103为(52.15±0.3)%[19],与本实验的研究结果较一致。尽管乳酸菌对3-甲基吲哚降解能力的研究较少,但目前的研究已初步表明乳酸菌具有降解3-甲基吲哚的能力。本实验结果丰富了降解肠道毒素的微生物资源,同时也为今后扩展乳酸菌的应用范围提供了切实可行的理论依据。
[1] GONZALEZ L M, MOESER A J, BLIKSLAGER A T.Porcine models of digestive disease:The future of large animal translational research[J].Translational Research, 2015, 166(1):12-27.
[2] BHARUCHA A E, PEMBERTON J H, LOCKE G R Ⅲ.American gastroenterological association technical review on constipation[J].Gastroenterology, 2013, 144(1):218-238.
[3] 陈辰, 房静远.饮食因素影响结直肠癌发生的研究进展[J].中华医学杂志, 2014, 94(26):2 069-2 072.
CHEN C, FANG J Y.Advances in the study of dietary factors affecting colorectal carcinogenesis[J].National Medical Journal of China, 2014, 94(26):2 069-2 072.
[4] BELGHITI D K, SCORSONE E, DE SANOIT J, et al.Simultaneous detection of indole and 3-methylindole using boron-doped diamond electrodes[J].Physica Status Solidi, 2016, 213(10):2 662-2 671.
[5] SIVAN A, CORRALES L, HUBERT N, et al.Commensal Bifidobacterium promotes antitumor immunity and facilitates anti-PD-L1 efficacy[J].Science, 2015, 350(6 264):1 084-1 089.
[6] HUANG Y, WANG J F, CHENG Y, et al.The hypocholesterolaemic effects of Lactobacillus acidophilus American type culture collection 4356 in rats are mediated by the down-regulation of Niemann-Pick C1-Like 1[J].The British Journal of Nutrition, 2010, 104(6):807-812.
[7] 田丰松, 王军, 杨连玉, 等.不同乳酸菌分离株抗菌物质及其抗菌活性的体外检测及鉴定[J].中国预防兽医学报, 2016, 38(7):558-561.
TIAN F S, WANG J, YANG L Y, et al.In vitro analysis of substance with antibacterial activity of lactic acid bacteria[J].Chinese Journal of Preventive Veterinary Medicine, 2016, 38(7):558-561.
[8] BEN SALAH-ABB S J,ABB
S J,ABB S S, JEBALI R, et al.Potential preventive role of lactic acid bacteria against AFM1 immunotoxicity and genotoxicity in mice[J].Journal of Immunotoxicology, 2015, 12(2):107-114.
S S, JEBALI R, et al.Potential preventive role of lactic acid bacteria against AFM1 immunotoxicity and genotoxicity in mice[J].Journal of Immunotoxicology, 2015, 12(2):107-114.
[9] ABRUNHOSA L, IN S A, RODRIGUES A I, et al.Biodegradation of ochratoxin A by Pediococcus parvulus isolated from Douro wines[J].International Journal of Food Microbiology, 2014, 188:45-52.
S A, RODRIGUES A I, et al.Biodegradation of ochratoxin A by Pediococcus parvulus isolated from Douro wines[J].International Journal of Food Microbiology, 2014, 188:45-52.
[10] ARORA P K,SHARMA A, BAE H H.Microbial degradation of indole and its derivatives[J].Journal of Chemistry, 2015.DOI:10.1155/2015/129159.
[11] 朱雅琴, 黄煦杰, 江岩, 等.骆驼瘤胃乳酸菌的分离、鉴定及其降解吲哚的功能研究[J].食品工业科技, 2020, 41(11):134-139;145.
ZHU Y Q, HUANG X J, JIANG Y, et al.Isolation and identification of lactic acid bacteria from rumen of camel and its function in degradation of indole[J].Science and Technology of Food Industry, 2020, 41(11):134-139;145.
[12] MA Q, QU H, MENG N, et al.Biodegradation of skatole by Burkholderia sp.IDO3 and its successful bioaugmentation in activated sludge systems[J].Environmental Research, 2020, 182:109123.
[13] SHARMA N, DOERNER K C, ALOK P C, et al.Skatole remediation potential of Rhodopseudomonas palustris WKU-KDNS3 isolated from an animal waste lagoon[J].Letters in Applied Microbiology, 2015, 60(3):298-306.
[14] YIN B O, HUANG L M, GU J D.Biodegradation of 1-methylindole and 3-methylindole by mangrove sediment enrichment cultures and a pure culture of an isolated Pseudomonas aeruginosags[J].Water, Air, and Soil Pollution, 2006, 176(1-4):185-199.
[15] TESSO T A, ZHENG A J, CAI H Y, et al.Isolation and characterization of two Acinetobacter species able to degrade 3-methylindole[J].PLoS One, 2019, 14(1):e0211275.
[16] GU J D, FAN Y Z, SHI H C.Relationship between structures of substituted indolic compounds and their degradation by marine anaerobic microorganisms[J].Marine Pollution Bulletin, 2002, 45(1):379-384.
[17] BOROWSKI S, MATUSIAK K, POWA OWSKI S, et al.A novel microbial-mineral preparation for the removal of offensive odors from poultry manure[J].International Biodeterioration & Biodegradation, 2017, 119:299-308.
OWSKI S, et al.A novel microbial-mineral preparation for the removal of offensive odors from poultry manure[J].International Biodeterioration & Biodegradation, 2017, 119:299-308.
[18] 曾正清. 蚯蚓和乳酸菌(L4)对猪粪尿臭气浓度和免疫机能的影响及其机理研究[D].北京:中国农业大学, 2003.
ZENG Z Q.Effect of earthworms and lactic acid bacteria (L4) on odor concentration and immune function of pig feces and urine and their mechanism[D].Beijing:China Agricultural University, 2003.
[19] MENG X, HE Z F, LI H J, et al.Removal of 3-methylindole by lactic acid bacteria in vitro[J].Experimental & Therapeutic Medicine, 2013, 6(4):983-988.