黑曲霉pyrG遗传转化系统的构建及应用
胡江峰1,刘舒雯1,杨焱1,李林霖1,李迎凯2,张健1*
1(工业发酵微生物教育部重点实验室,天津科技大学 生物工程学院,天津,300457)2(天津市经济贸易学校,天津,300381)
摘 要 用于黑曲霉遗传操作的筛选标记基因非常有限,而基因改造往往涉及诸多基因的敲除或表达,有限的筛选标记基因难以满足需要。该文构建了以pyrG为筛选标记的黑曲霉遗传转化系统,并利用该系统使红色荧光蛋白rfp在黑曲霉中成功表达。首先,运用同源重组原理完全敲除pyrG基因,在含有5-氟乳清酸和尿苷/尿嘧啶的培养基平板进行筛选,获得1株稳定遗传的尿苷/尿嘧啶营养缺陷型菌株黑曲霉ng-1。然后构建了以pyrG作为回补标记,以三磷酸甘油醛脱氢酶启动子gpdA来调节rfp基因表达的质粒,将质粒转入农杆菌AGL1并侵染黑曲霉菌株ng-1,成功获得了黑曲霉rfp表达菌株,表明pyrG筛选标记可成功用于黑曲霉的遗传转化。
关键词 黑曲霉;pyrG;根癌农杆菌介导的转化法;筛选标记;红色荧光蛋白
DOI:10.13995/j.cnki.11-1802/ts.027893
引用格式:胡江峰,刘舒雯,杨焱,等.黑曲霉pyrG遗传转化系统的构建及应用[J].食品与发酵工业,2022,48(2):15-19.HU Jiangfeng,LIU Shuwen,YANG Yan, et al.Construction and application of Aspergillus niger pyrG genetic transformation system[J].Food and Fermentation Industries,2022,48(2):15-19.
第一作者:硕士研究生(张健副研究员为通信作者,E-mail:zj96sk@tust.edu.cn)
基金项目:国家自然科学基金面上项目(31471725);山东省重点研发计划(领军人才培育项目)(2016GRC3201)
收稿日期:2021-04-28,改回日期:2021-05-15
黑曲霉具有多种活性强大的酶系[1-2],对发酵食品的风味和品质起到重要作用,如酸性蛋白酶能催化发酵物料中蛋白质的水解,增加种曲或发酵制品中氨基酸含量,提高营养价值[3];纤维素酶、葡萄糖氧化酶分解原料能使发酵制品的色、香、味变得更加协调。黑曲霉还是重要的有机酸产生菌,广泛用于柠檬酸的生产[4]。由于黑曲霉在食品与发酵工业中的重要作用,利用基因工程手段对其进行针对性改造以提高其生产性能越来越受到人们的关注。
通过遗传代谢手段研究黑曲霉菌株,不仅可以更好地理解其代谢调控机制,还能有目的地进行遗传改造,提高目标产物的产量,优化菌株的发酵性能[5]。遗传改造过程中,筛选标记基因必不可少,潮霉素抗性标记hyg[6-7],博来霉素抗性标记ble[8]是丝状真菌基因改造时常用的筛选标记,但有些丝状真菌具有较高的耐药性,且抗性基因有被转移到环境和其他微生物的风险,因而其应用有一定局限性[9]。
营养缺陷型标记通过将标记基因转入相应的营养缺陷型受体菌,实现基因功能互补,使受体菌恢复野生型表型,达到转化子筛选目的。常用的营养缺陷型有尿苷/尿嘧啶缺陷型[10-11],亚硝酸盐缺陷型[12-13]等,其中,尿苷/尿嘧啶营养缺陷型中pyrG基因编码乳清酸核苷-5′-磷酸脱羧酶,缺乏该酶的菌株无法在不含尿嘧啶核苷的培养基上生长,必须补充尿苷/尿嘧啶才能正常生长,而野生型菌株会把5-氟乳清酸(5-fluoroorotic acid,5-FOA)转化为致死的5-氟尿嘧啶,因而不能在含5-FOA的培养基生长[14-15]。利用这个特性,一方面可以通过5-FOA筛选获得尿苷/尿嘧啶营养缺陷型菌株,另一方面可以用不加尿苷/尿嘧啶的培养基筛选回补原养型菌株。
本研究在黑曲霉中成功构建了以pyrG 基因为筛选标记的遗传转化系统,获得1株稳定遗传的尿苷/尿嘧啶营养缺陷型菌株ng-1,并以pyrG作为回补标记将红色荧光蛋白rfp成功表达在黑曲霉中[16-17]。
1 材料与方法
1.1 菌株和质粒
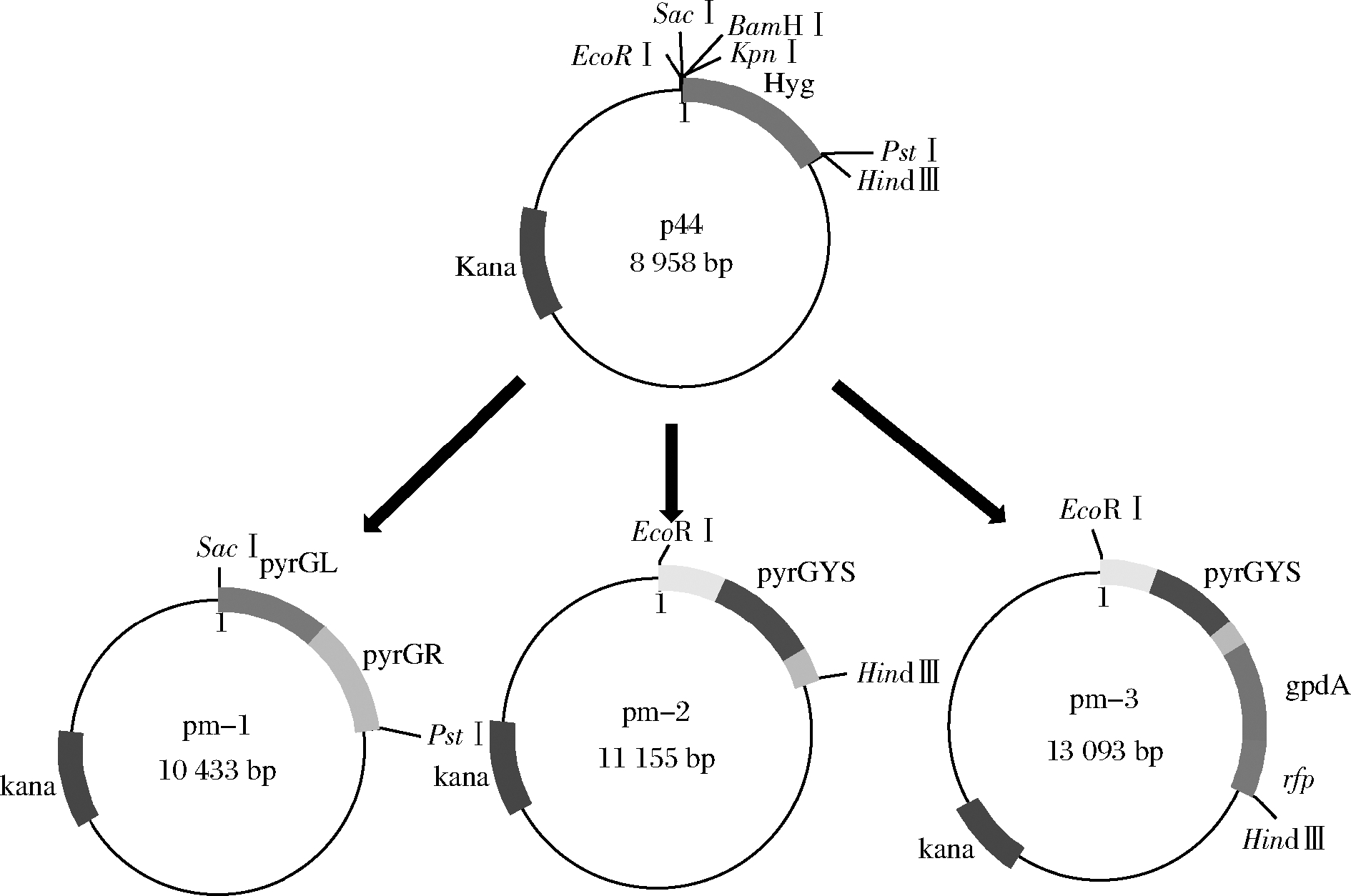
黑曲霉CICC 41702(Aspergillus niger CICC 41702)、大肠杆菌DH5α(Escherichia coli DH5α)、根癌农杆菌AGL1(Agrobacterium tumefaciens AGL1)、双元穿梭质粒p44,天津科技大学生化过程与技术实验室保存;本实验构建质粒:pyrG敲除质粒pm-1;pyrGYS回补标记质粒pm-2;红色荧光蛋白rfp表达质粒pm-3。
1.2 试剂
NH4Cl、(NH4)2SO4、K2HPO4、NaCl、葡萄糖、MgSO4·7H2O、琼脂粉(均为分析纯),天津市北方天医化学试剂厂;5-FOA、尿苷、尿嘧啶、头孢噻肟钠、氨苄青霉素、卡那霉素(均为分析纯),北京市索来宝科技有限公司;DL 5 000 DNA Maker、DL 10 000 DNA Marker、快速DNA聚合酶(5 U/μL),南京诺唯赞生物科技有限公司;限制性内切酶EcoR I(15 U/μL)、Hind Ⅲ(15 U/μL)、Sac Ⅰ(15 U/μL)、Pst Ⅰ(15 U/μL),宝日医生物技术有限公司。
1.3 培养基
大肠杆菌和根癌农杆菌增殖培养采用LB培养基,根癌农杆菌转化采用IM培养基[18];黑曲霉所用培养基包括完全培养基(complete medium,CM)[19]、选择培养基M+met(质量分数):0.2% NH4Cl,0.1% (NH4)2SO4,0.05% NaCl,0.1% KH2PO4,0.05% MgSO4,0.002% FeSO4,2%葡萄糖,0.15%蛋氨酸。
1.4 仪器与设备
SpX-250B-Z生化培养箱、HHS型电热恒温水浴锅,上海博迅实业有限公司医疗设备厂;LDZX-50FB立式压力蒸汽灭菌,上海申安医疗器械厂;电子天平,无限量衡器有限公司;光学显微镜,OLYMpUS公司;TCL台式高速离心机,上海医药分析仪器厂;全自动凝胶成像仪,北京赛智创业科技有限公司;DYY-6C电泳仪,北京市六一仪器厂;Wp700型格兰仕微波炉,顺德市格兰仕电器有限公司;正置荧光显微镜,北京普析通用仪器有限责任公司。
1.5 引物
研究所使用的引物如表1所示。
表1 本研究所用引物
Table 1 Primers used in this study

名称引物序列(5'→3')引物作用pm1-pyrGL-F/RCATGATTACGAATTCGAGCTCTTCTTTTCGCGTTTGACTAATTCT/GTGCTCGACATTGGTCCTTAAATCTGAAGGAAGACCAAGG扩增pyrG左臂pm1-pyrGR-F/RTAAGGACCAATGTCGAGCACGGGT/GCCAAGCTTGCATGCCTGCAGAAGTGTGATGACTTCACCATGGAG扩增pyrG右臂pm2-pyrGYS-F/RCTATGACATGATTACGAATTCCTATACCAGCTATATGTAATAATCTCTACTGTATACT/ACGACGGCCAGTGCCAAGCTTGGTCCAT-GTTTTCCAGCCG扩增与线性P44连接的pyrGYS片段pm3-pyrGYS-F/RCTATGACATGATTACGAATTCCTATACCAGCTATATGTAATAATCTCTACTGTATACT/GCCTCTGTGGTCCATGTTTTCCAGCCG扩增与gpdA左臂融合的pyrGYS片段pm3-gpdA-F/RAAAACATGGACCACAGAGGCCAGAGCATCACCA/CCTCGGTGTTGTCCATTGTTTAGATGTGTCTATGTGGCGG扩增gpdA启动子全长pm3-rfp-F/RAACAATGGACAACACCGAGGACGTC/ACGACGGCCAGTGCCAAGCTTCTACTGGGAGCCGGAGTGG扩增rfp基因全长
注:下划线的部分为酶切位点
1.6 质粒的构建
以p44为出发质粒,黑曲霉CICC 41702基因组为模板扩增所需片段。根据NCBI上已经公布的黑曲霉乳清酸核苷-5′-磷酸脱羧酶基因(pyrG)序列(an12 g03570)设计上下游引物,利用pm1-pyrGL-F/R引物对,pm1-pyrGR-F/R引物对分别扩增得到pyrG上、下游同源臂pyrGL(1 200 bp)和pyrGR(1 200 bp)。用引物pm1-pyrGL-F和pm1-pyrGR-R将2个同源臂片段融合成1个片段pyrGLR(2 400 bp)。连接以Sac Ⅰ 和Pst Ⅰ 双酶切的p44质粒和片段pyrGLR,获得质粒pm-1。
利用pm2-pyrGYS-F/R引物对扩增pyrGYS片段,该片段包括:pyrG基因上游启动子区734 bp,pyrG基因1 127 bp,pyrG基因下游终止子区336 bp。以EcoR Ⅰ和Hind Ⅲ双酶切p44质粒并与pyrGYS片段连接获得质粒pm-2。
利用pm3-pyrGYS-F/R,pm3-gpdA-F/R,pm3-rfp-F/R引物对分别扩增得到pyrGYS(2 197 bp)、gpdA启动子(1 250 bp)和rfp红色荧光蛋白基因(678 bp),用pm3-gpdA-F和pm3-rfp-R引物先将gpdA启动子和rfp红色荧光蛋白融合为1个片段形成gpdA-rfp(1 928 bp),再用pm3-pyrGYS-F和pm3-rfp-R引物将pyrGYS与gpdA-rfp融合形成pyrGYS-gpdA-rfp(4 125 bp)。将双酶切的p44质粒(酶切位点EcoR I,Hind Ⅲ)与pyrGYS-gpdA-rfp连接获得质粒pm-3,如图1所示。
1.7 转化子的筛选
利用同源重组原理,将敲除质粒pm-1通过电转导入根癌农杆菌AGL1中[20],菌落PCR验证成功后,将其与黑曲霉新鲜孢子在含有硝酸纤维膜的IM固体培养基中25 ℃避光共培养60 h,用无菌水将黑曲霉孢子洗至含有尿苷(0.5 g/L)、尿嘧啶(0.5 g/L)、5-FOA(2 g/L)、0.1 g/L的氨苄青霉素和0.25 g/L头孢噻肟钠的M+met培养基中,25 ℃培养7~10 d,待其长出转化子后提基因组进行PCR验证,将验证正确的转化子在CM培养基中遗传10代验证其稳定性,获得尿苷/尿嘧啶营养缺陷型突变株ng-1[21]。将构建的质粒pm-2 和pm-3分别电转入根癌农杆菌AGL1中后,分别与ng-1的新鲜孢子共培养60 h,以M+met作为选择培养基,其中添加0.1 g/L的氨苄青霉素和0.25 g/L头孢噻肟钠,25 ℃培养7~10 d,待其长出转化子后提基因组进行PCR验证,正确的转化子即为pyrG营养缺陷型菌株的回补菌株和rfp表达菌株。
1.8 转化子的荧光测定
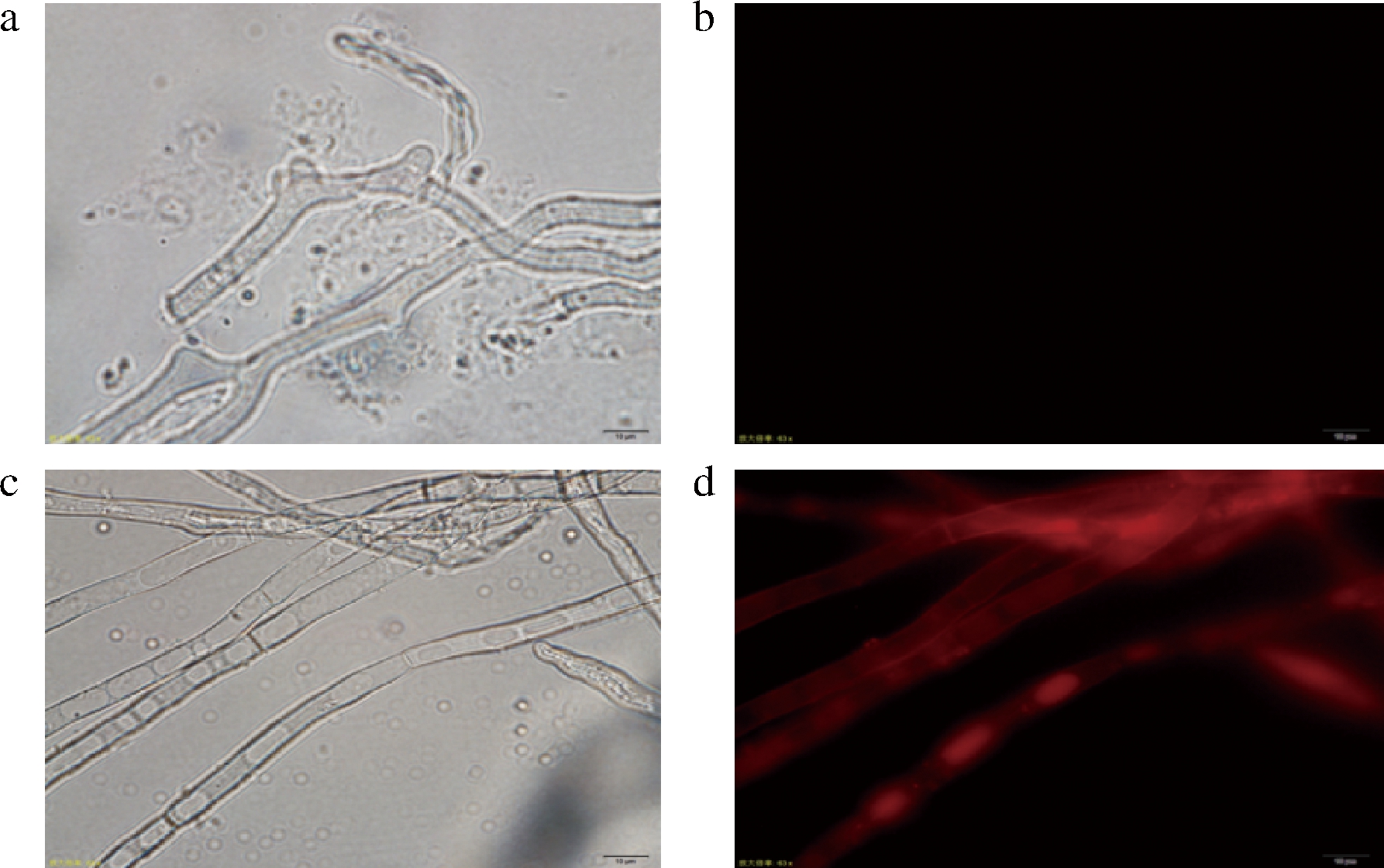
首先准备干净的载玻片,用移液枪枪头吸1滴无菌水滴在载玻片,挑取CM培养基上适量的幼嫩菌丝至载玻片的小水滴中,盖上盖玻片,轻轻按压盖玻片,挤出盖玻片内的气泡和多余的无菌水。放置在正置荧光显微镜上的载物台上,滴1滴香柏油,高倍镜观察菌丝形态。在黑暗环境中找到清晰的菌丝后调节光源至绿色光观察菌丝是否具有红色荧光[22]。
2 结果与分析
2.1 pyrG敲除菌株的筛选及验证
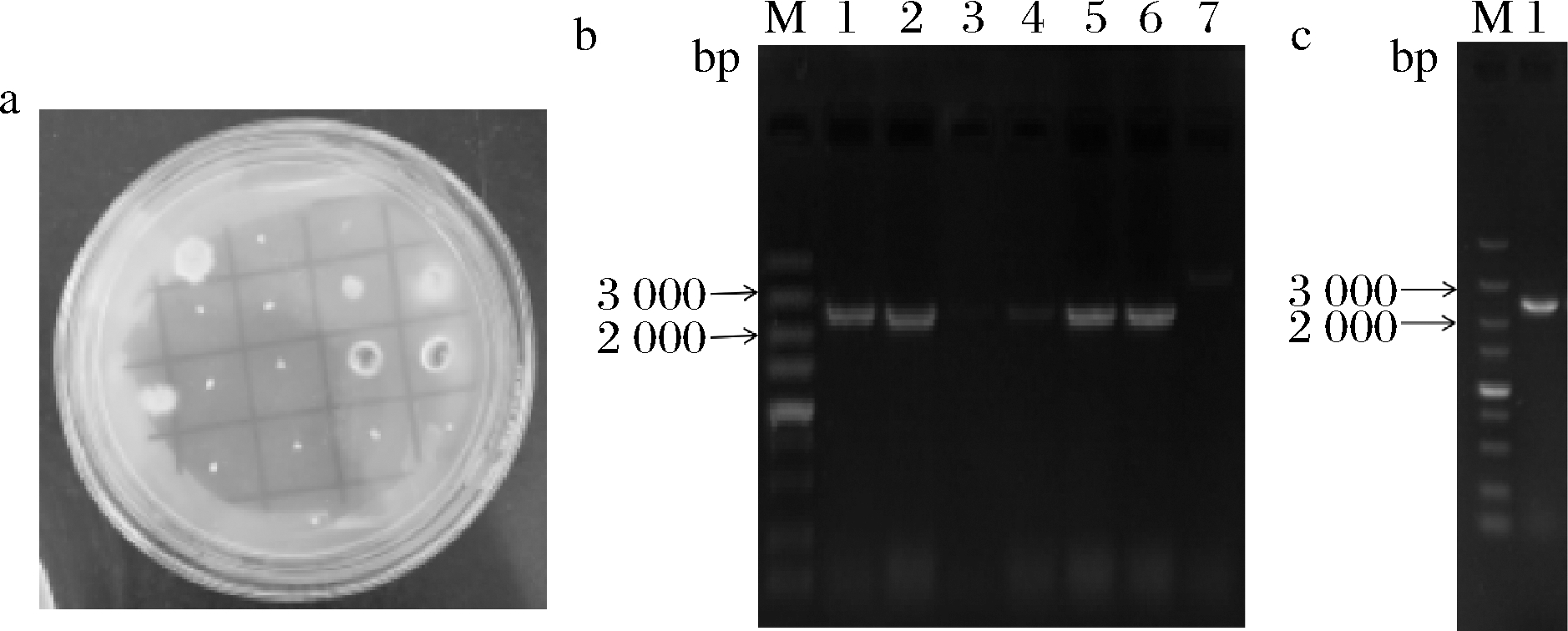
如图2-a所示,尿苷/尿嘧啶营养缺陷型转化子在含有5-FOA和尿苷、尿嘧啶的M+met培养基中能够生长,而野生型菌株无法生长。挑取转化子接发酵小瓶,2 d后待其长出菌丝,提基因组,以引物pm1-pyrGL-F/R验证转化子,如图2-b所示,1、2、4、5、6号泳道条带大小与预期相符,为正确转化子,7号泳道为阴性对照;图2-c中1号泳道为质粒阳性对照,由此可知黑曲霉CICC 41702中的pyrG基因被敲除。挑取正确的转化子传10代进行验证,结果证明pyrG基因敲除性状能够稳定的遗传,选择1株pyrG基因敲除转化子命名为黑曲霉ng-1,进行后续pyrG回补试验。
2.2 pyrG营养缺陷型菌株的回补
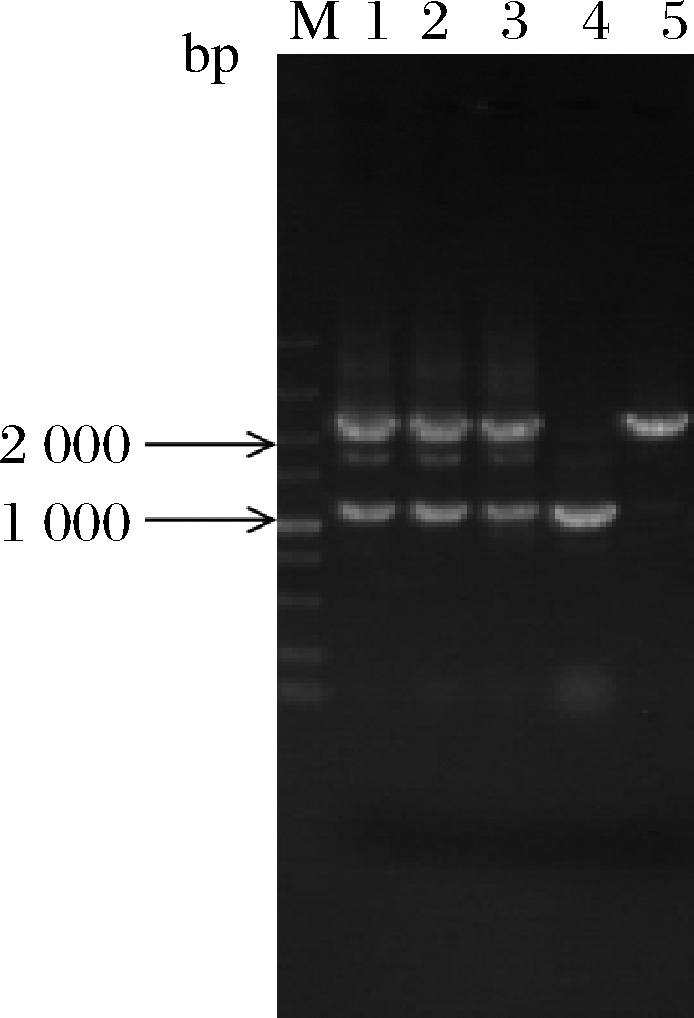
将pm-2质粒电转至根癌农杆菌AGL1,侵染黑曲霉菌株ng-1,以不含尿苷/尿嘧啶的M+met作为选择培养基,共筛选出3株随机插入转化子。以pm2-pyrGYS-F/R为引物,进行PCR验证。如图3所示,3个转化子条带大小与预期相符。将条带大小正确的转化子接入添加尿苷、尿嘧啶和5-FOA的培养基中,转化子不生长;接入只添加尿苷/尿嘧啶的培养基中,转化子生长,证明从黑曲霉CICC 41702基因组扩增得到的pyrGYS回补标记可用于pyrG型尿苷/尿嘧啶营养缺陷型黑曲霉恢复突变,同时证明黑曲霉ng-1为稳定的pyrG基因缺陷型,可直接用于基因转化。
2.3 红色荧光蛋白在黑曲霉中的表达
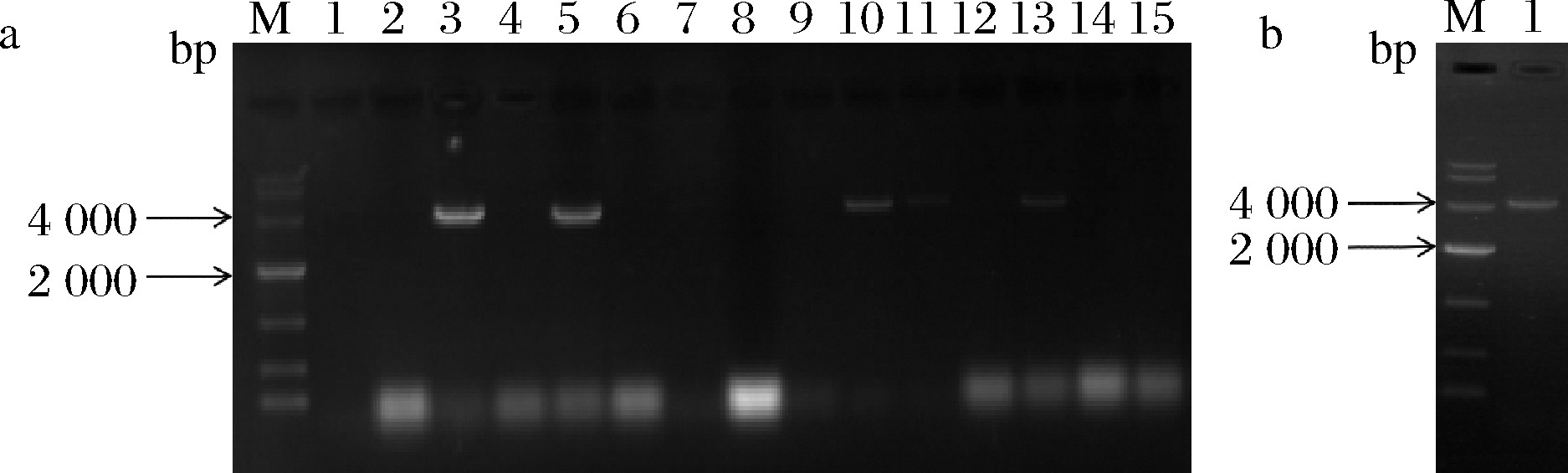
以黑曲霉ng-1作为出发菌株,以pyrGYS为回补标记,gpdA为红色荧光蛋白rfp的启动子pm-3质粒根癌农杆菌转化,以不含尿苷/尿嘧啶的M+met作为选择培养基,共筛选出14株随机插入转化子。如图4所示,以引物pm3-pyrGYS-F和pm3-rfp-R对转化子全长验证,其中3、5、10、11、13号泳道条带大小与预期相符,为正确转化子。将正确的转化子接入发酵培养基中,待其长出菌丝后,对转化子菌丝进行荧光显微镜检测,如图5所示,可知红色荧光蛋白在ng-1的菌株中很好的表达,证明pyrG基因可作为筛选标记直接进行基因改造,并实现以此为标记的基因操作。
3 结论
本研究利用根癌农杆菌介导的转化方法,基于同源重组原理,敲除了黑曲霉CICC 41702中pyrG基因,获得性状稳定的尿苷/尿嘧啶营养缺陷型黑曲霉ng-1。将包含黑曲霉菌株CICC 41702中pyrG全长基因的质粒pm-2成功转化到菌株ng-1中,可恢复菌株ng-1的合成尿苷/尿嘧啶的能力,使营养缺陷型菌株恢复野生型菌株的表型,充分证明黑曲霉pyrG基因是一种严格的营养缺陷型选择标记,可用于黑曲霉遗传转化系统。利用该系统,成功构建5株荧光蛋白报告菌株,为从细胞水平研究黑曲霉中蛋白的分泌和定位奠定了基础。
参考文献
[1] LI C, ZHOU J W, DU G C, et al.Developing Aspergillus niger as a cell factory for food enzyme production[J].Biotechnology Advances, 2020, 44:107630.
[2] 谢承佳, 庄琪.酱油制曲研究进展[J].中国调味品, 2017, 42(6):77-80.
XIE C J, ZHUANG Q.Research progress of koji making for fermented soy sauce[J].China Condiment, 2017, 42(6):77-80.
[3] 李莉. 用黑曲霉、绿色木霉制备酱油种曲的工艺参数确定[J].中国调味品, 2008, 33(9):42-44;52.
LI L.Ascertainment of optimum technology parameters for producting seed koji using Aspergillus niger and Trichoderma viride[J].China Condiment, 2008, 33(9):42-44;52.
[4] 孙士健, 王丽娟, 秦郦, 等.复合诱变筛选高产柠檬酸黑曲霉及其发酵研究[J].食品研究与开发, 2019, 49(17):194-200.
SUN S J, WANG L J, QIN L, et al.Compound mutation and screening Aspergillus niger with high yield of citric acid and its fermentation research[J].Food Research and Development, 2019, 49(17):194-200.
[5] 孙菁, 任文琪, 许勤虎, 等.以amdS为筛选标记的黑曲霉遗传转化体系的建立[J].中国农业科技导报, 2020, 22(9):179-187.
SUN J, REN W Q, XU Q H, et al.Transformation system of Aspergillus niger using amdS as a dominant selective marker[J].Journal of Agricultural Science and Technology, 2020, 22(9):179-187.
[6] ORTEGA-ESCALANTE J A, KWOK O, MILLER S M.New selectable markers for Volvox carteri transformation[J].Protist, 2019, 170(1):52-63.
[7] LIU J J, XIE Z P, SHIN H D, et al.Rewiring the reductive tricarboxylic acid pathway and L-malate transport pathway of Aspergillus oryzae for overproduction of L-malate[J].Journal of Biotechnology, 2017, 253:1-9.
[8] SUZUKI S, TADA S, FUKUOKA M, et al.A novel transformation system using a bleomycin resistance marker with chemosensitizers for Aspergillus oryzae[J].Biochemical and Biophysical Research Communications, 2009, 383(1):42-47.
[9] 王伯华. 橙色红曲菌中基于pyrG标记的同源转化系统的建立[D].南昌:南昌大学, 2010.
WANG B H.Development of a homologous transformation system for Monascus aurantiacus based on the pyrG gene[D].Nanchang:Nanchang University, 2010.
[10] HARTINGSVELDT W, MATTERN I E, ZEIJL C M J, et al.Development of a homologous transformation system for Aspergillus niger based on the pyrG gene[J].Molecular and General Genetics, 1987, 206(1):71-75.
[11] NGUYEN K T, HO Q N, PHAM T H, et al.The construction and use of versatile binary vectors carrying pyrG auxotrophic marker and fluorescent reporter genes for Agrobacterium-mediated transformation of Aspergillus oryzae[J].World Journal of Microbiology and Biotechnology, 2016, 32(12):1-9.
[12] UNKLES S E, CAMPBELL E I, DE RUITER-JACOBS Y M J T, et al.The development of a homologous transformation system for Aspergillus oryzae based on the nitrate assimilation pathway:A convenient and general selection system for filamentous fungal transformation[J].Molecular and General Genetics, 1989, 218(1):99-104.
[13] 李方方, 潘力, 曾沛斌.酱油工业生产菌沪酿3042基因工程转化体系的构建[J].食品工业科技, 2009,13(6):94-95;99.
LI F F, PAN L, ZENG P B.Construction of genetic engineering transforming system of Aspergillus oryzae HuNiang 3042 used in soy sauce industry[J].Science and Technology of Food Industry, 2009,13(6):94-95;99.
[14] THAI H D, NGUYEN B P T, NGUYEN V M, et al.Development of a new Agrobacterium-mediated transformation system based on a dual auxotrophic approach in the filamentous fungus Aspergillus oryzae[J].World Journal of Microbiology and Biotechnology, 2021, 37(6):92.
[15] BOEKE J D, TRUEHEART J, NATSOULIS G, et al.5-Fluoroorotic acid as a selective agent in yeast molecular genetics[J].Methods in Enzymology, 1987, 154:164-175.
[16] 陈英, 王培娟, 张文君, 等.mCherry红色荧光标记乳酸菌的融合表达系统构建及应用[J].生物工程学报, 2019, 35(3):492-504.
CHEN Y, WANG P J, ZHANG W J, et al.Construction and application of mCherry red fluorescent protein fusion expression system in lactic acid bacteria[J].Chinese Journal of Biotechnology, 2019, 35(3):492-504.
[17] ZHAO P, YE M H, WANG R Q, et al.Systematic identification and functional analysis of potato (Solanum tuberosum L.) bZIP transcription factors and overexpression of potato bZIP transcription factor StbZIP-65 enhances salt tolerance[J].International Journal of Biological Macromolecules, 2020, 161:155-167.
[18] 陈阳霞, 顾桉菁, 梁宇恒, 等.电穿孔介导马尔尼菲青霉转化体系的建立和优化[J].中国真菌学杂志, 2014, 9(1):12-15.
CHEN Y X, GU A J, LIANG Y H, et al.Electroporation-mediate transformation of Penicillium marneffei and optimization of the transforming conditions[J].Chinese Journal of Mycology, 2014, 9(1):12-15.
[19] 李载平. 分子克隆实验指南(第3版)[J].科学通报, 2002, 47(24):1 888.
LI Z P.Molecular cloning experiment guide(the 3rd edition)[J].Chinese Science Bulletin, 2002, 47(24):1 888.
[20] 黎明, 刘萌, 黄云雁, 等.根癌农杆菌介导的黑曲霉遗传转化体系的建立及优化[J].中国生物工程杂志, 2012, 32(1):56-63.
LI M, LIU M, HUANG Y Y, et al.Establishment and optimization of Agrobacterium tumefaciens mediated transformation system of Aspergillus niger[J].China Biotechnology, 2012, 32(1):56-63.
[21] 毕付提, 史亚楠, 张久祎, 等.米曲霉3.042尿苷/尿嘧啶营养缺陷型遗传转化体系的构建[J].食品研究与开发, 2021, 42(3):189-195.
BI F T, SHI Y N, ZHANG J Y, et al.Construction of Aspergillus oryzae 3.042 uridine/uracil auxotrophy genetic transformation system[J].Food Research and Development, 2021, 42(3):189-195.
[22] 裴静娴, 王月刚, 张艺军, 等.p53RFP基因启动子荧光素酶报告基因载体的构建及鉴定[J].广东医学, 2017, 38(2):170-172.
PEI J X, WANG Y G, ZHANG Y J, et al.Construction and identification of luciferase reporter plasmid containing p53RFP gene promoter[J].Guangdong Medical Journal, 2017, 38(2):170-172.
Construction and application of Aspergillus niger pyrG genetic transformation system
HU Jiangfeng1,LIU Shuwen1,YANG Yan1,LI Linlin1,LI Yingkai2,ZHANG Jian1*
1(Key Laboratory of Industrial Fermentation Microbiology Ministry of Education, College of Biotechnology, Tianjin University of Science and Technology, Tianjin 300457, China)2 (Tianjin Economics and Trade School, Tianjin 300381, China)
ABSTRACT Few selective marker genes are used in the genetic operation of Aspergillus niger. However, genetic modification often involves the knockout or expression of many genes, and the limited selective marker genes are difficult to meet the needs. In this study, genetic transformation system was constructed using pyrG as selective marker in A. niger and the red fluorescent protein rfp in A. niger was expressed using this system. First, the pyrG gene was knocked out by targeted gene replacement using Agrobacterium tumefaciens mediated transformation. The stable genetic uridine/uracil auxotrophic strain A. niger ng-1 was obtained on medium containing 5-fluoroorotic acid and uridine/uracil. Then we constructed the rfp gene-expression plasmid which contained the rfp gene driven by the glyceraldehyde triphosphate dehydrogenase promoter gpdA and the selective marker pyrG. The plasmid was transferred to A. tumefaciens AGL1 and infected the A. niger ng-1, so as to obtain rfp gene-expression A. niger strains. This work showed that the genetic transformation system using the pyrG as a selective marker is effective and feasible in A. niger.
Key words Aspergillus niger;pyrG;Agrobacterium tumefaciens-mediated transformation;selective marker;red fluorescent protein