结肠相关癌症(colorectal cancer,CRC)占美国癌症致死的第3位,5年生存率大概是14%[1]。在世界范围内,以美国和欧洲为首的发达国家发病率较高,从1975年开始,美国结肠癌发病率呈下降趋势,但年轻人的发病率有所升高;非洲和亚洲国家的发病率较低,但是,随着中国经济的迅速发展,结肠癌发病率呈逐年递增趋势[2]。结肠癌主要分为两类,第一类是散发性结肠癌(sporadic colorectal cancer,SCRC),主要发展机制是一系列基因突变的结果,其中腺瘤性息肉病(adenomatous polyposis coli,APC)基因失活是SCRC的起因;第二类是炎症相关的结肠癌(colitis-associated cancer,CAC),其发病机制尚不明确,有些研究认为,炎症引起结肠上皮细胞中的氧化应激导致DNA损伤是这类结肠癌变的起因[3-4]。癌症化学预防的定义是通过使用天然,合成或生物化学试剂来逆转,抑制或预防癌症的发展[5]。结肠肿瘤发生的多步骤性为预防提供了机会[6]。环氧合酶2(cyclooxygenase2,COX2)是预防结肠癌最有希望的分子靶标,但临床试验表明,长期抑制COX2会引起心血管毒性[7]。治疗癌症的一些药物,例如5-氟尿嘧啶(5-fluorouracil,5-FU)和他莫昔芬等,会出现耐药性,高风险复发等副作用。因此,近年来人们开始关注有效改善化学疗法,并降低不良反应的自然疗法[8]。长期摄入嘌呤含量高的食物,例如海鲜,啤酒等可以引起高尿酸血症,进而引起痛风性关节炎和高尿酸肾病,黄嘌呤氧化酶(xanthine oxidase, XO)是治疗这些疾病的主要靶点[9]。最近的研究表明,XO可以促进肿瘤的发展[10],得益于XO在痛风中的研究结果,黄酮类物质展示出对XO抑制的巨大潜力[11];另一方面,流行病学证据表明,大豆异黄酮可预防结直肠癌的发展[12-14]。综上所述,具有抑制XO作用的黄酮类化合物可能有预防结肠癌的潜力。因此,本研究首先通过HPLC的方法,体外筛选XO的抑制剂;然后建立氧化偶氮甲烷(azoxymethane,AOM)/葡聚糖硫酸钠(dextran sulfate sodium,DSS)诱导的小鼠结肠癌模型评价这些抑制剂的体内效果。研究成果表明,金雀异黄酮可以通过抑制XO有效延缓结肠癌的发展。
1.1.1 实验动物
SPF级C57BL/6 N雄性小鼠,5周龄(体重20~22 g),北京维通利华实验动物技术有限公司。
1.1.2 抗体
重组Anti-Xanthine Oxidase抗体(ab109235)、重组Anti-TNFα抗体(ab81299),Abcam。
1.1.3 实验试剂
还原性谷胱甘肽(glutathione,GSH)、尿酸试剂盒,南京建成生物工程研究所;XO活性检测试剂盒,北京索莱宝科技有限公司;Mouse TNFα ELISA Kit、Mouse IL-6 ELISA Kit,南京福麦斯生物技术有限公司;免疫组化试剂盒,生工生物工程股份有限公司;AOM,无锡莱弗思生物有限公司;DSS,南京百思凯科技有限公司;XO、别嘌呤醇(allopurinol)、尿酸(uric acid)、黄嘌呤(xanthine),Sigma公司;黄酮类(flavones):芹菜素(apigenin)、白杨素/柯因(chrysin),黄酮醇类(flavonols):高良姜素(galangin)、山奈酚(kaempferol)、槲皮素(quercetin)、漆黄素(fisetin)、桑色素(morin),异黄酮类(isoflavones):金雀异黄酮(genistein)、黄豆苷元(daidxein),黄烷酮类(flavanones):二氢黄酮甙(hesperiden)、柚皮素(naringenin),类黄酮醇(flavanonols):花旗松素(taxifolin),酚酸类(phenolic acids):绿原酸(chlorogenic acid)、咖啡酸(caffeic acid),上海阿拉丁生化科技股份有限公司。
1.2.1 HPLC法筛选XO的有效抑制剂
利用XO催化黄嘌呤氧化生成尿酸这一反应。首先在1.5 mL EP管中加入终浓度为100 μmol/L的抑制剂和20 μL、0.1 U/mg prot的XO,在PBS(PH 7.5)缓冲溶液里室温下反应15 min,然后加入330 μL 150 μmol/L黄嘌呤,反应30 min后加入100 μL 1 mol/L盐酸终止反应;PBS和别嘌呤醇(10 μmol/L)分别作为空白和阳性对照。反应后的溶液经0.22 μm的滤膜过滤后,HPLC法检测产物尿酸的峰面积,为保证数据的准确性,需进行3次平行重复实验[15]。因有些化合物的光不稳定性较差,整个过程需注意避光,利用公式(1)计算XO的活性。
XO活性![]()
(1)
HPLC的检测方法:流动相为0.1 mol/L磷酸二氢钠水溶液,流速为0.8 mL/min,室温,ODS-C18柱(150 mm×4.6 mm,5 μm),检测波长为290 nm,液相色谱仪为Q Exactive LC (Thermo Fisher)。
1.2.2 利用AOM/DSS诱导原发结直肠癌肿瘤小鼠模型实验
5周龄SPF级C57BL/6 N雄性小鼠,饲养于江南大学实验动物中心SPF屏障环境中,实验编号为:JN.No20181230c1250401 [279]。小鼠在屏障环境中适应喂养1周后,随机分为4组,每组12只,分别为空白组、模型组和实验组,其中实验组包括低剂量金雀异黄酮组(20 mg/kg)和高剂量金雀异黄酮组(40 mg/kg)。分组后,模型组和实验组小鼠腹腔注射AOM(10 mg/kg,200 μL),空白组注射相同体积的9 g/L NaCl溶液。1周后,模型组和实验组小鼠接受含有3% DSS饮用水[16],持续1周,同时开始给与实验组小鼠灌胃低剂量和高剂量金雀异黄酮,空白组和模型组灌胃相同体积的NaCl溶液。模型组和实验组小鼠停止给与DSS后,用普通的饮用水继续喂养6周。实验结束后,收集血清,结肠,肝脾等组织,用于后续实验。其中每组6只小鼠的结肠放于液氮中保存,用于测量生化指标,其余6只小鼠的结肠,用4%多聚甲醛固定,用于苏木精- 伊红(hematoxylin-eosin,HE)染色法和免疫组化(immunohistochemistry,IHC)分析。
1.2.3 小鼠结肠组织固定和HE染色
用于HE和IHC分析的结肠组织,用冷的PBS冲洗干净后,纵切后平铺在试验台上,从远端结肠开始卷起,直到盲肠,“瑞士卷”做好后,放入4%多聚甲醛中固定,经脱水、透明、浸蜡和包埋后,制成5 μm的切片,经HE染色,于显微镜下观察拍照,对异常隐窝病灶和肿瘤计数。
1.2.4 IHC分析
结肠组织切片经过烤片、脱蜡、复水后,经3%体积分数的过氧化氢溶液中浸泡10 min灭酶,柠檬酸钠溶液中微波加热6 min完成抗原修复,冷却至室温,使用5% BSA溶液室温封闭1 h,切片放入恒湿盒内,并在4 ℃层析柜内孵育一抗(XO、TNFα抗体,1∶200稀释),过夜,然后按IHC试剂盒说明书完成染色和苏木精复染等后续实验,并在扫描显微镜下拍照分析XO和TNFα的表达水平和定位。
1.2.5 小鼠结肠部位TNFα,IL-6和GSH含量测定
液氮保存的结肠样品,加入20倍体积PBS,组织研磨后,12 000 r/min,30 min,4 ℃离心收集上清液,如果上清液脂肪过多,需再次离心,重新收集上清液,避免上清液脂肪影响实验结果的准确性。取部分上清液经5倍稀释后,用BCA法测蛋白浓度;取另外一部分上清液,检测结肠部位IL-6,TNFα和GSH含量,IL-6和TNFα的含量严格按照说明书所提供的酶联免疫方法进行检测,GSH含量严格按照说明书所提供的生化微板法进行检测,检测结果用蛋白含量进行标定。其余上清液放入-80 ℃冰箱备用。
采用平均值±标准差表示实验结果,使用Graph Pad Prism 5.0统计软件包进行统计分析。Turkey′s t-test 检验用于比较2组之间的数据;One-way ANOVA和Bonferroni校正用于比较3个或更多组之间的数据。对于P<0.05 的分析结果,认为具有显著性差异,其中*表示P<0.05,**表示P<0.01,***表示P<0.001。
通过HPLC筛选的方法,分别评价了12种黄酮类化合物和2种酚酸类化合物对XO活性的影响,结果见图1,阳性对照别嘌呤醇组XO活性为(1.5±0.7)%,芹菜素和金雀异黄酮对XO活性抑制显著,XO的活性分别为(26.3±3.3)%(P<0.01)和(9.8±0.3)%(P<0.001);进一步考察了金雀异黄酮对XO活性抑制的剂量依赖效应,结果见图2,10、30、100 μmol/L金雀异黄酮组的XO活性分别为(82.2±3.1)%(P >0.05),(61.2±1.1)%(P<0.05)和(10.9±1.5)%(P<0.001),金雀异黄酮表现出对XO活性抑制的剂量依赖效应。
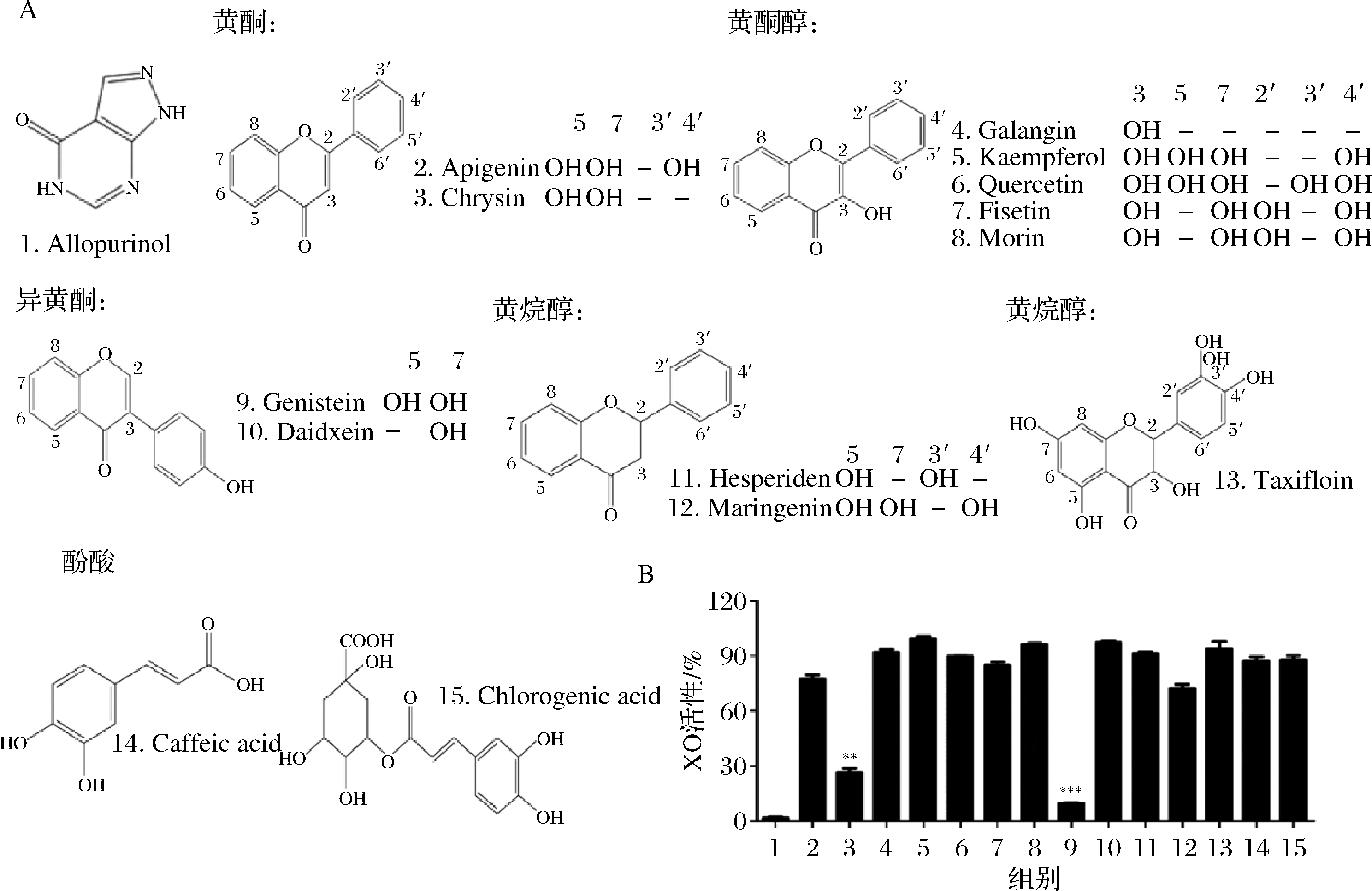
A-黄酮和酚酸类物质的结构式;B-黄酮和酚酸类物质对黄嘌呤氧化酶催化黄嘌呤产生尿酸活性的影响
图1 黄酮和酚酸类化合物对 XO 活性的影响
Fig.1 The effect of flavonoids and phenolic acids on the activity of xanthine oxidase
注:*表示P<0.05,**P<0.01,***表示P<0.001(下同)
通过建立AOM/DSS诱导原发结直肠癌肿瘤小鼠模型,评价了不同浓度金雀异黄酮对结肠肿瘤的预防作用,图3-A为实验方案设计。图3-B显示各组小鼠的体重分别是,空白组(27.6±2.0)g,模型组(26.1±1.5)g,低剂量金雀异黄酮组(25.7±1.9)g,高剂量金雀异黄酮组(25.2±2.1)g。实验组小鼠较空白和模型组小鼠的体重有所下降,但无显著性差异(P>0.05),通过结肠长度和肝指数(图3-C和图3-D)可以看出,小鼠表现出对金雀异黄酮的耐受,无明显的肝毒性。图3-E表明模型组的脾指数显著高于空白组(P<0.001),高剂量的金雀异黄酮可以显著抑制AOM/DSS引起的脾指数升高(P<0.001)。AOM/DSS模型组小鼠结肠组织中的肿瘤数目(P<0.01),TNFα(P<0.05)和IL-6(P<0.05)水平较空白组显著升高,高剂量的金雀异黄酮显著降低结肠部位的肿瘤数目(P<0.05)和TNFα水平(P<0.05)(图3-F~图3-H)。这些结果表明高剂量金雀异黄酮可以抑制AOM/DSS引起的结肠炎症相关癌症的发展。
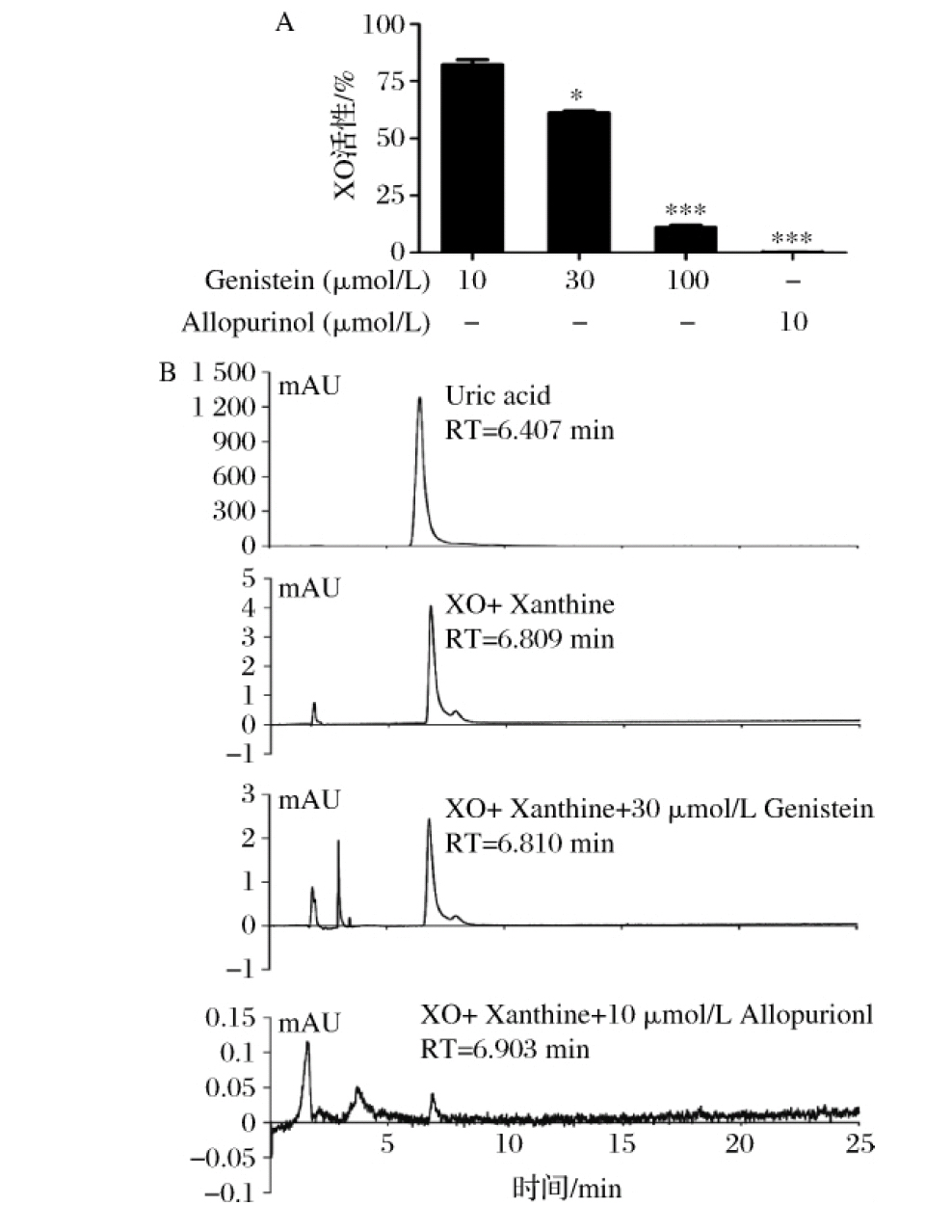
A-不同浓度的金雀异黄酮对黄嘌呤氧化酶活力的影响;
B-HPLC法检测金雀异黄酮对黄嘌呤氧化酶催化黄嘌呤产生尿酸的影响
图2 金雀异黄酮对 XO 活性抑制的剂量依赖效应
Fig.2 The dose-dependent effect of genistein on the
inhibition of xanthine oxidase activity

A-AOM/DSS诱导小鼠结肠肿瘤模型实验设计图;B-体重;C-结肠长度;D-肝指数;E-脾指数;F-结肠荷瘤数;
G-结肠黏膜中TNFα含量;H-结肠黏膜中IL-6含量
图3 不同浓度金雀异黄酮对小鼠结肠肿瘤发展的影响
Fig.3 The effect of different concentrations of genistein on the development of colon tumors in mice
最近的研究表明,XO可促进肿瘤的发展[10],鉴于金雀异黄酮在体外显示出对XO的抑制作用,金雀异黄酮抑制小鼠结肠癌发展的靶点可能是XO。图4中IHC结果表明小鼠结肠肿瘤部位的XO和TNFα蛋白水平升高,XO在间质和黏膜中均有表达,TNFα主要在间质表达。AOM/DSS诱导的模型组小鼠结肠部位XO活性(P<0.01)和产物尿酸的水平(P<0.05)较空白组显著升高,高剂量金雀异黄酮显著抑制结肠部位XO(P<0.05)和尿酸水平(P<0.05),并显著提高了GSH水平(P<0.05)。这些结果表明金雀异黄酮通过抑制XO活性延缓结肠肿瘤的发展。

A-黄嘌呤氧化酶在结肠肿瘤中的定位;B-小鼠结肠黏膜中XO活性;C-结肠黏膜中尿酸含量;D-金雀异黄酮对AOM/DSS诱导小鼠结肠黏膜中GSH含量影响
图4 不同浓度金雀异黄酮对结肠癌模型小鼠中 XO 的影响
Fig.4 The effect of different concentrations of genistein on xanthine oxidase in colon cancer mice
别嘌呤醇可以通过竟争性抑制XO的活性来治疗痛风等疾病,但会出现过敏性皮疹、腹痛腹泻等不良反应,因此这种药物在临床上的应用饱受非议[9]。近年来,随着不断深入研究,发现天然产物中一些黄酮类化合物可有效抑制XO的活性[11]。本文通过HPLC的方法评价了12种黄酮类和2种酚酸类对XO活性的影响,发现金雀异黄酮可以显著抑制XO活性,并具有明显的剂量依赖,这可能与金雀异黄酮A环上5和7位的羟基和C环上3位的苯酚基团有关,但是金雀异黄酮是如何抑制XO及抑制类型需进一步研究确认。
在体内,金雀异黄酮也可以抑制AOM/DSS小鼠结肠癌模型中结肠部位XO活性,并减少结肠部位小鼠肿瘤的数目。这些结果表明,金雀异黄酮可以通过抑制XO有效延缓结肠癌的发展。值得注意的是,金雀异黄酮降低了AOM/DSS小鼠结肠癌模型中尿酸含量,升高了结肠部位的GSH含量,这个结果显示金雀异黄酮可能是通过降低尿酸或者缓解结肠部位的氧化应激而延缓结肠癌的发展。氧化应激引起的组织损伤长期以来一直与结肠炎相关的结肠肿瘤发生有关,但其分子机制仍不清楚[17]。最近的研究表明,过量的尿酸对机体是一种危险信号,参与机体的炎症反应[18-19]。因此,XO具体是通过哪种代谢产物促进了结肠癌的发展还需进一步研究。
综上,本研究通过HPLC的方法,筛选到金雀异黄酮可有效抑制XO,并延缓AOM/DSS引起的小鼠结肠癌的发展。临床数据也表明,金雀异黄酮与抗癌药物,例如阿霉素,多西他赛,和他莫昔芬联合使用时,展现出明显的协同作用[20-21]。这些结果表明,金雀异黄酮具有潜在的临床治疗或者联合其他抗癌药物预防结肠癌的作用。
[1] SIEGEL R L, MILLER K D, JEMAL A.Cancer statistics, 2019 [J].CA:A Cancer Journal for Clinicians, 2019, 69(1):7-34.
[2] KANG Y P, WARD N P, DENICOLA G M.Recent advances in cancer metabolism:A technological perspective[J].Experimental & molecular medicine, 2018, 50(4):1-16.
[3] SAKITA J Y, GASPAROTTO B, GARCIA S B, et al.A critical discussion on diet, genomic mutations and repair mechanisms in colon carcinogenesis [J].Toxicology Letters, 2017, 265:106-116.
[4] JAWAD N, DIREKZE N, LEEDHAM S J.Inflammatory bowel disease and colon cancer.[J].Recent Results in Cancer Research.Fortschritte Der Krebsforschung.Progrès Dans Les Recherches Sur Le Cancer, 2011, 185:99-115.
[5] BODE A M, DONG Z G.Cancer prevention research-then and now[J].Nature Reviews Cancer, 2009,9(7):508-516.
[6] J NNE P A, MAYER R J.Chemoprevention of colorectal cancer[J].New England Journal of Medicine, 2000, 342(26):1 960-1 968.
NNE P A, MAYER R J.Chemoprevention of colorectal cancer[J].New England Journal of Medicine, 2000, 342(26):1 960-1 968.
[7] SOLOMON S D, MCMURRAY J J V, PFEFFER M A, et al.Cardiovascular risk associated with celecoxib in a clinical trial for colorectal adenoma prevention[J].The New England Journal of Medicine.2005, 352(11):1 071-1 080.
[8] SPAGNUOLO C, RUSSO G L, ORHAN I E, et al.Genistein and cancer:Current status, challenges, and future directions[J].Advances in Nutrition, 2015, 6(4):408-419.
[9] HAINER B L, MATHESON E, WILKES R T.Diagnosis, treatment, and prevention of gout[J].American Family Physician, 2014, 90(12):831-836.
[10] KUSANO T, EHIRCHIOU D, MATSUMURA T, et al.Targeted knock-in mice expressing the oxidase-fixed form of xanthine oxidoreductase favor tumor growth [J].Nature Communications, 2019, 10(1):4 904.
[11] BORGES F, FERNANDES E, ROLEIRA F.Progress towards the discovery of xanthine oxidase inhibitors[J].Current Medicinal Chemistry, 2002, 9(2):195-217.
[12] YAN L, SPITZNAGEI E L.Soy consumption and prostate cancer risk in men:A revisit of a meta-analysis[J].The American Journal of Clinical Nutrition, 2009, 89(4):1 155-1 163.
[13] YAN L, SPITZNAGEL E L.Meta-analysis of soy food and risk of prostate cancer in men[J].International Journal of Cancer, 2005, 117(4):667-669.
[14] APPLEGATE C, ROWLES J L, RANARD K M, et al.Soy consumption and the risk of prostate cancer:An updated systematic review and meta-analysis[J].Nutrients, 2018, 10(1):40.
[15] LI D Q, ZHAO J, LI S P.High-performance liquid chromatography coupled with post-column dual-bioactivity assay for simultaneous screening of xanthine oxidase inhibitors and free radical scavengers from complex mixture[J].Journal of Chromatography A, 2014,1 345:50-56.
[16] NEUFERT C, BECKER C, NEURATH M F.An inducible mouse model of colon carcinogenesis for the analysis of sporadic and inflammation-driven tumor progression[J].Nature Protocols, 2007, 2(8):1 998-2 004.
[17] BHATTACHARYYA A, CHATTOPADHYAY R, MITRA S, et al.Oxidative stress:An essential factor in the pathogenesis of gastrointestinal mucosal diseases[J].Physiological Reviews, 2014, 94(2):329-354.
[18] GASSE P, RITEAU N, PÉTRILLI V, et al.Uric acid is a danger signal activating NALP3 inflammasome in lung injury inflammation and fibrosis[J].Revue Des Maladies Respiratoires 2008,25(9):1 191.
[19] CHIARO T R, SOTO R, STEPHENS W Z, et al.A member of the gut mycobiota modulates host purine metabolism exacerbating colitis in mice[J].Science Translational Medicine, 2017, 9(380).DOI:10.1126/scitranslmed.aaf9044.
[20] CHANG E C, CHARN T H, PARK S H, et al.Estrogen receptors α and β as determinants of gene expression:Influence of ligand, dose, and chromatin binding[J].Molecular Endocrinology, 2008,22(5):1 032-1 043.
[21] SPAGNUOLO C, RUSSO G L, ORHAN I E, et al.Genistein and cancer:Current status, challenges, and future directions [J].Advances in Nutrition, 2015, 6(4):408-419.