嗜黏蛋白阿克曼氏菌(Akkermansia muciniphila,Akk)是定植于肠道黏液层中可特异性降解黏蛋白的革兰氏阴性厌氧菌[1]。研究发现,Akk具有良好的调节代谢的能力,口服Akk可改善动物脂代谢和肠道通透性,起到预防肥胖和改善脂多糖内毒素血症的作用[2]。初步的临床实验也表明,Akk安全性良好,适量补充可显著降低超重和肥胖患者的胰岛素分泌和总胆固醇水平,减轻胰岛素抵抗[3]。此外,在炎症性肠病[4]、糖尿病[5]、自闭症[6]、癫痫[7]、高血压[8]等疾病中也相继报道了Akk改善疾病症状的作用。Akk与机体肠道生态、代谢、神经等生理状态密切相关,具有良好的肠道益生作用。
借助大规模基因组测序分析,Akk发挥肠道益生作用的机制与其显著调节肠道微生态之间的关联已逐步揭示。多项人体与动物实验研究结果发现,肥胖、糖尿病、炎症和代谢紊乱等疾病的发生发展均伴随不同程度的Akk丰度的降低[9]。不仅如此,Akk对肠道上皮细胞良好的黏附作用以及自聚集能力,有利于在肠道菌群中形成优势占位[10],这也为其参与调节代谢稳态及相关途径基因表达提供基础。目前,有关Akk益生性能的研究大多采用测序的方法从群落水平上进行分析,鲜有研究从菌株水平进行探讨。本研究即借助微生物纯培养与细胞模型等体外研究方法,对Akk进行益生性能的考查和评价,进一步了解Akk发挥肠道益生作用的微生物学基础。
1.1.1 实验材料
Akk模式菌株,购自ATCC菌种保藏库(ATCC BAA-835);Caco-2细胞,江南大学附属医院肿瘤研究所殷媛博士馈赠。
甘露寡糖(聚合度2~7),成都永安缘和生物科技有限公司;壳寡糖(聚合度2~7),扬州日兴生物科技有限公司;褐藻寡糖(聚合度2~7),实验室自行制备;溶菌酶、胰蛋白酶、脑心浸液(brain heart infusion,BHI)、黏蛋白、L-半胱氨酸、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)、丙三醇、氢氧化钠,美国sigma公司。
1.1.2 培养基及溶液配制
BHI培养基(g/L):BHI 37.0、黏蛋白5.0、L-半胱氨酸0.3。121 ℃,灭菌20 min后备用。
低聚糖培养基:甘露寡糖、壳寡糖和褐藻寡糖分别配制1 mg/mL母液,采用0.22 μm滤膜过滤除菌,加入BHI培养基中分别配制低聚糖质量浓度为250、500、1 000 μg/mL的3种含糖培养基,灭菌备用。
胆盐培养基:BHI培养基中加入胆盐,使胆盐在液体培养基中的最终质量分数分别为1.0%、1.2%、1.4%、1.6%,灭菌备用。
Akk培养条件:厌氧工作站培养,37 ℃,气体组成为80% CO2,10% H2,10% N2。
1.1.3 溶液配制
人工胃液的配制:用盐酸调整蒸馏水的pH值至3.5,加入胃蛋白酶,使其质量浓度为10 mg/mL,用0.22 μm的滤膜进行过滤除菌后得到人工胃液。
人工肠液的配制:取磷酸二氢钾6.8 g,加水500 mL溶解,用0.4%氢氧化钠溶液调整pH值至7.0;另取胰蛋白酶10 g,加水适量溶解,将两液混合后,加水稀释至1 000 mL,0.22 μm的微孔滤膜过滤除菌后制得人工肠液。
DNS的配制:称取244.4 g酒石酸钾钠于500 mL去离子水中,45 ℃加热溶解。向溶液中加入21 g氢氧化钠,然后加入DNS 6.3 g,溶解后分别加入5 mL苯酚和5 g亚硫酸氢钠,待溶液冷却后定容至1 L,置于棕色瓶中避光贮存1周后备用。
1.1.4 仪器与设备
DG250厌氧培养工作站,Don Whitley Science公司;酶标仪,Bio-Rad公司;UltiMate3000高效液相色谱仪,戴安(中国)有限公司;SU8220场发射扫描电子显微镜(field emission scanning electron microscope,FESEM),日本HITACHI公司。
1.2.1 菌种活化与培养
在超净工作台中,蘸取保存管中的菌液,平板划线后在厌氧工作站中37 ℃静置过夜培养。挑取平板上的单菌落接种于液体培养基中活化24 h,再按 5.0%的接种量进行发酵培养。
1.2.2 Akk对模拟胃肠环境耐受性评价
模拟胃肠液耐受性:将Akk发酵液按体积比1∶10加至模拟胃液中,37 ℃恒温静置培养,分别计数0、0.5、1、2、4 h时混合液中的Akk活菌数;在模拟胃液中作用4 h的悬浊液进一步以体积比1∶10加至模拟肠液中,在0、0.5、1、2、4 h分别取样计活菌数。每组3个平行,实验重复3次。以存活率评价Akk分别对模拟胃肠液的耐受能力。如公式(1)所示:
存活率![]()
(1)
式中:Ni为不同时间点样品中的活菌数;N0为初始活菌数。
胆盐耐受性:向胆盐质量分数分别为1.0%、1.2%、1.4%、1.6%的BHI培养基中分别加入体积分数1.0%的Akk发酵液,37 ℃下静置培养,在0、3、6、9、24 h分别取样进行活菌计数,并按公式(1)计算存活率,以菌株存活率来评价Akk对胆盐的耐受能力。
1.2.3 低聚糖对Akk生长的影响
以10%的接种量将Akk发酵液接种到不同浓度的3种低聚糖培养基中,37 ℃静置培养。分别在0、12、24、36、48、60 h时间点取样,在600 nm处测定OD值。
1.2.4 Akk利用低聚糖产短链脂肪酸(short-chain fatty acids,SCFAs)的分析
1.2.4.1 糖耗曲线测定
采用DNS法测定Akk在低聚糖培养基不同发酵时间样品的还原糖浓度[11]。取1 mL发酵样品与1 mL DNS沸水浴反应10 min后,加去离子水9 mL终止反应,以时间为横坐标,还原糖含量为纵坐标,绘制Akk对不同低聚糖的消耗曲线。
1.2.4.2 SCFAs分析
将Akk在不同低聚糖培养基中的发酵液样品12 000 r/min离心5 min,上清液用0.22 μm滤膜过滤,采用HPLC检测SCFAs,色谱柱:Waters XBridge C18 (5 μm),流动相:30%乙腈、70%水(0.05%磷酸),柱温35 ℃,流速0.5 mL/min,进样体积20 μL。
1.2.5 FESEM观察
Caco-2细胞在RPMI 1640中连续培养21 d后,通过离心收集细胞重悬培养液中,调整细胞数为1.0×107 CFU/mL。Akk发酵液离心收集菌体,PBS缓冲液洗涤3次后配制悬浮液,调节菌体浓度为1.0×107CFU/mL。添加至Caco-2细胞中孵育6 h后,在含3%戊二醛磷酸盐缓冲液中固定24 h,然后PBS洗涤3次,每次15 min,在60 ℃下96%乙醇脱水6 h,室温干燥。最后,用金-钯(约2~4 nm厚)进行等离子涂层,并通过FESEM在0.1~30 kV的加速电压下以纳米图像分辨率进行分析。
1.2.6 生物膜的测定
将Akk接种到不同浓度的低聚糖液体培养基中,培养24 h结束后,将菌浓度调为1.0×107 CFU/mL 置于 96孔板里培养24 h后弃去培养基,加入0.2 mL 1%结晶紫作用30 min,用蒸馏水漂洗后加入0.2 mL 95%的乙醇,所得有色溶液在590 nm测量吸光度,重复试验 3次并取平均值记为OD值。以Akk在不含低聚糖的培养基中同等波长下的吸光度做为对照,重复3次试验并记录平均值为D。以对照的平均值加3倍标准差作为生物膜形成的界定值Dc(D+3S),将OD与Dc进行比较,判定细菌形成生物膜能力:OD≤Dc,无生物膜形成能力;Dc<OD≤2Dc,弱生物膜形成能力;2Dc<OD≤4Dc,中等生物膜形成能力;OD>4Dc,强生物膜形成能力[12]。
1.2.7 数据分析
实验分析采用OriginPro 9.1软件进行,实验结果以平均值±标准差表示,每组3个平行,实验重复3次。使用SPSS 23.0软件对数据统计,不同组间比较采用单因素方差分析进行差异显著性分析,P<0.05表示差异显著,用*表示,P<0.01表示差异极显著,用**表示。
经过消化系统到达肠道是益生菌发挥益生作用的基础。因此,Akk在胃肠液和胆盐等高渗透压环境的耐受能力是评价其是否能够作为益生菌应用的重要指标之一。从模拟胃液中Akk存活率来看(图1),Akk在模拟胃液中0.5 h存活率高达92.16%,随后开始下降,在1~2 h间趋于平稳;在2~4 h内Akk存活率持续下降,但仍能维持在80%以上。随后进入模拟肠液后,Akk存活率下降幅度平缓,总体处于较稳定的水平,存活率接近77%,说明Akk具有耐受模拟胃肠液的能力。
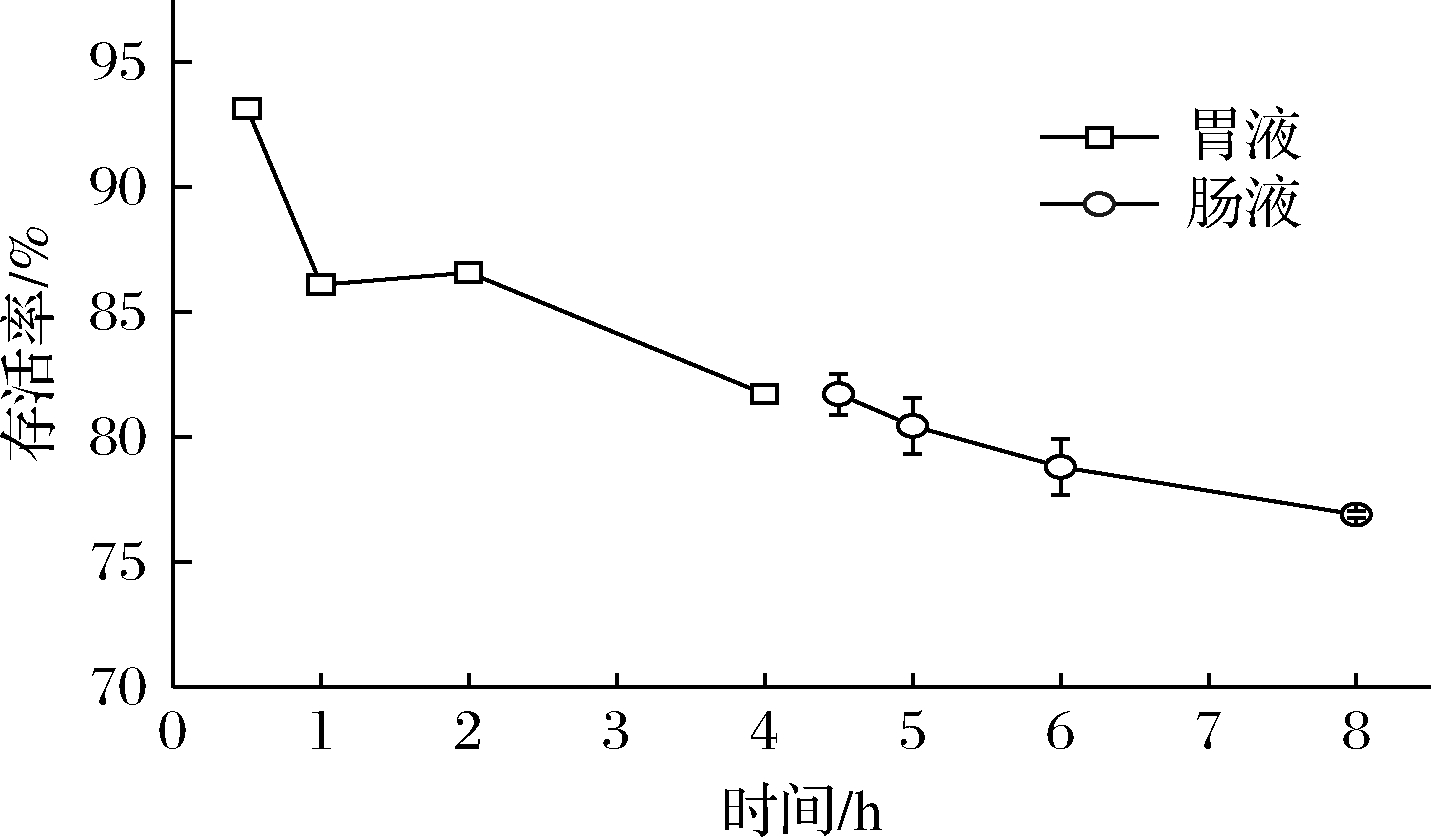
图1 Akk对模拟胃肠液的耐受性
Fig.1 Tolerance of Akk to simulated gastrointestinal fluids
进一步评价Akk对胆盐的耐受能力。由图2可知,Akk存活率随胆盐处理时间无明显差异,胆盐浓度增加Akk存活率表现小幅度降低,在质量分数为1.2%胆盐的培养基中培养24 h后存活率为83.7%,在1.4%及1.6%胆盐的培养基培养24 h存活率分别为80.3%和78.1%,说明Akk具有较好的胆盐耐受性能力。文献中报道了该模式菌株与植物乳杆菌Lactobacillus plantarum subsp.plantarum ATCC14917胃肠耐受性的对比。Akk本身表现出比植物乳杆菌更优良的耐受能力,而当利用黄原胶和结冷胶包埋菌体后,植物乳杆菌耐受性更强。Akk良好的耐受能力不仅与包埋介质相关,也与其自有的耐酸系统有关[13]。

图2 Akk在含不同质量分数胆盐培养基中生长情况
Fig.2 Growth of Akk in media containing bile
salts with different concentrations
肠道微生物对宿主肠道上皮细胞的黏附能力是微生物定植肠道并与宿主互作的重要性质。以Caco-2细胞模拟肠上皮细胞,采用FESEM观察Akk对细胞的黏附。从图3可直观观察到,Akk能较好地附着于分化状态的Caco-2细胞微绒毛尖端上。这与文献中采用荧光染色观察的结果一致。Akk对不同分化状态的Caco-2细胞均有一定的黏附能力,共培养时跨上皮电阻显著提高,增加了肠上皮细胞的完整性[14]。Akk黏附能力可能与其良好的自聚能力有关[15],自聚能力强的益生菌通常具有较强的上皮细胞黏附能力[16]。

a-Caco-2细胞;b-Akk与Caco-2细胞孵育
图3 Akk对Caco-2细胞黏附性的FESEM图
Fig.3 FESEM images for adhesion ability of Akk to
Caco-2 cells
2.3.1 低聚糖对Akk生长影响
作为调节肠道微生物的益生元,低聚糖具有促进益生菌增殖等作用。考查菌株对低聚糖的利用能力成为评价益生菌性能指标之一[17]。结合目前关于低聚糖类益生元的研究现状,我们选择分别具有阴离子、阳离子、中性特征的褐藻寡糖、壳寡糖与甘露寡糖3种低聚糖进行评价,考查Akk对其利用与代谢能力,辅助了解Akk与低聚糖益生元的作用。整体分析Akk生物量随时间的变化可知,Akk在12 h以内均可以快速利用3种低聚糖生长,并在12 h达到最大;12~60 h,Akk对褐藻寡糖和壳寡糖的利用基本维持不变(图4-a、图4-b),对甘露寡糖的利用能力略有增加(图4-c)。比较不同种类的低聚糖利用情况发现,3种低聚糖中,以壳寡糖对Akk生长促进作用相对明显,1 000 μg/mL的壳寡糖培养基中OD值最高,约0.7。不同低聚糖对益生菌生长的影响可能与菌株对糖的利用偏好性有关[18]。低聚糖的浓度对Akk的生长情况影响不显著,3组浓度对应的生长曲线几乎重合。
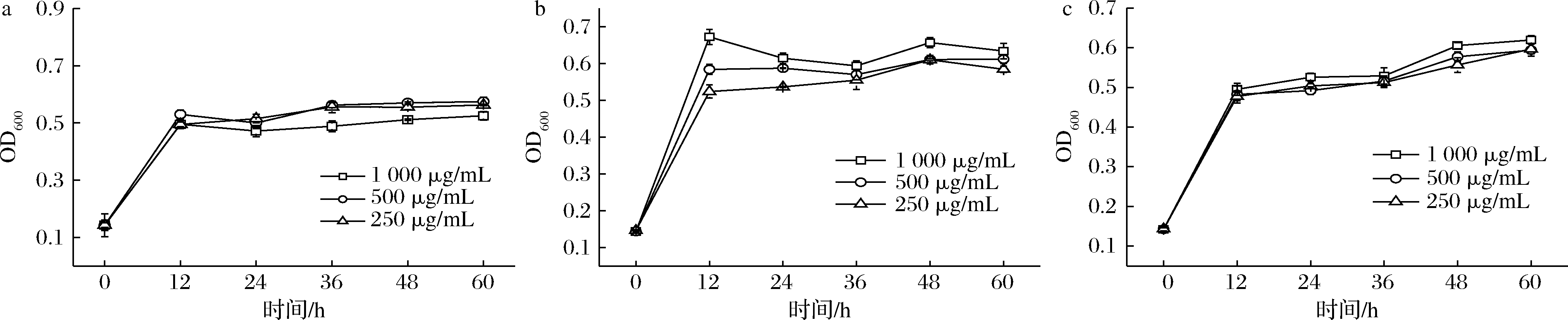
a-褐藻寡糖;b-壳寡糖;c-甘露寡糖
图4 Akk在不同低聚糖培养基中生长情况
Fig.4 Growth of Akk in media containing various oligosaccharides with different concentrations
2.3.2 Akk对低聚糖的利用
通过培养基中剩余还原糖的含量测定考查Akk对低聚糖的利用情况。图5可以看出,12 h以内还原糖含量迅速降低,说明Akk可快速利用3种低聚糖;12 h后,还原糖的含量基本趋于稳定,这与上述Akk在3种低聚糖培养基中的生长曲线一致。比较3种低聚糖的利用情况,Akk对褐藻寡糖和壳寡糖的利用程度相当,略高于甘露寡糖。研究发现,Akk可表达多种多糖降解酶,包括β-半乳糖苷酶、α-岩藻糖苷酶、α-唾液酸酶、β-氨基己糖苷酶等,辅助其对不同结构母乳寡糖的降解利用[19]。除Akk外,其他益生菌对糖类底物的利用也有报道。如双歧杆菌在胃肠道的定植能力很大程度上依赖于对碳水化合物的利用[20],且不同菌株对糖的利用情况不同,如青春双歧杆菌优先利用半乳糖、甘露糖、葡萄糖、低聚果糖和菊粉,而对N-乙酰半乳糖胺偏好性则较低[21]。Akk菌对糖利用与代谢的机制值得进一步研究。
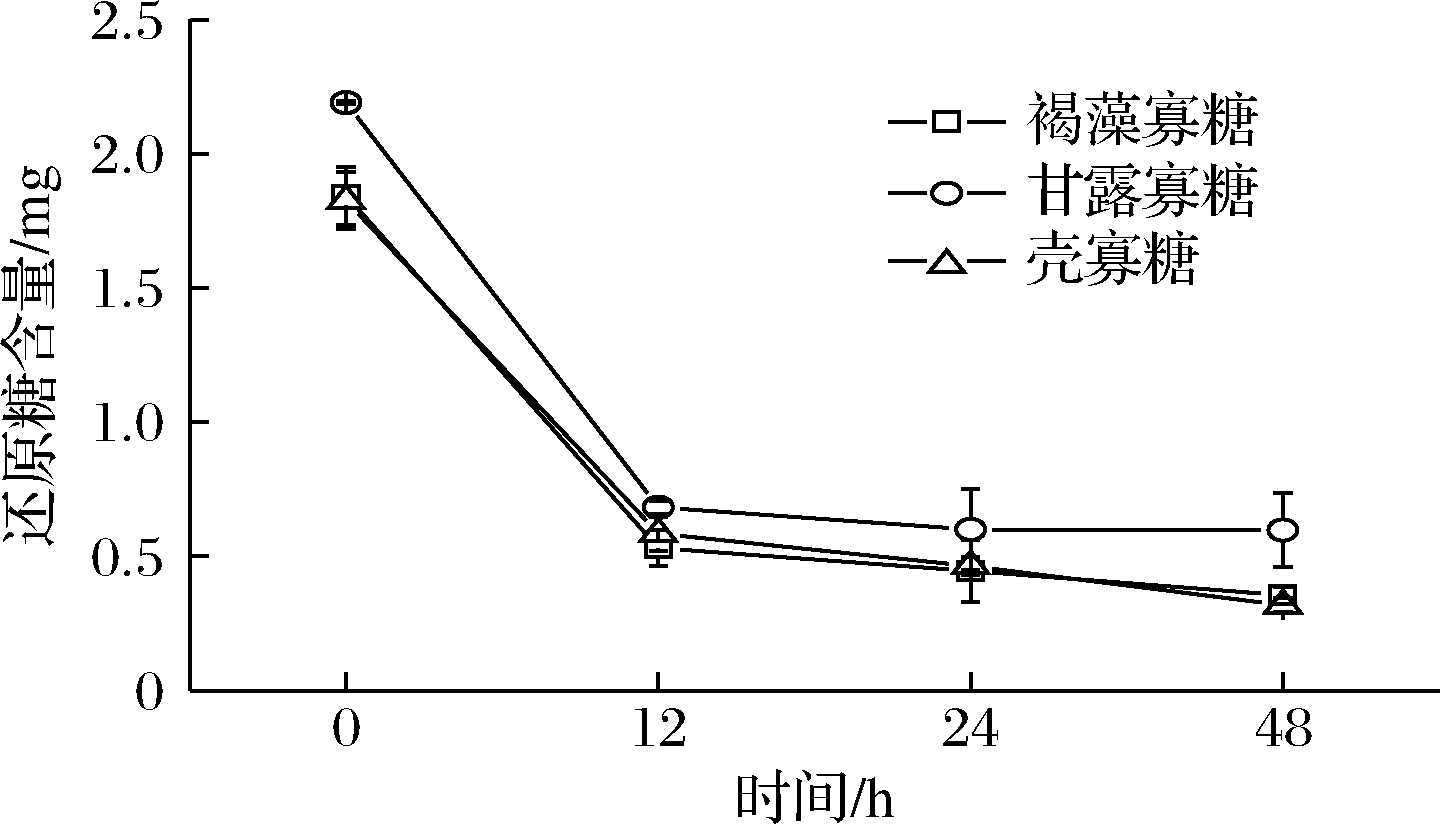
图5 Akk糖耗曲线
Fig.5 Consumption curve of reducing sugars for Akk
2.3.3 Akk利用低聚糖产SCFAs
SCFAs是肠道菌利用益生元产生的一类有助于调节能量代谢和肠道稳态的代谢物,SCFAs有助于肠道稳态和能量代谢的调节,与代谢性疾病[22]、血脑屏障的通透性调节[23]、抗病毒免疫有密切的联系[24],乙酸、丙酸和丁酸是主要种类[25],其中,乙酸产生量最大,可作为肠外周细胞的能量来源,为机体生理活动提供能量;丙酸可影响肝脏和胆固醇代谢,丁酸是结肠黏膜上皮细胞的主要能量来源,均与结肠健康状态密切相关[26]。图6结果显示,Akk在不添加低聚糖培养基中几乎不产SCFAs,总酸含量低于10 mg/mL;添加3种低聚糖后SCFAs产量显著提高,主要集中于乙酸、丁酸、丙酸和戊酸,其中,含量最高的均为乙酸(P<0.01),约是丙酸含量的50倍,其次是丁酸(P<0.05),戊酸最少。进一步比较发现,Akk利用3种低聚糖代谢产生的SCFAs比例不尽相同。Akk利用褐藻寡糖产丁酸的能力高于其他2种低聚糖(P<0.05),而利用壳寡糖产乙酸的能力最强(P<0.01),质量浓度为(51.62±0.23)mg/mL。这一方面可能与不同种类低聚糖的糖基组成及结构有关[27],另一方面,与益生元利用相关的基因往往是诱导表达,从而会引起代谢物的不同[28]。研究表明,包括Akk在内的肠道益生菌可表达多种糖苷水解酶以降解聚糖或低聚糖等膳食纤维,进而通过多种生物途径最终产生乙酸、丙酸和丁酸等SCFAs,为宿主代谢提供能量[29]。

图6 Akk产SCFAs情况
Fig.6 Production of SCFAs of Akk
注:*表示P<0.05,**表示P<0.01(下同)
微生物为了适应所处环境,通过分泌胞外多糖和凝胶状黏液使菌体相互黏连进而形成生物膜。生物膜的形成是益生菌形成优势占位、发挥益生作用的重要途径。如图7-a所示,Akk在未添加低聚糖的培养基中有一定的自聚集能力,但未形成明显的生物膜。低聚糖的添加可显著促进Akk形成生物膜,其中,在添加褐藻寡糖培养基中,Akk周围包裹致密黏液层,形成较为致密的生物膜(图7-b),而在含壳寡糖和甘露寡糖的培养基中,Akk能形成较为明显的生物膜,但致密与连续程度不及褐藻寡糖(图7-c、图7-d)。

a-Akk组;b-Akk添加褐藻寡糖组;c-Akk添加壳寡糖组;
d-Akk添加甘露寡糖组
图7 Akk在不同低聚糖培养基中形成生物膜的FESEM图
Fig.7 FESEM images of biofilm for Akk in media
with various oligosaccharides
进一步结合染色结果进行比较。如图8所示,Akk在有无低聚糖添加的培养基中能形成少量生物膜,成膜能力较弱(图8-a)。这与文献报道结果一致。文献中采用结晶紫染色法测定Akk和植物乳杆菌生物膜的形成情况,结果表明,植物乳杆菌具有强生物膜形成能力,而Akk生物膜形成能力较弱[14]。3种低聚糖均可显著提高Akk的成膜能力至中等,OD590显著升高(P<0.05),低聚糖质量浓度在0~500 μg/mL时,生物膜形成能力随浓度增加而增加;在500~1 000 μg/mL,生物膜形成能力随低聚糖浓度增加而降低,可能是较高浓度的低聚糖未能发挥协同Akk生长的效果,其中以500 μg/mL褐藻寡糖中的Akk生物膜形成效果最好(P<0.01),OD值为1.996±0.01。因此,低聚糖的添加显著增加了Akk生物膜的形成能力。
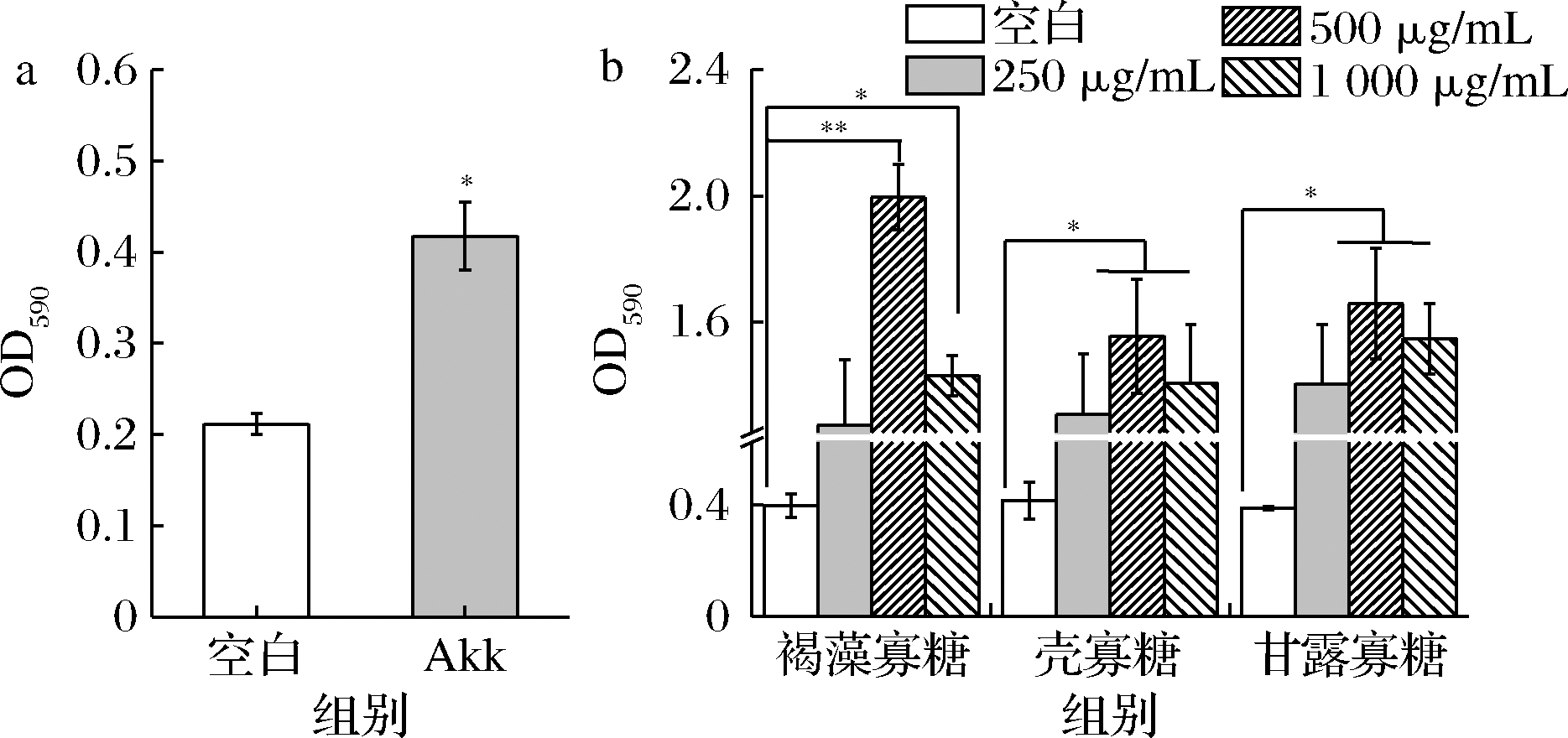
a-Akk在BHI培养基中的生物膜形成能力;b-Akk在低聚糖
BHI培养基中的生物膜形成能力
图8 Akk生物膜形成能力
Fig.8 The ability of biofilm formation for Akk
本研究以Akk模式菌株ATCC BAA-835为研究对象,通过体外静置培养的方式探讨了该菌株在胃肠液中的耐受情况,以及对Caco-2细胞的黏附性,并且探究了Akk对3种低聚糖的利用特性以及生物膜形成能力。研究结果表明,Akk具有较好的耐受胃酸、肠液与胆盐的特性,能够黏附在分化的Caco-2细胞上。培养基中添加3种低聚糖均有利于Akk的快速生长,12 h后进入稳定期,其中以壳寡糖培养基中Akk生长情况最好,结果与糖耗曲线相互吻合。Akk利用低聚糖产SCFAs中含量最高的均为乙酸,其次为丁酸,且利用褐藻寡糖产丁酸的能力最高,利用壳寡糖产乙酸的能力最强。Akk自身具有弱生物膜形成能力,低聚糖可显著提高生物膜形成能力至中等,其中Akk在添加褐藻寡糖培养基中生物膜形成能力较好,可以看出低聚糖促进了Akk生物膜的形成。这些结果表明,本研究利用体外评价手段,从微生物性能角度探讨了Akk肠道益生作用的潜在机制,丰富了对Akk作为肠道益生菌的认知。
[1] ROPOT A V, KARAMZIN A M, SERGEYEV O V.Cultivation of the next-generation probiotic Akkermansia muciniphila, methods of its safe delivery to the intestine, and factors contributing to its growth in vivo[J].Current Microbiology, 2020, 77(8):1 363-1 372.
[2] DAO M C, EVERARD A, ARON-WISNEWSKY J, et al.Akkermansia muciniphila and improved metabolic health during a dietary intervention in obesity:Relationship with gut microbiome richness and ecology[J].Gut, 2016.65(3):426-436.
[3] DEPOMMIER C, EVERARD A, DRUART C, et al.Supplementation with Akkermansia muciniphila in overweight and obese human volunteers:A proof-of-concept exploratory study[J].Nature Medicine.2019, 25(7):1 096-1 103.
[4] ZHAI R, XUE X H, ZHANG L Y, et al.Strain-specific anti-inflammatory properties of two Akkermansia muciniphila strains on chronic colitis in mice[J].Frontiers in Cellular and Infection Microbiology, 2019, 9:239.
[5] ANH F F, NACHBAR R T, VARIN T V, et al.A polyphenol-rich cranberry extract reverses insulin resistance and hepatic steatosis independently of body weight loss[J].Molecular Metabolism, 2017, 6(12):1 563-1 573.
F F, NACHBAR R T, VARIN T V, et al.A polyphenol-rich cranberry extract reverses insulin resistance and hepatic steatosis independently of body weight loss[J].Molecular Metabolism, 2017, 6(12):1 563-1 573.
[6] ZOU R, XU F F, WANG Y Z, et al.Changes in the gut microbiota of children with autism spectrum disorder[J].Autism Research, 2020, 13(9):1 614-1 625.
[7] OLSON C A, VUONG H E, YANO J M, et al.The gut microbiota mediates the anti-seizure effects of the ketogenic diet[J].Cell, 2019, 173(7):1 728-1 741.
[8] LI J, ZHAO F Q, WANG Y D, et al.Gut microbiota dysbiosis contributes to the development of hypertension[J].Microbiome, 2017, 5(1):1-19.
[9] ZHOU K Q.Strategies to promote abundance of Akkermansia muciniphila, an emerging probiotics in the gut, evidence from dietary intervention studies[J].Journal of Functional Foods, 2017, 33:194-201.
[10] COZZOLINO A, VERGALITO F, TRREMONTE P, et al.Preliminary evaluation of the safety and probiotic potential of Akkermansia muciniphila DSM 22959 in comparison with Lactobacillus rhamnosus GG[J].Microorganisms, 2020, 8(2):189-202.
[11] 张小贝, 朱国鹏, 祝志欣, 等.利用3,5-二硝基水杨酸法测定菜用甘薯叶中的多糖含量[J].热带生物学报, 2017, 8(3):359-363;377.
ZHANG X B, ZHU G P, ZHU Z Z, et al.Determination of the polysaccharide content of sweet potato leaves by using 3′5′-dinitrosalicylic acid(DNS)[J].Journal of Tropical Biology, 2017,8(3):359-363;377.
[12] 强华,刘光英,林任玺. 粪肠球菌ace阳性和阴性菌株体外生物被膜形成能力比较[J]. 中国人兽共患病学报, 2019, 35(7): 599-603.
QIANG H, LIU G Y, LIN R X. Biofilm formation ability of Enterococcus faecalis ace positive and negative strains in vitro[J]. Chinese Journal of Zoonoses, 2019, 35(7): 599-603.
[13] MARCIAL-COBA M S, CIEPLAK T, ![]() T B,et al.Viability of microencapsulated Akkermansia muciniphila and Lactobacillus plantarum during freeze-drying, storage and in vitro simulated upper gastrointestinal tract passage[J].Food Function, 2018, 9(11):5 868-5 879.
T B,et al.Viability of microencapsulated Akkermansia muciniphila and Lactobacillus plantarum during freeze-drying, storage and in vitro simulated upper gastrointestinal tract passage[J].Food Function, 2018, 9(11):5 868-5 879.
[14] REUNANEN J, KAINULAIINEN V, HUUSKONEN L, et al.Akkermansia muciniphila adheres to enterocytes and strengthens the integrity of the epithelial cell layer[J].Applied and Environmental Microbiology, 2015, 81(11):3 655-3 662.
[15] COZZOLINO A, VERGALITO F, TREMONTE P, et al.Preliminary evaluation of the safety and probiotic potential of Akkermansia muciniphila DSM 22959 in comparison with Lactobacillus rhamnosus GG[J].Microorganisms, 2020, 8(2):189.
[16] SOPHATHA B, PIWAT S, TEANPAISAN R.Adhesion, anti-adhesion and aggregation properties relating to surface charges of selected Lactobacillus strains:Study in Caco-2 and H357 cells[J].Archives of Microbiology, 2020, 202(6):1 349-1 357.
[17] 张秋香, 应聪萍, 刘思思,等.乳酸菌利用低聚果糖和低聚木糖的特性研究[J].食品与生物技术学报, 2020, 39(4):18-23.
ZHANG Q X, YING C P, LIU S S, et al. Fructooligosaccharides and xylooligosaccharides utilization properties of lactic acid bacteria[J].Journal of Food Science and Biotechnology, 2020, 39(4):18-23.
[18] 陈韫慧, 方思璇, 陈佳琪, 等.不同益生元对植物乳杆菌生长的影响[J].食品与发酵工业, 2020, 46(21):28-33.
CHEN Y H, FANG S X, CHEN J Q, et a1.Effects of different prebiotics on the growth of Lactobacillus plantarum[J].Food and Fermentation Industries, 2020, 46(21):28-33.
[19] KOSTOPOULOS I, ELZINGA J, OTTMAN N, et al.Akkermansia muciniphila uses human milk oligosaccharides to thrive in the early life conditions in vitro[J].Scientific Reports, 2020, 10(1):14 330-14 347.
[20] MILANI C, TURRONI F, DURANTI S, et al.Genomics of the genus Bifidobacterium reveals species-specific adaptation to the glycan-rich gut environment[J].Applied and Environmental Microbiology, 2016, 82(4):980-991.
[21] DURANTI S, TURRONI F, LUGLI G A, et al.Genomic characterization and transcriptional studies of the starch-utilizing strain Bifidobacterium adolescentis 22L[J].Applied and Environmental Microbiology, 2014, 80(19):6 080-6 090.
[22] OVERBY H B, FERGUSON J F.Gut microbiota-derived short-chain fatty acids facilitate microbiota: Host cross talk and modulate obesity and hypertension[J].Current Hypertension Reports, 2021, 23(2): 1-10.
[23] SHIN C, LIM Y, LIM H, et al.Plasma short-chain fatty acids in patients with parkinson′s disease[J].Movement Disorders, 2020, 35(6):1 021-1 027.
[24] VAN DER.HEE B, WELLS J M.Microbial regulation of host physiology by short-chain fatty acids[J].Trends in Microbiology, 2021,29(8):700-712.
[25] TANG R Q, LI L J.Modulation of short-chain fatty acids as potential therapy method for type 2 diabetes mellitus[J].The Canadian Journal of Infectious Diseases & Medical Microbiology, 2021.DOI:10.1155/2021/9756586.
[26] VAN DER BEEK C,DEJONG C H C, TROOST F J, et al.Role of short-chain fatty acids in colonic inflammation, carcinogenesis, and mucosal protection and healing[J].Nutrition Reviews, 2017, 75(4):286-305.
[27] 杨开, 张雅杰, 张酥, 等.灵芝孢子粉低聚糖的制备及调节肠道菌群功能研究[J].食品与发酵工业, 2020, 46(9):37-42.
YANG K, ZHANG Y J, ZHANG S, et al.Preparation of ganoderma lucidum spore oligosaccharide and its regulation on gut microbiota[J]. Food and Fermentation Industries, 2020, 46(9):37-42.
[28] LU X, ZHANG Y, WU X T,et al.Effect of specific structure of lotus seed oligosaccharides on the production of short-chain fatty acids by Bifidobacterium adolescentis[J].Chinese Journal of Structural Chemistry, 2015, 34(4):510-522.
[29] TURRONI F, MILANI C, DURANTI S, et al.Deciphering bifidobacterial-mediated metabolic interactions and their impact on gut microbiota by a multi-omics approach[J].The ISME Journal, 2016, 10(7):1 656-1 668.