已有研究证明全麦食品能够有效地预防多种慢性病和代谢综合症[1]。全麦食品中含有大量矿物质、维生素和纤维素等营养物质,受到了全球食品行业主流营养价值观的推崇以及消费者的青睐,然而全麦食品却有质地坚硬、结构粗糙等缺点,严重影响了其风味和口感。这主要是因为麸皮破坏了面团各组分间的相互作用和完整的网络结构[1]。麦麸主要成分阿拉伯木聚糖,纤维素及与多糖交联的阿魏酸二聚体(约2.5 mg/g)带来了全麦食品的大部分生理活性[2]。因此为了提高全麦食品的口感和风味,对麦麸中阿拉伯木聚糖、阿魏酸、膳食纤维等有效成分在面制品中作用的研究是十分有必要的。
阿魏酰低聚糖(feruloylated oligosaccharides,FOs)作为麦麸的主要提取物,是由阿魏酸(ferulic acid,FA)通过酯键与木聚糖侧链上的阿拉伯糖残基连接的一类重要的水溶性低聚糖,兼具FA和低聚糖的生理活性,广泛存在于植物细胞壁中。自1982年FRY[3]从菠菜细胞壁中得到FOs之后,研究者们又陆续从麦麸、玉米皮、米糠、啤酒糟等农副产品中得到该物质。2010年,美国食品药品监督管理局以麦麸提取物的名义批准FOs作为食品添加剂。
阿拉伯低聚木糖(araboxylan,AXOs)和FA是FOs的有效生物活性成分。已有研究发现AXOs能显著抑制肿瘤细胞增殖,增强机体免疫[4],具有较强的双歧作用[5];由于FA具有抗氧化、抗肿瘤、抗血栓、降血脂及防止心血管疾病的功效,已被广泛应用于化妆品、保健品和食品添加剂等领域。有学者发现FOs对双歧杆菌的益生作用显著高于AXOs[6],此外,刘慧琳等[7]研究发现FOs能抑制荧光晚期糖基化终末产物(advanced glycation end products,AGEs)和羧甲基赖氨酸(carboxy methyl lysine, CML)的生成。然而,有研究发现不溶性AXOs能够破坏面筋网络结构[8],FA会降低面团的弹性和混合耐性[9];此外,ZHAO等[10]研究发现FOs抑制了优良焙烤特征性风味物质的形成,同时促进了糠醛等不良风味的形成。
环糊精包合物是一个或多个合适的客体分子全部或部分通过非共价键进入到环糊精空腔内部而形成的化合物,具有容易制备、水溶性良好、低毒性和低免疫原性的优点。WANG等[11]和CELEBIOGLU等[12]已经成功制备了FA与β-羟丙基环糊精(hydroxypropyl-β-cyclodextrin, HP-β-CD)的包合物,并提高了FA的溶解性和稳定性;CUNHA等[13]已经制备了阿魏酸乙酯-β-环糊精包合物,成功提高了阿魏酸乙酯的水溶性和药理效应。为改善FOs对面制品口感和风味的不良影响,本研究中FOs通过非共价键进入到HP-β-CD空腔形成FOs-HP-β-CD包合物,并研究FOs-HP-β-CD对面团品质、饼干美拉德反应及抗氧化活性的影响。
出芽短梗霉,中国普通微生物菌种保藏管理中心(CGMCC);麦麸、中筋面粉(11%蛋白质,1.6%脂肪,73.5%碳水化合物,30.4%湿面筋),江苏省盐城市;木聚糖、乙酸(HPLC级),源叶生物科技有限公司;甘氨酸、十二烷基硫酸钠(sodium dodecyl sulfate, SDS),德国BioFroxx公司;蛋白胨、大孔树脂、β-羟丙基环糊精、阿魏酸、乙醇、甲醇(HPLC级)、乙腈(HPLC级)、EDTA、5,5′-二硫代双(2-硝基苯甲酸)[5,5′-dithiobis-(2-nitrobenzoic acid),DTNB]、1,2-二氯苯、丙酮醛、3-脱氧葡萄糖醛酮、正己烷、正己烷、水杨酸、氯化亚铁、过氧化氢、DPPH、ABTS、过硫酸钾等等,国药集团化学试剂有限公司。
BXM-30R立式压力蒸汽灭菌器,上海博讯实业有限公司;H1850R 离心机,湖南湘仪实验室仪器开发有限公司;BS-2F振荡培养箱,金坛市杰瑞尔电器有限公司;FA1104电子天平,上海舜宇恒平科学仪器有限公司;UV752 N紫外可见分光光度计,上海佑科仪器仪表有限公司;SW-CJ-1D无菌操作台,江苏通泽器械有限公司;DNP电热恒温培养箱,上海金宏实验设备有限公司;高效液相色谱,安捷伦科技有限公司;真空冷冻干燥机,北京博医康实验仪器有限公司;CAR/PDMS固相微萃取头(75 mm),美国Supelco公司;气相-质谱联用,赛默飞世尔科技(中国)有限公司。
1.3.1 FOs的制备
50 g/L麦麸液:将烘干后的麦麸粉碎过60目筛,取50 g过筛麦麸于1 000 mL锥形瓶中,加入950 mL蒸馏水,用2%(体积分数)硫酸调至pH 5.5,然后将麦麸液在50 ℃水浴中保温2 h,待冷却至室温后,4 ℃贮藏备用。
发酵条件:10%(体积分数)出芽短梗霉菌液,50 g/L麦麸液,添加10 g/L木聚糖和1 g/L蛋白胨;在pH 7.0,28 ℃条件下发酵4 d,12 000 r/min离心5 min,取上清液于真空旋转蒸发仪40 ℃条件下浓缩后纯化。
分离纯化:添加50%(体积分数)乙醇沉淀发酵液去除非FOs沉淀,收集上清液,添加80%乙醇沉淀发酵液,收集沉淀物,溶解后用三氯乙酸除蛋白,再用醇沉、用热水(60~70 ℃)复溶,于真空旋转蒸发仪40 ℃浓缩后冷冻干燥;然后过大孔树脂层析柱,采用50%乙醇洗脱,收集洗脱液,真空旋转蒸发仪40 ℃浓缩后冷冻干燥。
1.3.2 FOs-环糊精包合物的制备
FOs-环糊精包合物制备工艺[11]:
6 g β-羟丙基环糊精(HP-β-CD)+1 g FOs→室温,黑暗环境搅拌6 h→光照环境搅拌12 h→过滤→冷冻干燥→FOs-HP-β-CD
1.3.3 FOs-环糊精包合物对面团的影响
(1)面团的制备
50 g面粉添加含50 mg FOs的包埋体,添加23 mL水,揉制面团。
(2)持水性[14]
在离心管中加入含FOs包埋体的面团5.0 g和15 mL蒸馏水,在37 ℃水浴振荡1 h以至面筋蛋白完全水合。然后将糊状物以6 000 r/min离心10 min,弃去上清液,称离心管和沉淀的质量。按公式(1)计算面筋蛋白的持水力:
持水性![]()
(1)
式中:m1,离心管质量;m2,沉淀质量;m3,样品质量。
(3)游离巯基的测定[15]
将1.3.3(1)中的面团样品在冷冻干燥机中冷冻干燥24 h,研磨过筛(60目),将上述过筛面筋粉(40 mg)与4 mL SDS-TGE溶液(10.4% Tris,6.9 g甘氨酸和1.2 g/L EDTA,2.5% SDS,pH 8.0)一起温育持续30 min,每10 min摇动1次。将该分散体系在4 ℃下于高速离心机中以8 000 r/min离心20 min,随后将上清液留下备用,将沉淀丢弃。取上清液1 mL于试管中,再加入4 mL 的SDS-TGE溶液,使待测体积为5 mL,在加入0.04 mL DTNB溶液。其中DTNB在TGE(4 mg/mL)中混合,并在25 ℃的水浴中温育30 min。用紫外分光光度计测定其吸光值,波长为412 nm,并将不含DTNB试剂的样品用作空白对照。实验重复2次。使用考马斯亮蓝法测定上清液的蛋白质浓度。根据公式(2)将吸光度值转换为游离巯基的含量:
游离硫基含量![]()
(2)
式中:73.53,消光系数,L/mol;A412,412 nm处的吸光度;D,上清液的稀释倍数;C,面筋蛋白的质量浓度,mg/mL。
(4)粉质特性[16]
循环水浴槽温度为30 ℃,300.0 g普通面粉,2.0 g FOs-HP-β-CD(含300 mg FOs),215 mL去离子水,收集面团的形成时间、稳定时间、面团稠度、弱化度及粉质指数的数据。
(5)质构特性[10, 16]
测试模式:破裂模式;测前速度:1.0 mm/s;测试速度:1.0 mm/s;测后速度:10 mm/s;下压距离:12 mm;触发力:5 g。
1.3.4 FOs-环糊精包合物对饼干品质的影响
(1)饼干的制备
实验根据GB/T 20980—2007《饼干(含第1号修改单)》中曲奇饼干的标准来制作,饼干配料见表1。
表1 饼干配料表
Table 1 Biscuit ingredients table
成分中筋面粉棉白糖盐蛋黄黄油FOs-HP-β-CD质量/g45012032个2703
(2)丙酮醛(methylglyoxal,MGO)和3-脱氧葡萄糖醛酮(3-deoxyglucosone,3-DG)的测定[19]
前处理:样品经过高速粉碎机粉碎成粉末状,取10 g饼干样品于50 mL的离心管中,加入20 mL正己烷,涡旋振荡2 min,在温度为4 ℃,转速为8 000 r/min条件下离心15 min,除去上清液,再加入20 mL正己烷,涡旋振荡2 min,在温度为4 ℃,转速为8 000 r/min 条件下离心15 min,除去上清液,将固体残渣置于通风橱内24 h,待正己烷全部挥发干后,称量剩余固体粉末质量。
准确称取上述处理好的样品2 g于50 mL的离心管中,加入7 mL的水振荡提取2 min,在4 ℃下离心10 min(10 000 r/min),转移上清液至15 mL的离心管中,分别向其中加入0.5 mL Carrez试剂Ⅰ和0.5 mL Carrez试剂Ⅱ,在4 ℃、转速为10 000 r/min条件下离心15 min,将上清液再次转移至15 mL的离心管中,分别向其中加入0.5 mL Carrez试剂Ⅰ和0.5 mL Carrez试剂Ⅱ,在4 ℃、转速为10 000 r/min条件下离心15 min,将上清液再次转移至15 mL的离心管中(含0.2 g样品),然后经衍生后采用HPLC测定。
衍生条件:选用邻苯二胺作为衍生试剂,准确移取上述上清液1 mL,加入邻苯二胺衍生试剂(60 mg/mL水溶液)50 μL于EP管中,在60 ℃水浴反应30 min,然后用0.22 μm水系微孔滤膜过滤,等待HPLC测定。
HPLC色谱条件:流动相:0.1%(体积分数)醋酸(B)和甲醇(A),采用二元高压梯度洗脱,具体程序如下:0~10 min,8% B~40% B;10~12 min,40% B~48% B;12~13 min,48% B~60% B;13~15.5 min,60% B~80% B;15.5~20.5 min,80% B;20.5~25.5 min,80% B~45% B;25.5~30.5 min,45% B~8% B;流速:0.8 mL/min;进样量:20 μL;柱温:25 ℃;检测波长:313 nm。
(3)褐变指数
饼干提取物的制备:2.0 g饼干粉末样品中,加入15 mL甲醇涡旋3 min 后,超声提取2 min,4 ℃,12 000 r/min离心10 min。过0.22 μm微孔滤膜备用。
褐变指数[17]:波长420 nm处的吸光度能反映样品中类黑素的含量,因此测定美拉德反应产物在420 nm处的吸光度值(A420)来表征饼干的褐变指数。
(4)荧光AGEs含量测定
荧光光谱特性AGEs含量测定[10]:光电倍增管电压设定为650 mV,狭缝宽度为5 nm,分别于激发波长325 nm/发射波长440 nm处测定荧光AGEs含量,激发波长370 nm/发射波长440 nm测定糖基化胶原含量,激发波长325 nm/发射波长 434 nm测定N-甲酰犬尿氨酸含量。通过公式(3)计算FOs对荧光总AGEs、糖基化胶原、N-甲酰犬尿氨酸的抑制率[20]:
抑制率![]()
(3)
式中:A0,未加FOs空白对照组样品荧光响应值;A1,样品组荧光响应值。
(5)感官评定
随机邀请20位大学生组成饼干感官评定小组,按照表2感官评分标准给不同组别饼干打分。
表2 感官评定打分标准
Table 2 The scoring criteria for sensory assessment

评定项目评分标准评分色泽不匀称,有明显异色,有焦糊、过白现象1~5色泽色泽基本匀称,略有异色,无过焦、发白等现象6~15呈金黄色,色泽匀称,无过焦,发白现象16~20断面结构呈无孔状,形态不规则,厚薄不均匀1~5形态断面结构呈有孔状,细密,无大孔洞,形态较规则,厚薄较均匀6~15断面结构呈多孔状,细密,无大孔洞,形态规则,厚薄均匀16~20香味淡,有异味1~5风味气味较芳香,无明显异味,6~15醇厚芳香,无异味16~20过甜或无甜味,较硬,粘牙1~5口感甜度较适中,较酥脆,口溶性较好,不粘牙6~15甜度适中,酥脆,口溶性好,不粘牙16~20
1.3.5 FOs-环糊精包合物对体外抗氧化活性的影响
清除羟自由基[21]:取上述样品溶液1 mL,加入1 mL 6 mmol/L水杨酸溶液(无水乙醇配制)、1 mL 6 mmol/L FeCl2溶液、1 mL蒸馏水和1 mL 6 mmol/L H2O2溶液,混合均匀,37 ℃水浴反应30 min,反应结束后用酶标仪测定其在510 nm处的吸光值,每隔5 min测定1次,共测8次。按公式(4)计算样品溶液对羟自由基的清除率:
羟自由基清除率![]()
(4)
式中:A1,样品吸光度值;A2,蒸馏水代替FeCl2溶液所测得的吸光值;A3,甲醇代替样品溶液所测得的吸光值。
清除DPPH自由基[22]:取上述样品溶液100 μL,加入100 μL 0.5 mmol/L DPPH溶液(用95%乙醇配制),混合均匀,室温下避光反应10 min。反应结束后酶标仪测定其在517 nm处的吸光度。按公式(5)计算DPPH自由基的清除率:
DPPH自由基清除率![]()
(5)
式中:B1,样品吸光度值;B2,95%乙醇代替DPPH溶液的吸光值;B3,甲醇代替样品的吸光值。
清除ABTS阳离子自由基[22]:用pH=7.4的磷酸缓冲液配制6 mmol/L ABTS溶液,加入过量过硫酸钾反应后过滤,制成ABTS储备液,使用时用磷酸缓冲液稀释使其在734 nm处吸光值为0.70±0.02。向96孔板中加入20 μL样品溶液与180 μL ABTS溶液,充分混匀避光反应10 min,在734 nm 测吸光值,空白为200 μL磷酸缓冲液的吸光值。按公式(6)计算ABTS阳离子自由基清除率:
ABTS阳离子自由基清除率![]()
(6)
式中:C0,ABTS溶液的吸光值;Ci,样品的吸光值。
结果均以平均值±方差的形式表示,每组实验重复测定3次,采用Graphpad Prism7作图,IBM SPSS Statistics 5进行数据分析。
2.1.1 持水力
面团持水力是指在不施加任何外力的情况下面团结合的水量。本研究中,FOs对面团的持水力有显著的影响,如图1-a所示,FOs显著降低了面团的持水力,这可能是FOs破坏了面筋结构,而添加FOs-HP-β-CD面团的持水力相较于未包埋FOs提高了5.91%,并且与空白面团的持水力没有显著性差异,而与FOs组具有显著性差异。这些结果表明,环糊精包合物能有效降低FOs对面团持水力的破坏作用(P<0.05)。
2.1.2 巯基含量
面团中游离巯基含量反映面筋蛋白聚合程度的重要指标,与面筋蛋白二硫键含量的变化呈负相关[15]。司晓静等[8]认为AXOs较大的空间位阻和物理缠结作用减少了面筋蛋白分子链上的巯基相互之间的接触机会,导致二硫键无法形成,从而提高了游离巯基的含量。本研究发现添加全麦面粉相对含量FOs显著提高了面团的游离巯基含量,而添加FOs-HP-β-CD面团的游离巯基与空白组不存在显著性差异,并且相较于未包埋FOs面团的游离巯基减少了11.82%(图1-b)。这些结果表明,FOs能显著增加面团的游离巯基,从而导致二硫键无法形成,该研究结果与KOH等[9]报道的FA可减少硬质面粉蛋白质交联,并释放不溶于SDS的高分子质量蛋白质的结果一致。李翠翠等[15]研究发现二硫键的减少可直接导致面片中水分子的流动性变大,不可冻结水百分比呈显著下降趋势。结合李翠翠等的研究,发现FOs对面团持水力和游离巯基的影响具有一致性。
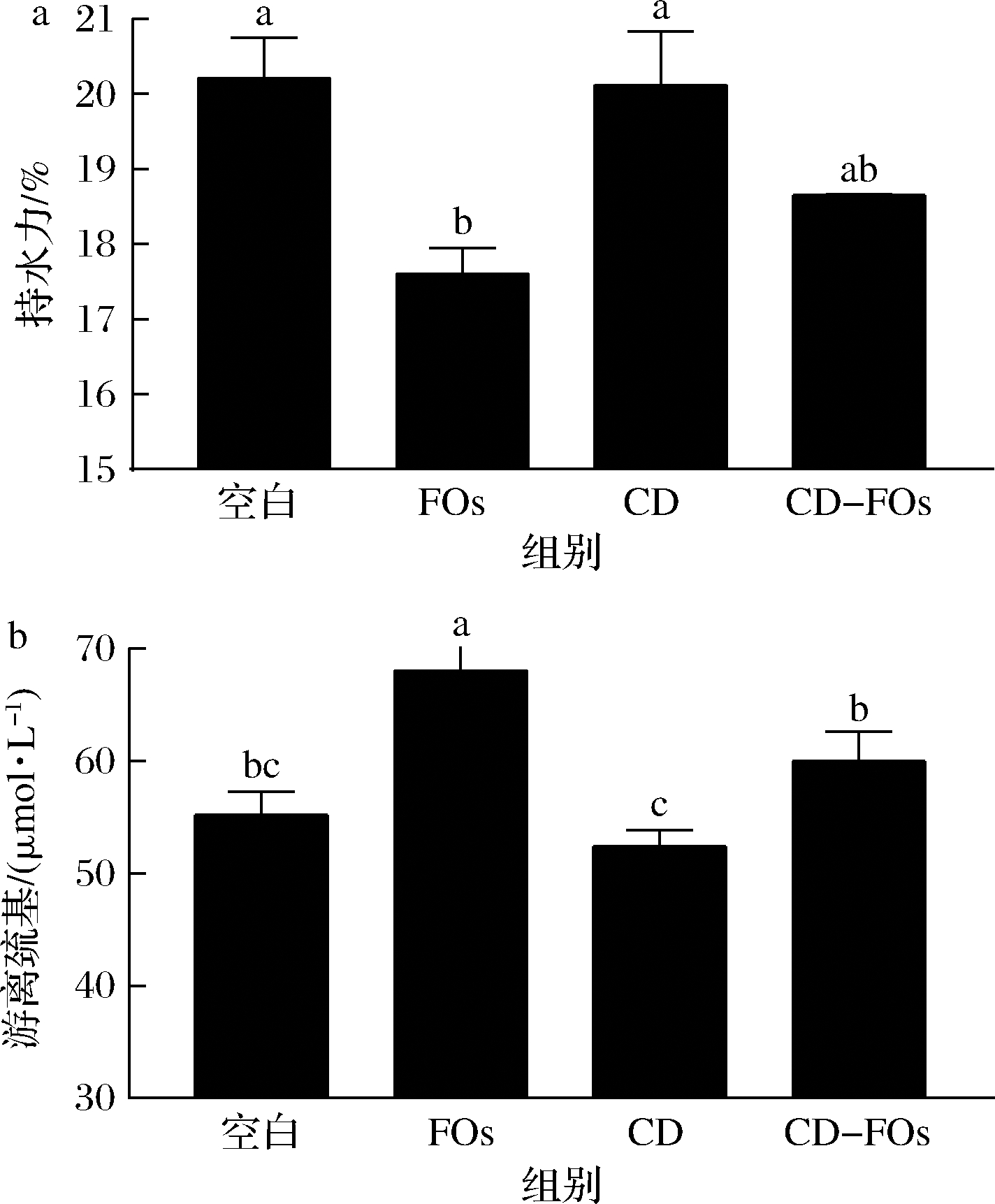
a-持水力;b-游离巯基
图1 FOs-HP-β-CD对面团持水力和游离巯基的影响
Fig.1 Effect of FOs-HP-β-CD on water-holding
capacity and free sulfhydryl groups in dough
注:不同小写字母表示数据有显著差异(P<0.05)(下同)
2.1.3 粉质特性
面团的形成时间反映了面筋蛋白网络形成的速度,稳定时间反映了面团的耐搅拌能力,面团的稳定时间越长,耐揉混能力越强;面团的弱化度反映了面团调制过程中面筋网络受机械搅拌被破坏的程度,其数值越大,表明面团的面筋越弱;质量指数指粉质曲线从加水初始至达到最大稠度并衰降30 FU处时间轴坐标长度[23]。潘志琴[23]发现FA降低了面团的形成时间和稳定时间,提高了面团的弱化度;本研究发现FOs也能降低面团的形成时间和稳定时间,提高面团的稠度和弱化度,使面团的粉质质量指数降低;而添加FOs-HP-β-CD面团的形成时间、稳定时间和质量指数相对未包埋FOs面团都增加,面团稠度和弱化度相对降低。由此推测,FOs破坏了面筋蛋白网络结构,使面团发黏,而FOs-HP-β-CD克服了FOs对面团粉质特性和面团网络结构所造成的不良影响,对面团的粉质特性有较好的保持效果。
表3 FOs-HP-β-CD对面团粉质特性的影响
Table 3 Effect of FOs-HP-β-CD on farinose quality in dough

粉质特性面团形成时/min面团稳定时间/min面团稠度/FU弱化度/FU质量指数/mm空白4.5±0.1bc4.6±0.01c511.5±5.5a68.5±1.5a85.5±3.5cFOs3.9±0.2a3.95±0.35a531.5±8.5c81±3c67±3aCD4.65±0.15c4.65±0.05c514.5±6.5ab70±1ab82.5±0.5bcCD-FOs4.05±0.05a4.3±0.1b526±7bc77.5±2.5c77.5±1.5b
注:不同字母表示数据间有显著性差异(P<0.05,n=3)(下同)
2.2.1 褐变指数
芳香化合物、色素化合物、AGEs和类黑素都是还原糖的羰基与游离氨基酸、肽和蛋白质的氨基间发生美拉德反应末期产生的美拉德反应产物;类黑精是美拉德反应产生的一类棕色含氮化合物,具有抗氧化、抗肿瘤、抗菌、抗炎、降糖、降血压等多种生理活性,在波长420 nm左右的紫外光谱吸收最大,是咖啡、可可、面包、麦芽和蜂蜜等食物呈褐色的主要原因[29]。因此美拉德反应产物的褐变指数常用OD420来表示[17]。KOCADAGH等[24]和黄俊卿[25]发现FOs会增加烘焙过程中还原糖浓度,从而通过焦糖化作用导致褐变反应增强;本研究发现未包埋FOs的饼干褐变指数与空白组相比显著提高,而添加FOs-HP-β-CD的饼干褐变指数与未包埋FOs饼干相比降低了34.33%,并与FOs饼干有显著性差异,与空白饼干没有显著性差异(P<0.05,n=3)(图2-a)。黄俊卿发现10 mg/g的FOs可导致饼干严重褐变[25],此本研究结果一致,由此推测FOs促进了美拉德反应过程中类黑素的产生,而FOs-HP-β-CD可以抑制FOs对类黑素产生的促进作用。
2.2.2 α-二羰基化合物
有研究表明,α-二羰基化合物如MGO和3-DG 因能够导致蛋白质糖基化而造成细胞的损害,产生AGEs,会引起细胞毒性,造成细胞损伤,损伤蛋白质、核苷酸等人体功能成分的生物活性,进而导致糖尿病及人体的衰老[26]。姚胜文等[18]发现添加0.1%的FOs对MGO和3-DG的最大抑制率分别达66%和62.9%[18];本研究发现FOs显著降低了饼干中3-DG和MGO含量,相对于空白对照分别降低了20.66%和22.33%,FOs-HP-β-CD对3-DG和 MGO的抑制率分别达到了37.75%和40.38%,结合姚胜文等[18]的研究推断FOs能够抑制美拉德反应中间产物α-二羰基化合物的产生,FOs-HP-β-CD保留了FOs抑制α-二羰基化合物生成的作用(P<0.05,n=3)(图2-b)。
2.2.3 AGEs
AGEs是美拉德反应伴生危害产物之一,大致可以分为三大类:有荧光的交联AGEs如糖基化胶原、戊糖素、N-甲酰犬尿氨酸等;没有荧光的交联AGEs如精氨酸-赖氨酸咪唑复合物;既没有荧光也没有交联的AGEs如羧甲基赖氨酸等。本研究发现全麦面粉相对含量FOs对N-甲酰犬尿氨酸、糖基化胶原以及总荧光AGEs具有显著抑制作用,分别达到了30.83%、23.99%和12.40%,FOs-HP-β-CD对N-甲酰犬尿氨酸、糖基化胶原以及总荧光AGEs的抑制效果并没有显著降低,分别为33.54%、26.28%和13.27%(P<0.05,n=3)(图2-c)。黄俊卿[25]研究发现10 mg/mL的玉米皮FOs对饼干总AGEs、二酪氨酸、犬尿氨酸和 N -甲酰犬尿氨酸的荧光强度分别降低80%、97%、56%和86%;高汪磊[28]研究发现0.5 mg/mL的青稞FOs在牛血清白蛋白-葡萄糖模拟体系中对糖基化胶原和总AGEs的抑制率分别为44.11%和71.67%,在蛋白非酶糖基化模拟体系中对糖基化胶原和总AGEs的抑制率分别为50.94%和90.05%。本研究结果与上述两位研究者的研究结果一致,并且FOs可以显著抑制α-二羰基化合物MGO和3-DG的生成,由此推断FOs可以通过抑制二羰基化合物的生成而抑制AGEs的形成,而环糊精并没有减弱FOs对α-二羰基化合物和AGEs的抑制作用。
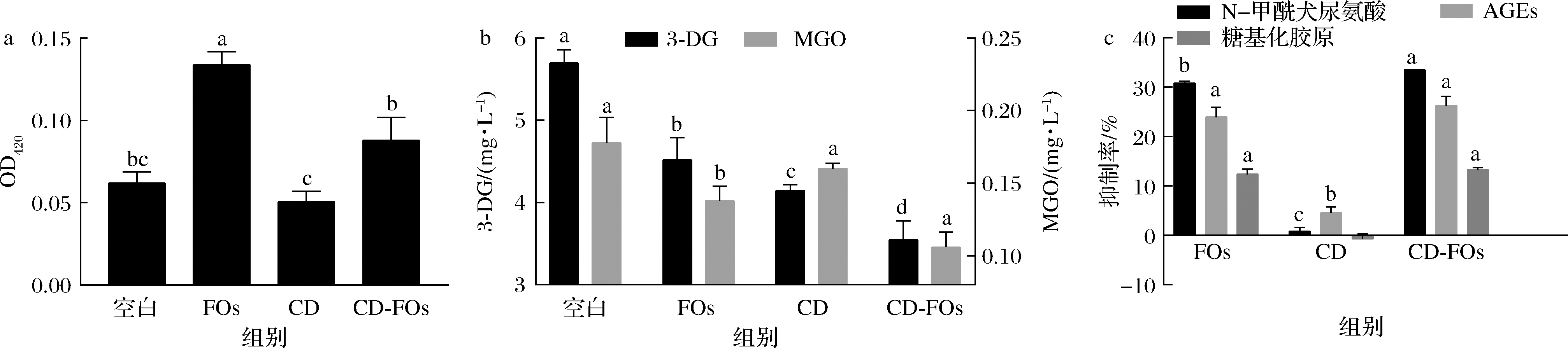
a-褐变指数;b-α-二羰基化合物;c-晚期糖基化终末产物
图2 FOs-HP-β-CD对饼干褐变指数、α-二羰基化合物和晚期糖基化终末产物的影响
Fig.2 Effects of FOs-HP-β-CD on browning index, α-dicarbonyl compounds and advanced glycation end products in biscuits
2.2.4 感官评价
由对色泽、形态、风味与口感等综合评分及最终得到的感官评分可知,未包埋FOs的饼干色泽、形态、风味与口感的评分均略低于空白对照饼干的分值,并且色泽、风味与口感的得分均与空白对照组有显著性差异;而添加FOs-HP-β-CD饼干的色泽、形态、风味与口感的评分均高于未包埋FOs的饼干,并且与空白对照组没有显著性差异;本研究发现添加FOs-HP-β-CD的饼干相对于未包埋FOs的饼干能显著提高饼干的感官特性(P<0.05,n=3)(表4)。
表4 FOs-HP-β-CD对饼干感官评价的影响(n=18)
Table 4 Effect of FOs-HP-β-CD on sensory evaluations
in biscuits
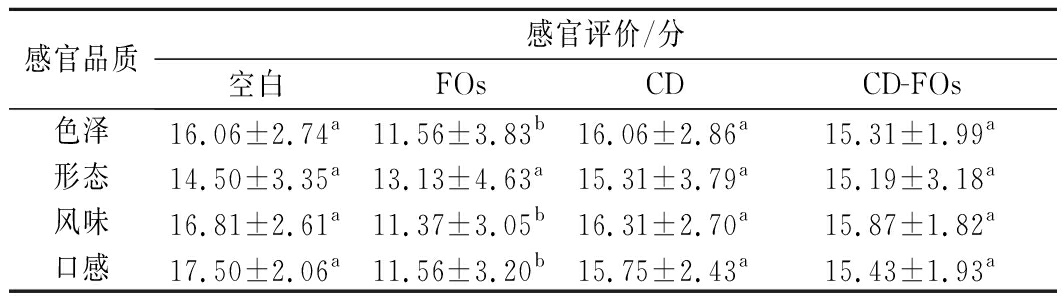
感官品质感官评价/分空白FOsCDCD-FOs色泽16.06±2.74a11.56±3.83b16.06±2.86a15.31±1.99a形态14.50±3.35a13.13±4.63a15.31±3.79a15.19±3.18a风味16.81±2.61a11.37±3.05b16.31±2.70a15.87±1.82a口感17.50±2.06a11.56±3.20b15.75±2.43a15.43±1.93a
已有研究发现FOs具有强抗氧化活性,宋春艳[27]发现FOs对羟自由基、超氧阴离子自由基和DPPH自由基都具有较好的清除能力,且清除作用均高于FA和低聚木糖。EC50值表示抑制率为50%时的底物浓度,由表5可知,FOs-β-HP-CD、FOs和维生素C这3种底物的DPPH自由基清除率、ABTS阳离子自由基清除率和羟自由基清除率的EC50都是维生素C<FOs<FOs-β-HP-CD(FOs-β-HP-CD质量浓度以FOs相对质量浓度计算),虽然FOs-β-HP-CD有很强的体外抗氧化活性,但是其EC50大于未包埋FOs,这可能是环糊精包合物的缓释作用造成的。王丽平[30]研究发现阿魏酸-β-环糊精包合物在蒸馏水环境中300 min的阿魏酸的释放率只有10%左右。本研究发现未包埋FOs饼干的羟自由基清除率、DPPH自由基清除率和ABTS阳离子自由基清除率分别较空白饼干升高了13.65%、12.70%和19.15%,添加FOs-β-HP-CD饼干的羟自由基清除率、DPPH自由基清除率和ABTS阳离子自由基清除率分别较空白饼干升高了10.97%、13.41%和23.45%(P<0.05,n=3)(图3)。由此可见,FOs-β-HP-CD饼干释放了FOs的抗氧化活性。
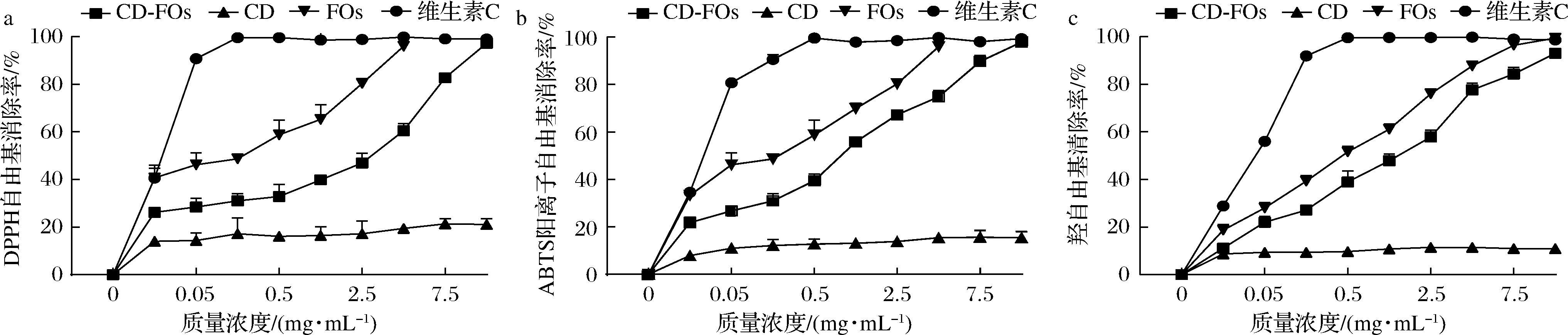
a-DPPH自由基清除率;b-ABTS阳离子自由基清除率;c-羟自由基清除率
图3 FOs-HP-β-CD对饼干体外抗氧化活性的影响
Fig.3 Effects of FOs-HP-β-CD on antioxidant activity in biscuits in vitro
表5 EC50值
Table 5 EC50 vaule

本文研究了FOs-HP-β-CD对面团持水力、巯基含量和粉质特性等理化特性的影响,以及其对焙烤面制品的褐变指数、α-二羰基化合物、晚期糖基化终末产物、挥发性成分以及感官评价等的影响。结果显示,FOs-HP-β-CD比未包埋FOs面团的持水力和粉质特性显著提高,游离巯基含量明显降低;此外,FOs-HP-β-CD 饼干中类黑素含量明显低于未包埋FOs,色泽、形态、风味与口感等感官评价得分也升高了。此外,FOs-HP-β-CD保留了FOs抑制焙烤制品α-二羰基化合物和AGEs含量的作用,同时,FOs-HP-β-CD保留了FOs的抗氧化等营养功能。本研究通过环糊精包埋降低了麦麸提取物FOs对面制品口感和风味的影响,并保留了FOs的抗氧化等生理活性,为今后FOs在面制品中的应用以及全麦食品的开发奠定基础。
[1] KHALID K H, OHM J B, SIMSEK S.Whole wheat bread:Effect of bran fractions on dough and end-product quality[J].Journal of Cereal Science, 2017, 78:48-56.
[2] 吴青兰. 脱皮率对小麦粉、面团及馒头品质的影响[D].杨凌:西北农林科技大学, 2019.
WU Q L.Effect of debranning degrees on the quality of wheat flour, dough and steamed bread[D].Yangling:North West Agriculture and Forestry University, 2019.
[3] FRY S C.Phenolic components of the primary cell wall.Feruloylated disaccharides of D-galactose and L-arabinose from spinach polysaccharide[J].Biochemical Journal, 1982, 203(2):493-504.
[4] 宋春艳, 李彦林, 张蔚, 等.源于啤酒糟的阿魏酰低聚糖组成及其抗氧化活性分析[J].食品工业科技, 2019, 40(9):1-5;12.
SONG C Y, LI Y L, ZHANG W, et al.Composition and antioxidant activity analysis of feruloyl oligosaccharides produced from brewer′s grains[J].Food Industry Science and Technology, 2019, 40(9):1-5;12.
[5] SINGH R D, BANERJEE J, ARORA A.Prebiotic potential of oligosaccharides:A focus on xylan derived oligosaccharides[J].Bioactive Carbohydrates and Dietary Fibre, 2015, 5(1):19-30.
[6] CHEN Z Y, LI S S, FU Y F, et al.Arabinoxylan structural characteristics, interaction with gut microbiota and potential health functions[J].Journal of Functional Foods, 2019, 54:536-551.
[7] 刘慧琳, 陈晓默, 倪天鸿, 等.麦麸提取物对晚期糖基化终产物的抑制研究[J].现代食品科技, 2017, 33(7):50-55.
LIU H L, CHEN X M, NI T H, et al.Stunhibitory effect of wheat bran extract on the advanced glycation end products[J].Modern Food Science and Technology, 2017, 33(7):50-55.
[8] 司晓静, 钱海峰, 李言, 等.水不溶性阿拉伯木聚糖及其酶解物对面筋蛋白特性的影响[J/OL].食品与发酵工业, 2021.DOI:10.13995/j.cnki.11-1802/ts.025819.
SI X J, QIAN H F, LI Y, et al.Effects of water-unextracted arabinoxylan and its hydrolysates on the properties of gluten proteins[J/OL].Food and Fermentation Industries,2021.DOI:10.13995/j.cnki.11-1802/ts.025819.
[9] KOH K B, PERRY K W N.Effects of ferulic acid and transglutaminase on hard wheat flour dough and bread[J].John Wiley & Sons, Ltd, 2009, 86(1):18-22.
[10] ZHAO Q Z, YAO S W, OU S Y.Maillard volatiles in baked products as affected by feruloylated oligosaccharides from maize bran[J].Taylor & Francis, 2017, 20(12):3 266-3 273.
[11] WANG J, CAO Y, SUN B, et al.Characterisation of inclusion complex of trans-ferulic acid and hydroxypropyl-β-cyclodextrin[J].Food Chemistry, 2011, 124(3):1 069-1 075.
[12] CELEBIOGLU A, UYAR T.Development of ferulic acid/cyclodextrin inclusion complex nanofibers for fast-dissolving drug delivery system[J].International Journal of Pharmaceutics, 2020, 584:119395.
[13] CUNHA F V M, DO NASCIMENTO CALDAS TRINDADE G, DA SLIVA AZEVEDO, et al.Ethyl ferulate/β-cyclodextrin inclusion complex inhibits edema formation[J].Materials Science & Engineering C, 2020, 115:111057.
[14] HU H, FAN X, ZHOU Z, et al.Acid-induced gelation behavior of soybean protein isolate with high intensity ultrasonic pre-treatments[J].Ultrason Sonochem, 2013, 20(1):187-195.
[15] 李翠翠, 陆啟玉, 张晶晶.面粉中二硫键含量对面片水分分布状态的影响[J].中国食品学报, 2018, 18(7):129-135.
LI C C, LU Q Y, ZHANG J J.Effect of disulfide bond content in flour on surface water distribution[J].Journal of Chinese Institute of Food Science and Technology, 2018, 18(7):129-135.
[16] 冯佳. 魔芋葡甘露聚糖对小麦面团性质和结构的影响[D].天津:天津科技大学, 2019.
FENG J.Effect of konjac glucomannanon the properties and structure of wheat dough[D].Tianjin:Tianjin University of Science and Technology, 2019.
[17] 崔和平. 美拉德反应中间体的水相制备及其加工风味形成规律研究[D].无锡:江南大学,2019.
CUI H P.Study on the regularity of aqueous preparation of maillard reaction intermediates and its formation of processing flavors[D].Wuxi:Jiangnan University, 2019.
[18] 姚胜文, 赵倩竹, 鲜傲霜, 等.低聚糖阿魏酸酯对美拉德反应挥发性产物的影响[J].现代食品科技, 2016, 32(3):113-118;203.
YAO S W, ZHAO Q W, XIAN A S, et al.Effect of feruloylated oligosaccharides on the volatile products of maillard reaction[J].Modern Food Science and Technology, 2016, 32(3):113-118;203.
[19] 刘红. 微波焙烤条件对饼干品质的影响及美拉德有害产物的控制研究[D].天津:天津科技大学, 2017.
LIU H.Study on the effects of microwave baking conditions on the quality of cookies and the control of hazardous products of maillard reaction[D].Tianjin:Tianjin University of Science and Technology, 2017.
[20] 许良元, 朱灵, 张龙, 等.荧光光谱技术在晚期糖基化终末产物中的应用[J].压电与声光, 2010, 32(2):186-190.
XU L Y, ZHU L, ZHANG L, et al.Application of fluorescence spectrum technology in the detecting for advanced glycation endproducts[J].Piezoelectrics & Acoustooptics, 2010, 32(2):186-190.
[21] 张芯蕊. 微波焙烤对藜麦功能特性及其应用的影响研究[D].杨凌:西北农林科技大学, 2018.
ZHANG X R.Study on the effects of microwave baking on functional properties and application of chenopodium quinoa[D].Yangling:North West Agriculture and Forestry University, 2018.
[22] 程璐. 曲奇中美拉德反应伴生危害物及其控制技术研究[D].杭州:浙江大学, 2014.
CHENG L.Studies on maillard reaction-derived hazards and their control technology in a cookie system[D].Hangzhou:Zhejiang University, 2014.
[23] 潘志琴. 漆酶协同阿魏酸对小麦面团微观结构及冻藏稳定性的影响机制[D].广州:华南理工大学, 2019.
PAN Z Q.Effect of laccase and ferulic acid on the microstructure and frozen stability of wheat dough[D].Guangzhou:South China University of Technology, 2019.
[24] KOCADAGH T, ![]() S, TAS N G L , et al.Formation of α-dicarbonyl compounds in cookies made from wheat, hull-less barley and colored corn and its relation with phenolic compounds, free amino acids and sugars[J].European Food Research Technology, 2016, 42(1):51-60.
S, TAS N G L , et al.Formation of α-dicarbonyl compounds in cookies made from wheat, hull-less barley and colored corn and its relation with phenolic compounds, free amino acids and sugars[J].European Food Research Technology, 2016, 42(1):51-60.
[25] 黄俊卿. 玉米皮低聚糖阿魏酸酯对糖尿病大鼠症状的缓解作用及其机制研究[D].广州:暨南大学, 2018.
HUANG J Q.Investigation of anti-diabetic mechanism of maize bran feruloylated oligosaccharides on diabetic rats[D].Guangzhou:Jinan University, 2018.
[26] 黄启瑞. 甜香型美拉德模拟反应体系中风味物质与α-二羰基化合物的生成及其关联性研究[D].无锡:江南大学, 2016.
HUANG Q R.Study on the relevance and generation of flavor substances and α-dicarbonyl compounds in the sweet maillard reaction model systems[D].Wuxi:Jiangnan University, 2016.
[27] 宋春艳. 酶法制备阿魏酰低聚糖的研究[D].无锡:江南大学, 2019.
SONG C Y.Study on enzymatic preparation of feruloyl oligosaccharides[D].Wuxi:Jiangnan University, 2019.
[28] 高汪磊. 青稞麸皮中阿魏酰糖酯的分离提取及其抗糖化作用研究[D].杭州:浙江大学, 2015.
GAO W L.Extraction feruloyl oligosaccharides from tibetan hull-less barley bran and the study of antiglycation activities[D].Hangzhou:Zhejiang University, 2015.
[29] WANG H Y, QIAN H, YAO W R.Melanoidins produced by the maillard reaction:Structure and biological activity[J].Food Chemistry, 2011, 128(3):573-784.
[30] 王丽平. 阿魏酸-β-环糊精包合物制备及带鱼保鲜研究[D].杭州:浙江大学,2018.
WANG L P.Prenaration of ferulic acid-β-cyclodextrin inclusion complexes and preservation for hairtail(Trichurus lenturus)[D].Hangzhou:Zhejiang University, 2018.