植物蛋白是人类不可缺少的的蛋白质来源之一,常被作为蛋白大分子乳化剂应用于食品工业中来提高食品的营养价值和品质,对产品的食用性能和加工性能都有一定的影响[1]。紫苏是一种药食两用型植物资源,在我国种植面积广阔,资源丰富。紫苏籽主要被用来提取紫苏油,提油后的紫苏粕常被用作饲料或者肥料,紫苏粕中含有28%~45%的蛋白质。紫苏蛋白是一种良好的蛋白质资源,富含多种功能性氨基酸,必需氨基酸组成复合FAO与WHO规定的标准[2]。目前,关于紫苏蛋白的提取工艺及蛋白组分的功能性质报道比较常见,而对于紫苏蛋白的应用以及技术开发方面的研究较少。HE等[3]采用响应面法优化了具有功能特性的紫苏分离蛋白的超声辅助提取工艺参数。ZHAO等[4]分别采用热压、冷压和溶剂萃取的方法提取紫苏分离蛋白,研究其结构和功能性质以及在Pickering乳液中的应用。王楠等[5]通过对碱溶酸沉法提取的紫苏分离蛋白、南瓜籽分离蛋白和大豆分离蛋白对比发现,紫苏分离蛋白溶解性、乳化性及泡沫稳定性均高于其他2种蛋白。刘宁等[6]对紫苏蛋白组分及功能性质研究,发现紫苏分离蛋白热变性温度较高,球蛋白乳化性和乳化稳定性较好。
本文对紫苏脱脂粉采用osbome法提取紫苏球蛋白,对其乳化性进行研究后将其应用于水包油(oil in water,O/W)乳液,研究紫苏球蛋白质量浓度对乳液稳定性的影响。以期为紫苏蛋白的高附加值利用提供有价值的依据。
紫苏籽,西安风吹麦浪农产品技术开发有限公司;紫苏油,市售;盐酸(分析纯),天津红岩化学试剂有限公司;氢氧化钠(分析纯),天津大茂化学试剂厂;十二烷基磺酸钠(分析纯),生工生物工程(上海)有限公司;硼酸、浓硫酸、1,2-丙二醇(分析纯),天津天力化学试剂有限公司。
LE204E分析天平,奥豪斯仪器设备有限公司;PHS-3C雷磁pH计,上海仪电仪器股份有限公司;JH-1恒温水浴锅、JJ-1精密増力电动搅拌器,上海浦东物理光学仪器公司;FD-1D-50冷冻干燥机,青岛永合创信科技有限公司;FA25-D高速剪切分散乳化机,上海佛鲁克科技有限公司;H-1850R高速离心机,长沙市离心机仪器有限公司;AH1500高压均质机,德祥科技有限公司;2000激光粒度分析仪、NANO-ZS90纳米粒度表面电位分析仪,英国Malvern公司;K9840半自动凯氏定氮仪,济南海能仪器股份有限公司。
1.3.1 紫苏球蛋白提取
利用粉碎机将紫苏籽粉碎后过60目筛,取一定量紫苏粉于烧杯加入3倍质量石油醚(沸程:60~90 ℃)室温搅拌30 min,重复数次至石油醚变为无色,紫苏粉于通风橱挥干残留石油醚,过80目筛即得紫苏脱脂粉。根据GB 5009.5—2016的方法测定其蛋白质含量。
紫苏球蛋白的制备参考osborne法[7]分级提取和吴颖等[8]的方法,紫苏籽脱脂粉中加入1∶13(g∶mL)的去离子水充分搅拌2 h,4 ℃条件下8 000 r/min离心15 min,弃去上清液。沉淀用1%(质量分数)的NaCl溶液以1∶13(g∶mL)混合溶解搅拌2 h,4 ℃条件下8 000 r/min离心15 min,重复3次合并上清液,上清液流动水透析2 d,纯净水透析1 d后冻干即得紫苏球蛋白。
1.3.2 蛋白质溶解性测定
蛋白质溶解性的测定参考XU等[9]的方法。取0.5 g(m1)清蛋白、球蛋白和分离蛋白分别溶解于50 mL 蒸馏水中,分别调节蛋白分散液的pH值为2~9,室温条件下磁力搅拌1.5 h后5 000 r/min速度离心15 min,上清液定容到100 mL,采用考马斯亮蓝的方法测定上清液中的蛋白质含量(m2),按照公式(1)计算蛋白质的溶解度。
溶解度![]()
(1)
式中:m1,原蛋白质质量,g;m2,上清液蛋白质质量,g。
1.3.3 乳化活性及乳化稳定性测定
参考SUI等[10]的方法,配制的蛋白溶液分成8等份,每份15 mL,分别调节pH值为2~9,向每份蛋白质分散液中加入5 mL大豆油,在20 000 r/min的均质速度下均质1 min,从试管底部吸取50 μL均质完的乳液,用质量分数为0.1%的SDS稀释100倍,用分光光度仪在500 nm处比色。乳化活性(m2/g)和乳化稳定性(min)根据公式(2)、公式(3)计算:
乳化活性![]()
(2)
乳化稳定性![]()
(3)
式中:DF表示乳状液稀释倍数,DF=100;C表示蛋白质量浓度,g/mL;φ表示光程,φ=0.01 m;θ=0.25;均质后0和10 min时的吸光度值分别用A0和A10表示。
1.3.4 乳状液制备
分别称取一定质量的紫苏球蛋白溶于10 mmol/L pH 7的磷酸缓冲液中,25 ℃搅拌3 h确保蛋白质充分溶解,水化过夜,得到蛋白质量浓度为2.5、5.0、7.5、10.0、12.5 g/L的蛋白分散液,再次调pH值至7,向每一份蛋白浓度分散液中加入10%(体积分数)的紫苏油,搅拌1 h,以60 MPa压力均质2次得到不同蛋白质量浓度的新鲜乳状液。
1.3.5 粒径分布、乳状液絮凝、凝结指数测定
参考SARKAR等[11]的方法,采用马尔文激光粒度分析仪分析测定乳状液的粒径。测定参数设如下:通用模式;颗粒的折射率为1.520;分散剂折射率为1.330;泵的转速为2 050 r/min,分别测定乳滴在去离子水和1% SDS中的粒径分布及体积平均粒径d4,3。絮凝指数和凝结指数的测定参考TANG等[12]的方法,计算如公式(4)、公式(5)所示:
絮凝指数![]()
(4)
凝结指数![]()
(5)
式中:d4,3-水和d4,3-SDS分别表示乳状液在水和1% SDS分散剂中体积平均粒径;d4,3(24 h)和d4,3(0 h)分别表示乳液在放置0和24 h测定的体积平均粒径(1% SDS分散剂)。
1.3.6 ζ-电位测定
采用马尔文纳米粒度表面电位测定仪对乳状液ζ-电位进行测定。测定前先用10 mmol/L pH 7的磷酸缓冲液将样品稀释100倍。测定条件如下:测量温度为25 ℃,平衡时间为1 min,每个样品测定3次,取平均值。
1.3.7 界面蛋白含量及浓度测定
参考邓欣伦[13]的方法,取50 g新鲜乳状液于离心管中,采用高速离心机以10 000 r/min速度离心30 min,离心温度设为4 ℃,离心后样品分离成上下2层,上层为乳析层,下层为清液层,用针管收集下层清液,采用凯氏定氮仪测定下层清液中的蛋白质含量(N×5.3),计算过程如公式(6)、(7)所示:
界面蛋白含量![]()
(6)
(7)
式中:Γ表示界面蛋白浓度,mg/m2;Ctotal表示初始乳状液中的蛋白质质量浓度,g/L;Cserum表示下层清液层中蛋白质量质浓度,g/L;A表示液滴的比表面积,m2/g。
1.3.8 脂肪上浮率测定
取一定量的乳状液于试管中,加入3滴2%的叠氮钠,样品于室温下贮藏14 d,静置的条件下定期观察乳状液总高度(cm)和清液层的高度(cm),根据如下公式计算脂肪上浮率,计算过程如公式(8)所示:
脂肪上浮率![]()
(8)
1.3.9 贮存稳定性测定
对方法1.2.8中贮存的乳液定期进行拍照,记录乳液的宏观变化。
1.3.10 数据处理
实验数据取3次测量平均值,采用Excel处理数据,SPSS statistics 26软件比较结果平均值之间的显著性差异,Origin 8.5进行绘图。
对紫苏脱脂粉进行蛋白含量进行测定,发现其蛋白含量较高,为32.5%。对紫苏脱脂粉分级提取得到紫苏球蛋白含量为13.9%。课题组前期在对紫苏籽不同蛋白组分功能性质研究中发现紫苏球蛋白热变性温度为104.58 ℃,分别由5~10、20、25和45 kDa 的4种组分组成,其含有人体所需的8种必需氨基酸和其他多种氨基酸。
蛋白质的溶解度对其功能性质有很大影响,主要受pH、离子强度、温度和溶剂类型等因素影响[14]。图1为紫苏球蛋白的溶解性-pH曲线,可以看出紫苏球蛋白溶解性随pH变化呈现U型曲线。当pH偏离等电点时,球蛋白溶解性逐渐增大;当pH在等电点附近时,溶解性都比较低。球蛋白在pH 4时的溶解性低于pH值为5时的溶解性,这可能与球蛋白酸性亚基和碱性亚基的比例不同有关[15]。
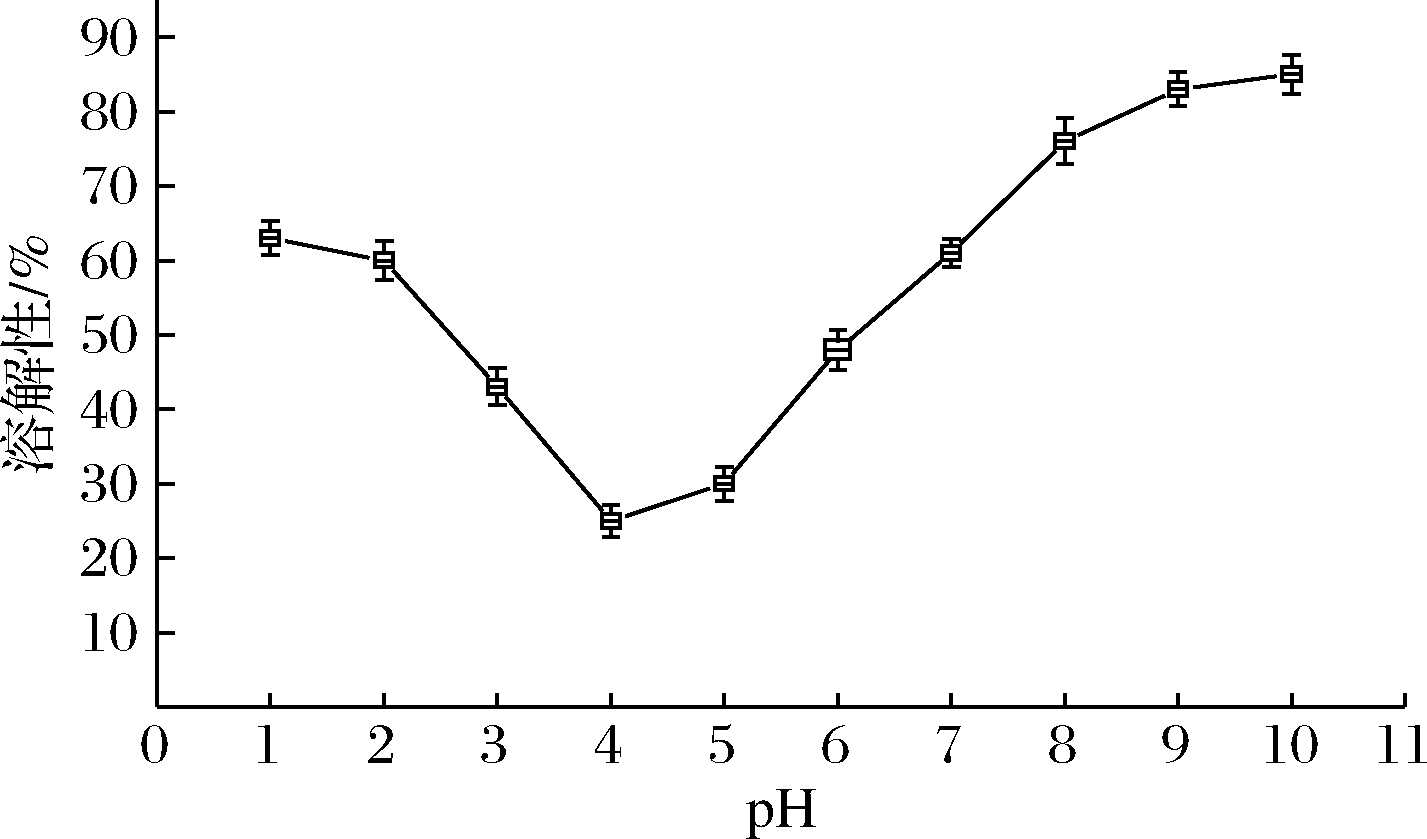
图1 紫苏球蛋白质溶解性-pH曲线
Fig.1 Solubility pH curve of Perilla frutescens
乳化活性是蛋白质乳化特性评定的重要指标,通过单位质量所能稳定的油水界面面积来表征蛋白质促进油水混合形成乳状液的能力。乳化稳定性表示乳状液处于稳定状态而不发生相分层或分离现象的特征[16]。紫苏球蛋白乳化活性和乳化稳定性结果如图2所示,乳化活性-pH结果与乳化稳定性-pH结果均表现出相似的U型曲线。当pH为4时,球蛋白乳化活性和乳化稳定性最低,为 25.2 m2/g和16.5 min。当pH偏离等电点时,紫苏球蛋白乳化活性及乳化稳定性迅速增加。
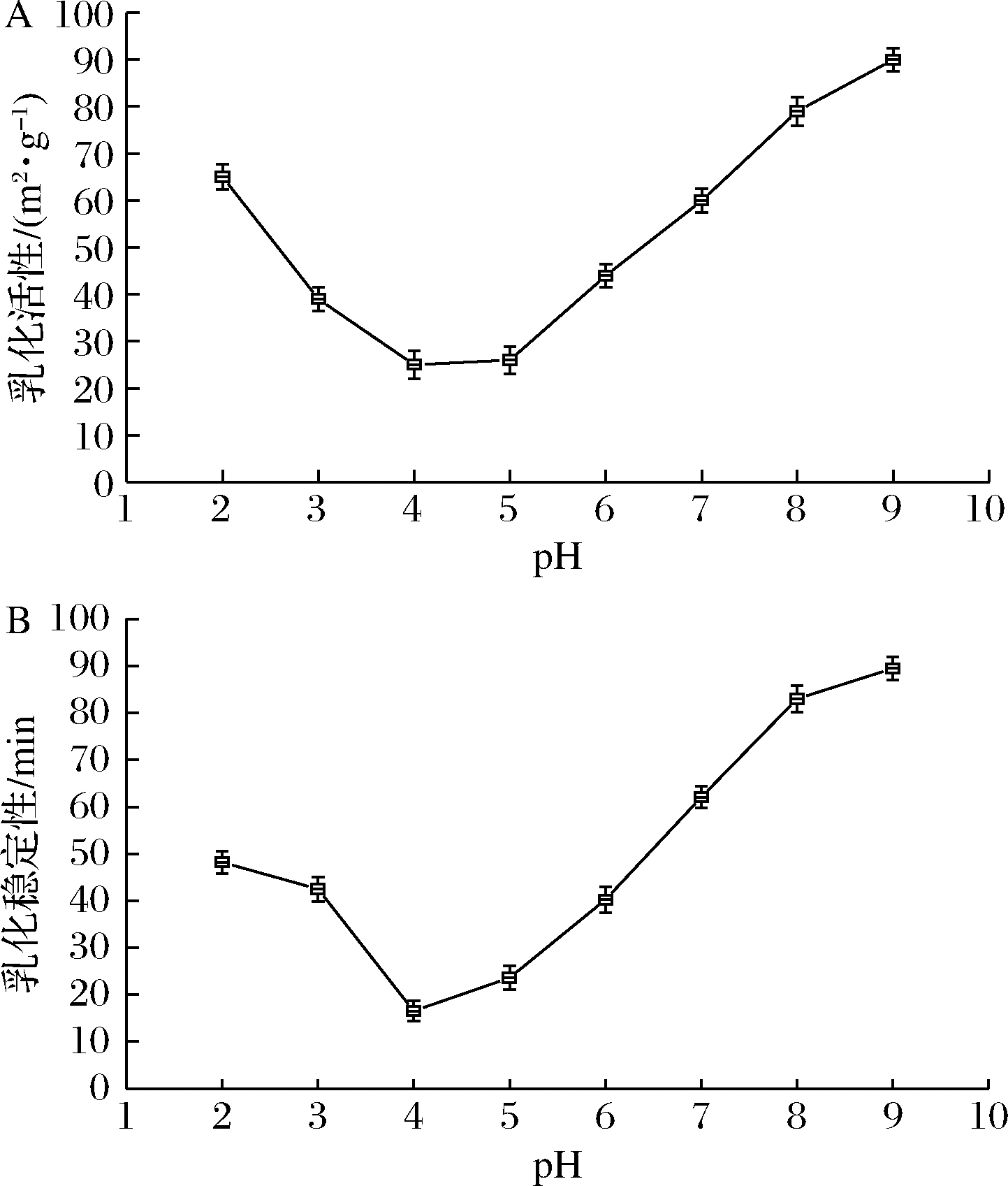
A-乳化活性;B-乳化稳定性
图2 紫苏球蛋白乳化活性-pH和乳化稳定性-pH结果
Fig.2 Emulsifying activity pH and emulsifying stability
pH results of Perilla globulin
乳液液滴在分散液介质中的分布情况如图3所示,图3-A和图3-B分别为0和24 h时紫苏球蛋白乳液在水介质中的粒径分布;图3-C和图3-D分别0和24 h时紫苏球蛋白乳液在1% SDS中的粒径分布。随着蛋白质量浓度的增加,乳状液的粒径分布趋向于更小的粒径分布。乳液在1%SDS中的粒径表示乳化剂帮助油滴在水中的分散能力,乳液液滴的体积平均粒径越小说明蛋白质乳化能力越好[17]。随着蛋白质量浓度的增大,乳液液滴粒径分布图均有向更小粒径方向迁移的趋势。乳液在水中的粒径分布能够反映乳液油滴絮凝体的粒径大小分布情况,不同紫苏球蛋白浓度的乳液液滴均出现不同程度的絮凝。
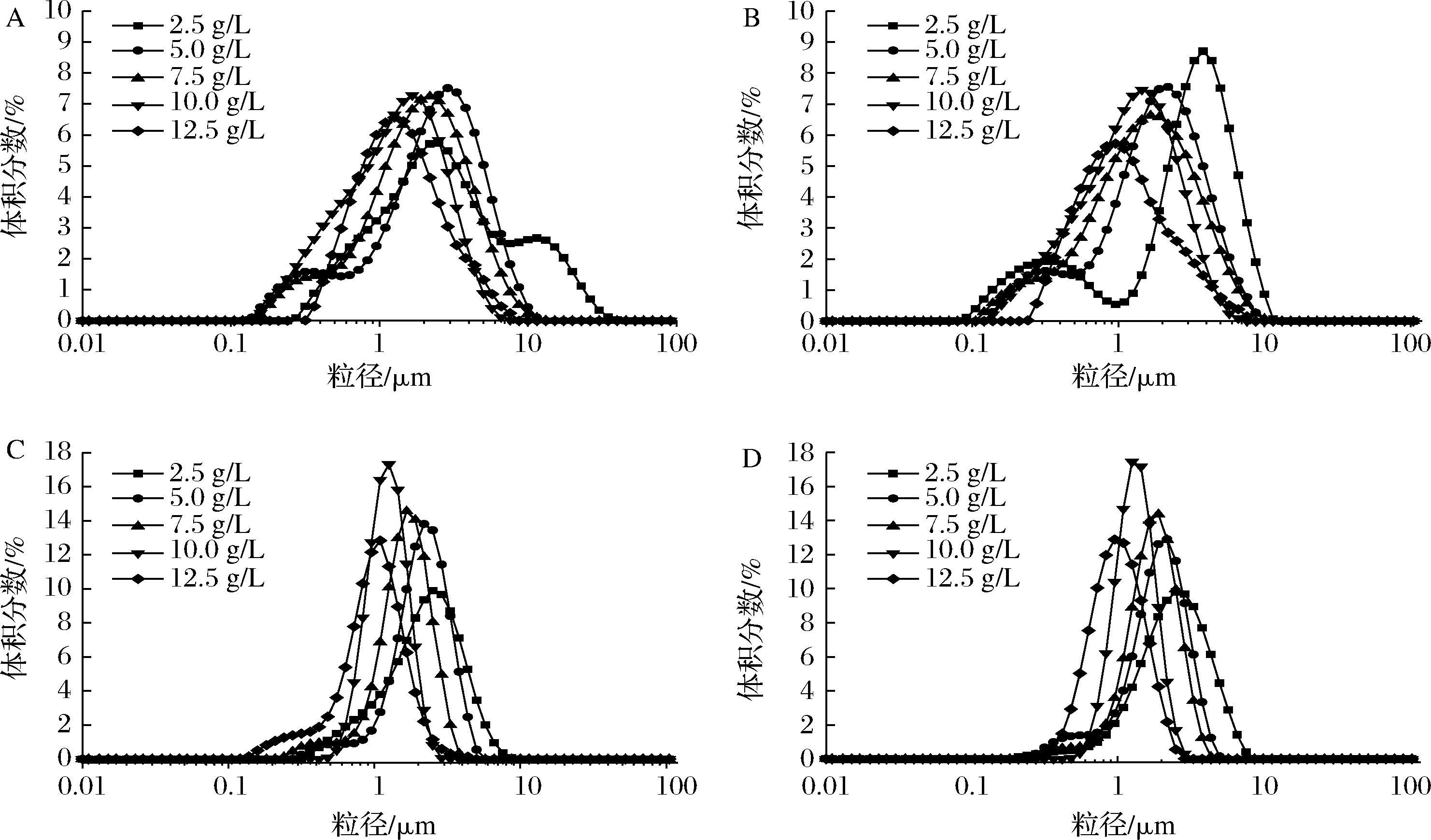
A-0 h;B-24 h水介质;C-0 h,1%SDS;D-24 h,1%SDS
图3 不同紫苏球蛋白浓度的O/W乳液的粒径分布
Fig.3 Particle size distribution of O/W emulsion with different Perilla globulin concentration
乳液的稳定性可以用0和24 h的絮凝指数和24 h的凝结指数表征。表1为不同紫苏球蛋白浓度的O/W乳液的粒径大小、絮凝指数和凝结指数结果(P<0.05)。乳状液在水中的粒径为液滴絮凝体的大小,蛋白质量浓度为2.5 g/L时,乳液絮凝体粒径和液滴粒径最大,随着蛋白质量浓度增大,乳液液滴粒径逐渐减小;乳液在1%SDS中的粒径小于在水中的粒径,这是因为SDS为抗絮凝剂,能够阻止乳状液油滴的絮凝[18]。24 h乳液液滴较0 h时均发生不同程度增大,说明乳液在贮存过程中发生了一定程度的聚结;随着蛋白,浓度的增大,乳液的絮凝指数(0、24 h)和凝结指数都呈现减小的趋势,絮凝指数变化较大,0 h时从82.8%下降到10%,24 h时从81.5%下降到7.6%;凝结指数变化较小,从103%下降到99%,乳状液在贮存过程中,液滴的絮凝现象和凝结现象一般同步发生。
表1 不同紫苏球蛋白浓度的O/W乳液乳化特性:液滴粒径,絮凝指数,凝结指数,界面吸附蛋白含量和界面蛋白浓度
Table 1 Emulsification properties of different Perilla globulin O/W emulsions:droplet size, flocculation
index and coagulation index, content and concentration of interfacial protein

蛋白质量浓度/(g·L-1)体积平均粒径/μm絮凝指数凝结指数界面蛋白0 h24 h水1%SDS水1%SDS0 h24 h24 h含量/%浓度/[mg·(m2)-1]2.55.54a3.03a5.68a3.13a82.8a81.5a103a19.2e0.71e5.03.87b2.65b3.96b2.68b46.0b47.7b101ab22.6d1.09d7.52.59c2.27c2.57c2.29c14.1c12.7c101ab28.3c1.21c10.01.27d1.15d1.25d1.17d7.6de6.8de99ab33.7b1.58b12.51.12e1.06e1.18de1.14de10.0d7.6d100ab37.5a1.83a
注:同列不同字母表示差异显著(P<0.05)
乳液液滴表面的电荷量用ζ-电位表征,ζ-电位绝对值大小决定乳状液的液滴间的排斥力强弱,ζ-电位对乳状液的物理稳定性具有非常重要的作用[19]。不同紫苏球蛋白质量浓度的O/W乳液的ζ-电位如图4所示(P<0.05),当蛋白质量浓度为2.5~12.5 g/L时,乳状液的ζ-电位为-25.9~33.9 mV。随紫苏球蛋白质量浓度增大,乳液ζ-电位值逐渐减小,绝对值逐渐增大。

图4 不同紫苏球蛋白浓度的O/W乳液ζ-电位
测定结果
Fig.4 Determination of zeta potential of O/W emulsion with
different Perilla globulin concentratio
注:不同小写字母代表差异显著(P<0.05)
乳液界面蛋白含量和界面蛋白浓度是反映乳状液稳定性的一个重要参数指标[11]。不同紫苏球蛋白质量浓度O/W乳液界面蛋白含量和界面蛋白浓度如表2所示(P<0.05),随着蛋白质量浓度增大,界面蛋白含量和浓度随之增大,在蛋白质量浓度为2.5~12.5 g/L时,乳液界面蛋白含量从19.2%增加到37.5%,界面蛋白浓度从0.71 mg/m2增加到1.98 mg/m2。一般情况下,界面蛋白浓度越高,乳液的抗凝结性就越好,紫苏球蛋白浓度从2.5 g/L增大到 12.5 g/L时,有更多的蛋白质吸附到油水界面,增加了乳状液液滴界面的黏弹特性[20]。这与粒径、絮凝及凝结指数结果相印证。
水相和油相的密度差异会导致乳液出现脂肪上浮现象,脂肪上浮率是乳液油相与连续相所达到的一种平衡比例的稳定性指标[21]。图5为不同紫苏球蛋白质量浓度O/W乳液在贮存14 d内的脂肪上浮率结果。紫苏球蛋白质量浓度为2.5~7.5 g/L的乳状液在贮存1 d时就发生了明显的脂肪上浮现象,蛋白质量浓度为2.5 g/L的乳状液在贮存4 d时脂肪上浮率达到最大值,蛋白质量浓度为5.0和7.5 g/L的乳状液均在贮存8 d时乳状液脂肪上浮率达到最大值,蛋白质量浓度为10.0和12.5 g/L的乳状液在整个14 d的贮存过程中几乎未发生脂肪上浮现象。这是因为在蛋白质量浓度较高条件下,蛋白质具有更好的乳化能力,更多的蛋白质吸附到乳状液油滴界面,形成的乳状液的液滴就越小,对乳状液的贮存过程中的脂肪上浮具有抑制作用[22]。
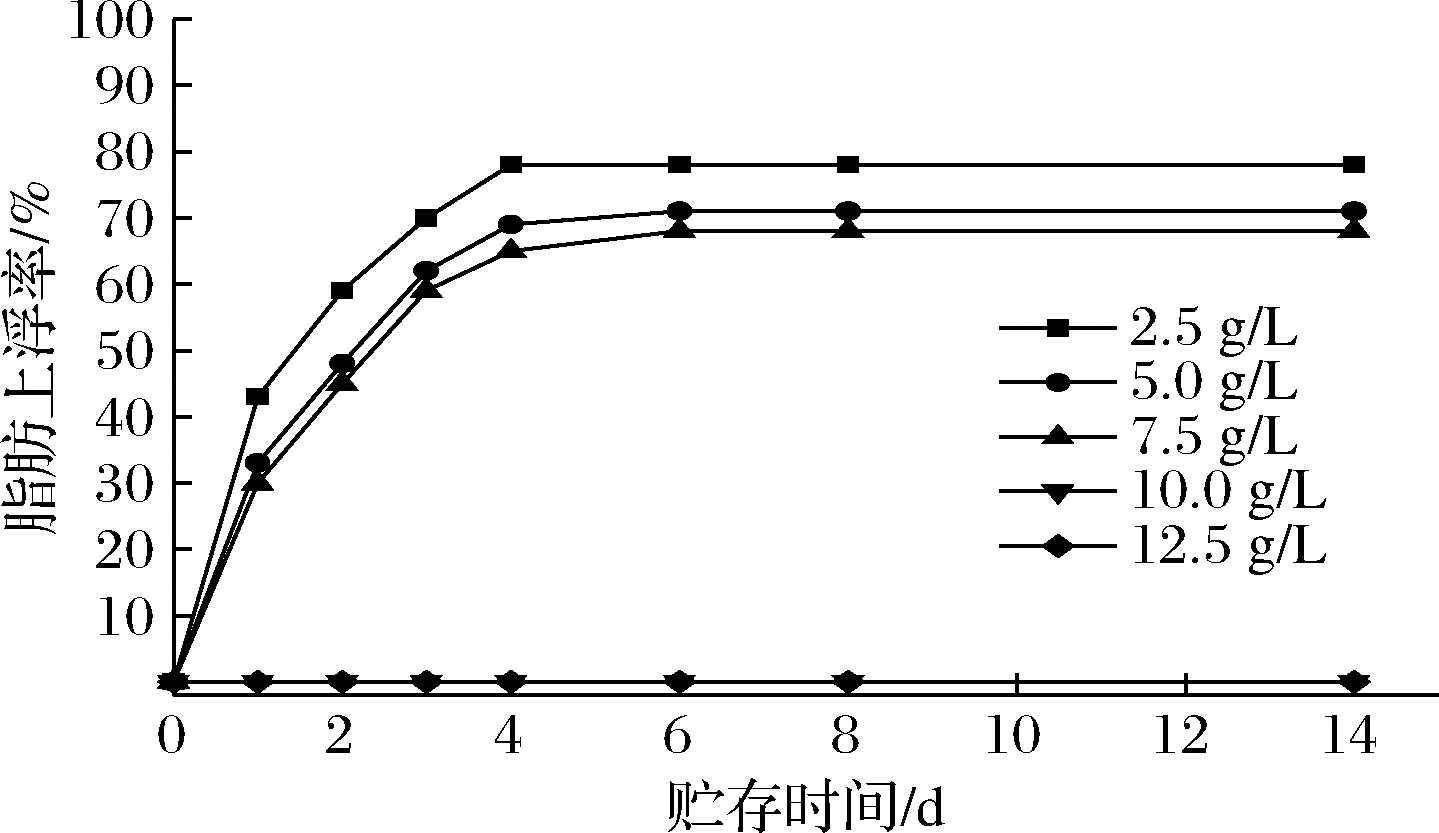
图5 不同紫苏球蛋白浓度的O/W乳液的脂肪上浮率结果
Fig.5 Results of fat floating rate of O/W emulsion with
different Perilla globulin concentration
不同紫苏球蛋白浓度O/W乳液的贮存稳定性结果如图6所示。图6-A为乳液贮存0 d时的结果;图6-B为乳液贮存14 d的结果。当乳液贮存14 d时,蛋白质量浓度为2.5、5.0、7.5 g/L的乳液发生了明显的分层现象,蛋白质量浓度为10.0和12.5 g/L的乳液未发生分层,这可能是因为蛋白含量低于10 g/L时,较大乳液液滴由于发生重力分层或者聚结现象失稳。界面蛋白含量较低,形成的蛋白界面膜界面张力较大,容易发生破裂,液滴之间相互结合形成更大的乳状液液滴,最终不断聚集结合使乳液失稳发生脂肪上浮[23]。

A-0 d;B-14 d
图6 不同紫苏球蛋白浓度的O/W乳液的贮存稳定性结果
Fig.6 Storage stability of O/W emulsion with different
Perilla globulin concentration
紫苏脱脂粉中球蛋白质含量较高,其溶解性、乳化活性和乳化稳定性随pH变化均呈现U型曲线;对紫苏秋蛋白质量浓度为2.5~12.5 g/L的O/W乳液研究发现,随紫苏球蛋白质量浓度增大,乳液粒径、絮凝指数、凝结指数均逐渐减小,界面蛋白含量和浓度增加;在14 d贮存过程中,低于7.5 g/L球蛋白质量浓度的乳液均发生脂肪上浮现象,10.0 g/L以上紫苏球蛋白质量浓度的乳液贮存稳定性良好。
[1] KIM W, WANG Y, SELOMULYA C.Dairy and plant proteins as natural food emulsifiers[J].Trends in Food Science & Technology, 2020, 105:261-272.
[2] 贾青慧,沈奇,陈莉.紫苏籽蛋白质与氨基酸的含量测定及营养评价[J].食品研究与开发,2016,37(10):6-9.
JIA Q H,SHEN Q, CHEN L.The content determination and nutritional evaluation of Perilla seed protein and amino acids[J].Food Research and Development, 2016, 37(10):6-9.
[3] HE D L, ZHANG Z J, LI H Z, et al.Optimizing functional properties of Perilla protein isolate using the response surface methodology[J].Food Science and Technology, 2020, 38(2):348-355.
[4] ZHAO Q L, WANG L F, HONG X, et al.Structural and functional properties of Perilla protein isolate extracted from oilseed residues and its utilization in Pickering emulsions[J].Food Hydrocolloids, 2020, 113:106412.
[5] 王楠,冯志彪.两种油料蛋白制备及其功能性研究[J].中国油脂,2012,37(3):18-22.
WANG N, FENG Z B.Preparation and functional properties of two kinds of oilseed protein[J].China Oils and Fats, 2012,37(3):18-22.
[6] 刘宁,赵佳,武选民,等.紫苏籽中不同蛋白组分的功能性质研究[J].中国油脂,2019,44(6):45-49.
LIU N, ZHAO J, WU X M, et al.Functional properties of different protein components from Perilla seed[J].China Oils and Fats, 2019, 44(6):45-49.
[7] DENG Y J, HUANG L X, ZHANG C H.et al.Chinese quince seed proteins:Sequential extraction processing and fraction characterization [J].Journal of Food Science and Technology, 2020, 57(2):764-774.
[8] 吴颖,王啸,邱树毅,等.响应面法优化苦荞麦盐溶性球蛋白提取工艺研究[J].中国酿造,2020,39(7):192-196.
WU Y, WANG X, QIU S Y, et al.Optimization of extraction technology of salt-soluble globulin from Tartary buckwheat by response surface methodology[J].China Brewing, 2020, 39(7):192-196.
[9] XU R, ZHENG L, SU G W, et al.Protein solubility, secondary structure and microstructure changes in two types of undenatured type II collagen under different gastrointestinal digestion conditions [J].Food Chemistry, 2021, 343:128555.
[10] SUI X N, BI S, QI B K, et al.Impact of ultrasonic treatment on an emulsion system stabilized with soybean protein isolate and lecithin:Its emulsifying property and emulsion stability[J].Food Hydrocolloids, 2017, 63:727-734.
[11] SARKAR A, KAMARUDDIN H, BENTLEY A, et al.Emulsion stabilization by tomato seed protein isolate:Influence of pH, ionic strength and thermal treatment[J].Food Hydrocolloids, 2016, 57(1):160-168.
[12] TANG Y R, GHOSH S.Stability and rheology of canola protein isolate-stabilized concentrated oil-in-water emulsions [J].Food Hydrocolloids, 2021, 113:106399.
[13] 邓欣伦.核桃蛋白—多糖界面相互作用及其对乳浊液性质影响的研究[D].广州:华南理工大学,2016.
DENG X L.Walnut protein-polysaccharide interactions at the oil/water interface:Effect on the properties of emulsion[D].Guangzhou:South China University of Technology, 2016.
[14] KIM T K, YONG H I, JEONG C H, et al.Technical functional properties of water- and salt- soluble proteins extracted from edible insects[J].Food Science of Animal Resources, 2019, 39(4):643-654.
[15] 舒文涛,耿臻,李金花,等.大豆7 s球蛋白β-伴大豆球蛋白亚基的氨基酸序列分析[J].中国农学通报,2018,34(26):48-51.
SHU W T, GENG Z, LI J H, et al.Amino acid sequence analysis of 7s globulin (β-conglycinin) of soybean[J].Chinese Agricultural Science Bulletin, 2018, 34(26):48-51.
[16] VALDEZ-HURTADO S, ![]() L S, HIGUERA-BARRAZA O A, et al.Effect of ultrasonication time on the functional properties of giant squid (Dosidicus gigas) mantle protein concentrate[J].Food Bioscience, 2018, 27:1-5.
L S, HIGUERA-BARRAZA O A, et al.Effect of ultrasonication time on the functional properties of giant squid (Dosidicus gigas) mantle protein concentrate[J].Food Bioscience, 2018, 27:1-5.
[17] WEI X L, LI J, EID M, et al.Fabrication and characterization of emulsions stabilized by tannic acid-wheat starch complexes[J].Food Hydrocolloids, 2020, 107:105728.
[18] ERDMANN M E, LAUTENSCHLAEGER R, ZEEB B, et al.Effect of differently sized O/W emulsions loaded with rosemary extract on lipid oxidation in cooked emulsion-type sausages rich in n-3 fatty acids[J].LWT-Food Science and Technology, 2017, 79:496-502.
[19] DECKER E A, MCCLEMENTS D J, BOURLIEU-LACANAL C, Hurdles in predicting antioxidant efficacy in oil-in-water emulsions[J].Trends in Food Science & Technology, 2017, 67:183-194.
[20] HAN S W, SONG H Y, MOOM T W, et al.Influence of emulsion interfacial membrane characteristics on Ostwald ripening in a model emulsion[J].Food Chemistry, 2018, 242:91-97.
[21] WEI Y, XIE Y P, CAI Z X, et al.Interfacial rheology, emulsifying property and emulsion stability of glyceryl monooleate-modified corn fiber gum [J].Food Chemistry, 2021, 343:128416.
[22] CHEN E M, WU S, MCCLEMENTS D J, et al.Influence of pH and cinnamaldehyde on the physical stability and lipolysis of whey protein isolate-stabilized emulsions[J].Food Hydrocolloids, 2017, 69:103-110.
[23] SARKAR A, KAMARUDDIN H, BENTLY A, et al.Emulsion stabilization by tomato seed protein isolate:Influence of pH, ionic strength and thermal treatment[J].Food Hydrocolloids,2016, 57:160-168.