随着我国人民生活水平的提高,调理肉制品正逐渐成为我国肉类消费的主流[1-2]。调理肉制品在贮藏过程中所含水分和肌原纤维蛋白质会不断流失[2-3],失去肉制品原本的弹性和保水能力,导致蛋白质的冷冻变性[3]。如何在冷冻过程中保证肉制品的营养价值,是亟待解决的难题[4]。目前,在冷冻肉品中加入抗冻保护剂是抑制肉制品蛋白质冷冻变性的方法之一。一般情况下,抗冻保护剂可以有效溶解冰晶,阻断冰晶生长,防止肌原纤维蛋白功能和结构的改变,减少产品品质劣变,提高食品贮藏品质[5]。
应用较为广泛的抗冻保护剂主要包括四大类:糖类抗冻保护剂、蛋白类抗冻保护剂、盐类抗冻保护剂和多酚类抗冻保护剂[5]。DU等[6]研究鸡皮胶原蛋白水解物对分离的肌动球蛋白的冷冻变性具有显著的保护作用。![]() 等[7]研究发现海藻糖和麦芽糖对水洗牛肉的肌原纤维蛋白的功能稳定性具有保护作用。YANG等[8]研究发现经过山梨醇、蔗糖和三聚磷酸钠混合物处理过的猪肉的抗冻效果较好。尽管抗冻保护剂均在一定程度上提升了冷冻肉制品的抗冻性能,但是仍存在不可忽视的缺点,例如,大多数的糖类抗冻保护剂会给肉品带来一定的甜味,影响感官的测定;盐类抗冻保护剂的能力略低于糖类,且不利于肉品凝胶的形成;多酚类抗冻保护剂具有很强的抗氧化能力,但其抗冻机理仍然存在许多假说,无法确定其对食品的抗冻保护作用[5-7]。牛皮胶原蛋白是一种蛋白质水解物,属于蛋白类抗冻保护剂的一种,相比于其他类别的抗冻保护剂,具有高效无污染特点,可以有效地抑制冰晶的生长和再结晶、保护蛋白质的冷冻变性,具有绿色环保、价格便宜等优势。牛皮胶原蛋白可以作为天然的绿色的抗冻保护剂[5]。
等[7]研究发现海藻糖和麦芽糖对水洗牛肉的肌原纤维蛋白的功能稳定性具有保护作用。YANG等[8]研究发现经过山梨醇、蔗糖和三聚磷酸钠混合物处理过的猪肉的抗冻效果较好。尽管抗冻保护剂均在一定程度上提升了冷冻肉制品的抗冻性能,但是仍存在不可忽视的缺点,例如,大多数的糖类抗冻保护剂会给肉品带来一定的甜味,影响感官的测定;盐类抗冻保护剂的能力略低于糖类,且不利于肉品凝胶的形成;多酚类抗冻保护剂具有很强的抗氧化能力,但其抗冻机理仍然存在许多假说,无法确定其对食品的抗冻保护作用[5-7]。牛皮胶原蛋白是一种蛋白质水解物,属于蛋白类抗冻保护剂的一种,相比于其他类别的抗冻保护剂,具有高效无污染特点,可以有效地抑制冰晶的生长和再结晶、保护蛋白质的冷冻变性,具有绿色环保、价格便宜等优势。牛皮胶原蛋白可以作为天然的绿色的抗冻保护剂[5]。
目前,国内外对于抗冻保护剂的研究大多停留在定性描述的能力分析,且处于传统抗冻保护剂的应用阶段,对于新型蛋白质水解物抗冻保护剂研究尚未进行深入研究。本文针对调理牛肉饼在冷冻期间的变化进行深入研究,测定其水分和肌原纤维蛋白等含量变化,探究抗冻剂牛皮胶原蛋白对调理牛肉饼中水分和肌原纤维蛋白质的保护能力,为调理牛肉饼冷冻期间品质评价提供理论依据。
选取牛后腿肉作为主要原料,采用保鲜膜包装,4 ℃ 保存。
牛皮胶原蛋白,西安卓瑞生物科技有限公司;Tris-maleate,雷根生物;氯化钾、氯化钙,天津市大茂化学试剂厂;ATP粉剂、偏钼酸铵,上海山浦化工有限公司;高氯酸,烟台市双双化工有限公司;钼酸铵,徐州天鸿化工有限公司;双缩脲法试剂盒,南京建成生物工程研究所。
BSA224S-CW电子天平,赛多利斯科学仪器(北京)有限公司;HH-4数显恒温水浴锅、JI-1精密增力电动搅拌器、国华电器有限公司;752 N紫外可见分光光度计,上海仪电分析仪器有限公司;TGL-16M高速冷冻离心机,上海卢相仪离心机仪器有限公司;Testo 205型便携式pH计,德国德图(深圳)有限公司;WSC-S色差仪,北京精密科学仪器有限公司。
1.3.1 原料预处理
先使用4~10 ℃的清水漂洗原料肉2次,每次2 min。将肉切割成1 cm3的肉块,去除表面的血丝等。于-24 ℃的冰箱中进行冻藏,保证肉品中心温度迅速冻结到-18 ℃。
1.3.2 测定条件
分别测定在-24 ℃冻藏7 d和30 d牛肉饼的指标变化。另外测定牛肉饼在冻融循环2、4、6次条件下的指标变化(-24 ℃冻藏24 h,4 ℃解冻6 h记1次循环),设置空白对照组,即4 ℃下新鲜肉。
1.3.3 牛肉饼加工工艺
采用孟子晴等[9]的制作方法,略有修改。按工艺要求修整肉块,去除表面的脂肪、筋腱、软骨以及结缔组织,手动搅碎制成肉糜,以1个牛肉饼的肉重记为 1,以喷洒的方式加入2%、4%、6%、8%(质量份数)的牛皮胶原蛋白,2%(质量份数)食盐、0.3%(质量份数)复合磷酸盐,搅拌均匀后4 ℃冷藏成型为直径 6 cm,厚1 cm,内无气泡的肉饼,生牛肉糜饼速冻后贮存于-24 ℃冰箱。生牛肉指标于4 ℃解冻5 h,待测。
1.3.4 解冻损失率的测定
取样品30 g,使用滤纸擦干表面残留的水分,每个处理组至少重复测定3次[10],解冻损失率计算如公式(1)所示:
解冻损失率![]()
(1)
1.3.5 pH的测定
选用样品,利用Testo 205型便携式pH计,测定样品在冷冻期内pH值的变化情况,且每个处理组至少重复测定3次。
1.3.6 色泽的测定
利用CM-2300 d型分光测色计,测定样品在冷冻期内表面颜色参数的变化情况。为保证测定结果准确,样品测定前需对分光测色计进行白板校正和零校正。样品测定时,在样品表面选择3处不同地方进行测定,并记录L*(亮度值)、a*(红度值)和b*(黄度值)的示数,最终分别计算每组颜色参数的平均值和标准差。每个处理组至少重复测定3次。
1.3.7 盐溶性蛋白溶解量的测定
参考宋蕾[10]的测定方法,使用双缩脲试剂盒的说明书进行。
1.3.8 盐溶性蛋白凝胶保水性测定
参考赵子瑞[11]的测定方法,将50 mg/mL的肌原纤维蛋白溶液放入10 mL的离心管中,以1 min上升1 ℃ 的加热速率从20 ℃水浴加热到75 ℃,并在75 ℃保持30 min后用流水立即冷却,放入4 ℃冰箱12 h。使用离心法测定凝胶保水性。准确称取3 g凝胶至5 mL 的离心管中,10 000 r/min 4 ℃离心10 min,弃去上清液。分别记录离心前后离心管和凝胶的总重。凝胶保水性是指离心后总重占离心前总重的百分比(质量分数)。
1.3.9 Ca2+-腺苷三磷酸酶(adenosine triphosphatase,ATPase)活力测定
参考梁鹏等[12]的方法,略作修改,称取样品20 g,加入0.6 mol/L NaCl溶液80 mL,在4 ℃ 8 000 r/min高速匀浆30 min后在4 ℃条件下静置24 h;使用双层纱布过滤,粗滤液经4 000 r/min离心5 min后,所得上清液即为肌原纤维蛋白溶液。肌原纤维蛋白溶液制备出后,在试管中加入0.5 mL 0.5 mol/L Tris-马来酸、0.5 mL 0.1 mol/L CaCl2、2.2 mL 2.0 mol/L KCl、0.5 mL 20 mmol/L ATP(pH 7.0)、1.0 mL肌原纤维蛋白溶液和5.3 mL蒸馏水。反应混合液在25 ℃恒温中水浴,加入酶液后反应开始,反应5 min后加入5 mL 15%(体积分数)高氯酸终止反应。空白组为先加入5 mL 15%高氯酸,再加入其他溶液。采用钒钼黄比色法测定反应中释放的无机磷含量,同时设空白对照。Ca2+-ATPase的活性以1 mg蛋白质在1 min内生成的微摩尔Pi来表示。
采用 Design Expert 8.0.6、Origin 2017 和 SPSS 21对试验数据进行处理。
解冻损失率是肉制品品质评价的重要指标,影响着肉制品表面微生物群的活化和增殖,降低酶的活性,对肉制品的品质测定产生负面影响[2,13]。由图1可知,新鲜牛肉的解冻损失率为10.09%;在固定温度的冷冻贮藏下,解冻损失率随着时间的延长而增大,这与钱书意等[14]的研究结果相符,导致这一现象的主要原因是由于在贮藏过程中,冷冻牛肉饼中自由水形成冰晶,在解冻时冰晶所化的水没有充分的时间重新被肌肉组织吸收,导致水分流失;在冻融循环的过程中,随着循环次数的增多,解冻损失率不断增大,且解冻损失率更高,这是由于冻融循环过程中,样品中水分冷冻形成冰晶体,解冻后冰晶体被破坏,导致肌肉发生不可逆机械损伤,水分流失严重[15],这与蒙健宗等[16]和ZHANG等[17]的研究结果相吻合。在相同的贮藏时间内,加入不同含量的牛皮胶原蛋白后,发现在6%的添加量下解冻损失率最低,且显著低于其他含量(P<0.05),最高可提高15.74%,这可能由于牛皮胶原蛋白作为一种蛋白质水解物,可以应用滞后效应,降低冰点且改变冰晶形态,从而抑制冰晶生长[15-17]。以上结果表明,牛皮胶原蛋白可以修饰冰晶降低其冰点,通过将大冰晶减少为小冰晶,抑制了在冻融循环下的重结晶。
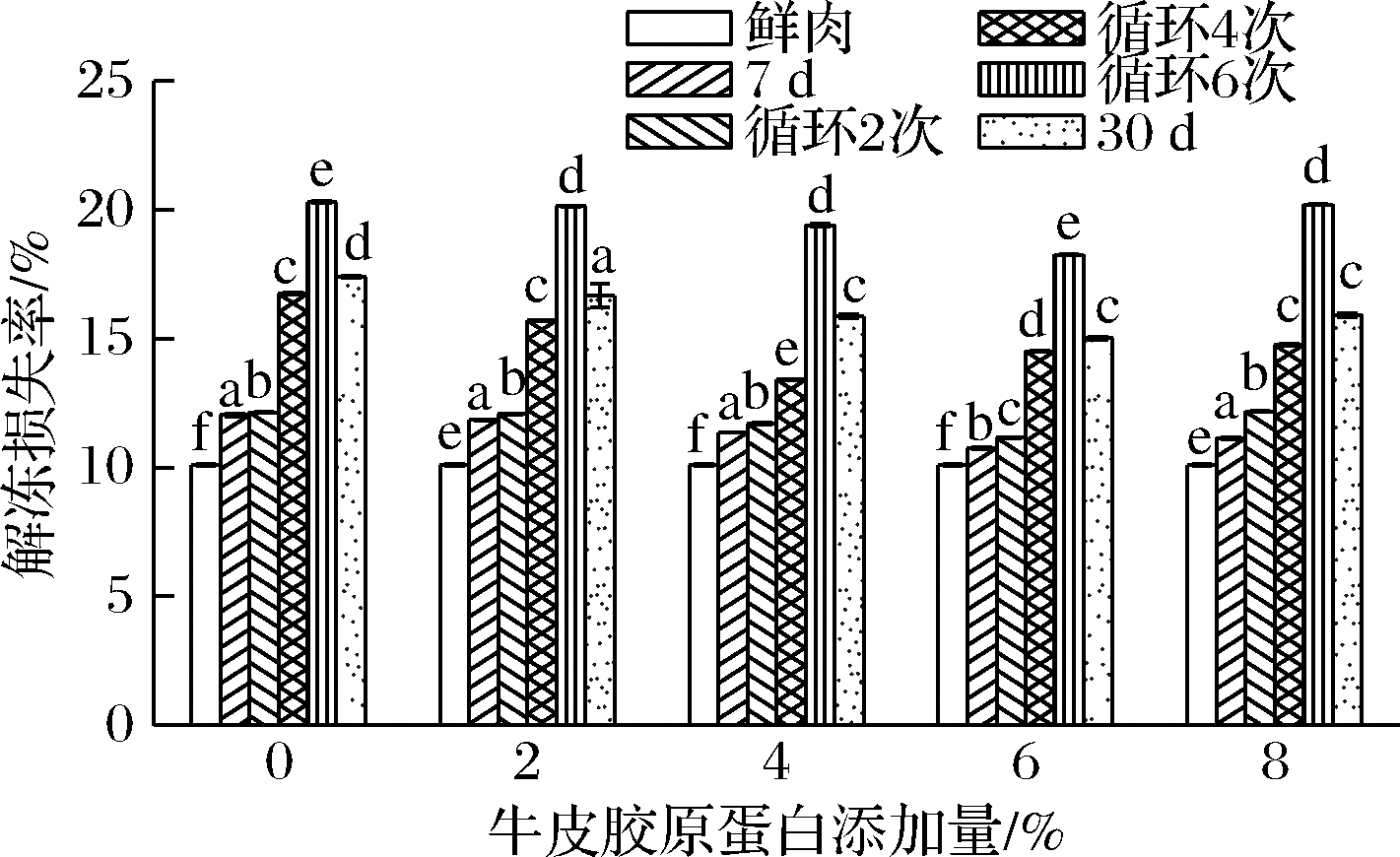
图1 牛皮胶原蛋白添加量对不同贮藏条件下
解冻损失率的影响
Fig.1 Effect of different amount of bovine collagen
on thawing loss rate in different storage condition
注:图中同一组中不同小写字母代表差异显著(P<0.05)(下同)
肉制品pH的高低可以反映肉制品品质的好坏[18-19]。新鲜肉品的初始pH值为6.20,由表1可知,随着贮藏时间的延长,pH不断降低,可能是由于肌肉中糖类发酵分解产生的乳酸和ATP产生的磷酸不断增加,导致pH的降低[19];在冻融循环过程中,pH值随着冻融循环的次数增加而降低,且降低速度相较于短期和长期贮藏更快(P<0.05),并在循环6次时最低。这可能是由于低温冷冻抑制了牛肉饼表面微生物的生长和酶的活性,生成的碱性物质较少,pH未升高[19]。加入不同含量牛皮胶原蛋后实验组中肉制品的pH与对照组相比变化不显著,这可能是由于牛皮胶原蛋白对酸性物质没有抑制作用,且对碱性物质无促进生长的作用,导致pH不受其影响。
表1 冷冻牛肉饼pH和色泽参数比较
Table 1 Comparison of pH and color parameters of
frozen beef cakes

评价指标处理组牛皮胶原蛋白添加量0%2%4%6%8%鲜肉6.20±0.01a6.20±0.01a6.20±0.01a6.20±0.01a6.20±0.01a7 d5.47±0.00b5.47±0.01b5.48±0.01a5.47±0.00b5.46±0.01bpH循环2次5.43±0.01d5.45±0.00c5.46±0.01b5.48±0.01a5.43±0.01d循环4次5.30±0.01d5.31±0.01cd5.32±0.01c5.34±0.00b5.32±0.01cd循环6次5.22±0.01c5.25±0.01b5.26±0.01c5.27±0.00a5.21±0.00d30 d5.42±0.01d5.45±0.01c5.47±0.01b5.45±0.00c5.46±0.01bc鲜肉40.57±0.01a40.57±0.01a40.57±0.01a40.57±0.01a40.57±0.01a7 d41.40±0.01a41.30±0.01b40.80±0.01d40.80±0.00c40.90±0.00cL*循环2次43.50±0.01b43.40±0.01c43.30±0.01c42.90±0.01d42.80±0.04e循环4次45.40±0.03a45.40±0.01b44.80±0.01c44.70±0.01d44.60±0.02e循环6次43.10±0.01a43.10±0.01a43.00±0.01c42.40±0.02e42.80±0.03d30 d42.35±0.02a41.55±0.47b41.22±0.02b41.56±0.01b41.55±0.01b鲜肉21.42±0.01a21.42±0.01a21.42±0.01a21.42±0.01a21.42±0.01a7 d20.31±0.01b20.32±0.01b20.31±0.01b20.33±0.01a20.31±0.01ba*循环2次20.26±0.01d20.27±0.01cd20.28±0.01bc20.31±0.01a20.29±0.01b循环4次20.23±0.01c20.25±0.01c20.27±0.01b20.31±0.00a20.28±0.01b循环6次18.09±0.02d18.13±0.01c18.16±0.01b18.22±0.01a18.18±0.01b30 d20.24±0.01e20.25±0.01e20.28±0.01d20.34±0.01b20.32±0.01c鲜肉8.98±0.01a8.98±0.01a8.98±0.01a8.98±0.01a8.98±0.01a7 d9.15±0.01a9.14±0.01ab9.13±0.01bc9.12±0.01c9.14±0.01abb*循环2次9.72±0.01a9.73±0.01a9.72±0.01ab9.67±0.01c9.71±0.01b循环4次9.95±0.01a9.93±0.01a9.88±0.01b9.81±0.01d9.83±0.01c循环6次10.45±0.01a10.43±0.01b10.40±0.01c10.33±0.01e10.37±0.01d30 d9.66±0.01a9.64±0.01b9.63±0.01b9.57±0.01d9.61±0.01c
注:表中不同字母代表差异显著(P<0.05)
肉制品的颜色是消费者购买产品时考虑的重要因素之一,也是评价冻藏肉制品的重要指标[20]。由表1可知,在7 d和30 d的贮藏期中,L*值和b*值增大但变化不显著,a*值减小且变化显著(P<0.05),这可能是由于在低温冷冻过程中,低温降低了氧合肌红蛋白的氧化速率,暗褐色的高铁肌红蛋白的生成过程受到抑制,使肉制品呈现较好的肉色;在冻融循环过程中,L*值先增大后减小,a*值逐渐减小,在冻融6次时显著减少(P<0.05),b*值逐渐增大,在冻融6次时显著增大(P<0.05),这与李金平等[21]研究结果相吻合,这可能是由于冻融循环条件下牛肉饼的汁液损失增大,导致前期的L*值不断增大,色泽相对于初始更鲜亮,但在冻融循环后期,牛肉表面的肌红蛋白被氧化,形成褐色的高铁肌红蛋白,导致色泽变暗,这与QI等[22]的结果相符。而加入不同含量牛皮胶原蛋白后产生了部分变化,但变化不显著,出现这种情况的原因可能是牛皮胶原蛋白对肉中呈色的肌红蛋白和高铁肌红蛋白无影响,导致肉色变化不显著。
盐溶性蛋白是主要的肌肉蛋白质[23-24],显著影响着蛋白质的功能特性,其变性会导致肉制品的劣变。由图2可知,盐溶性蛋白溶解量随着时间的延长而逐渐降低,经显著性分析可知,在短期、长期和冻融循环下盐溶性蛋白溶解量下降程度均显著低于新鲜肉,这是由于在冻藏过程中,蛋白质结构发生改变,其分子间的氢键和疏水键导致蛋白质表面疏水性增加,蛋白质无法充分吸附水分从而增加了盐溶性蛋白不稳定性[24],在冻融循环状态下,盐溶性蛋白下降显著(P<0.05)。这可能是由于在循环解冻过程中,水不断生成冰晶挤压蛋白质,使蛋白质的二级结构发生改变,导致肉制品的可溶性蛋白含量减少,食用品质降低,这与LEE等[24]研究结果相符。LEYGONIE等[25]发现冷冻过程中冰晶的形成和生长破坏了肉的微观结构,且蛋白结构周围的溶质浓度增大,导致蛋白变性,引起肉制品的劣变。这与本试验的结果相吻合。在加入不同含量的牛皮胶原蛋白后,各组的蛋白质含量均有显著提升,对比新鲜肉,盐溶性蛋白含量随着牛皮胶原蛋白添加量的提高而上升,且在6%的添加量下蛋白质含量维持得最好,最高可提高25.79%。相对于短期和长期冻藏,蛋白质含量在冻融循环中上升较快。说明牛皮胶原蛋白可以有效地延缓了盐溶性蛋白溶解量下降的问题,一方面可能是通过增强其蛋白质和水之间的结合,减少蛋白质间的不可逆结合,这与下一节的结果相呼应,另一方面,牛皮胶原蛋白作为大分子化合物,加入后可以提高非冻结相的含量及浓度,自由水等冻结相浓度相对降低,且维持蛋白质分子的水合环境稳定,减缓蛋白质的结构作用力的平衡被破坏的现象。在加入牛皮胶原蛋白时,发现其可以和肉糜均匀混合在一起,呈透明态,具有一定黏性,猜测可以在混合状态时在肉糜间形成隔膜类的屏障,阻碍各相间的反应,从而减缓盐溶性蛋白溶解量在低温和温度波动状态下的下降情况。
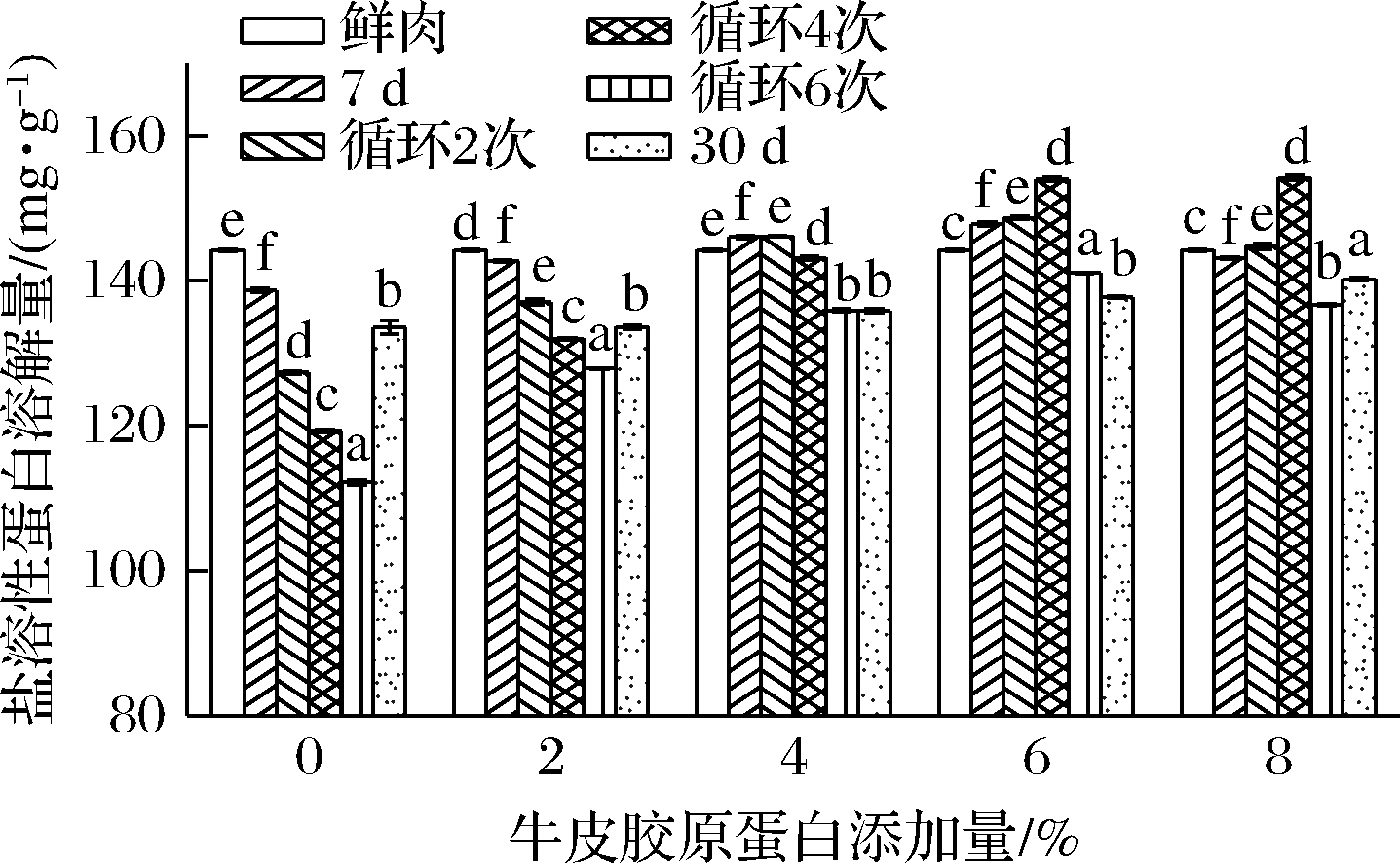
图2 牛皮胶原蛋白添加量对不同贮藏条件下
盐溶性蛋白溶解量的影响
Fig.2 Effect of different amount of bovine collagen on
salt soluble protein content in different storage condition
肉制品蛋白凝胶保水性与盐溶性蛋白质含量呈正相关,盐溶性蛋白的损失越少,其蛋白质的持水能力越高[26]。由图3可知,在冻藏过程中,盐溶性蛋白的凝胶保水力随着时间的延长而下降,在冻融循环过程中,随着温度波动次数的增加,其保水力下降速度显著高于固定温度冻藏,这说明温度波动对盐溶性蛋白凝胶保水性的能力影响较为显著[27](P<0.05)。这可能是由于在热凝胶过程中,盐溶性蛋白加热后结构变松散,其分子间的网状结构封锁了自由水的流动,从而形成较为具有弹性的凝胶产物,而盐溶性蛋白含量的下降,导致其形成凝胶的能力下降,保水能力降低,这与LIU等[28]和欧阳杰等[26]研究结果相符合,也与本试验前部分对于盐溶性蛋白含量的变化趋势研究相符。与空白对照对比,加入不同含量的牛皮胶原蛋白后的牛肉饼的凝胶保水性有所上升,且在6%时最高,最高可达到34.95%,后续趋于平缓(P>0.05),这说明在冻藏过程中,牛皮胶原蛋白可以有效地保护蛋白质的冷冻变性,从而减少盐溶性蛋白的凝胶保水性的降低[28]。
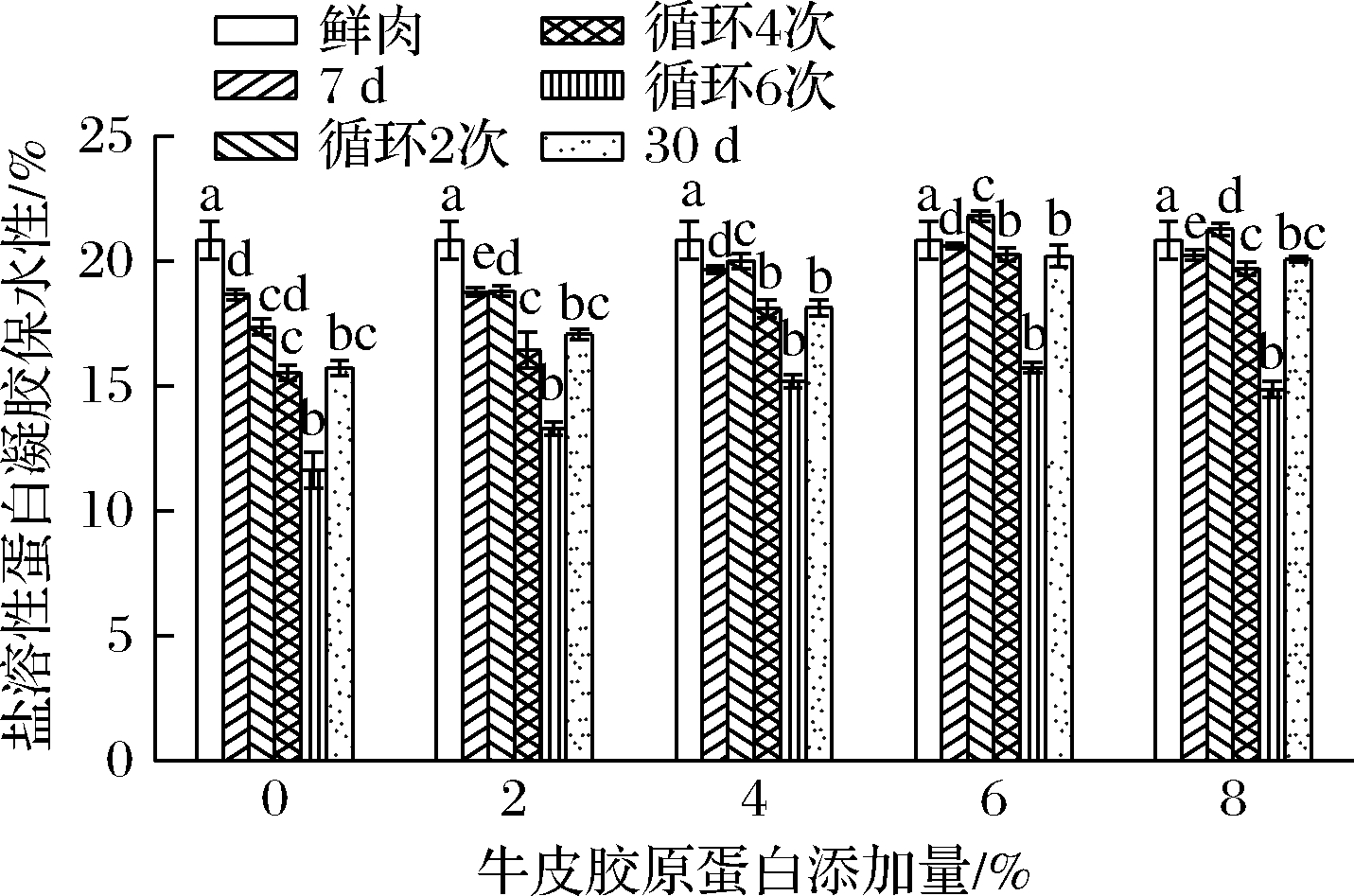
图3 牛皮胶原蛋白添加量对不同贮藏条件下
盐溶性蛋白凝胶保水性的影响
Fig.3 Effect of different amount of bovine collagen on salt-extractable
protein water holding capacity in different storage condition
由于肌球蛋白的结构在冻藏中发生变性,其位于头部的Ca2+-ATPase的活性会发生显著下降,所以Ca2+-ATPase是评价肌动球蛋白分子完整性的良好指标[14]。在肌肉中,Ca2+-ATPase的活性越高,蛋白质变性程度越小[29]。由图4可知,冷冻后的牛肉饼的Ca2+-ATPase对比于新鲜肉组显著下降(P<0.05),且在冻融循环过程中下降更快,这可能是因为在冷冻和温度波动条件下,蛋白质结不断发生改变,冷冻变性后蛋白质的Ca2+-ATPase活力减弱[29-30]。在加入不同含量的牛皮胶原蛋白后,Ca2+-ATPase的活力明显提升,这说明牛皮胶原蛋白对蛋白质产生了明显的保护作用;在6%添加量时Ca2+-ATPase的活力值最高,后续趋于平稳(P>0.05),说明此时的蛋白质性质最稳定,蛋白质变性程度最小,Ca2+-ATPase活性增高,最高可上升25.71%。说明牛皮胶原蛋白对Ca2+-ATPase的活性降低有显著的效果,这与本试验前部分对于盐溶性蛋白含量的变化趋势研究相符。

图4 牛皮胶原蛋白添加量对不同贮藏条件下
Ca2+-ATPase活性的影响
Fig.4 Effect of different amount of bovine collagen on
Ca2+-ATPase activity in different storage condition
试验针对6%牛皮胶原蛋白添加量下,冻藏和冻融循环下牛肉饼的解冻损失率(thawing loss rate, Tlr)、pH、色泽(L*, a*, b*)、盐溶性蛋白溶解量(salt soluble protein content, SSPC)、盐溶性蛋白凝胶保水性(salt-extractable protein water holding capacity, SepWHC)以及Ca2+-ATPase活力进行相关性分析,结果如表2所示。解冻损失率与b*值(r=0.848,P<0.01)呈极显著正相关,与a*值(r=-0.783,P<0.01)和pH值(r=-0.862,P<0.01)、SSPC(r=-0.913,P<0.01)、SepWHC(r=-0.885,P<0.01)和Ca2+-ATPase(r=-0.885,P<0.01)呈极显著负相关[18];pH值与a*值(r=-0.808,P<0.01)、SSPC(r=0.597,P<0.01)、SepWHC(r=0.546,P<0.01)、Ca2+-ATPase(r=0.864,P<0.01)呈极显著正相关[29],与L*值(r=-0.467,P<0.01)、b*值(r=-0.858,P<0.01)呈极显著负相关;SSPC与SepWHC(r=0.947,P<0.01)呈极显著正相关[14]。这说明了牛肉在冻藏过程中,水分的流失导致肌原纤维蛋白出现变性,引起SepWHC、Ca2+-ATPase活力的下降,使其在冻藏过程中品质发生劣变。
表2 冷冻牛肉饼品质指标相关性分析
Table 2 Correlation analysis of quality indexes of
frozen beef cakes
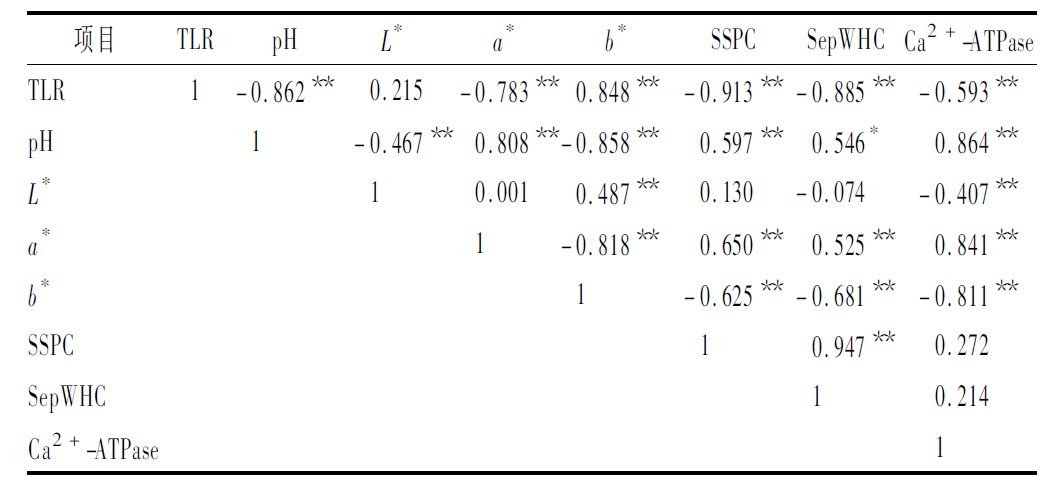
注:*代表差异显著(P<0.05),**代表差异极显著(P<0.01)
本文研究了不同添加量的牛皮胶原蛋白在冻藏条件下和冻融循环条件下的牛肉饼相关指标的变化规律,发现牛皮胶原蛋白可以有效地抑制肉制品中解冻损失率和汁液损失率的上升,减缓蛋白质的冷冻变性,提高其凝胶保水能力和Ca2+-ATPase的活力,且6%添加量的牛肉制品相对于其他添加量对肉制品的品质保持更加显著。研究结果表明,牛皮胶原蛋白作为一种绿色高效的抗冻保护剂,对调理牛肉制品中水分和蛋白质有良好的保护能力。本研究为牛皮胶原蛋白作为抗冻剂在冷冻调理牛肉制中的应用提供了一定数据基础和技术支持。
[1] 杨永安,李静静,刘建福,等.不同温度波动对冻藏三文鱼色差和质构的影响[J].食品与发酵工业, 2021,47(10):145-150.
YANG Y A, LI J J, LIU J F, et al.Temperature fluctuation on color difference and texture of frozen salmon[J].Food and Fermentation Industries, 2021,47(10):145-150.
[2] 程天赋, 蒋奕, 张翼飞,等.基于低场核磁共振研究不同解冻方式对冻猪肉食用品质的影响[J].食品科学, 2019, 40(7):20-26.
CHENG T F, JIANG Y, ZHANG Y F, et al.Effects of different thawing methods on quality of frozen pork as investigated using low field-nuclear magnetic resonance[J].Food Science, 2019, 40(7):20-26.
[3] 何艳, 刘彦言, 鲍文静, 等.不同解冻方法对冻结肉品质的影响[J].食品与发酵工业, 2018, 44(5):291-295.
HE Y, LIU Y Y, BAO W J, et al.Effects of different thawing methods on the quality of frozen meat[J].Food and Fermentation Industries, 2018, 44(5):291-295.
[4] 于淑池,谢家淑.复合抗冻剂的配方优化及对卵形鲳鲹冻藏品质的影响[J].食品科技,2020,45(7):267-274.
YU S C, XIE J S.Optimization of the formulation of composite cryoprotectant and its effects on the quality of frozen Trachinotus Ovatus[J].Food Science and Technology, 2020, 45(7):267-274.
[5] 李敏涵, 李洪军, 李少博, 等.抗冻保护剂在肉品及水产品贮藏保鲜中的应用研究进展[J].食品科学,2021,42(1):294-301.
LI M H, LI H J, LI S B, et al.Application of cryoprotectants in the frozen storage of meat and aquatic products:A review[J].Food Science,2021,42(1):294-301.
[6] DU L, BETTI M.Cryoprotective property of chicken collagen hydrolysate(CCH) on isolated actomyosin (IAM)[J].Meat Science, 2016(112):124.
[7] ![]() K.Cryoprotective effect of trehalose and maltose on washed and frozen stored beef meat[J].Czech Journal of Food Sciences, 2011, 29(1):15-23.
K.Cryoprotective effect of trehalose and maltose on washed and frozen stored beef meat[J].Czech Journal of Food Sciences, 2011, 29(1):15-23.
[8] YANG S Y,KIM Y H,LEE M H.The effect of cryoprotectants on the quality changes of pork and beef during frozen storage[J].Korean Journal of Food Science and Technology(Korea R.), 1989, 21:364-369.
[9] 孟子晴, 赵改名, 祝超智, 等.牛肉饼中植物源添加物的配方优化及对牛肉肉糜品质的影响[J].现代食品科技, 2019, 35(12):166-175;76.
MENG Z Q, ZHAO G M, ZHU C Z, et al.Optimization of plant additive-containing formulations for beef patties and its effect on beef minced meat quality[J].Modern Food Science and Technology, 2019, 35(12):166-175;76.
[10] 宋蕾. 冻藏条件和糖类抗冻剂对调理肉丸品质的影响[D].南京:南京农业大学, 2016.
SONG L.Effects of frozen storage condition and carbohydrate cryoprotectants on the quality of prepared meatballs[D].Nanjing:Nanjing Agricultural University, 2016.
[11] 赵子瑞. 低钠酱牛肉制备配方优化与品质改良及贮藏特性研究[D].长春:吉林大学,2019.
ZHAO Z R.Study on the preparation formula optimization, quality improvement and storage characteristics of low sodium spiced beef[D].Changchun:Jilin University,2019
[12] 梁鹏, 钟机, 张浩, 等.复合抗冻剂对蓝圆鯵冷冻鱼糜抗冻效果的影响[J].福建农林大学学报(自然科学版), 2015, 44(6):618-623.
LIANG P, ZHONG J, ZHANG H, et al.Effect of composite antifreeze on Decapterus maruadsi surimi during frozen storage[J].Journal of Fujian Agriculture and Forestry University (Natural Science Edition), 2015, 44(6):618-623.
[13] NAING A H, KIM C K.A brief review of applications of antifreeze proteins in cryopreservation and metabolic genetic engineering[J].3 Biotech, 2019, 9(9):329.
[14] 钱书意, 李侠, 孙圳, 等.不同冻结温度下牛肉的肌原纤维蛋白变性与肌肉持水性[J].食品科学,2018,39(15):24-30.
QIAN S Y, LI X, SUN Z, et al.Myofibrillar protein denaturation and water-holding capacity of beef frozen at different temperatures[J].Food Science, 2018, 39(15):24-30.
[15] WU X F, ZHANG M, ADHIKARI B, et al.Recent developments in novel freezing and thawing technologies applied to foods[J].Critical Reviews in Food Science and Nutrition, 2017, 57(17):3 620-3 631.
[16] 蒙健宗, 秦小明, 赵文报, 等.海藻糖对冷冻罗非鱼片蛋白质变性作用的影响[J].食品工业科技, 2007, 28(2):214-216.
MENG J Z, QIN X M, ZHAO W B, et al.Effect of trehalose on protein denaturation of frozen tilapia fillets[J].Science and Technology of Food Industry, 2007, 28(2):214-216.
[17] ZHANG M, LI F, DIAO X, et al.Moisture migration, microstructure damage and protein structure changes in porcine longissimus muscle as influenced by multiple freeze-thaw cycles[J].Meat Science, 2017, 133:10-18.
[18] 李磊, 崔丽伟, 张雪, 等.乳清粉在鲜切牛排涂膜中的应用研究[J].食品科技, 2019, 44(1):174-179.
LI L, CUI L W, ZHANG X, et al.The application of whey in the coating of fresh-cut steak[J].Food Science and Technology, 2019, 44(1):174-179.
[19] 董福凯, 查恩辉, 张振, 等.不同包装方式调理牛排在冰温贮藏过程中品质变化特点[J].食品工业科技, 2019, 40(8):247-253.
DONG F K, CHA E H, ZHANG Z, et al.Changes characteristics in the quality of conditioning steak in different packaging methods during ice-temperature storage[J].Science and Technology of Food Industry, 2019, 40(8):247-253.
[20] 明丹丹, 张一敏, 董鹏程, 等.牛肉肉色的影响因素及其控制技术研究进展[J].食品科学, 2020, 41(1):284-291.
MING D D, ZHANG Y M, DONG P C, et al.Recent progress in studies of factors influencing beef color and technologies for controlling it[J].Food Science, 2020, 41(1):284-291.
[21] 李金平, 李春保, 徐幸莲, 等.反复冻融对牛外脊肉品质的影响[J].江苏农业学报, 2010, 26(2):406-410.
LI J P, LI C B, XU X L, et al.Effect of freeze-thaw cycleon meat quality of beef striploin[J].Jiangsu Journal of Agricultural Sciences, 2010,26(2):406-410.
[22] QI J, LI C, CHEN Y, et al.Changes in meat quality of ovine longissimus dorsi muscle in response to repeated freeze and thaw[J].Meat Science, 2012, 92(4):619-626.
[23] SEO J H, NAING A H, JEON S M, et al.Anti-freezing-protein type III strongly influences the expression of relevant genes in cryopreserved potato shoot tips[J].Plant Molecular Biology, 2018, 97(4):347-355.
[24] LEE H H, LEE H J, KIM H J, et al.Effects of antifreeze proteins on the vitrification of mouse oocytes:Comparison of three different antifreeze proteins[J].Human Reproduction, 2015, 30(9):2 110-2 119.
[25] LEYGONIE C, BRITZ T J, HOFFMAN L C.Impact of freezing and thawing on the quality of meat[J].Meat Science, 2012, 91(2):93-98.
[26] 欧阳杰, 倪锦, 吴锦婷, 等.解冻方式对大黄鱼解冻效率和品质的影响[J].肉类研究, 2016,30(8):30-34.
OUYANG J, NI J, WU J T, et al.Influence of thawing methods on thawing efficiency and quality of Pseudosciaena crocea[J].Meat Research, 2016, 30(8):30-34.
[27] ENGLISH M M, KEOUGH J M, MCSWEENEY M B, et al.Impact of a novel cryoprotectant blend on the sensory quality of frozen lobster(Homarus americanus)[J].Journal of Food Science, 2019, 84(6):1 547-1 553.
[28] LIU M, LIANG Y, WANG Y N, et al.Effects of recombinant carrot antifreeze protein from Pichia pastoris GS115 on the physicochemical properties of hydrated gluten during freeze-thawed cycles[J].Journal of Cereal Science, 2018, 83:245-251.
[29] 陈思, 李婷婷, 李欢, 等.白鲢鱼片在冷藏和微冻条件下的鲜度和品质变化[J].食品科学, 2015, 36(24):297-301.
CHEN S, LI T T, LI H, et al.Changes in freshness and quality of silver carp fillets during chilled and partial freezing storage[J].Food Science, 2015, 36(24):297-301.
[30] 王宁. 复合抗冻剂对大黄花鱼抗冷冻变性及持水性的研究[D].锦州:锦州医科大学,2018.
WANG N. The research of compound antifreeze on the antifreeze and hydrophobicity of frozen larimichthys crocea[D].Jinzhou:Jinzhou Medical University,2018.