直穗小檗(Berberi dasystachya M.),小檗科,小檗属,落叶灌木[1],因其黄色茎和根而被称为“黄刺”,在青海省分布广,资源丰富[2],是青藏高原一种重要的药食同源浆果资源。其果实中富含多糖、植物甾醇、有机酸、多酚等多种活性物质[3],课题组前期研究表明,黄刺果粉能通过缓解氧化应激来改善胰岛β细胞损伤,达到降血糖的目的[4]。活性多糖是其主要功效成分之一,据报道,黄刺多糖具有较强的降血糖[5]、抗氧化、抗肿瘤增殖[5]等有益的生物学功能,极具开发价值。
肠道消化酶抑制剂可有效降低餐后血糖水平,然而国内外有关黄刺多糖对糖苷酶活性的抑制作用尚未见报道。氧化应激是糖尿病发病因素之一,相关研究表明自由基过量引发氧化应激反应,产生多余的活性氧,进而氧化和攻击DNA、脂质、蛋白质等大分子物质,损伤胰岛β细胞[6],因此可通过清除自由基体系评价多糖的体外抗氧化活性。多糖的降血糖机制与体内的消化代谢过程关系密切[7],即通过调节肠道微生物组成比例提高有益的短链脂肪酸(short chain fatty acid,SCFA)含量,多种肠道细菌对单糖、双糖及多糖具有酵解作用,由肠道微生物群酵解的多糖的主要代谢物是SCFA:乙酸、丙酸和丁酸,其在体内发挥重要的作用[8],乙酸可以降低餐后血糖和胰岛素抵抗;丙酸是糖异生的主要前体物;丁酸作为结肠上皮细胞重要的能量来源,能修复细胞损伤、维持肠道内环境稳定。SCFA具有调节血糖、改善肠道菌群平衡等作用[9-10]。嗜酸乳杆菌和大肠杆菌分别作为肠道优势益生菌和致病菌,通过炎症反应、SCFA等多种途径参与糖尿病的发生与发展[11]。因此综合探讨体外抗氧化、降血糖及多糖体外消化酵解对肠道菌群的影响可以更全面地探讨黄刺多糖的降血糖活性。
多糖的生物活性与分子质量、单糖组成等密切相关,不同组分多糖的结构与生物活性具有一定差异[12],如ZOU等[13]发现80%乙醇醇沉得到的多糖的抗氧化和抗癌细胞增殖效果最优,对扁豆多糖[14]的研究发现乙醇体积分数为55%和70%时多糖结合胆汁酸的能力最强,适于降低血脂。因此,本文以黄刺浆果为原料,分级醇沉提取3种不同分子质量的活性多糖组分,比较体外抗氧化和降血糖功效,利用体外细菌培养条件单一的优势,基于肠道微生物菌群角度研究糖尿病治疗及作用机制,为将黄刺多糖研制成高效无毒的天然降血糖医药提供理论依据。
黄刺,采摘自青海省大通县;大肠杆菌菌粉,北京北纳创联生物技术研究院;嗜酸乳杆菌,中国工业微生物菌种保藏中心;抗坏血酸、DPPH、ABTS、α-葡萄糖苷酶,南京都莱生物技术有限公司;α-淀粉酶、对硝基苯-α-D-葡萄糖苷(4-nitrophenyl-α-D-glucopyranoside, PNPG),北京索莱宝生物科技有限公司;阿卡波糖,拜耳医药保健有限公司;葡聚糖标准品,色谱纯,美国Sigma-Aldrich公司;其余化学试剂均为分析纯。
GS55-9冷冻干燥机、ND-One全波长超微量分光光度计,基因有限公司;UV-1780紫外可见分光光度计、LC-10A高效液相色谱仪,岛津有限公司;HHS-4S电子恒温不锈钢水浴锅,上海宜昌仪器纱筛厂;SB-3200DTD超声波清洗机,宁波新芝生物科技股份有限公司;S-100傅里叶变换红外光谱仪,珀金埃尔默仪器有限公司;SU8220冷场发射扫描电子显微镜,日本日立公司;SPX-250F生化培养箱,宁波特朗普仪器有限公司;SW-CJ-2FD洁净工作台,苏州安泰空气技术有限公司;YM-75立式压力蒸汽灭菌器,上海三申医疗器械有限公司;7890A气相色谱仪,美国安捷伦科技有限公司。
1.2.1 不同组分黄刺多糖的制备
工艺流程:
黄刺干果→粉碎过筛→95%乙醇浸泡过夜(脱脂)→超声辅助热水浸提残渣(重复3次)→滤液浓缩至1/4→Sevage法除蛋白→D101大孔树脂脱色→透析(除小分子物质)→醇沉→冷冻干燥→黄刺粗多糖BDPs
将10 g的BDPs溶于100 mL超纯水,4 500 r/min离心10 min,在上清液中加入无水乙醇使得乙醇体积分数达到70%,醇沉24 h,4 500 r/min离心10 min,沉淀经冷冻干燥后得到多糖样品BDPs-70,上清液中继续添加无水乙醇使乙醇体积分数达到80%,重复上述操作分别得到BDPs-80和BDPs-90[12]。
1.2.2 不同组分BDPs得率的计算
将1.2.1中得到的3个组分多糖称重,得率计算如公式(1)所示:
BDPs得率![]()
(1)
1.2.3 不同组分BDPs的化学组成
多糖含量测定采用苯酚硫酸法[15],根据回归方程y=13.782x-0.000 4(R2=0.999 3)计算;蛋白含量测定采用考马斯亮蓝法[9],根据回归方程y=8.400 4x-0.010 6(R2=0.999 4)计算;糖醛酸含量测定采用硫酸-咔唑法[11],根据回归方程y=3.779 6x+0.003 2(R2=0.999 0)计算。
1.2.4 不同组分BDPs的初步结构表征
1.2.4.1 高效凝胶渗透色谱(high performance gel permeation chromatography,HPGPC)表征不同组分BDPs的分子质量
(1)样品及标准品溶液配制:精密称取样品和标准品,样品配制成5 mg/mL溶液,12 000 r/min离心10 min,上清液用0.22 μm的微孔滤膜过滤,然后将样品转置于1.8 mL进样小瓶中。
(2)色谱条件:色谱柱为BRT105-104-102串联凝胶柱(8 mm×300 mm);流动相:0.05 mmol/L NaCl溶液;流速0.6 mL/min,柱温40 ℃;进样量20 μL;示差检测器RI-10A[16]。
1.2.4.2 傅里叶红外光谱(Fourier infrared spectroscopy,FT-IR)分析
分别取2 mg不同组分BDPs粉末与100 mg无水KBr均匀混合,研磨压片,在FT-IR仪上于4 000~400 cm-1扫描[17]。
1.2.4.3 扫描电镜(scanning electron microscope,SEM)
在基板上放置带有薄金层的样品涂层,1.0 kV电压下观察样品形貌[18]。
1.2.5 不同组分BDPs的体外抗氧化活性测定
1.2.5.1 DPPH自由基清除率测定
参考文献[19]并稍作修改,2 mL 0.2 mmol/L DPPH溶液(乙醇配制)与2 mL样品(0.5、1、2、4、8、16 mg/mL)均匀混合,置于室温下反应30 min,于517 nm处检测其吸光值。DPPH自由基清除率计算如公式(2)所示:
DPPH自由基清除率![]()
(2)
式中:A1为DPPH溶液加无水乙醇的吸光值;A2为DPPH溶液中加样品反应后的吸光值。
1.2.5.2 ABTS阳离子自由基清除率测定
参考文献[20],将7 mmol/L ABTS与2.45 mmol/L过硫酸钾均匀混合,放置于黑暗阴凉处16 h;而后用PBS溶液(pH=7.0)稀释混合液至其吸光值在734 nm处为0.70±0.02;样品(0.5、1、2、4、8、16 mg/mL)与ABTS混合溶液比例为1∶20,混合后于室温下孵育6 min,于734 nm处测定吸光值。ABTS阳离子自由基清除率计算如公式(3)所示:
ABTS阳离子自由基清除率![]()
(3)
式中:A1为ABTS混合溶液加超纯水的吸光值;A2为ABTS混合溶液中加样品后测的吸光值。
1.2.5.3 还原力测定
参考文献[21]并稍作修改,1 mL样品(0.5、1、2、4、8、16 mg/mL)中加入1 mL磷酸盐缓冲液(0.2 mol/L、pH 6.6)和铁氰化钾溶液,均匀混合后50 ℃反应20 min,加入1 mL 100 g/L三氯乙酸溶液,冷却至室温,加入1 mL 1 g/L的三氯化铁溶液,静置10 min,700 nm处测定吸光值。
1.2.6 不同组分BDPs的体外降血糖活性测定
1.2.6.1 α-葡萄糖苷酶抑制率测定
参考文献[22],将不同组分黄刺多糖用磷酸缓冲液(pH=6.8)稀释至不同质量浓度(16、8、4、2、1、0.5 mg/mL),在96孔板中依次加90 μL样品、20 μL 2 U/mL α-葡萄糖苷酶,37 ℃反应5 min,加入50 μL 10 mmol/L PNPG,37 ℃反应10 min后于405 nm处测定吸光值,抑制率计算如公式(4)所示:
α-葡萄糖苷酶抑制率![]()
(4)
式中:A1、A2、A3和A4分别为样品组、样品空白组,阴性对照组和空白组的吸光值。
1.2.6.2 α-淀粉酶抑制率测定
参考文献[22],0.5 mL冻存管中依次加入25 μL样品(同1.2.6.1)、25 μL 15 U/mL α-淀粉酶溶液,37 ℃ 水浴10 min,加入25 μL 10 mg/mL淀粉溶液,37 ℃反应10 min后加入125 μL DNS试剂,沸水浴反应5 min,迅速冷却至室温,540 nm处测定吸光值。
α-淀粉酶抑制率![]()
(5)
式中:A1、A2、A3和A4分别为样品组、样品空白组,阴性对照组和空白组的吸光值。
1.2.7 菌种的活化及菌悬液制备
用无菌接种环接种嗜酸乳杆菌(大肠杆菌)于MRS(LB)固体培养基,37 ℃恒温培养24 h,无菌生理盐水稀释已活化的菌悬液,制备104~105 CFU/mL菌悬液待用[23]。
1.2.8 不同组分BDPs的酵解和菌种生长速率的测定
取0.1 mL不同质量浓度(1、0.5、0.25、0.125、0.062 5、0.031 25 mg/mL)的多糖液加入到无菌MRS(LB)固体培养基中,0.1 mL无菌水作对照,再吸取0.1 mL的嗜酸乳杆菌(大肠杆菌)菌液加入到培养基中涂布均匀,培养48 h,培养结束后计数,观察数据得多糖的增殖或抑制效果[24]。
取100 μL的MRS(LB)肉汤于96孔板中,加入25 μL的嗜酸乳杆菌(大肠杆菌)菌液(0.5 mg/mL),最后加入75 μL的不同组分BDPs溶液,不加多糖溶液的一组作为对照组。放入生长曲线机中测绘24 h(45 h)的生长曲线。
1.2.9 SCFA含量的测定
(1)色谱及质谱条件:色谱柱为DB-WAX(60 m×0.25 mm,0.5 μm);进样口温度240 ℃,载气为N2,进样量3 μL;柱升温程序为初始温度70 ℃,以10 ℃/min升温至200 ℃,然后以30 ℃/min升温至240 ℃并保持3 min,分流比20∶1;柱流量1 mL/min,20PSI恒压模式;EI离子源温度230 ℃。
(2)SCFA的标准曲线绘制:将乙酸、丙酸、异丁酸、正丁酸配制成一系列不同质量浓度梯度(0.1~5.0 μg/mL)的标准溶液,过滤并按浓度梯度进样,以标准样品浓度为横坐标,峰面积为纵坐标,得到各种短链脂肪酸的标准曲线。
乙酸:y=26.78x+1.542(R2=0.999 2)
丙酸:y=34.15x+2.506(R2=0.999 4)
异丁酸:y=12.46x+2.097(R2=0.998 3)
正丁酸:y=33.446x+4.598(R2=0.999 6)
(3)样品前处理:称取0.2 g培养48 h后的培养基于无菌离心管内,加入1 mL甲醇静置10 min,振荡混匀成悬液。再用浓硫酸调节pH 2~3,静置5 min,离心(1 000 r/min,10 min)吸取上清液,过0.22 μm有机滤膜,检测SCFA含量[16]。
数据结果用平均数±标准差(SD)表示;使用SPSS 20软件进行单因素方差分析,P<0.05表示差异显著,P<0.01表示差异极显著,Origin 2018绘图。
由表1可知,乙醇体积分数越高,多糖得率越高,说明沉淀出来的多糖的种类随着乙醇浓度的升高而增多,多糖和糖醛酸含量依次为BDPs-80>BDPs-90>BDPs-70,且差异显著(P<0.05);蛋白质含量均较低,说明提取及精制过程中蛋白基本被脱除。造成BDPs-90的多糖和蛋白含量减少的原因可能是随着乙醇体积分数的增大,某些多糖分子与蛋白相结合形成糖蛋白,并溶解到乙醇中[25]。
表1 不同组分BDPs的得率及化学成分 单位:%
Table 1 The yield and chemical composition of
different BDPs

样品得率多糖含量糖醛酸含量蛋白质含量BDPs-700.934.65±0.31c18.90±0.29c0.78±0.03aBDPs-801.349.37±0.10a37.22±0.54a0.87±0.04aBDPs-902.539.91±0.19b25.51±0.51b0.65±0.02a
注:同列小写字母不同表示差异显著(P<0.05)
2.1.1 不同组分BDPs分子质量分布
采用HPGPC测定BDPs-70、BDPs-80、BDPs-90的分子质量,根据GPC软件拟合出的标准品校正曲线lgMw=-0.181 7tR+11.888(tR为保留时间Mw为重均分子质量),R2=0.987 6,计算出每个样品的分子质量大小,结果见图1。各组分的保留时间、Mw及多分散性相对含量见表2。由图1和表2可知,BDPs-70、BDPs-80、BDPs-90的保留时间分别为43.225、43.213、43.224 min,Mw分别为9 851、9 901、9 855 Da,表明分级醇沉可以得到分子质量不同的多糖,随着乙醇浓度的增大,部分低浓度难以沉淀的大分子多糖逐渐沉淀,而乙醇浓度进一步增大时,有利于小分子多糖的沉淀[13],从而导致分子质量先增后减,BDPs-90中可能存在较多低分子质量多糖;多分散指数分别为1.21、1.20、1.20,接近于1,说明分子质量分布均一且均在可接受范围。
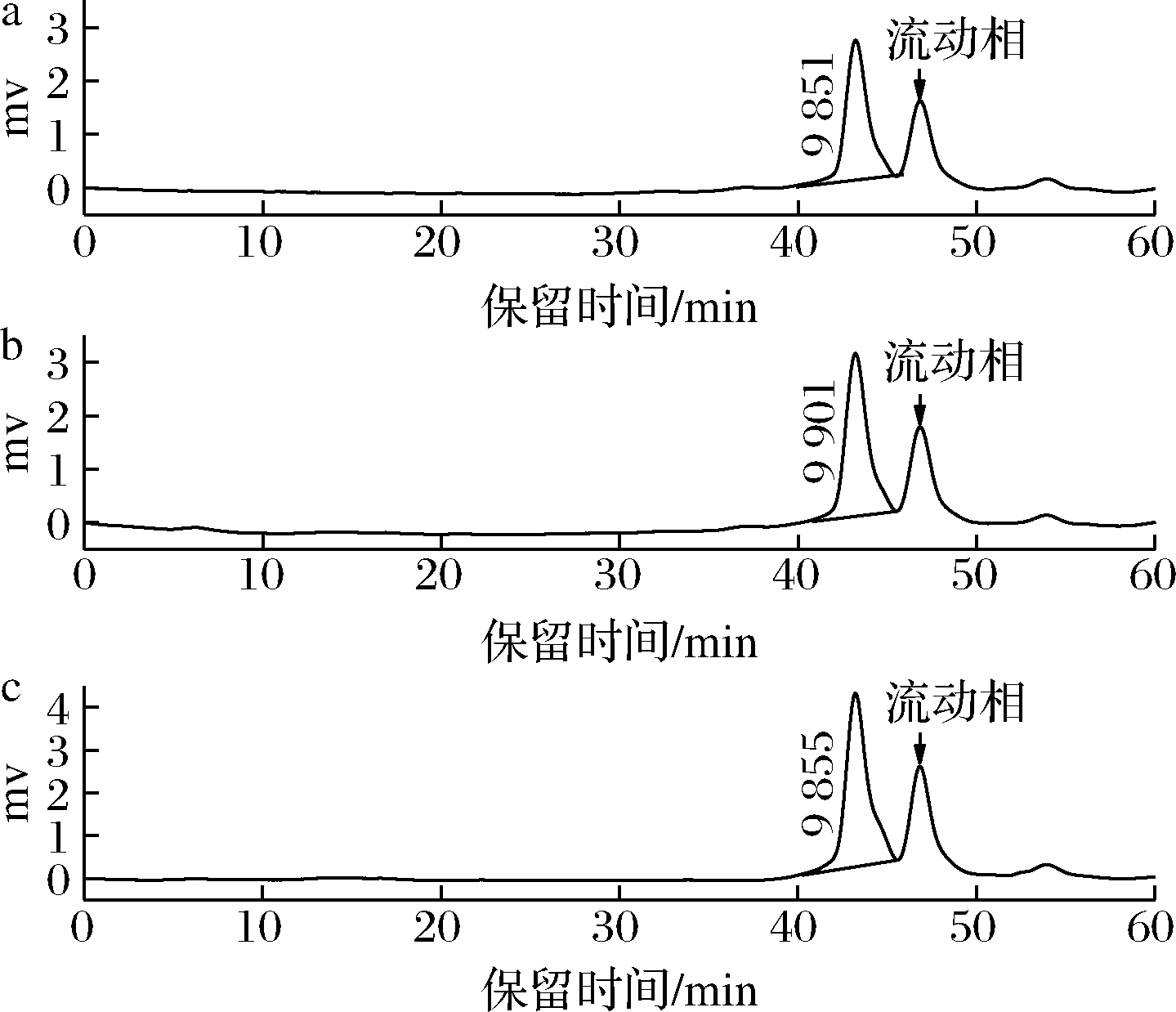
a-BDPs-70;b-BDPs-80;c-BDPs-90
图1 不同组分BDPs的HPGPC谱图
Fig.1 High performance gel permeation chromatography of
BDPs with different components
注:46.8 min左右为流动相的峰
表2 不同组分BDPs分子质量分布表
Table 2 Molecular weight distribution table of
BDPs of different components
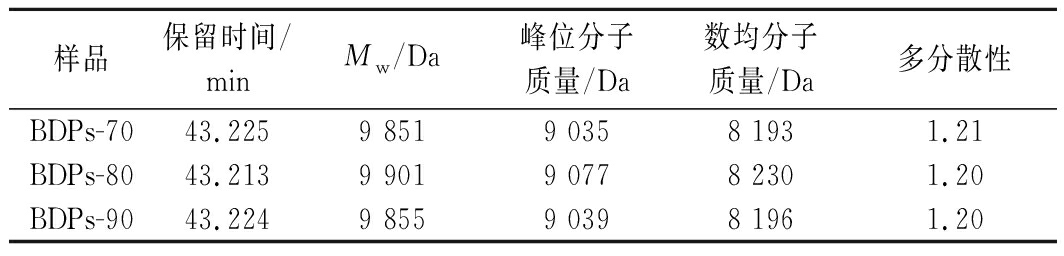
样品保留时间/minMw/Da峰位分子质量/Da数均分子质量/Da多分散性BDPs-7043.2259 8519 0358 1931.21BDPs-8043.2139 9019 0778 2301.20BDPs-9043.2249 8559 0398 1961.20
2.1.2 红外光谱分析
FT-IR用于研究碳水化合物,因为其能够识别植物多糖的官能团,由图2可知,不同浓度乙醇醇沉的BDPs组分具有相同的特征,均具有多糖类物质的特征吸收峰。其中3 421 cm-1处附近出现的强吸收峰为糖类—OH的伸缩振动峰,说明不同组分BDPs均存在分子间氢键。2 927 cm-1附近的吸收峰是C—H的伸缩振动引起的,羰基在1 608 cm-1处有强吸收峰。1 403 cm-1处的吸收为羧基的对称伸缩振动,提示结构中可能存在糖醛酸,与糖醛酸含量测定一致。1 085 cm-1处的吸收峰表明不同组分BDPs的糖环构型为吡喃型。879 cm-1附近的吸收峰为β-糖苷的特征吸收峰[26-27]。由此可推测不同组分BDPs结构相似,均为β-吡喃型多糖。
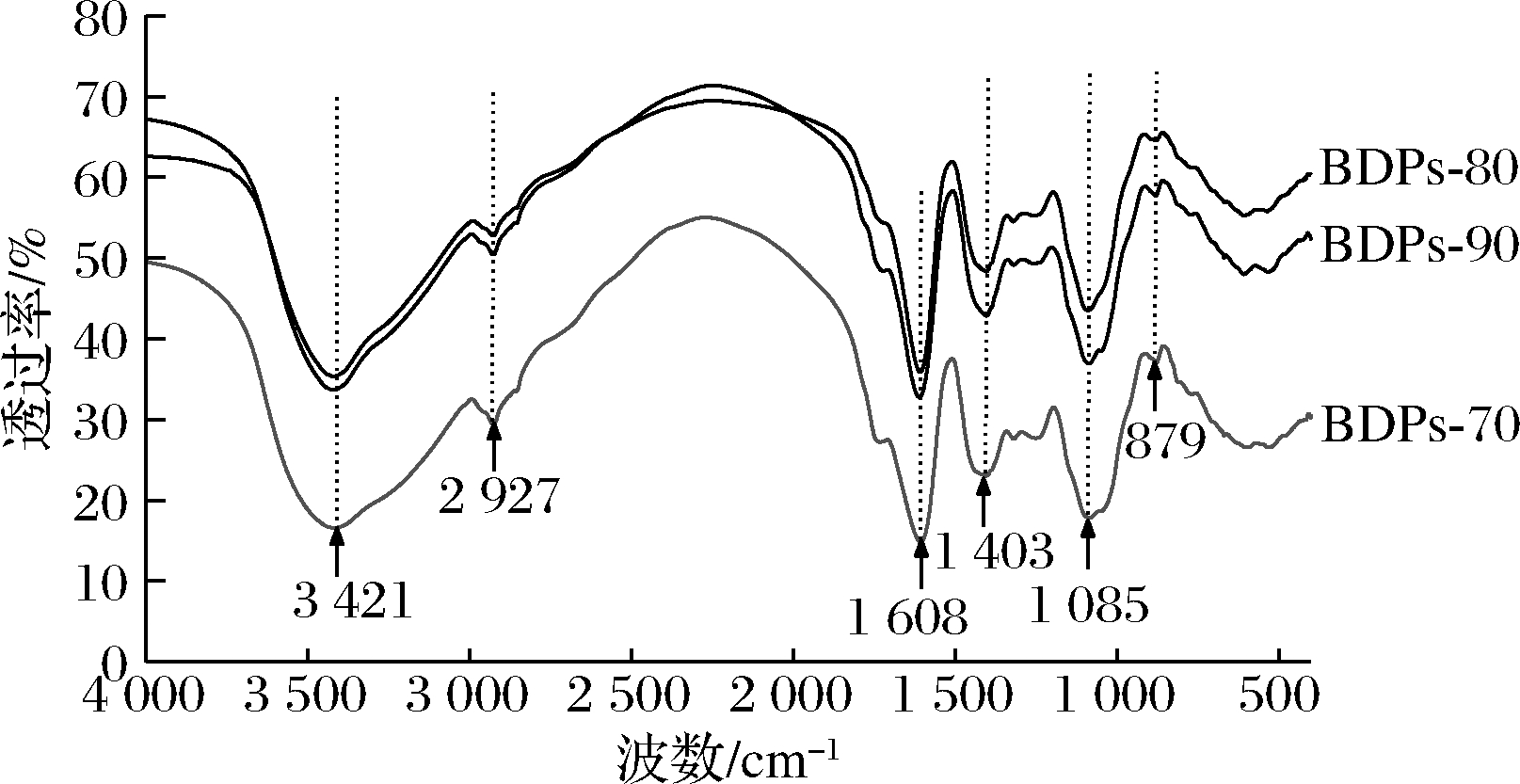
图2 不同组分BDPs的红外光谱图
Fig.2 Infrared spectra of BDPs with different components
2.1.3 SEM分析
由图3可观察到3个组分的BDPs均由片状体为主,比较粗糙,形貌有一定差异性,如紧密程度不同,可能是由于多糖醇沉过程中乙醇浓度不同引起不一样的超微结构。BDPs-70由部分致密膜状物和堆积的较松散的片状组成。BDPs-80片层完整,质地紧致。BDPs-90片层瓦解,表面较多孔洞,粗糙且松散。

a-BDPs-70;b-BDPs-80;c-BDPs-90
图3 不同组分BDPs的SEM图
Fig.3 SEM of BDPs with different components
活性氧,如DPPH、ABTS阳离子自由基是生物体通过多种方式产生的,过量的活性氧危害大,毒性强,易导致胰岛β细胞氧化损伤[4],为有效预防和控制过量的自由基引起的氧化应激反应,通过测定天然产物对自由基的清除作用评价天然产物的抗氧化活性[28]。
2.2.1 清除DPPH自由基活性
不同组分BDPs对DPPH自由基的清除率如图4-a所示,在实验质量浓度0.5~16 mg/mL内呈剂量依赖型,但一直低于维生素C的清除效果(P<0.01)。16 mg/mL时,清除率BDPs-90略高于BDPs-80(P>0.05),均显著高于BDPs-70(P<0.05)。半抑制浓度(IC50)依次为:5.174 mg/mL(BDPs-90)<7.031 mg/mL(BDPs-80)<7.187 mg/mL(BDPs-70),综合最大清除率和IC50可发现,BDPs-90清除DPPH自由基的效果最好的,这可能与多糖分子质量、结构及单糖组成有关。
2.2.2 清除ABTS阳离子自由基活性
如图4-b所示,不同组分BDPs对ABTS阳离子自由基的清除率与质量浓度呈正相关,多糖质量浓度16 mg/mL时,清除率均接近于维生素C(P<0.01),且BDPs-90>BDPs-80>BDPs-70,差异不显著(P>0.05),IC50依次为:5.186 mg/mL(BDPs-80)<5.689 mg/mL(BDPs-90)<8.478 mg/mL(BDPs-70),BDPs-80和BDPs-90 对ABTS阳离子自由基的清除活性无显著差异。在同一测试浓度下,对DPPH自由基清除率高于ABTS阳离子自由基,这种差异可能是由于自由基的清除机制不同。
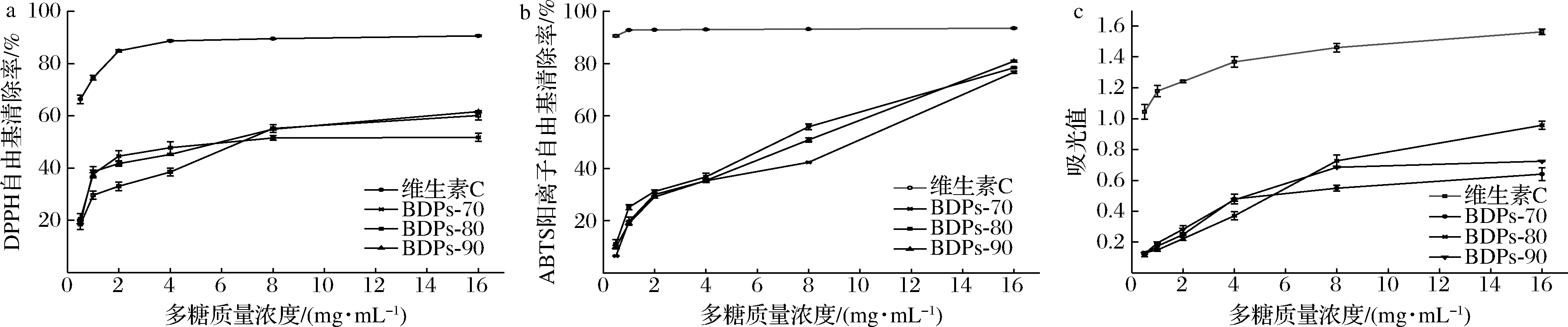
a-清除DPPH自由基能力;b-清除ABTS阳离子自由基能力;c-还原力
图4 不同组分BDPs体外抗氧化活性
Fig.4 Antioxidant activity of different components of BDPs in vitro
2.2.3 还原力
抗氧化剂清除自由基主要通过自身还原作用,吸光值越大,还原力越高[29]。由图4-c可知,不同组分BDPs还原力大小与多糖质量浓度呈明显的剂量依赖性,当多糖质量浓度达到16 mg/mL时,不同组分BDPs还原能力均达到最大,BDPs-80的OD700高达0.960 027,尽管低于维生素C(P<0.01),但也呈现出较好的还原能力。
碳水化合物(如淀粉等)在体内先被α-淀粉酶水解为麦芽糖、α-糊精等,再与蔗糖共同被α-葡萄糖苷酶水解成葡萄糖、果糖等,被小肠吸收[30],抑制消化酶活性可降低餐后血糖。
2.3.1 不同组分BDPs对α-淀粉酶的抑制率
如图5-a所示,不同组分BDPs对α-淀粉酶的抑制率与浓度呈正相关,多糖质量浓度为0.5 mg/mL时,抑制率均高于50%,展现出较好的降血糖活性。多糖质量浓度为16 mg/mL时,抑制率依次为:BDPs-90(73.72%)>BDPs-80(73.10%)>BDPs-70(71.21%),无显著差异,但均低于阿卡波糖(P<0.01)。由于提取的BDPs均未纯化,经纯化后抑制率是否会高于阿卡波糖有待深入研究。
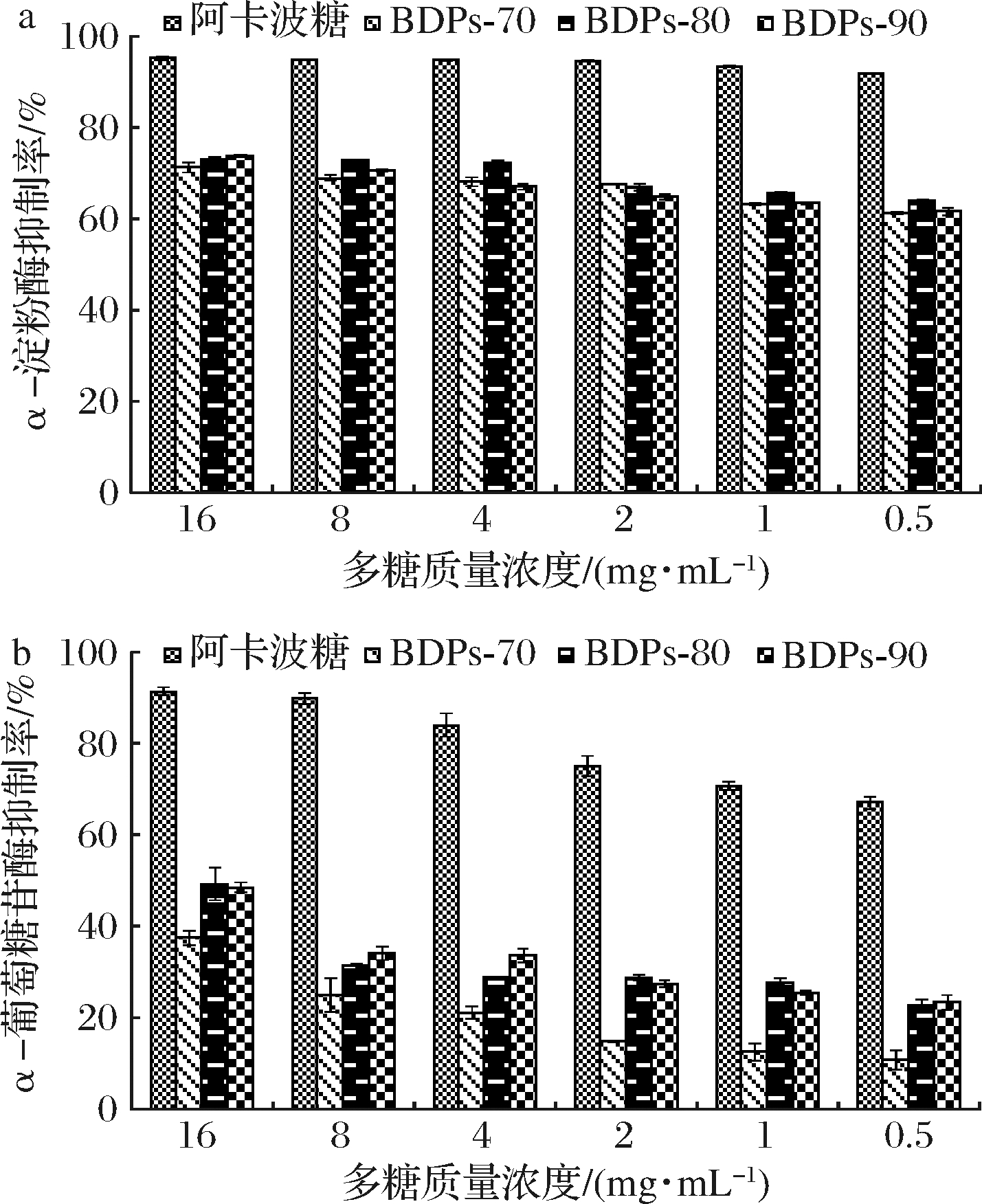
a-对α-淀粉酶的抑制率;b-对α-葡萄糖苷酶的抑制率
图5 不同组分BDPs体外降血糖活性
Fig.5 Hypoglycemic activity of different components of BDPs in vitro
2.3.2 不同组分BDPs对α-葡萄糖苷酶的抑制率
如图5-b所示,不同组分BDPs对α-葡萄糖苷酶的抑制率随多糖质量浓度的增加而增大,均具有一定的降血糖活性,多糖质量浓度为16 mg/mL时,BDPs-80的抑制率稍高于BDPs-90,差异不显著,但均显著高于BDPs-70(P<0.01)。IC50依次为:17.038 mg/mL(BDPs-80)<18.745 mg/mL(BDPs-90)<26.789 mg/mL(BDPs-70)。由此可看出BDPs-80和BDPs-90的降血糖活性优于BDPs-70。
肠道菌群的组成结构与糖尿病密切联系,大肠杆菌属、肠球菌属等致病菌的含量与炎性细胞因子呈正相关,乳酸杆菌属、双歧杆菌属等有益菌的含量与之呈负相关[31]。
由图6-a可看出,将不同组分BDPs作为特定的生长因子添加到嗜酸乳杆菌的培养基中,与空白对照相比,发现多糖对嗜酸乳杆菌有明显的增殖效果,但无剂量依赖性。BDPs-90在实验浓度范围内均表现较好的增殖效果。
由图6-b可知,将不同组分BDPs作为特定的生长因子添加到大肠杆菌的培养基中,结果表明,BDPs-80组分与对照组相比呈现极显著抑制效果,且不同组分BDPs对大肠杆菌均有一定的抑制能力。
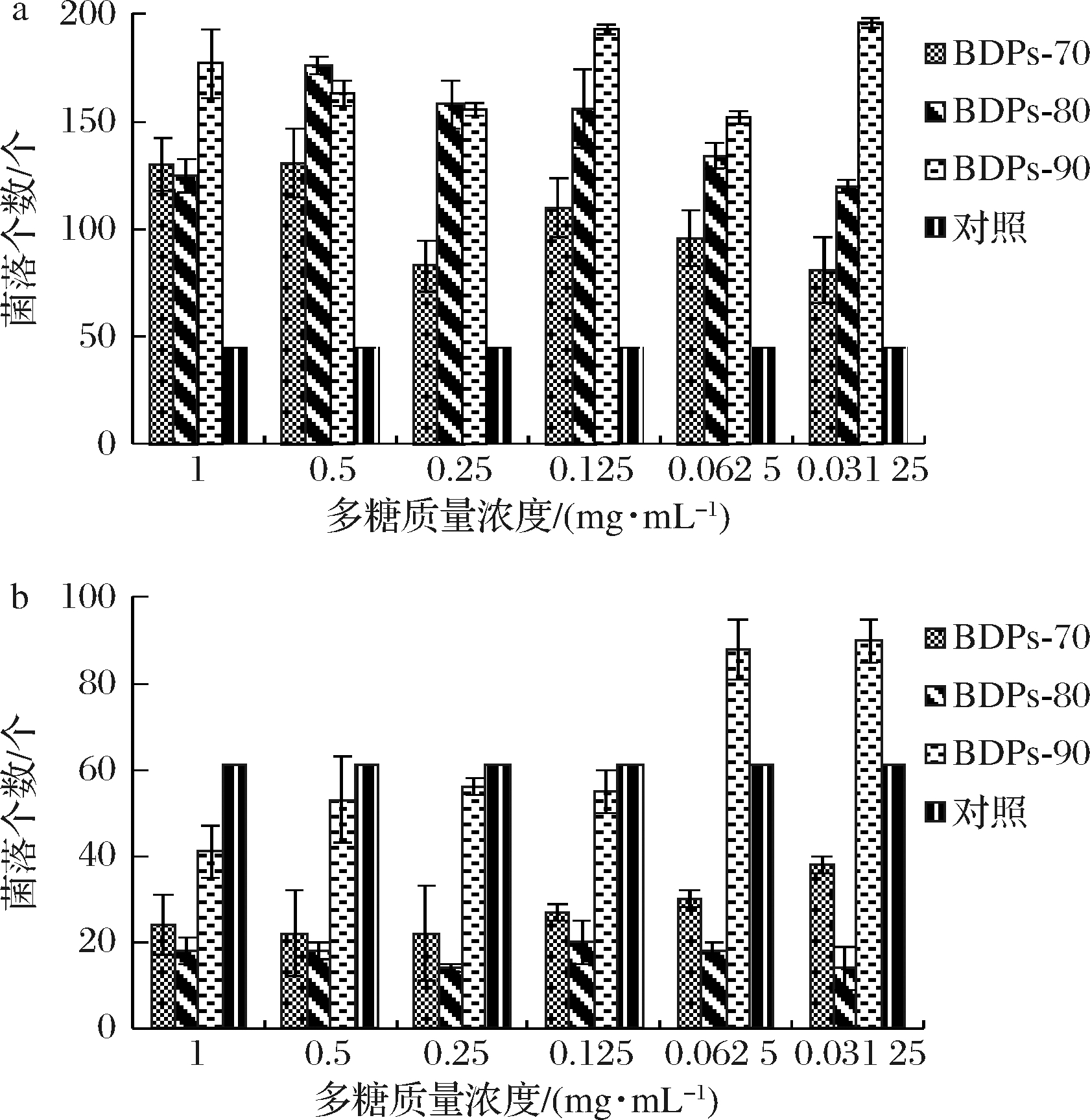
a-嗜酸乳杆菌;b-大肠杆菌
图6 不同组分BDPs对细菌体外增殖作用的影响
Fig.6 The effects of different components of BDPs on the
proliferation of bacteria
由图7-a可知,加入不同组分BDPs对嗜酸乳杆菌有增殖作用,随着培养时间的延长,其吸光值也会有相应的增长,说明嗜酸乳杆菌可以利用不同组分的BDPs并促进其自身的生长,在培养的24 h内BDPs-70与BDPs-90的促增殖效果优于BDPs-80。
由图7-b可看出,培养时间在0~35 h,不同组分BDPs对大肠杆菌的抑制作用并不明显,随着培养时间的延长,BDPs-90和BDPs-80对大肠杆菌生长开始产生抑制作用,BDPs-70对大肠杆菌的抑制效果在41 h之后才体现出来。
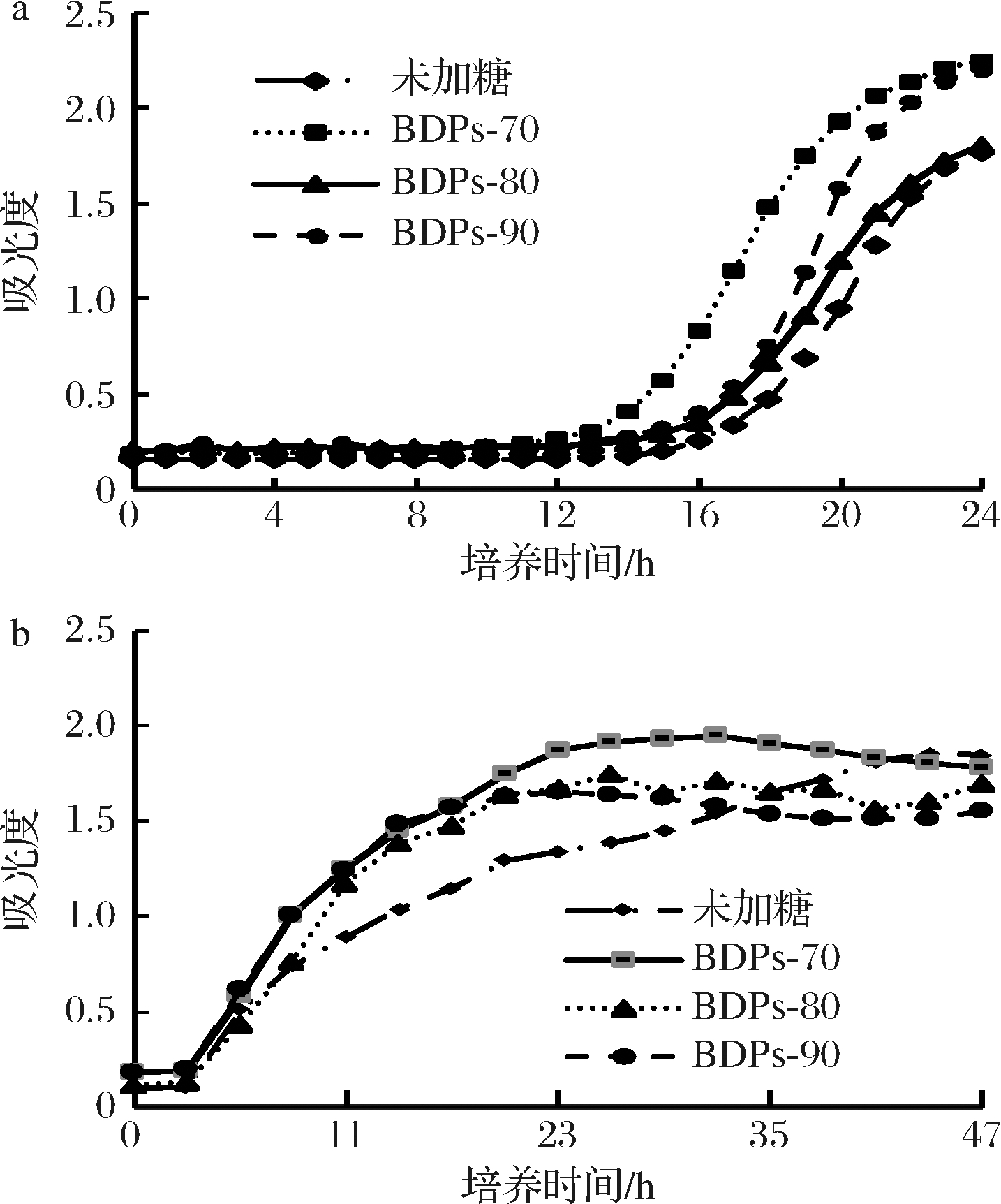
a-嗜酸乳杆菌;b-大肠杆菌
图7 不同组分BDPs对细菌生长曲线的影响
Fig.7 Effects of different components of BDPs on the
growth curves of bacteria
肠道微生物最重要的代谢功能是能够发酵食物中由宿主自身不能消化,分解的碳水化合物,其中就包括大分子植物多糖,将其转化为代谢终产物——SCFA。SCFA可以促进宿主代谢,对保持肠道屏障完好无损至关重要[16]。此外,这些代谢物与人体正常的葡萄糖水平存在广泛关联[32]。乙酸、丙酸、异丁酸、正丁酸的气质图谱如图8所示。
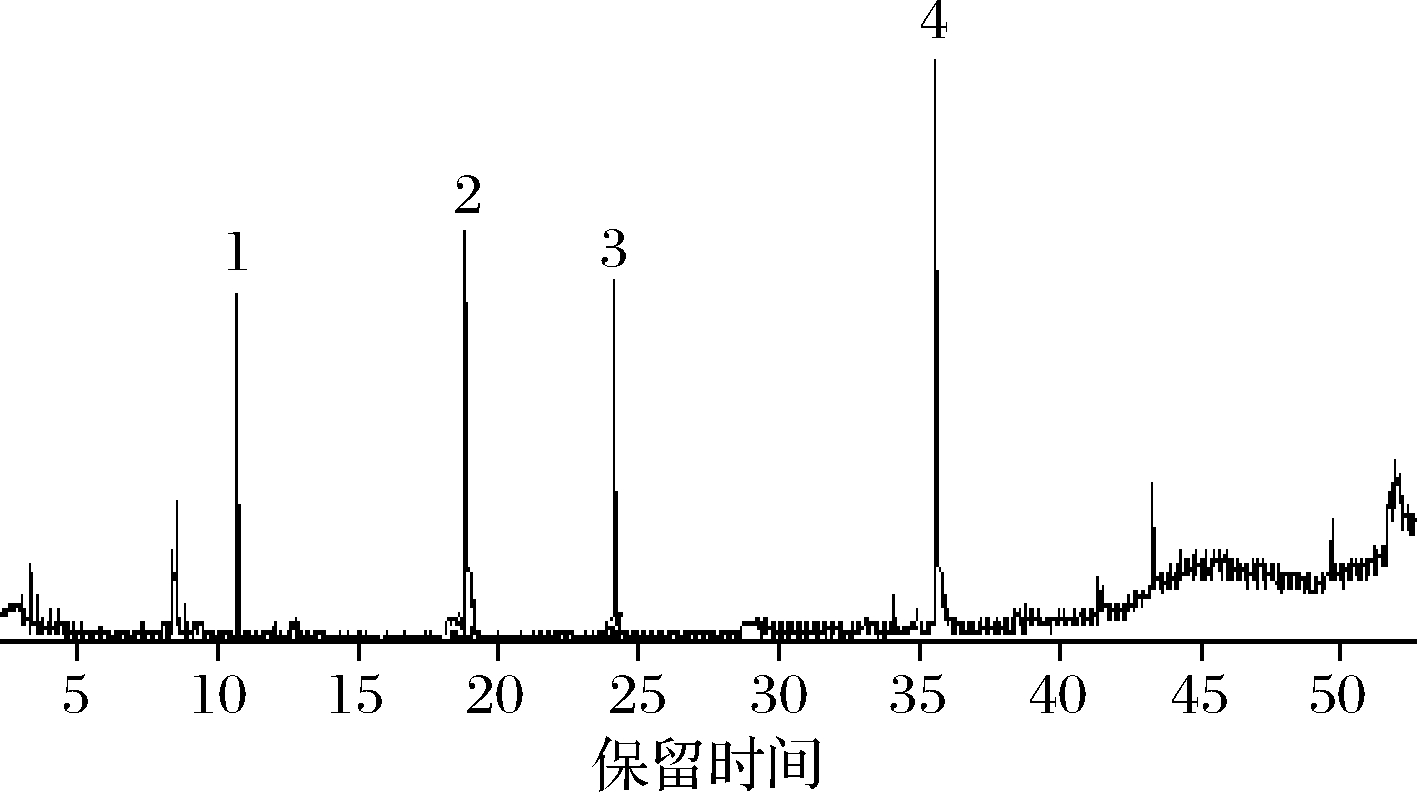
1-乙酸;2-丙酸;3-异丁酸;4-正丁酸
图8 短链脂肪酸标准品的气质图谱
Fig.8 Temperament profile of standard short-chain
fatty acids
如图9-a所示,与空白组相比,添加不同组分BDPs的嗜酸乳杆菌的培养基经体外发酵48 h后SCFA总含量均得到了不同程度的提高(P<0.05)。BDPs-80酵解组乙酸、丙酸、正丁酸含量显著高于BDPs-70(P<0.05);BDPs-90酵解组异丁酸含量较对照组高(P<0.05)。

a-嗜酸乳杆菌;b-大肠杆菌
图9 不同组分BDPs对细菌发酵产短链脂肪酸的影响
Fig.9 Effects of different components of BDPs on bacteria
fermentation to produce short-chain fatty acids
注:图中不同小写字母表示差异显著(P<0.05)
将不同组分BDPs作为生长因子加入到大肠杆菌的培养基中,对培养48 h后的培养基中的SCFA含量进行测定,结果如图9-b所示,SCFA总量较空白组均在一定程度上减少(P<0.05),意味着大肠杆菌几乎不能利用BDPs产SCFA。BDPs-80酵解组SCFA含量显著低于对照组(P<0.05)。
综上可推测不同组分BDPs可通过促进肠道有益菌和抑制致病菌的生长,从而改变肠道菌群的组成,酵解产生更多有益SCFA,有针对性地改善Ⅱ型糖尿病[16]。
黄刺干果经分级醇沉后得到分子质量不同的3个组分多糖:BDPs-70、BDPs-80及BDPs-90,综合对比3个组分BDPs在同一自由基清除体系或糖苷酶抑制体系,及同一组分BDPs在不同的自由基清除体系和糖苷酶抑制体系中的抗氧化及降血糖能力,显示BDPs-90和BDPs-80的体外抗氧化和降血糖能力较强,可以作为下一步研究的重点。本实验通过对嗜酸乳杆菌和大肠杆菌体外发酵不同组分BDPs产SCFA的研究发现,3种多糖作为碳源均能增加有益菌的丰度和SCFA含量,抑制致病菌的生长,其中BDPs-90对嗜酸乳杆菌体外增殖效果显著,BDPs-80能有效抑制大肠杆菌的生长活性。
综上所述,黄刺多糖作为具有一定开发潜力的天然降糖物质,在糖尿病的预防和治疗中具有广泛前景。根据生物学活性及初步表征的结果,推测不同组分BDPs降血糖能力存在差异可能与多糖的分子质量、结构组成有关。但试验还存在诸多问题,如未对不同组分BDPs进行分离纯化,不能排除粗多糖中其他杂质对活性的影响,体外发酵多糖未结合pH变化曲线,单一菌群难以体现肠道微生物的多样性,难以模拟人体内部环境,不能阐明多糖多途径的调节肠道健康的过程,因此对生物体内缓解氧化应激调节血糖及对肠道微生物的作用机制还有待进一步的试验验证。
[1] 严作庆, 聂俊青.青海野生果树资源调查研究[J].青海农林科技, 2008(2):73-75.
YAN Z Q, NIE J Q.Investigates research on wild fruit tree resources in Qinghai[J].Science and Technology of Qinghai Agriculture and Forestry, 2008(2):73-75.
[2] 向前胜, 王宁, 赵越, 等.青海省3种小檗不同地区、不同部位小檗碱含量的比较研究[J].西南农业学报, 2016, 29(1):54-58.
XIANG Q S, WANG N, ZHAO Y, et al.Comparative study of Berberine in various organs of three kinds of Berberis in different areas of Qinghai province[J].Southwest China Journal of Agricultural Sciences, 2016, 29(1):54-58.
[3] HAN L J, SUO Y R, YANG Y J, et al.Optimization, characterization, and biological activity of polysaccharides from Berberis dasystachya Maxim[J].International Journal of Biological Macromolecules, 2016, 85:655-666.
[4] 韩丽娟, 乔杨波, 索有瑞, 等.直穗小檗果粉对STZ诱导的Ⅰ型糖尿病大鼠糖脂代谢的调节作用[J].食品工业科技, 2020, 41(4):298-306.
HAN L J, QIAO Y B, SUO Y R, et al.Effect of Berberis dasystachya Maxim.fruit powder on glucose and lipid metabolisms in STZ-induced typeⅠdiabetic rats[J].Science and Technology of Food Industry, 2020, 41(4):298-306.
[5] 索有瑞, 韩丽娟, 杨永晶, 等.黄刺果实多糖降血糖的用途:中国, CN104906164B[P].2019-10-11.
SUO Y R, HAN L J, YANG Y J, et al.Effect of Berberis dasystachya Maxim.fruit polysaccharides for lowering blood sugar:China, CN104906164B[P].2019-10-11.
[6] CHAI W Z, TANG K S.Protective potential of cerium oxide nanoparticles in diabetes mellitus[J].Journal of Trace Elements in Medicine and Biology, 2021, 66:126742.
[7] WANG L, LI C, HUANG Q, et al.Polysaccharide from Rosa roxburghii Tratt fruit attenuates hyperglycemia and hyperlipidemia and regulates colon microbiota in diabetic db/db mice[J].Journal of Agricultural and Food Chemistry, 2020,68(1):147-159.
[8] XIE G X, ZHONG W, ZHENG X J, et al.Chronic ethanol consumption alters mammalian gastrointestinal content metabolites[J].Journal of Proteome Research, 2013, 12(7):3 297-3 306.
[9] WEN L, WONG F S.Dietary short-chain fatty acids protect against type 1 diabetes[J].Nature Immunology, 2017, 18(5):484-486.
[10] CHAMBERS E S, BYRNE C S, MORRISON D J, et al.Dietary supplementation with inulin-propionate ester or inulin improves insulin sensitivity in adults with overweight and obesity with distinct effects on the gut microbiota, plasma metabolome and systemic inflammatory responses:A randomised cross-over trial[J].Gut, 2019, 68(8):1 430-1 438.
[11] LIU Y Y, WANG C R, LI J S, et al. Phellinus linteus polysaccharide extract improves insulin resistance by regulating gut microbiota composition[J].The FASEB Journal, 2020,34(1):1 065-1 078.
[12] 陈庆, 李超, 黄婷, 等.刺梨多糖的理化性质、体外抗氧化和α-葡萄糖苷酶抑制活性[J].现代食品科技, 2019, 35(11):114-119;253.
CHEN Q, LI C, HUANG T, et al.Physicochemical characterization, in vitro antioxidant and α-glucosidase inhibitory activity of polysaccharides from Rosa sterilis fruit[J].Modern Food Science and Technology, 2019, 35(11):114-119;253.
[13] ZOU P, YANG X, HUANG W W, et al.Characterization and bioactivity of polysaccharides obtained from pine cones of Pinus koraiensis by graded ethanol precipitation[J].Molecules, 2013, 18(8):9 933-9 948.
[14] LONG H R, GU X Y, ZHOU N, et al.Physicochemical characterization and bile acid-binding capacity of water-extract polysaccharides fractionated by stepwise ethanol precipitation from Caulerpa lentillifera[J].International Journal of Biological Macromolecules, 2020, 150:654-661.
[15] SZEWCZYK K, HEISE E, PIWOWARSKI J.Preliminary characterization and bioactivities of some Impatiens L.water-soluble polysaccharides[J].Molecules, 2018, 23(3):631.
[16] YANG X, JI H Y, FENG Y Y, et al.Structural characterization and antitumor activity of polysaccharides from Kaempferia galanga L[J].Oxidative Medicine and Cellular Longevity, 2018:9579262.
[17] 付海田, 邓超, 王敏, 等.虫草发酵多糖的提取, 结构分析及生物活性研究[J].天然产物研究与开发, 2014, 26(1):111-116.
FU H T, DENG C, WANG M, et al.Extraction, structural identification and bioactivities of polysaccharide from fermented Cordyceps[J].Natural Product Research and Development, 2014, 26(1):111-116.
[18] LIU C, DU P, GUO Y H, et al.Extraction, characterization of aloe polysaccharides and the in-depth analysis of its prebiotic effects on mice gut microbiota[J].Carbohydrate Polymers, 2021, 261(11):117874.
[19] WANG L B, LI L Y, GAO J Y, et al.Characterization, antioxidant and immunomodulatory effects of selenized polysaccharides from dandelion roots[J].Carbohydrate Polymers, 2021, 260:117796.
[20] 龙晓珊, 胡腾根, 邹宇晓, 等.发酵和加工对桑椹抗氧化和降血糖作用的影响[J].食品科学, 2019, 40(11):116-123.
LONG X S, HU T G, ZOU Y X, et al.Effect of fermentation and processing on antioxidant and hypoglycemic activity of mulberry fruit[J].Food Science, 2019, 40(11):116-123.
[21] LIN X M, JI X L, WANG M, et al.An alkali-extracted polysaccharide from Zizyphus jujuba Cv.Muzao:Structural characterizations and antioxidant activities[J].International Journal of Biological Macromolecules, 2019, 136:607-615.
[22] XU Y Q, NIU X J, LIU N Y, et al.Characterization, antioxidant and hypoglycemic activities of degraded polysaccharides from blackcurrant (Ribes nigrum L.) fruits[J].Food Chemistry, 2018, 243:26-35.
[23] 曹冠华, 张雪, 陈月月, 等.阳春砂仁叶和杆乙醇提取物抑菌作用的比较[J].中成药, 2020, 42(7):1 914-1 917.
CAO G H, ZHANG X, CHEN Y Y, et al.Comparison of antibacterial effects of ethanol extracts from Amomum villosum leaves and stems[J].Chinese Traditional Patent Medicine, 2020, 42(7):1 914-1 917.
[24] 翟娅菲, 张星稀, 相启森, 等.南瓜多糖的体外抑菌活性[J].食品研究与开发, 2019, 40(10):70-74.
ZHAI Y F, ZHANG X X, XIANG Q S, et al.Antimicrobial activity of pumpkin polysaccharide in vitro[J].Food Research and Development, 2019, 40(10):70-74.
[25] 郑必胜, 金江涛, 闫文娟.广东虫草多糖的醇沉及凝胶渗透色谱法表征其分子质量分布的研究[J].食品工业科技, 2009, 30(5):120-123.
ZHENG B S, JIN J T, YAN W J.Study on ethanol precipitation of Cordyceps guangdongensis polysaccharide and its molecular weight distribution by GPC[J].Science and Technology of Food Industry, 2009, 30(5):120-123.
[26] 宋丽丽, 闻格, 霍姗浩, 等.小黄姜多糖的分离纯化及其结构特征及抗氧化活性研究[J].食品与发酵工业, 2020, 46(12):73-79.
SONG L L, WEN G, HUO S H, et al.Isolation, purification, structural characterization and antioxidant activity of polysaccharide from Zingiber officinale Roscoe[J].Food and Fermentation Industries, 2020, 46(12):73-79.
[27] MUTAILLIFU P, BOBAKULOV K, ABUDUWAILI A, et al.Structural characterization and antioxidant activities of a water soluble polysaccharide isolated from Glycyrrhiza glabra[J].International Journal of Biological Macromolecules, 2020, 144:751-759.
[28] WANG L B, LIU F C, WANG A X, et al.Purification, characterization and bioactivity determination of a novel polysaccharide from pumpkin (Cucurbita moschata) seeds[J].Food Hydrocolloids, 2017, 66:357-364.
[29] APAK R, ÖZYÜREK M, GÜÇLÜ K, et al.Antioxidant activity/capacity measurement.2.hydrogen atom transfer (HAT)-based, mixed-mode (electron transfer (ET)/HAT), and lipid peroxidation assays[J].Journal of Agricultural and Food Chemistry, 2016,64(5):1 028-1 045.
[30] TIAN J L, SI X, WANG Y H, et al.Bioactive flavonoids from Rubus corchorifolius inhibit α-glucosidase and α-amylase to improve postprandial hyperglycemia[J].Food Chemistry, 2021, 341:128149.
[31] WANG X L, WANG X, JIANG H, et al.Marine polysaccharides attenuate metabolic syndrome by fermentation products and altering gut microbiota:An overview[J].Carbohydrate Polymers, 2018, 195:601-612.
[32] ARORA A, BEHL T, SEHGAL A, et al.Unravelling the involvement of gut microbiota in type 2 diabetes mellitus[J].Life Sciences, 2021, 273:119311.