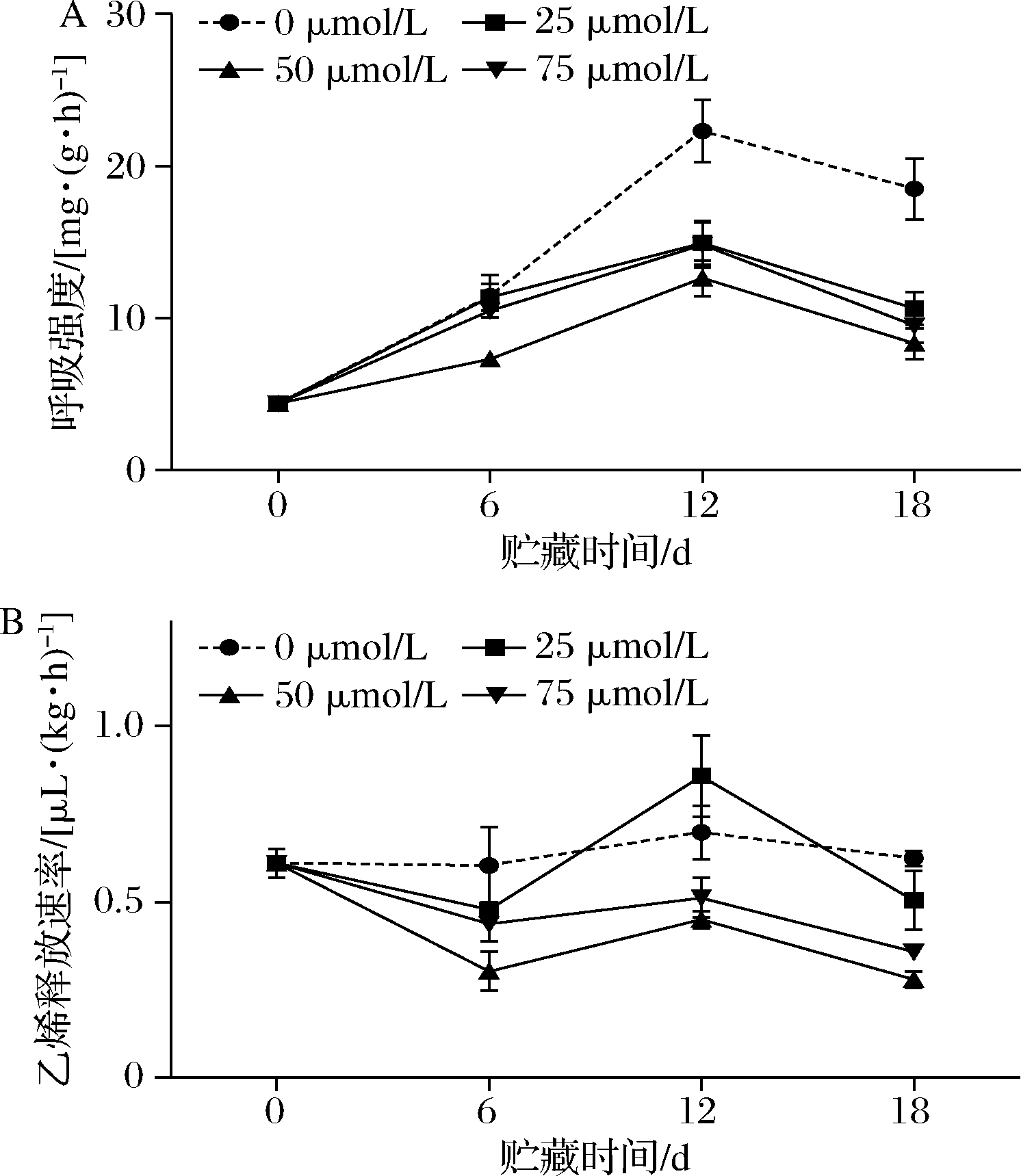
A-枸杞果实呼吸强度;B-乙烯释放速率
图1 褪黑素处理对枸杞果实呼吸强度和乙烯释放速率的影响
Fig.1 Effect of melatonin treatment on respiratory
intensity and ethylene release rate of goji berry
宁夏枸杞(Lycium barbarum L.)为我国西北地区栽培的主要经济林作物,其果实富含多糖、类胡萝卜素、多酚、黄酮和甜菜碱等天然活性成分而具有较高营养价值和保健功效,在国内外药食干制品市场享有盛誉[1]。研究表明,干燥过程易造成枸杞营养和功能成分损失[2],加上人们对新鲜果品消费的追求,枸杞鲜果销售的市场比例将日益增大。然而,枸杞浆果小而多汁,并且采收季节正值高温,给鲜果枸杞采后贮运保鲜带来挑战[3]。因此,开展枸杞果实采后生理及贮藏保鲜技术研究具有重要意义。
褪黑素(melatonin,MT)又名 N-乙酰-5-甲氧基色胺(N-acetyl-5-methoxytryptamine),是一种吲哚类激素物质,广泛存在于动植物中[4]。研究发现,褪黑素具有清除自由基、抗氧化、抗低温胁迫、延缓植物衰老等功能,被认为是一种新的植物生理活动调节剂[5],褪黑素还可应用于园艺作物成熟、衰老和贮藏保鲜的调控[6]。研究发现褪黑素对不同种类果实作用方式不尽相同,例如,褪黑素一方面可以延缓梨[7]、猕猴桃[8]、石榴[9]、桃[10]、柑橘[11]和草莓[12]等果实的采后衰老,但另一方面褪黑素又可促进番茄[13]、杏[14]和葡萄[15]等果实的成熟。然而,有关褪黑素处理对枸杞果实衰老的研究鲜见报道。
本研究以“宁杞5号”鲜果为材料,通过不同浓度外源褪黑素处理,研究其对低温贮藏期间枸杞果实生理指标和贮藏品质的影响,并采用主成分分析法对果实贮藏品质进行综合评价,以期为褪黑素在枸杞果实采后贮运保鲜上的应用提供理论依据和技术支撑。
供试枸杞鲜果(Lycium barbarum L.cv.Ningqi 5)采自宁夏农林科学院枸杞研究所,采摘当天运达实验室,挑选大小、色泽、果形和成熟度基本一致、无病虫害、无机械伤的果实作为试验材料。
UV-9000S型紫外可见分光光度计,上海元析仪器有限公司;H2100A型台式高速冷冻离心机,长沙湘仪离心机有限公司;SAM-706AC型水果糖度酸度测定仪,韩国G-WON公司;TMS-PRO型物性分析仪,美国FTC公司;PL2001-L型天平,梅特勒-托利多(上海)有限公司;HP-200型比色计,中国上海华科光电科技有限公司;7890A型气相色谱仪,美国安捷伦公司。
1.2.1 褪黑素处理枸杞果实
选取无病虫害,大小一致的枸杞果实,用75%(体积分数)乙醇擦拭果实表面消毒。将挑选的果实随机分成4组,分别用0(对照)、25、50和75 μmol/L的褪黑素溶液浸泡5 min,每处理3次重复,然后在室温下自然晾干,放入(4±0.5) ℃、(85±5)% 相对湿度(relative humidity,RH)的保鲜箱中[16]。每隔6 d测定果实的失重率、呼吸强度、乙烯、色泽、固酸比、硬度等指标。同时,在第0、6、12、18天进行果肉取样,去除枸杞籽后,将枸杞果肉混均并用锡箔纸包裹,并立即用液氮速冻后于-80 ℃冰箱保存待测。每处理每个时间点取样30包,每包3 g。
1.2.2 生理和品质指标测定
1.2.2.1 呼吸强度和乙烯释放速率
参照ZHANG等[17]的方法并作改进。称取30粒果实,置于250 mL具塞玻璃瓶中,密封5 h。用气体分析仪直接测定密闭环境中CO2浓度,并计算呼吸强度,以单位时间单位质量果实释放CO2的量表示,单位mg/(kg·h)。同时,从密闭容器中取出一定体积气体,用气相色谱法测定乙烯含量,以单位时间单位质量果实释放乙烯的量表示,单位μL/(kg·h)。
1.2.2.2 超氧阴离子含量
参照ZHANG等[18]方法并修改。取0.1 g果肉组织,加入1 mL pH 7.8的50 mmol/L磷酸提取缓冲液[内含20 g/L 聚乙烯吡咯烷酮,1 mmol/L 乙二胺四乙酸,0.3% (体积分数)TritonX-100]后冰浴匀浆,随后10 000×g、4 ℃离心20 min,取上清置于冰上待测。取待测液0.5 mL于试管中,加入0.4 mL 1 mmol/L盐酸羟胺溶液,混匀后于37 ℃水浴20 min。加入17 mmol/L 4-氨基苯磺酸和7 mmol/L的α-萘胺各0.3 mL,混匀后,37 ℃,20 min。加入氯仿0.5 mL,混匀,8 000×g、25 ℃离心5 min,小心吸取上层水相1.0 mL于530 nm测定吸光度值。超氧阴离子含量表示为每克鲜重果肉的超氧阴离子含量,即为nmol/g。每处理样品重复测定3次。
1.2.2.3 过氧化氢含量
参照WANG等[19]方法并修改。取0.02 g枸杞组织样品,加入0.2 mL 2 g/L三氯乙酸匀浆,4 ℃、12 000×g离心5 min后取上清液待测。取0.1 mL待测液于1.5 mL离心管中,加入0.2 mL 1 mol/L碘化钾溶液,轻轻混匀后于室温(25±3) ℃下放置30 min,然后测定反应体系在560 nm处的吸光度。过氧化氢含量表示为每克鲜重果肉的超氧阴离子含量,即为nmol/g。每处理样品重复测定3次。
1.2.2.4 色泽
在贮藏的第0、6、12、18天,使用校准的比色计对每个果实赤道部位的对称两面测量果皮颜色的a*、b*、L*、C*和H*值。其中,a*值表示呈色物质的绿色(-)到红色(+)偏向,b*值表示是蓝色(-)到黄色(+)偏向;L*代表亮度,数值范围从0(黑色)到100(白色);饱和度C*=(a*2+ b*2)1/2;色调角H*=arctan(b*/a*)[17]。
1.2.2.5 硬度
用质构仪测定果皮硬度[17]。使用直径为2 mm的圆柱形探针进行硬度测量,参数如下:测试前速度100 mm/min,测试速度30 mm/min,测试后速度100 mm/min,穿透距离5 mm,触发力0.05 N。每处理样品重复评估6个水果。
1.2.2.6 固酸比
用水果糖度酸度测定仪进行测定果实糖度(%)和酸度(%),并计算固酸比。
1.2.2.7 总酚和总黄酮含量
参照ZHANG等[17]的方法并作改进。用无水乙醇通过超声提取法提取总酚,将1 mL提取液与等体积福林酚试剂(1∶10,体积比)和1.5 mL 75 g/L 的Na2CO3溶液混合,然后在室温下避光孵育3 h。在765 nm测定吸光度,结果以mg/100g FW表示。每处理重复测定3次。
总黄酮含量的测定[20]:将0.5 mL上述总酚提取液与20%(体积分数)HCL溶液0.5 mL混合,再与37%(体积分数)甲醛溶液0.25 mL混合,并于室温下避光静置24 h。使用滤纸过滤反应溶液后,采用上述福林酚法测定滤液中非黄酮类化合物的含量。最后从总酚含量中减去总非黄酮类含量来计算总黄酮含量,结果以mg/100g FW表示。每处理重复测定3次。
1.2.2.8 类胡萝卜素含量
参照热合曼等[21]方法并修改。标准曲线制作:精密称取β-胡萝卜素标准品4 mg,用少量二氯甲烷溶解后, 石油醚-丙酮(4∶1,体积比)定容于50 mL棕色容量瓶中,分别量取0.5、1.0、1.5、2.0、2.5和3.0 mL 至10 mL棕色容量瓶中,用石油醚-丙酮(4∶1,体积比)定容,在448 nm处测定其吸光度,制作标准曲线。
样品测定:称取枸杞1.000 0 g(精确到0.000 1 g),按料液比1∶15(g∶mL)加15 mL V(石油醚)∶V(丙酮)=4∶1的混合溶液,室温条件下超声提取3次,每次20 min,过滤合并滤液,滤渣洗涤数次至滤液无色为止,定容至250 mL棕色容量瓶中,于448 nm处测定其吸光度,并按标准曲线方程算出相应的类胡萝卜素含量。类胡萝卜素含量以%表示,每处理重复测定3次。整个实验需在避光下进行。
采用GraphPad Prism 5.0计算平均值、标准偏差并绘制图表;采用SPSS 21.0软件对数据进行统计分析,用Duncan′s检验进行差异显著性分析(P<0.05为差异显著);采用XLSTAT 2016 对数据进行主成分分析。
2.1.1 对呼吸强度和乙烯释放速率的影响
褪黑素处理对枸杞果实呼吸强度的影响如图1-A所示。贮藏期间各组果实的呼吸强度均呈现先上升后下降的单峰形变化趋势,在第12天时达到峰值,对照组呼吸峰值最大。贮藏第18天时,对照组果实的呼吸强度高达18.49 mg/(kg·h),同期25、50和75 μmol/L褪黑素处理组果实的呼吸强度分别比对照组低7.87、10.18、和9.01 mg/(kg·h)。其中,50 μmol/L褪黑素处理组果实的呼吸强度在整个贮藏期始终处于最低水平。
如图1-B所示,不同时间点不同浓度褪黑素处理对枸杞果实乙烯释放速率的影响不同。随贮藏时间的延长,果实的乙烯释放速率呈现出下降后上升最后又下降的趋势,乙烯释放速率在第12天时达到峰值。第18天时,各浓度褪黑素处理组果实的乙烯释放速率均低于对照组[0.62 mg/(kg·h)],而50 μmol/L褪黑素处理组果实的乙烯释放速率最低。

A-枸杞果实呼吸强度;B-乙烯释放速率
图1 褪黑素处理对枸杞果实呼吸强度和乙烯释放速率的影响
Fig.1 Effect of melatonin treatment on respiratory
intensity and ethylene release rate of goji berry
2.1.2 对超氧阴离子和过氧化氢含量的影响
不同时间点不同浓度褪黑素处理对枸杞果实超氧阴离子含量的影响不同(图2-A)。枸杞果实中的超氧阴离子含量随着贮藏时间的延长而逐渐增加,在第18天时含量最高。贮藏第12天时,25、50和75 μmol/L 褪黑素处理果实的超氧阴离子含量分别为118.56、108.91和100.52 nmol/g,比同期对照(125.51 nmol/g)低5.54%、13.23%和19.91%。
由图2-B可以看出,各组枸杞果实中过氧化氢含量的变化趋势基本一致,整体呈先上升后下降的趋势。贮藏第12 d时,25、50和75 μmol/L褪黑素处理组比同期对照组(4 245.32 nmol/g)分别低22.11%、26.07%、6.57%。在第18天时,褪黑素处理组果实的过氧化氢积累量仍低于对照组。
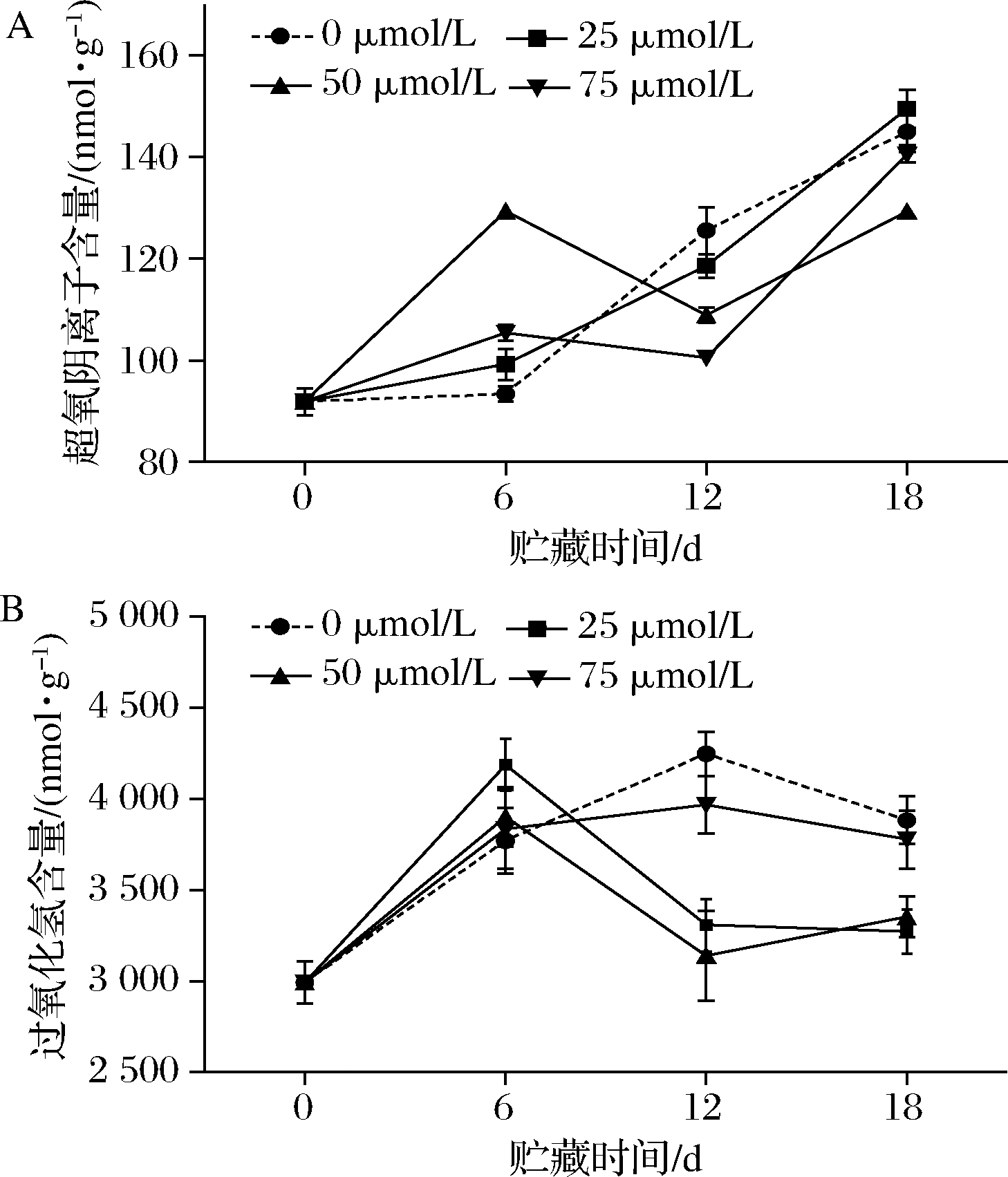
A-超氧阴离子;B-过氧化氢
图2 褪黑素处理对枸杞果实超氧阴离子和过氧化氢
含量的影响
Fig.2 Effect of melatonin treatment on the content of
superoxide anion and hydrogen peroxide in goji berry
2.2.1 褪黑素处理对枸杞果实品质指标的影响
褪黑素处理对枸杞果实色泽、硬度、固酸比、总酚、类黄酮、类胡萝卜素等品质指标的影响结果如表1所示。在贮藏期间,各组枸杞果实L*、a*、b*、C*、H*值总体呈下降趋势。在贮藏第6天时,各组a*、b*、H*值均无显著差异(P<0.05),而在贮藏第12天时,50 μmol/L处理组的a*和C*值均显著高于(P<0.05)同期对照组;在贮藏第18天时,25和50 μmol/L处理组的a*、b*和C*值均比同期对照组高(P<0.05)。
表1 褪黑素处理对枸杞果实品质指标的影响
Table 1 Effect of melatonin treatment on fruit quality index of goji berry

贮藏时间/d褪黑素/(μmol·L-1)L*a*b*C*H*硬度/N固酸比总酚含量/[mg·(100g)-1 FW]类黄酮含量/[mg·(100g)-1FW]类胡萝卜素含量/%0035.93±1.39a27.47±6.16a14.05±1.24a30.90±5.97a26.00±5.60a1.44±0.18a20.14±0.98a234.34±37.87a178.83±38.28a0.18±0.00a2535.93±1.39a27.47±6.16a14.05±1.24a30.90±5.97a26.00±5.60a1.44±0.18a20.14±0.98a234.34±37.87a178.83±38.28a0.18±0.00a5035.93±1.39a27.47±6.16a14.05±1.24a30.90±5.97a26.00±5.60a1.44±0.18a20.14±0.98a234.34±37.87a178.83±38.28a0.18±0.00a7535.93±1.39a27.47±6.16a14.05±1.24a30.90±5.97a26.00±5.60a1.44±0.18a20.14±0.98a234.34±37.87a178.83±38.28a0.18±0.00a6035.81±2.45a25.11±4.24a13.63±2.33a36.30±1.87a28.52±1.43a1.20±0.23a15.79±2.93b219.60±29.21b170.88±36.93b0.26±0.00a2532.93±3.34b21.08±4.55a11.57±1.44a24.09±4.53b29.18±3.62a1.19±0.29a15.53±0.56b217.81±27.73b159.34±18.66b0.25±0.00a5033.68±1.53a24.62±2.25a13.11±1.53a27.92±2.25b28.10±2.72a0.98±0.23a28.10±2.72a278.13±40.48a221.23±39.09a0.24±0.00b7532.45±1.08b22.51±3.37a12.31±1.08a25.65±3.29b28.89±3.89a1.35±0.38a24.90±1.99a269.56±15.80aa214.86±16.09a0.17±0.00c12035.25±1.19a24.59±0.91b14.60±0.76a29.81±2.91b30.23±2.23a1.24±0.26a14.42±0.39b256.46±26.03b199.27±24.62b0.16±0.00c2534.70±0.73b22.80±4.18b12.42±1.41b26.09±4.17b28.95±3.39a1.14±0.23a14.48±0.67b277.52±39.68ab221.07±34.76ab0.20±0.01a5034.83±1.34a27.88±3.91a13.45±1.34ab30.90±4.22a25.53±1.86b1.23±0.17a25.53±1.86a314.97±18.99a260.54±18.51a0.19±0.00b7533.28±1.71b23.50±2.96b12.23±1.71b26.50±3.34b27.51±0.53ab1.26±0.15a22.99±1.77a347.65±13.42a287.05±12.84a0.19±0.00b18034.36±0.48b22.24±5.81b12.51±1.68b31.47±1.41b27.74±2.30a1.04±0.09b9.76±0.93b250.89±12.81b198.49±19.19b0.13±0.00d2532.69±0.67b27.45±2.19a14.27±1.24a32.94±3.00a25.71±1.37ab1.14±0.18a9.65±1.84b311.54±42.72ab254.95±46.31ab0.19±0.00b5035.24±1.44a31.37±3.40a14.36±0.64a33.18±2.72a25.50±2.94ab1.13±0.25a25.50±2.94a330.59±10.51a270.59±9.33a0.22±0.00a7535.05±0.64a29.67±2.83a13.40±0.90ab30.05±2.26b23.92±2.44b1.12±0.29a20.37±9.52a364.84±50.73a307.58±52.56a0.16±0.01c
注:同一指标同一时间点不同字母表示差异显著(P<0.05)
在贮藏期间,随着时间的延长,枸杞果实的硬度和固酸比总体呈逐渐下降的趋势。贮藏第18天时,25、50和75 μmol/L褪黑素处理果实的硬度均显著高于(P<0.05)同期对照,分别是对照的1.10、1.09、1.08倍。在贮藏期间,50和75 μmol/L处理组的固酸比始终高于对照组(P<0.05)。
枸杞果实在贮藏期间的总酚及类黄酮含量总体均呈上升趋势,对照组的总酚及类黄酮含量始终处于较低水平。贮藏第12天时,对照组总酚含量达到峰值250.89 mg GAE/100g,同期50和75 μmol/L褪黑素处理组总酚含量分别为对照组的1.23和1.36倍,且与对照组存在显著性差异(P<0.05)。果实的类黄酮含量在贮藏第12天达到峰值199.27 mg GAE/100g,同期50和75 μmol/L褪黑素处理组的类黄酮含量显著高于(P<0.05)对照组,分别比对照组高出30.75%和44.05%。第18天时,50和75 μmol/L褪黑素处理组总酚及类黄酮含量仍显著高于(P<0.05)同期对照组。
类胡萝卜素含量在贮藏期间呈先上升后下降的趋势,且各处理组类胡萝卜素含量在12和18 d时均显著高于(P<0.05)对照组;第18天时,50 μmol/L的类胡萝卜素含量最高,为对照组的1.69倍。
2.2.2 枸杞果实贮藏期间品质的主成分分析
研究首先开展了Kaiser-Meyer-Olkin(KMO)检验和Bartlett′s球形检验,结果显示,KMO统计量为0.669,Bartlett球形度检验P(Sig.)<0.000 1,各变量之间存在显著相关性,适合进行主成分分析。通过主成分分析得出各主成分的特征值、方差贡献率、累积方差贡献率(表2)。由表2可知,前2个主成分的特征值均大于1,累积方差贡献率达到85.74%,说明前2个主成分反映了原始变量的绝大部分信息,符合分析要求。因此取前2个主成分做二维得分双标图(图3)与散点图(图4),研究所选变量与因子之间的相关性,从中分析可能得到信息。
表2 七个主成分的特征向量、特征值、
贡献率及累计贡献率
Table 2 The eigenvector, eigenvalue, account and
total account of 7 principal components
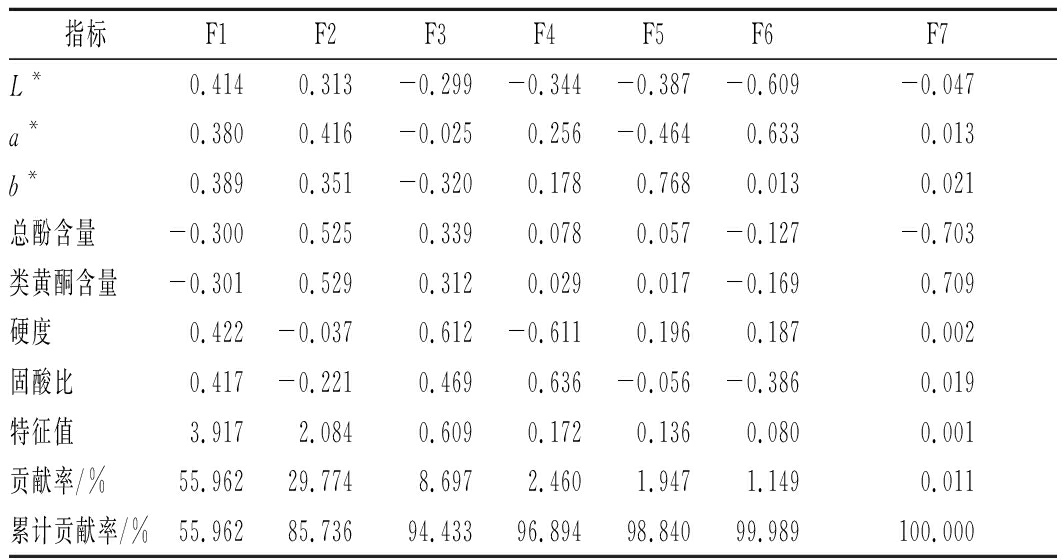
指标F1F2F3F4F5F6F7L*0.4140.313-0.299-0.344-0.387-0.609-0.047a*0.3800.416-0.0250.256-0.4640.6330.013b*0.3890.351-0.3200.1780.7680.0130.021总酚含量-0.3000.5250.3390.0780.057-0.127-0.703类黄酮含量-0.3010.5290.3120.0290.017-0.1690.709硬度0.422-0.0370.612-0.6110.1960.1870.002固酸比0.417-0.2210.4690.636-0.056-0.3860.019特征值3.9172.0840.6090.1720.1360.0800.001贡献率/%55.96229.7748.6972.4601.9471.1490.011累计贡献率/%55.96285.73694.43396.89498.84099.989100.000
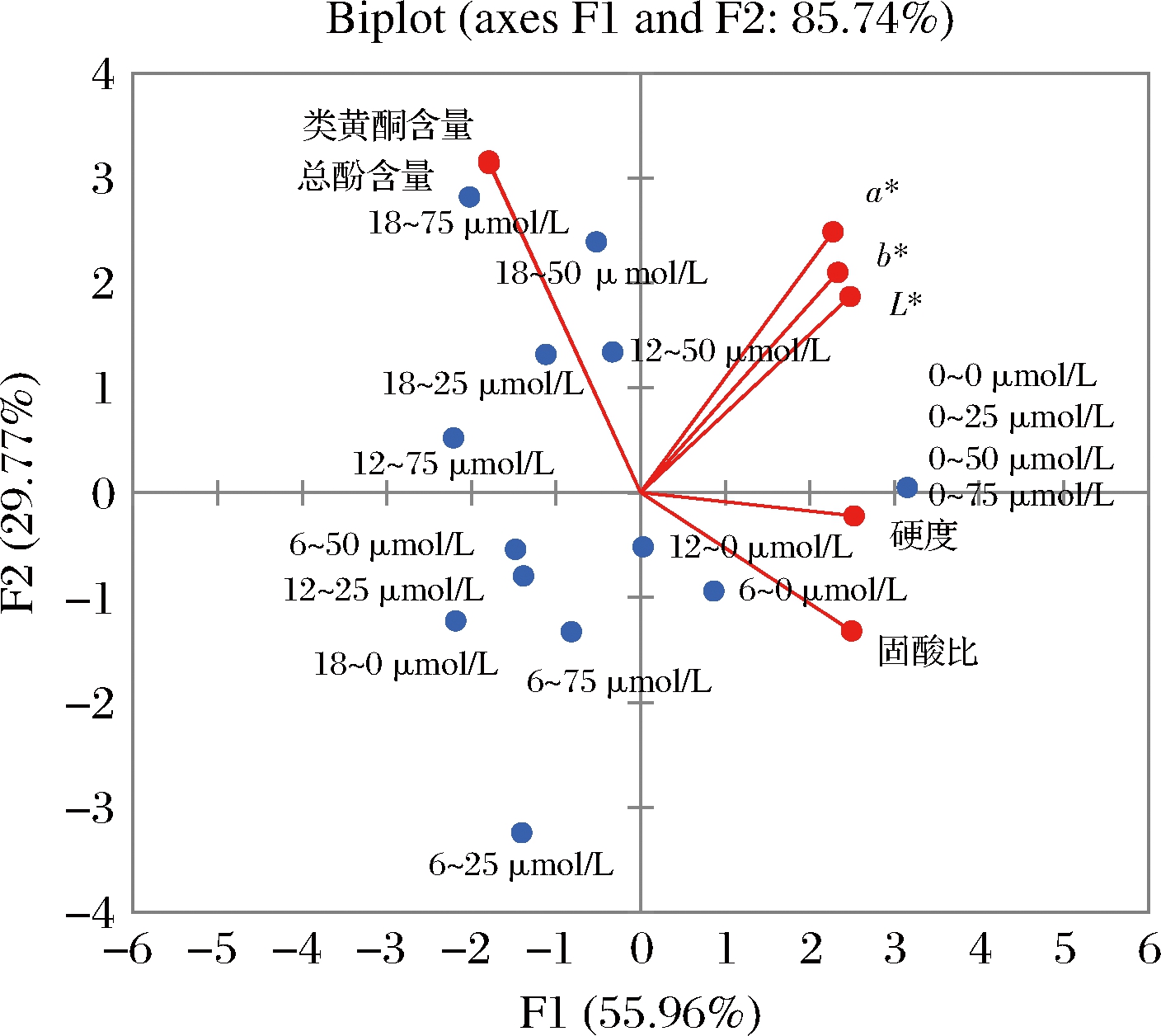
图3 枸杞果实贮藏品质主成分分析双标图
Fig.3 Double plot of scores for principal component
analysis of storage quality in goji berry
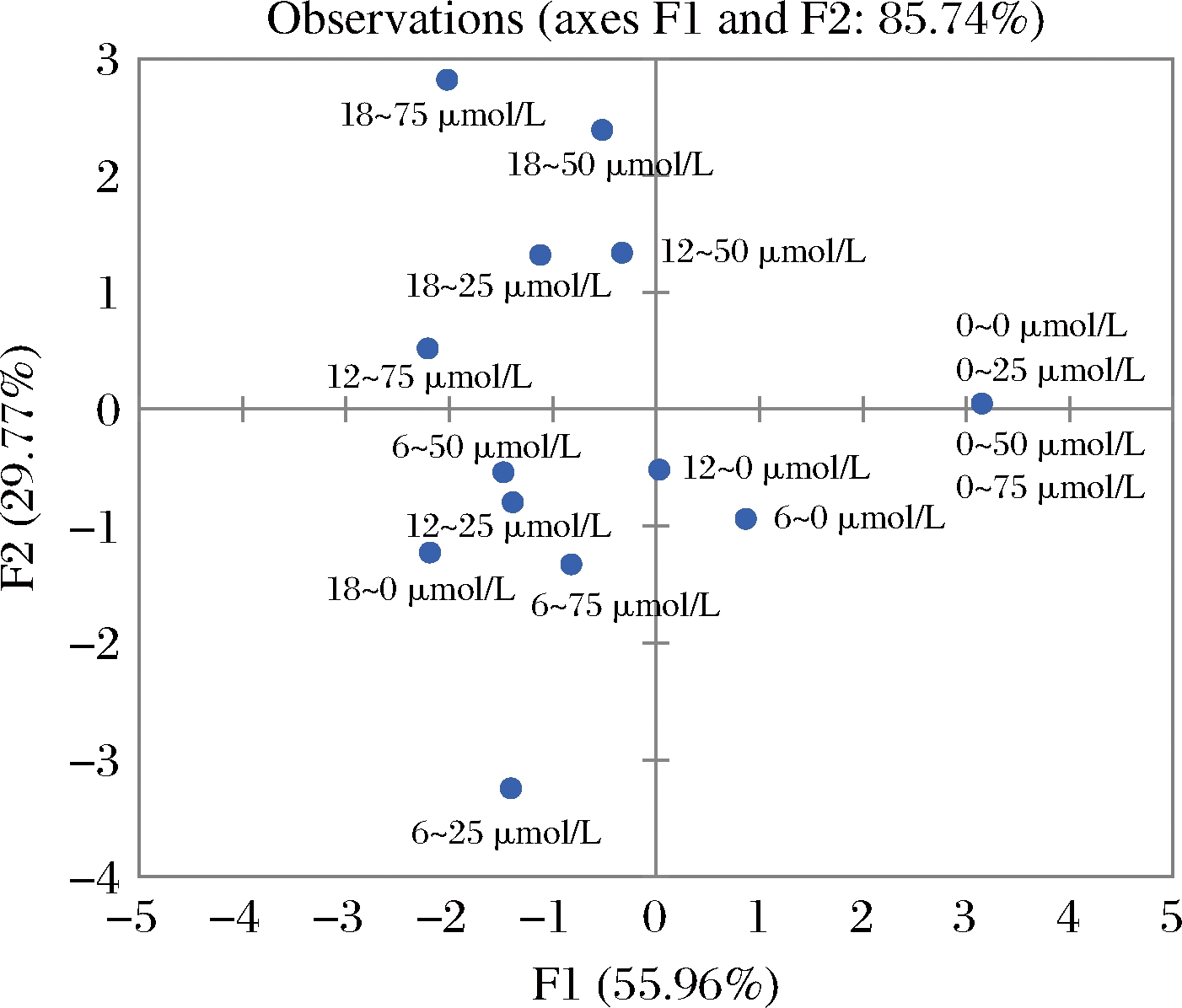
图4 枸杞果实贮藏品质主成分分析散点图
Fig.4 Distribution point diagram of principal
component analysis of storage quality in goji berry
由图3可知,主成分F1与L*、a*、b*、硬度及固酸比呈正相关,而与总酚含量、类黄酮含量呈负相关。结合图3、图4数据的分布情况可知,主成分F1可根据贮藏时间区分不同处理枸杞果实品质,即较长的贮藏时间对应于较差的品质指标。0~0、0~25、0~50及0~75 μmol/L位于双标图的右上象限,其特征是对应较高L*、a*、b*、硬度及固酸比。随贮藏时间的延长,在第6天时,各组均由右半区向左半区移动,枸杞果实的色泽、硬度和固酸比开始下降。在第12天时,褪黑素处理组(12~50、12~75 μmol/L)的枸杞果实的因子得分位于左上象限,对应较高的总酚及类黄酮含量;相比之下,对照组(12~0 μmol/L)位于负坐标处,表明其总酚和类黄酮的积累量较低,且色泽品质较差。贮藏结束时,各组都已从右半区移至左半区,果实色泽逐渐变得暗黄,果肉开始变软,品质逐渐下降。此时,对照组(18~0 μmol/L)处于左下象限,果实内总酚及类黄酮含量较少,枸杞的色泽、质地较差,贮藏品质不佳。与此相反,褪黑素处理组(18~25、18~50、18~75 μmol/L)均处于左上象限,枸杞果实内总酚和类黄酮的积累量较高,有效延缓了枸杞果实衰老,使枸杞品质得以较好地保持。
研究结果表明,枸杞果实贮藏期间,生理活动活跃,品质发生劣变,表现为果实呼吸强度和乙烯释放速率升高,色泽、硬度和固酸比下降;褪黑素处理有效延缓了枸杞果实贮藏前期果实色泽、硬度和固酸比等品质指标的下降,抑制呼吸强度升高,保持了较好的果实品质。但在贮藏后期对其品质影响不大,这可能是由于枸杞果实进入衰老期,活性氧代谢紊乱造成果实品质发生劣变。这与GAO等[10]和AGHDAM等[12]报道结果类似。此外,从品质指标测定结果可以看出贮藏末期果实品质是远远低于贮藏初期,这与李玉等[22]的报道结果类似。
在贮藏过程中,果实体内活性氧会不断积累,主要体现在超氧阴离子含量和过氧化氢含量的升高,这使得细胞出现脂质过氧化现象,导致细胞膜的退化,从而加速其衰老进程[23]。本试验结果表明,经褪黑素处理后,枸杞果实中超氧阴离子的积累量在短期增加后持续下降,且显著低于(P<0.05)对照组;贮藏后期,50 μmol/L褪黑素处理组效果最佳。这可能是由于褪黑素作为抗氧化剂,直接消除活性氧,激活抗氧化系统,提高其他抗氧化剂的效率,从而延缓枸杞果实的衰老[24]。第6天时,褪黑素处理组果实中出现了较高水平的过氧化氢含量,且各处理组均高于对照组。这与SHARAFI等[25]的研究结果相符,可能是由于过氧化氢作为信号促进内源褪黑素和γ-氨基丁酸的生物合成,从而有利于枸杞果实在冷藏过程中缓解应激,延缓衰老,保持感官和营养品质。然而贮藏6 d之后,经25和50 μmol/L褪黑素处理的枸杞果实内过氧化氢的积累量持续降低,表明褪黑素处理改善了枸杞果实中氧化应激,这可能是由于内源褪黑素积累表现出优越的活性氧清除特性[26]。酚类物质是植物中重要的次生代谢产物,有很强的清除自由基和抗氧化的能力[27];50 μmol/L褪黑素处理组在整个贮藏期保持较高总酚含量,延缓果实衰老的进程,延长贮藏期限。类黄酮则是重要的植保素,与果实抗氧化活性密切相关[28],褪黑素处理使果实保持较高类黄酮含量,维持了枸杞鲜果的抗氧化活性与营养品质。类胡萝卜素是枸杞的一类主要特征性功效成分,具有较高营养价值;50 μmol/L褪黑素处理可以减缓类胡萝卜素分解,使枸杞果实的营养品质得以较好保持,这一结果在MARCHETTI等[29]的研究中也被证实。
主成分分析法是利用降维的思维,运用线性变化将多个变量简化成少数综合变量的一种统计分析方法。这些综合指标能保留原有指标的大部分信息,且相互独立,避免了重复信息的干扰,分析结果更加合理,同时具有较强代表性,增加了可信度[30]。为避免单一品质指标分析的片面性,本研究通过主成分分析法对枸杞果实采后各品质指标进行了综合性评价。评价结果表明,L*、a*、b*、总酚含量、类黄酮含量、硬度及固酸比所代表的2个主成分可以客观地反映原始数据的大部分信息,显示了贮藏期间枸杞果实综合品质的动态变化;随着贮藏时间的延长,枸杞果实综合品质逐渐下降,而褪黑素处理在果实贮藏期间能减缓枸杞果实品质下降,延长果实的贮藏期限。
综上所述,外源褪黑素处理能够抑制枸杞鲜果采后呼吸强度和乙烯释放速率,清除果实体内的活性氧,有效保持果实色泽、硬度、固酸比、总酚含量、类黄酮含量和类胡萝卜素含量,从而延缓低温贮藏期间枸杞鲜果品质的下降,在枸杞果实采后贮运保鲜中具有潜在的应用前景。
[1] 王益民, 张珂, 许飞华, 等.不同品种枸杞子营养成分分析及评价[J].食品科学, 2014, 35(1):34-38.
WANG Y M, ZHANG K, XU F H, et al.Chemical analysis and nutritional evaluation of different varieties of goji berries (Lycium barbarum L.)[J].Food Science, 2014, 35(1):34-38.
[2] 曲云卿, 张同刚, 刘敦华.不同干燥方式枸杞挥发性风味成分的比较及主成分分析[J].食品工业科技, 2015, 36(11):296-300;388.
QU Y Q, ZHANG T G, LIU D H.Comparison of volatile flavor components in wolfberry with different drying methods and principal component analysis[J].Science and Technology of Food Industry, 2015, 36(11):296-300;388.
[3] 白小东, 毕阳, 李永才, 等.果蔬采后病害的潜伏侵染机理研究进展[J].食品科学, 2015, 36(7):278-282.
BAI X D, BI Y, LI Y C, et al.Mechanism of latent infection for postharvest diseases of fruits and vegetables[J].Food Science, 2015, 36(7):278-282.
[4] 王蕊, 杨小龙, 须晖, 等.高等植物褪黑素的合成和代谢研究进展[J].植物生理学报, 2016, 52(5):615-627.
WANG R, YANG X L, XU H, et al.Research progress of melatonin biosynthesis and metabolism in higher plants[J].Acta Plant Physiology, 2016, 52(5):615-627.
[5] WANG S Y, SHI X C, WANG R, et al.Melatonin in fruit production and postharvest preservation:A review[J].Food Chemistry, 2020, 320(12):55-59.
[6] 巩彪, 史庆华.园艺作物褪黑素的研究进展[J].中国农业科学, 2017, 50(12):2 326-2 337.
GONG B, SHI Q H.Review of melatonin in horticultural crops[J].Agricultural Sciences in China, 2017, 50(12):2 326-2 337.
[7] ZHAI R, LIU J, LIU F, et al.Melatonin limited ethylene production, softening and reduced physiology disorder in pear (Pyrus communis L.) fruit during senescence[J].Postharvest Biology and Technology, 2018, 139(54):38-46.
[8] 胡苗, 李佳颖, 饶景萍.褪黑素处理对采后猕猴桃果实后熟衰老的影响[J].食品科学, 2018, 39(19):226-232.
HU M, LI J Y, RAO J P.Effect of melatonin on ripening and senescence of postharvest kiwifruits[J].Food Science, 2018, 39(19):226-232.
[9] AGHDAM M S, LUO Z S, LI L, et al.Melatonin treatment maintains nutraceutical properties of pomegranate fruits during cold storage[J].Food Chemistry, 2020, 303:125385.
[10] GAO H, ZHANG Z K, CHAI H K, et al.Melatonin treatment delays postharvest senescence and regulates reactive oxygen species metabolism in peach fruit[J].Postharvest Biology and Technology, 2016, 118(23):103-110.
[11] LIN Y L, FAN L Q, XIA X H, et al.Melatonin decreases resistance to postharvest green mold on citrus fruit by scavenging defense-related reactive oxygen species[J].Postharvest Biology and Technology, 2019, 153:21-30.
[12] AGHDAM M S, FARD J R.Melatonin treatment attenuates postharvest decay and maintains nutritional quality of strawberry fruits (Fragaria×anannasa cv.Selva) by enhancing GABA shunt activity[J].Food Chemistry, 2017, 221(6):1 650-1 657.
[13] SUN Q Q, ZHANG N, WANG J F, et al.Melatonin promotes ripening and improves quality of tomato fruit during postharvest life[J].Journal of Experimental Botany, 2015, 66(3):657-668.
[14] 张婷婷, 李永才, 毕阳, 等.采后褪黑素处理对杏果实成熟的影响[J].中国果树, 2019(1):27-31.
ZHANG T T, LI Y C, BI Y, et al.Effect of postharvest melatonin treatment on ripening of apricot fruit[J].China Fruits, 2019(1):27-31.
[15] MENG J F, XU T F, SONG C Z, et al.Melatonin treatment of pre-veraison grape berries to increase size and synchronicity of berries and modify wine aroma components[J].Food Chemistry, 2015, 185(15):127-134.
[16] 王军节, 李贞彪, 张怀予, 等.香芹酚处理对枸杞鲜果采后黑霉病的控制[J].食品工业科技, 2019, 40(8):229-233;240.
WANG J J, LI Z B, ZHANG H Y, et al.Control of carvacrol treatment on black mold of postharvest goji berry[J].Science and Technology of Food Industry, 2019, 40(8):229-233;240.
[17] ZHANG H Y, MA Z M, WANG J J, et al.Treatment with exogenous salicylic acid maintains quality, increases bioactive compounds, and enhances the antioxidant capacity of fresh goji (Lycium barbarum L.) fruit during storage[J].LWT-Food Science and Technology, 2021, 140:110837.
[18] ZHANG Y Y, HUBER D J, HU M J, et al.Delay of postharvest browning in litchi fruit by melatonin via the enhancing of antioxidative processes and oxidation repair[J].Journal of Agricultural & Food Chemistry, 2018,66(28):7 475-7 484.
[19] WANG Z, MA L, ZHANG X, et al.The effect of exogenous salicylic acid on antioxidant activity, bioactive compounds and antioxidant system in apricot fruit[J].Scientia Horticulturae, 2015, 181:113-120.
[20] DEETAE P, PARICHANON P, TRAKUNLEEWATTHANA P, et al.Antioxidant and anti-glycation properties of Thai herbal teas in comparison with conventional teas[J].Food Chemistry, 2012, 133(3):953-959.
[21] 艾百拉·热合曼, 王璇, 赵亮, 等.干燥方法对枸杞营养和功能成分的影响[J].食品科学, 2017, 38(9):138-142.
REHEMAN A, WANG X, ZHANG L, et al.Nutrition and functional components of Chinese wolfberry dried by different drying methods[J].Food Science, 2017, 38(9):138-142.
[22] 李玉, 张铭容, 董红敏, 等.1-MCP对佛手瓜低温贮藏品质影响的主成分分析和综合评价[J].食品与发酵工业, 2015, 41(11):204-209.
LI Y, ZHANG M R, DONG H M, et al.Principal component analysis and comprehensive assessment on influence of 1-MCP on chayote fruit quality during cold storage[J].Food and Fermentation Industry, 2015, 41(11):204-209.
[23] 辛丹丹, 司金金, 寇莉萍.黄瓜采后外源褪黑素处理提高品质和延缓衰老的研究[J].园艺学报, 2017, 44(5):891-901.
XIN D D, SI J J, KOU L P.Postharvest exogenous melatonin enhances quality and delays the senescence of cucumber[J].Horticultural Plant Journal, 2017, 44(5):891-901.
[24] DEBNATH B, ISLAM W, LI M, et al.Melatonin mediates enhancement of stress tolerance in plants[J].International Journal of Molecular Sciences, 2019, 20(5):1 040-1 043.
[25] SHARAFI Y, AGHDAM M S, LUO Z S, et al.Melatonin treatment promotes endogenous melatonin accumulation and triggers GABA shunt pathway activity in tomato fruits during cold storage[J].Scientia Horticulturae, 2019, 254(6):222-227.
[26] GALANO A, REITER R J.Melatonin and its metabolites versus oxidative stress:From individual actions to collective protection[J].Journal of Pineal Research, 2018, 65(1):19-25.
[27] HATANO T, MIYATAKE H, NATSUME M, et al.Proanthocyanidin glycosides and related polyphenols from cacao liquor and their antioxidant effects[J].Phytochemistry, 2002, 59(7):49-58.
[28] 刘帅民, 胡康琦, 刘港帅, 等.外源褪黑素处理对鲜切芒果贮藏品质的影响[J].食品科学, 2020, 634(21):169-175.
LIU S M, HU K Q, LIU G S, et al.Effect of exogenous melatonin treatment on storage quality of fresh-cut mango[J].Food Science, 2020, 634(21):169-175.
[29] MARCHETTI C, SIDAHMED-ADRAR N, COLLIN F, et al.Melatonin protects PLPC liposomes and LDL towards radical-induced oxidation[J].Journal of Pineal Research, 2011, 51(3):286-296.
[30] 牟红梅, 于强, 李庆余, 等.基于主成分分析的烟台地区西洋梨果实品质综合评价[J].果树学报, 2019, 36(8):126-134.
MU H M, YU Q, LI Q Y, et al.Synthetic evaluation of fruit quality of common pears (Pyrus communis L.)based on principal component analysis in Yantai areas[J].Journal of Fruit Science, 2019, 36(8):126-134.