表1 腥味评价表
Table 1 Fishy smell evaluation form
腥味程度微有腥味 腥味一般 腥味偏重腥味较重腥味值/分0~23~56~88~10
小球藻(Chlorella)属于单细胞真核微藻,我国常见的有普通小球藻(C.vulgaris)、蛋白核小球藻(C.pyrenoidosa)和椭圆小球藻(C.ellipoidea)等[1-3]。小球藻中含有丰富的蛋白质、不饱和脂肪酸、多糖、维生素、微量元素和一些生物活性物质等[4-7]。小球藻生长因子(chlorella growth factor, CGF),也叫小球藻精,是一种由新鲜优质的小球藻细胞经多次离析浓缩和萃取提取到的有较高营养价值的活性物质。由于小球藻具有藻类特有的腥味,在应用于食品开发时还需要进一步加工以去除或遮盖腥味,尤其在制备饮品时脱腥是关键[6, 8-9]。
目前,已经开发的脱腥方法主要有包埋法、吸附法、遮蔽法、酵母发酵等。包埋法与遮蔽法主要是通过包裹或掩盖腥味物质,以达到脱腥效果,但由于包埋剂及遮蔽剂添加量限制,包埋遮蔽效果有限,需要与其他方法同时使用才能达到较好的脱腥效果;吸附法主要是通过将腥味物质与有效成分分离达到脱腥效果,但无法保证只吸附腥味物质;通过酵母发酵法脱腥,一方面是酵母本身疏松的结构对腥味物质具有类似活性炭的吸附作用,另一方面酵母中含有的某些酶对腥味物质有一定的酶解作用,但酶解可能会破坏一些蛋白质类功能成分。本文以加热法、包埋法、遮蔽法为单因素,研究了两种复合脱腥法工艺,旨在找到一种较好的脱腥方法,为进一步制备小球藻生长因子饮品提供基础。
小球藻生长因子液,广西生巴达生物科技有限公司;β-环状糊精(食品级,市售),孟州市华兴生物化工有限责任公司;茉莉花粉(食品级,市售),枫之味(福建)生物科技有限公司;绿茶提取物(食品级,市售),陕西嘉禾生物。
FlavourSpec®食品风味分析仪含CTC自动顶空进样器,德国 G.A.S 公司。
1.2.1 单因素脱腥工艺
1.2.1.1 加热法脱腥
取5 mL小球藻生长因子液,在保证其他条件相同的情况下,水浴加热30、45、60、75、90 min;取5 mL小球藻生长因子液,在保证其他条件相同的情况下,水浴加热40、50、60、70、80 ℃,冷却后以表1腥味值为评价指标进行腥味感官评价[10]。
1.2.1.2 包埋法脱腥
取5 mL小球藻生长因子液,常温下添加β-环糊精作为包埋剂,充分摇匀后静置5 min,确保β-环糊精溶解完全。控制β-环糊精的添加量(0.01、0.02、0.03、0.04、0.05 g/100mL)变化,以表1腥味值为评价指标进行腥味感官评价[10]。
1.2.1.3 遮蔽法脱腥
取5 mL小球藻生长因子液,常温下添加茉莉花粉和绿茶提取物作为遮蔽剂,充分摇匀。控制茉莉花粉的添加量(1、2、3、4、5 g/100mL)变化;控制绿茶提取物的添加量(1、2、3、4、5 g/100mL)变化,以表1腥味值为评价指标进行腥味感官评价[10]。
表1 腥味评价表
Table 1 Fishy smell evaluation form
腥味程度微有腥味 腥味一般 腥味偏重腥味较重腥味值/分0~23~56~88~10
1.2.2 复合脱腥工艺
1.2.2.1 包埋-加热复合法
在单因素试验的基础上,选取包埋法和加热法交互脱腥,分别取5 mL小球藻生长因子液,选取β-环糊精添加量、加热温度、加热时间为3个单因素,以表2 L9(33)正交表进行试验[10]。
表2 包埋法-加热复合法因素水平表
Table 2 Factor level table of embedding heating
composite method

水平因素A(β-环糊精添加量)/[g·(100mL)-1]B(加热温度)/℃C(加热时间)/min10.02406020.03507530.046090
1.2.2.2 遮蔽-加热复合法
在单因素试验的基础上,选取遮蔽法和加热法交互脱腥,分别选取茉莉花粉(添加量)/绿茶提取物添加量、加热温度、加热时间为3个单因素,以表3、表4 L9(33)正交表进行试验[11]。
表3 遮蔽-加热复合法因素水平表
Table 3 Factor level table of shielding heating composite method

水平因素A(茉莉花茶添加量/绿茶提取物添加量)/[g·(100mL)-1]B(加热温度)/℃C(加热时间)/min114060225075336090
1.2.3 气相-离子迁移谱(gas chromatography-lon mobility spectrometry,GC-IMS)分析方法
参照顾赛麒等[12]、邵悦春等[13]的方法略作修改。取1 mL样品至20 mL顶空进样瓶,设置1组平行对照,准备进样。孵化温度60 ℃,孵化时间10 min,进样方式为顶空进样,进样体积500 μL,进样针温度65 ℃,加热方式为振荡加热,振荡速度500 r/min,不分流,清洗时间5 min。
色谱柱FS-SE-54-CB-1;石英毛细管柱(15 m×0.53 mm,0.5 μm);色谱柱温度50 ℃;载气N2(纯度≥99.999%);载气流速:初始流速 0~2 min,2 mL/min;2~10 min,2~15 mL/min;10~15 min,15~100 mL/min;15~20 min,100 mL/min;20~25 min,100~150 mL/min;分析时间25 min。
漂移管长度98 mm;管内线性电压500 V/cm;漂移管温度45 ℃;漂移气N2(纯度≥99.999%);漂移气流量150 mL/min;放射源β射线(氚,3H);离子化模式,正离子。
1.2.4 数据处理
采用SPSS 26、Origin 9.0软件对数据进行统计和绘图。通过GC-IMS自带的LAV软件制作挥发性物质(volatile organic compounds,VOCs)二维谱图、定性、指纹图谱。
2.1.1 加热法脱腥效果
在不同加热时间下,小球藻生长因子液脱腥后腥味值变化如由图1-a所示,随着加热时间的增长,脱腥值呈现先下降后上升再下降的趋势,当加热时间为75 min时,其腥味值降到最低。在不同加热温度下,小球藻生长因子液脱腥后腥味值变化如由图1-b所示,当脱腥温度为40 ℃时,其腥味值最低;当脱腥温度>40 ℃时,其腥味值随着温度的升高呈逐渐升高的趋势,表明腥味并没有随着反应温度的升高而减弱。综合结果分析,小球藻生长因子液在加热40 ℃、75 min时,脱腥效果较好。张丽君等[11]研究发现在加热60 ℃、30 min时脱腥效果最佳,并认为温度过高会使螺旋藻溶液产生异味,所以小球藻生长因子液的腥味值随着温度的升高呈逐渐升高的趋势;阳晖等[14]在对螺旋藻脱腥工艺筛选时发现,在加热40 ℃、30 min时脱腥效果较好,时间过长会产生沉淀,但小球藻生长因子液经过多次离析浓缩和萃取,在一定温度下,随着加热时间的增长,其脱腥值呈现先下降后上升再下降的趋势。

a-加热时间;b-加热温度
图1 加热法对小球藻生长因子液脱腥效果影响
Fig.1 Effect of heating on deodorization of chlorella
growth factor solution
注:不同小写表示差异显著(P<0.05)(下同)
2.1.2 包埋法脱腥效果
在不同β-环糊精添加量下,小球藻生长因子液脱腥后腥味值变化如由图2所示,当添加量为0.03 g/100mL时,其腥味值最低,添加量增加,腥味值逐渐平稳,可能由于β-环糊精包埋已经达到最大程度。大量文献研究发现[15-17],β-环糊精可以通过将小分子物质包埋达到脱腥效果,但包埋程度有限,可以同其他脱腥方法交互脱腥。
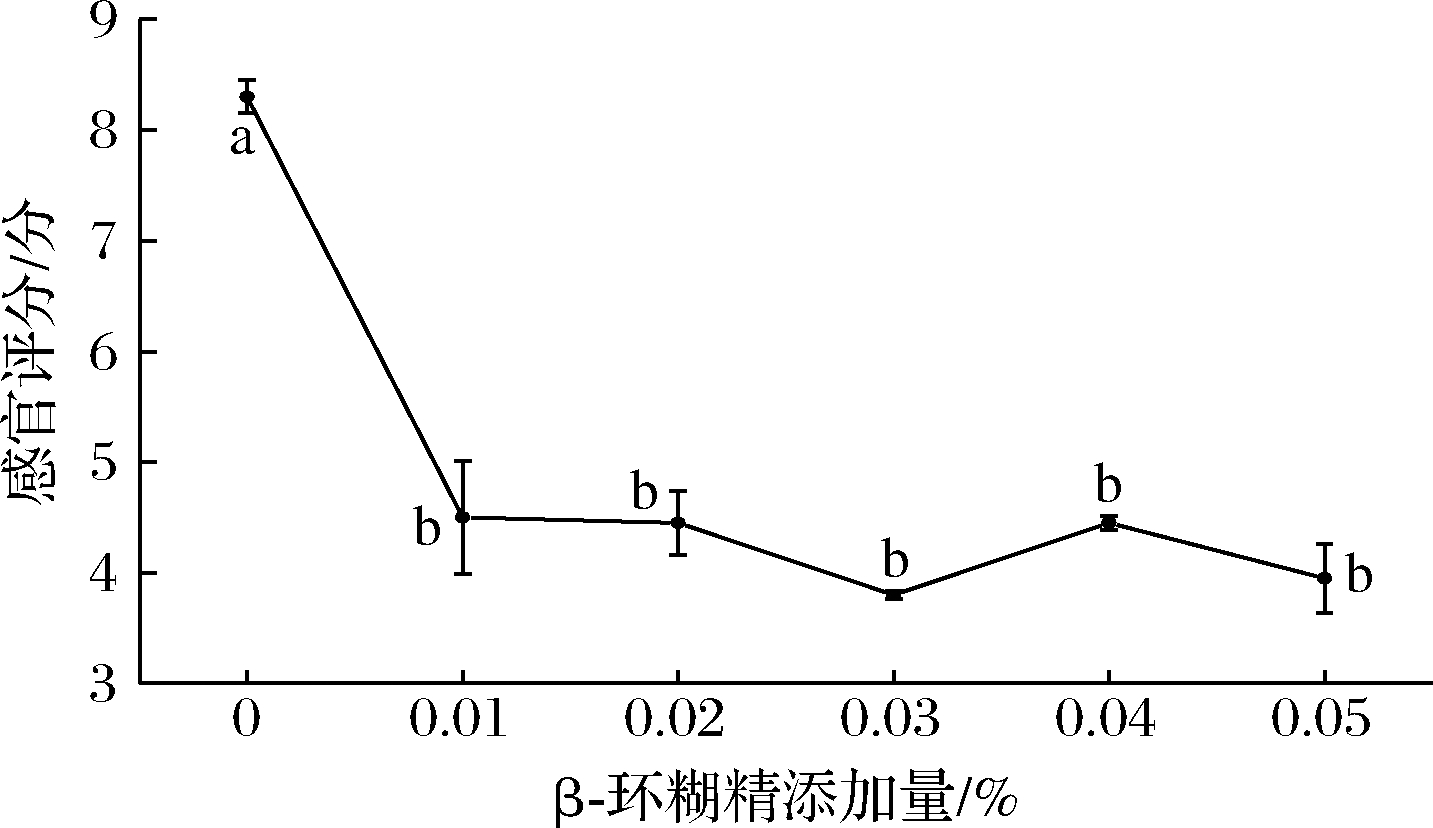
图2 包埋法对小球藻生长因子液脱腥效果影响
Fig.2 Effect of embedding method on deodorization of chlorella
growth factor solutiont
2.1.3 遮蔽法脱腥效果
如图3所示,当添加量为1 g/100mL时,腥味值最低,随着茉莉花粉和绿茶提取物添加量的增长,脱腥值呈现先下降后上升的趋势,可能由于茉莉花粉和绿茶提取物的香气与小球藻生长因子液的气味相互叠加,使气味不被人接受。庞庭才等[10]添加薄荷香精遮蔽腥味;张晓梅[18]添加绿茶与β-环糊精复合脱腥,得到呈淡绿色、基本无腥味,有淡淡的绿茶香味的羊栖菜提取液。
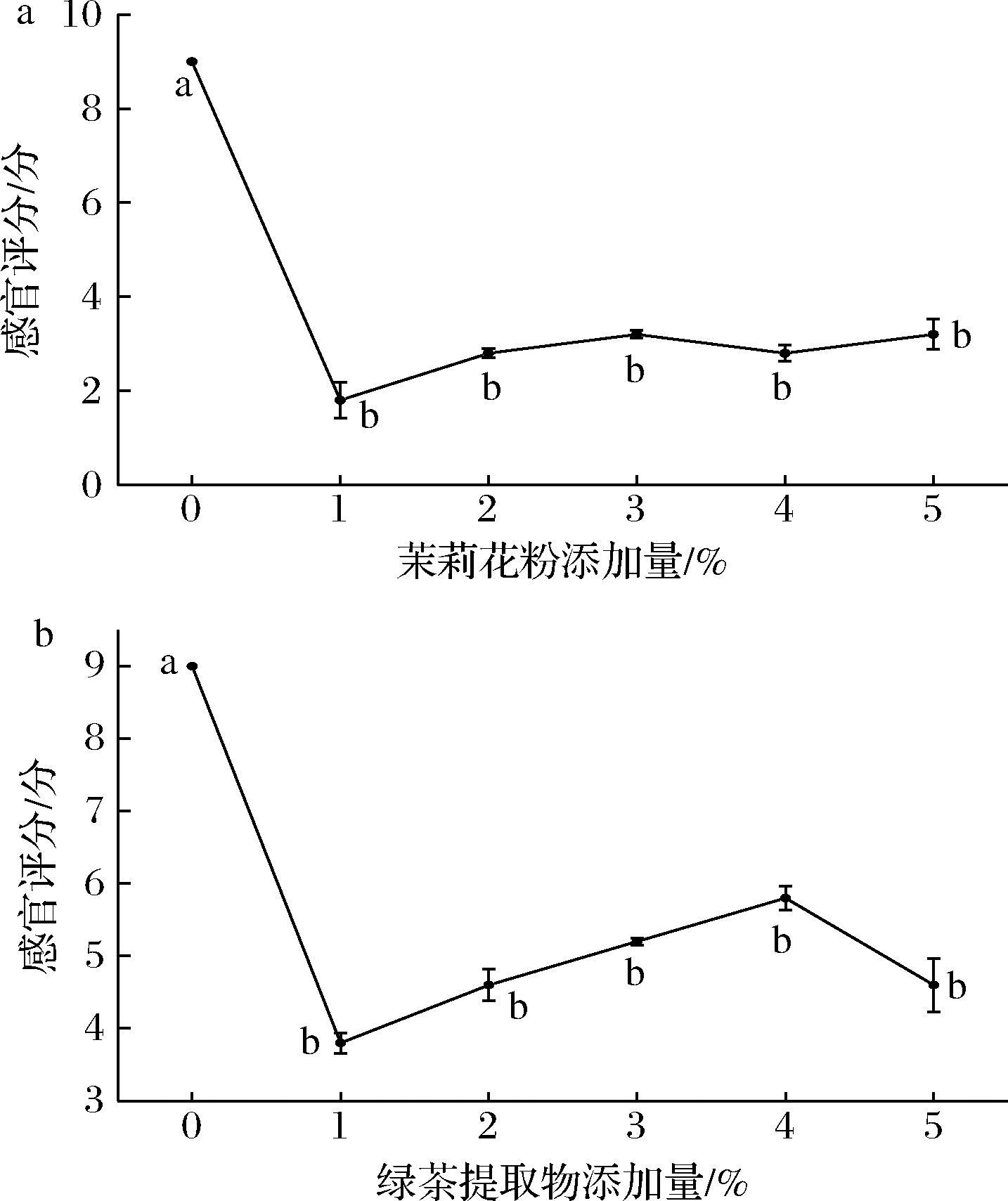
a-茉莉花粉添加量;b-绿茶提取物添加量
图3 遮蔽法对小球藻生长因子液脱腥效果影响
Fig.3 Effect of shading on deodorization of chlorella growth
factor solution
2.2.1 包埋-加热复合法正交试验结果分析
由表4极差分析可知,影响小球藻生长因子液腥味值主次因素的关系为:A>B>C,对小球藻生长因子液腥味值影响最显著为β-环糊精添加量。由正交设计得到各个因素的最优组合为A2B2C3,即加热温度50 ℃、加热时间90 min、β-环糊精添加量0.03 g/100mL。
表4 包埋-加热复合法正交因素水平表
Table 4 Factor level table of orthogonal test of heating
composite method
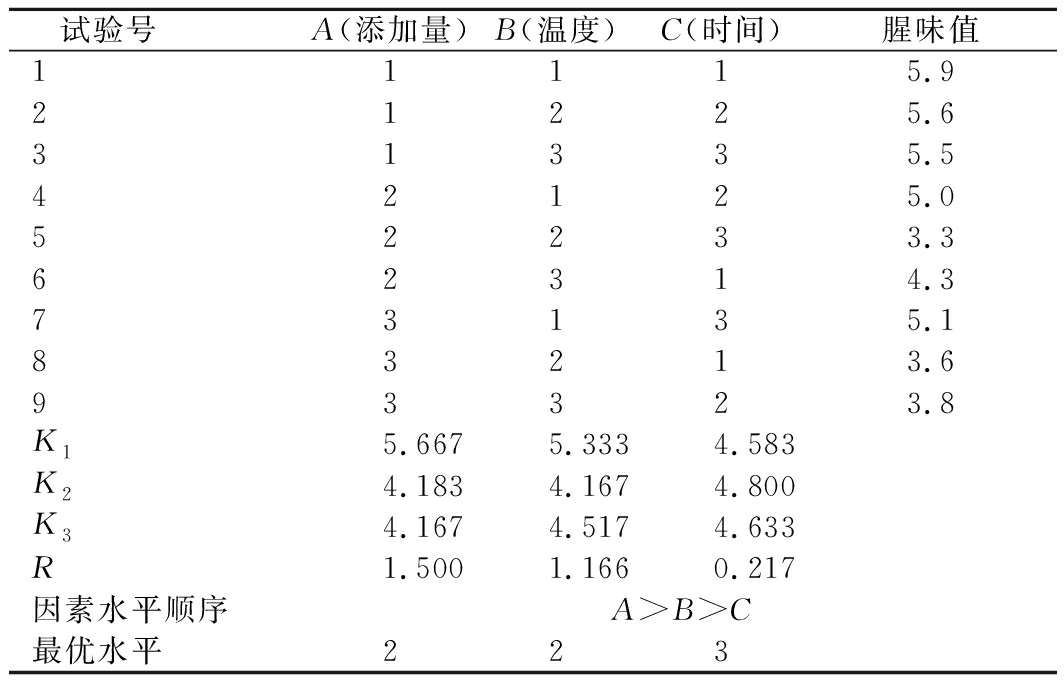
试验号 A(添加量)B(温度)C(时间)腥味值11115.921225.631335.542125.052233.362314.373135.183213.693323.8K15.6675.3334.583K24.1834.1674.800K34.1674.5174.633R1.5001.1660.217因素水平顺序A>B>C最优水平223
2.2.2 遮蔽-加热复合法正交试验结果分析
2.2.2.1 茉莉花粉正交试验结果分析
由表5极差分析可知,影响小球藻生长因子液腥味值主次因素的关系为:A>B=C,对小球藻生长因子液腥味值影响最显著为茉莉花粉添加量。由正交设计得到各个因素的最优组合为A1B1C1,即加热温度40 ℃、加热时间60 min、茉莉花粉添加量1 g/100mL。
表5 遮蔽-加热复合法正交因素水平表
Table 5 Factor level table of orthogonal test of shielding
heating composite method
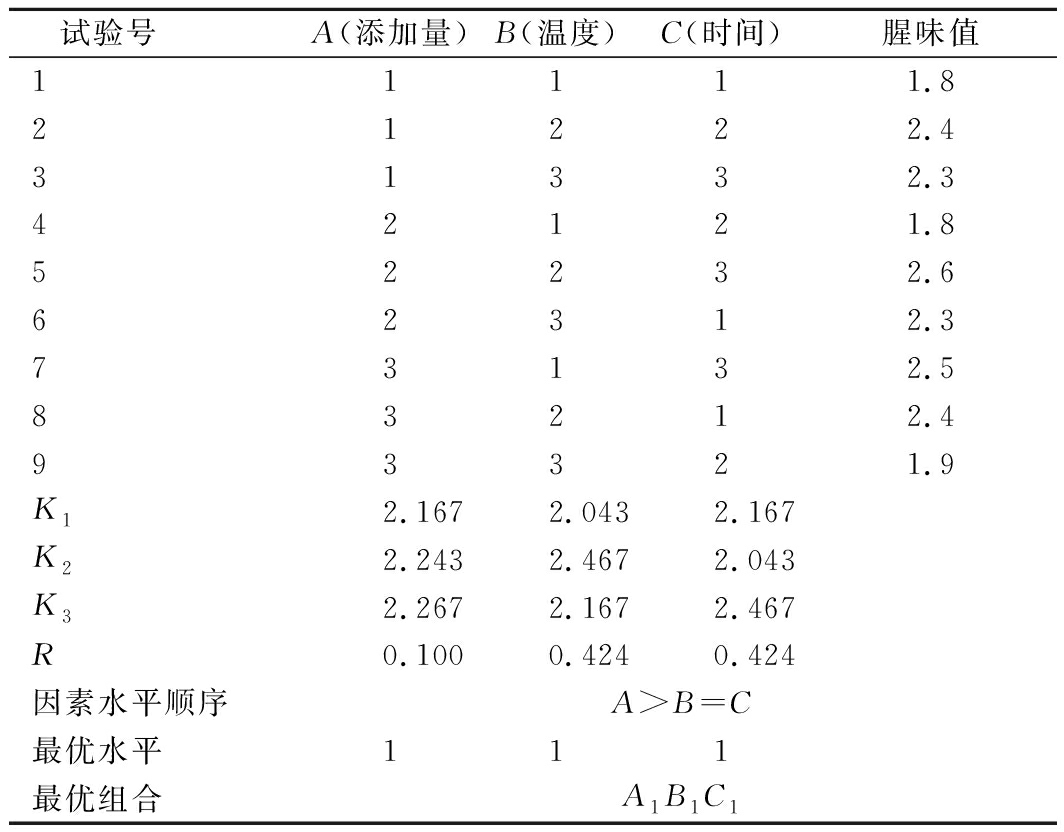
试验号 A(添加量)B(温度)C(时间)腥味值11111.821222.431332.342121.852232.662312.373132.583212.493321.9K12.1672.0432.167K22.2432.4672.043K32.2672.1672.467R0.1000.4240.424因素水平顺序A>B=C最优水平111最优组合A1B1C1
2.2.2.2 绿茶提取物正交试验结果分析
由表6极差分析可知,影响小球藻生长因子液腥味值主次因素的关系为:C>B>A,对小球藻生长因子液腥味值影响最显著为加热时间。由正交设计得到各个因素的最优组合为A2B2C3,即加热温度50 ℃、加热时间90 min、绿茶提取物添加量2 g/100mL。此结果为设计方案中试验5,为最优结果,无需进行验证实验。
表6 遮蔽-加热复合法正交因素水平表
Table 6 Factor level table of orthogonal test of
shielding heating composite method
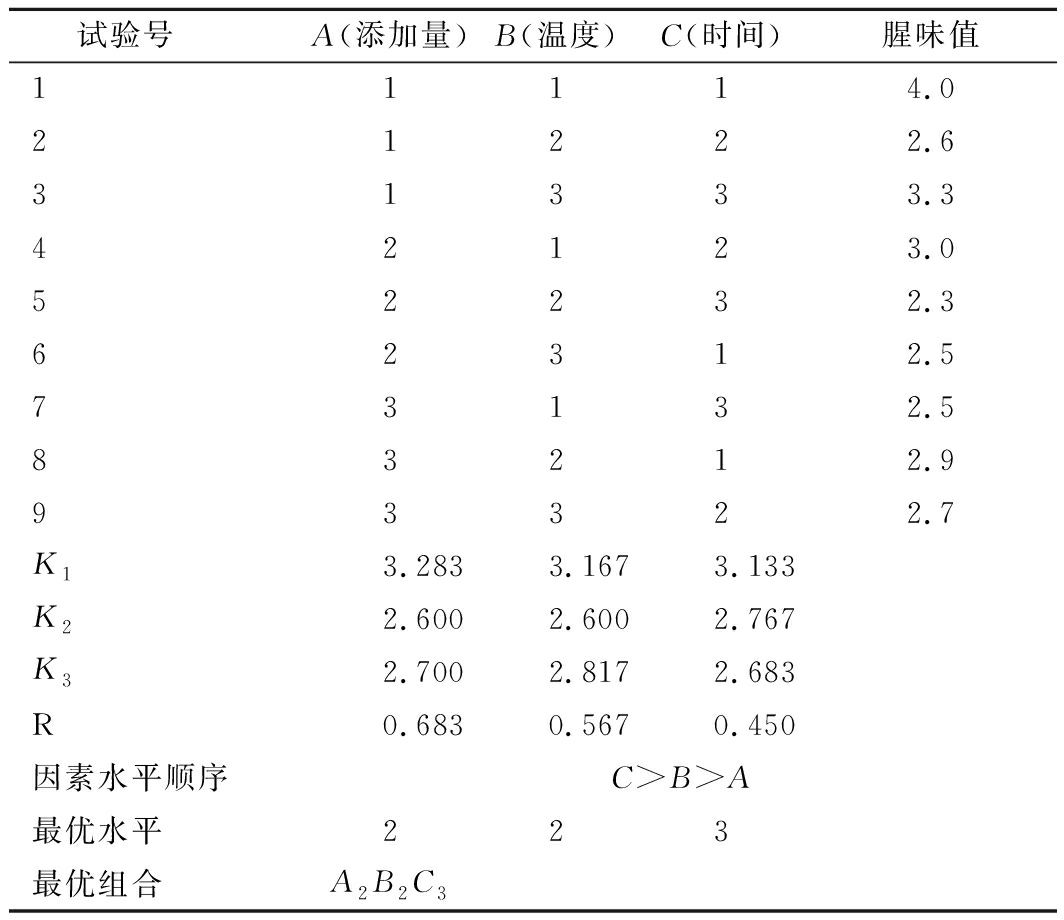
试验号 A(添加量)B(温度)C(时间)腥味值11114.021222.631333.342123.052232.362312.573132.583212.993322.7K13.2833.1673.133K22.6002.6002.767K32.7002.8172.683R0.6830.5670.450因素水平顺序C>B>A最优水平223最优组合A2B2C3
2.3.1 不同脱腥方法小球藻生长因子二维谱图分析
图4为小球藻生长因子液与经β-环糊精、茉莉花粉、绿茶提取物脱腥后的小球藻生长因子液的GC-IMS二维谱图及二维离子迁移谱差异图。由图4-a可以看出4个样品的各VOCs分离状况良好,在4个样品的二维谱图中共发现51个待分析峰。根据图4-b离子迁移谱差异图可以看出,原液与β-环糊精脱腥样品的差异集中在保留时间300~800,原液与茉莉花茶粉脱腥样品、绿茶提取物脱腥样品的差异集中在1 000~1 400。

a-二维谱图;b-二维离子迁移谱
图4 脱腥前后小球藻生长因子液的GC-IMS二维
谱图及二维离子迁移谱差异图
Fig.4 GC-IMS two-dimensional spectrum and two-
dimensional ion mobility spectrum of chlorella growth
factor solution before and after deodorization
2.3.2 不同脱腥方法小球藻生长因子液VOCs定性
参考ZHOU等[19]的方法,通过GC-IMS内置的NIST2014气相保留指数数据库定性,在4个样品中共检测到的51个VOCs,共定性32种VOCs。由表7所示,定性出的VOCs包含醇类7种、酯类4种、酮类7种、醛类6种、苯类4种、烯烃类2种;其中,1-辛烯-3-醇、2,3-戊二酮、2-戊酮等C5化合物被发现为小球藻中的典型挥发性化合物[20-21];在已定性的32种VOCs中,4组样品中共定性出醇类化合物7种,其中有5种VOCs在茉莉花粉脱腥样品中检测到,芳樟醇为茉莉花特征风味之一[22],叶醇为绿茶特征风味之一[23],可以为小球藻生长因子液增加香气;使用β-环糊精脱腥后的样品与原液相比,醛类化合物种类明显减少,醛类化合物有很强的叠加效应[24],在原液中主要呈现刺激性气味,β-环糊精可以一定程度减少小球藻生长因子液中的不被人接受的气味。
表7 脱腥前后小球藻生长因子液的 GC-IMS 挥发性组分定性
Table 7 Characterization of volatile components of chlorella growth factor solution before and after deodorization by GC-IMS

分类编号组分CAS号原液β-环糊精茉莉花粉绿茶提取物气味描述醇类 1正丁醇71-36-3+-+-具有特殊气味2叶醇928-96-1--++存在于烟叶中31-辛烯-3-醇3391-86-4+--+具强烈药草香韵;清香带甜的薰衣草气息,但显得较为淡弱存在于白肋烟烟叶中4苯乙醇1960-12-8---+有一种令人愉悦的气味,存在于烤烟烟叶5L-芳樟醇C78706--++6α-松油醇98-55-5--+-7正戊醇71-41-0---+略有气味酯类 8乙酸异丙酯108-21-4++++带有一种水果的气味9丙酸乙酯105-37-3++++带有一种水果的,像朗姆酒的、像空气的气味10乙酸乙酯141-78-6++++有芳香气味,易挥发11乙酸异丙酯108-21-4+-++酮类 12甲乙酮78-93-3++++乳脂奶香132,3-戊二酮600-14-6++--带有指甲油的气味142-戊酮107-87-9---+存在于烤烟烟叶、烟气中152-己酮591-78-6++++有类似梨的水果香味162-庚酮110-43-0+++-有强烈的刺激性臭味17环己酮108-94-1+++存在于烟叶中18仲辛酮111-13-7+---乳脂奶香醛类 19丁醛123-72-8+--+有刺激性气味20戊醛110-62-3+--+有刺激性气味21正己醛66-25-1+-++有刺激性气味22庚醛111-71-7--++带有新鲜的、绿色、甜的草本的气味23戊醛110-62-3++++24苯甲醛100-52-7+-++存在于烤烟烟叶、白肋烟烟叶、香料烟烟叶、烟气中苯类 25苯71-43-2+++-有强烈芳香味26甲苯108-88-3++++27对二甲苯106-42-3--++有类似甲苯的气味28邻二甲苯95-47-6+烯烃类29柠檬烯138-86-3++--带有一种像柠檬的气味30苯乙烯100-42-5+-++存在于烤烟烟叶、烟气中其他 312-甲基吡嗪109-08-0++--具有似牛肉加热时发生的香味和果仁及可可似香味322-甲巯基吩噻嗪764-38-5+---
注:表中“+”表示VOCs的存在,“-”表示VOCs的相对含量降低或种类减少
2.3.3 不同脱腥方法小球藻生长因子液指纹图谱结果分析
参考杨晓璇等[24]的方法,基于4个样品的GC-IMS二维谱图中VOCs数据建立的指纹图谱(图5)。在指纹图谱中可以明显看出4组样品VOCs种类和相对含量的异同,且大致可按组分类;A框区域为4种样品中相对含量都较高的VOCs;B框区域为β-环糊精脱腥样品中相对含量或种类减少的VOCs;C框区域为茉莉花茶脱腥样品和绿茶提取物脱腥样品为小球藻生长因子液增加的VOCs。
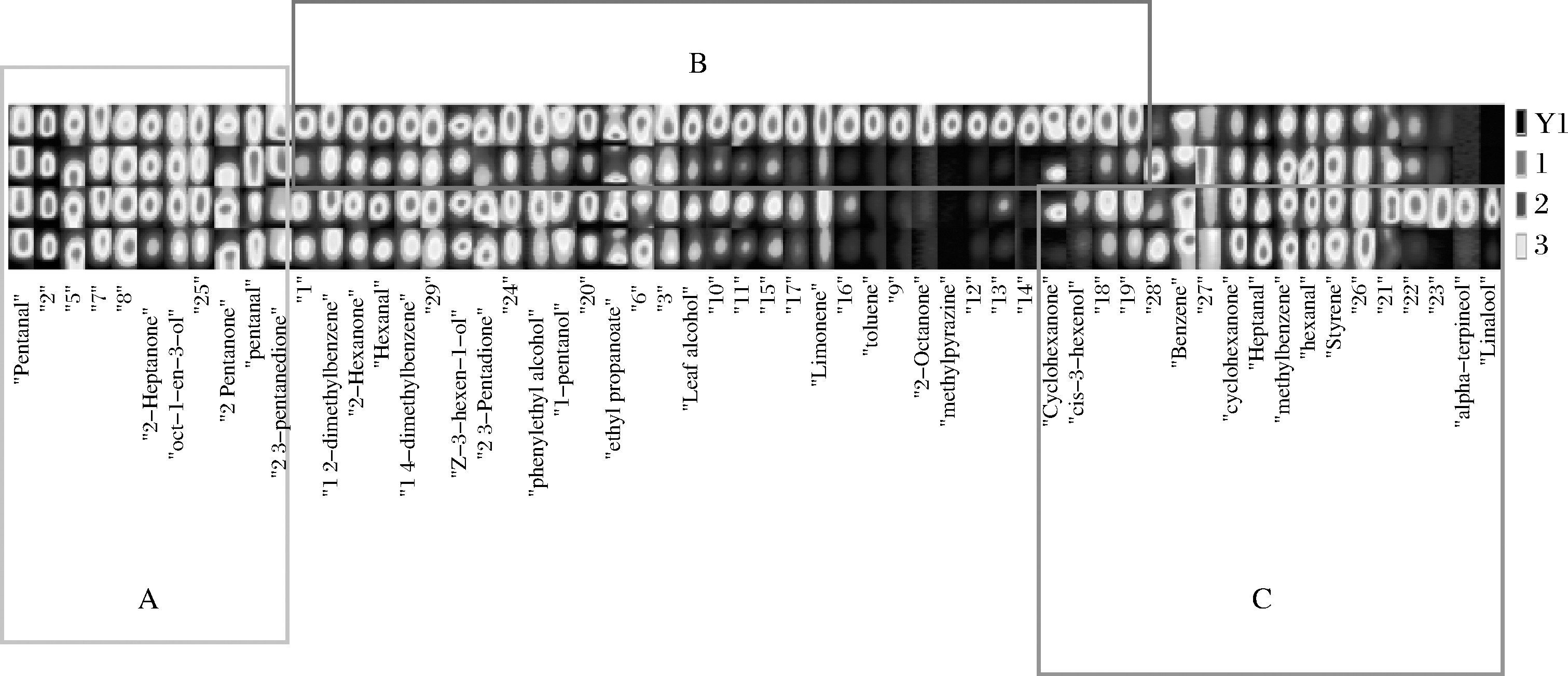
图5 脱腥前后小球藻生长因子液的GC-IMS指纹图谱
Fig.5 GC-IMS fingerprint of chlorella growth factor solution before and after deodorization
注:图中每一行代表一种样品,每一列代表一种VOCS物质,数字代表未定性出物质
本文对3种小球藻生长因子液脱腥方法进行了研究,通过单因素试验,确定小球藻生长因子液的最佳加热温度为40 ℃、加热时间为75 min、β-环糊精添加量0.03 g/100mL、茉莉花粉添加量1 g/100mL、绿茶提取物添加量1 g/100mL;通过正交试验对复合脱腥工艺进行优化,优化获得包埋-加热复合脱腥法:加热温度50 ℃、加热时间90 min、β-环糊精添加量0.03 g/100mL。优化获得遮蔽-加热复合脱腥法,茉莉花粉遮蔽:加热温度40 ℃、加热时间60 min、茉莉花粉添加量1 g/100mL;绿茶提取物脱遮蔽:加热温度50 ℃、加热时间90 min、绿茶提取物添加量2 g/100mL。
通过GC-IMS分析可知,脱腥前后样品中定性出32中挥发性物质,其中醇类7种、酯类4种、酮类7种、醛类6种、苯类4种、烯烃类2种。使用茉莉花粉和绿茶提取物脱腥前后主要增加的为醇类化合物,为小球藻生长因子液增加了愉悦气味;1-辛烯-3-醇、2,3-戊二酮、2-戊酮等C5化合物被发现为小球藻中的典型挥发性化合物,使用β-环糊精脱腥后C5化合物种类明显减少,减少小球藻生长因子液中的不被人接受的气味。
综上所述,使用β-环糊精脱腥可以包埋小球藻生长因子液中部分刺激性气味,降低腥味值;使用茉莉花茶和绿茶提取物掩盖小球藻生长因子液中不被人接受的气味,同时还会为小球藻生长因子液增加令人愉悦的气味,从而降低腥味值,本文为小球藻生长因子风味饮料的生产应用提供了技术和理论支持。
[1] 韩士群, 张振华, 刘海琴.小球藻生长因子的生理功能研究[J].江苏农业科学, 2003, 31(5):99-101.
HAN S Q, ZHANG Z H, LIU H Q.Physiological function of Chlorella growth factor[J].Jiangsu Agricultural Science, 2003, 31(5):99-101.
[2] BALDWIN E A, BAI J H, PLOTTO A, et al.Electronic noses and tongues:Applications for the food and pharmaceutical industries[J].Sensors, 2011,11(5):4 744-4 766.
[3] KADAM S U, PRABHASANKAR P.Marine foods as functional ingredients in bakery and pasta products[J].Food Research International, 2010,43(8):1 975-1 980.
[4] WAN X Z, LI T T, ZHONG R T, et al.Anti-diabetic activity of PUFAs-rich extracts of Chlorella pyrenoidosa and Spirulina platensis in rats[J].Food and Chemical Toxicology, 2019,128:233-239.
[5] LAFARGE C, CAYOT N.Insight on a comprehensive profile of volatile compounds of Chlorella vulgaris extracted by two “green” methods[J].Food Science & Nutrition, 2019,7(3):918-929.
[6] 薄香兰, 窦勇, 张文慧, 等.小球藻生长因子的研究进展[C]//第一届微藻与水族高峰论坛论文集, 天津, 2017.
BO X L, DOU Y, ZHANG W H, et al.Response of Chlorella growth to major environmental factors and analysis of CGF components and functions[C]//Proceedings of the First Mcroalgae and Aquarium Summit Forum, Tianjin, 2017.
[7] 秦文.小球藻生长因子(CGF)活性物质的初步分离纯化以及生物活性的研究[D].上海:上海师范大学, 2014.
QIN W.Preliminary separation, purification and bioactivity of Chlorella growth factor (CGF) [D].Shanghai:Shanghai Normal University, 2014.
[8] 薄香兰.小球藻生长对主要环境因子的响应及CGF成分和功能分析研究[D].天津:天津农学院, 2018.
BO X L.The response of Chlorella vulgaris growth to major environmental factors and the ananlysis of the composition and function of CGF[D].Tianjin:Tianjin Agricultural University, 2018.
[9] NOGUCHI N, MARUYAMA I, YAMADA A.The influence of Chlorella and its hot water extract supplementation on quality of life in patients with breast cancer[J].Evidence-Based Complementary and Alternative Medicine, 2014(2):704619.
[10] 庞庭才, 胡上英, 林美芳, 等.小球藻发酵饮料加工工艺[J].食品与发酵工业, 2014,40(11):260-264.
PANG T C, HU S Y, LIN M F, et al.Research on the processing of Chlorella fermented beverage [J].Food and Fermentation Industries, 2014,40 (11):260-264.
[11] 张丽君, 刘冬, 李世敏.螺旋藻脱腥工艺研究[J].食品与发酵工业, 2008, 34(6):95-97.
ZHANG L J, LIU D, LI S M.Study on deodourization process of Spirulina [J].Food and Fermentation Industries, 2008, 34(6):95-97.
[12] 顾赛麒, 胡彬超, 张月婷, 等.基于电子鼻、气-质联用技术和感官评价方法优化海带发酵脱腥工艺[J].食品与发酵工业, 2020,46(19):124-129.
GU S Q, HU B C, ZHANG Y T, et al.Optimization of fermentation deodorization of Laminaria japonica based on electronic nose, GC-MS and sensory evaluation [J].Food and Fermentation Industries, 2020,46 (19):124-129.
[13] 邵悦春, 付晓婷, 许加超, 等.基于气相离子迁移谱的发酵海带风味分析[J].食品工业科技, 2020:1-14.
SHAO Y C, FU X T, XU J C, et al.lavor analysis of fermented Laminaria japonica based on gas chromatograph-ion mobility spectrometer(GC-IMS) [J].Science and Technology of Food Industry, 2021, 42(12):300-306.
[14] 阳晖, 方遂, 邹霞, 等.螺旋藻脱腥工艺的筛选[J].食品研究与开发, 2009,30(7):106-110.
YANG H, FANG S, ZOU X, et al.Research on the eliminating fishy smell of Spirulina[J].Food Research and Development, 2009,30(7):106-110.
[15] 梁英妹, 陈妙莹, 陈清梅, 等.小球藻食品工艺中的关键技术[J].科技创新导报, 2018,15(10):247-250.
LIANG Y M, CHEN M Y, CHEN Q M, et al.Key technologies in Chlorella food technology [J].Science and Technology Innovation Herald, 2018,15 (10):247-250.
[16] 杨昭, 高柳纯, 姚玉静, 等.苦瓜牡蛎酶解液复合饮料的研制[J].食品工业, 2020,41(8):72-76.
YANG Z, GAO L C, YAO Y J, et al.Preparation and development of bitter melon and oyster hydrolysates compound beverage[J].The Food Industry, 2020,41(8):72-76.
[17] 田其英. 螺旋藻脱除腥味的研究[J].畜牧与饲料科学, 2009,30(4):78-79.
TIAN Q Y.The research on remove algae smell of spiral algae[J].Animal Husbandry and Feed Science, 2009,30 (4):78-79.
[18] 张晓梅.羊栖菜营养及其多糖复合饮品的研究[D].保定:河北农业大学, 2018.
ZHANG X M.Study on nutrition and polysaccharides compound drink of Sargassum fusiforme [D].Baoding:Hebei Agricultural University, 2018.
[19] ZHOU L, CHEN J, XU J L, et al.Change of volatile components in six microalgae with different growth phases[J].Journal of the Science of Food and Agriculture, 2017,97(3):761-769.
[20] 陈姣, 徐继林, 李艳, 等.3种海洋硅藻不同培养阶段挥发性成分的比较分析[J].海洋学报(中文版), 2014,36(8):49-64.
CHEN J, XU J L, LI Y, et al.Analysis of volatile components from three marine diatoms at different growth stages[J].Acta Oceanologica Sinica, 2014, 36(8):49-64.
[21] 陈姣, 徐继林, 李艳, 等.9种海洋硅藻挥发性成分的比较分析[J].生物学杂志, 2014,31(2):35-40.
CHEN J, XU J L, LI Y, et al.Comparative analysis of volatile components in nine species of marine diatoms[J].Journal of Biology, 2014, 31(2):35-40.
[22] 刘晓港.茉莉花茶制作过程中风味成分及微生物变化研究[D].福州:福州大学, 2017.
LIU X G.Research of flavour components and microorganism change in the jasmine tea production[D].Fuzhou:Fuzhou University, 2017.
[23] 窦宏亮, 李春美, 顾海峰, 等.采用HS-SPME/GC-MS/GC-Olfactometry/RI对绿茶和绿茶鲜汁饮料香气的比较分析[J].茶叶科学, 2007,27(1):51-60.
DOU H L, LI C M, GU H F, et al.Comparative analysis on aromatic components of green tea and fresh green tea beverage using HS-SPME/GC-MS/GC-olfactometry/RI methods[J].Journal of Tea Science, 2007, 27(1):51-60.
[24] 杨晓璇, 李阳, 马宁, 等.酱油中挥发性风味物质的气相色谱-离子迁移谱分析[J].中国酿造, 2021,40(3):149-154.
YANG X X, LI Y, MA N, et al.Analysis of volatile flavor compounds in soy sauce by gas chromatography ion mobility spectrometry [J].China Brewing, 2021,40(3):149-154.