作为一种广谱氯霉素类抗生素,氟苯尼考(florfenicol,FF)被广泛用于治疗猪、禽、牛以及水产等养殖动物的细菌性疾病[1]。但氟苯尼考会通过食源性生物富集而影响人体健康。氟苯尼考胺(florfenicol amine,FFA)是氟苯尼考在动物肝脏中存在时间最长且含量最高的代谢物,因此,一般将氟苯尼考胺作为动物源食品中氟苯尼考的标示性残留物之一[2]。根据农业部GB 31650—2019《食品中兽药最大残留限量》[3]规定,在鸡蛋、牛奶等产品中禁止检出氟苯尼考,但由于部分养殖户在鸡的产蛋期中的违规用药屡禁不止,因此,市售鸡蛋中氟苯尼考残留的检出时有发生。有必要对鸡蛋中的氟苯尼考残留水平进行检测。
灵敏度高、选择性好的高效液相色谱[4]及液相色谱-串联质谱法是氟苯尼考残留检测的首选方法[5],但该类检测一般需要进行复杂的样品前处理步骤,且需要价格昂贵的专业设备,难以应用于现场快速检测环节。因此,研究操作简单、快速且便携的氟苯尼考检测方法很有必要。基于金纳米粒子(gold nanoparticles,AuNPs)独特的光学性能和极高的摩尔消光系数[6]设计的肉眼直接观察的显色探针有利于现场检测结果的快速分析[7]。目前,该传感器已在金属离子[8]、蛋白质[9]、DNA[10]以及小分子化合物[6]等多种靶标的分析中得到应用。此外,能与靶标高亲和力及选择性结合的核酸适配体(aptamer,Apt)是一类新型的分子识别元件,特异性优良,具有可批量合成、易于修饰及稳定性好的优点[11]。研究表明,适配体核酸碱基上N和O键与金纳米可通过范德华力及疏水作用而结合[12],这为金纳米的适配体功能化及构建具有识别特异性的比色传感器提供了思路[13]。
一般情况下,纳米金比色传感器可通过肉眼观察体系的颜色变化进行定性或半定量检测,但准确性与灵敏性相对较低;借助于紫外分光光度计和酶标仪的使用可以提高检测的灵敏度,但专业设备需要技术支持与维护,多应用于实验室检测。智能手机具有便携性、现场图像采集、数据处理和传输能力,若能将其与比色检测相结合则可使比色传感器的现场快速检测更为便捷[14]。例如,CHEN等[15]探索了以智能手机读取Hg2+比色试纸的颜色变化,并以蓝值与红值的比值作为指标检测池塘和河水中的Hg2+,该方法的检出限为50 nmol/L,且实现了在现场短时间内对多个样品的快速检测,使检测效率大大提高。
基于以上分析,本研究以建立简单、灵敏的氟苯尼考比色传感快速分析技术为目标,在合成氟苯尼考适配体功能化的金纳米粒子(aptamer- gold nanoparticles,Apt-AuNPs)的基础上,优化检测条件,构建基于Apt-AuNPs的氟苯尼考比色传感器,验证方法的特异性、稳定性、灵敏度及在鸡蛋中应用的可行性。另外,对应用智能手机成像分析(红绿蓝值分析)采集、识别和分析体系颜色变化的可行性进行探索,为动物食品样品中氟苯尼考的现场快速检测提供参考。
1.1.1 主要试剂
氟苯尼考适配体序列为5′-GCTGTGTGACTCCTGCAAGGTCCATTCAAGTCGTAGGTTTGCCTTCAGCC-TCAACGCTTACGCAGCTGTATCTTGTCTCC-3′[16],上海生工生物工程股份有限公司合成纯化;氟苯尼考,上海阿拉丁生化科技股份有限公司;氟苯尼考胺,加拿大多伦多研究化学品公司;其余药品:氯金酸、柠檬酸三钠、氯化钠、正己烷、乙酸乙酯、甲砜霉素、四环素、氯霉素、阿莫西林、恩诺沙星、甲醇,上海麦克林化学试剂有限公司。加标回收样本鸡蛋,上海本地超市;真实阳性样本鸡蛋,通过对产蛋期的蛋鸡进行预拌料方式连续给药(20%氟苯尼考)所得。
1.1.2 主要仪器与设备
Synergy H4型多功能酶标仪,美国BioTek Instruments公司;NanoBrook 173Plus型动态光散射仪,美国Brookhaven公司;JEM-2100型透射电子显微镜,日本JEOL公司;RV 10 basic型旋转蒸发仪,德国IKA公司;THZ-103B型恒温培养摇床,上海一恒科学仪器有限公司;JJ-1型电动机械搅拌器,常州市苏越实验仪器厂;85-2A型恒温磁力搅拌器,金坛市科析仪器有限公司;Sorvall ST8型高速离心机,美国赛默飞世尔科技公司;Zeta-sizer Nano ZS型激光粒度仪,英国马尔文公司。
1.2.1 金纳米粒子的合成与表征
采用柠檬酸三钠还原氯金酸的方法合成金纳米粒子,在ZIEGLER等[17]方法的基础上进行改进。具体步骤如下:在100 mL煮沸的超纯水中加入1.4 mL氯金酸溶液(20 mmol/L)并搅拌,随后迅速加入1.2 mL柠檬酸三钠溶液(100 mmol/L)在持续加热下剧烈搅拌15 min,可观察到溶液颜色在此过程中由灰色变为深红色,最终呈透明酒红色。停止加热,搅拌溶液冷却至室温。12 000 r/min离心15 min除去多余的柠檬酸钠,移除上清液后用超纯水进行重分散,4 000 r/min离心15 min,取上清液,得到AuNPs溶液,4 ℃低温避光保存。
AuNPs的浓度的计算:取210 μL AuNPs与90 μL 超纯水混合均匀,置于96孔板内,以酶标仪测量其在400~800 nm的吸收光谱。根据朗伯比尔定律,AuNPs的浓度计算如公式(1)所示:
A=εbc
(1)
式中:A,吸光度;ε,吸光系数或摩尔吸光系数,mol/(L·cm);b,吸收介质的厚度,cm;C,物质浓度,mol/L。当λ=520 nm时,AuNPs的ε为2.7×108 mol/(L·cm)[18]。
1.2.2 检测方法的性能分析
1.2.2.1 检测方法的灵敏度评估
将210 μL的AuNPs溶液与30 μL适配体溶液(7 500 nmol/L)混合均匀后,37 ℃摇床孵育30 min,形成Apt-AuNPs溶液。再分别加入30 μL不同浓度的氟苯尼考(或氟苯尼考胺)溶液,使体系中氟苯尼考浓度(或氟苯尼考胺)为0~50 nmol/L,室温孵育20 min后,加入30 μL NaCl溶液(500 mmol/L),室温反应5 min。使用酶标仪测量体系在400~800 nm的吸收光谱,以不添加目标物的体系为对照,计算A650/A520及ΔA650/A520。
以氟苯尼考(或氟苯尼考胺)浓度为横坐标,ΔA650/A520为纵坐标,绘制工作曲线。计算该方法的检出限(limitation of detection,LOD),对该比色传感器的灵敏度进行评估[19],计算如公式(2)所示:
(2)
式中:Sb,对照组A650/A520值的标准偏差(11次重复);K,置信水平常数(K=3);S,检测物标准曲线的斜率。
1.2.2.2 检测方法的特异性评估
以建立的方法分别对恩诺沙星(enrofloxacin,ENR)、阿莫西林(amoxicillin,AMO)、氯霉素(chloramphenicol,CAP)、四环素(tetracycline,TC)、甲砜霉素(thiamphenicol,TAP)体系进行检测,以不含目标物的体系为对照,计算ΔA650/A520,并与氟苯尼考及氟苯尼考胺体系的检测结果进行比较。
1.2.3 鸡蛋样品的前处理
以鸡蛋为实际检测样品时,参照XIE等[1]方法对鸡蛋进行前处理。具体步骤如下:称取1.5 g均质后的鸡蛋,置于聚丙烯离心管中,加入10 mL乙酸乙酯混合并漩涡振荡1 min,超声提取5 min,以4 000 r/min 离心5 min后,移取上清液,并以旋转蒸发仪45 ℃减压浓缩。加入2 mL超纯水进行溶解,漩涡振荡1 min,超声提取5 min,加入3 mL正己烷,漩涡振荡1 min,超声提取5 min,以4 000 r/min离心5 min,移除上层正己烷相,移取下层水相供分析。
1.2.4 样品的红蓝绿(red-green-blue, RGB)分析
使用智能手机(OXF-AN10,华为,中国深圳)对各体系的比色结果进行提取与分析。具体步骤如下:手机与样品保持水平,在高度约10 cm处记录样品图像,使用色采APP (2.5.3版本)提取图像中的RGB信息。基于RGB信息计算蓝值/红值(B/R),利用B/R值与目标物浓度绘制比色卡。以不含目标物的体系为对照,计算ΔB/R。分别以氟苯尼考和氟苯尼考胺浓度为横坐标,ΔB/R为纵坐标,绘制工作曲线。
基于适配体功能化金纳米的比色传感器检测氟苯尼考的原理如图1所示。

图1 基于核酸适配体功能化的纳米金的比色传感器检测氟苯尼考的原理示意图
Fig.1 Schematic illustration of the proposed colorimetric sensor for the detection of florfenicol with Apt-AuNPs as the indicator
图1表明,核酸适配体碱基上N和O键与金纳米间通过范德华力及疏水作用吸附于AuNPs表面[12],从而形成Apt-AuNPs识别探针。当体系中无目标物(氟苯尼考或氟苯尼考胺)存在时,核酸适配体可以保护AuNPs,避免其在NaCl作用下发生聚集,使AuNPs在一定盐浓度下仍保持分散状态。当体系含有目标物时,由于目标物与核酸适配体之间具有更强的亲和力,核酸适配体则从AuNPs表面脱落,而失去适配体保护的AuNPs粒子在NaCl的作用下发生团聚。其分散态到聚集态的转变使体系的颜色从酒红色变为紫红色,最终变为蓝灰色。这一颜色变化可通过肉眼识别、比色检测或使用智能手机等便携式设备进行颜色分析。样品颜色的变化程度又取决于目标物的浓度,因此可通过样品体系颜色变化与目标物浓度的变化规律实现对样品中目标物(氟苯尼考或氟苯尼考胺)的检测。
为证明成功制备金纳米粒子及所得的金纳米粒子的光学特性、粒径及微观形貌适合比色传感器的构建,对其进行表征,结果如图2所示。图2-a~图2-c分别是金纳米粒子的紫外可见吸收光谱、粒径分布图及透射电镜图。图2-e为表面ζ-电位变化结果,表明适配体吸附于金纳米离子表面。同时,为了证明所提出的检测方法的可行性,对该方法的原理进行验证,结果如图2及表1所示。
表1 不同体系的平均水合粒径及PDI结果
Table 1 The average diameter and PDI of
different nanoparticles system
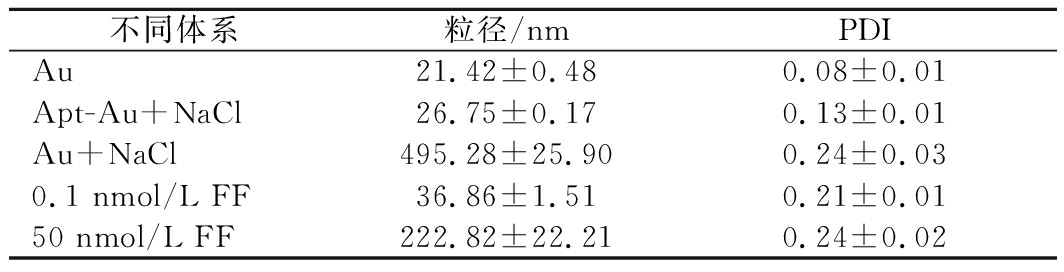
不同体系粒径/nmPDIAu21.42±0.480.08±0.01Apt-Au+NaCl26.75±0.170.13±0.01Au+NaCl495.28±25.900.24±0.030.1 nmol/L FF36.86±1.510.21±0.0150 nmol/L FF222.82±22.210.24±0.02
由图2-a的紫外吸收光谱及样品颜色变化结果可知,所制备的金纳米溶液呈红色,由于表面特征等离子体共振,金纳米粒子在λ=520 nm处呈现明显的金特征吸收峰,吸光度为0.375±0.021。通过朗伯比尔定律[18]计算得AuNPs溶液浓度约为1.5 nmol/L。如图2-b及表1所示,AuNPs的平均水合粒径为(21.42±0.48) nm,多分散性指数(polydispersity index,PDI)为0.08±0.01,说明所制备的AuNPs在溶液中呈单分散状态,粒径分布均匀。由图2-c AuNPs的透射电镜图像可知,所得到的AuNPs呈大小均一(约15 nm)的规则球体,分散性良好,可用于比色传感器的构建。由图2-e可知,裸露的金纳米粒子表面ζ-电位为(-62.77±1.72) mV,当金纳米粒子与适配体孵育30 min后,表面ζ-电位为(-48.10±0.70) mV,这是由于金纳米粒子与适配体发生结合而使金表面的柠檬酸根的负电荷被中和,从而使ζ-电位绝对值相对减小[6]。

a-不同体系的紫外可见吸收光谱及颜色变化;b-不同体系的粒径分布图;c-分散态金纳米粒子的透射电镜图像;
d-聚集态金纳米粒子的透射电镜图像;e-金纳米适配体吸附前后的ζ-电位变化
图2 金纳米粒子的表征及检测原理的验证
Fig.2 Characterization of AuNPs and verification of detection principle
与不含NaCl的AuNPs溶液体系相比,当体系中有NaCl存在时,AuNPs溶液由红色变为蓝灰色,体系在520 nm处的吸收峰降低,而在670 nm处出现了显著的吸收峰。与此同时,AuNPs的平均水合粒径增大至(495.28±25.90) nm,PDI增大至0.24±0.03。说明在NaCl的作用下, AuNPs由分散态变为聚集态。而Apt-Au在含有NaCl的体系中时,溶液颜色、紫外吸收光谱、平均水合粒径及PDI均与不含NaCl的AuNPs体系相近,这证明了适配体吸附于AuNPs表面可起到一定的保护作用,使AuNPs在一定浓度的NaCl下仍保持分散态。当加入不同浓度的氟苯尼考后,体系的水合粒径及PDI均相对增大,例如,当体系中含有0.1 nmol/L的氟苯尼考时,体系的水合粒径增加至(36.86±1.51) nm,PDI 增大至0.21±0.01,说明AuNPs开始发生团聚。由含50 nmol/L氟苯尼考体系的透射电镜图像(图2-d)可知,此时的AuNPs发生明显团聚而形成团簇。以上结果证明所提出的比色传感器具有可行性,且溶液的颜色变化与目标物浓度存在联系。
2.3.1 NaCl浓度的优化
在所设计的比色传感器中,NaCl浓度对AuNPs的团聚有重要影响。NaCl浓度对AuNPs体系的A650/A520的影响如图3所示。
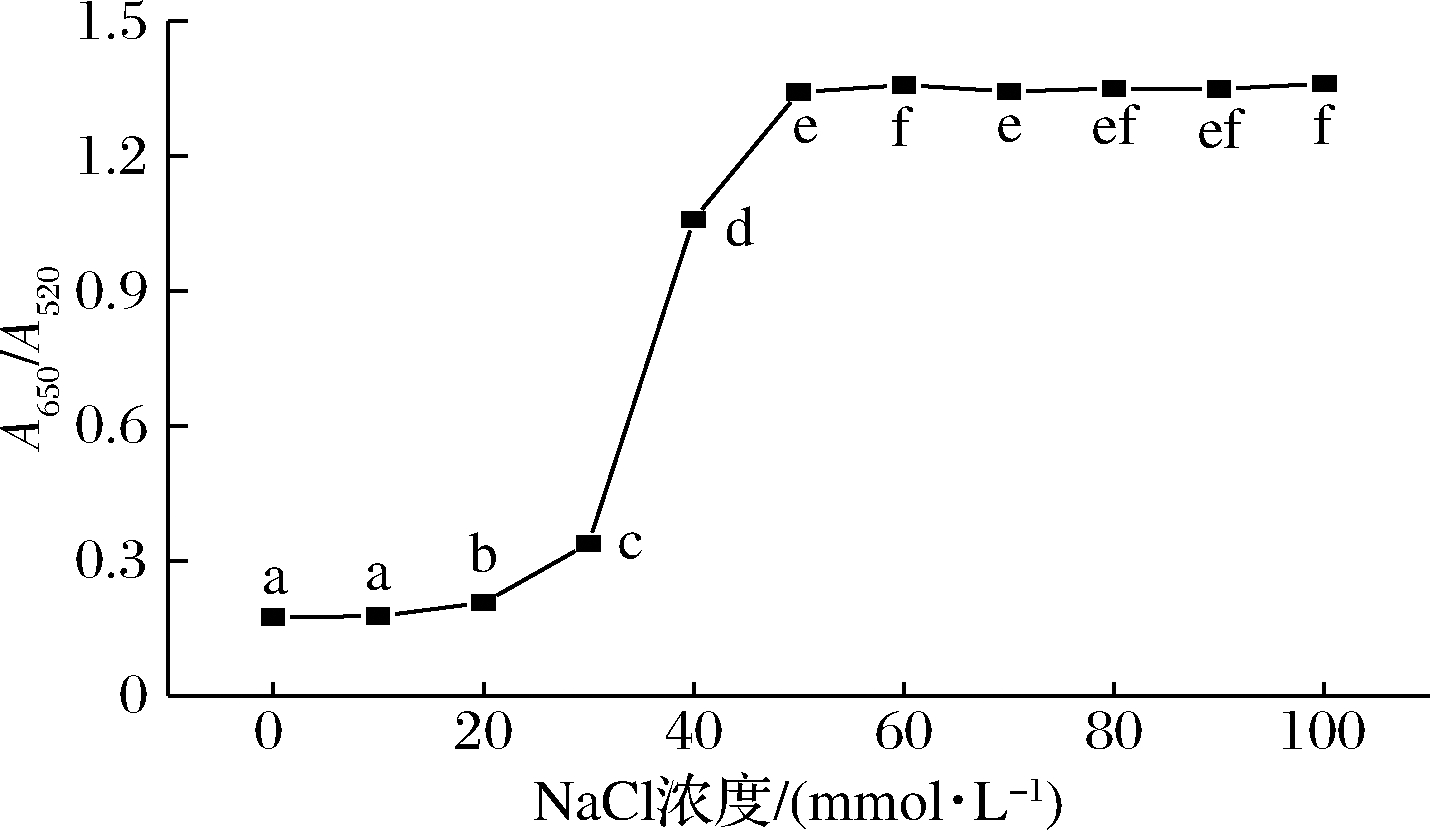
图3 不同NaCl浓度下AuNPs的A650/A520变化
Fig.3 A650/A520 of system under different NaCl concentration
注:不同小写字母表示差异显著
图3表明,随着NaCl浓度从0 mmol/L增加至50 mmol/L时,体系的A650/A520由0.174 2±0.004 0显著增大至1.342 2±0.003 0。当NaCl浓度进一步增大,A650/A520的变化则趋于平坦,这说明当NaCl浓度为50 mmol/L时,已使体系中的AuNPs发生明显团聚,故选择50 mmol/L的NaCl用于后续检测。
2.3.2 适配体浓度的优化
适配体浓度对传感器的灵敏性与稳定性有重要影响。适配体浓度对体系A650/A520及ΔA650/A520的影响如图4所示。
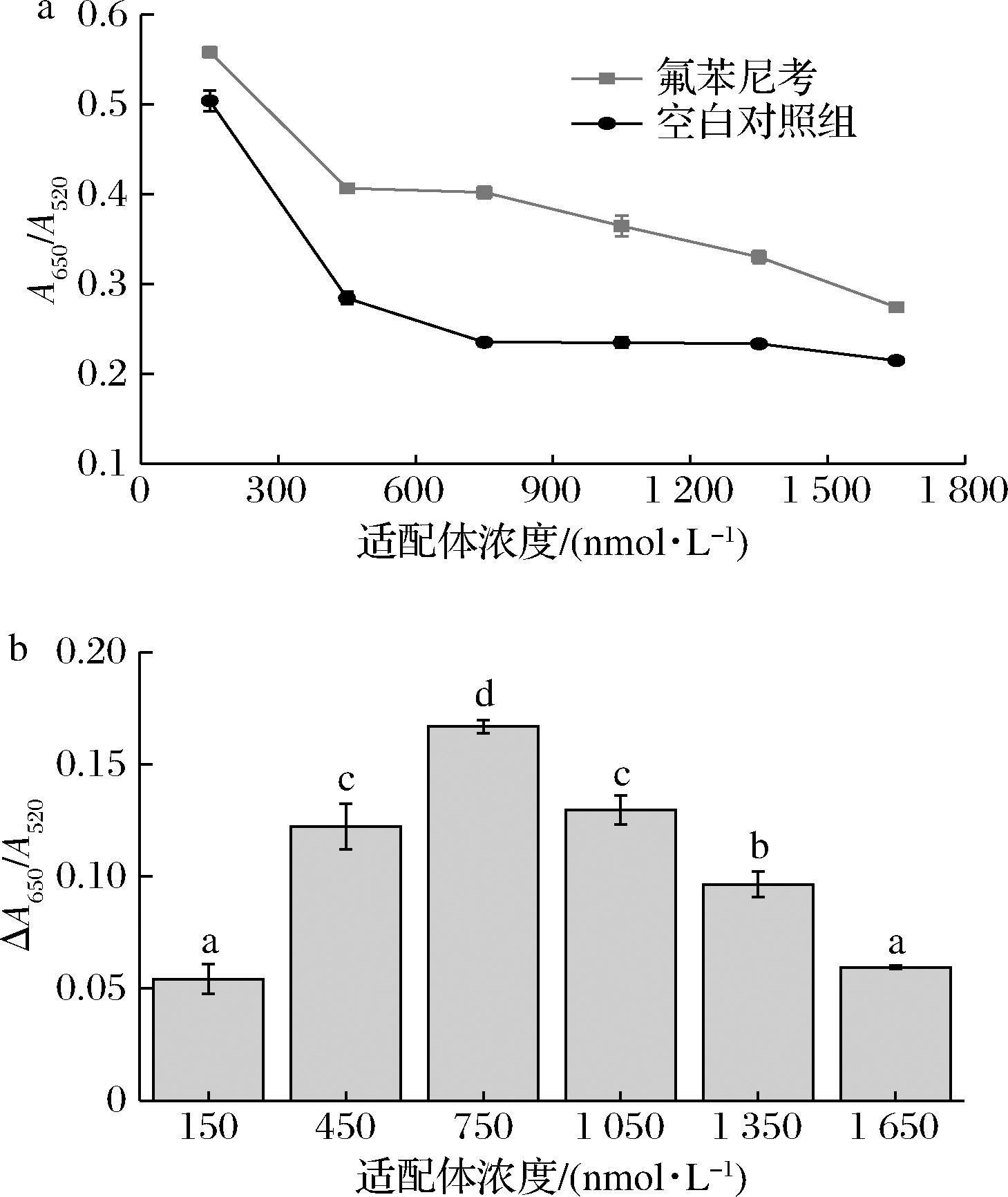
a-不同浓度适配体对体系A650/A520的影响;
b-不同浓度适配体对体系ΔA650/A520的影响
图4 适配体浓度对体系的影响
Fig.4 The effect of aptamers concentration on the
response of system
图4-a表明,当适配体浓度从150 nmol/L增加至750 nmol/L,空白对照组的A650/A520发生降低,从0.504 0±0.011 5减少至0.235 3±0.004 3,随着适配体浓度的进一步增大,空白对照组的A650/A520的变化趋于平坦。这是由于,随着适配体浓度的增大,有利于保护粒子避免发生聚集,故A650/A520相对减小。当适配体达到750 nmol/L时,吸附于AuNPs表面的适配体趋于饱和,进一步增大适配体浓度无法提高保护作用,故A650/A520无明显变化。此结果与KIM等[20]研究一致,随着适配体与金纳米比例的增大,溶液A650/A520减小,且当适配体与金纳米粒子比例达50∶1时,适配体保护金纳米粒子避免盐诱导聚集。试验组的A650/A520亦随着适配体浓度的增大而相对降低,当适配体浓度由150 nmol/L增加至1 650 nmol/L时,A650/A520从0.558 2±0.006 0减少至0.274 4±0.001 7。这是由于,随着适配浓度的增加,吸附于AuNPs表面的适配体趋于饱和,溶液中游离的适配体增加并与目标物结合[20],故从AuNPs表面脱落与目标物结合的适配体数量越少,AuNPs表面剩余的适配体相对较多,有助于粒子稳定性的保持,因此即使在NaCl的作用下,AuNPs发生团聚的程度相对减小,表现为体系A650/A520的降低。
ΔA650/A520可以更加清晰地反映AuNPs团聚程度的变化。由图4-b可知,随着适配体浓度的增大,体系的ΔA650/A520先增大再减小,当适配体浓度为750 nmol/L时,ΔA650/A520最大,为0.166 8±0.003 0。这说明,当适配体浓度为750 nmol/L时,一方面保证有足够的适配体吸附于AuNPs,避免其在NaCl的作用下直接产生聚沉而产生假阳性,另一方面又避免了体系中存在过多的适配体而影响传感器的灵敏度。因此,适配体浓度为750 nmol/L时更利于后续检测。
2.3.3 NaCl孵育时间的优化
NaCl与体系的孵育时间会影响AuNPs聚集,故在优化的NaCl及适配体浓度的基础上,研究NaCl的孵育时间对体系A650/A520及ΔA650/A520的影响,结果如图5所示。

a-NaCl不同孵育时间对体系A650/A520的影响;
b-NaCl不同孵育时间对体系ΔA650/A520的影响
图5 NaCl孵育时间对体系的影响
Fig.5 The effect of NaCl incubation time on the
response of system
图5-a表明,随着样品体系与NaCl孵育时间的延长,空白对照组及试验组的A650/A520均相对增大。其中,空白组的变化相对较小,仅由0.226 2±0.004 9增大至0.274 7±0.003 4,表明仍呈良好分散状态;而试验组的 A650/A520迅速增大,在孵育5 min内已由0.270 6±0.008 9增大至0.409 5±0.001 6,随后变化趋缓,说明随着作用时间的延长,AuNPs的团聚程度增加,5 min时大部分AuNPs可形成团簇。由图5-b可知,随NaCl孵育时间从1 min增加至5 min, 体系的ΔA650/A520从0.044 4±0.012 1显著增加至0.168 8±0.003 0,但继续延长时间后,ΔA650/A520则相对减少(P<0.05)。故后续试验中NaCl与体系孵育时间应为5 min。
2.3.4 目标物反应时间的优化
目标物与体系的反应时间会对目标物和适配体的结合程度产生影响,从而影响体系中AuNPs的聚集程度及检测效果。不同目标物反应时间对体系A650/A520及ΔA650/A520的影响如图6所示。
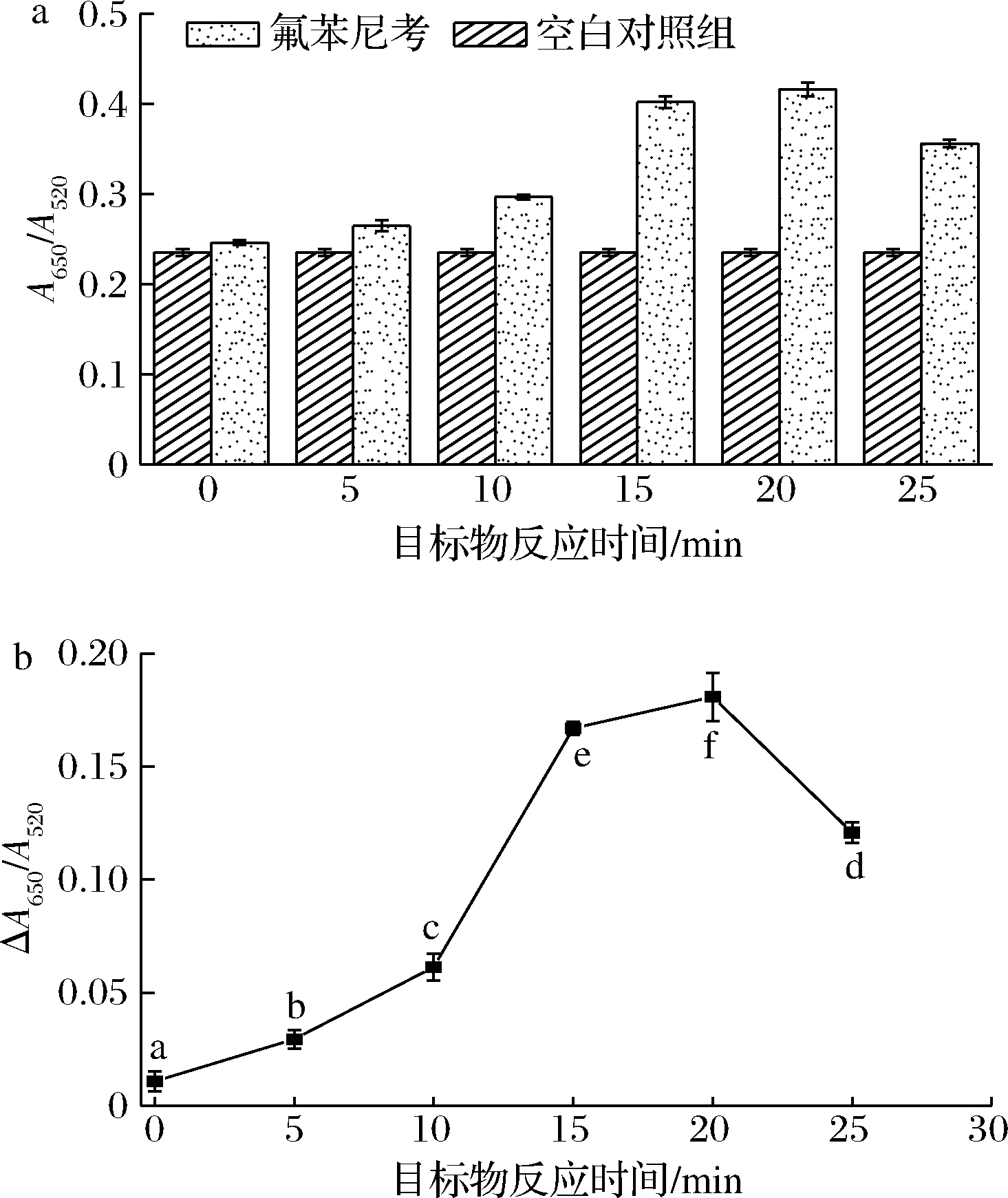
a-不同目标物反应时间对体系A650/A520的影响;
b-不同目标物反应时间对体系ΔA650/A520的影响
图6 目标物反应时间时间对体系的影响
Fig.6 The effect of target reaction time on the response of system
图6-a表明,随反应时间从0 min延长至20 min时,空白对照组的A650/A520在孵育过程中无显著改变;而试验组的A650/A520则由0.246 1±0.002 4 增加至0.416 1±0.007 6,说明随反应时间的延长,更多的适配体从AuNPs表面脱落并与目标物结合,使AuNPs在NaCl的作用下团聚程度增大,A650/A520增加。但继续延长反应时间至25 min时,体系的A650/A520则相对降低,为0.356 1±0.004 3,这一变化与WU等[6]在优化比色传感器氯霉素和四环素反应时间中发现的规律相似。这可能与一些脱落下来未和目标物结合紧密的适配体重新吸附于AuNPs表面有关,使得后续加入NaCl进行反应时,AuNPs的聚集程度有所减小。
由图6-b可知,随着反应时间的延长,体系的ΔA650/A520先增大后减小。0 min时,由于目标物与适配体还未充分反应,因此ΔA650/A520变化相对较小,仅为0.010 8±0.004 3。随着反应时间的延长,目标物与适配体反应程度加大,ΔA650/A520显著增大(P<0.05),并在反应20 min时达到峰值(0.180 8±0.010 6)。因此,选择目标物与体系反应时间为20 min。
为了评估所构建的比色传感器的灵敏度,在确定的检测条件下检测不同浓度(0.1~45 nmol/L)氟苯尼考及氟苯尼考胺,建立ΔA650/A520与目标物浓度间的线性关系。
如图7-a所示,随着氟苯尼考浓度从0.1 nmol/L增大至45 nmol/L,ΔA650/A520从0.013 3±0.000 4增加到0.880 2±0.027 2。由图7-b可知,在20~40 nmol/L,氟苯尼考浓度与ΔA650/A520呈良好的线性关系,其线性方程如公式(3)所示:
yFF=0.031 6x-0.465 3(R2=0.999 2)
(3)
由图7-c可知,随着氟苯尼考胺的浓度增加,ΔA650/A520从0.021 1±0.002 6逐渐增加到0.928 5±0.005 7。如图7-d所示,在20~45 nmol/L,氟苯尼考胺浓度与ΔA650/A520呈良好的线性关系,其线性方程如公式(4)所示:
yFFA=0.027 2x-0.325 8 (R2=0.985 4)
(4)
进一步计算检测限,氟苯尼考及氟苯尼考胺的检测限分别为5.41 nmol/L (1.94 μg/kg)和6.29 nmol/L (1.56 μg/kg)。

a-Δ A650/A520随氟苯尼考浓度的变化曲线;b-氟苯尼考的工作曲线;c-ΔA650/A520随氟苯尼考胺浓度的变化曲线;d-氟苯尼考胺的工作曲线
图7 Apt-AuNPs比色传感器检测氟苯尼考及氟苯尼考胺的灵敏度评估
Fig.7 Sensitivity of the colorimetric sensor for florfenicol detection
检验方法的特异性是其性能的重要指标。以所构建的比色传感器对氟苯尼考、氟苯尼考胺及5种抗生素(恩诺沙星、阿莫西林、氯霉素、四环素、甲砜霉素)进行检测,评价该比色传感器的检测特异性,结果如图8所示。
图8表明,当检测物浓度为45 nmol/L时,氟苯尼考及氟苯尼考胺的ΔA650/A520分别为0.880 2±0.027 2 和0.928 5±0.005 7,显著高于其他5种抗生素(P<0.05),如恩诺沙星(0.085 2±0.008 3)、阿莫西林(0.059 3±0.007 1)、氯霉素(0.090 5±0.008 0)、四环素(0.060 6±0.005 6)。即使与氟苯尼考的结构极为类似的甲砜霉素,其ΔA650/A520(0.350 9±0.009 7)仍显著低于目标物组(P<0.05)。为了验证当干扰物浓度大于目标物浓度时方法的特异性,将干扰物的浓度增大到4 500 nmol/L时发现,其他5种抗生素的ΔA650/A520仍显著低于目标物(P<0.05)。其中,恩诺沙星、阿莫西林、氯霉素、四环素、甲砜霉素的ΔA650/A520分别为0.124 0±0.006 1、0.116 3±0.006 2、0.143 1±0.005 1、0.124 9±0.005 7及0.363 9±0.005 7,这表明,即使在此浓度下,方法仍具有良好的特异性。
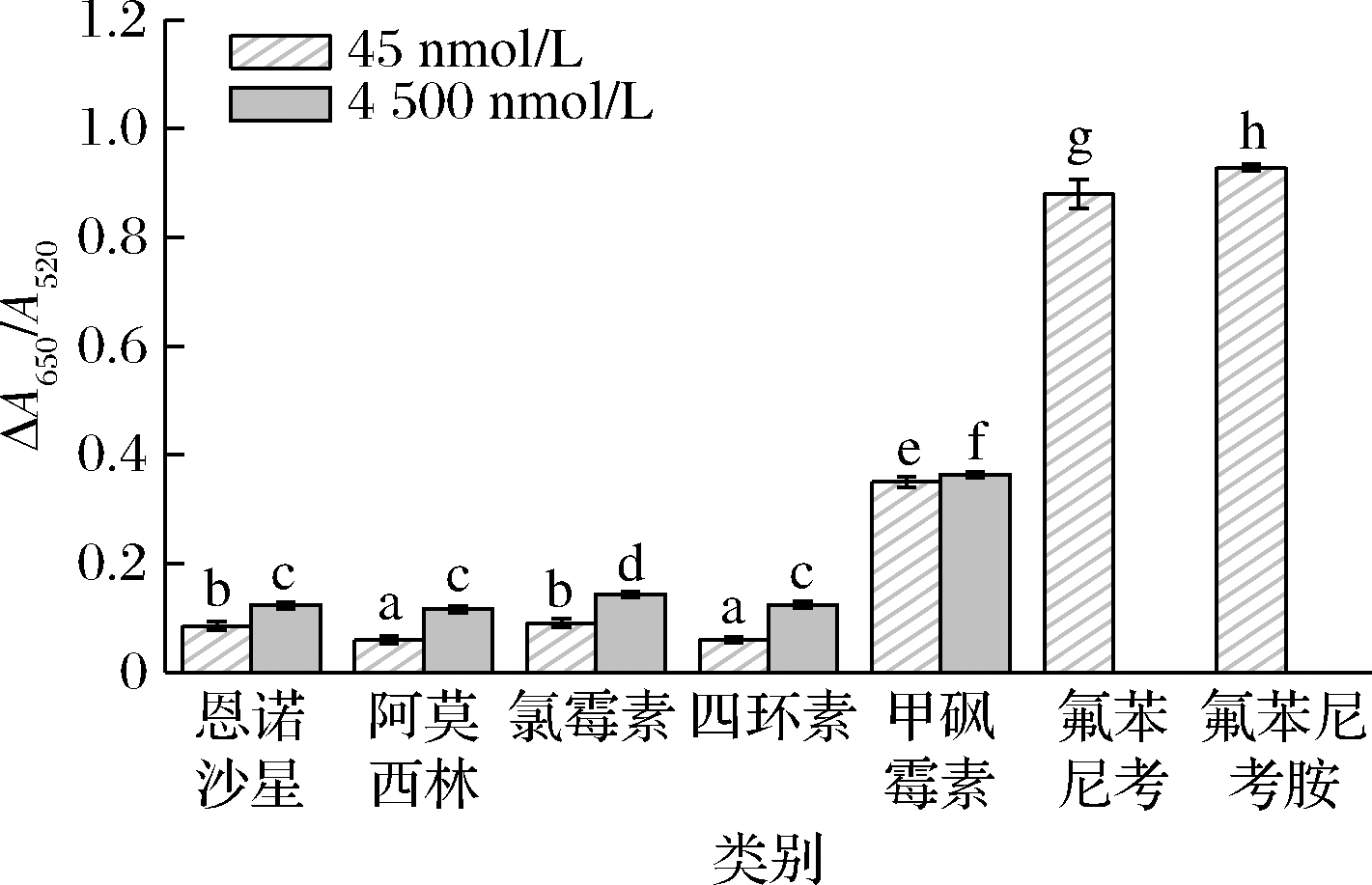
图8 Apt-AuNPs比色传感器检测氟苯尼考及
氟苯尼考胺的特异性评估
Fig.8 Selectivity of the colorimetric sensor for
florfenicol detection
以鸡蛋为实际样本进行加标回收检测试验,结果如表2所示。由表2可知,氟苯尼考的回收率为98.65%~103.40%,RSD为0.24%~1.44%;氟苯尼考胺的回收率为98.35%~107.49%,RSD为0.07%~6.78%。结果表明,该比色传感器在鸡蛋样品的检测具有准确性与稳定性,可以很好地低应用于实际样品的现场检测。
表2 氟苯尼考及氟苯尼考胺的加标回收结果
Table 2 Recoveries of florfenicol in egg samples
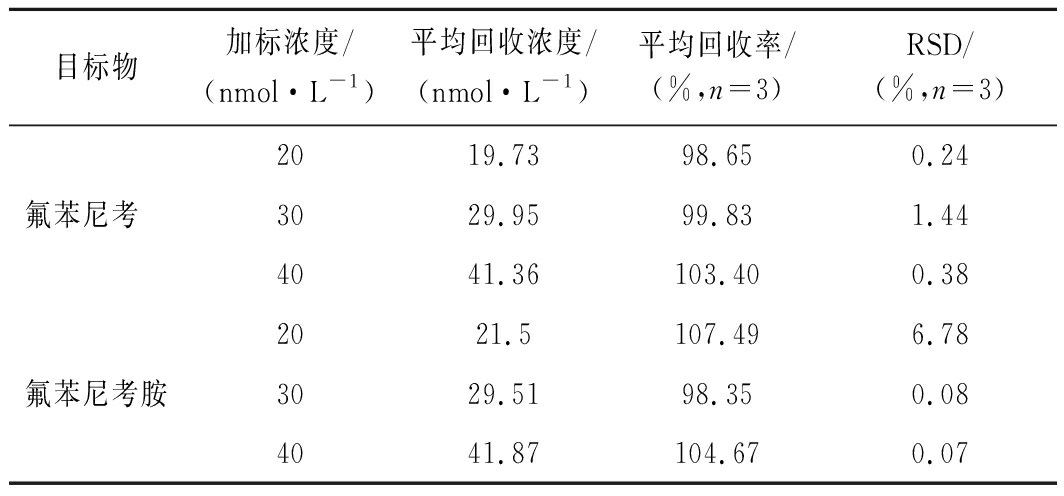
目标物加标浓度/(nmol·L-1)平均回收浓度/(nmol·L-1)平均回收率/(%,n=3)RSD/(%,n=3)2019.7398.650.24氟苯尼考 3029.9599.831.444041.36103.400.382021.5107.496.78氟苯尼考胺3029.5198.350.084041.87104.670.07
为了提高检测方法的便捷性,实现在资源有限或实验室以外的现场高通量检测,本研究利用智能手机软件对检测体系的颜色变化进行读取和RGB分析,结果如图9所示。

a-氟苯尼考浓度变化的比色卡;b-氟苯尼考浓度对ΔB/R的影响;c-氟苯尼考浓度与ΔB/R的工作曲线;d-氟苯尼考胺浓度变化的比色卡;
e-氟苯尼考胺浓度对ΔB/R的影响;f-氟苯尼考胺浓度与ΔB/R的工作曲线
图9 Apt-AuNPs比色传感器RGB分析结果
Fig.9 RGB analysis with the smartphone
图9-a及图9-d表明,随着氟苯尼考及氟苯尼考胺浓度的增加,溶液从红色变为紫色再变为蓝灰色,智能手机读取图像中的B/R(蓝色/红色)值也逐渐增大。由图9-b及图9-e可知, 体系的ΔB/R值与目标物浓度密切相关。当氟苯尼考由0.1 nmol/L增大至45 nmol/L时,体系的ΔB/R由0.01增大至0.388;当氟苯尼考胺由0.1 nmol/L增大至45 nmol/L时,体系的ΔB/R由0.02增大至0.423。同时,如图9-c和图9-f所示,在20~45 nmol/L,ΔB/R与目标物浓度呈良好线性关系,氟苯尼考和氟苯尼考胺的线性回归方程分别如公式(5)和公式(6)所示:
yFF=0.012 5x-0.164 5(R2=0.992 0)
(5)
yFFA=0.011 8x-0.125 9(R2=0.974 7)
(6)
与比色分析相比,虽然ΔB/R值与目标物的相关性稍低,但是该方法可借助于智能手机进行更为便捷的现场快速分析,操作更为简便,这也具有一定的实际应用价值。
为了验证所构建的比色传感器在实际样品检测中应用可行性,对产蛋期的蛋鸡进行预拌料方式连续给药(20%氟苯尼考)5 d,收集所产鸡蛋进行检测,检测结果如图10及表3所示。

图10 真实样品检测结果
Fig.10 Real samples detection of florfenicol in eggs
表3 真实鸡蛋样品中氟苯尼考残留量的检测 单位:μg/kg
Table 3 Real samples detection of florfenicol residue
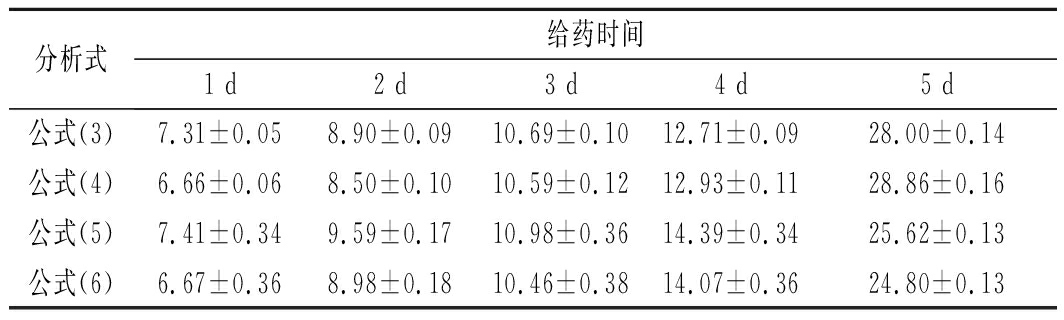
分析式给药时间1 d2 d3 d4 d5 d公式(3)7.31±0.058.90±0.0910.69±0.1012.71±0.0928.00±0.14公式(4)6.66±0.068.50±0.1010.59±0.1212.93±0.1128.86±0.16公式(5)7.41±0.349.59±0.1710.98±0.3614.39±0.3425.62±0.13公式(6)6.67±0.368.98±0.1810.46±0.3814.07±0.3624.80±0.13
图10表明,利用所建立的Apt-AuNPs比色传感器可以有效监测鸡蛋中氟苯尼考随给药天数的变化。其中,第5天的鸡蛋氟苯尼考含量超过此传感器的线性范围,故先进行适当稀释后进行检测分析。如表3所示,根据公式(3)计算所得鸡蛋中氟苯尼考的残留量由(7.31±0.05) μg/kg增加到(28.00±0.14) μg/kg,公式(4)计算所得氟苯尼考残留量由(6.66±0.06) μg/kg增加到(28.86±0.16) μg/kg。根据RGB分析公式(5)计算所得鸡蛋氟苯尼考残留量由(7.41±0.34) μg/kg增加到(25.62±0.13) μg/kg,公式(6)计算所得鸡蛋氟苯尼考残留量由(6.67±0.36) μg/kg增加到(24.80±0.13) μg/kg。不同分析式计算结果基本一致,且与张静等[21]报道的鸡蛋氟苯尼考残留量随给药天数变化的趋势一致。检测结果表明,比色传感器具有检测实际样品的能力。
表4列出了目前部分氟苯尼考的检测方法的检测物、检出限、回收率和相对标准偏差等信息。相比之下,本研究中所建立的比色传感器对氟苯尼考及氟苯尼考胺的检出限(1.94 μg/kg和1.56 μg/kg)优于传统的高效液相色谱法[22]和荧光传感器[16]。而与更为灵敏的液相串联质谱法[1]、酶联免疫[23]及高效液相荧光检测方法[24]相比,本比色传感器则显示出了更好的回收率(98.35%~107.49%)。低于6.78%的标准偏差也显示了此传感器具有良好的稳定性。
表4 氟苯尼考检测方法的对比 单位:μg/kg
Table 4 Comparison of detection methods for florfenicol
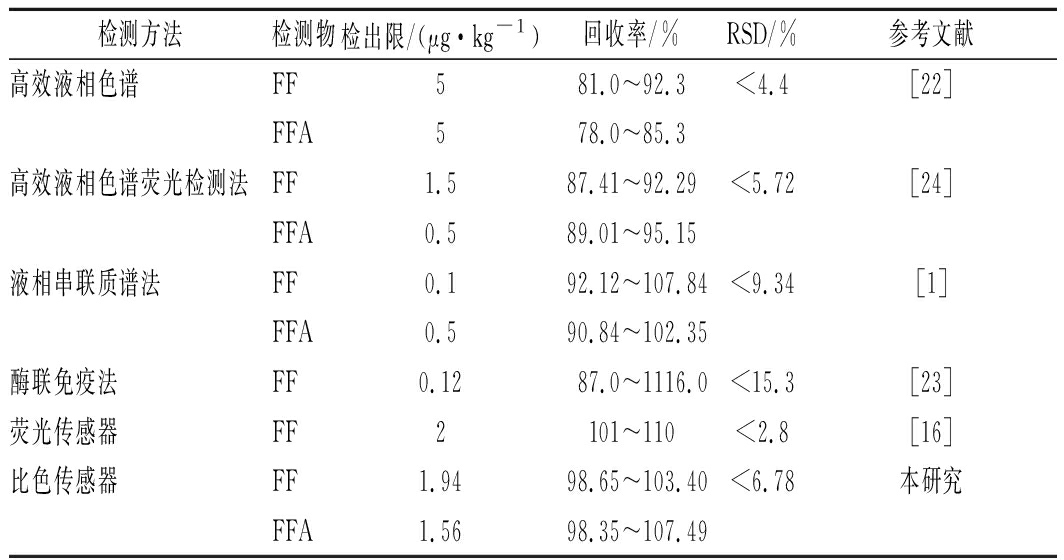
检测方法检测物检出限/(μg·kg-1)回收率/%RSD/%参考文献高效液相色谱FF581.0~92.3<4.4[22]FFA578.0~85.3高效液相色谱荧光检测法FF1.587.41~92.29<5.72[24]FFA0.589.01~95.15液相串联质谱法FF0.192.12~107.84<9.34[1]FFA0.590.84~102.35酶联免疫法FF0.1287.0~1116.0<15.3[23]荧光传感器FF2101~110<2.8[16]比色传感器FF1.9498.65~103.40<6.78本研究FFA1.5698.35~107.49
本研究构建了基于适配体功能化的纳米金比色传感器,在优化检测条件的基础上,评估了传感器的灵敏性、特异性及对鸡蛋中氟苯尼考检测的可行性,进而探索了借助于智能手机的成像分析进行现场快速分析的可行性。比色传感器的优化条件如下:NaCl浓度为50 mmol/L,NaCl孵育时间为5 min,适配体浓度为750 nmol/L,目标物与体系的反应时间为20 min。在此条件下,ΔA650/A520与氟苯尼考的浓度(20~40 nmol/L)、氟苯尼考胺的浓度(20~45 nmol/L)均呈良好线性关系,检测限分别为5.41 nmol/L和6.29 nmol/L,传感器具有良好的特异性。鸡蛋中氟苯尼考及氟苯尼考胺的加标回收率分别为98.65%~103.40%和98.35%~107.49%,相对标准偏差小于6.78%。智能手机红蓝绿分析结果表明,ΔB/R与氟苯尼考及氟苯尼考胺均存在良好的线性关系,R2分别为0.992 0 和0.974 7,故以ΔB/R为指标可实现智能手机的快速检测。所建立的Apt-AuNPs比色传感器可以有效监测鸡蛋中氟苯尼考随给药天数的变化,证实了该方法在实际样品分析应用的可行性。总体而言,本研究中所建立的比色传感器对氟苯尼考具有较高的检测灵敏度和特异性,且简单快速,具有良好的应用价值,可应用于实际畜、禽食品中的氟苯尼考的现场快速筛查检测。
[1] XIE X, WANG B, PANG M D, et al.Quantitative analysis of chloramphenicol, thiamphenicol, florfenicol and florfenicol amine in eggs via liquid chromatography-electrospray ionization tandem mass spectrometry[J].Food Chemistry, 2018, 269:542-548.
[2] XIE K Z, JIA L F, YAO Y L, et al.Simultaneous determination of thiamphenicol, florfenicol and florfenicol amine in eggs by reversed-phase high-performance liquid chromatography with fluorescence detection[J].Journal of Chromatography B, 2011, 879(23):2 351-2 354.
[3] 中华人民共和国国家质量监督检验检疫局, 中国国家标准化管理委员会.GB 31650—2019 食品安全国家标准 食品中兽药最大残留限量[S].北京:中国标准出版社, 2019.
State Administration of Quality Supervision, Inspection and Quarantine of the People′s Republic of China, China National Standardization Administration Committee.GB 31650—2019 National food safety standard maximum residue limits for veterinary drugs in foods[S].Beijing:China Standards Press, 2019.
[4] WEI S L, LI J W, LIU Y, et al.Development of magnetic molecularly imprinted polymers with double templates for the rapid and selective determination of amphenicol antibiotics in water, blood, and egg samples[J].Journal of Chromatography A, 2016, 1 473:19-27.
[5] FEDENIUK R W, MCKENZIE D, MIZUNO M, et al.Development and validation of determinative and confirmatory LC-MS/MS methodologies for total florfenicol and tulathromycin residues in bovine, equine and porcine kidney, liver and muscle tissues[J].Journal of Chromatography B, 2015, 983-984:1-9.
[6] WU Y Y, HUANG P, WU F Y.A label-free colorimetric aptasensor based on controllable aggregation of AuNPs for the detection of multiplex antibiotics[J].Food Chemistry, 2020, 304:125377.
[7] SAHA K, AGASTI S S, KIM C, et al.Gold nanoparticles in chemical and biological sensing[J].Chemical Reviews, 2012, 112(5):2 739-2 779.
[8] 关桦楠, 薛悦, 刘博, 等.新型巯基化适配体修饰金纳米粒子比色检测饮用水中汞离子的研究[J].现代化工, 2021, 41(2):256-260.
GUAN H N, XUE Y, LIU B, et al.Colorimetric assay of mercury ions in drinking water by a novel thiolated aptamer modified gold nanoparticles[J].Modern Chemical Industry, 2021, 41(2):256-260.
[9] 高伟雯, 陈丽敏, 郭桐彤, 等.基于L-天冬氨酸功能化纳米金比率型探针的卡那霉素A比色法检测[J].分析试验室, 2020, 39(11):1 271-1 275.
GAO W Y, CHEN L M, GUO T T, et al.A radiometric L-aspartic acid functionalized gold nanoparticles probe for colorimetric detection of kanamycin A[J].Chinese Journal of Analysis Laboratory, 2020, 39(11):1 271-1 275.
[10] UDAYAN G, MARSELLA A, VALENTINI P.An ultrasensitive colorimetric test for the detection of somatic rare mutations in DNA[J].Nanoscale, 2020, 12(5):2 973-2 979.
[11] CANICA M, MANAGEIRO V, ABRIOUEL H, et al.Antibiotic resistance in foodborne bacteria[J].Trends in Food Science & Technology, 2019, 84:41-44.
[12] LIU J W.Adsorption of DNA onto gold nanoparticles and graphene oxide:Surface science and applications[J].Physical Chemistry Chemical Physics:PCCP, 2012, 14(30):10 485-10 496.
[13] MA Q, WANG Y X, JIA J, et al.Colorimetric aptasensors for determination of tobramycin in milk and chicken eggs based on DNA and gold nanoparticles[J].Food Chemistry, 2018, 249:98-103.
[14] YU L L, SONG Z R, PENG J, et al.Progress of gold nanomaterials for colorimetric sensing based on different strategies[J].TrAC Trends in Analytical Chemistry, 2020, 127:115880.
[15] CHEN G H, CHEN W Y, YEN Y C, et al.Detection of mercury (II) ions using colorimetric gold nanoparticles on paper-based analytical devices[J].Analytical Chemistry, 2014, 86(14):6 843-6 849.
[16] SADEGHI A S, MOHSENZADEH M, ABNOUS K, et al.Development and characterization of DNA aptamers against florfenicol:Fabrication of a sensitive fluorescent aptasensor for specific detection of florfenicol in milk[J].Talanta, 2018, 182:193-201.
[17] ZIEGLER C, EYCHMÜLLER A.Seeded growth synthesis of uniform gold nanoparticles with diameters of 15-300 nm[J].The Journal of Physical Chemistry C, 2011, 115(11):4 502-4 506.
[18] HUANG P C, GAO N, LI J F, et al.Colorimetric detection of methionine based on anti-aggregation of gold nanoparticles in the presence of melamine[J].Sensors and Actuators B:Chemical, 2018, 255:2 779-2 784.
[19] ZHANG Y, SHEN J C, YANG H, et al.A highly selective magnetic sensor for Cd2+ in living cells with (Zn, Mn)-doped iron oxide nanoparticles[J].Sensors and Actuators B:Chemical, 2015, 207:887-892.
[20] KIM Y S, KIM J H, KIM I A, et al.A novel colorimetric aptasensor using gold nanoparticle for a highly sensitive and specific detection of oxytetracycline[J].Biosensors and Bioelectronics, 2010, 26(4):1 644-1 649.
[21] 张静, 周倩, 高玉时, 等.氟苯尼考及其代谢物氟苯尼考胺在鸡蛋中的残留消除规律[J].浙江大学学报(农业与生命科学版), 2021, 47(1):127-134.
ZHANG J, ZHOU Q, GAO Y S, et al.Residue depletion laws of florfenicol and its metabolite florfenicol amine in eggs[J].Journal of Zhejiang University (Agriculture and Life Sciences), 2021, 47(1):127-134.
[22] 刘明生, 甘辉群, 刘俊栋, 等.鸡蛋中氟苯尼考和氟苯尼考胺残留的检测技术研究[C].第三届中国兽医临床大会论文集.兰州, 2012:360-363.
LIU M S, GAN H Q, LIU J D, et al.Determination of florfenicol and florfenicol amine residues in eggs[C].Proceedings of the 3rd Chinese Veterinary Clinical Congress. Lanzhou,2012:360-363.
[23] LI R, LIN Z J, YANG J Y, et al.An indirect competitive enzyme-linked immunosorbent assay for simultaneous determination of florfenicol and thiamphenicol in animal meat and urine[J].Chinese Journal of Analytical Chemistry, 2018, 46(8):1 321-1 328.
[24] 谢恺舟, 姚宜林, 徐东, 等.高效液相色谱荧光检测法同时检测鸡蛋中氟苯尼考及其代谢物氟苯尼考胺残留[J].中国兽医杂志, 2011, 47(8):74-77.
XIE K Z, YAO Y L, XU D, et al.Simultaneous determination of residues of florfenicol and the metabolite florfenicol amine in hen eggs by HPLC with fluorescence detection[J].Chinese Journal of Veterinary Medicine, 2011, 47(8):74-77.