表1 硫代黄素的质谱参考条件
Table 1 Optimized parameters of MS/MS for thioflavine T

药物名称定量离子对m/z定性离子对m/z驻留时间/ms碰撞能量/eV硫代黄素283.2>267.0283.2>267.0283.2>253.0100.0100.03635
大黄鱼中含有丰富的微量元素、蛋白质和维生素[1-2],备受消费者的喜爱和关注。因其保鲜期短、产量低、价格高,有不法商贩向“伪黄鱼”或品质差的黄鱼中添加硫代黄素等黄色化工染料冒充新鲜黄鱼,“染色黄鱼”问题经常曝出。硫代黄素,又名碱性黄1和硫磺素T,为芳香胺类碱性工业染料,常用于生物组织学染色等工业领域。《食品中可能违法添加的非食用物质和易滥用的食品添加剂品种名单(第五批)》[3]规定硫代黄素不能作为食品添加剂使用,指出其可能存在的食品种类为大黄鱼,长期过量食用将对人体肾脏、肝脏造成损害甚至致癌。目前,大黄鱼中硫代黄素的检测无相关国家或行业标准,硫代黄素的相关检测方法鲜有报道,亦没有大黄鱼中硫代黄素LC-MS/MS的检测方法,为了有效的监控大黄鱼中硫代黄素的非法添加,建立快速准确的相关检测方法尤为必要。
文献报道中关于工业染料的检测方法主要有分光光度法[4-5]、酶联免疫吸附法[6-7]、液相色谱法[8-10]和液相色谱-串联质谱法[11-13]等。其中分光光度法操作简单,但在面对复杂基质时需要繁琐的前处理过程,且特异性低。酶联免疫吸附法无需贵重仪器,检测成本低,但目前制备高质量特异性抗体比较困难,限制了其使用。液相色谱法能够准确定量,获得广泛应用,但灵敏度低,且分析时间长,其仅采用保留时间进行定性易产生假阳性结果;液相色谱-串联质谱法能够在一定程度上排除基质干扰,灵敏度高、选择性好,很适合复杂基质中目标物的痕量检测。大黄鱼肉中含有大量的脂肪、蛋白质、碳水化合物等物质,成分复杂,提取和净化困难,常见前处理技术有液液萃取法[14]、固相萃取法[15-16]、QuEChERS方法[17-20]等,前2种方法存在前处理过程复杂、耗时长、效率低等问题。QuEChERS方法作为农药残留检测较为成熟的前处理方法,具有快速、简单、高效、可靠和安全等优点,已被广泛用于兽药残留、非法添加等成分的检测。
本研究采用改良的QuEChERS方法结合超高效液相色谱-串联质谱(ultra performance liquid chromatography-MS/MS,UPLC-MS/MS)检测大黄鱼中硫代黄素含量。本方法净化步骤简单、快速高效、灵敏度高,填补了国内UPLC-MS/MS法测定大黄鱼中硫代黄素含量的技术空白,为水产品质量安全监控提供了新的检测方法。
Agilent1290 InfinityⅡ液相色谱系统和Agilent 6470三重四极杆液质联用系统,美国Agilent公司;AB204-S型电子天平,瑞士Mettler Toledo公司;SB-800DTD 型超声波清洗器,中国宁波新芝生物科技股份有限公司;3-18K型冷冻离心机,德国Sigma公司;Milli-Q纯水系统,美国Millipore公司;涡旋混合器,德国IKA公司。
硫代黄素标准品(纯度95.9%),天津阿尔塔科技有限公司;甲醇、乙腈(HPLC级,纯度>99.9%),德国Merck公司;DisQuE净化包[900 mg无水硫酸镁(MgSO4)、150 mg N-丙基乙二胺吸附剂(primary secondary amine,PSA)、150 mg十八烷基键合硅胶吸附剂(C18)],美国Waters公司;实验所用大黄鱼样品,市售。
1.2.1 标准溶液的配制
准确称取硫代黄素标准物质10.00 mg(精确至0.01 mg),用乙腈溶解并定容至10 mL,配制成标准储备液(1 mg/mL),置于棕色玻璃瓶中,于冰箱-18 ℃冷冻保存。移取标准储备液,用乙腈稀释至适当浓度,得到标准工作液,于-18 ℃冷冻保存。
1.2.2 样品前处理
提取:称取2.000 g均匀样品(准确至0.001 g),置于50 mL离心管中,加入10 mL 80%(体积分数)乙腈水溶液,涡旋2 min,超声提取10 min,加入2 g NaCl涡旋,以8 000 r/min离心5 min,取上清液备用;用10 mL 80%乙腈水溶液(8∶2,体积比)重复提取1次,合并上清液,待净化。
净化:移取上清液4 mL,加入装有200 mg无水硫酸镁、50 mg PSA吸附剂、50 mg C18吸附剂的15 mL的离心管中,涡旋混合1 min,8 000 r/min离心5 min,上清液经微孔滤膜过滤,待测。
1.2.3 色谱条件
色谱柱:Waters BEHC18柱(2.1 mm×50 mm,1.7 μm);流动相:0.1%(体积分数)甲酸水溶液(A)和乙腈(B);柱温:40 ℃;进样体积:1 μL;流速:0.30 mL/min;梯度洗脱程序:0~0.5 min,5% B;0.5~3.5 min,5% B~90% B;3.5~5.0 min,保持90%B;5.0~5.1 min,90% B~5% B;5.1~6.0 min,保持5% B。
1.2.4 质谱条件
离子源:电喷雾离子源;离子化模式:正离子模式;监测方式:多反应监测(multiple reaction monitoring,MRM);干燥气温度:250 ℃;干燥气速度:5 L/min;鞘气温度:350 ℃;鞘气流速:11 L/min;毛细管电压:4 000 V;硫代黄素的定性离子对、定量离子对及其他质谱参数见表1。
表1 硫代黄素的质谱参考条件
Table 1 Optimized parameters of MS/MS for thioflavine T

药物名称定量离子对m/z定性离子对m/z驻留时间/ms碰撞能量/eV硫代黄素283.2>267.0283.2>267.0283.2>253.0100.0100.03635
2.1.1 色谱柱的选择
分别采用Agilent ZORBAX Eclipse Plus C18(2.1 mm×50 mm,1.8 μm)、Waters BEH C18色谱柱(2.1 mm×50 mm,1.7 μm)、Waters HSS T3(2.1 mm×100 mm,1.8 μm)3种不同保留性能的色谱柱进行测定。发现硫代黄素在3种色谱柱上均能有效分配和分离,HSS T3保留性能过强,硫代黄素峰型拖尾。色谱柱越长溶剂损耗越多,分析时间延长,综合考虑分离效果和效率,2种50 mm C18色谱柱均能够满足分析,本研究采用Waters BEH C18色谱柱(2.1 mm×50 mm,1.7 μm)完成实验。
2.1.2 流动相的选择
在优化的质谱条件下,考察不同流动相对目标物质谱信号的影响。分别考察甲醇-水、乙腈-水、乙腈-0.1%甲酸、乙腈-0.1%甲酸/乙酸铵等作为流动相对目标物的影响,结果发现甲醇、乙腈作为有机相,目标物响应相当,但考虑乙腈为强洗脱溶剂,对消除非法染料在色谱体系的残留较好,选择乙腈作为有机相。纯水作为流动相时,硫代黄素拖尾严重,峰型较差。在水相中加入0.1%甲酸后,峰形变好,且响应增高,能够满足定量需求。此外,水相中加入乙酸铵后,目标物响应明显降低,因此最终选择乙腈-0.1%甲酸水作为流动相。
根据硫代黄素的分子结构特征和化学电离性质,选择了正离子模式电喷雾电离。以1 μg/mL的硫代黄素标准溶液注入质谱仪,通过一级质谱扫描获得相应的母离子,并通过优化离子源质谱参数获得最优离子源参数。获得化合物的准分子离子峰m/z 283.2为[M+H]+形式。在产物离子扫描模式下,以化合物的准分子离子峰为母离子,进行二级质谱扫描,获得碎片离子m/z 267.0、m/z 253.0、m/z 223.9、m/z 161.7、m/z144.8,通过对二级质谱分析推测(图1),推测硫代黄素的裂解途径为母离子m/z 283.2经电子转移后,开环裂解失去叔胺上的—CH3基团,得到m/z 267.0子离子;或开环裂解失去—C![]() NH基团,得到m/z 253.0子离子;或开环断裂得到m/z 161.7。其中m/z 267.0和m/z 161.7碎片又分别进一步断裂得到m/z 223.9和m/z 144.8。由分析可以看到,硫代黄素的主要裂解规律是在噻唑环处开环,对硫代黄素这类噻唑类非法染料的准确定性具有较好的确证作用。在所有碎片离子中,选择2对丰度较强,基质干扰较小的离子m/z 267.0和m/z 253.0为MRM模式下的子离子,以满足欧盟96/23/EC指令中对残留检测确证的要求。进一步优化碰撞能等质谱参数,优化后的质谱条件见表1。
NH基团,得到m/z 253.0子离子;或开环断裂得到m/z 161.7。其中m/z 267.0和m/z 161.7碎片又分别进一步断裂得到m/z 223.9和m/z 144.8。由分析可以看到,硫代黄素的主要裂解规律是在噻唑环处开环,对硫代黄素这类噻唑类非法染料的准确定性具有较好的确证作用。在所有碎片离子中,选择2对丰度较强,基质干扰较小的离子m/z 267.0和m/z 253.0为MRM模式下的子离子,以满足欧盟96/23/EC指令中对残留检测确证的要求。进一步优化碰撞能等质谱参数,优化后的质谱条件见表1。

A-二级质谱图;B-可能裂解途径
图1 硫黄素T二级质谱图及可能裂解途径
Fig.1 The spectra of daughter ions scanning and
fragmentation pathways of thioflavine T
2.3.1 提取条件的优化
本实验分别考察了乙腈、甲醇、纯水作为提取溶剂对目标物的提取效率,结果显示纯水作为提取溶剂,目标物的回收率约为20%,且提取液浑浊,样品净化困难。甲醇与乙腈提取效率均能达到90%,考虑乙腈具有更好的沉淀蛋白质的作用,并且其带出的弱极性成分少,质谱响应高、基质干扰小,因而选用乙腈作为主要提取溶剂。考虑到纯乙腈易使蛋白质快速凝结成团,提取液中加入一定比例水相会提高样品分散程度,有利于样品中目标物的提取。因此本实验比较了不同体积分数乙腈水溶液的提取效果,结果如图2所示,80%乙腈水溶液作为提取剂时目标物的回收率最高,而提取溶剂为50%乙腈水溶液时回收率增幅开始下降。分析原因可能为随水的比例增加,提取液变浑浊,基质效应(matrix effect,ME)变大。经80%乙腈水溶液提取后,蛋白沉淀效果好,提取液较澄清,回收率高,因此选择80%乙腈水溶液作为提取溶剂。

图2 不同体积分数乙腈水溶液对提取效率的影响
Fig.2 Effect of different proportions of acetonitrile aqueous
solution on extraction efficiency
实验进一步对提取体积和次数进行了考察,结果显示,提取溶剂体积为10、15、20 mL时三者回收率无显著性差异。用10 mL乙腈水溶液提取2次时的回收率升高,继续增加提取次数,回收率无明显差异,因此选择用10 mL提取溶剂对目标物提取2次。
2.3.2 净化方式的选择
大黄鱼作为优质水产品,基质化学成分复杂,含有大量的脂肪、蛋白质、碳水化合物等,本实验采用新型通过式固相萃取柱PRiME HLB和QuEChERs方法对目标物进行净化,结果显示,PRiME HLB对目标物有一定的吸附作用,需要进行进一步的洗脱,而采取乙腈进行洗脱会将色谱柱中保留的磷脂等干扰物重新洗脱下来,影响净化效果,因此该方法不适用于目标物的净化。QuEChERs方法常用的吸附剂有PSA、C18、石墨化碳黑(graphitized carbon black,GCB)等,其中GCB易对色素成分有吸附,而PSA对大黄鱼基质中脂肪酸、碳水化合物以及甾醇等极性干扰物有净化效果,C18可以去除脂肪和脂类等非极性干扰物。因此本实验选择PSA和C18作为优化吸附剂,净化过程中水分含量会影响PSA的净化效果,选用无水硫酸镁来除水。首先采用成品净化包(PSA 150 mg+C18 150 mg+无水MgSO4 900 mg)对提取液进行预实验,结果回收率能够满足要求。为更好地提高净化效果,进一步对QuEChERS方法中吸附剂用量进行优化,首先对无水硫酸镁用量进行优化。如图3所示,吸附剂中无水硫酸镁用量为200、500、900 mg时,回收率均在90%以上,200 mg时回收率最高,高于未加入时的数值。无水硫酸镁用量超过200 mg后回收率有下降趋势,当无水硫酸镁用量在1 500 mg时回收率明显降低,原因可能为无水硫酸镁过多吸附少量目标物质,且无水硫酸镁用量越多所需待净化溶剂越多。因此选择在吸附剂中加入200 mg无水硫酸镁。
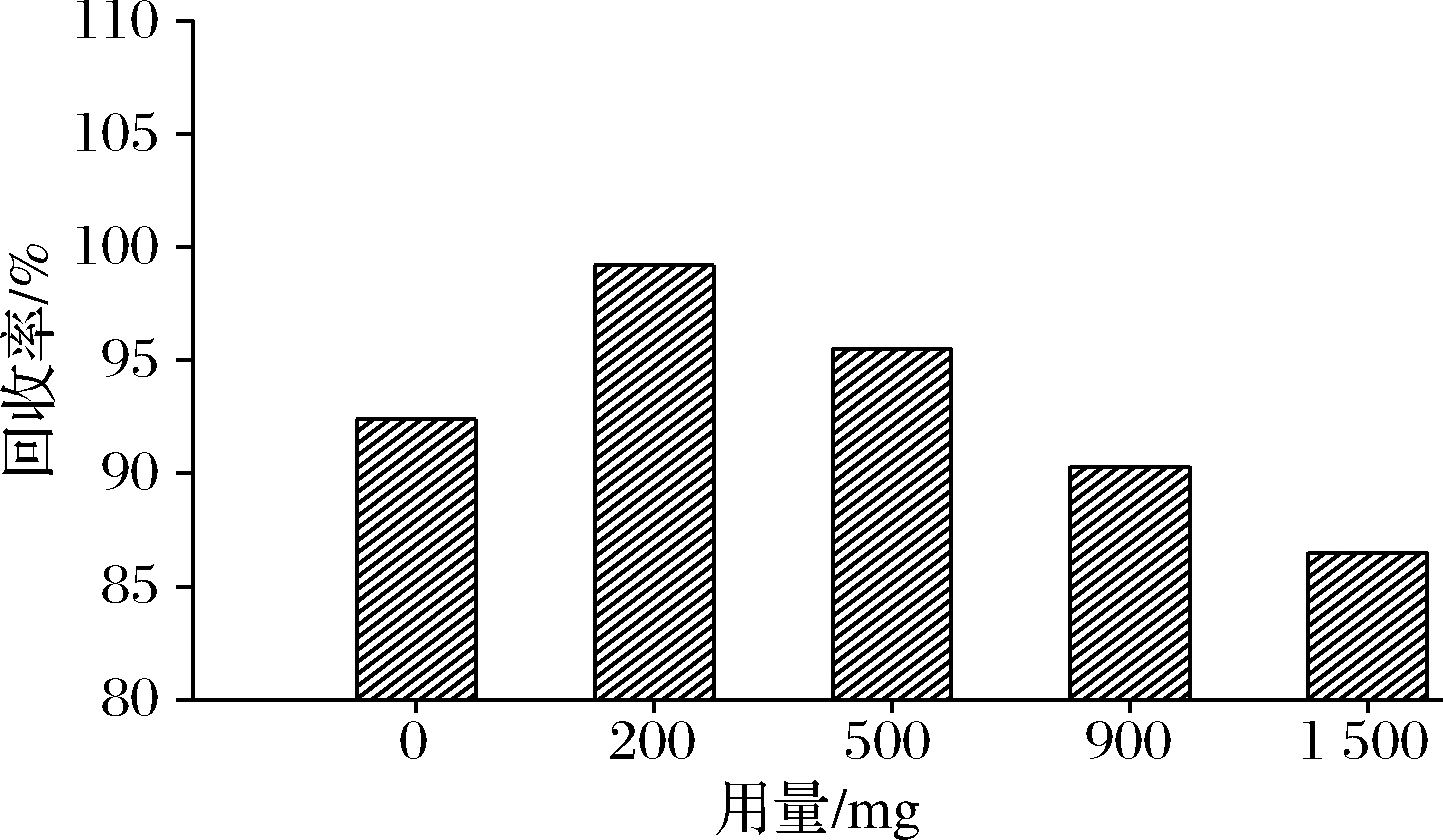
图3 无水硫酸镁用量对回收率的影响
Fig.3 Effect of anhydrous magnesium sulfate content on
recovery rate
对PSA和C18用量进行优化,两者用量设置相同,用量为50、100、150 mg时回收率均高于90%,用量为300 mg时回收率降低,如图4所示。综合考虑回收率和实验成本,本方法选择PSA和C18用量均为50 mg。

图4 PSA和C18用量对回收率的影响
Fig.4 Effect of PSA and C18 content on recovery rate
2.3.3 浓缩过程的考察
对痕量物质的检测,氮吹浓缩是常见提高目标物分析灵敏度或置换溶剂的常见手段。以空白样品加标为例,考察了氮吹浓缩对方法回收率的影响。结果显示,氮吹浓缩之前,硫代黄素回收率为95.2%,氮吹浓缩后硫代黄素回收率为80.1%,明显低于氮吹浓缩之前,原因可能为氮吹过程中目标物发生了损失。兼顾方法的灵敏度与准确性,本方法不进行氮吹富集。
2.4.1 方法的线性范围
用纯乙腈配制硫代黄素系列标准溶液,质量浓度分别为0.5、2.0、10.0、20.0、50.0 ng/mL。将标准溶液按浓度从低到高依次经液相色谱-串联质谱条件进行测定,根据质量浓度与色谱峰面积响应绘制标准曲线和计算回归方程及其相关系数。结果表明,硫代黄素质量浓度为0.5~50.0 ng/mL时,浓度与其峰面积呈良好的线性关系,线性方程为Y=3 660.332X+837.035,其相关系数(r)大于0.998。采用空白基质加标的方法,以信噪比S/N=10得到目标物的LOQ为5.0 μg/kg,以信噪比S/N=3得到目标物的检出限为2.0 μg/kg。硫代黄素标准溶液和样品加标溶液总离子流和特征离子质量色谱图如图5所示。

A-标准溶液(2 ng/mL);B-样品加标溶液(20.0 μg/kg)
图5 硫代黄素标准溶液和样品加标溶液的总离子流和
提取离子流色谱图
Fig.5 Extracted ion current chromatograms of
thioflavine T in the standard solution
2.4.2 方法回收率和精密度
称取大黄鱼阴性样品加入硫代黄素标准溶液,得到低、中、高3水平浓度为5.0、20.0和100.0 μg/kg的加标样品,按照本方法对大黄鱼样品中的硫代黄素进行6次测定,回收率在94.1%~99.2%,相对标准偏差为0.53%~1.60%时,符合重复性试验对相对标准偏差的要求,结果如表2所示。
表2 大黄鱼中硫代黄素回收率及精密度(RSD)(n=6)
Table 2 Recoveries and RSDs of thioflavine T in
Larimichthys crocea (n=6)
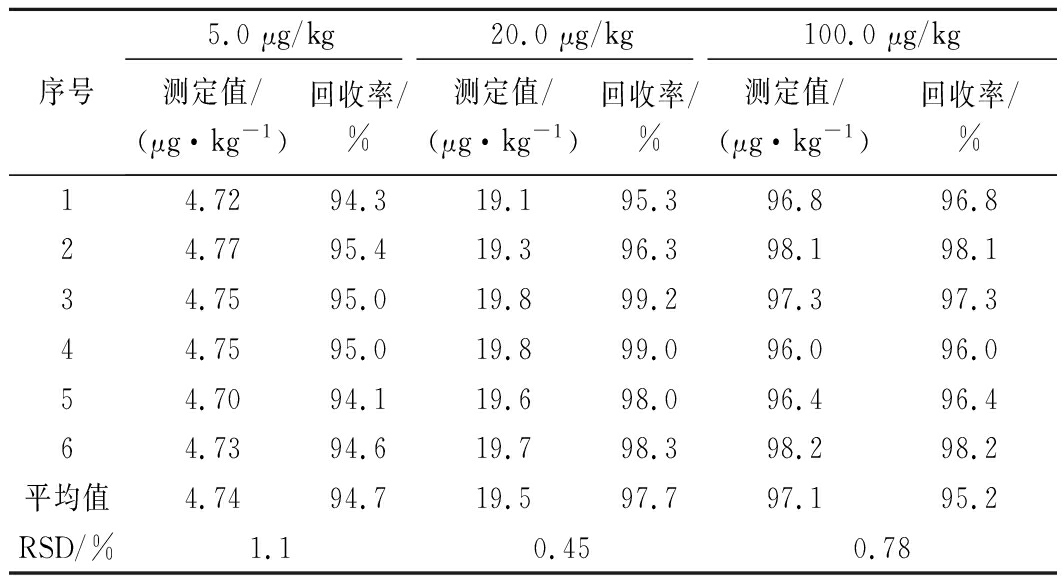
序号5.0 μg/kg20.0 μg/kg100.0 μg/kg测定值/(μg·kg-1)回收率/%测定值/(μg·kg-1)回收率/%测定值/(μg·kg-1)回收率/%14.7294.319.195.396.896.824.7795.419.396.398.198.134.7595.019.899.297.397.344.7595.019.899.096.096.054.7094.119.698.096.496.464.7394.619.798.398.298.2平均值4.7494.719.597.797.195.2RSD/%1.10.450.78
2.4.3 ME的考察
本方法分别测定了空白样品处理液与纯溶剂中添加同水平目标成分的响应值,计算二者的相对比值来评价ME。ME计算如公式(1)所示:
(1)
式中:ME为负值表示存在基质抑制效应,为正值表示存在基质增强效应,0为无ME,绝对值越大表示ME越强。结果显示,本方法中硫代黄素的ME为2.1%~10.2%时,ME影响不明显,因此采用纯溶剂标准溶液进行定量。
应用所建立的方法对市售20批次大黄鱼样品进行测定,结果均未检出硫代黄素。
本文通过优化仪器条件及前处理条件,建立了改进QuEChERS方法结合UPLC-MS/MS测定大黄鱼中硫代黄素残留的分析方法。该方法简单、快速、灵敏度高,定性定量准确,适用于大黄鱼中硫代黄素的检测,填补了国内UPLC-MS/MS法测定大黄鱼中硫代黄素含量的技术空白,为检验标准的建立提供技术参考,有助力于市场监管部门对硫代黄素非法添加的有效监管。
[1] 刘家富, 韩坤煌.我国大黄鱼产业的发展现状与对策[J].福建水产, 2011, 33(5):4-8.
LIU J F, HAN K H.Current development situation and countermeasure of large yellow crocker industry in China[J].Journal of Fujian Fisheries, 2011, 33(5):4-8.
[2] 何志刚, 艾庆辉, 麦康森.大黄鱼营养需求研究进展[J].饲料工业, 2010, 31(24):56-59.
HE Z G, AI Q H, MAI K S.Advances in nutrition and feed for large yellow croaker[J].Feed Industry, 2010, 31(24):56-59.
[3] 全国食品安全整顿工作办公室. 关于印发《食品中可能违法添加的 非食用物质和易滥用的食品添加剂 品种名单(第五批)》的通知[EB/OL].http://www.nhc.gov.cn, 2011-01-03.
National Food Safety Rectification Office.Notice of list of potential illegal dietary supplements that contain inedible and/or unsafe ingredients (part Ⅴ)[EB/OL].http://www.nhc.gov.cn, 2011-01-03.
[4] 庞艳玲, 王怀友.薄层色谱-紫外可见分光光度法测定食品中的苏丹红Ⅰ号[J].分析试验室, 2008, 27(1):60-62.
PANG Y L, WANG H Y.Determination of Sudan redⅠin food by TLC-UV-Vis spectrophotometry[J].Chinese Journal of Analysis Laboratory, 2008, 27(1):60-62.
[5] 王成, 程军喜, 张小军.饮料中日落黄和胭脂红含量同时测定的分光光度法[J].职业与健康, 2008, 24(15):1 516-1 518.
WANG C, CHENG J X, ZHANG X J.Simultaneous determination of sunset yellow and carmine contents in beverage by spectrophotometry[J].Occupation and Health, 2008, 24(15):1 516-1 518.
[6] OPLATOWSKA M, ELLIOTT C T.Development and validation of rapid disequilibrium enzyme-linked immunosorbent assays for the detection of methyl yellow and Rhodamine B dyes in foods[J].Analyst, 2011, 136(11):2 403-2 410.
[7] 韩丹, 于梦, 吴梅, 等.酶联免疫吸附分析法测定食品中的苏丹红Ⅰ号[J].分析化学, 2007, 35(8):1 168-1 170.
HAN D, YU M, WU M, et al.A sensitive enzyme linked immunosorbent assay for the analysis of Sudan Ⅰ in food samples[J].Chinese Journal of Analysis Chemistry, 2007, 35(8):1 168-1 170.
[8] 刘敏, 李小林, 别玮, 等.固相萃取-高效液相色谱法同时测定调味品中15种工业合成染料[J].色谱, 2011, 29(2):162-167.
LIU M, LI X L, BIE W, et al.Simultaneous determination of 15 industrial synthetic dyes in condiment by solid phase extraction-high performance liquid chromatography[J].Journal of Chromatography, 2011, 29(2):162-167.
[9] 杨琳, 陈青俊, 丁献荣.反相高效液相色谱法测定食品中的多种黄色工业染料[J].食品工业科技, 2011, 32(2):350-352.
YANG L, CHEN Q J, DING X R.RP-HPLC determination of five kinds of yellow industry dyes in foods[J].Science and Technology of Industry, 2011, 32(2):350-352.
[10] 肖海龙, 屠海云, 王红青.反相高效液相色谱法快速测定食品中18种水溶性合成着色剂[J].中国卫生检验杂志, 2011, 21(2):264-266.
XIAO H L, TU H Y, WANG H Q.Rapid method for simultaneous determination of 18 water-soluble synthetic pigments in food by RP-HPLC[J].Chinese Journal of Health Laboratory Techinology, 2011, 21(2):264-266.
[11] 赵珊, 张晶, 杨奕.超高效液相色谱-电喷雾串联四级杆质谱法检测果汁和葡萄酒中的27种工业染料[J].色谱, 2010, 28(4):356-362.
ZHAO S, ZHANG J, YANG Y.Determination of 27 industrial dyes in juice and wine using ultra performance liquid chromatography with electrospray ionization tandem quadrupole mass spectrometry[J].Journal of Chromatography, 2010, 28(4):356-362.
[12] 郭新东, 冼燕萍, 罗海英.凝胶净化/超高效液相色谱串联质谱法测定调味酱中32种工业染料[J].分析测试学报, 2012, 6(6):658-663.
GUO X D, XIAN Y P, LUO H Y.Determination of 32 industrial dyes in seasoning paste by gel permeation chromatography and ultra performance liquid chromatography-tandem mass spectrometry[J].Journal of Instrumental Analysis, 2012, 6(6):658-663.
[13] 路勇, 渠岩, 冯楠.超高效液相色谱-串联四极杆质谱法快速筛查食品中的45种工业染料[J].食品科学, 2012, 33(6):176-180.
LU Y, QU Y, FENG N.Rapid screening of 45 industrial dyes in foods by ultra performance liquid chromatography-tandem quadrupole mass spectrometry[J].Food Science, 2012, 33(6):176-180.
[14] 王兴益, 陈彦龙, 肖小华.水产品中有害物质分析样品前处理技术研究进展[J].色谱, 2021, 39(1):34-45.
WANG X Y, CHEN Y L, XIAO X H.Recent advances in sample preparation technologies for analysis of harmful substances in aquatic products[J].Journal of Chromatography, 2021, 39(1):34-45.
[15] 郑向华, 孙婷, 陈燕.固相萃取-液相色谱串联质谱法同时测定水产品中3种鱼用麻醉剂残留量[J].食品科技, 2020, 45(4):333-337.
ZHENG X H, SUN T, CHEN Y.Determination of three residues of anaesthetic for fish in aquatic products by solid-phase extraction with liquid chromatography tandem mass spectrometry[J].Food Science and Technology, 2020, 45(4):333-337.
[16] 陈思, 薛鸣, 张虹.超高效液相色谱-串联质谱法同时测定鱼、肉类罐头食品中的BADGE、NOGE及其衍生物[J].食品与发酵工业,2011, 37(8):155-160.
CHEN S, XUE M, ZHANG H.Determination of bisphenol a diglycidyl ether (BADGE), novolac glycidyl ethers (NOGE) and its derivatives in canned fish and meat by ultra-performance liquid chromatography with tandem mass spectrometry[J].Food and Fermentation Industries, 2011, 37(8):155-160.
[17] 于紫玲, 左优, 马瑞雪.QuEChERS /超高效液相色谱-串联质谱法同时测定水产品中四溴双酚A与六溴环十二烷[J].分析测试学报, 2019, 38(3):301-306.
YU Z L, ZUO Y, MA R X.Simultaneous determination of tetrabromobisphenol A and hexabromocyclododecane in aquatic products by QuEChERS extraction/ultra-high performance liquid chromatography-tandem mass spectrometry[J].Journal of Instrumental Analysis, 2019, 38(3):301-306.
[18] 马丽莎, 戴晓欣, 谢文平.QuEChERS /GC-MS法同时测定鱼、虾中的雌二醇与己烯雌酚残留[J].分析测试学报, 2015, 34(1):62-66.
MA L S, DAI X X, XIE W P.Simultaneous determination of diethylstilbestrol and estradiol in fish and shrimp by GC-MS with QuEChERS sample preparation[J].Journal of Instrumental Analysis, 2015, 34(1):62-66.
[19] 孔祥一, 庄丽丽, 方恩华.QuEChERS-同位素稀释-气相色谱-串联质谱法测定动物源性食品中9种N-亚硝胺类化合物[J].色谱, 2021, 39(1):96-103.
KONG X Y, ZHUANG L L, FANG E H.Determination of nine N-nitrosamines in animal derived foods by QuEChERS-isotope dilution combined with gas chromatography-tandem mass spectrometry[J].Journal of Chromatography, 2021, 39(1):96-103.
[20] 吴少明, 蔡小明, 周鹏.超高效液相色谱-串联质谱法同时测定水产品中6种丁香酚类物质的残留量[J].食品科学, 2020, 41(16):320-326.
WU S M, CAI X M, ZHOU P.Determination of 6 eugenol residues in aquatic products by ultra-high performance liquid chromatography-tandem mass spectrometry[J].Food Science, 2020, 41(16):320-326.