树脂对小麦秸秆水解液中丁醇发酵抑制物的脱除效果
刘国强1,2,3,易卓林1,3,何开泽1,3,杨林1,3,方扬1,3,赵海1,3*,靳艳玲1,3*
1(中国科学院成都生物研究所,四川 成都,610041)2(中国科学院大学 生命科学学院,北京,100049) 3(中国科学院环境与应用微生物重点实验室,四川 成都,610041)
摘 要 酸水解产生的副产物会严重抑制小麦秸秆水解液丁醇发酵。该文针对树脂对小麦秸秆水解液中丁醇发酵抑制物的脱除效果进行研究。通过强酸性苯乙烯系阳离子交换树脂732及大孔树脂XAD-4对小麦秸秆水解液进行抑制物脱除处理,以未处理组作为对照。离子交换树脂732处理后丁醇得率及含量均高于大孔树脂XAD-4处理。离子交换树脂732处理后在糖质量浓度为33.23 g/L的条件下发酵,丁醇和总溶剂质量浓度可达到7.58、13.09 g/L,得率分别可达到0.23、0.40 g/g,相对于对照组产量分别提高了5.3、5.9倍。在发酵前期,对照组丙酮丁醇梭菌的ATP和烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NADH)积累缓慢,在发酵进行到24 h的时候达到峰值。随着发酵的进行,对照组中丙酮丁醇梭菌的乙醇脱氢酶和丁醇脱氢酶活性最高仅能达到初始状态的29%和44%,而在离子交换树脂732处理组中可以达到初始状态的171%和142%。
关键词 小麦秸秆;丙酮丁醇梭菌;丁醇;树脂;发酵抑制物
DOI:10.13995/j.cnki.11-1802/ts.027540
引用格式:刘国强,易卓林,何开泽,等.树脂对小麦秸秆水解液中丁醇发酵抑制物的脱除效果[J].食品与发酵工业,2022,48(2):26-32.LIU Guoqiang,YI Zhuolin,HE Kaize, et al.Removal effect of resins on butanol fermentation inhibitors in wheat straw hydrolysate[J].Food and Fermentation Industries,2022,48(2):26-32.
第一作者:硕士研究生(赵海研究员和靳艳玲研究员为共同通信作者,E-mail:zhaohai@cib.ac.cn;jinyl@cib.ac.cn)
基金项目:国家重点研发计划项目(2018YFB1501401)
收稿日期:2021-03-29,改回日期:2021-05-15
随着化石燃料的不断消耗,人类逐渐面临能源危机,寻找新的清洁可再生能源越来越受到重视。丁醇作为第二代生物质液体燃料,因具有燃烧热值高,不容易吸水以及可与汽油任意比互溶等优势被认为是最有潜力代替化石燃料的生物质能源之一[1]。
微生物发酵生产丁醇又称丙酮-丁醇-乙醇(acetone-butanol-ethanol,ABE)发酵,指通过产溶剂梭菌利用糖蜜、淀粉和木质纤维素材料在厌氧条件下发酵生产丁醇,并产生副产物丙酮和乙醇的过程[2]。目前用于丁醇发酵的主要微生物包括四类:丙酮丁醇梭菌(Clostridium acetobutylicum)、拜式梭菌(Clostridium beijerinckii)、糖丁酸梭菌(Clostridium beijerinckii)和糖乙酸多丁醇梭菌(Clostridium saccharoperbutylacetonicum)[3]。前两类可以很好地利用木质纤维素水解液进行发酵,因此受到广泛研究。
为了避免出现“与人争粮”等问题,开发木质纤维素材料作为发酵底物生产丁醇成为近几年研究热点。农作物中的小麦秸秆、玉米秸秆和水稻秸秆等主要由木质素、纤维素和半纤维素组成,复杂的木质素和纤维素交联结构阻止了微生物直接利用纤维素。因此在利用秸秆作为发酵原料时需要对其进行预处理。最快捷、经济的预处理方式为中温、短时间稀酸处理,但是稀酸处理会导致木质纤维素原料水解液中含有大量发酵抑制物,如糠醛、酚酸、羟甲基糠醛等已知抑制物及其他未知抑制物[4~6],这些抑制物会严重影响丁醇产量及得率,因此需要对水解液进行发酵抑制物的脱除处理。比较常用的脱除方式包括活性炭吸附、Ca(OH)2过中和、树脂处理等,其中效果最佳的脱除方式为树脂处理,主要利用的树脂包括高聚物吸附树脂(XAD-4,XAD-17)及离子交换树脂(阴离子交换树脂,阳离子交换树脂)[7~9]。大量的研究表明通过树脂处理后会使发酵效果得到提升,但具体的促进机理还知之甚少。
ABE发酵为双相发酵系统,分为产酸期和产溶剂期。在产酸期主要合成丁酸和乙酸,并伴随ATP的合成及细胞增殖,其中乙酸激酶和丁酸激酶起着关键酶作用,负责乙酸和丁酸的合成。产溶剂期是指利用发酵底物或者前期积累的乙酸和丁酸合成乙醇、丁醇同时产生副产物丙酮的过程,其中乙醇脱氢酶和丁醇脱氢酶在该过程起着关键作用[10-11]。本文研究了强酸性苯乙烯系阳离子交换树脂732脱毒处理对丙酮丁醇梭菌发酵小麦秸秆水解液生产丁醇的影响,并监测了发酵过程中菌体OD值,发酵液pH值,底物和产物含量,ATP和烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NADH)含量及关键酶活性的变化情况,以期对利用农业废弃物秸秆高产丁醇提供理论依据。
1 材料与方法
1.1 材料
菌种,Clostridium acetobutylicum CICC 8012,中国工业微生物菌种保藏管理中心。
小麦秸秆:中国科学院成都生物研究所双流中试基地,收获后去除杂质,自然晾晒,于60 ℃烘箱中烘干备用。
纤维素酶:GC220,杰能科生物工程有限公司,标准酶活性为89 FPU/mL。酶活性单位FPU定义为在1 min内产生1 μmol葡萄糖所用的酶量。
木聚糖酶:Shearzyme 500 L,诺维信公司,标准酶活性500 FXU/mL。FXU是诺维信公司木聚糖酶酶活单位,定义为在40 ℃,pH 6.0,30 min的条件下,从被Remazol Brilliant Blue R染色的底物中释放出的染料的量。
强酸性苯乙烯系阳离子交换树脂732、Amberlite XAD-4非离子型大孔树脂、葡萄糖、H2SO4、Ca(OH)2、CH3COONH4、KH2PO4、MgSO4、FeCl3、HCl等,成都市科龙化工试剂厂。
厚壁微生物蛋白提取试剂盒,广州德为生物科技有限公司;ATP含量检测试剂盒,北京盒子生工科技有限公司。
1.2 仪器与设备
LAI-3厌氧培养箱,上海龙跃仪器设备有限公司;752紫外可见光分光光度仪,上海奥普勒仪器有限公司;pHS-3C型数字酸度计,上海盛磁仪器有限公司;全自动蒸汽压力灭菌锅,江苏医疗设备厂;高效液相色谱仪:配置蒸发光检测器(All-Tech ELSD 6000,Deerfield,IL,USA)和Aminex HPX-87-Pb色谱柱(Bio-Rad,Hercules,CA,USA)的Waters 2795高效液相色谱系统(Waters 2795,Milford,MA,USA);FULI气相色谱仪9790,浙江福立分析仪器有限公司。
1.3 实验方法
1.3.1 小麦秸秆水解液制备
将干燥后的小麦秸秆粉碎,过50目分离筛。取100 g秸秆粉,加入1 L体积分数1% H2SO4溶液充分混合,115 ℃高温处理60 min,冷却至室温后利用Ca(OH)2调节pH至4.8,加入6 mL纤维素酶及1.5 mL木聚糖酶,50 ℃,150 r/min恒温酶解60 h,真空抽滤得到澄清溶液,再次利用Ca(OH)2调节pH至7.0,8 000 r/min离心10 min得到小麦秸秆水解液,备用。
1.3.2 树脂活化及小麦秸秆水解液抑制物脱除
参照孙彦平[12]的方法对小麦秸秆水解液抑制物进行树脂脱除处理。
1.3.2.1 树脂活化
取一定量强酸性苯乙烯系阳离子交换树脂732用蒸馏水洗至水清澈,加入4倍体积1 mol/L HCl浸泡12 h,再用蒸馏水洗至中性,加入4倍体积1 mol/L NaOH浸泡12 h,最后利用蒸馏水洗至中性,加入4倍体积1 mol/L HCl浸泡12 h,加水洗至中性,得到活化后的732树脂。同样取一定量大孔树脂XAD-4用4倍体积95%乙醇浸泡24 h,用蒸馏水冲洗至无乙醇气味,得到活化后XAD-4树脂。
1.3.2.2 小麦秸秆水解液抑制物脱除
树脂处理:取活化后的树脂小心装入直径为25 mm的玻璃柱中,避免出现气泡,装至离玻璃柱上端口3~4 cm处,将适量小麦秸秆水解液以6 mL/min过柱,所得液体即为树脂处理液。
Ca(OH)2过中和处理:小麦秸秆水解液适量,用Ca(OH)2调pH=11,摇匀后于50 ℃水浴锅中恒温30 min[13],之后用体积分数60%的H3PO4溶液调pH=7.0,4 000 r/min离心10 min,所得上清液即为Ca(OH)2过中和处理液。
1.3.3 培养基的制备
种子培养基:50 g玉米粉加入1 L自来水,充分混匀,煮至微沸后继续加热1 h,补足糊化过程中丢失的水分,冷却后分装于厌氧试管或者厌氧瓶中,通N2除氧,121 ℃灭菌60 min,自然pH,得到种子培养基。
未处理培养基:1 L小麦秸秆水解液中加入1 g CH3COONH4、0.6 g KH2PO4、0.2 g MgSO4,调节pH至7.0。取150 mL分装于已装有0.45 g豆粕粉的厌氧瓶中,充N2除氧,115 ℃灭菌15 min,冷却待用。将小麦秸秆水解液换成经树脂或Ca(OH)2所得的处理液,其余成分不变配制成处理培养基。
纯糖培养基:1 L蒸馏水中加入1 g CH3COONH4、0.6 g KH2PO4、0.2 g MgSO4、20 g葡萄糖、15 g木糖,调节pH至7.0。取150 mL分装于已装有0.45 g豆粕粉的厌氧瓶中,充N2除氧,115 ℃灭菌15 min,冷却待用。
维生素混合液:生物素0.01 g,维生素B1 0.8 g,烟酸0.8 g,维生素B6 0.8 g,肌醇2 g,蒸馏水定容至1 L,0.22 μm滤膜过滤除菌,4 ℃保存。
1.3.4 菌种活化及种子液的制备
取4 ℃保存的丙酮丁醇梭菌菌种按照10%接种量接入种子厌氧管培养基中,沸水热激75 s,迅速流水冷却至室温,37 ℃静置培养24 h,再以10%接种量接种至种子厌氧瓶中,同样操作培养24 h,得到新鲜种子液。
1.3.5 丙酮丁醇发酵
按照10%接种量将新鲜种子液接入发酵培养基中,按照体积分数1%的量加入维生素混合液,37 ℃静置发酵72 h。
1.4 测定方法
利用酸度计测定发酵液pH;紫外可见分光光度计测定发酵液菌体浓度、酶活性、ATP及NADH含量;高效液相色谱仪测定糖含量:色谱柱采用Aminex HPX-87P糖分析柱,柱温79 ℃,检测器105 ℃,柱流速0.6 mL/min,进样量10 μL;有机酸及总溶剂利用FULI气相色谱仪9790:以异丁醇为内标,氢离子火焰检测器(flame ionization ditector,FID),色谱柱为GDX-103填充柱,柱温箱180 ℃,检测器200 ℃,进样器210 ℃,载气N2,流速30 mL/min,进样量1 μL。
1.4.1 粗蛋白的提取
取发酵液50 mL,800 r/min,4 ℃离心30 min,去除大颗粒杂质,再10 000 r/min,4 ℃离心2 min,收集沉淀,用0.1 mol/L Tris-HCl(pH 7.0)洗涤2~3次,收集菌体,向菌体中加入200 μL厚壁微生物总蛋白提取试剂盒中的活性裂解液及适量研磨粉,研磨棒研磨5 min,12 000 r/min,4 ℃离心10 min,上清液即为粗蛋白提取液。粗蛋白浓度利用考马斯亮蓝法进行测定[14]。
1.4.2 丙酮丁醇梭菌酶活性测定
乙醇脱氢酶与丁醇脱氢酶活性换算如公式(1)、公式(2)所示:通过NADH及还原型烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)在340 nm下吸光值降低量来测定其活性[15-16]。
乙醛+NADH→乙醇+NAD++H+
(1)
丁醛+NADPH→丁醇+NADP++H+
(2)
乙酸激酶与丁酸激酶酶活性测定可利用乙酰磷酸或者丁酰磷酸与ATP在过量羟胺环境中生成羟戊酸,再利用Fe3+在酸性环境中进行着色,5~30 min于540 nm下测定二磷酸腺苷(adenosine diphosphate,ADP)吸光值的变化,从而推算出酶活性[17-18]。
1.4.3 发酵过程中ATP及NADH测定
ATP含量利用试剂盒测定。NADH含量参照酿酒酵母辅酶NAD+及NADH含量测定方法进行测定[19]。
2 结果与分析
2.1 不同脱毒方式对发酵的影响
树脂或Ca(OH)2处理的目的是除去某些抑制发酵的物质让发酵效果得到恢复。不同处理方式所得小麦秸秆水解液静置发酵72 h,期间持续放气直至产气结束,发酵结果如表1所示。
表1 不同脱毒方式对发酵的影响
Table 1 Effects of different detoxification methods on fermentation
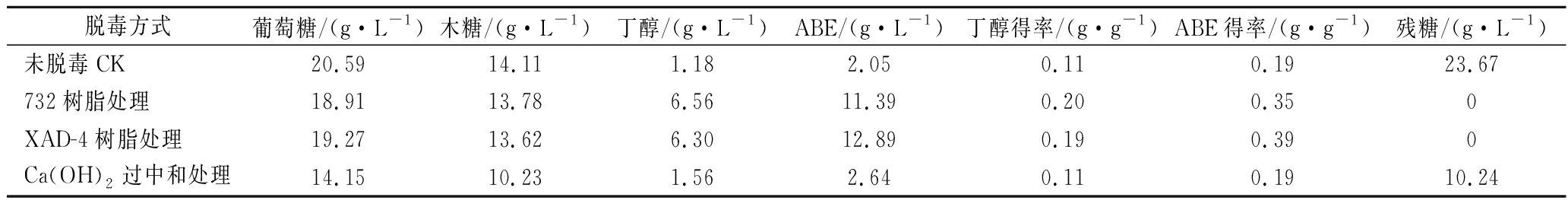
脱毒方式葡萄糖/(g·L-1)木糖/(g·L-1)丁醇/(g·L-1)ABE/(g·L-1)丁醇得率/(g·g-1)ABE得率/(g·g-1)残糖/(g·L-1)未脱毒CK20.5914.111.182.050.110.1923.67732树脂处理18.9113.786.5611.390.200.350XAD-4树脂处理19.2713.626.3012.890.190.390Ca(OH)2过中和处理14.1510.231.562.640.110.1910.24
可以发现Ca(OH)2过中和处理会造成大量底物糖类的损失,与对照组相比,糖含量降低近30%。由于此处理过程是在pH为11的强碱性条件下进行,该条件下糖类不稳定[20]。虽然Ca(OH)2过中和处理组的丁醇和总溶剂得率与对照组一致,但对丁醇及总溶剂浓度提升效果不显著。其原因一方面可能是Ca(OH)2过中和处理对抑制物的脱除率较低,孙彦平[12]研究发现Ca(OH)2过中和处理方式在玉米芯纤维素水解液中对抑制物的脱除率只能达到27.9%,因此对发酵效果没有显著的提升作用。另一方面是Ca(OH)2过中和处理的小麦秸秆稀硫酸水解液中生成了大量CaSO4,会进一步去除后续培养基中的KH2PO4,邱学剑等[21]研究发现在pH为10.0的条件下,CaSO4对于磷酸盐的去除率最高可达99.16%,近似于完全去除,导致菌体发酵过程缺少磷酸根而不能正常生长发酵。
相比较之下,利用树脂进行发酵抑制物的脱除,可以很好地恢复发酵效果,同时仅造成约5%还原糖的损失。经过XAD-4树脂处理,总溶剂得率可以达到0.39 g/g,但是丁醇得率略低于阳离子交换树脂732处理。离子交换树脂的吸附能力主要归因于氢键的存在,而非极性大孔树脂的吸附效果主要是通过疏水性、高比表面积及大网状结构来实现,不存在功能基团,也无法进行离子交换[22-23]。因此大孔树脂XAD-4对小麦秸秆水解液中抑制物的脱除效果低于阳离子交换树脂732处理效果。综合比较两种树脂处理后的发酵效果发现,利用强酸性苯乙烯系阳离子交换树脂732进行发酵抑制的脱除更具有优势,后续实验将利用该树脂进行小麦秸秆水解液中发酵抑制物的脱除。
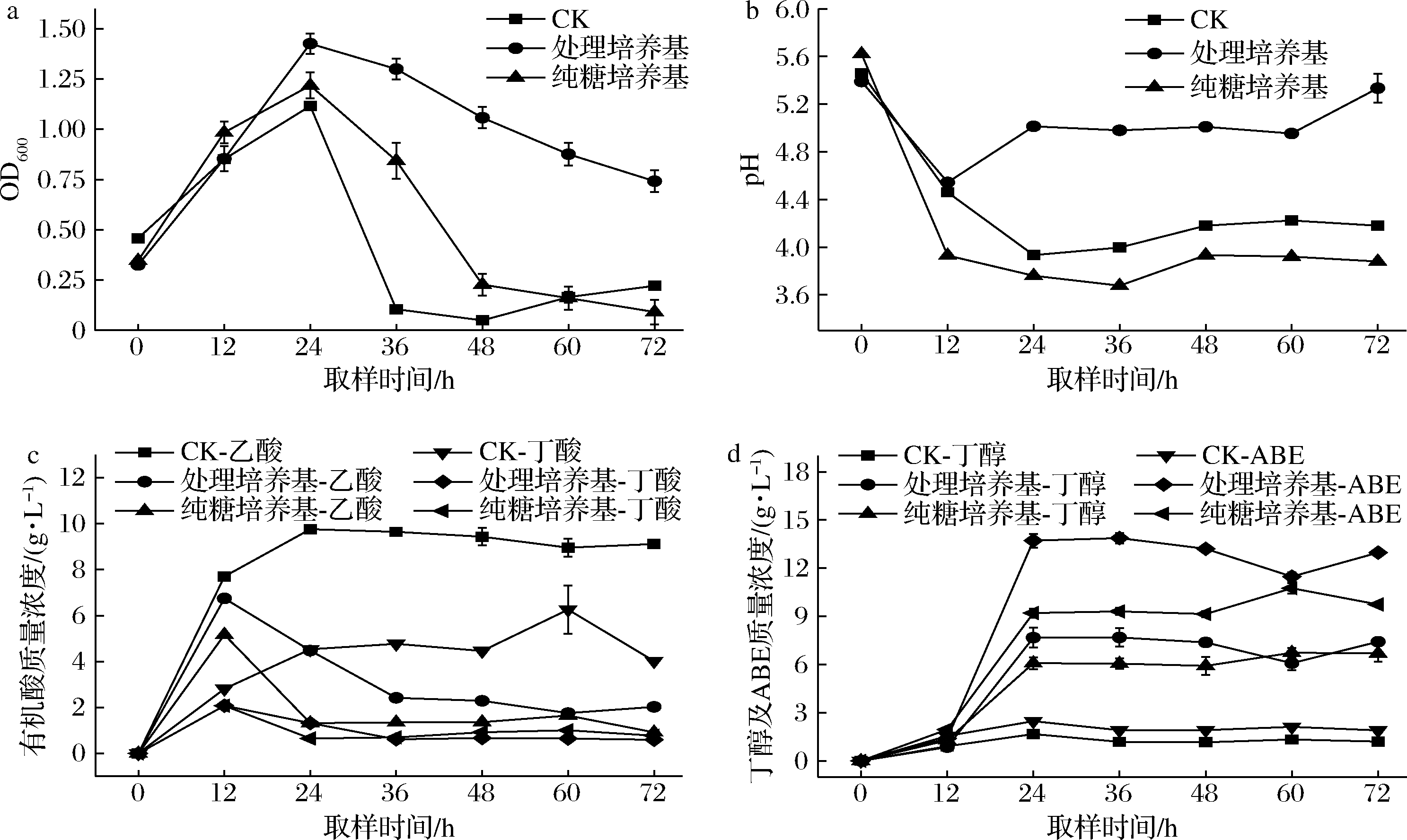
2.2 树脂处理前后对发酵的影响
采用未处理培养基(CK),处理培养基以及纯糖培养基在相同条件下进行发酵,间歇放气,每隔12 h取样,测定OD值、pH等指标,直至发酵结束。结果如图1所示,由图1-a~图1-c可以发现在发酵前12 h,主要是利用底物合成有机酸并进行菌体的生长繁殖产生少量的溶剂。快速积累的有机酸导致发酵液pH骤降,纯糖培养基pH下降最严重,可能是由于纯糖培养基成分比较简单导致自身缺乏对pH变化的缓冲作用能力。发酵12~36 h阶段,是快速合成溶剂阶段,此阶段菌体量基本处于稳定状态,但是未处理培养基菌体在12~24 h已经在快速死亡,对比其他两种培养基可知道发生此现象并非丁酸和乙酸积累导致的毒害作用,而是随着发酵的进行,培养基中存在的抑制物对菌体产生强烈的毒害作用。
有研究证明,丙酮丁醇梭菌丁醇发酵酸的重吸收作用是否开启由pH决定,当pH下降到4.3左右将开启酸的重吸收作用合成溶剂[24]。由此可以从图1-b发现,纯糖培养基相对于处理培养基会更早开启酸的重吸收过程,因此,在纯培养基中丁酸和乙酸最高浓度低于处理培养基中的乙酸和丁酸,如图1-c所示。同时在发酵初期,未处理培养基发酵现象最为剧烈,同时产生大量H2和CO2。也许是因为处理培养基和纯糖培养基中在酸的重吸收过程需要消耗一定的H2和CO2,导致产气现象并没有未处理培养基剧烈。
由图1-b、图1-c可以看出在发酵12~24 h阶段处理培养基中由于酸的不断消耗使得pH明显上升,同样的纯糖培养基在此阶段的有机酸含量也在快速下降,但pH一直处于较低状态并没有出现回升现象,说明纯糖培养基可能还生成了一定量其他种类的有机酸如甲酸,乳酸等,这些有机酸无法被进一步利用从而消耗了一定的碳源,导致在消耗同样底物的情况下总溶剂产量低于处理培养基。在未处理培养基中的抑制物可能是通过抑制菌体开启酸重吸收过程而导致菌体无法进行正常发酵,最终总溶剂质量浓度仅有1.9 g/L。图1-d为各培养基溶剂含量变化情况,树脂处理之后最终在糖质量浓度为33.23 g/L的条件下,丁醇和总溶剂质量浓度分别可达到7.58、13.09 g/L,较未处理培养基产量分别提高5.3、5.9倍。CEBREIROS等[8]、GAO等[25]通过弱碱性阴离子交换树脂处理桉树木材水解液进行发酵可分别得到质量浓度为6.9、12.2 g/L的丁醇和总溶剂;同样的利用树脂L-493对芦苇稀酸预处理液中抑制物脱除后进行发酵,分别得到质量浓度为5.49、14.44 g/L的丁醇和总溶剂。由此说明树脂的确可以解除木质纤维素材料酸处理水解液中某些物质对发酵的抑制作用。
2.3 树脂处理前后对丁醇发酵关键酶活性的影响
丙酮丁醇梭菌发酵丁醇前期乙酸激酶和丁酸激酶分别参与乙酸和丁酸以及ATP的合成,后期主要是乙醇脱氢酶和丁醇脱氢酶参与溶剂的合成并参与酸的重吸收过程,这4种关键酶活性高低会直接影响最终溶剂的产量,因此分析了发酵过程中酶活性的变化情况。每隔12 h取样测定4种关键酶活性,0 h代表玉米醪种子液中菌体酶活性,结果如图2所示。可以发现,前12 h乙醇脱氢酶和丁醇脱氢酶活性相对于种子液中均显著降低,乙酸激酶和丁酸激酶活性明显升高。结合发酵现象来分析,在前12 h内,未处理水解液中存在的抑制物并未对菌体利用底物产酸过程产生抑制作用。在12 h至发酵结束,未处理培养基中乙醇脱氢酶与丁醇脱氢酶活性一直处于极低的状态,特别是到发酵48~72 h已检测不到酶活性,可能由于此时菌体已完全裂解,表达的蛋白在不适的环境下失活。从图2-a、图2-b可以发现纯糖培养基中的乙酸激酶和丁酸激酶一直处于高活性状态并且活性高于处理培养基,这与图1-a的细胞密度结果相反,出现这个现象的原因目前还不清楚,推测可能是由pH的差异所造成。顾春凯等[26]发现酸水解液可以抑制溶剂相关基因的表达,并且玉米秸秆水解液占发酵培养基比例越高,抑制发酵的效果越强,通过促进乙酸合成关键基因的表达,从而积累大量乙酸抑制发酵。但据本研究小组的实验结果发现,乙酸和丁酸的积累并不会抑制发酵,相反可能是小麦秸秆水解液中其他物质抑制了利用乙酸的途径而导致发酵结果丁醇及总溶剂产量较低。
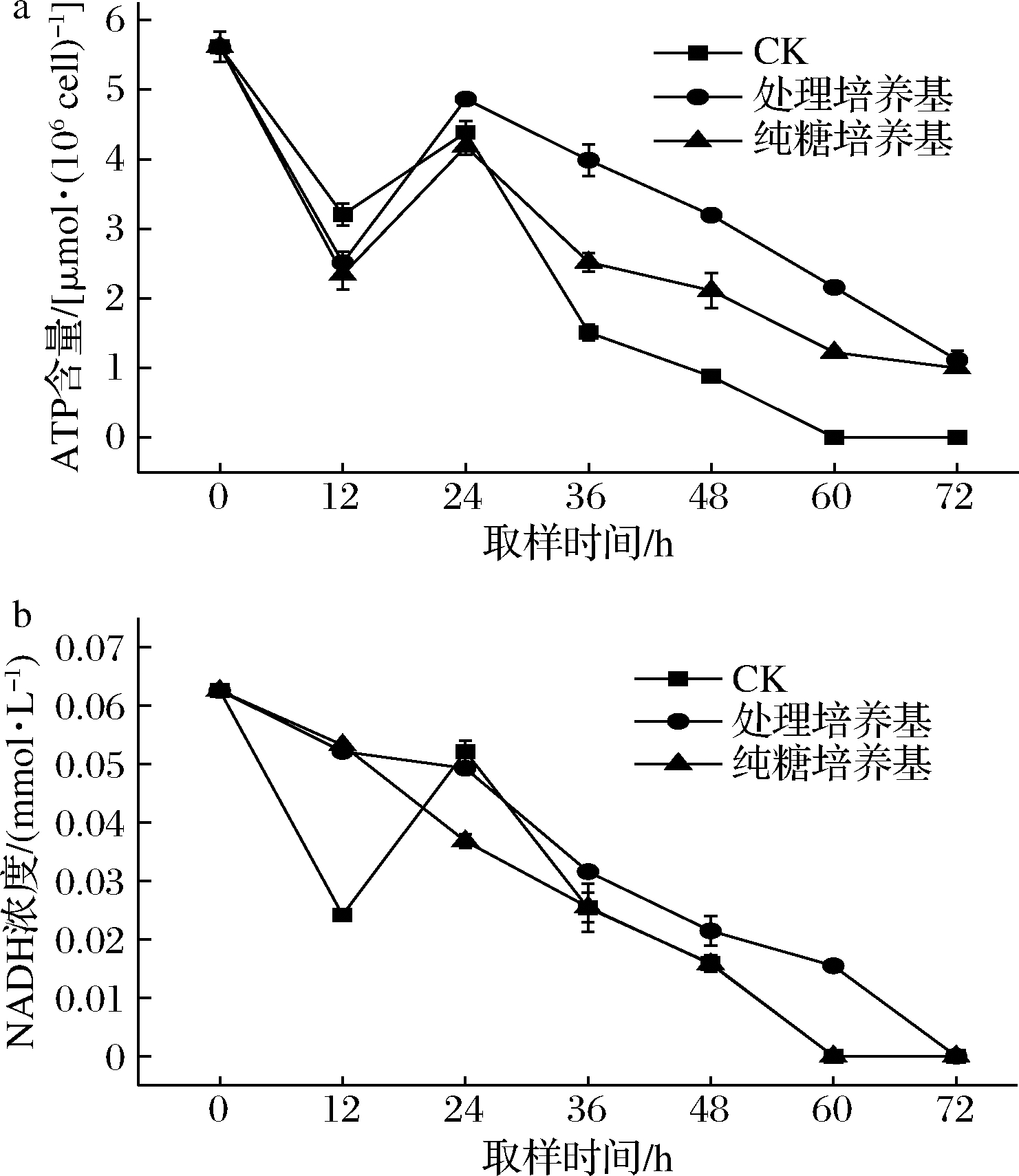
2.4 树脂处理前后对NADH及ATP的影响
丙酮丁醇梭菌在丁醇发酵后期需要大量消耗还原力NADH,如果还原力供应不足,可能会导致酸的过量积累,出现“酸崩溃”现象[27]。ATP是生物体内能量转换的重要载体,参与各种酶促反应。NADH和ATP的含量反映细胞的活性状态,细胞处于凋亡或者受到毒性伤害时胞内ATP和NADH含量均会降低[14]。不同培养基发酵过程中NADH和ATP动态变化如图3所示。可以发现,发酵24 h之前会大量合成NADH和ATP,但最终积累量始终低于种子液中的含量,可能是玉米醪中存在一些其他因子促进两者的合成。进入发酵24 h左右,由于未处理培养基中溶剂合成受到抑制,因此导致NADH积累到一个峰值,随后其含量降低可能是因为还原力被用于克服抑制物的毒害作用而被大量消耗,同时ATP也被快速消耗。而在纯糖培养基及处理培养基中,由于在24 h的时候就已经大量合成溶剂,因此表现出来的是NADH含量一直减少,同时由于糖的持续消耗,导致NADH和ATP减少速率相对于未处理培养基更缓慢。
3 结论
本文研究了利用强酸性苯乙烯系阳离子交换树脂732及大孔树脂XAD-4处理对小麦秸秆水解液丁醇发酵的影响,经树脂732处理后相对于大孔树脂XAD-4能得到更高比例的丁醇,因此树脂732更具有应用优势。通过树脂732对发酵抑制物进行脱除后,丁醇和总溶剂产量相较于未处理分别提高了大约5.3、5.9倍,分别达到7.58、13.09 g/L。在发酵到24 h的时候未处理培养基中乙醇脱氢酶和丁醇脱氢酶最高仅能分别达到种子培养基的29%和44%,而处理培养基中活性相对于种子培养基最高分别提高了71%和42%。小麦秸秆稀硫酸水解液产生的抑制物通过抑制溶剂合成关键酶活性以及酸的重吸收和糖酵解过程来抑制丁醇发酵,而通过树脂处理可以一定程度上解除这些抑制作用。发酵12~24 h阶段3种培养基中ATP和NADH均在大量积累,但是由于在此过程处理培养基与纯糖培养基已经开启酸的重吸收作用,导致表现出NADH含量的降低。后续可以进一步研究树脂处理对丙酮丁醇梭菌转录水平的影响。
参考文献
[1] 高越, 郭晓鹏, 杨阳, 等.生物丁醇发酵研究进展[J].生物技术通报, 2018, 34(8):27-34.
GAO Y, GUO X P, YANG Y, et al.Research progress of biobutanol fermentation[J].Biotechnology Bulletin, 2018, 34(8):27-34.
[2] VEZA I, MUHAMAD SAID M F, LATIFF Z A.Recent advances in butanol production by acetone-butanol-ethanol (ABE) fermentation[J].Biomass and Bioenergy, 2021, 144:105919.
[3] KEIS S, SHAHEEN R, JONES D T.Emended descriptions of Clostridium acetobutylicum and Clostridium beijerinckii, and descriptions of Clostridium saccharoperbutylacetonicum sp.nov.and Clostridium saccharobutylicum sp.nov[J].International Journal of Systematic Evolutionary Microbiology, 2001, 51(6):2 095-2 103.
[4] KLINKE H B, THOMSEN A B, AHRING B K.Inhibition of ethanol-producing yeast and bacteria by degradation products produced during pre-treatment of biomass[J].Applied Microbiology and Biotechnology, 2004, 66(1):10-26.
[5] SUN Y, CHENG J Y.Hydrolysis of lignocellulosic materials for ethanol production:A review[J].Bioresource Technology, 2002, 83(1):1-11.
[6] OLSSON L, HAHN-H GERDAL B.Fermentation of lignocellulosic hydrolysates for ethanol production[J].Enzyme and Microbial Technology, 1996, 18(5):312-331.
GERDAL B.Fermentation of lignocellulosic hydrolysates for ethanol production[J].Enzyme and Microbial Technology, 1996, 18(5):312-331.
[7] DONG J J, HAN R Z, XU G C, et al.Detoxification of furfural residues hydrolysate for butanol fermentation by Clostridium saccharobutylicum DSM 13864[J].Bioresource Technology, 2018, 259:40-45.
[8] CEBREIROS F, RISSO F, CAGNO M, et al.Enhanced production of butanol and xylosaccharides from Eucalyptus grandis wood using steam explosion in a semi-continuous pre-pilot reactor[J].Fuel, 2021,290:119818.
[9] HARDE S M, JADHAV S B, BANKAR S B, et al.Acetone-butanol-ethanol (ABE) fermentation using the root hydrolysate after extraction of forskolin from Coleus forskohlii[J].Renewable Energy, 2016, 86:594-601.
[10] GREEN E M, BOYNTON Z L,HARRIS L M, et al.Genetic manipulation of acid formation pathways by gene inactivation in Clostridium acetobutylicum ATCC 824[J].Microbiology, 1996, 142(8):2 079-2 086.
[11] WIESENBORN D P, RUDOLPH F B, PAPOUTSAKIS E T.Coenzyme A transferase from Clostridium acetobutylicum ATCC 824 and its role in the uptake of acids[J].Applied and Environmental Microbiology, 1989, 55(2):323-329.
[12] 孙彦平. 玉米芯纤维素发酵生产燃料丁醇的研究[D].成都:中国科学院成都生物研究所, 2010.
SUN Y P.Studies on the butanol fermentation from corn cob cellulose[D].Chengdu:Chengdu Institute of Biology, Chinese Academy of Science, 2010.
[13] ZHU Y, YANG S T.Adaptation of Clostridium tyrobutyricum for enhanced tolerance to butyric acid in a fibrous-bed bioreactor[J].Biotechnology Progress, 2003, 19(2):365-372.
[14] 苏增平. Ca2+对玉米秸秆水解液丙酮丁醇发酵的影响[D].郑州:河南农业大学, 2018.
SU Z P.Effect of Ca2+ on acetone-butanol fermentation from corn stalk hydrolysate[D].Zhengzhou:Henan Agricultural University, 2018.
[15] DURRE P, KUHN A, GOTTSCHALK G.Treatment with allyl alcohol selects specifically for mutants of Clostridium acetobutylicum defective in butanol synthesis[J].Fems Microbiology Letters, 1986, 36(1):77-81.
[16] HIU S F, ZHU C X, YAN R T, et al.Butanol-ethanol dehydrogenase and butanol-ethanol-isopropanol dehydrogenase:Different alcohol dehydrogenases in two strains of Clostridium beijerinckii (Clostridium butylicum) [J].Applied and Environmental Microbiology, 1987, 53(4):697-703.
[17] ROSE I A. Acetate Kinase of Bacteria (Acetokinase)[M].Methods in Enzymology, Amsterdam: Elsevier, 1955:591-595.
[18] ACETI D J, FERRY J G.Purification and characterization of acetate kinase from acetate-grown Methanosarcina thermophila.Evidence for regulation of synthesis[J].Journal of Biological Chemistry, 1988, 263(30):15 444-15 448.
[19] 李骆冰, 王永红, 庄英萍, 等.乙醇发酵中酿酒酵母辅酶NAD+及NADH测定方法[J].食品与生物技术学报, 2011, 30(2):287-294.
LI L B, WANG Y H, ZHUANG Y P, et al.Determination of coenzyme NAD+ and NADH of Saccharomyces cerevisiae cells in ethanol production[J].Journal of Food Science and Biotechnology, 2011, 30(2):287-294.
[20] 王镜岩. 生物化学[M].第三版.北京:高等教育出版社, 2007.
WANG J Y.Biochemistry[M].3th ed.Beijing:Higher Education Press, 2007.
[21] 邱学剑, 刘江, 杨成志, 等.硫酸钙晶须对磷的静态吸附[J].化工环保, 2014, 34(5):405-409.
QIU X J, LIU J, YANG C Z, et al.Static adsorption of phosphorus on calcium sulfate whisker[J].Environmental Protection of Chemical Industry, 2014, 34(5):405-409.
[22] YU Y, CHRISTOPHER L P.Detoxification of hemicellulose-rich poplar hydrolysate by polymeric resins for improved ethanol fermentability[J].Fuel, 2017, 203:187-196.
[23] IJZER A C, VRIEZEKOLK E, ROLEVINK E, et al.Performance analysis of aromatic adsorptive resins for the effective removal of furan derivatives from glucose[J].Journal of Chemical Technology and Biotechnology, 2015, 90(1):101-109.
[24] 何景昌, 张正波, 裘娟萍.生物丁醇合成途径中关键酶及其基因的研究进展[J].食品与发酵工业, 2009, 35(2):116-120.
HE J C, ZHANG Z B, QIU J P.Progress in crucial enzymes and gene involved in biobutanol synthesis[J].Food and Fermentation Industries, 2009, 35(2):116-120.
[25] GAO K, REHMANN L.Combined detoxification and insitu product removal by a single resin during lignocellulosic butanol production[J].Scientific Reports, 2016, 6:30533.
[26] 顾春凯, 王根宇, 刘宏娟, 等.玉米芯半纤维素水解液中抑制物对丁醇发酵的影响[J].生物技术通报, 2016, 32(7):178-185.
GU C K, WANG G Y, LIU H J, et al.Effects of inhibitors in corncob hemicellulose hydrolysate on butanol fermentation[J].Biotechnology Bulletin, 2016, 32(7):178-185.
[27] WANG S H, ZHANG Y P, DONG H J, et al.Formic acid triggers the “Acid Crash” of acetone-butanol-ethanol fermentation by Clostridium acetobutylicum[J].Applied and Environmental Microbiology, 2011, 77(5):1 674-1 680.
Removal effect of resins on butanol fermentation inhibitors in wheat straw hydrolysate
LIU Guoqiang1,2,3,YI Zhuolin1,3,HE Kaize1,3,YANG Lin1,3,FANG Yang1,3,ZHAO Hai1,3*,JIN Yanling1,3*
1(Chengdu Institute of Biology, Chinese Academy of Science, Chengdu 610041, China)2(College of Life Sciences, University of Chinese Academy of Science, Beijing 100049, China)3(Key Laboratory of Environmental and Applied Microbiology, Chinese Academy of Science, Chengdu 610041, China)
ABSTRACT By-products from acid hydrolysis of wheat straw can seriously inhibit butanol fermentation. The removal effect of resins on butanol fermentation inhibitors was studied here. Strong acid styrene cation exchange resin 732 and microporous resin XAD-4 were used for the removal of inhibitors in wheat straw hydrolysate, while the untreated group was set as control. Higher yield and concentration of butanol were obtained from the fermentation with resin 732 treatment than those from macroporous resin XAD-4 treatment. Additionally, after resin 732 treatment, fermentation was conducted at a sugar content of 33.23 g/L, and the concentration of butanol and total solvent reached 7.58 and 13.09 g/L, with the yield of 0.23 and 0.40 g/g, which were 5.3 and 5.9 times higher than those from the control group, respectively. In the control group, the accumulation rates of ATP and NADH were slow at the early fermentation stage and reached top values at 24 h. More importantly, during the fermentation, the highest activities of ethanol dehydrogenase and butanol dehydrogenase only reached 29% and 44% of the initial value, while in resin 732 treated group, these could reach as high as 171% and 142%, respectively.
Key words wheat straw; Clostridium acetobutylicum;butanol;resin;fermentation inhibitor


 GERDAL B.Fermentation of lignocellulosic hydrolysates for ethanol production[J].Enzyme and Microbial Technology, 1996, 18(5):312-331.
GERDAL B.Fermentation of lignocellulosic hydrolysates for ethanol production[J].Enzyme and Microbial Technology, 1996, 18(5):312-331.