传统肉制品烹调方式有很多种,如蒸、煮、煎、炒、焖、煨等,而烤制是最原始的烹饪方法,至今已存在三千余年。传统烧烤肉制品因其独有的色、香、味、形受到消费者喜爱。我国传统的烤肉制品有北京烤鸭、广东叉烧肉、广东脆皮乳猪、新疆烤羊肉串等;在国外有土耳其烤肉、塞浦路斯烤肠、科威特烤肉串等。因此,烧烤肉制品在肉类体系中占有相当重要的地位,也是世界珍贵历史文化的重要组成部分。
随着经济高速发展和消费观念改变,在追寻食品口感与香味的同时,其安全性也极为重要,尤其是近年来社会各界对食品安全问题的高度重视,给食品加工业发展带来很大挑战。烧烤肉制品因脂肪、蛋白质、糖类降解及其产物之间的复杂化学反应,形成了特有的风味,同时也会产生一些强致癌物质——多环芳烃和杂环胺。烧烤肉制品加工过程中多环芳烃和杂环胺的形成因素诸多,比如原料肉中的蛋白质、脂肪等含量,烤制工艺的选择以及烤制燃料类型等。本文综述了烧烤肉制品在加工过程中主要产生的害物质多环芳烃和杂环胺形成的途径、影响因素及抑制方法的研究进展,由于多环芳烃和杂环的形成途径较多,本文重点阐述烧烤肉制品中多环芳烃通过HAVA和Diels-alder机理形成的情况;而杂环胺则是通过自由基途径及美拉德反应形成,并为此提出相对防控方法:合理控制烤制温度和烤制时间、合理选择烤制技术、减少食用油及酱油用量、适度添加天然香辛料、抗氧化剂等外源抑制剂,显著抑制烧烤肉制品中多环芳烃、杂环胺等有害物质的生成,并应用于肉制品加工领域,促进肉制品行业绿色安全发展。
多环芳烃分子结构由2个或2个以上苯环组成,根据苯环的数量,可以将多环芳烃分为两类,轻质多环芳烃(2~4个苯环)和重质多环芳烃(4个以上苯环)[1-2]。在肉制品加工过程中,轻质的多环芳烃极不稳定,容易向重质的多环芳烃转化[3]。鉴于多环芳烃具有致癌和致突变性,欧盟将16种多环芳烃视作为需要优先控制的污染物[4],16种多环芳烃名称见表1。欧盟相关机构在2014年9月1日新发布的《关于食品中多环芳烃最大限量的修正案》要求烟熏肉及其制品中的苯并芘限量为2 μg/kg,PAH4[![]() 、苯并(a)蒽、苯并(b)荧蒽、苯并(a)芘]的总量限制也由原来的30 μg/kg降低到了12 μg/kg[5]。而我国GB2762—2017《食品中污染物限量》中限定了熟肉制品中苯并(a)芘不高于5 μg/kg。
、苯并(a)蒽、苯并(b)荧蒽、苯并(a)芘]的总量限制也由原来的30 μg/kg降低到了12 μg/kg[5]。而我国GB2762—2017《食品中污染物限量》中限定了熟肉制品中苯并(a)芘不高于5 μg/kg。
表1 EU公布的16种优先控制的多环芳烃
Table 1 16 priority-controlled polycyclic aromatic
hydrocarbons listed by the EU
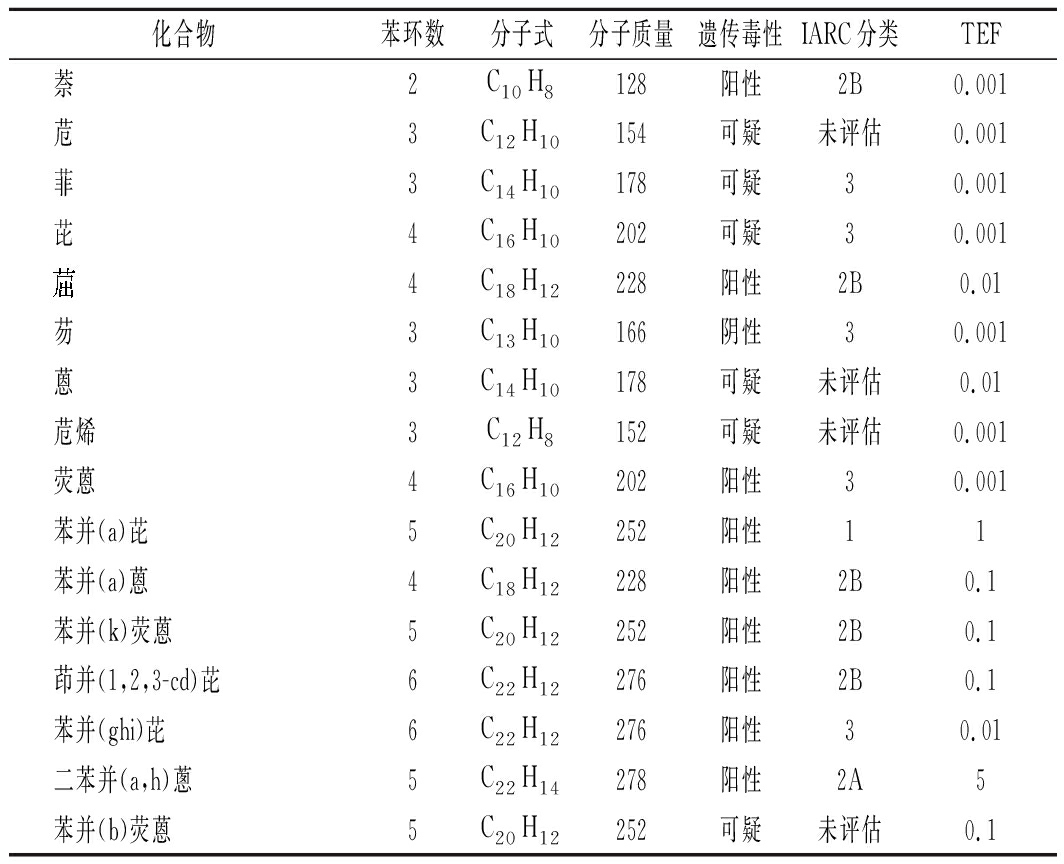
化合物苯环数分子式分子质量遗传毒性IARC分类TEF萘2C10H8128阳性2B0.001苊3C12H10154可疑未评估0.001菲3C14H10178可疑30.001芘4C16H10202可疑30.0014C18H12228阳性2B0.01芴3C13H10166阴性30.001蒽3C14H10178可疑未评估0.01苊烯3C12H8152可疑未评估0.001荧蒽4C16H10202阳性30.001苯并(a)芘5C20H12252阳性11苯并(a)蒽4C18H12228阳性2B0.1苯并(k)荧蒽5C20H12252阳性2B0.1茚并(1,2,3-cd)芘6C22H12276阳性2B0.1苯并(ghi)芘6C22H12276阳性30.01二苯并(a,h)蔥5C22H14278阳性2A5苯并(b)荧蒽5C20H12252可疑未评估0.1
注:TEF (toxicity equivalency factor):毒性当量因子,表中假设苯并(a)芘的毒性为1,其他皆以此为参照;1-致癌;2A-很可能致癌;2B-潜在致癌物;3-无法分类
食品中多环芳烃的形成是一个十分复杂过程,通过对国内外食品中多环芳烃的生成机理进行总结,分述如下:
(1)食品中的脂肪、蛋白质、碳水化合物在高温下裂解,通过环化、聚合形成多环芳烃。CHEN等[6]研究发现,食品中的脂肪酸氧化形成氢过氧化物,最后通过HACA机理实现分子生长形成多环芳烃。KIM等[7]研究发现,选取不同脂肪含量的原料肉经烤制后多环芳烃生成量也有所不同。BRITT等[8]研究表明,高温条件下脯氨酸与葡萄糖会生成Amadori产物,再通过一系列化学反应形成多环芳烃。SHARMA等[9]研究表明,天冬氨酸、脯氨酸、色氨酸在高温下能够热解形成多环芳烃,说明某些氨基酸是生成多环芳烃的重要前体物质。MCGRATH等[10]研究纤维素在高温下脱水碳化、脱羧、脱氢等发生一系列化学转化及重排形成多环芳烃。由此可见,食品中的蛋白质、碳水化合物、脂肪也是形成多环芳烃的主要来源。
(2)苯环形成途径主要由2种[11]:第一种是1,3-C4H6+C2H2→C6H6;第二种是—C≡≡C—CH3和—C≡≡C—CH3→C6H6,食品中含有这些化合物在高温条件下分解成相对应的取代基,这些取代基会与苯环上的氢发生取代反应生成相对应的化合物,在高温加热条件下按HAVA分子生长机理[12]形成多环芳烃。由于食品中含有许多结构相同化合物,故此推理出多环芳烃通过HAVA机理途径形成,如图1所示。
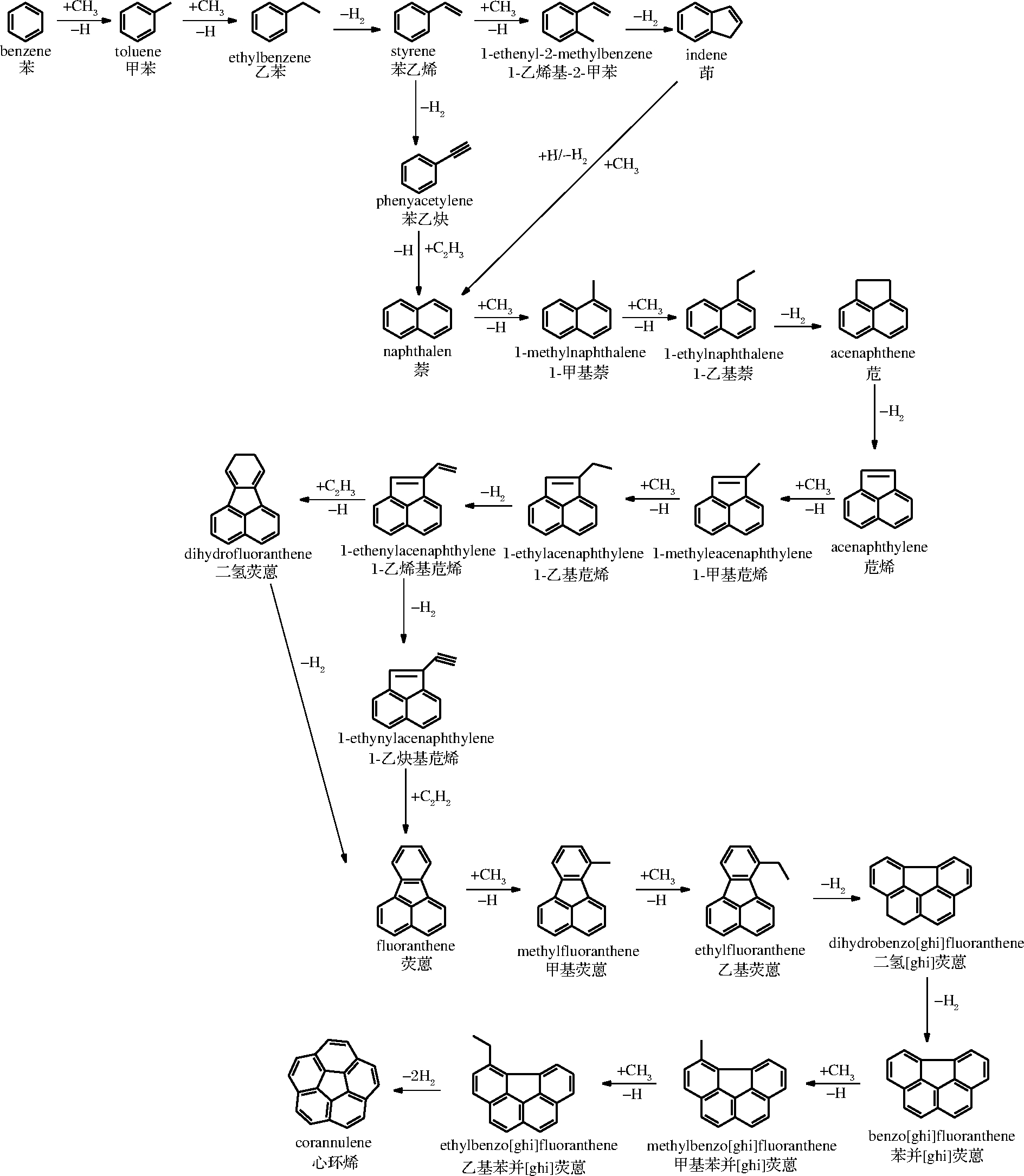
图1 多环芳烃的HAVA形成途径
Fig.1 HAVA formation pathway of polycyclic
aromatic hydrocarbons
(3)Diels-alder机理是多环芳烃形成的主要途径[13]。食品在加工过程中轻质多环芳烃生成量要高于重质多环芳烃,但轻质的多环芳烃极不稳定,容易向重质的多环芳烃转化,如图2所示。食品中含有的不饱和烯烃类化合物以及单环化合物,在高温加工过程中发生第一步加成反应生成环己烯。形成中间产物1,4,5,6,7,8,9,10-8氢萘与这些不饱和烯烃类化合物发生加成反应,进一步氧化形成两环结构的萘和三环结构的蒽,萘再进一步与发生脱氢、取代反应最终形成三环结构的苊烯、苊和四环结构的荧蒽;此外,1,4,5,6,7,8,9,10-8氢萘通过异构化形成 3,4,5,6,7,8,9,10-8氢萘与这些不饱和烯烃通过氧化形成三环结构的菲,菲再进一步通过氧化形成四环结构的芘以及![]() 。除此之外,蒽也会发生加成、氧化反应形成四环结构的苯并(a)蒽,苯并(a)蒽再进一步通过加成、氧化反应后分别形成五环结构的苯并(a)芘和二苯并(a,h)蔥。
。除此之外,蒽也会发生加成、氧化反应形成四环结构的苯并(a)蒽,苯并(a)蒽再进一步通过加成、氧化反应后分别形成五环结构的苯并(a)芘和二苯并(a,h)蔥。

图2 轻环多环芳烃通过Diels-Alder机理形成重环多环芳烃
Fig.2 Generation of heavy polycyclic aromatic hydrocarbons by
Diels-alder reaction of light polycyclic aromatic hydrocarbons
杂环胺是肉制品经过高温加热后产生的芳香族杂环化合物,且大多数具有多环芳香族结构,因此也被称之为杂环芳香胺(heterocyclic aromatic amines,HAAs)[14-15]。根据化学结构的不同,可分为氨基咪唑氮杂芳烃类极性杂环胺和氨基咔啉类(amino-carbolines)非极性杂环胺两大类,目前已经从不同食物成分体系中分离并且鉴定杂环胺约30种[16]。流行病学研究表明,几乎所有的杂环胺都具有致癌性,IARC将致癌物分为5类、4个级别,包括1级、2A级、2B级、3级和4级。根据各不相同杂环胺致癌作用的差异,国际癌症研究机构将MeIQ、MeIQx、PhIP、AaC、MeAaC、Trp-P-1和Trp-P-2列为2B类潜在致癌物,把IQ列为2A类可能致癌物[17-18],具体名称见表2。
表2 杂环胺名称、特性、缩写、分子质量和分子式
Table 2 name of HASS,properties,abbreviation,
molecular weight and formula

化合物缩写特性分子质量分子式2-氨基-1-甲基-6-苯基咪唑并[4,5-b]-吡啶PhIP极性224.3C13H12N42-氨基-1-甲基-6-(4羟基苯基)-咪唑并[4,5-b]-吡啶4'-OH-PhIP极性240.6C13H12N4O2-氨基-1,5,6-三甲基咪唑并[4,5-b]-吡啶1,5,6-TMIP极性176.2C9H12N42-氨基-3,5,6-三甲基咪唑并[4,5-b]-吡啶3,5,6-TMIP极性176.2C9H12N42-氨基-1,6-二甲基咪唑并[4,5-b]-吡啶DMIP极性162.2C8H10N42-氨基-3-甲基-咪唑并[4,5-f]-喹啉IQ极性198.2C11H10N42-氨基-1-甲基-咪唑并[4,5-f]-喹啉Iso-IQ极性198.2 C11H10N42-氨基-1-甲基-咪唑并[4,5-b]-喹啉IQ[4,5-b]极性198.2C11H10N42-氨基-3-甲基-咪唑并[4,5-f]-喹喔啉IQx极性199.3C10H9 N52-氨基-3,4-二甲基-咪唑并[4,5-f]-喹啉MeIQ极性212.3C12H12N42-氨基-3,4-二甲基-咪唑并[4,5-f]-喹喔啉4-MeIQx极性213.3C11H11N52-氨基-3,8-二甲基-咪唑并[4,5-f]-喹喔啉8-MeIQx极性213.3C11H11N52-氨基-3,4,8-三甲基-咪唑并[4,5-f]-喹喔啉4,8-DiMeIQx极性227.3C12H13N52-氨基-3,7,8-三甲基-咪唑并[4,5-f]-喹喔啉7,8-DiMeIQx极性227.3C12H13N52-氨基-4-羟甲基-3,8-二甲基咪唑并[4,5-f]-喹喔啉4-CH2OH-8-MeIQx极性243.3C12H13N5O2-氨基-3,4,7,8-四甲基-咪唑并[4,5-f]-喹喔啉TriMeIQx极性241.3C13H15N52-氨基-1-甲基-咪唑并[4,5-g]-喹喔啉IgQx极性199.3C10H9 N52-氨基-1,7-二甲基-咪唑并[4,5-g]-喹喔啉7-MeIgQx极性213.3C11H11N52-氨基-1,6,7-三甲基-咪唑并[4,5-g]-喹喔啉6,7-DiMeIgQx极性227.3C12H13N52-氨基-1,7,9-三甲基-咪唑并[4,5-g]-喹喔啉7,9-DiMeIgQx极性227.3C12H13N52-氨基-1,6-二甲基-呋喃并[3,2-e]-咪唑并[4,5-b]-吡啶IFP极性202.3C10H10N4O2-氨基-9H-吡啶并[2,3-b]吲哚AαC非极性183.2C11H9 N32-氨基-3-甲基-9H-吡啶并[2,3-b]吲哚MeAαC非极性197.2C12H11N31-甲基-9H-吡啶并[3,4-b]吲哚Harman非极性182.3C12H10N29H-吡啶并[3,4-b]吲哚Norharman非极性168.2C11H8 N23-氨基-1,4-二甲基-5H-吡啶并[4,3-b]吲哚Trp-p-1非极性211.3C13H13N33-氨基-1-甲基-5H-吡啶并[4,3-b]吲哚Trp-p-2非极性197.4C12H11N32-氨基-6-甲基二吡啶并[1,2-a:3',2'-d]咪唑Glu-p-1非极性252.7C11H13ClN4O2-氨基二吡啶并[1,2-a:3',2'-d]咪唑Glu-p-2非极性220.66C10H9ClN44-氨基-6-甲基-1H-2,5,10,10b四氮杂卟啉Orn-p-1非极性237.3C13H11N54-氨基-1,6-二甲基-2-甲基氨基-1H-6H-吡咯并[3,4-f]苯并咪唑-5,7-二酮Cre-p-1非极性259.3C12H13N5O23,4-环戊烯-吡啶并[3,2-a]咔唑Lys-p-1非极性257.3C18H13N22-氨基-5-苯基吡啶Phe-p-1非极性170.2C11H10N2
1.4.1 氨基咪唑氮杂芳烃类杂环胺形成途径
氨基咪唑氮杂芳烃类杂环胺由食品中的肌酸酐、氨基酸、肌酸和碳水化合物等前体在100~300 ℃之间通过美拉德反应等一系列复杂化学反应,被称为“热型杂环胺,且与IQ(2-氨基-3-甲基咪唑并[4,5-f]喹啉)性质相似,因此又被称为IQ型杂环胺,即极性杂环胺。氨基咪唑氮杂芳烃类形成途径有2种:(1)通过自由基途径形成。![]() 等[19]对4-MeIQx和4,8-DiMeIQx形成机理的研究结果表明,4-MeIQx和4,8-DiMeIQx形成机理主要分为2个阶段:经过初始步骤和稳态反应。初始步骤是美拉德反应中的Strecker降解反应,形成吡啶和吡嗪自由基;稳态阶段是自由基会进一步形成相应的吡啶和吡嗪衍生物,这些化合物再与肌酸酐反应形成4-MeIQx喹啉和4,8-DiMeIQx喹喔啉。(2)通过美拉德途径形成[20]。随着美拉德反应进行,葡萄糖降解形成二基化合物,与氨基酸和多肽类化合物发生Strecker降解以及化学反应,再进一步通过氧化反应、脱水反应形成8种吡嗪类物质(2-甲基吡嗪、2-乙基吡嗪、2,5-二甲基吡嗪、2-乙基-3-甲基吡嗪、2-乙基-5-甲基吡嗪、2,3-二甲基吡嗪、3-戊基-2,5二甲基吡嗪、2-乙基-3,5二甲基吡嗪),由此推理出8种吡嗪类物质生成途径,如图3所示。这些吡嗪类物质进一步与肌酸酐反应形成相应的咪唑喹啉、咪唑喹喔啉和咪唑吡啶类杂环胺化合物。
等[19]对4-MeIQx和4,8-DiMeIQx形成机理的研究结果表明,4-MeIQx和4,8-DiMeIQx形成机理主要分为2个阶段:经过初始步骤和稳态反应。初始步骤是美拉德反应中的Strecker降解反应,形成吡啶和吡嗪自由基;稳态阶段是自由基会进一步形成相应的吡啶和吡嗪衍生物,这些化合物再与肌酸酐反应形成4-MeIQx喹啉和4,8-DiMeIQx喹喔啉。(2)通过美拉德途径形成[20]。随着美拉德反应进行,葡萄糖降解形成二基化合物,与氨基酸和多肽类化合物发生Strecker降解以及化学反应,再进一步通过氧化反应、脱水反应形成8种吡嗪类物质(2-甲基吡嗪、2-乙基吡嗪、2,5-二甲基吡嗪、2-乙基-3-甲基吡嗪、2-乙基-5-甲基吡嗪、2,3-二甲基吡嗪、3-戊基-2,5二甲基吡嗪、2-乙基-3,5二甲基吡嗪),由此推理出8种吡嗪类物质生成途径,如图3所示。这些吡嗪类物质进一步与肌酸酐反应形成相应的咪唑喹啉、咪唑喹喔啉和咪唑吡啶类杂环胺化合物。

图3 吡嗪类化合物生成途径
Fig.3 Generation pathway of pyrazine compounds formations
1.4.2 氨基咔啉类杂环胺形成途径
氨基咔啉类中大部分物质如α-咔啉类(AαC、MeAαC)、γ-咔啉类(Trp-P-1、Trp-P-2)、δ-咔啉类(Glu-P-1、Glu-P-2)形成温度通常超过300 ℃,由氨基酸直接热解产生:AαC、MeAαC是通过球蛋白高温裂解而成;Trp-P-1、Trp-P-2通过色氨酸高温裂解而成的;Glu-P-1、Glu-P-2通过谷氨酸高温裂解而成的。因此这类被称为“热解型杂环胺”,又称非极性杂环胺。而β-咔啉类主要分为1-甲基-9H-吡啶并[3,4-b]吲哚(harman)和9H-吡啶并[3,4-b]吲哚(norharman)。β-咔啉类杂环胺可以在低温下(低于100 ℃)通过氨基酸或小分子肽热解而成,主要存在烤鱼、肉的提取物及熟肉。如GROSS等[21]测定不同加工条件下鱼肉中norharman和harman的含量。结果表明,煎炸方式下鱼肉中norharman和harman含量随加热时间延长而升高;碳烤方式下鱼肉中norharman和harman含量随加热时间延长而升高。SKOG等[22]运用气相色谱-质谱分析法测定熟肉中的非极性杂环胺的含量,结果表明,煎炸方式下猪肉中norharman和harman含量随加热时间延长而升高;烤制方式下猪肉中norharman含量随加热时间延长而升高,而harman含量随加热时间延长不变。目前,对于harman和norharman形成机制,QUAN 等[23]和BERTRAND等[24]提出了相关途径的研究,在美拉德反应初期,醛糖和氨基酸反应形成醛糖胺,通过Amadori重排生成Amadori化合物(pH>7),发生断裂生成二基化合物(α-二基化合物),二基化合物(α-二基化合物)与半胱氨酸通过一系列复杂反应生成乙醛;由此推出在美拉德反应末期,乙醛与色氨酸会在低温下(100~130 ℃)形成harman和norharman,具体过程见图4。
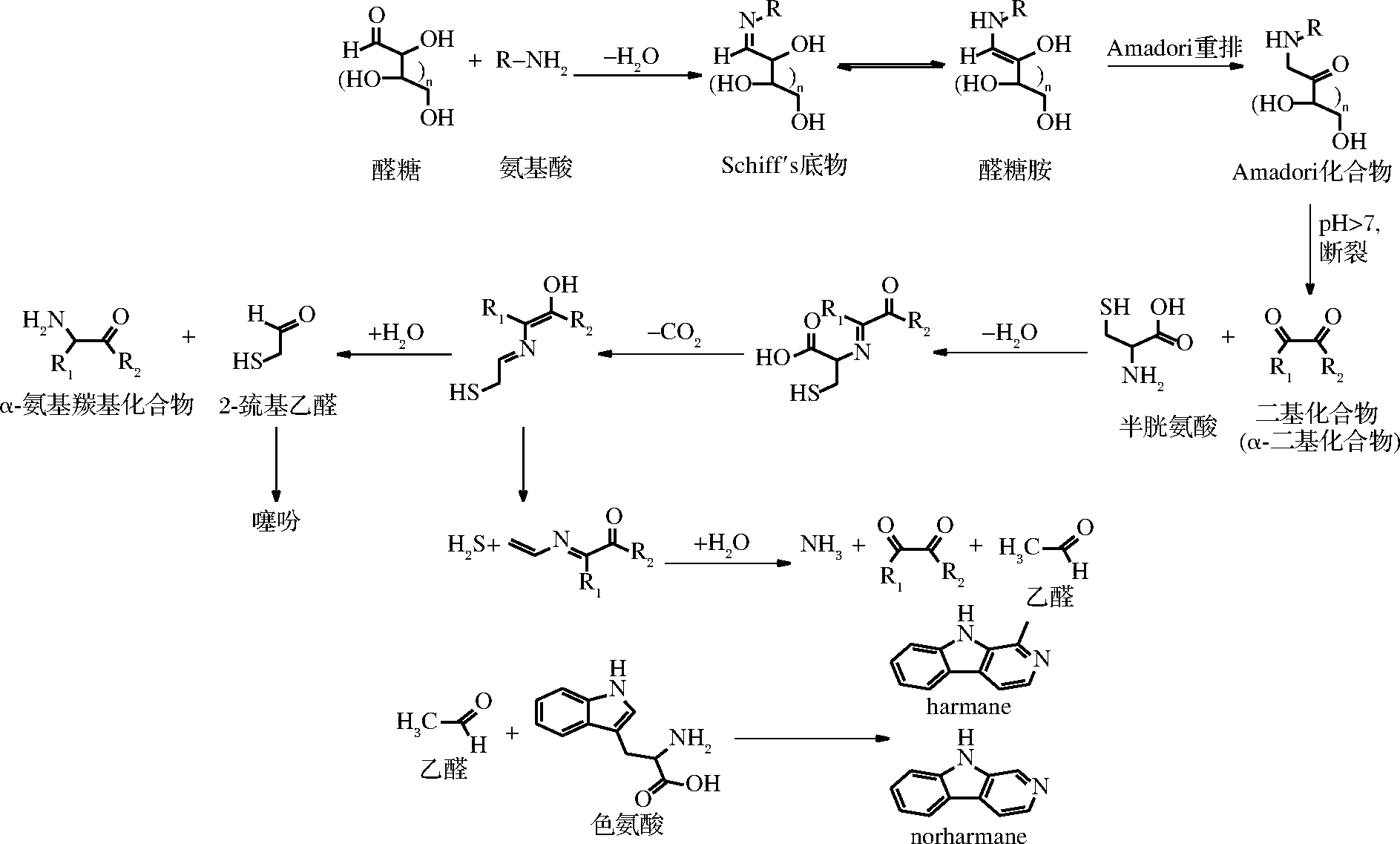
图4 醛糖和氨基酸反应生成harman和norharman
化合物途径
Fig.4 Generation of harman and norharman compounds
from aldose and amino acid reaction
烤制温度、时间会显著影响烧烤肉制品中有害物的生成,廖倩[25]研究发现,烤制温度为170 ℃时,鸭皮中多环芳烃生成量为0.19 μg/kg,当温度升高为210 ℃时,多环芳烃含量上升为0.69 μg/kg,增加了近4倍。张兰等[26]研究发现,烤制温度为160 ℃时,牛肉中多环芳烃生成量为38.63 μg/kg,当温度为200 ℃时,多环芳烃含量上升为82.9 μg/kg,多环芳烃含量增加2倍。因此,随着烤制温度的升高,肉制品中多环芳烃含量显著增加,当温度超过200 ℃时多环芳烃含量急剧上升。烤制时间也会影响肉制品中多环芳烃的生成量,姜三群[27]在相同烤制温度下,分别在时间为1~9 min时,研究羊肉串瘦肉和肥肉中多环芳烃含量变化,当烤制时间在2 min内时,羊肉串瘦肉中多环芳烃总量约为1.3 ng/g,肥肉约为1.9 ng/g,2~7 min内羊肉串瘦肉和肥肉中多环芳烃总量呈上升趋势,当在9 min时,羊肉串瘦肉中多环芳烃总量为6.333 ng/g,肥肉中为6.299 ng/g,多环芳烃总量明显升高。
烧烤肉制品中杂环胺的产生因素与多环芳烃产生因素类似,高温是杂环胺形成的必要因素。高温下,由于前体物质如部分氨基酸、肌酸、肌酸酐、糖类等通过Strecker降解等化学反应形成杂环胺,低温烤制可以有效减少杂环胺的形成。如廖国周[28]研究发现,当烤制温度低于170 ℃时,烤鸭中杂环胺生成量为3.52 ng/g,当温度为200 ℃时,杂环胺含量上升为34.01 ng/g,随着烤制温度的升高,烤鸭中杂环胺含量增加,当温度超过200 ℃时杂环胺含量急剧上升。BALOGH等[29]研究发现,制作牛肉饼时采用低温烤制的方法,烤制温度为175 ℃时,牛肉饼中的杂环胺总含量为3.0 ng/g,当温度为225 ℃时,杂环胺含量上升为24.6 ng/g,随着烤制温度的升,高牛肉饼中杂环胺含量增加,当温度超过200 ℃时与空白组相比,杂环胺含量急剧上升。GIBIS等[30]采用不同温度、不同时间煎炸培根,探讨培根中杂环胺的形成及感官品质的变化。随着煎炸温度升高,时间延长,杂环胺总量逐渐升高。因此,烤制温度及时间对烧烤肉制品中多环芳烃、杂环胺的生成影响较大,可以通过优化不同种类肉制品的烤制工艺,保证烧烤肉制品良好的色泽与口感等品质下,最大程度降低有害物质生成。
烧烤肉制品常见的烤制方式有碳烤、电烤、气烤等,而不同烤制方式对有害物的生成影响也有所不同。TERZI等[31]研究发现,气体方式烤肉时测得多环芳烃含量为5.7 μg/kg,当选用木炭烤制时,多环芳烃含量升高为24.2 μg/kg,木炭烤制方式下产生的多环芳烃含量显著高于气体烤制方式。CHUNG等[32]采用了木炭烘烤、木炭烧烤、气体烧烤3种不同烤制方式烤制猪肉,结果表明,3种方式烤制猪肉中多环芳烃总量由多到少的顺序为木炭烧烤>木炭烘烤>气体烧烤,其中木炭烧烤中多环芳烃总量为11.033 μg/kg,远远高于其他2种烤制方式。LARSSON等[33]研究发现,电烤方式烤香肠时测得多环芳烃含量为24 μg/kg,当选用木炭烤制时,多环芳烃含量升高为51 μg/kg,增加了近2倍,木炭烤制方式下产生的多环芳烃含量显著高于电烤方式。OZ等[34]研究表明,采用石头烤制牛排时测多环芳烃含量为0.92 ng/g;当选用电烤方式时,多环芳烃含量为0.77 ng/g,生成量减少,电烤优于石头烤制方式。对于杂环胺而言,JINAP等[35]研究结果也表明了,碳烤方式下测的牛肉中杂环胺总含量为81.68 ng/g;当选用微波烤制方式时,杂环胺总含量为65.52 ng/g,生成量减少,微波烤制方式优于碳烤方式。ÖZSARAC等[36]研究表明,猪肉经电烤方式时,杂环胺含量为0.894 ng/g,当选用气体烤制后测得杂环胺含量为0.588 ng/g,生成量明显减少,且气体烤制优于电烤方式。
综上所述,在烧烤肉制品加工过程中,采用电烤、气烤及石头碳烤能够有效降低烧烤肉制品中多环芳烃、杂环胺的含量,且成量均显著低于木炭烤制。
2.3.1 合理减控食用油及酱油的使用
人们在烤制肉类时,会添加腌制辅料对肉制品进行前处理来改善其风味和滋味,研究表明腌制辅料对烧烤肉制品中杂环胺和多环芳烃生成也有一定的促进作用,这是因腌制辅料中含有的糖类、氨基酸等前体物质,在高温烤制时这些物质会导致有害物的含量增加。乌日娜[37]分析了大豆油、花生油、调和油、葵花籽油、玉米油、芝麻油、橄榄油中种总多环芳烃(16种)的含量,花生油中种总多环芳烃(16种)含量最高为45.49 μg/kg,芝麻油含量次之为38.46 μg/kg,说明不同食用油本底中种总多环芳烃(16种)含量各不相同。因此,食用油的优化选择对烤制肉制品的种总多环芳烃(16种)含量有较大影响。FARHADIAN等[38]研究了经食用油腌制后烤牛肉中多环芳烃含量,与空白组相比,腌制组的牛肉中多环芳烃含量为98.9 μg/kg生成量明显增加。WONGMANEEPRATIP等[39]研究表明,与空白组相比,棕榈油腌制后测得烤鸡中多环芳烃含量为457.6 μg/kg,葵花籽油腌制后烤鸡中多环芳烃含量为376.6 μg/kg,而用葵花籽油腌制后鸡肉多环芳烃含量低于棕榈油腌制,且两者生成量明显高于未经腌制组。ALAM等[40]采用了4种不同类型酱油腌制鸡肉,经不同腌制时间后进行烤制并测定杂环胺含量,与空白组相比,随着腌制时间延长,sweet soy sauce腌制组测得杂环胺含量81.46 mg/g;salty soy sauce腌制组测得杂环胺含量69.95 mg/g;light soy sauce腌制组测得杂环胺含量98.44 mg/g;dark soy sauce腌制组测得杂环胺含量68.76 mg/g;且杂环胺生成量均比空白组增加。
由此,食用油及酱油是烧烤肉制品中多环芳烃、杂环胺的生成的重要因素[41],可以通过优化不同种类肉制品的辅料添加量及腌制时间,保证烧烤肉制品良好口感等品质的同时最大程度上降低有害物质生成。
2.3.2 适度添加天然香辛料
在制作烧烤肉制品时,会添加香辛料来改善肉制品的风味,同时香辛料对烧烤肉制品杂环胺和多环芳烃的生成也有一定的抑制作用。JANOSZKA[42]使用洋葱和大蒜作为香辛料,研究其对烤肉中多环芳烃产生的影响,发现二者均对多环芳烃形成有抑制作用,洋葱抑制效果达到了50%,大蒜素为24.3%。聂文等[43]研究了大蒜素和葛根素对烟熏香肠中多环芳烃生成影响,发现葛根素抑制效果达到了90%,大蒜素为95%。对于杂环胺而言,秦川[44]在烤牛肉中证实了加入膳食类黄酮化合物(芹菜苷元、根皮苷、木犀草素、染料木素、表没食子儿茶素没食子酸酯、槲皮素、柚皮素和山奈酚)能够通过清除苯乙醛来抑制PhIP形成,且表没食子儿茶素没食子酸酯、槲皮素和根皮苷抑制效果最佳。于春娣等[45]也证实在烤制牛肉中加入膳食类黄酮化合物(甘薯叶黄酮类物质、芦丁、葛根素、甘草素、槲皮素)能够通过清除苯乙醛来抑制PhIP形成,甘薯叶黄酮类物质抑制率为67.31%,且效果最佳。NURAY等[46]研究表明,在肉丸中加入洋葱提取物经熟制后测得杂环胺为0.07 ng/g,与空白组相比,生成量显著降低。
因此,在烤制时加入天然香辛料如大蒜、洋葱等能够显著降低多环芳烃和杂环胺的生成,同时葛根素、膳食类黄酮化合物等天然提取物也能够显著抑制烧烤肉制品中多环芳烃和杂环胺的生成,这可能是香辛料具有的自由基清除能力,可以显著抑制肉制品经高温烤制产生的自由基反应,从而减少或降低多环芳烃和杂环胺的生成[47]。
2.3.3 适度添加天然抗氧化剂
MIN等[48]烤肉时分别加入α-生育酚、表没食子儿茶素没食子酸酯、芝麻酚和丁基羟基茴香醚、2,6-二叔丁基对甲酚测定多环芳烃含量并设空白组对比,结果表明,天然及人工合成的抗氧化剂均对多环芳烃形成有抑制作用,α-生育酚抑制效果为40%,表没食子儿茶素没食子酸酯抑制效果为39%,芝麻酚抑制效果为42%,丁基羟基茴香醚抑制效果为38%,2,6-二叔丁基对甲酚抑制效果为39%,且天然抗氧化剂抑制效果优于人工合成抗氧化剂。WANG等[49]研究在烤制鸡肉前将其经过绿茶、白茶或茶中提取的茶多酚处理后,抑制率分别为53%和17%,且多环芳烃含量显著降低。另外,在烤制时添加竹叶提取物[50]、花椒叶提取物[51]等天然抗氧化剂均能有效降低杂环胺生成量。
人工合成的抗氧化剂包括丁基羟基茴香醚、二丁基羟基甲苯、没食子酸丙酯和叔丁基对苯二酚等,对于多环芳烃和杂环胺生成的抑制效果取决于抗氧化剂种类、添加量等,但这些人工合成的抗氧化剂因具有一定的毒性[52]而被限制添加量从而降低抑制效果,因此可添加天然抗氧化剂抑制多环芳烃和杂环胺的形成。
本文综述了烧烤肉制品加工过程中杂环胺、多环芳烃的生成机理;烤制温度、烤制时间、烤制方式、食物原料、脂肪含量以及食品腌制辅料等影响有害物的生成因素;通过添加外源抑制剂、合理控制烤制温度和烤制时间、减少腌制辅料的用量等方法来控制有害物的生成量。所得主要结论概述如下:
烧烤肉制品加工过程中多环芳烃和杂环胺的形成因素诸多,其中最主要的形成途径是原料肉中的组分在加工过程中发生的化学变化。原料肉中蛋白质、碳水化合物、脂肪会在高温下会发生裂解,再通过一系列环化、聚合反应形成多环芳烃;而杂环胺的形成途径主要是通过美拉德反应,还原糖(葡萄糖)首先降解形成二基化合物,再与氨基酸发生Strecker降解反应形成2-甲基吡嗪、2-乙基吡嗪、2,5-二甲基吡嗪、2-乙基-3-甲基吡嗪、2-乙基-5-甲基吡嗪、2,3-二甲基吡嗪、3-戊基-2,5二甲基吡嗪、2-乙基-3,5二甲基吡嗪等吡嗪类物质,与肌酸酐形成咪唑喹啉、咪唑喹喔啉和咪唑吡啶类化合物。
烧烤肉制品加工中有害物防控方法主要为:(1)合理控制烤制温度和烤制时间。降低烤制温度和减少烤制时间均能减少烧烤肉制品加工中有害物生成量;(2)合理选择烤制技术。微波烤制、气体烧烤、电烤、石头烧烤等新型的烤制方式与传统木炭烤制和木炭烘烤对比,经烤制后烧烤肉制品中有害物含量均低于木炭烤制和木炭烘烤;(3)添加外源物质。在原料肉的腌制过程中,加入大蒜素、葛根素、洋葱提取物后,有害物的含量显著降低;此外,黄酮类物质、抗氧化剂都能够有效降低或减少有害物生成量。
[1] CHEN T, WANG Y.Molecular bending as a vital step toward transforming planar PAHs to fullerenes and tubular structures[J].Astronomy & Astrophysics, 2020, 644:A146.
[2] GAVILAN MARIN L, BEJAOUI S, HAGGMARK M, et al.Low-temperature formation of carbonaceous dust grains from PAHs[J].The Astrophysical Journal Letters, 2020, 889(2):101.
[3] WANG C, XIE Y T, WANG H Y, et al.Phenolic compounds in beer inhibit formation of polycyclic aromatic hydrocarbons from charcoal-grilled chicken wings[J].Food Chemistry, 2019, 294:578-586.
[4] LEDESMA E, RENDUELES M, D AZ M.Contamination of meat products during smoking by polycyclic aromatic hydrocarbons:Processes and prevention[J].Food Control, 2016, 60:64-87.
AZ M.Contamination of meat products during smoking by polycyclic aromatic hydrocarbons:Processes and prevention[J].Food Control, 2016, 60:64-87.
[5] The European Commission.(EU) No 835/2011.Amending Regulation(EC) No 1881/2006 as regards maximum levels for polycyclic aromatic hydrocarbons in foodstuffs[S].Brussels:Official Journal of the European Union, 2011.
[6] CHEN B H, CHEN Y C.Formation of polycyclic aromatic hydrocarbons in the smoke from heated model lipids and food lipids[J].Journal of Agricultural and Food Chemistry, 2001, 49(11):5 238-5 243.
[7] KIM H J, CHO J, JANG A.Effect of charcoal type on the formation of polycyclic aromatic hydrocarbons in grilled meats[J].Food Chemistry, 2021, 343:128453.
[8] BRITT P F, BUCHANAN A C, OWENS C V, et al.Does glucose enhance the formation of nitrogen containing polycyclic aromatic compounds and polycyclic aromatic hydrocarbons in the pyrolysis of proline?[J].Fuel, 2004, 83(11-12):1 417-1 432.
[9] SHARMA R K, CHAN W G, SEEMAN J I, et al.Formation of low molecular weight heterocycles and polycyclic aromatic compounds (PACs) in the pyrolysis of α-amino acids[J].Journal of Analytical and Applied Pyrolysis, 2003, 66(1-2):97-121.
[10] MCGRATH T E, CHAN W G, HAJALIGOL M R.Low temperature mechanism for the formation of polycyclic aromatic hydrocarbons from the pyrolysis of cellulose[J].Journal of Analytical and Applied Pyrolysis, 2003, 66(1-2):51-70.
[11] WANG H, FRENKLACH M.A detailed kinetic modeling study of aromatics formation in laminar premixed acetylene and ethylene flames[J].Combustion and Flame, 1997, 110(1-2):173-221.
[12] SHUKLA B, KOSHI M.Importance of fundamental sp, sp2, and sp3 hydrocarbon radicals in the growth of polycyclic aromatic hydrocarbons[J].Analytical Chemistry, 2012, 84(11):5 007-5 016.
[13] LLAMAS A, AL-LAL A M, GARC A-MART
A-MART NEZ M J, et al.Polycyclic aromatic hydrocarbons (PAHs) produced in the combustion of fatty acid alkyl esters from different feedstocks:Quantification, statistical analysis and mechanisms of formation[J].Science of the Total Environment, 2017, 586:446-456.
NEZ M J, et al.Polycyclic aromatic hydrocarbons (PAHs) produced in the combustion of fatty acid alkyl esters from different feedstocks:Quantification, statistical analysis and mechanisms of formation[J].Science of the Total Environment, 2017, 586:446-456.
[14] ZENG M M, WANG J H, ZHANG M R, et al.Inhibitory effects of Sichuan pepper (Zanthoxylum bungeanum) and sanshoamide extract on heterocyclic amine formation in grilled ground beef patties[J].Food Chemistry, 2018, 239:111-118.
[15] KHAN I A, LIU D M, YAO M J, et al.Inhibitory effect of Chrysanthemum morifolium flower extract on the formation of heterocyclic amines in goat meat patties cooked by various cooking methods and temperatures[J].Meat Science, 2019, 147:70-81.
[16] 程轶群, 雷阳, 周兴虎, 等.传统肉制品中杂环胺研究进展[J/OL].食品科学, 2021.DOI:10.7506/ spkx1002-6630-20200927-338.
CHEN Y Q, LEI Y, ZHOU X H, et al.Heterocyclic amines in Chinese traditional meat products:A review[J/OL].Food Science, 2021.DOI:10.7506/spkx1 002-6630-20200927-338.
[17] JINAP S, MOHD-MOKHTAR M S, FARHADIAN A, et al.Effects of varying degrees of doneness on the formation of heterocyclic aromatic amines in chicken and beef satay[J].Meat Science, 2013, 94(2):202-207.
[18] 杜洪振, 陈倩, 刘骞, 等.肉制品中杂环胺的形成及其机制[J].中国食品学报, 2020, 20(9):323-336.
DU H Z, CHEN Q, LIU N, et al.Formation and mechanism of heterocyclic amines in meat products[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(9):323-336.
[19] ![]() J M.Synthesis of some heterocyclic aminoimidazoazarenes[J].Food Chemistry, 1993, 46(3):273-276.
J M.Synthesis of some heterocyclic aminoimidazoazarenes[J].Food Chemistry, 1993, 46(3):273-276.
[20] SCALONE G L L, LAMICHHANE P, CUCU T, et al.Impact of different enzymatic hydrolysates of whey protein on the formation of pyrazines in Maillard model systems[J].Food Chemistry, 2019, 278:533-544.
[21] GROSS G A, GRÜTER A.Quantitation of mutagegnic/carcinogenic heterocyclic aromatic amines in food products[J].Journal of Chromatography A, 1992, 592(1-2):271-278.
[22] SKOG K, SOLYAKOV A, ARVIDSSON P, et al.Analysis of nonpolar heterocyclic amines in cooked foods and meat extracts using gas chromatography-mass spectrometry[J].Journal of Chromatography A, 1998, 803(1-2):227-233.
[23] QUAN W, LI Y, JIAO Y, et al.Simultaneous generation of acrylamide, β-carboline heterocyclic amines and advanced glycation ends products in an aqueous Maillard reaction model system[J].Food Chemistry, 2020, 332:127387.
[24] BERTRAND E, EL BOUSTANY P, FAULDS C B, et al.The Maillard Reaction in Food:An Introduction[M].Amsterdam:Elsevier, 2018.
[25] 廖倩. 气体射流冲击烤制“北京烤鸭”加工技术与多环芳烃产生的研究[D].石河子:石河子大学, 2009.
LIAO Q.Study on the production of polycyclic aromatic hydrocarbons in “Peking roast duck” with air-jet impingement roasting technique[D].Shihezi:Shihezi University, 2009.
[26] 张兰, 高天丽, 刘永峰, 等.八种中式烹饪工艺对牛肉中多环芳烃、反式脂肪酸和亚硝酸盐的影响[J].中国农业科学, 2017, 50(6):1 126-1 138.
ZHANG L, GAO T L, LIU Y F, et al.Effects of eight Chinese style cuisine methods on polycyclic aromatic hydrocarbons, trans-fatty acids and nitrite of beef[J].Scientia Agricultura Sinica, 2017, 50(6):1 126-1 138.
[27] 姜三群. 羊肉串烤制中品质和有害物质变化规律及影响因素的研究[D].乌鲁木齐:新疆农业大学, 2014.
JIANG S Q.Studies on quality, harmful substances and influence factors of mutton shashlik in the baking[D].Urumqi:Xinjiang Agricultural University, 2014.
[28] 廖国周. 烧烤肉制品中杂环胺形成规律研究[D].南京:南京农业大学, 2008.
LIAO G Z.Studies on the formation discipline of heterocyclic aromatic amines in fried meat[D].Nanjing:Nanjing Agricultural University, 2008.
[29] BALOGH Z, GRAY J I, GOMAA E A, et al.Formation and inhibition of heterocyclic aromatic amines in fried ground beef patties[J].Food and Chemical Toxicology, 2000, 38(5):395-401.
[30] GIBIS M, KRUWINNUS M, WEISS J.Impact of different Pan-frying conditions on the formation of heterocyclic aromatic amines and sensory quality in fried bacon[J].Food Chemistry, 2015, 168:383-389.
[31] TERZI G, CELIK T H, NISBET C.Determination of benzo [a] pyrene in Turkish döner kebab samples cooked with charcoal or gas fire[J].Irish Journal of Agricultural and Food Research, 2008, 47(2):187-193.
[32] CHUNG S Y, YETTELLA R R, KIM J S, et al.Effects of grilling and roasting on the levels of polycyclic aromatic hydrocarbons in beef and pork[J].Food Chemistry, 2011, 129(4):1 420-1 426.
[33] LARSSON B K, SAHLBERG G P, ERIKSSON A T, et al.Polycyclic aromatic hydrocarbons in grilled food[J].Journal of Agricultural and Food Chemistry, 1983, 31(4):867-873.
[34] OZ F, YUZER M O.The effects of cooking on wire and stone barbecue at different cooking levels on the formation of heterocyclic aromatic amines and polycyclic aromatic hydrocarbons in beef steak[J].Food Chemistry, 2016, 203:59-66.
[35] JINAP S, MOHD-MOKHTAR M S, FARHADIAN A, et al.Effects of varying degrees of doneness on the formation of heterocyclic aromatic amines in chicken and beef satay[J].Meat Science, 2013, 94(2):202-207.
[36] ÖZSARAÇ N, KOLSARICI N, DEMIROK SONCU E, et al.Formation of heterocyclic aromatic amines in doner kebab cooked with different methods at varying degrees of doneness[J].Food Additives & Contaminants:Part A, 2019, 36(2):225-235.
[37] 乌日娜. 多环芳烃在食用植物油加工工艺中的污染特征研究[D].北京:中国农业科学院, 2016.
WU R N.Study on pollution characteristics of polycyclic aromatic hydrocarbons in edible vegetable oil processing[D].Beijing:Chinese Academy of Agricultural Sciences, 2016.
[38] FARHADIAN A, JINAP S, FARIDAH A, et al.Effects of marinating on the formation of polycyclic aromatic hydrocarbons (benzo[a]Pyrene, benzo[b]fluoranthene and fluoranthene) in grilled beef meat[J].Food Control, 2012, 28(2):420-425.
[39] WONGMANEEPRATIP W, VANGNAI K.Effects of oil types and pH on carcinogenic polycyclic aromatic hydrocarbons (PAHs) in grilled chicken[J].Food Control, 2017, 79:119-125.
[40] ALAM SHAH S, SELAMAT J, HAQUE AKANDA M J, et al.Effects of different types of soy sauce on the formation of heterocyclic amines in roasted chicken[J].Food Additives & Contaminants:Part A, 2018, 35(5):870-881.
[41] 沈习习, 汤晓艳, 战俊良, 等.烧烤肉中多环芳烃的检测方法及控制措施[J].中国食物与营养, 2019, 25(11):21-25.
SHEN X X, TANG X Y, ZHAN J L, et al.Research progress in testing standards and control technologies of polycyclic aromatic hydrocarbons(PAHs) in grilled meat products[J].Food and Nutrition in China, 2019, 25(11):21-25.
[42] JANOSZKA B.HPLC-fluorescence analysis of polycyclic aromatic hydrocarbons (PAHs) in pork meat and its gravy fried without additives and in the presence of onion and garlic[J].Food Chemistry, 2011, 126(3):1 344-1 353.
[43] 聂文, 屠泽慧, 蔡克周.葛根素和大蒜素对烟熏香肠中多环芳烃含量的影响[J].肉类工业, 2017(8):37-41.
NIE W, TU Z H, CAI K Z.Effect of puerarin and allicin on the content of polycyclic aromatic hydrocarbons in smoked sausages[J].Meat Industry, 2017(8):37-41.
[44] 秦川. 膳食类黄酮抑制烤牛肉饼中杂环胺PhIP的形成作用研究[D].无锡:江南大学, 2014.
QIN C.Inhibition of PhIP in roast beef patties by dietary flavonoids:Formation mechanism[D].Wuxi:Jiangnan University, 2014.
[45] 于春娣, 邵泽平, 张燕, 等.模拟体系中PhIP的产生规律及抑制作用研究[J].食品研究与开发, 2017, 38(7):18-22.
YU C D, SHAO Z P, ZHANG Y, et al.The study of formation rule and inhibitory effect on ph IP in model system[J].Food Research and Development, 2017, 38(7):18-22.
[46] NURAY M, OZ F.The effect of using different types and rates of onion-water extract in meatball production on the formation of heterocyclic aromatic amines[J].Journal of the Science of Food and Agriculture, 2019, 99(7):3 538-3 547.
[47] SHON M Y, CHOI S D, KAHNG G G, et al.Antimutagenic, antioxidant and free radical scavenging activity of ethyl acetate extracts from white, yellow and red Onions[J].Food and Chemical Toxicology, 2004, 42(4):659-666.
[48] MIN S, PATRA J K, SHIN H S.Factors influencing inhibition of eight polycyclic aromatic hydrocarbons in heated meat model system[J].Food Chemistry, 2018, 239:993-1 000.
[49] WANG C, XIE Y T, QI J, et al.Effect of Tea Marinades on the formation of polycyclic aromatic hydrocarbons in charcoal-grilled chicken wings[J].Food Control, 2018, 93:325-333.
[50] 李明杨, 陈胜慧子, 牛希跃, 等.抗氧化剂对油炸肉制品品质及杂环胺形成的影响[J].食品科学, 2021, 42(16):29-38.
LI M Y, CHEN S H Z, NIU X Y, et al.Effects of different antioxidants on the quality of and heterocyclic amine formation in deep-fat fried meat products[J].Food Science, 2021, 42(16):29-38.
[51] 王未, 任晓镤, 鲍英杰, 等.花椒叶提取物对烤牛肉饼杂环胺形成的影响[J/OL].食品科学, 2020.DOI:10.7506/spkx1002-6630-20201028-281.
WANG W, REN X P, BAO Y J, et al.Effects of Zanthoxylum bungeanum Maxim.leaf Extract on Heterocyclic Amines Formation of Roast Beef Patties[J/OL].Food Science, 2020.DOI:10.7506/spkx1002-6630-20201028-281.
[52] DASSARMA B, NANDI D K, GANGOPADHYAY S, et al.Hepatoprotective effect of food preservatives (butylated hydroxyanisole, butylated hydroxytoluene) on carbon tetrachloride-induced hepatotoxicity in rat[J].Toxicology Reports, 2018, 5:31-37.