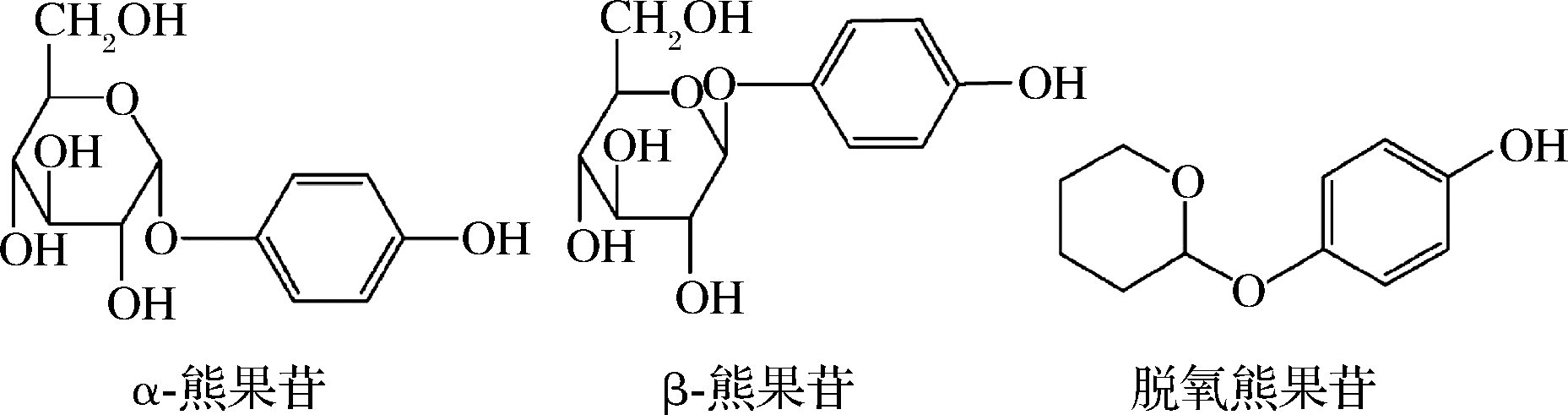
图1 三种熊果苷的结构式
Fig.1 Structural formulae of the three arbutin
熊果苷(arbutin, Arb),又名熊果素[1],学名对苯二酚葡萄糖苷[2]。是一种源于绿色植物天然存在的糖苷类物质,是许多耐冻干植物,如小麦、梨[3]、杜鹃花科的熊果[4-5]中含量丰富的溶质[6]。呈白色针状结晶或粉末,易溶于热水、乙醇,略溶于冷水。目前已知的熊果苷有α-熊果苷、β-熊果苷和脱氧熊果苷。α-熊果苷来源途径较窄,很少能从植物中提取得到,一般只能通过不同微生物的酶进行转移反应,目前的合成方法主要有酶合成法和生物转化法。β-熊果苷可以通过植物提取、植物细胞培养、酶转化和化学合成4种方法得到,但由于产率、成本、技术水平等因素的制约,目前工业化生产β-熊果苷多采用化学合成法,适合大规模的工业化发展。脱氧熊果苷,其来源主要是有机合成,包括对苯二酚直接醚化、以2 - [(4 -苄氧基) 苯氧基]四氢吡喃为原料合成2种方法[7]。3种熊果苷的结构式见图1。

图1 三种熊果苷的结构式
Fig.1 Structural formulae of the three arbutin
作为21世纪理想的皮肤美白及祛斑活性剂,熊果苷是一种集“绿色植物,安全可靠”于一身的皮肤高效色素脱失组分。熊果苷在保护肌肤不受自由基侵害的同时,具有良好的亲水性,所以经常作为美白剂在市场中销售,在亚洲各国受到极大的欢迎。
随着近年来研究的深入和研究范围的进一步扩大,熊果苷的更多作用突显出来,如抗氧化、抗炎[8]、抑菌[3]、镇咳、祛痰、平喘、抗癌[9]、抗肿瘤[10]、治疗急性肺损伤等。因此,化妆品市场和医药市场对熊果苷的需求量正在逐年增加。鉴于熊果苷的研究工作对今后医疗的研究意义以及在日常生活中的现实应用意义,本文对熊果苷的药理活性作用及其机制做一综述。
酪氨酸是黑色素形成的原料,作为主要限速酶,酪氨酸酶的活性决定了黑色素的形成量。酪氨酸酶具有酪氨酸羟化酶活性(催化酪氨酸→多巴)和多巴氧化酶活性(催化多巴→多巴醌),是黑素细胞合成黑色素的关键因素。
而熊果苷作为一种酪氨酸酶活性竞争抑制剂具有可逆性。它能迅速渗入肌肤,在黑色素细胞没有毒性的浓度范围内且不影响细胞增殖浓度的情况下,有效地抑制酪氨酸酶活性,通过自身与酪氨酸酶的直接结合,竞争多巴的结合位点,阻断多巴及多巴醌的合成,进而干扰黑色素细胞,抑制黑色素的生成(图2)。同时它还具有淡化已形成的黑色素,加速黑色素的分解与排泄,减少皮肤色素沉积[11],祛除色斑和雀斑[12] 的功能。

图2 人体皮肤黑色素形成机制及熊果苷作用示意图
Fig.2 Mechanism of melanin formation in human skin and effect of arbutin
陆彬等[13]以斑马鱼胚胎为模型,通过定性观察发现,随着熊果苷浓度的增加,其对黑色素生成的抑制作用明显增强。而通过基因表达分析表明,熊果苷还可以通过抑制眼皮肤白化病II型,酪氨酸酶和银色毛发等黑色素合成的相关基因,抑制黑色素的合成。
熊果苷作为美白剂在化妆品中广泛应用,临床也用于黄褐斑及黑色素瘤的治疗[3]。何盾等[14]通过复制黄褐斑鼠模型,予熊果苷干预,观察其疗效并探讨可能机制。经实验证明其具有效的增白作用,可能通过提高局部皮肤组织中超氧化物歧化酶(superoxide dismutase, SOD)活性,明显降低酪氨酸、丙二醛(malondialdehyde, MDA)的含量,从而抑制黑色素细胞和黑色素瘤细胞的酪氨酸酶活性,促使皮肤细胞的氧化还原反应,减少自由基产生,抑制黑色素的形成,进而有效治疗黄褐斑[14]。
作为黑色素抑制剂,熊果苷与其他同、异类物质相比,在化妆品、医疗、商业等领域,体现出其应用范围广、作用效果明显、使用过程安全无毒的优势。
熊果苷可用于抗炎、抗溃疡。在药理上能抑制胰岛素的降解,口服后在体内水解产生氢醌而具有杀菌作用[15]。在传统医疗过程中,熊果苷作为熊果叶的主要药效成分[16],凭借着杀菌、消炎能力强的特点,主要用于治疗尿路感染[17]及肠道消炎。研究表明,熊果苷能显著降低促炎性细胞因子,及其他炎症相关的基因,可用于治疗响应于脂多糖(lipopolysaccharide, LPS)刺激的BV2小胶质细胞活化的炎症和有害的影响[15],可以快速止痛、迅速消除红肿、愈合快、不留疤痕、无毒副作用。
YE等[18]研究了熊果苷对LPS诱导的肺损伤的影响。研究通过建立LPS静脉注射大鼠肺损伤模型发现,在LPS刺激后,血清和肺组织中的炎性细胞因子水平显著升高,而熊果苷预处理降低了LPS诱导的MDA水平,增加了LPS诱导的SOD活性。研究表明,熊果苷可能是急性肺损伤的一种新的治疗方法。
炎症反应过程中,细胞膜磷脂在磷脂酶A2的作用下释放出花生四烯酸。花生四烯酸经环氧化酶作用生成前列腺素和血栓素;经脂氧化酶作用产生白三烯、脂氧素和羟基环氧素。为了研究熊果苷的抗炎作用及其作用机理,王佩等[19]经试验观察到,熊果苷可减少炎症组织前列腺素其纳克级水平局部组织前列腺素E2(prostaglandin E2, PGE2)水平,抑制大鼠腹腔巨噬细胞释放白三烯B4 (leukotriene B4, LTB4)。试验表明,熊果苷的抗炎效果可能与抑制炎症介质PGE2及LTB4的释放有关(图3)。
在此基础上,KAJIWARA等[20]研究了熊果苷的聚合物,证明了由于聚合物酚基团的邻近效应以及聚合物在培养板表面的浓度效应,聚合物熊果苷比单分子熊果苷具有更高的抗菌活性。
随着“天然”热潮,王佩等[19]又尝试将天然熊果苷与其他物质联用,力求达到更好的抗炎效果。例如:熊果苷与甘草酸 (glycyrrhizin, GL)合用对免疫性炎症的治疗。熊果苷与GL合用对福氏全佐剂诱发的大鼠原发性及继发性足肿胀以及口恶唑酮引起的小鼠两耳肿胀均有抑制作用。并且,合用组小鼠血中![]() 细胞、PGE2相对含量显著降低,两药合用可抑制大鼠腹腔巨噬细胞释放LTB4。结果表明,熊果苷与GL对免疫性炎症具有协同治疗作用[21]。
细胞、PGE2相对含量显著降低,两药合用可抑制大鼠腹腔巨噬细胞释放LTB4。结果表明,熊果苷与GL对免疫性炎症具有协同治疗作用[21]。
JANA等[22]进行了熊果苷与卡维地洛联合用药对嗜中性粒细胞作用的研究。研究表明,熊果苷与卡维地洛合用,可通过减少磷脂酶D、髓过氧化物酶、弹性酶活性、超氧化物和随后衍生的活性氧(reactive oxygen species, ROS)的生成,达到减少组织损伤的目的。试验表明,熊果苷能够抑制炎症的发生和发展,同时证实熊果苷和卡维地洛的联合作用比单独使用更有效。

图3 膜磷脂生成的物质及熊果苷作用示意图
Fig.3 Schematic diagram of substances produced by membrane phospholipids and effects of arbutin
咳、痰、喘是呼吸系统疾病常见的三大症状。慢性反复发作性咳嗽、咳痰或伴有喘息是气管、支气管黏膜及其周围组织慢性非特异性炎症的主要临床表现。有研究表明,熊果苷灌胃可增加动物气管分泌、延长氨水引咳潜伏期[15, 23-24]、减少咳嗽次数、明显增多气管酚红排泌量[16]。
王亚芳等[25]采用引咳、祛痰、平喘动物实验模型进行了药效学实验研究。小鼠氨水引咳时,50~200 mg/kg的熊果苷有较强的镇咳作用,在相同剂量下50 mg/kg 的熊果苷与咳必清作用相当;200 mg/kg的熊果苷对磷酸组织胺致豚鼠哮喘具有一定防治作用,可明显延长豚鼠哮喘潜伏期;50~200 mg/kg的熊果苷可增加小鼠气管中酚红的排泌,尤以200 mg/kg祛痰作用最强;熊果苷能显著地对抗磷酸组织胺引起的豚鼠离体气管条收缩,20 mg/kg 的熊果苷与25 μg/mL 的异丙嗪作用相当。上述药效学实验结果显示,熊果苷具有一定的镇咳、祛痰及平喘作用[25]。
手术或者外部放射治疗一直是部分癌症治疗的主要手段,但其副作用较大。所以,中药提取物治疗肿瘤成为当下研究的热点。临床已证实熊果苷在人体内没有明显的毒副作用,而且HAJAR等[26]展示了熊果苷作为抗氧化剂对前列腺癌细胞的影响,发现熊果苷可显著诱导肿瘤细胞凋亡,为辅助治疗前列腺癌开辟了新的前景。同时,也说明熊果苷具有抗肿瘤的潜在作用,可有效抑制部分癌细胞的转移行为。
JIANG等[27]研究制备了乙酰化熊果苷。结果发现熊果苷和乙酰化熊果苷在B16小鼠黑色素瘤细胞中均能显著降低细胞活力,促进细胞凋亡,导致G1细胞周期阻滞,诱导线粒体断裂。熊果苷和乙酰化熊果苷通过线粒体途径对B16小鼠黑色素瘤细胞发挥促凋亡作用。研究结果支持乙酰化熊果苷作为皮肤美白和黑色素瘤治疗的一种新的潜在候选制剂。
熊果苷可以作为天然分子结合受体与miRNA结合并参与其表达调控过程,影响细胞自身的增殖和凋亡行为。郭锦辉等[28]探讨了熊果苷对膀胱癌EJ-1细胞增殖的影响及其机制研究。观察不同质量浓度及不同作用时间熊果苷对膀胱癌EJ-1细胞增殖能力的影响。研究发现,100 μg/mL熊果苷对膀胱癌EJ-1细胞增殖的抑制作用最佳,可干扰膀胱癌EJ-1细胞的周期进展,且呈时间依赖性,可将细胞阻滞于G2/M期,并促进细胞凋亡。
为了进一步研究其机制,郭锦辉等[28]观察了熊果苷对膀胱癌EJ-1细胞外调节蛋白激酶(extracellular regulated protein kinases, ERK)、磷酸化ERK (p-ERK)、G1/S-特异性周期蛋白-D1(Cyclin D1)、p21蛋白表达的影响。结果显示,作用24、48、72、96 h后,p-ERK蛋白表达水平均降低,呈逐渐下降后升高的趋势;ERK蛋白表达水平均降低,但差异无统计学意义;Cyclin D1蛋白表达水平均升高,呈逐渐升高后下降的趋势;p21蛋白表达水平随时间延长逐渐升高,于96 h差异有统计学意义。结果表明,熊果苷处理膀胱癌EJ-1细胞后可抑制ERK蛋白的磷酸化进程,由于ERK通路是主要的促有丝分裂信号,因此,熊果苷对ERK信号通路途径的灭活似乎对其抗增殖作用有直接的干扰,其具体作用环节还需进一步研究;同时,熊果苷可通过上调p21基因抑制人膀胱癌EJ-1细胞的增殖[15],其机制可能与抑制细胞周期相关蛋白ERK和p21蛋白的表达有关[28]。
骨肉瘤(osteosarcoma, OS)也叫成骨肉瘤,是一种恶性肿瘤,它起源于长骨的远端,在20岁以下的青少年或儿童中最为常见[29]。目前的主要治疗方法是手术切除和全身多药化疗,虽然系统治疗在操作方面取得了巨大进展,但是由于其急速和早期转移的特性,OS患者的长期整体存活率仍然不高。
WANG等[29]调查了熊果苷是否影响OS细胞系的细胞增殖。测定所示,熊果苷以剂量和时间依赖的方式降低了OS细胞的生存能力。熊果苷降低了MTHFD1L蛋白质的水平,MTHFD1L是 OS 细胞中miR-338-3p的直接靶向基因,miR-338-3p直接瞄准并调控MTHFD1L的表达,即熊果苷可通过MTHFD1L对miR-338-3p的敲击抑制OS细胞的入侵、迁移和增殖。AKT/mTOR 信号的异常活动在实体肿瘤中频繁出现,它的激活显著促进了各种癌症的发展,包括OS。熊果苷调解 OS 细胞中miR-338-3p/MTHFD1L轴调控作用的同时,抑制了OS中的AKT/mTOR信号。
在本次研究中证实,熊果苷通过调节miR-338-3p/MTHFD1L对OS的抗增殖和抗创特性影响,从而灭活了AKT/mTOR通路,停用了AKT/mTOR信号,阻碍了OS的发展。
蛋白激酶2(HIPK2),参与调节癌细胞的分化、增殖和凋亡。在癌症中,HIPK2通常被认为是潜在的肿瘤抑制因子。李佳等[30]的研究中,熊果苷呈浓度依赖性地上调胰腺癌细胞HIPK2的表达,且结果显示,减少HIPK2能够逆转熊果苷对胰腺癌细胞生长抑制作用。HIPK2可能与心肌肌球蛋白结合蛋白C(cMyc)相互作用并使其磷酸化,从而导致其不稳定。HIPK2通过调节cMyc的表达,进而调节有氧糖酵解及相关蛋白乳酸脱氢酶A、己糖激酶2(HK-2)和葡萄糖转运蛋白1(GLUT1)的表达,从而影响胰腺癌细胞的增殖、凋亡,选择性地抑制胰腺癌细胞生长。
游离辐射自由基与DNA的相互作用可引起DNA损伤,导致诱变和核囊形成。NADI等[31]研究了熊果苷的抗分裂活性,计算多染红细胞与多染红细胞加常染红细胞的比例[PCE/(PCE+NCE)],以显示熊果苷的细胞增殖活性,进而研究熊果苷对大鼠骨的保护作用。在放射前2 h和4 h,分别给予样品不同剂量的熊果苷。计算每个样品的微核频率和PCE/(PCE+NCE),检验对数据进行统计分析。结果表明,与未给予药物治疗的样品相比,熊果苷显著降低了小鼠骨髓中微核多色红细胞的频率,增加了PCE/(PCE+NCE)。不同剂量的熊果苷对骨髓细胞均无毒,对大鼠骨具有明显的保护作用,可抵抗射线照射引起的细胞杀伤作用。
之后,NADI等[32]通过测定血清碱性磷酸酶(alkaline phosphatse,ALP)、谷丙转氨酶和谷草转氨酶的活性水平,在发现熊果苷有效降低大剂量X射线照射对小鼠全身组织影响的同时,证实50 mg/kg的熊果苷具有较高的放射防护效果。
异体软骨用于修复受损的关节软骨,但其需要活的软骨细胞。鉴于没有一种保存方法能够有效地满足这一目的,所以ROSA等[33]希望研究出更有效的低温保护剂(cryoprotectant, CPA)。他们研究了熊果苷单独或与其他低浓度CPA联合使用,对人关节软骨低温保护作用的效果。
研究通过人体胫骨平台,研究熊果苷单独或结合各种浓度二甲基亚砜(dimethyl sulfoxide, DMSO)和甘油的治疗效果。在冻融前后,评估软骨细胞活力,以评估细胞膜完整性。研究发现,在熊果苷中加入DMSO和甘油后,不再增加软骨细胞的生存能力,说明熊果苷是潜在的可替代DMSO和甘油在骨软骨移植中的冷冻保护剂[33],并且熊果苷是一种较DMSO和甘油更有效的骨软骨移植冷冻保护剂。作为冷冻保护剂,熊果苷还可应用于山羊精子的冷冻保护中[15, 34]。
MAN等[35]研究探讨了熊果苷对小鼠成骨前体细胞(MC3T3 E1)体外增殖和分化的作用及其机制。试验通过ALP染色,检测I型胶原蛋白(COL1A1)、骨含伽马羧酸蛋白(BGLAP)和Sp7转录因子(Sp7 mRNA)的表达水平,研究熊果苷对成骨分化的影响。通过逆转录、定量聚合酶链反应和蛋白质印迹法分析了相关转录因子2(RUNX2)和连环蛋白(catenin, cats)的mRNA和蛋白表达水平。结果显示:熊果苷处理能显著促进MC3T3 E1细胞增殖,增加S期细胞比例;提高MC3T3 E1细胞ALP活性和COL1A1、BGLAP、SP7 mRNA表达水平;显著升高RUNX2、cats的mRNA和蛋白表达水平。研究结果表明熊果苷能够促进MC3T3 E1细胞的增殖和分化。
LYU等[36]研究了熊果苷在高糖诱导的人肾皮质近曲小管上皮细胞(human kidnBJ proximal tubular epithelial cells,HK-2细胞)凋亡和自噬中的作用。采用葡萄糖和熊果苷处理HK-2细胞后,检测细胞存活率及葡萄糖和熊果苷处理后HK-2细胞凋亡及相关蛋白水平。研究了microRNA (miR-27a)在高糖和熊果苷共同处理的HK-2细胞中的表达。转染miR-27a 抑制剂后,研究miR-27a对熊果苷影响细胞凋亡和自噬的影响,并检测c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)和哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)通路。
研究结果表明,熊果苷可减轻高糖诱导的HK-2细胞的凋亡、自噬及调节相关蛋白水平。在高糖和熊果苷共同处理的HK-2细胞中,随着熊果苷浓度的增加,MiR-27a表达加速,抑制miR-27a可以明显消除熊果苷在高糖诱导的HK-2细胞凋亡和自噬中的作用,并且熊果苷可以通过调控miR-27a阻断JNK和mTOR通路。以上研究显示,熊果苷通过调节miR-27a/JNK/mTOR轴,减轻了高糖诱导的HK-2细胞的凋亡和自噬,为熊果苷在糖尿病肾病中的应用提供了实验依据。
SUBRAMANIAN等[37]研究了熊果苷对盐酸异丙肾上腺素(isoprenaline, ISO)诱导的H9c2心原细胞毒性心脏保护作用的可能机制。研究结果表明,预给熊果苷能显著改善异氧诱导的H9c2细胞线粒体膜电位的变化,明显抑制异氧诱导的细胞形态毒性作用,恢复线粒体功能,并呈剂量依赖性地增加活细胞数量,保护细胞免受异氧诱导的损伤。
ZHAO等[38]研究发现在熊果苷和H2O2处理的细胞中,熊果苷可调节视网膜神经节细胞的microRNA-29a (miR-29a)表达增加,阻断MEK/ERK和p38MAPK信号通路,通过促进细胞活力、减少细胞凋亡、调节细胞生长相关因子蛋白水平,显著减轻H2O2诱导的视神经氧化损伤。
抗氧化剂能有效地对抗氧化应激造成的损害。董钦等[39]采用体外培养人脐静脉内皮细胞进行研究,结果表明,当细胞被H2O2损伤时,熊果苷可以增加细胞生存能力,改善细胞能量代谢,使细胞免受ROS损害。报告证实,熊果苷可以抵御H2O2所致的人脐静脉内皮细胞氧化应激损伤。
ZHOU等[40]研究了熊果苷对秀丽隐杆线虫的影响,结果表明,优选的最佳浓度熊果苷可以延长寿命,增强抗氧化能力。这些作用的潜在分子机制包括ROS水平降低、daf-16的核定位改善以及daf-16及其下游靶点表达上调。结果表明,熊果苷可以作为维持整体健康的抗氧化剂。
熊果苷作为抗氧化剂,可以降低氧化水平参数,包括脂质过氧化标记物、亚硝酸盐、蛋白羰基和铁还原抗氧化能力水平;提高SOD与谷胱甘肽过氧化物酶活力,减少氧化应激和亚硝化应激,同时降低MDA的含量;使ROS水平降低,增强抗氧化状态。熊果苷的抗氧化作用可以应用于神经系统、心血管系统和免疫系统等,维护身体整体健康。
张永刚等[41]制成脑缺血再灌注损伤模型,检测脑组织中SOD活性、MDA含量及谷胱甘肽过氧化物酶活性的变化。研究发现,熊果苷能显著提高小鼠脑组织内SOD与谷胱甘肽过氧化物酶活力,同时降低MDA的含量,降低组织内脂质过氧化水平。进而说明,熊果苷能通过提高脑组织中内源性的抗氧化体系来提高自身的抗氧化能力,对小鼠缺血再灌注脑损伤起到一定的保护作用[15]。
DASTAN等[42]根据天然产品对治疗阿尔茨海默病有益的理论,研究了熊果苷对链脲佐菌素(streptozocin, STZ)诱导的大鼠神经毒性的保护作用。研究结果发现,通过脑室内注射STZ可导致海马组织的空间记忆损伤和氧化应激标志物水平的升高;相反,STZ注射前给予熊果苷预处理可以改善空间记忆,减少氧化应激和亚硝化应激,血清和海马组织中的MDA和亚硝酸盐含量显著下降。此外,在接受熊果苷的动物中,观察到海马组织的铁还原抗氧化能力水平增加,但熊果苷在动物体内的蛋白质羰基含量没有降低。研究结果表明,熊果苷对脑内STZ诱导的记忆损伤和海马组织氧化损伤具有一定的保护作用,熊果苷的神经保护作用可能是通过其抗氧化和清除自由基的作用介导的。
DADGAR等[43],根据熊果苷抗氧化和清除自由基的作用,研究了熊果苷对1-甲基-4-苯基-1,2,3,6-四氢吡啶(pyridine,1,2,3,6-tetrahydro-1-methyl-4-phenylpyridine, MPTP)诱发帕金森病(parkinson′s disease, PD)动物模型的行为障碍、氧化应激和亚硝化应激的影响。结果显示,熊果苷处理降低了PD小鼠氧化水平的参数,包括脂质过氧化标记物、亚硝酸盐、蛋白羰基和铁还原抗氧化能力水平。实验表明,熊果苷治疗改善了MPTP诱导的PD模型的运动功能,其可以减轻帕金森病动物模型的行为损伤和氧化应激。
NALBAN等[44]研究了熊果苷对ISO诱导的小鼠心肌肥厚的影响。实验将小鼠熊果苷预处理一周,ISO给予10 d后处死。测定血清中肌酸酐激酶和乳酸脱氢酶等心脏损伤标志物浓度,发现熊果苷显著地抑制了促炎细胞因子,并且增强了心肌抗氧化状态。研究表明,熊果苷预处理对异氧诱导的小鼠心肌肥厚具有明显的保护作用。因此,熊果苷可以作为潜在的药物,干预治疗心肌肥厚。
环孢素A(ciclosporin A, CsA)是一种有效的免疫抑制剂,具有治疗和毒性作用,但CsA的使用受到其毒性的限制。一些研究者提出氧化应激可能在CsA诱导的毒性中发挥重要作用,熊果苷具有抗氧化和清除自由基的能力,所以KHADIR等[45]研究探讨了熊果苷对CsA治疗大鼠血清脂质过氧化和抗氧化能力的影响。研究控制不同的CsA及熊果苷的含量,测定血清脂质过氧化反应,并测定血清总抗氧化能力,即血浆铁还原能力。结果显示,熊果苷对CsA诱导的毒性有保护作用,但高浓度熊果苷对CsA诱导的毒性有显著的氧化和脂质过氧化作用。
熊果苷在祛除色素、抗氧化、抗炎、抗菌、镇咳平喘、抗癌等方面具有优异的性能,在其他方面也有其自身的特点,例如,能够减少粪肠杆菌生物膜在导尿管表面的形成[46]、可抑制黄瓜角叶斑病且无细胞毒性更为安全[47-48]等。并且,在临床中也有一定的应用和人群研究。ANGELO等[49]评估了一种含有薯果苷、香豆素和熊果苷的名为Linfadren的产品以及复杂的减充血疗法(complex decongestive therapy, CDT)对乳腺癌相关淋巴水肿(breast cancer-related lymphedema, BCRL)患者的疗效和安全性。方法选取了50例BCRL门诊患者(年龄28~71岁)作为研究对象,随机接受CDT治疗。结果证实,这种含有薯果苷、香豆素和熊果苷的产品联合CDT是一种安全有效减少BCRL的治疗方法,疗效优于单纯CDT。
但需要注意的是,以上研究文献在熊果苷的使用上,虽然没有明确指出是哪一种熊果苷,但从实验材料的来源分析,多为β-熊果苷。现有的化学合成法及通过植物资源提取或离体培养转化的也以β-熊果苷为主。同时,合成的β-熊果苷在化妆品行业应用广泛,但有研究认为用量过大可能存在一定的安全隐患。
α-熊果苷是一种高价值糖苷,在化妆品和制药行业具有广阔的应用前景[50]。有实验证实α-熊果苷比β-熊果苷对小鼠黑素瘤酪氨酸酶活性抑制更强效,且α-熊果苷具有更高的安全性[36,51]。但目前,α-熊果苷的获取成本较高,常通过微生物转化法和酶转化法[52]定向合成,化学合成尚未能提供高效立体专一性的合成方法。并且,关于α-熊果苷药理学研究的报道还十分少见。因此究竟 α-熊果苷和 β-熊果苷是否具有同等药理作用,或是各有不同,需区别对待,这有待于药理学工作者进一步的研究。
熊果苷在化妆品、药品的应用方面发展迅速,但其应用于食品中的安全性研究较为薄弱,食用时的限制性、品种来源的复杂性等问题都尚待解决。我国是药食同源的发源地,随着人们保健意识的增强,既能调整身体亚健康状态又能增加食物风味的药食同源食品正迅速发展。我国具有得天独厚的地理优势、资源优势、科研优势和人才优势,随着研究的进行,新剂型、新技术也将为熊果苷的制备、合成及在食品、保健品、药品、化妆品中的应用提供更广阔的思路。
[1] 祝上宾, 王英飒, 敬凡尘, 等.熊果苷磷脂复合物的制备、表征及理化性质研究 [J].中草药, 2020, 51(22):5 698-5 704.
ZHU S B, WANG Y S, JING F C, et al.Preparation, characterization and physicochemical properties of arbutin phospholipid complex [J].Chinese Traditional and Herbal Drugs, 2020, 51(22):5 698-5 704.
[2] 刘德文, 马伟, 齐会娟, 等.笃斯越橘、红豆越橘和细叶杜香中β-熊果苷含量的测定 [J].特种经济动植物, 2019, 22(7):24-25.
LIU D W, MA W, QI H J, et al.Determination of β-arbutin content in cranberry, cranberry and dulcet [J].Special Economic Animal and Plant, 2019, 22(7):24-25.
[3] SHANG Y, WEI W P, ZHANG P, et al.Engineering Yarrowia lipolytica for enhanced production of arbutin [J].Journal of Agricultural and Food Chemistry, 2020.
[4] ZHOU H Y, ZHAO J, LI A T, et al.Chemical and biocatalytic routes to arbutin[J].Molecules (Basel, Switzerland), 2019, 24(18):3 303.
[5] SHANG Y, WEI W P, ZHANG P, et al.Engineering Yarrowia lipolytica for enhanced production of arbutin [J].Journal of Agricultural and Food Chemistry, 2020, 68(5):1 364-1 372.
[6] HINCHA D K, OLIVER A E, CROWE J H.Lipid composition determines the effects of arbutin on the stability of membranes [J].Biophysical Journal, 1999, 77(4):2 024-2 034.
[7] 刘彩云, 吴培诚, 梁高卫, 等.3种熊果苷的研究进展 [J].日用化学工业, 2015, 45(9):529-532.
LIU C Y, WU P C, LIANG G W, et al.Research progress of three kinds of arbutin [J].China Detergent & Chemical Industry, 2015, 45(9):529-532.
[8] Arbutin suppresses osteosarcoma progression via miR-338-3p/MTHFD1L and inactivation of the AKT/mTOR pathway [J].FEBS Open Bio, 2021,11(1):289-299.
[9] PARK J J, HWANG S J, KANG Y S, et al.Synthesis of Arbutin-gold nanoparticle complexes and their enhanced performance for whitening [J].Archives of Pharmacal Research, 2019, 42(11):977-989.
[10] EBADOLLAHI S, POURAMIR M, ZABIHI E, et al.The effect of arbutin on expression of tumor suppressor p53, bax/ bcl-2 ratio and oxidative stress induced by tert-butyl hydroperoxide in fibroblast and lncap cell lines [J].Cell Journal, 2020, 22(4):532-541.
[11] LYU L, ZHANG J, TIAN F Q, et al.Arbutin protects HK-2 cells against high glucose-induced apoptosis and autophagy by up-regulating microRNA-27a [J].Artificial Cells, Nanomedicine, and Biotechnology, 2019, 47(1):2 940-2 947.
[12] 杨勇. 美白剂复配对改善皮肤色素沉积的探索 [J].福建轻纺, 2020(7):43-46.
YANG Y.Exploration of whitening agent combination to improve skin pigment deposition [J].The Light & Textile Industries of Fujian, 2020(7):43-46.
[13] 陆彬, 楼鸳鸯, 陈楚楚, 等.熊果苷抑制斑马鱼胚胎黑色素合成的研究 [J].湖南科技大学学报(自然科学版), 2015, 30(1):116-120.
LU B, LOU Y Y, CHEN C C, et al.Inhibition of melanin synthesis in zebrafish embryos by arbutin [J].Journal of Hunan University of Science & Technology(Natural Science Edition), 2015, 30(1):116-120.
[14] 何盾, 吴芳兰, 徐晓芃, 等.熊果苷对黄褐斑鼠模型治疗效果及机制研究 [J].中国现代医学杂志, 2018, 28(34):6-10.
HE D, WU F L, XU X P, et al.Study on therapeutic effect and mechanism of arbutin on chloasma mouse model [J].China Journal of Modern Medicine, 2018, 28(34):6-10.
[15] 唐婕妤, 彭菲.熊果苷的药理作用与资源获取途径研究进展 [J].今日药学, 2015, 2(9):673-677.
TANG J Y, PENG F.Advances in pharmacological effects of arbutin and access to resources [J].Pharmacy Today, 2015, 2(9):673-677.
[16] 郭静, 徐平, 金立元.熊果苷的研究进展 [J].宁夏医学杂志, 2008, 30(3):281-283.
GUO J, XU P, JIN L Y.Research progress of arbutin [J].Ningxia Medical Journal, 2008, 30(3):281-283.
[17] 郑肖莹. 欧洲国家的植物药研究应用近况(待续)——治疗肾、尿道、前列腺疾病的草药 [J].中成药, 1998, 20(7):3-5.
ZHENG X Y.Research and application of herbal medicine in European countries (to be continued)——herbal medicine for the treatment of diseases of kidney, urethra and prostate [J].Chinese Traditional Patent Medicine, 1998, 20(7):3-5.
[18] YE J, GUAN M, LU Y, et al.Arbutin attenuates LPS-induced lung injury via Sirt1/ Nrf2/ NF-κBp65 pathway [J].Pulmonary Pharmacology & Therapeutics, 2019, 54:53-59.
[19] 王佩, 赖瑛, 吴锡铭.熊果苷抗炎作用的研究 [J].中华中医药学刊, 2008, 26(9):1 933-1 935.
WANG P, LAI Y, WU X M.Study on anti - inflammatory effect of arbutin [J].Chinese Archives of Traditional Chinese Medicine, 2008, 26(9):1 933-1 935.
[20] KAJIWARA R, SETO A, KOFUJITA H, et al.Enhanced antimicrobial activities of polymerized arbutin and its derivatives prepared by oxidative polymerization of arbutin[J].Reactive & Functional Polymers, 2019, 138:39-45.
[21] 张乐, 姜艳艳, 钟昆芮, 等.熊果苷的应用及检测研究进展[C].// 中华中医药学会中药化学分会第九届学术年会论文集(第一册).北京:中华中医药学会, 2014:9.
ZHANG L, JINAG Y Y, ZHONG K R, et al.Progress in the application and detection of arbutin[C].Proceedings of the 9th Annual Conference of Chemistry of Traditional Chinese Medicine Branch of China Association of Traditional Chinese Medicine (Volume 1).Beijing:China Association of Traditional Chinese Medicine, 2014:9.
[22] JANA P, RADOM R N, KL
R N, KL RA S, et al.Arbutin and decrease of potentially toxic substances generated in human blood neutrophils [J].Interdiplinary Toxicology, 2014, 7(4):195-200.
RA S, et al.Arbutin and decrease of potentially toxic substances generated in human blood neutrophils [J].Interdiplinary Toxicology, 2014, 7(4):195-200.
[23] 张恩户, 于妮娜, 刘敏, 等.女贞叶提取物及其成分熊果苷祛痰、镇咳作用的实验研究 [J].江苏中医药, 2005, 26(11):69-70.
ZHANG E H, YU N N, LIU M, et al.Experimental study on expectorant and antitussive effects of extract from privet leaf and its constituent arbutin [J].Jiangsu Journal of Traditional Chinese Medicine, 2005, 26(11):69-70.
[24] 郑晓珂, 毕跃峰, 冯卫生, 等.卷柏化学成分研究 [J].药学学报, 2004, 39(4):266-268.
ZHENG X K, BI Y F, FENG W S, et al.Study on the chemical constituents of Cyprinus scrolls[J].Acta Pharmaceutica Sinica, 2004, 39(4):266-268.
[25] 王亚芳, 周宇辉, 张建军.熊果苷镇咳、祛痰及平喘的药效学研究 [J].中草药, 2003, 34(8):739-741.
WANG Y F, ZHOU Y H, ZHANG J J, et al.Pharmacodynamics of arbutin in antitussive, expectorant and antiasthmatic effects [J].Chinese Traditional and Herbal Drugs, 2003, 34(8):739-741.
[26] HAJAR S, EBRAHIM Z, MAHDI P, et al.Decrease of intracellular ROS by arbutin is associated with apoptosis induction and downregulation of IL-1β and TNF-α in LNCaP;prostate cancer [J].Journal of Food Biochemistry, 2020, 44(9):e13360.
[27] JIANG L, WANG D, ZHANG Y, et al.Investigation of the pro-apoptotic effects of arbutin and its acetylated derivative on murine melanoma cells [J].International Journal of Molecular Medicine, 2018, 41(2):1 048-1 054.
[28] 郭锦辉, 高卫芳, 邓智建.熊果苷对膀胱癌EJ-1细胞增殖的影响及其机制研究 [J].广州中医药大学学报, 2019, 36(7):1 069-1 073.
GUO J H, GAO W F, DENG Z J.Effect of arbutin on proliferation of bladder cancer EJ-1 cells and its mechanism [J].Journal of Guangzhou University of Traditional Chinese Medicine, 2019, 36(7):1 069-1 073.
[29] WANG C Q, WANG X M, LI B L, et al.Arbutin suppresses osteosarcoma progression via miR-338-3p/MTHFD1L and inactivation of the AKT/mTOR pathway [J].FEBS Open Bio, 2020, 11(1):289-299.
[30] 李佳, 吕雪莲, 秦新新, 等.熊果苷抑制胰腺癌细胞生长及好氧糖酵解的研究 [J].中国临床药理学杂志, 2020, 36(19):3 070-3 074.
LI J, LYU X L, QIN X X, et al.Inhibitory effect of arbutin on growth and aerobic glycolysis of pancreatic cancer cells [J].The Chinese Journal of Clinical Pharmacology, 2020, 36(19):3 070-3 074.
[31] NADI S, MONFARED A S, MOZDARANI H, et al.Effects of arbutin on radiation-induced micronuclei in mice bone marrow cells and its definite dose reduction factor [J].Iranian Journal of Medical Sciences, 2016, 41(3):180-185.
[32] NADI S, ELAHI M, MORADI S, et al.Radioprotective effect of arbutin in megavoltage therapeutic X-irradiated mice using liver enzymes assessment[J].Journal of Biomedical Physics & Engineering, 2019, 9(5):533-540.
[33] ROSA S C, GONÇALVES J, JUDAS F, et al.Assessment of strategies to increase chondrocyte viability in cryopreserved human osteochondral allografts:Evaluation of the glycosylated hydroquinone, arbutin [J].Osteoarthritis and Cartilage, 2009, 17(12):1 657-1 661.
[34] ABOAGLA M E, MAEDA T.Arbutin′s suppression of cryodamage in goat sperm and its mechanism of cryoprotection [J].Theriogenology, 2011, 76(3):538-546.
[35] MAN X, YANG L, LIU S, et al.Arbutin promotes MC3T3E1 mouse osteoblast precursor cell proliferation and differentiation via the Wnt/βcatenin signaling pathway [J].Molecular Medicine Reports, 2019, 19(6):4 637-4 644.
[36] LYU L, ZHANG J, TIAN F, et al.Arbutin protects HK-2 cells against high glucose-inducedapoptosis and autophagy by up-regulating microRNA-27a [J].Artificial Cells, 2019, 47(1):2 940-2 947.
[37] SUBRAMANIAN S, LOORDHURANI A, LAKSHMANAN V, et al.Preventive effect of arbutin on isoproterenol-induced oxidative stress, mitochondrial damage and apoptosis in H9c2 cells [J].International Journal of Nutrition, Pharmacology, Neurological Diseases, 2019, 9(3):97-104.
[38] ZHAO W B, WANG S, QIN T Y, et al.Arbutin attenuates hydrogen peroxide-induced oxidative injury through regulation of microRNA-29a in retinal ganglion cells [J].Biomedicine & Pharmacotherapy, 2019, 112:1-8.
[39] 董钦, 张春晶, 周宏博, 等.熊果苷拮抗H2O2损伤的研究(英文) [J].哈尔滨医科大学学报, 2005, 38(2):142-144.
DONG Q, ZHANG C J, ZHOU H B, et al.Study on the antagonistic effect of arbutin on H2O2 damage[J].Journal of Harbin Medical University, 2005, 38(2):142-144.
[40] ZHOU L, FU X, JIANG L, et al.Arbutin increases Caenorhabditis elegans longevity and stress resistance [J].PeerJ, 2017, 5(12):e4170.
[41] 张永刚, 蒋淑丽, 任志明, 等.熊果苷对小鼠脑缺血再灌注损伤的影响 [J].现代生物医学进展, 2014, 14(8):1 464-1 466.
ZHANG Y G, JIANG S L, REN Z M, et al.Effect of arbutin on cerebral ischemia reperfusion injury in rats [J].Progress in Modern Biomedicine, 2014, 14(8):1 464-1 466.
[42] DASTAN Z, POURAMIR M, GHASEMI K M, et al.Arbutin reduces cognitive deficit and oxidative stress in animal model of Alzheimer′s disease [J].The International Journal of Neuroscience, 2019, 129(11):1 145-1 153.
[43] DADGAR M, POURAMIR M, DASTAN Z, et al.Arbutin attenuates behavioral impairment and oxidative stress in an animal model of Parkinson′s disease [J].Avicenna Journal of Phytomedicine, 2018, 8(6):533-542.
[44] NALBAN N, SANGARAJU R, ALAVALA S, et al.Arbutin attenuates isoproterenol-induced cardiac hypertrophy by inhibiting TLR-4/NF-κB pathway in mice [J].Cardiovascular Toxicology, 2019, 20(6):235-248.
[45] KHADIR F, POURAMIR M, JOORSARAEE S G, et al.The effect of arbutin on lipid peroxidation and antioxidant capacity in the serum of cyclosporine-treated rats [J].Caspian Journal of Internal Medicine, 2015, 6(4):196-200.
[46] TOMMASO C, LUCA G, FRANCESCA M, et al.The efficacy of umbelliferone, arbutin, and N-acetylcysteine to prevent microbial colonization and biofilm development on urinary catheter surface:Results from a preliminary study[J].Journal of Pathogens, 2016:1590952-1590957.
[47] ![]() E, WIELANEK M, CHWATKO G, et al.Salicylic acid and cysteine contribute to arbutin-induced alleviation of angular leaf spot disease development in cucumber [J].Journal of Plant Physiology, 2015, 181:9-13.
E, WIELANEK M, CHWATKO G, et al.Salicylic acid and cysteine contribute to arbutin-induced alleviation of angular leaf spot disease development in cucumber [J].Journal of Plant Physiology, 2015, 181:9-13.
[48] SK ODOWSKA M, NALIWAJSKI M, WIELANEK M, et al.Arbutin- and benzotiadiazole-mediated cucumber response to Pseudomonas syringae pv. lachrymans infection in cArbohydrate metabolism [J].Scientia Horticulturae, 2015, 192:200-210.
ODOWSKA M, NALIWAJSKI M, WIELANEK M, et al.Arbutin- and benzotiadiazole-mediated cucumber response to Pseudomonas syringae pv. lachrymans infection in cArbohydrate metabolism [J].Scientia Horticulturae, 2015, 192:200-210.
[49] ANGELO C, ROSA P, MARINA B, et al.Effectiveness and safety of a product containing diosmin, coumarin, and arbutin (Linfadren®) in addition to complex decongestive therapy on management of breast cancer-related lymphedema [J].Supportive Care in Cancer, 2019, 27(4):1 471-1 480.
[50] 沈洋, 吕雪芹, 林璐, 等.蔗糖磷酸化酶的半理性设计及生产α-熊果苷的条件优化 [J].食品与发酵工业, 2020, 46(13):1-9.
SHEN Y, LYU X Q, LIN L, et al.Semi-rational design of sucrose phosphorylase and optimization of production conditions for α-arbutin [J].Food and Fermentation Industries, 2020, 46(13):1-9.
[51] 王晓芊. 熊果苷的潮起潮落——解析美白成分熊果苷 [J].中国化妆品, 2019(10):85-87.
WANG X Q.The ebb and flow of arbutin—analysis of whitening component arbutin [J].China Cosmetics Review, 2019(10):85-87.
[52] 沈洋. 蔗糖磷酸化酶的克隆表达及生物转化制备α-熊果苷的研究 [D].无锡:江南大学, 2020:68.
SHEN Y.Cloning and expression of sucrose phosphorylase and preparation of α-arbutin by biotransformation [D].Wuxi:Jiangnan University, 2020:68.