宰后不同部位牛肉保水性变化和蛋白质特性研究
左惠心,温彬,罗欣,朱立贤*,牛乐宝,张一敏,毛衍伟
(山东农业大学 食品科学与工程学院,山东 泰安,271018)
摘 要 为探究宰后不同部位牛肉保水性存在差异的原因,该研究以成熟1、2、3、5和7 d的冷却牛背最长肌、半膜肌和腰大肌作为研究对象,通过对失水率、蛋白质化学作用力以及蛋白质稳定性的变化和差异进行分析,阐述3种部位冷却牛肉成熟过程中保水性及蛋白质特性变化。结果表明,在成熟前5 d离子键作用力变化不显著(P> 0.05),成熟第7天显著升高(P< 0.05);3种部位中,氢键和疏水性相互作用力在成熟过程中的变化不同,且不同部位之间的差异也不相同。但在较长的成熟时间内,3种部位牛肉的离子键、氢键和疏水性相互作用力差异不大。差示扫描量热法结果显示,成熟期间腰大肌的TmaxpeakI由55.03 ℃显著降低至54.14 ℃(P<0.05),TmaxpeakII的均值为63.56 ℃,腰大肌的焓变值DHpeakI和DHpeakII具有相同趋势,均显著低于背最长肌和半膜肌(P<0.05),表明腰大肌蛋白质更易发生变性,且肌球蛋白和肌浆蛋白的蛋白质变性程度更高。蛋白质变性程度不同可能是导致不同部位牛肉保水性存在差异的原因。
关键词 冷却牛肉;不同部位肉;保水性;化学作用力;蛋白质稳定性
DOI:10.13995/j.cnki.11-1802/ts.027663
引用格式:左惠心,温彬,罗欣,等.宰后不同部位牛肉保水性变化和蛋白质特性研究[J].食品与发酵工业,2022,48(2):45-51.ZUO Huixin,WEN Bin,LUO Xin, et al.Water-holding capacity and protein properties analysis in different parts of chilled beef during postmortem aging[J].Food and Fermentation Industries,2022,48(2):45-51.
第一作者:博士,讲师(朱立贤教授为通信作者,E-mail:zhlx@sdau.edu.cn)
基金项目:国家自然科学基金青年基金项目(31801610);国家自然科学基金面上基金项目(32072239);国家肉牛牦牛产业技术体系项目(CARS-37)
收稿日期:2021-04-08,改回日期:2021-04-24
保水性(water-holding capacity,WHC)是指肌肉保持其原有水分与添加水分的能力[1],牛肉保水性的大小与嫩度、风味、多汁性和营养价值等食用品质密切相关[2]。在屠宰、加工、贮藏和运输过程中,牛肉中的汁液会不可避免地发生损失,流失的汁液在很大程度上影响了肉品品质、造成经济损失[3-4]。对于生鲜肉和肉品加工行业来说,保水性是当今最重要的肉品品质之一[5]。研究表明,不同部位牛肉的保水性存在差异[6],但不同部位牛肉保水性存在差异的原因尚不明确。近年来,小包装分割冷鲜肉销量逐年上升,人们更加关注畜禽肉不同部位之间食用品质的差异[7]。因此,研究不同部位肌肉保水性的变化规律及其差异因素,不仅具有重要的理论价值,而且具有重要的经济意义。
研究表明,肉品保水性受蛋白质空间结构的变化、肌球蛋白和肌动蛋白丝间净电荷作用的影响[8-9]。SCH FER等[10]指出,细胞骨架蛋白在肉品成熟过程中结构变化会引起细胞形态以及肉品保水性的改变。LAWSON等[11]研究表明连接细胞骨架和胞外基质的整合素蛋白对猪肉中汁液流失通道的形成至关重要。ZHANG等[12]也有类似的研究结果,其研究发现肌间线蛋白的完整性、整合素蛋白的降解、μ-钙蛋白酶含量与宰后猪肉的保水性变化有关。这些研究说明肌纤维结构变化、水分溢出、汁液流失通道等与汁液损失有重要联系,可以解释大部分汁液流失现象。然而,这些研究并不能对肉的保水性提供完整的解释,也无法直接证明是否是蛋白质的降解导致肉中水分的流失。LI等[13]运用差示扫描量热仪(differential scanning calorimetry,DSC)研究了冷却猪肉在成熟过程中保水性变化与蛋白质变化的关系,结果表明,在成熟过程中蛋白质发生降解,且与肌浆蛋白变性程度呈显著负相关关系(R=-0.91,P<0.05)。MA等[14]对成熟过程中不同部位肌肉的蛋白水解变化与肉品品质特性进行了相关性分析,结果表明,在成熟过程中,不同部位肌肉的蛋白质水解变化是以其特有的方式发生的,这可能导致成熟过程中不同肌肉的肉质变化速率和程度不同。
FER等[10]指出,细胞骨架蛋白在肉品成熟过程中结构变化会引起细胞形态以及肉品保水性的改变。LAWSON等[11]研究表明连接细胞骨架和胞外基质的整合素蛋白对猪肉中汁液流失通道的形成至关重要。ZHANG等[12]也有类似的研究结果,其研究发现肌间线蛋白的完整性、整合素蛋白的降解、μ-钙蛋白酶含量与宰后猪肉的保水性变化有关。这些研究说明肌纤维结构变化、水分溢出、汁液流失通道等与汁液损失有重要联系,可以解释大部分汁液流失现象。然而,这些研究并不能对肉的保水性提供完整的解释,也无法直接证明是否是蛋白质的降解导致肉中水分的流失。LI等[13]运用差示扫描量热仪(differential scanning calorimetry,DSC)研究了冷却猪肉在成熟过程中保水性变化与蛋白质变化的关系,结果表明,在成熟过程中蛋白质发生降解,且与肌浆蛋白变性程度呈显著负相关关系(R=-0.91,P<0.05)。MA等[14]对成熟过程中不同部位肌肉的蛋白水解变化与肉品品质特性进行了相关性分析,结果表明,在成熟过程中,不同部位肌肉的蛋白质水解变化是以其特有的方式发生的,这可能导致成熟过程中不同肌肉的肉质变化速率和程度不同。
本研究以冷却牛背最长肌、半膜肌和腰大肌作为研究对象,在各成熟时间点采集样本,测定蛋白质化学作用力的变化;并运用DSC测定肌肉蛋白质的变性程度。通过研究蛋白质化学作用力变化和蛋白质热变性规律变化,从蛋白质特性变化的角度分析不同部位牛肉保水性存在差异的原因,以期为全面阐明宰后不同部位牛肉保水性机制提供新视角,为分割牛肉市场价值和加工特性的提高提供理论依据。
1 材料与方法
1.1 材料与试剂
本实验所用牛肉样品采自山东省阳信县某公司,挑选8头体重相近,18~24月龄左右的杂交公牛(鲁西黄牛×西门塔尔牛),按照伊斯兰屠宰方式屠宰,胴体在排酸库冷却成熟24 h后,取左半胴体的背最长肌(第12根胸肋到腰椎末尾)、半膜肌、腰大肌部位,将肉样于4 ℃环境温度下运回实验室,对肉样分割成2.54 cm厚度的牛排并进行托盘包装,进行后续试验。
氯化钠(分析纯),天津市凯通化学试剂有限公司;无水乙醇、磷酸盐缓冲液,国药集团化学试剂有限公司;尿素、Lowry法蛋白定量试剂盒,北京索莱宝科技有限公司。
1.2 仪器与设备
AB104-S分析天平,瑞士Mettler Toledo公司;BD-145HDE冷藏冷冻转换柜,青岛海尔特种电冰柜有限公司;5804R高速冷冻离心机,德国Eppendorf公司;IKA T18匀浆机,艾卡仪器设备有限公司;YYW-2应变控制式无侧限压力仪,南京土壤仪器厂有限公司;SpectraMax M5酶标仪,美国Molecular Devices公司;DSC-200PC差示扫描量热仪,德国NETZSCH公司。
1.3 实验方法
1.3.1 失水率的测定
参照FRANCO等[15]的方法并稍加修改,用取样刀从牛排样品中切取1 cm厚的均匀薄片,平置在洁净的橡皮片上,用直径为2.523 cm的圆形取样器切取中心部肉样,立即用感量为0.001 g的天平称重(m1),并记录,然后放置于铺有18层定性滤纸的压力仪平台上,肉样上方再放18层定性滤纸,加压至35 kg,保持5 min,中间不断调节维持35 kg压力。滤纸的层数可根据样品保水性情况调整,以水分不透出、能够全部吸净为度。撤除压力后,再次称重记为m2。重复3次取平均值。失水率计算如公式(1)所示:
失水率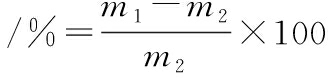
(1)
1.3.2 化学作用力的测定
参照G MEZ-GUILLÉN等[16]和康怀彬等[17]的方法并稍加修改。分别取1.0 g牛肉(除筋腱后)分别与10 mL A、B、C和D 4种溶液混合。A液为0.05 mol/L NaCl,B液为0.6 mol/L NaCl,C液为0.6 mol/L NaCl+1.5 mol/L尿素,D液为0.6 mol/L NaCl+8 mol/L尿素。混合后均质,于4 ℃静置1 h,然后10 000 r/min离心15 min,用Lowry法测定上清液中蛋白质的含量。离子键的作用力以溶解于A与B溶液中蛋白质含量之差来表示;氢键的作用力以溶解于B与C溶液中蛋白质含量之差来表示;疏水性相互作用的作用力以溶解于C与D溶液中蛋白质含量之差来表示。
MEZ-GUILLÉN等[16]和康怀彬等[17]的方法并稍加修改。分别取1.0 g牛肉(除筋腱后)分别与10 mL A、B、C和D 4种溶液混合。A液为0.05 mol/L NaCl,B液为0.6 mol/L NaCl,C液为0.6 mol/L NaCl+1.5 mol/L尿素,D液为0.6 mol/L NaCl+8 mol/L尿素。混合后均质,于4 ℃静置1 h,然后10 000 r/min离心15 min,用Lowry法测定上清液中蛋白质的含量。离子键的作用力以溶解于A与B溶液中蛋白质含量之差来表示;氢键的作用力以溶解于B与C溶液中蛋白质含量之差来表示;疏水性相互作用的作用力以溶解于C与D溶液中蛋白质含量之差来表示。
1.3.3 肌肉蛋白质稳定性分析
参照DENG等[18]和LI等[13]的方法,将冷冻样品(10~15 mg)在-20 ℃的封闭冷冻箱中制备,密封在铝坩埚中并称重。将样品在20 ℃下静置2 min,DSC仪器测定温度为20~100 ℃,升温速率5 ℃/min。用空坩埚作为热分析的参考。使用仪器自带软件进行热图分析,其中确定了显著吸热峰的最高温度Tmaxpeak,并计算热变性焓DHpeak作为峰面积。
1.4 数据分析
数据采用IBM SPSS Statistics 20.0软件以成熟时间、部位为固定因子,采用一般线性模型进行统计分析,用多重比较选择比较主效应因素,采用Orign 2018软件对数据作图。所有结果以平均值±标准误(mean±SE)的形式表示。
2 结果与分析
2.1 不同部位牛肉成熟过程中失水率变化
失水率,即加压损失,反映肌肉中自由水的含量。如表1所示,成熟时间和部位对失水率影响极显著(P<0.01),部位和成熟时间的交互作用对失水率影响显著(P<0.05)。可以看到,在整个成熟期间,半膜肌的失水率显著高于背最长肌和腰大肌(P<0.05),说明腰大肌的保水性显著高于背最长肌和半膜肌(P<0.05)。成熟过程中,不同部位牛肉的失水率呈现先上升后下降趋势(P<0.05),在成熟3 d时达到最大值。
表1 不同部位牛肉成熟过程中失水率变化
Table 1 The rate of pressure loss in different parts of beef during postmortem aging

成熟时间/d失水率/%P值背最长肌半膜肌腰大肌成熟时间部位成熟时间×部位116.61±0.39ey19.04±0.30ex14.53±0.64ez219.30±0.51dy23.49±0.50dx17.67±0.28dz325.63±0.46ay28.31±0.68ax23.78±0.22az<0.01<0.01<0.05524.46±0.50by26.52±0.50bx22.43±0.39bz722.60±0.62cy24.46±0.50cx20.82±0.29cz
注:a~e不同字母表示同一部位不同成熟时间差异达到显著水平(P<0.05),x~z不同字母表示同一成熟时间不同部位差异达到显著水平(P<0.05)
2.2 不同部位牛肉成熟过程中化学作用力的变化
ZHANG等[12]研究发现,牛肉宰后成熟过程中蛋白质会发生降解。ZENG等[19]认为,肌纤维结构蛋白的完整性会对肉品的保水性具有显著影响。离子键、氢键和疏水性相互作用力作为维持蛋白质三级结构的主要作用力,其值的变化可以反映蛋白质的变性程度[20]。
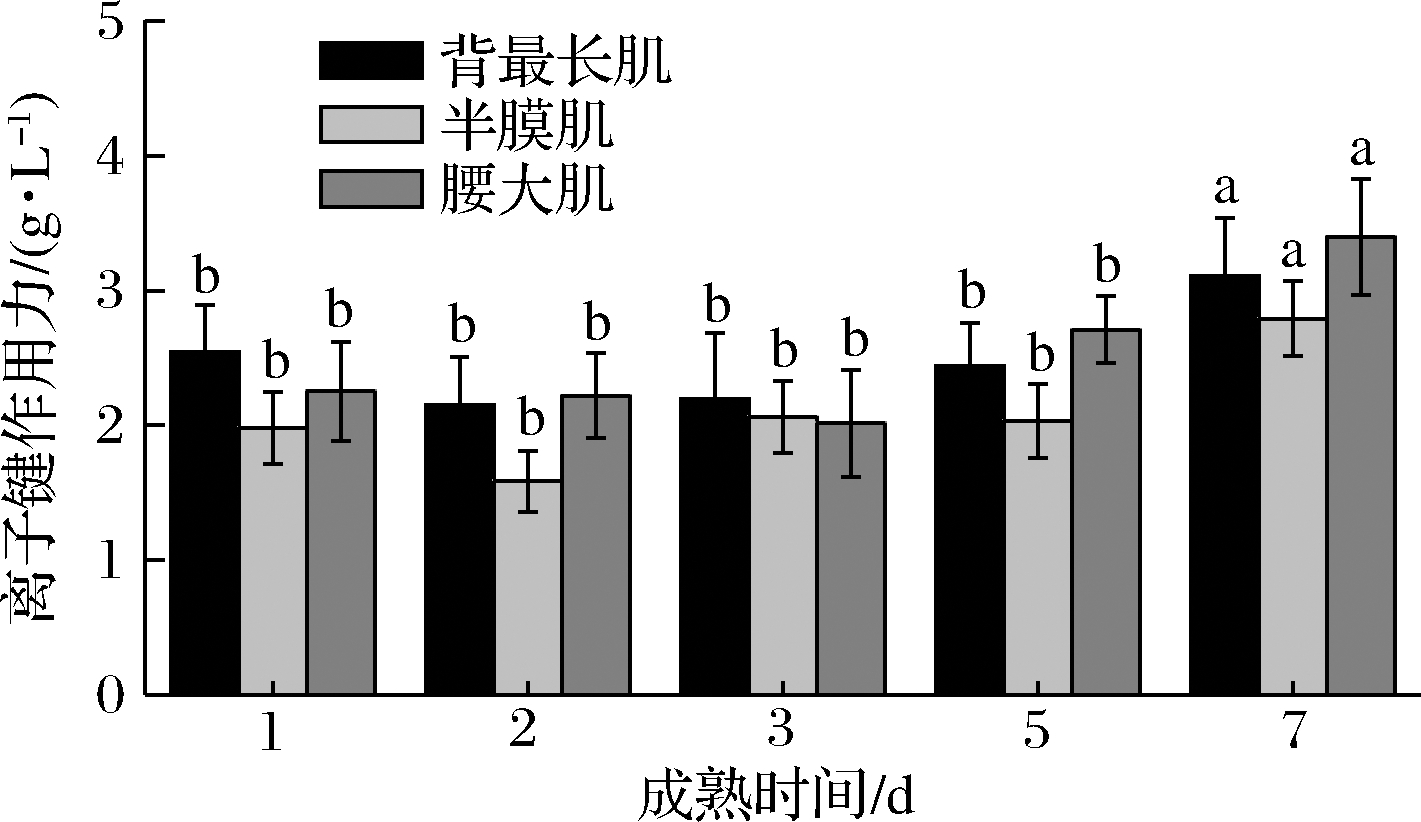
3种部位牛肉在成熟过程中离子键的变化如图1所示,不同部位牛肉之间的离子键作用力均无显著差别(P>0.05),仅成熟时间对离子键作用力影响显著(P<0.05)。在成熟前5 d离子键作用力变化不显著(P>0.05),成熟第7天时显著升高(P<0.05)。
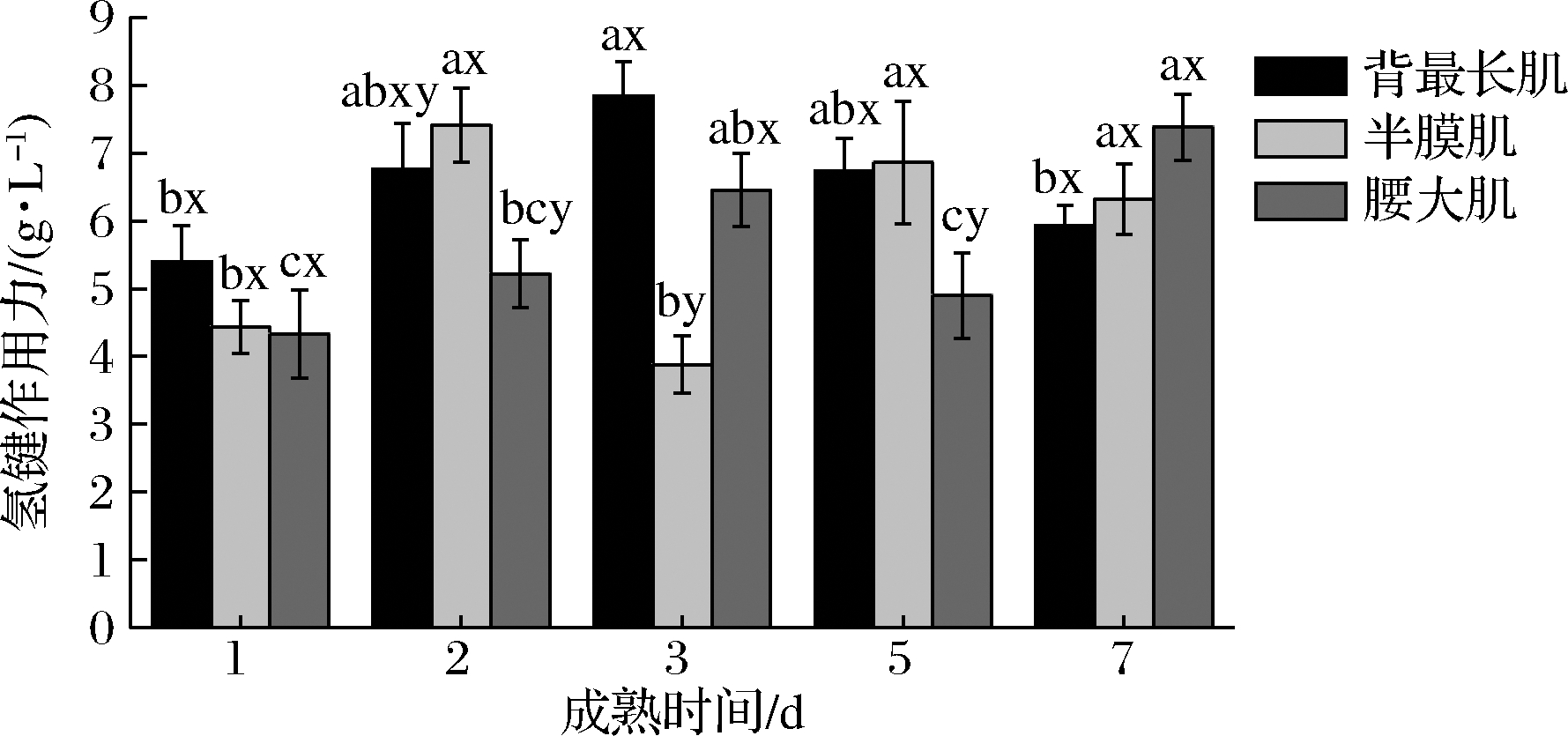
图2表示3种部位牛肉在成熟过程中氢键的变化。对于氢键作用力,部位、成熟时间和其交互作用对氢键作用力影响显著(P<0.05),在整个成熟期间内,背最长肌的氢键作用力1~3 d时显著升高至7.84 mg/mL,在成熟5~7 d时降低至5.93 mg/mL,呈现先升高后降低的趋势(P<0.05),半膜肌和腰大肌的氢键作用力在成熟期间变化较复杂,但整体呈现为显著上升的趋势(P<0.05)。对比不同部位牛肉的氢键作用力,腰大肌的氢键作用力在成熟第2天和第5天时显著低于背最长肌和半膜肌(P<0.05)。
3种部位牛肉在成熟过程中疏水性相互作用力的变化如图3所示。部位和成熟时间的交互作用对疏水性相互作用力影响显著(P<0.05),各部位牛肉疏水性相互作用力在成熟期间的变化各不相同,背最长肌的疏水性相互作用力在成熟第3天降低至2.21 mg/mL后在第7天升高至3.34mg/mL(P<0.05)。半膜肌的疏水性相互作用力在成熟前5 d无显著变化(P> 0.05),在成熟第7天降低至3.66 mg/mL(P<0.05)。腰大肌的疏水性相互作用力在1~3 d时由4.24 mg/mL显著升高至6.91 mg/mL,在3~7 d显著降低至4.66 mg/mL,呈现先升高后降低的趋势(P<0.05)。在成熟前3 d,半膜肌的疏水性相互作用力显著高于或不显著低于背最长肌与腰大肌(P<0.05);成熟3~5 d,各部位的疏水性相互作用力无显著差异,维持在3.34~4.66 mg/mL。综合分析来看,成熟期间3种部位牛肉的化学作用力均发生不同程度的变化(P<0.05),且不同部位牛肉的化学作用力的变化幅度各不相同。
离子键、氢键和疏水性相互作用力作为维持蛋白质三级结构的主要作用力,其值的变化可以反映蛋白质的变性程度[16-17]。综合分析来看,成熟期内3种部位牛肉的化学作用力均发生不同程度的变化(P<0.05),且不同部位牛肉的化学作用力的变化幅度各不相同。康怀彬等[17]分析认为,蛋白质空间结构的改变会导致蛋白质内疏水性基团发生暴露,随着蛋白质的变性,肽段的构象发生变化,同时生成了复杂的结构,进而降低了疏水性相互作用。总体而言,随着蛋白质发生降解、价键被破坏,蛋白质原有的构象发生改变,蛋白质无序程度增加[17]。G MEZ-GUILLÉN等[16]认为,相较于离子键作用力和氢键作用力,疏水性相互作用和二硫键等作用力在维持蛋白质空间结构时起主要作用。有研究表明蛋白分子作用力的变化与保水性具有一定关系。郭兆斌等[21]研究表明,蛋白质表面疏水性反映了蛋白质的水合特性,可以用来评价肌原纤维蛋白构象稳定性对保水性的影响;王静宇等[22]研究表明,肌原纤维蛋白凝胶保水性受氢键、静电相互作用、疏水相互作用和二硫键等相互作用力的影响。在本研究中,成熟期内3种部位牛肉的氢键作用力和疏水性相互作用力的变化和差异各不相同,离子键作用力仅第7天呈现显著升高的趋势(P< 0.05),因此认为不同部位的牛肉蛋白质的化学作用力变化不同,化学作用力不是造成牛肉不同部位之间保水性差异的原因。
MEZ-GUILLÉN等[16]认为,相较于离子键作用力和氢键作用力,疏水性相互作用和二硫键等作用力在维持蛋白质空间结构时起主要作用。有研究表明蛋白分子作用力的变化与保水性具有一定关系。郭兆斌等[21]研究表明,蛋白质表面疏水性反映了蛋白质的水合特性,可以用来评价肌原纤维蛋白构象稳定性对保水性的影响;王静宇等[22]研究表明,肌原纤维蛋白凝胶保水性受氢键、静电相互作用、疏水相互作用和二硫键等相互作用力的影响。在本研究中,成熟期内3种部位牛肉的氢键作用力和疏水性相互作用力的变化和差异各不相同,离子键作用力仅第7天呈现显著升高的趋势(P< 0.05),因此认为不同部位的牛肉蛋白质的化学作用力变化不同,化学作用力不是造成牛肉不同部位之间保水性差异的原因。
2.3 不同部位牛肉成熟过程中蛋白质稳定性的分析
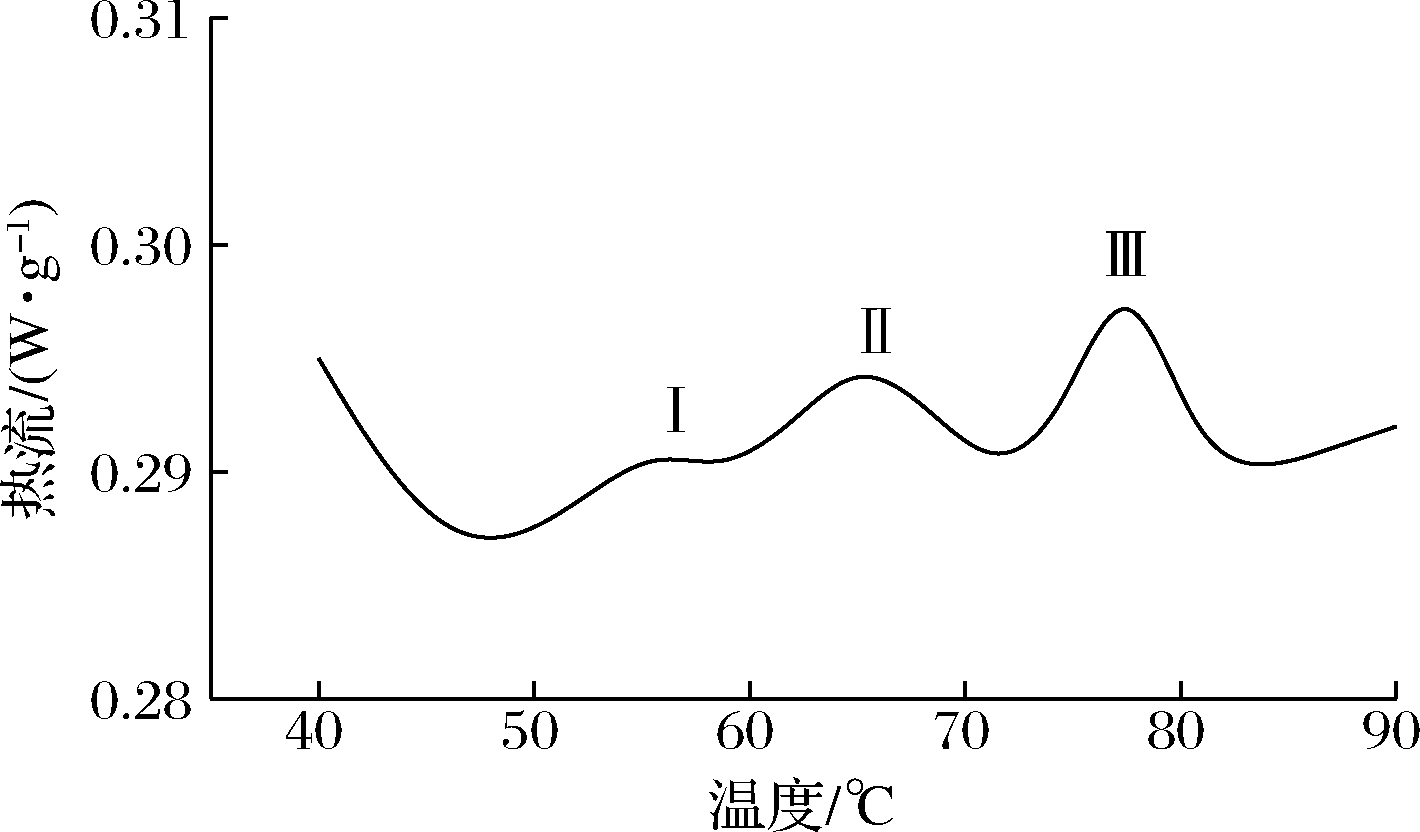
根据1.3.3所述分析方法可得牛肉DSC变化的一般曲线,以此图为例,可以说明牛肉中肌球蛋白、肌动蛋白和肌浆蛋白变性的一般规律(图4)。DENG等[18]的研究表明,DSC热流图中出现的3种峰分别代表了肌球蛋白质头部(峰I)、肌球蛋白尾部和肌浆蛋白(峰II)与肌动蛋白的变化(峰III);峰的顶点温度(Tmaxpeak)为蛋白质的变性温度,反映了蛋白质的稳定性,Tmaxpeak越高,其稳定性越好;各峰的峰面积为蛋白质的变性焓(DHpeak),反映了蛋白质的变性程度,焓值越高,说明蛋白质变性程度越小[13, 18]。
由表2、表3可知,成熟时间与部位的交互作用对肌球蛋白头部的变性温度影响显著(P<0.01),其中背最长肌和半膜肌在整个成熟时间内虽整体下降,但下降不显著(P>0.05),腰大肌呈现显著下降的趋势,由55.03 ℃降低至54.14 ℃(P<0.05)。对于肌球蛋白头部的焓变值DHpeakI,仅成熟时间和部位作用显著(P<0.05),交互作用不显著(P>0.05),其中腰大肌的焓变值(0.14 J/g)显著低于背最长肌(0.15 J/g)与半膜肌(0.16 J/g),说明腰大肌的肌球蛋白头部更容易变性,且随着成熟时间延长,3种部位牛肉DHpeak I的平均值由0.16 J/g降低至0.13 J/g(P<0.05),表明3种部位牛肉的肌球蛋白头部均发生变性。对于Tmaxpeak II及其焓变DHpeak II,其变化趋势与肌球蛋白头部变性的情况相同,总体随成熟时间呈现显著降低的趋势,且腰大肌的变性温度(63.56 ℃)与焓变(0.28 J/g)均显著低于背最长肌(63.94 ℃,0.31 J/g)与半膜肌(63.96 ℃,0.30 J/g),表明腰大肌的肌球蛋白与肌浆蛋白更容易变性。
表2 不同部位牛肉成熟过程中蛋白质变性温度的变化
Table 2 The protein denaturation temperature in different parts of beef during postmortem aging
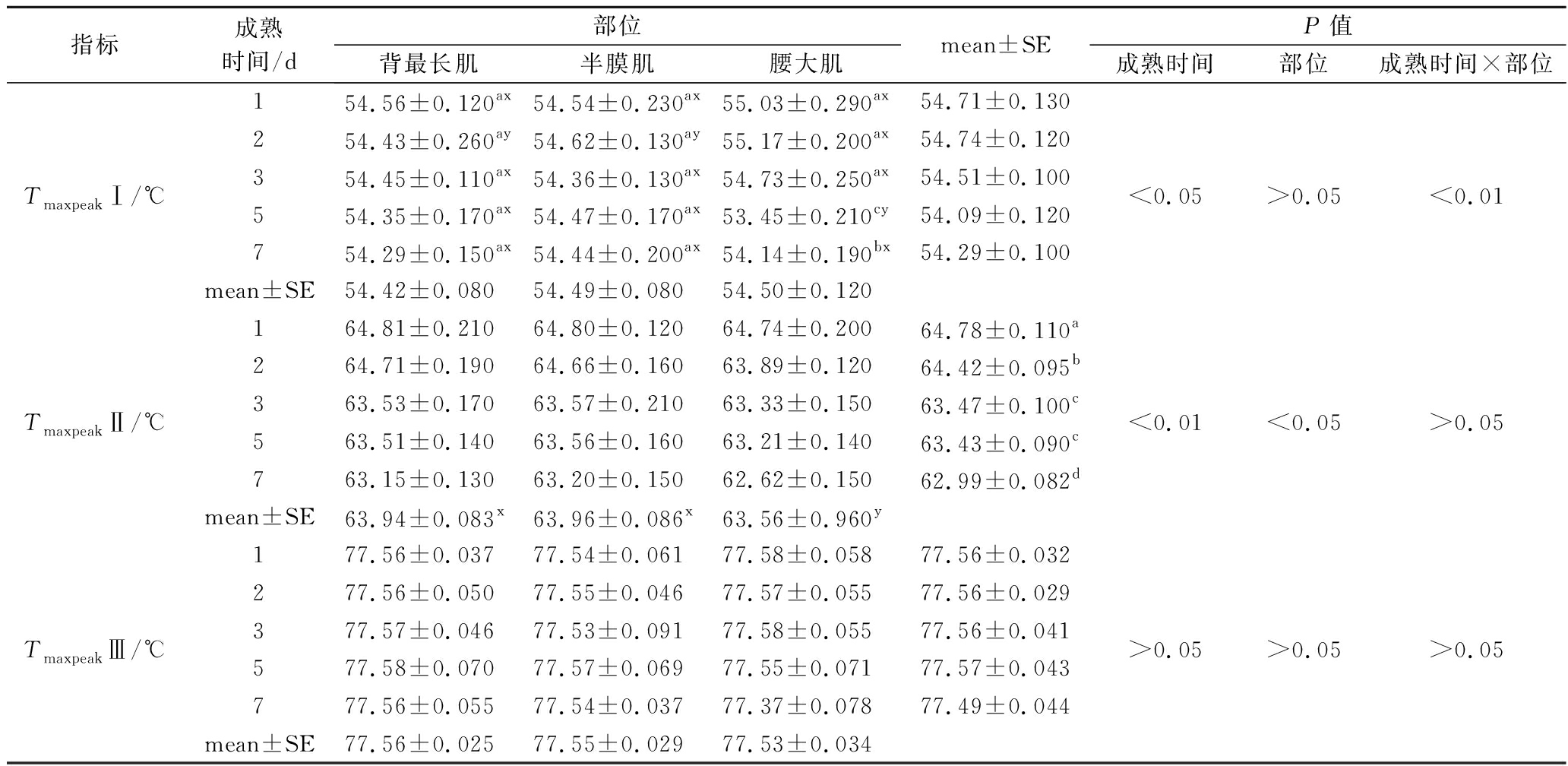
指标成熟时间/d部位mean±SEP值背最长肌半膜肌腰大肌成熟时间部位成熟时间×部位154.56±0.120ax54.54±0.230ax55.03±0.290ax54.71±0.130254.43±0.260ay54.62±0.130ay55.17±0.200ax54.74±0.120Tmaxpeak Ⅰ/℃354.45±0.110ax54.36±0.130ax54.73±0.250ax54.51±0.100<0.05>0.05<0.01554.35±0.170ax54.47±0.170ax53.45±0.210cy54.09±0.120754.29±0.150ax54.44±0.200ax54.14±0.190bx54.29±0.100mean±SE54.42±0.08054.49±0.08054.50±0.120164.81±0.21064.80±0.12064.74±0.20064.78±0.110a264.71±0.19064.66±0.16063.89±0.12064.42±0.095bTmaxpeak Ⅱ/℃363.53±0.17063.57±0.21063.33±0.15063.47±0.100c<0.01<0.05>0.05563.51±0.14063.56±0.16063.21±0.14063.43±0.090c763.15±0.13063.20±0.15062.62±0.15062.99±0.082dmean±SE63.94±0.083x63.96±0.086x63.56±0.960y177.56±0.03777.54±0.06177.58±0.05877.56±0.032277.56±0.05077.55±0.04677.57±0.05577.56±0.029Tmaxpeak Ⅲ/℃377.57±0.04677.53±0.09177.58±0.05577.56±0.041>0.05>0.05>0.05577.58±0.07077.57±0.06977.55±0.07177.57±0.043777.56±0.05577.54±0.03777.37±0.07877.49±0.044mean±SE77.56±0.02577.55±0.02977.53±0.034
注:a~d不同字母表示同一部位不同成熟时间差异显著(P<0.05),x~y不同字母表示同一成熟时间不同部位差异显著(P<0.05)
表3 不同部位牛肉成熟过程中蛋白质变性焓的变化
Table 3 The thermal denaturation enthalpies in different parts of beef during postmortem aging
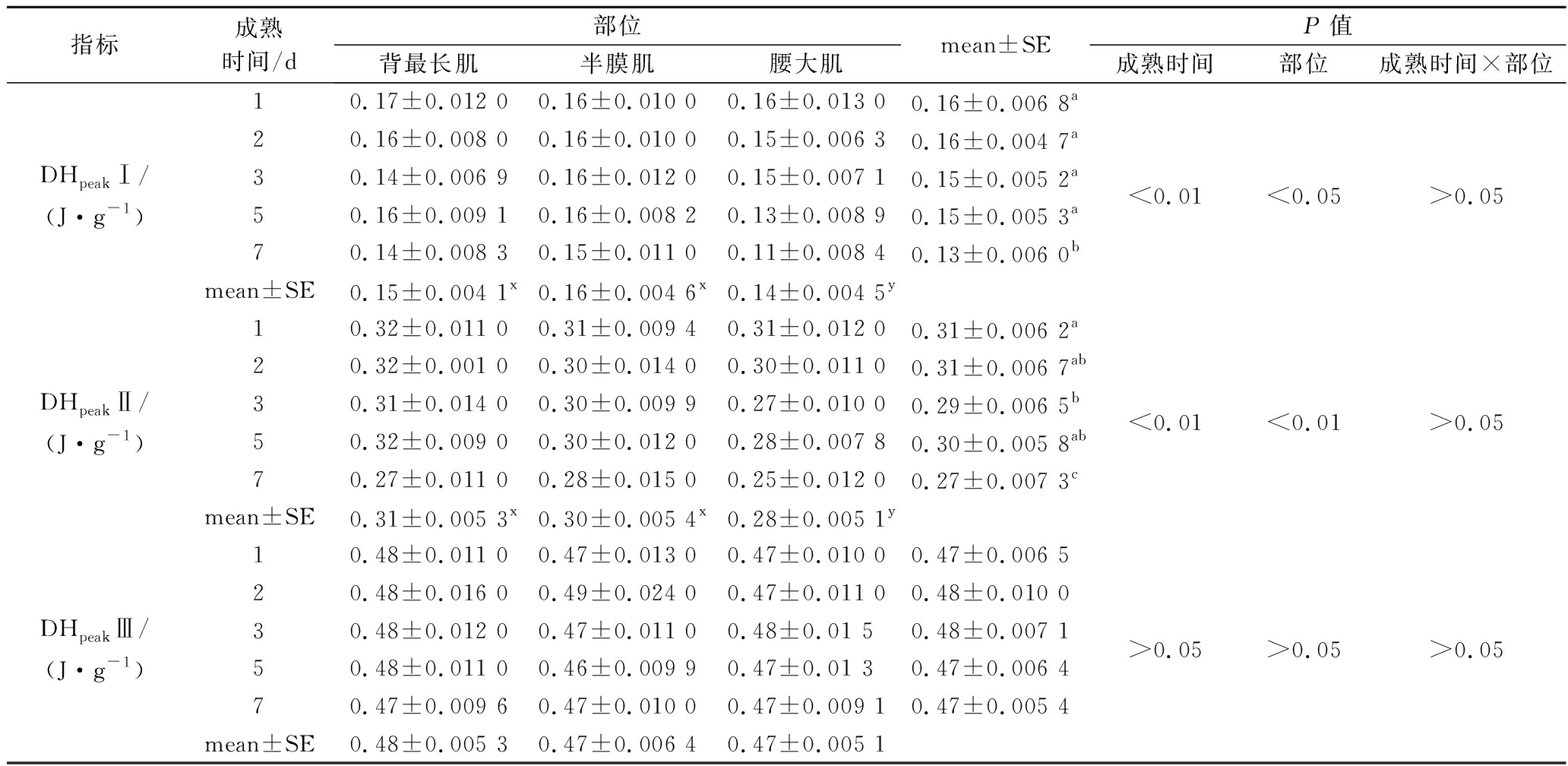
指标成熟时间/d部位mean±SEP值背最长肌半膜肌腰大肌成熟时间部位成熟时间×部位10.17±0.012 00.16±0.010 00.16±0.013 00.16±0.006 8a20.16±0.008 00.16±0.010 00.15±0.006 30.16±0.004 7aDHpeakⅠ/30.14±0.006 90.16±0.012 00.15±0.007 10.15±0.005 2a<0.01<0.05>0.05(J·g-1)50.16±0.009 10.16±0.008 20.13±0.008 90.15±0.005 3a70.14±0.008 30.15±0.011 00.11±0.008 40.13±0.006 0bmean±SE0.15±0.004 1x0.16±0.004 6x0.14±0.004 5y10.32±0.011 00.31±0.009 40.31±0.012 00.31±0.006 2a20.32±0.001 00.30±0.014 00.30±0.011 00.31±0.006 7abDHpeakⅡ/30.31±0.014 00.30±0.009 90.27±0.010 00.29±0.006 5b<0.01<0.01>0.05(J·g-1)50.32±0.009 00.30±0.012 00.28±0.007 80.30±0.005 8ab70.27±0.011 00.28±0.015 00.25±0.012 00.27±0.007 3cmean±SE0.31±0.005 3x0.30±0.005 4x0.28±0.005 1y10.48±0.011 00.47±0.013 00.47±0.010 00.47±0.006 520.48±0.016 00.49±0.024 00.47±0.011 00.48±0.010 0DHpeakⅢ/30.48±0.012 00.47±0.011 00.48±0.01 50.48±0.007 1>0.05>0.05>0.05(J·g-1)50.48±0.011 00.46±0.009 90.47±0.01 30.47±0.006 470.47±0.009 60.47±0.010 00.47±0.009 10.47±0.005 4mean±SE0.48±0.005 30.47±0.006 40.47±0.005 1
注:a~c不同字母表示同一部位不同成熟时间差异显著(P<0.05),x~y不同字母表示同一成熟时间不同部位差异显著(P<0.05)
对于肌动蛋白的变化,虽然Tmaxpeak III随成熟时间由第1天的77.56 ℃降低至第7天的77.49 ℃,整体呈现降低的趋势,但变化不显著(P>0.05),且不同部位之间的差异性也不显著(P>0.05),变性焓值的差异和变化与Tmaxpeak III类似,表明在整个成熟期内(7 d)3种部位牛肉的肌动蛋白降解程度低且稳定性高。综合整个DSC数据来看,在成熟期间内3种部位牛肉的肌原纤维均发生变性,且腰大肌的肌球蛋白与肌浆蛋白更易发生变性,且发生变性的程度更高。
在成熟过程中,细胞骨架蛋白(肌球蛋白、肌间线蛋白、肌动蛋白、肌联蛋白等)的降解对保水性的影响至关重要[23-24]。研究表明,肉品成熟过程中保水性的降低与蛋白质的变性有关[25-27]。以上结果表明,3种部位相比,腰大肌中肌球蛋白和肌浆蛋白更易变性,而腰大肌的保水性较好(表1),换言之,腰大肌中蛋白质变性程度的增加降低了牛肉可渗出的水分。因此,推测肌球蛋白与肌浆蛋白的变性可能促进了肌肉结构对汁液的维持,在外力作用如加压状态下,减少了牛肉可流失的汁液。BERTRAM等[28]研究表明,肌球蛋白和肌动蛋白的变性与肉中的水分变化具有一定关系。陈韬[29]认为,不同保水性样品的肌球蛋白和肌浆蛋白的变性程度存在差异。在本研究中,成熟期间腰大肌的TmaxpeakI由55.03 ℃降低至54.14 ℃(P<0.05),TmaxpeakII的均值为63.56 ℃,腰大肌的焓变值DHpeak I和DHpeak II也显示出相同的趋势,均显著低于背最长肌和半膜肌(P<0.05)。腰大肌的肌球蛋白与肌浆蛋白变性程度均高于背最长肌和腰大肌(P<0.05),而保水性的结果却是腰大肌的保水性显著高于背最长肌和半膜肌(P<0.05),分析认为随着成熟时间的延长,蛋白质降解、无序程度增加,肌细胞滞留水的能力更强[30]。因此蛋白质作为肌肉中固体物质的主要组成成分,蛋白质的变性对保水性起作用。
3 结论
在本研究中,成熟期内3种部位牛肉的氢键作用力和疏水性相互作用力的变化和差异各不相同,离子键作用力仅第7天呈现显著升高的趋势(P<0.05),因此认为不同部位的牛肉蛋白质的化学作用力变化不同,化学作用力不是造成牛肉不同部位之间保水性差异的原因。DSC结果表明,腰大肌的蛋白质更易发生变性,且肌球蛋白和肌浆蛋白的蛋白质变性程度更高,蛋白质变性程度不同是引起不同部位之间牛肉保水性存在差异的原因。本研究通过探讨蛋白质特性改变对保水性的影响,明确不同部位牛肉保水性存在差异的原因,为提高牛肉的保水性提供理论依据。
参考文献
[1] 孙文彬, 罗欣, 毛衍伟, 等.正常牛肉与DFD牛肉成熟过程中保水性和水分状态变化[J].食品科学, 2020, 41(13):14-21.
SUN W B, LUO X, MAO Y W, et al.Changes in water retention and moisture state of normal and dark, firm and dry beef during postmortem aging[J].Food Science, 2020, 41(13):14-21.
[2] PUOLANNE E.Developments in Our Understanding of Water-Holding Capacity in Meat[M].Amsterdam:Elsevier, 2017.
[3] 左惠心, 殷元虎, 韩玲, 等.宰后牦牛肉保水性变化与差异蛋白的生物信息学分析[J].农业机械学报, 2017, 48(7):325-331;300.
ZUO H X, YIN Y H, HAN L, et al.Changes of postmortem water-holding capacity in yak muscle and bioinformatic analysis of differentially abundant proteins[J].Transactions of the Chinese Society for Agricultural Machinery, 2017, 48(7):325-331;300.
[4] 左惠心, 韩玲, 余群力, 等.牦牛与黄牛肌肉差异蛋白质组及生物信息学分析[J].农业机械学报, 2017, 48(4):313-320.
ZUO H X, HAN L, YU Q L, et al.Proteomics and bioinformatics analyses of differentially expressed proteins in yak and beef cattle muscle[J].Transactions of the Chinese Society for Agricultural Machinery, 2017, 48(4):313-320.
[5] ZUO H X, HAN L, YU Q L, et al.Proteome changes on water-holding capacity of yak longissimus lumborum during postmortem aging[J].Meat Science, 2016, 121:409-419.
[6] 杨玉莹, 张一敏, 毛衍伟, 等.不同部位牦牛肉肌纤维特性与肉品质差异[J].食品科学, 2019, 40(21):72-77.
YANG Y Y, ZHANG Y M, MAO Y W, et al.Differences in myofiber characteristics and meat quality of different yak muscles[J].Food Science, 2019, 40(21):72-77.
[7] 尹靖东. 动物肌肉生物学与肉品科学[M].北京:中国农业大学出版社, 2011.
YIN J D.Animal Muscle Biology and Meat Quality[M].Beijing:China Agricultural University Press, 2011.
[8] VASKOSKA R, HA M, ONG L, et al.Ageing and cathepsin inhibition affect the shrinkage of fibre fragments of bovine semitendinosus, biceps femoris and psoas major during heating[J].Meat Science, 2021, 172:108 339.
[9] ERTBJERG P, PUOLANNE E.Muscle structure, sarcomere length and influences on meat quality:A review[J].Meat Science, 2017, 132:139-152.
[10] SCH FER A, ROSENVOLD K, PURSLOW P P, et al.Physiological and structural events post mortem of importance for drip loss in pork[J].Meat Science, 2002, 61(4):355-366.
FER A, ROSENVOLD K, PURSLOW P P, et al.Physiological and structural events post mortem of importance for drip loss in pork[J].Meat Science, 2002, 61(4):355-366.
[11] LAWSON M A.The role of integrin degradation in post-mortem drip loss in pork[J].Meat Science, 2004, 68(4):559-566.
[12] ZHANG W G, LONERGAN S M, GARDNER M A, et al.Contribution of postmortem changes of integrin, desmin and μ-calpain to variation in water holding capacity of pork[J].Meat Science, 2006, 74(3):578-585.
[13] LI X, WEI X L, WANG H, et al.Relationship between protein denaturation and water holding capacity of pork during postmortem ageing[J].Food Biophysics, 2018, 13(1):18-24.
[14] MA D Y, KIM Y H B.Proteolytic changes of myofibrillar and small heat shock proteins in different bovine muscles during aging:Their relevance to tenderness and water-holding capacity[J].Meat Science, 2020, 163:108090.
[15] FRANCO D, BISPO E, GONZ LEZ L, et al.Effect of finishing and ageing time on quality attributes of loin from the meat of Holstein-Fresian cull cows[J].Meat Science, 2009, 83(3):484-491.
LEZ L, et al.Effect of finishing and ageing time on quality attributes of loin from the meat of Holstein-Fresian cull cows[J].Meat Science, 2009, 83(3):484-491.
[16] G MEZ-GUILLÉN M C, BORDER
MEZ-GUILLÉN M C, BORDER AS A J, MONTERO P.Chemical interactions of nonmuscle proteins in the network of Sardine (Sardina pilchardus) muscle gels[J].LWT-Food Science and Technology, 1997, 30(6):602-608.
AS A J, MONTERO P.Chemical interactions of nonmuscle proteins in the network of Sardine (Sardina pilchardus) muscle gels[J].LWT-Food Science and Technology, 1997, 30(6):602-608.
[17] 康怀彬, 邹良亮, 张慧芸, 等.高温处理对牛肉蛋白质化学作用力及肌原纤维蛋白结构的影响[J].食品科学, 2018, 39(23):80-86.
KANG H B, ZOU L L, ZHANG H Y, et al.Effect of high temperature treatment on chemical forces of beef proteins and structure of myofibrillar protein[J].Food Science, 2018, 39(23):80-86.
[18] DENG Y, ROSENVOLD K, KARLSSON A H, et al.Relationship between thermal denaturation of porcine muscle proteins and water-holding capacity[J].Journal of Food Science, 2002, 67(5):1 642-1 647.
[19] ZENG Z, LI C, ERTBJERG P.Relationship between proteolysis and water-holding of myofibrils[J].Meat Science, 2017, 131:48-55.
[20] 郑红, 苏现波, 马良, 等.货架期冷藏过程中鳝鱼肉理化指标及蛋白质变化规律[J].食品科学, 2018, 39(7):215-220.
ZHENG H, SU X B, MA L, et al.Changes in physicochemical properties and proteins during shelf life of cold stored swamp eel (Monopterus albus)[J].Food Science, 2018, 39(7):215-220.
[21] 郭兆斌, 余群力, 陈骋, 等.宰后牦牛肉水分分布变化与持水性能关系研究[J].农业机械学报, 2019, 50(10):343-351.
GUO Z B, YU Q L, CHEN C, et al.Relationship between water distribution change and water retention properties of yak meat during postmortem aging[J].Transactions of the Chinese Society for Agricultural Machinery, 2019, 50(10):343-351.
[22] 王静宇, 胡新, 刘晓艳, 等.肌原纤维蛋白热诱导凝胶特性及化学作用力研究进展[J].食品与发酵工业, 2020, 46(8):300-306.
WANG J Y, HU X, LIU X Y, et al.Advances in heat-induced gel properties and chemical forces of myofibrillar protein gel[J].Food and Fermentation Industries, 2020, 46(8):300-306.
[23] KRISTENSEN L, PURSLOW P P.The effect of ageing on the water-holding capacity of pork:Role of cytoskeletal proteins[J].Meat Science, 2001, 58(1):17-23.
[24] HUGHES J M, OISETH S K, PURSLOW P P, et al.A structural approach to understanding the interactions between colour, water-holding capacity and tenderness[J].Meat Science, 2014, 98(3):520-532.
[25] WIKLUND E, STEVENSON-BARRY J M, DUNCAN S J, et al.Electrical stimulation of red deer (Cervus elaphus) carcasses-effects on rate of pH-decline, meat tenderness, colour stability and water-holding capacity[J].Meat Science, 2001, 59(2):211-220.
[26] SUJIWO J, KIM H J, SONG S O, et al.Relationship between quality and freshness traits and torrymeter value of beef loin during cold storage[J].Meat Science, 2019, 149:120-125.
[27] KIM Y H B, WARNER R D, ROSENVOLD K.Influence of high pre-rigor temperature and fast pH fall on muscle proteins and meat quality:A review[J].Animal Production Science, 2014, 54(4):375.
[28] BERTRAM H C, WU Z Y, VAN DEN BERG F, et al.NMR relaxometry and differential scanning calorimetry during meat cooking[J].Meat Science, 2006, 74(4):684-689.
[29] 陈韬. 宰后肌肉蛋白质和组织结构变化与冷却猪肉持水性的关系研究[D].南京:南京农业大学, 2005.
CHEN T.Study on relationship between muscle protein and structural changes postmortem and water-holding capacity of chilled pork[D].Nanjing:Nanjing Agricultural University, 2005.
[30] HUFF-LONERGAN E, LONERGAN S M.Mechanisms of water-holding capacity of meat:The role of postmortem biochemical and structural changes[J].Meat Science, 2005, 71(1):194-204.
Water-holding capacity and protein properties analysis in different parts of chilled beef during postmortem aging
ZUO Huixin,WEN Bin,LUO Xin,ZHU Lixian*,NIU Lebao,ZHANG Yimin,MAO Yanwei
(College of Food Science and Engineering, Shandong Agricultural University, Tai′an 271018, China)
ABSTRACT In order to investigate the changes of water-holding capacity (WHC) in different parts of chilled beef, the chilled M.longissimus lumborum (LL), M. semimembranosus (SM) and M.psoas major (PM) beef aged for 1, 2, 3, 5 and 7 d were investigated in this study. From the perspectives of pressure loss, chemical forces and protein stability, the changes of WHC and protein properties of the three parts of chilled beef were described. The results indicated that the ionic bond force did not change significantly until the 5th day (P>0.05) of postmortem aging time. And it increased significantly on the 7th day (P< 0.05). For the changes of hydrogen bond force and hydrophobic interaction force, the changes of each part were different during postmortem aging. However, in the longer postmortem aging time, the change of the chemical forces in three parts of beef were not significant, which indicating that there was no relationship between the chemical forces and WHC in the three parts of chilled beef. The results of differential scanning calorimetry (DSC) showed that TmaxpeakI was significantly reduced from 55.03 ℃ to 54.14 ℃ (P< 0.05). And the TmaxpeakII was 63.56 ℃ and the DHpeak had the same trend in PM (P< 0.05). Moreover, DHpeak I and DHpeak II in PM were significantly lower than that of LL and SM (P< 0.05), indicating that the protein of PM was more susceptible to denaturation. Besides, the protein denaturation of myosin and sarcoplasmic proteins were higher in PM. The different degree of protein denaturation may be the reason for the changes in WHC in different parts of beef.
Key words chilled beef;different parts of meat;water-holding capacity;chemical forces;protein stability
 FER等[10]指出,细胞骨架蛋白在肉品成熟过程中结构变化会引起细胞形态以及肉品保水性的改变。LAWSON等[11]研究表明连接细胞骨架和胞外基质的整合素蛋白对猪肉中汁液流失通道的形成至关重要。ZHANG等[12]也有类似的研究结果,其研究发现肌间线蛋白的完整性、整合素蛋白的降解、μ-钙蛋白酶含量与宰后猪肉的保水性变化有关。这些研究说明肌纤维结构变化、水分溢出、汁液流失通道等与汁液损失有重要联系,可以解释大部分汁液流失现象。然而,这些研究并不能对肉的保水性提供完整的解释,也无法直接证明是否是蛋白质的降解导致肉中水分的流失。LI等[13]运用差示扫描量热仪(differential scanning calorimetry,DSC)研究了冷却猪肉在成熟过程中保水性变化与蛋白质变化的关系,结果表明,在成熟过程中蛋白质发生降解,且与肌浆蛋白变性程度呈显著负相关关系(R=-0.91,P<0.05)。MA等[14]对成熟过程中不同部位肌肉的蛋白水解变化与肉品品质特性进行了相关性分析,结果表明,在成熟过程中,不同部位肌肉的蛋白质水解变化是以其特有的方式发生的,这可能导致成熟过程中不同肌肉的肉质变化速率和程度不同。
FER等[10]指出,细胞骨架蛋白在肉品成熟过程中结构变化会引起细胞形态以及肉品保水性的改变。LAWSON等[11]研究表明连接细胞骨架和胞外基质的整合素蛋白对猪肉中汁液流失通道的形成至关重要。ZHANG等[12]也有类似的研究结果,其研究发现肌间线蛋白的完整性、整合素蛋白的降解、μ-钙蛋白酶含量与宰后猪肉的保水性变化有关。这些研究说明肌纤维结构变化、水分溢出、汁液流失通道等与汁液损失有重要联系,可以解释大部分汁液流失现象。然而,这些研究并不能对肉的保水性提供完整的解释,也无法直接证明是否是蛋白质的降解导致肉中水分的流失。LI等[13]运用差示扫描量热仪(differential scanning calorimetry,DSC)研究了冷却猪肉在成熟过程中保水性变化与蛋白质变化的关系,结果表明,在成熟过程中蛋白质发生降解,且与肌浆蛋白变性程度呈显著负相关关系(R=-0.91,P<0.05)。MA等[14]对成熟过程中不同部位肌肉的蛋白水解变化与肉品品质特性进行了相关性分析,结果表明,在成熟过程中,不同部位肌肉的蛋白质水解变化是以其特有的方式发生的,这可能导致成熟过程中不同肌肉的肉质变化速率和程度不同。 MEZ-GUILLÉN等
MEZ-GUILLÉN等



 FER A, ROSENVOLD K, PURSLOW P P, et al.Physiological and structural events post mortem of importance for drip loss in pork[J].Meat Science, 2002, 61(4):355-366.
FER A, ROSENVOLD K, PURSLOW P P, et al.Physiological and structural events post mortem of importance for drip loss in pork[J].Meat Science, 2002, 61(4):355-366. LEZ L, et al.Effect of finishing and ageing time on quality attributes of loin from the meat of Holstein-Fresian cull cows[J].Meat Science, 2009, 83(3):484-491.
LEZ L, et al.Effect of finishing and ageing time on quality attributes of loin from the meat of Holstein-Fresian cull cows[J].Meat Science, 2009, 83(3):484-491. MEZ-GUILLÉN M C, BORDER
MEZ-GUILLÉN M C, BORDER AS A J, MONTERO P.Chemical interactions of nonmuscle proteins in the network of Sardine (
AS A J, MONTERO P.Chemical interactions of nonmuscle proteins in the network of Sardine (