近平滑假丝酵母ATCC 7330羰基还原酶CpCR突变体酶的稳定性研究
龚大春1,2,王德林1,2,万里1,2,刘润1,2,吕育财1,2,罗华军1,2,宋婷1,2*
1(中国轻工业功能酵母重点实验室(三峡大学),湖北 宜昌,443002)2(三峡大学 生物与制药学院,湖北 宜昌,443002)
摘 要 通过蛋白质理性设计和定点突变技术,在近平滑假丝酵母ATCC 7330羰基还原酶wtCpCR的基础上,构建5个突变体酶A98N、S307N、G262N、S216N和S258N,考察了有机溶剂、温度、剪切力、氧气、辅酶NADPH浓度对突变体酶的稳定性影响。研究表明,A98 N在磷酸盐(potassium phosphate,PB)缓冲溶液中比酶活力提高10%,而S307 N没有酶活力,其他3个突变体比酶活力均有降低;A98 N和G262 N在PB/甲基叔丁基醚的双相体系中界面稳定性比原始酶wtCpCR分别提高1.7和1.4倍;4个突变体酶的耐热特性略有下降,T50值介于31~36 ℃;在100、200 r/min条件下,4个突变体耐剪切力均增强,在300 r/min 条件下G262 N突变酶的耐剪切稳定性比wtCpCR增强1.3倍;G262 N突变酶在有氧条件下的稳定性更好,比野生酶提高1.4倍,半衰期(t1/2)达到11.87 h;辅酶浓度为0~0.4 mmol/L时,G262 N突变酶更加稳定。该研究为该羰基还原酶wtCpCR的多点突变进一步改善酶稳定性提供重要的科学依据,同时可提高该酶在双相体系生物催化工艺的经济性。
关键词 近平滑假丝酵母;羰基还原酶;理性设计;定点突变;酶稳定性
DOI:10.13995/j.cnki.11-1802/ts.027246
引用格式:龚大春,王德林,万里,等.近平滑假丝酵母ATCC 7330羰基还原酶CpCR突变体酶的稳定性研究[J].食品与发酵工业,2022,48(2):59-64.GONG Dachun,WANG Delin,WAN Li, et al.Stability of CpCR mutants from Candida parapsilosis ATCC 7330 carbonyl reductase[J].Food and Fermentation Industries,2022,48(2):59-64.
第一作者:博士,教授(宋婷硕士研究生为通信作者,E-mail:1374813450@qq.com)
基金项目:国家自然基金项目(21776162);湖北省技术创新专项(2019ABA114)
收稿日期:2021-03-26,改回日期:2021-05-05
羰基还原酶在功能有机酸[1-3]和手性羟基化合物[4-6]合成中具有巨大的应用前景,但是该酶在耐热、耐溶剂、耐剪切等方面的稳定性有待进一步提高[7-9]。曹块[10]发现羰基还原酶存在热稳定性差、半衰期(t1/2)短,机械搅拌会加速酶失活等不足,GROSCH等[11]研究发现近平滑假丝酵母的羰基还原酶CPCR2界面稳定性差异较大,在单一的有机相如乙醇中很稳定,但在溶液-有机溶剂构成的双相体系中不稳定。宋婷等[12]也研究发现近平滑假丝酵母ATCC 7330羰基还原酶wtCpCR的界面稳定性和耐热性较差。因此为了提高该羰基还原酶在食品工业和生物化工应用价值,亟待改善其稳定性。
蛋白质工程及定点突变技术的快速发展[11,13-20],为提高酶的热稳定性、耐溶剂能力、耐酸能力等提供了高效的方法[17-25]。刘晓慧等[26]采用定点突变对氨基甲酸乙酯水解酶进行Q328C和Q328V分子改造后,将该酶40 ℃下的t1/2分别提高了7.46、1.99倍。郭超等[27]通过分子改造牛肠激酶得到R87P突变体酶的t1/2和T50较野生型分别提高了3.1 min和11.8 ℃。JAKOBLINNERT等[28]对羰基还原酶的A275和L276进行单突变和双突变,在环己烷-缓冲水溶液体系中酶活力提高1.5倍,热稳定性也提高2.7 ℃。沈瑞华等[29]构建的腈水合酶突变体M150C、T173Y和S189E在50 ℃下t1/2分别增加了32%、7%和107%,熔融温度(melting temperature,Tm)提高1~3 ℃。但利用定点突变技术对近平滑假丝酵母ATCC 7330羰基还原酶wtCpCR开展分子改造和稳定性研究还未见报道。
因此本文拟通过蛋白质理性设计和定点突变技术,筛选羰基还原wtCpCR与辅酶结合的柔性区域氨基酸残基突变位点,构建系列羰基还原酶突变体,研究其在界面稳定性、耐氧能力、耐剪切力和耐热等方面的特点,为拓展其在手性化合物和食品添加剂中的应用奠定科学基础。
1 材料与方法
1.1 材料与仪器
菌株Candida parapsilosis ATCC 7330、Escherichia coil BL21(DE3),本实验室保存;T4连接酶、质粒抽提试剂盒、产物纯化试剂盒,Vazyme生物技术有限公司;DL 10 000 bp Marker、蛋白质电泳Marker、6×loading Buffer、5×蛋白上样缓冲液,TAKARA有限公司;质粒载体pACYCDuet-1,北纳创联生物科技有限公司;异丙基-β-D-硫代半乳糖苷(Isopropyl-beta-D-thiogalactopyranoside,IPTG),纯度>99.9%,Calbiochem公司;PCR引物合成及测序,生工(上海)生物技术有限公司;Ni-Agarose His标签蛋白纯化试剂盒,北京康为世纪生物科技有限公司;其他试剂为国产或进口分析纯。
NanoDrop One超微量紫外可见分光光度计,Thermo Fisher Scientific;C1000 TouchPCR仪、Doc XR+Gel凝胶成像仪,伯乐生命医学产品有限公司(Bio-Rad);SX-700蒸汽灭菌器、MX-307落地高速冷冻离心机,Tomy Digital Biology;SW-CJ-2FD超净工作台,苏州净化设备有限公司;UV1800紫外可见分光光度计,岛津企业管理有限公司;Discovery Studio 2017版软件,北京创腾科技有限公司。
1.2 实验方法
1.2.1 羰基还原酶的突变点筛选
将近平滑假丝酵母ATCC 7330羰基还原酶蛋白(PDB数据库代号为4OAQ)分别与4-氯苯基甲酮和4-氯-3-酮基丁酸乙酯等不同底物采用Discovery studio 2017软件进行CDOCKER对接,通过模拟及文献[11]报道的羰基还原酶双相催化体系的钝化机理和稳定性推测,得到控制羰基还原酶wtCpCR耐溶剂、耐剪切、耐氧等稳定性的主要氨基酸有Ala98、Ser307、Gly262、Ser216和Ser258,除了Ser307外,其他均位于该酶的柔性区域。对这5个氨基酸采用饱和突变,计算突变能。得到5个突变体自由能,分别是ALA98Asn(-13.56 kJ/mol) 、Ser307Asn(-12.60 kJ/mol) 、Gly262Asn(-5.53 kJ/mol)、Ser216Asn(-5.15 kJ/mol)、Ser258Asn(-5.40 kJ/mol)。根据突变自由能比较[ΔΔGmut=ΔΔGfold(mutant)-ΔΔGfold(wild type)],这些突变体的突变能均为-4.186 kJ/mol以下,因此预测这些突变体酶的稳定性会有所提高。
1.2.2 定点突变引物设计、构建突变体文库、制备突变体酶
根据羰基还原酶wtCpCR的基因序列,利用SnapGene软件开展引物设计,如表1所示,用Mut Express Ⅱ Fast Mutagenesis Kit V2方法进行定点突变,得到突变质粒,转化到E.coli BL21(DE3)感受态细胞,构建突变文库,经测序验证后,再进行菌种培养、分离纯化得到相应突变体酶A98N、S307N、G262N、S216N、258N。
表1 定点突变引物设计表
Table 1 Primer design table for site-directed mutagenesis

突变点引物A98NF:TGGTGCGaacTCTTCCTCATGTCGTAGCTGTCAR:AGGAAGAgttCGCACCAATTCCAACACGGTCTS307NF:TGGATCCaacTTGTTGGGTTCCAAGACAGAAGTR:CCAACAAgttGGATCCAAAACTAGCACCTTGTTGG262NF:GTGGAATTGATaacTTGAACTTGTCTGAG-TACTTGTCCACTR:CAAgttATCAATTCCACTAGCACAGTTCAAAAS216NF:CTGCATTCaatAGATCCTCTTCCAAAAAGGAACAAR:GGATCTattGAATGCAGTGACATTGGCACCCAS258NF:CTGTGCTaacGGAATTGATGGTTTGAACTTGTCTGR:CAATTCCgttAGCACAGTTCAAAATAAAGTCAAAATG
注:小写字母部分为突变位点碱基
1.2.3 wtCpCR及其突变体酶的酶活力测定
突变体酶与wtCpCR的酶活力的测定参照文献[12],采用分光光度计法。酶活力测定的一般方法:总反应体积为1 mL,包含750 μL 100 mmol/L磷酸缓冲液(phosphate buffer,PB)(pH 7.5),100 μL 20~40 mmol/L带酮基或醛基底物,100 μL 2 mmol/L NADPH,30 ℃温育3 min,最后加入50 μL酶液,在340 nm条件下测定吸光度值的变化。本实验选用苯甲醛作为底物。
酶活力定义:在30 ℃、pH 7.5条件下,1 min催化氧化1 μmol NADPH所需要的酶量定义为1 U。酶活力计算如公式(1)所示:
(1)
式中:ΔA为初速度范围内每分钟吸光度值差值,min-1;V总为总反应体积,mL;n为酶液稀释倍数;6.22 为NADPH的消光系数,mmol/ (L·cm);d为比色皿直径,1 cm;V为酶液添加体积,mL。
1.2.4 突变体酶的稳定性研究
1.2.4.1 不同双相体系对羰基还原酶突变体的界面稳定性影响
建立PB-正己烷、PB-甲基叔丁基醚两种双相体系,检测wtCpCR及其突变酶在PB水相和双相体系条件下的酶活力变化,研究wtCpCR突变酶的界面稳定性变化规律。双相体系由1 mL的正己烷(或甲基叔丁基醚)和1 mL的酶溶液(0.1 mol/L PB,pH 7.5)组成。水相体系由1 mL PB和1 mL酶溶液组成。将单相或双相体系放入50 r/min、30 ℃的水浴锅中进行温育。定时取样,按照1.2.3酶活力测定方法测定剩余酶活力,确定各种酶在不同体系中的半衰期(t1/2)。所有实验重复3次,数据用Origin 8.0软件处理(下同)。
1.2.4.2 不同温度对羰基还原酶突变体的热稳定性影响
取适量酶液,置于4~50 ℃条件下保温2 h,移取部分酶液,按照1.2.3酶活力测定方法测定不同温度条件下剩余酶活力,计算该酶的T50值,考察该酶温度稳定性变化特点。T50的定义:酶活力降低至初始酶活力的50%时所对应的温度。
1.2.4.3 氧气对羰基还原酶突变体稳定性的影响
将经过无氧处理(在厌氧箱中进行氮气置换,以保证无氧条件)和未处理的酶溶液(0.1 mol/L PB,pH 7.5)放置在30 ℃条件下温育,每隔4 h取样 1次,按照1.2.3酶活力测定方法测定剩余酶活力,确定酶在无氧和有氧条件下的t1/2,研究酶在厌氧和有氧条件下的变化规律。
1.2.4.4 剪切力对羰基还原酶突变体稳定性的影响
在适当稀释的酶溶液(0.1 mol/L PB,pH 7.5)中加入5 mm聚四氟乙烯磁力搅拌子,并放置在30 ℃条件下温育,分别设置100、200、300 r/min 3种不同的转速条件。每隔2 h取样1次,按照1.2.3酶活力测定方法测定剩余酶活力,确定酶在不同剪切力强度下的t1/2,研究酶的耐剪切能力。
1.2.4.5 辅酶NADPH对羰基还原酶突变体的稳定性的影响
添加不同浓度的辅酶NADPH,通过测定酶活力的变化,研究辅酶对wtCpCR及其突变酶酶活力稳定性的影响。在酶溶液(0.1 mol/L PB,pH 7.5)中加入辅酶NADPH至终浓度分别为0.002、0.02、0.2、0.4 mmol/L,并放置在30 ℃条件下温育。每隔4 h取样,按照1.2.3酶活力测定方法测定剩余酶活力,确定酶在不同辅酶浓度条件下的t1/2。
2 结果与分析
2.1 突变体酶的比酶活变化
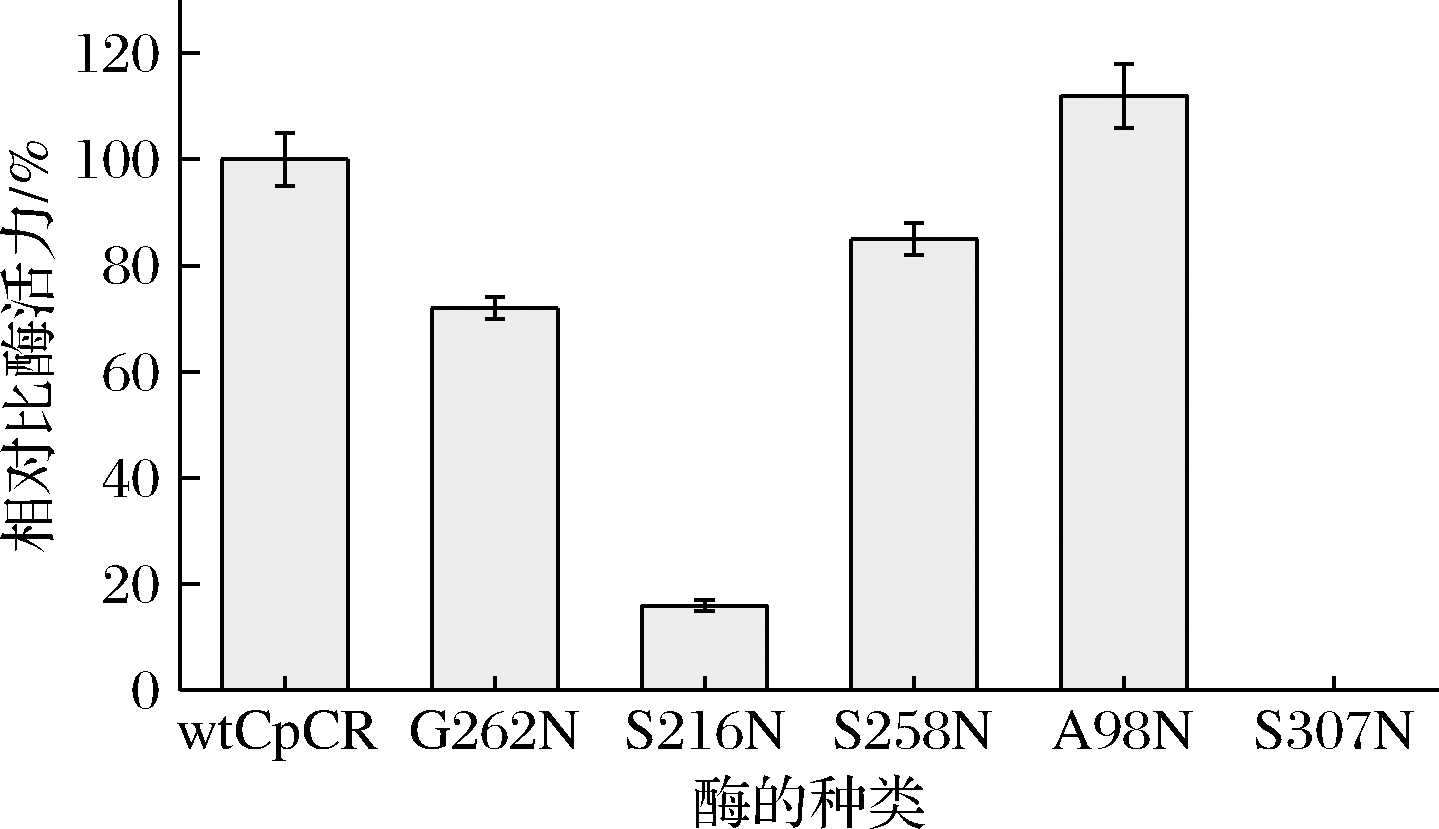
以wtCpCR为参照,不同突变体酶的相对比酶活力结果如图1所示。实验表明,A98N的比酶活力为14.52 U/mg,比野生酶提高了10%,说明第98位丙氨酸突变为天冬酰胺后得到的突变体酶可以增加其在PB中的催化能力。其余的突变体酶的比活力均有不同程度的减小。G262N、S258N的比酶活力下降为原始酶的66%和83%,S216N的比酶活力降低至原来的18%,而S307N未检测到酶活力,说明307位的丝氨酸是关键活性位点。因此选择G262N、S216N、S258N、A98N 4个突变体酶进行后续相关研究。
2.2 wtCpCR及突变酶的稳定性研究
2.2.1 wtCpCR及突变酶的双相界面稳定性变化特点
研究发现,wtCpCR在PB、PB-正己烷、PB-甲基叔丁基醚3种溶剂体系的t1/2依次下降,特别是PB-甲基叔丁基醚的双相体系中,该酶在25.9 min已下降为初始酶活力的一半,说明甲基叔丁基醚溶剂对酶的三维空间折叠影响很大,对酶有较强的毒性,导致酶快速失活。从图2-a可以看出,所有的突变体酶在PB-正己烷体系中的t1/2变短。但在PB单相体系中,G262N、S258N、A98N的t1/2均有增长,稳定性均增加。而这4个突变体酶在PB-甲基叔丁基醚体系中的t1/2差异较大(图2-b),其中A98N和G262N的t1/2延长,t1/2值分别是wtCpCR的1.7和1.4倍。表明98和262位置上的氨基酸是提高该酶在PB-甲基叔丁基醚体系中的界面稳定性关键氨基酸,通过分子改造后可以增强CpCR酶耐醚类溶剂的能力,对拓展该酶的工业化应用具有重要价值。
2.2.2 wtCpCR及其突变酶的热稳定性特点
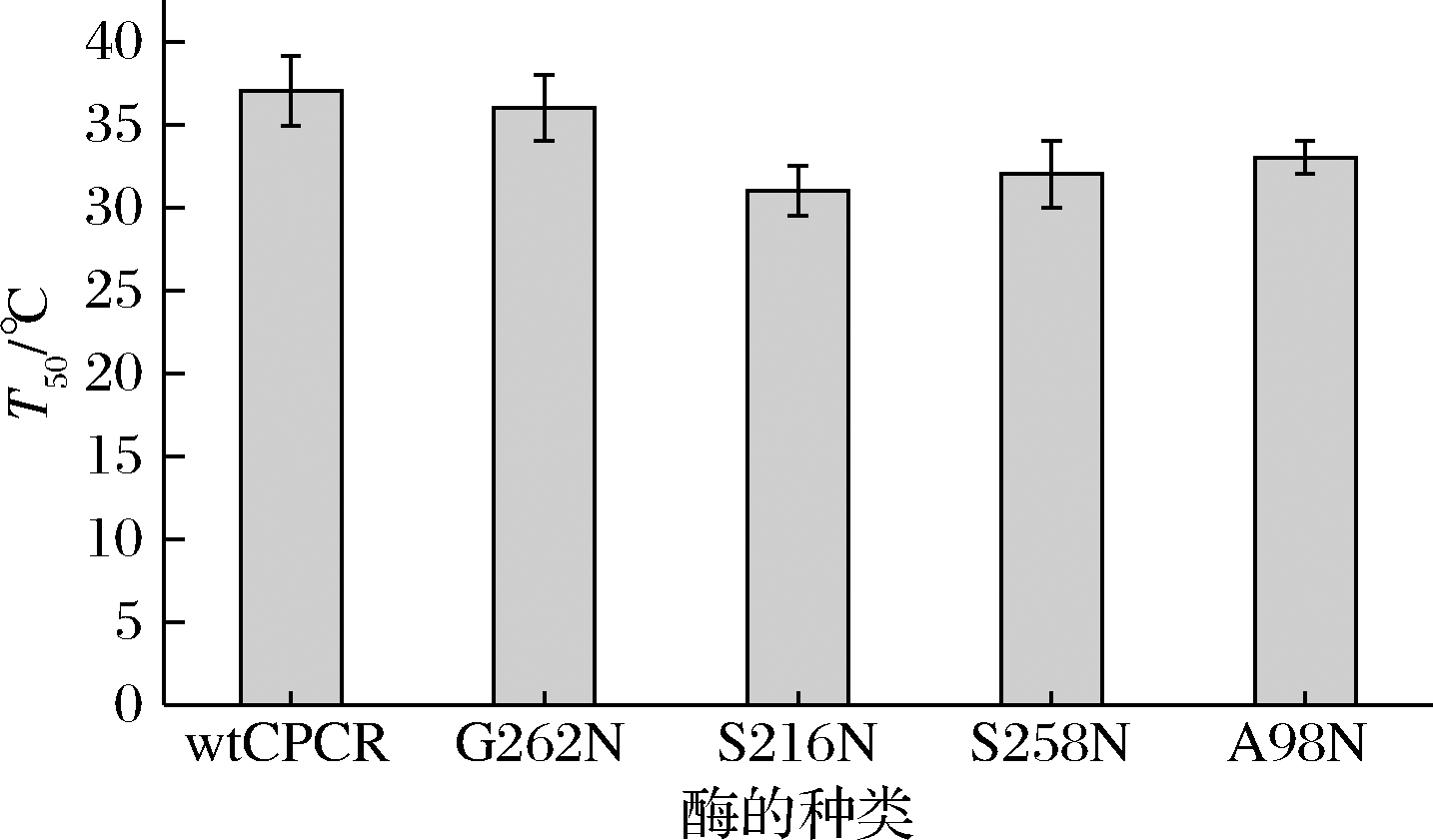
在4~50 ℃的温度下,研究了wtCpCR和突变体酶的热稳定性。从图3可以看出,4个位点的突变均对酶的热稳定性有一定的影响,T50值略有下降,其中S216N的T50值为31 ℃,下降较大,耐温性降低;而G262N的T50值与wtCpCR接近,为36 ℃,较wtCpCR下降1 ℃。
2.2.3 剪切力对wtCpCR和突变体酶稳定性的影响
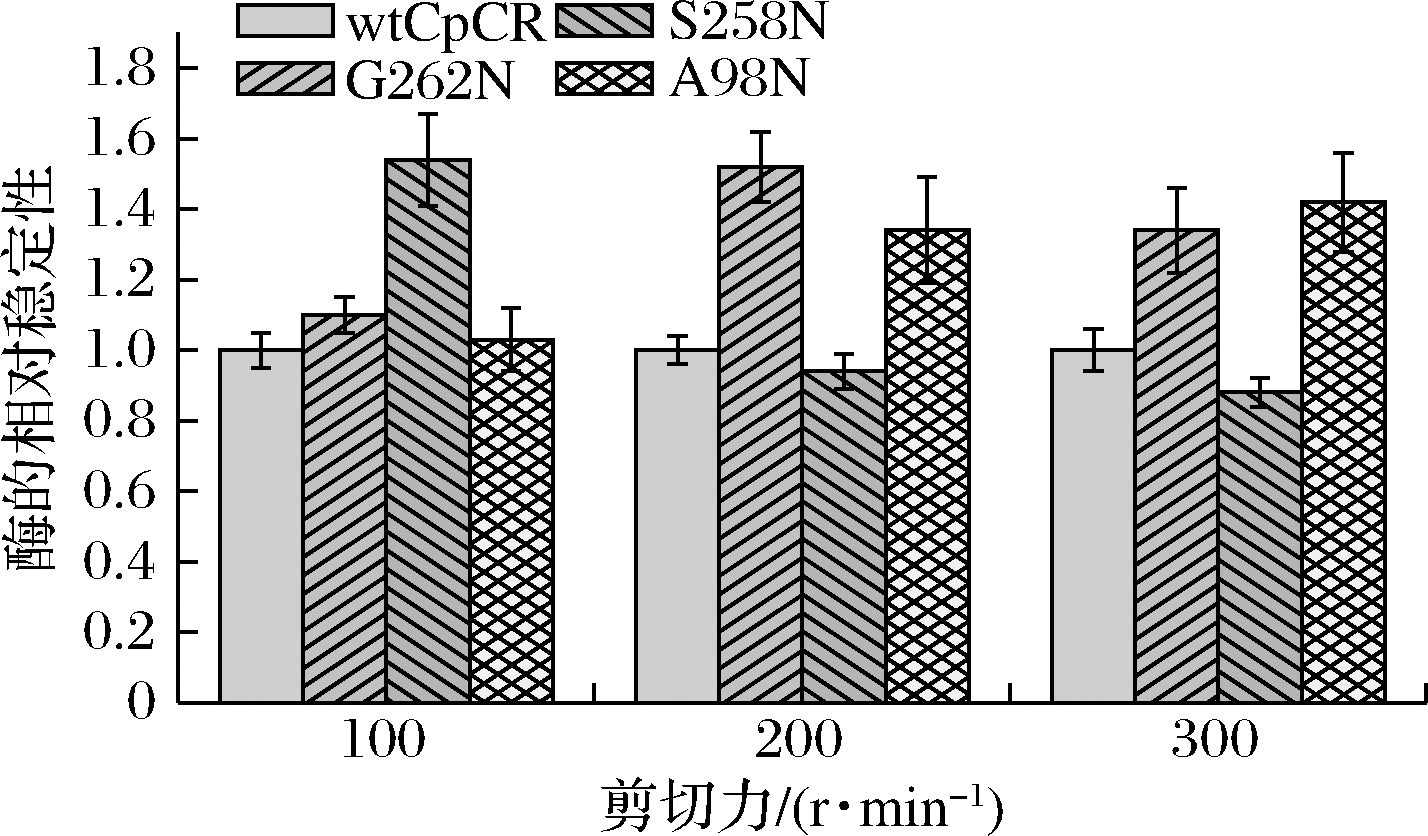
按照1.2.4.4方法研究100、200、300 r/min 3个不同剪切强度对wtCpCR及其突变酶的稳定性的影响,相对稳定性如图4所示。研究发现,随着剪切力的增加,wtCpCR和突变体酶的t1/2也下降。但在300 r/min的高剪切力下,G262 N和A98 N的稳定性比原始酶wtCpCR好,t1/2值是wtCpCR的1.3倍,G258 N突变体在高剪切力作用下酶的稳定性下降较多。说明对wtCpCR在262、98位开展定点突变,能提高酶的耐剪切能力。
2.2.4 氧对wtCpCR和突变体酶稳定性的影响
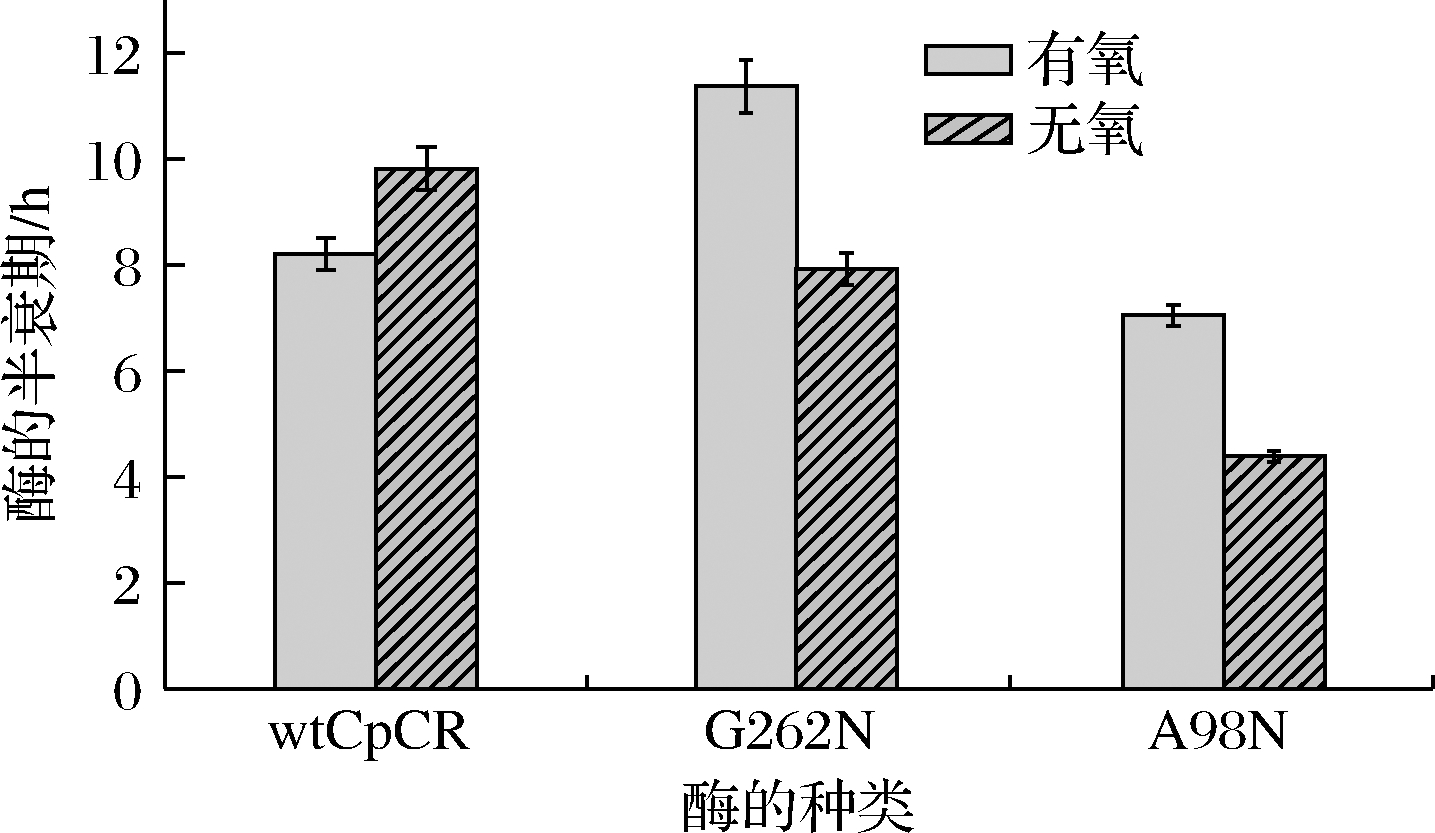
氧对G262N和A98N两种突变体酶稳定性的影响结果如图5所示。wtCpCR在无氧条件下的稳定性比有氧条件要好;但经过定点突变得到的突变酶G262 N在有氧条件下的稳定性更好,其中t1/2值为11.87 h,耐氧能力比野生酶提高1.4倍;无氧条件下,两个突变体酶的稳定性均有不同程度下降。
2.1.5 辅酶NADPH浓度对wtCpCR和突变体酶的稳定性的影响
按照1.2.4.6的方法测定了0~0.4 mmol/L浓度的辅酶NADPH对酶的稳定性影响。如图6所示,wtCpCR和突变体酶G262N、A98N均随着辅酶NADPH浓度的升高,t1/2也延长,稳定性增强。在整个考察的辅酶浓度区间突变体G262N酶更加稳定,表明262位的甘氨酸是提高CpCR酶稳定性的关键氨基酸。
3 结论
本实验通过蛋白质理性设计和定点突变技术成功得到5个突变体酶A98N、S307N、G262N、S216N和S258N。实验结果表明,以wtCpCR的比活力为参照,突变体酶A98N比活力提高了10%。在酶的稳定性实验结果表明,A98N和G262N在PB-甲基叔丁基醚的双相体系中酶的t1/2延长,耐溶剂稳定性比原始酶wtCpCR分别提高1.7、1.4倍;4个突变体酶的耐热特性均没有提高,T50值为31~36 ℃,T50值与wtCpCR最接近的是G262N;在300 r/min条件下,突变体酶G262N和A98N的稳定性比wtCpCR好,t1/2值是wtCpCR的1.3倍;突变酶G262N在有氧条件下的稳定性更好,其中t1/2值为11.87 h,耐氧能力比wtCpCR强1.38倍;辅酶浓度为0~0.4 mmol/L时,G262N酶更加稳定。综上分析,突变体A98N和G262N在耐醚类溶剂、耐剪切力具有提高,G262N突变体在有氧和辅酶浓度区域稳定性更好。本研究不仅为该酶的98位和262位的双点突变和酶稳定性进一步改造提供重要的科学依据,而且为提高该酶双相体系生物催化工艺经济性提供重要保障。
参考文献
[1] 宋伟. 多酶级联转化甘氨酸生产α-功能化有机酸的研究[D].无锡:江南大学, 2019.
SONG W.The study on cascade biocatalytic synthesis of α-functionalized organic acids from glycine[D].Wuxi:Jiangnan University, 2019.
[2] LIU F, WANG F T, DU L H, et al.Antibacterial and antibiofilm activity of phenyllactic acid against Enterobacter cloacae[J].Food Control, 2018, 84:442-448.
[3] KAWAGUCHI H, TERAMURA H, UEMATSU K, et al.Phenyllactic acid production by simultaneous saccharification and fermentation of pretreated sorghum bagasse[J].Bioresource Technology, 2015, 182:169-178.
[4] 张荣珍. 近平滑假丝酵母立体选择性还原酶表达、结构解析与改造[D].无锡:江南大学, 2009.
ZHANG R Z.Expresson, structure determination and rational design of the stereospecific reductases from Candida parapsilos[D].Wuxi:Jiangnan University, 2009.
[5] 宫绪敏. 近平滑假丝酵母立体选择性羰基还原酶催化特性的定点突变分子改造及其评价[D].无锡:江南大学, 2012.
GONG X M.Molecular engineering and assessment of stereospecific carbonyl reductase from Candida parapsilosis by site-directed mutagenesis[D].Wuxi:Jiangnan University, 2009.
[6] 柳磊. 苯丙胺脱氢酶的创制及其在手性胺合成中的应用[D].上海:华东理工大学, 2020.
LIU L.Developing amine dehydrogenases by engineering phenylalanine dehydrogenases for chiral amine synthesis[D].Shanghai:East China University of Science and Technology, 2020.
[7] HONDA K, INOUE M, ONO T, et al.Improvement of operational stability of, Ogataea minuta, carbonyl reductase for chiral alcohol production[J].Journal of Bioscience and Bioengineering, 2017, 123(6):673-678.
[8] OELSCHL GEL M, RIEDEL A, ZNISZCZO
GEL M, RIEDEL A, ZNISZCZO A, et al.Immobilization of an integral membrane protein for biotechnological phenylacetaldehyde production[J].Journal of Biotechnology, 2014, 174:7-13.
A, et al.Immobilization of an integral membrane protein for biotechnological phenylacetaldehyde production[J].Journal of Biotechnology, 2014, 174:7-13.
[9] CARVALHO T, FINOTELLI P V, BONOMO R C F, et al.Evaluating aqueous two-phase systems for Yarrowia lipolytica extracellular lipase purification[J].Process Biochemistry, 2017, 53:259-266.
[10] 曹块. 醛酮还原酶K1AKR和羰基还原酶CR稳定性研究[D].杭州:浙江工业大学, 2016.
CAO K.Stabilization study on aldo-keto reductase K1AKR and carbonyl reductase CR[D].Hangzhou:Zhejiang University of Technology, 2016.
[11] GROSCH J H, LODERER C, JESTEL T, et al.Carbonyl reductase of Candida parapsilosis-Stability analysis and stabilization strategy[J].Journal of Molecular Catalysis B:Enzymatic, 2015, 112:45-53.
[12] 宋婷, 王帅静, 汪沉, 等.近平滑假丝酵母ATCC 7330羰基还原酶CpCR的表达及酶学性质研究[J].食品与发酵工业, 2021, 47(3):18-24.
SONG T, WANG S J, WANG C, et al.Expression and characterization of carbonyl reductase CpCR from Candida parapsilosis ATCC 7330[J].Food and Fermentation Industries, 2021, 47(3):18-24.
[13] 张爱莉, 卢作焜.纤维素酶的蛋白质工程研究进展[J].食品工业, 2019, 40(8):263-266.
ZHANG A L, LU Z K.Recent advances of protein engineering of cellulase[J].The Food Industry, 2019, 40(8):263-266.
[14] 徐书琴, 胡静怡, 张恒维, 等.定点突变提高食品新型L-天冬酰胺酶的活力及热稳定性[J].食品与生物技术学报, 2020, 39(9):99-104.
XU S Q, HU J Y, ZHANG H W, et al.Improving the activity and thermal stability of Pyrococcus yayanosii CH1L-asparaginase by site-directed mutagenesis[J].Journal of Food Science and Biotechnology, 2020, 39(9):99-104.
[15] 向玉, 张萌, 许菲.基于多重计算设计策略提高枯草芽孢杆菌脂肪酶的热稳定性[J].生物工程学报, 2020, 36(8):1 556-1 567.
XIANG Y, ZHANG M, XU F, et al.Improving the thermal stability of Bacillus subtilis lipase based on multiple computational design strategies[J].Chinese Journal of Biotechnology, 2020, 36(8):1 556-1 567.
[16] 魏萍. 羰基还原酶AcCR的酶学性质、分子改造及其催化手性醇不对称合成的研究[D].广州:华南理工大学, 2018.
WEI P.Characterization of carbonyl reductase AcCR and its molecular modification and application in asymmetric synthesis of chiral alcohols[D].Guangzhou:South China University of Technology, 2018.
[17] 朱彩林, 吕祥, 夏小乐.盖子区域氨基酸的定点突变对T1脂肪酶酶学性质的影响[J].生物技术通报, 2020, 36(11):94-102.
ZHU C L, LYU X, XIA X L, et al.Effect of site-directed mutagenesis of amino acids in lid region on the enzymatic properties of T1 lipase[J].Biotechnology Bulletin, 2020, 36(11):94-102.
[18] 王珏, 胡丽丽, 张育敏, 等.基于前导肽和成熟区共进化提高米黑霉脂肪酶热稳定性研究[J].生物学杂志, 2021, 38(1):41-45.
WANG J, HU L L, ZHANG Y M, et al.Enhancing the thermostability of Rhizomucor miehei lipase through coevolution of the propeptide and the mature region[J].Journal of Biology, 2021, 38(1):41-45.
[19] QIN H M, YAMAMURA A, MIYAKAWA T, et al.Crystal structure of conjugated polyketone reductase (CPR-C1) from Candida parapsilosis IFO 0708 complexed with NADPH[J].Proteins, 2013, 81(11):2 059-2 063.
[20] 卢海强, 陈伟, 黄蕾, 等.烟曲霉单宁酶Kex2位点突变及酶学特性表征[J].食品科学, 2020, 41(14):124-130.
LU H Q, CHEN W, HUANG L, et al.Mutational analysis of Kex2 sites and characterization of tannase from Aspergillus fumigatus[J].Food Science, 2020, 41(14):124-130.
[21] ERDMANN V, MACKFELD U, ROTHER D, et al.Enantioselective, continuous (R)-and (S)-2-butanol synthesis:Achieving high space-time yields with recombinant E.coli cells in a micro-aqueous, solvent-free reaction system[J].Journal of Biotechnology, 2014, 191:106-112.
[22] 路福平, 黄爱岚, 赵蕾, 等.计算机模拟在食品工业用酶改造中的应用[J].中国食品学报, 2020, 20(11):1-10.
LU F P, HUANG A L, ZHAO L, et al.Application of computer simulation in modification of enzymes used in food industry[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(11):1-10.
[23] FUKUDA Y, SAKURABA H, ARAKI T, et al.Catalytic properties and crystal structure of thermostable NAD(P)H-dependent carbonyl reductase from the hyperthermophilic archaeon Aeropyrum pernix K1[J].Enzyme and Microbial Technology, 2016, 91:17-25.
[24] 戴威. 醇脱氢酶KpADH热稳定性改造及分子机制研究[D].无锡:江南大学, 2020.
DAI W.Investigation on molecular engineering and mechanism of the thermostability of alcohol dehydrogenase KpADH[D].Wuxi:Jiangnan University, 2020.
[25] 郑丹妮. Bacillus sp.FJAT-44876γ-环糊精葡萄糖基转移酶的表征及热稳定性提升研究[D].无锡:江南大学, 2020.
ZHENG D N.Characterization and thermostability improved of γ-CGTase from Bacillus sp.FJAT-44876[D].Wuxi:Jiangnan University, 2020.
[26] 刘晓慧, 方芳, 夏小乐, 等.定点突变改造提高纺锤形赖氨酸芽孢杆菌氨基甲酸乙酯水解酶稳定性[J].生物工程学报, 2016, 32(9):1 233-1 242.
LIU X H, FANG F, XIA X L, et al.Stability enhancement of urethanase from Lysinibacillus fusiformis by site-directed mutagenesis[J].Chinese Journal of Biotechnology, 2016, 32(9):1 233-1 242.
[27] 郭超, 王志彦, 甘一如, 等.理性设计改造牛肠激酶的热稳定性[J].中国生物工程杂志, 2016, 36(8):46-54.
GUO C, WANG Z Y, GAN Y R, et al.Engineering thermostability of bovine enterokinase by rational design method[J].China Biotechnology, 2016, 36(8):46-54.
[28] JAKOBLINNERT A, VAN DEN WITTENBOER A, SHIVANGE A V, et al.Design of an activity and stability improved carbonyl reductase from Candida parapsilosis[J].Journal of Biotechnology, 2013, 165(1):52-62.
[29] 沈瑞华, 郭军玲, 周哲敏.腈水合酶的稳定性改造研究进展[J].生物加工过程, 2020, 18(3):269-276.
SHEN R H, GUO J L, ZHOU Z M, et al.Recent advances in stability reconstruction of nitrile hydratase[J].Chinese Journal of Bioprocess Engineering, 2020, 18(3):269-276.
Stability of CpCR mutants from Candida parapsilosis ATCC 7330 carbonyl reductase
GONG Dachun1,2,WANG Delin1,2,WAN Li1,2,LIU Run1,2,LYU Yucai1,2,LUO Huajun1,2,SONG Ting1,2*
1(China Key Laboratory of Light Industry Functional Yeast, China Three Gorges University, Yichang 443002, China)2 (College of Biological and Pharmaceutical, China Three Gorges University,Yichang 443002, China)
ABSTRACT Using the protein rational design and site-directed mutagenesis technology, five mutants with A98N, S307N, G262N, S216N and S258N substitution in carbonyl reductase (wtCpCR) from Candida parapsilosis ATCC 7330 were constructed. And their stability in organic solvents, temperature, shear resistance, oxygen resistance, coenzyme NADPH concentration were studied. The results showed that compared with the enzymatic activity of wtCpCR in potassium dihydrogen phosphate/dibasic potassium phosphate (PB) buffer, the enzymatic activity of the A98N mutant increased by 10%, but the mutant S307N had no enzymatic activity and the activity of other mutants slightly decreased. The interfacial stability of A98N and G262N mutant in the PB/methyl tert-butyl ether biphasic media increased 1.7 and 1.4-fold compared to than that of the wtCpCR, respectively. The thermal resistance properties of four mutants slightly reduced, with T50 values ranging from 31-36 ℃. Under the conditions of 100 and 200 r/min, the shear resistance of the four mutants was enhanced. When the speed was 300 r/min, the stability of the G262N mutant was 1.3 times higher than that of wtCpCR. The G262N mutant enzyme had better stability under aerobic conditions, with a t1/2 value of 11.87 h, which was 1.4 times higher than that of the wild-type enzyme. When the NADPH concentration was 0-0.4 mmol/L, the G262N mutant was much more stable. This study has provided very important scientific evidences for multiple mutations to improve stability modification of the carbonyl reductase from Candida parapsilosis (CpCR), which can improve its economy of biocatalysis process in biphasic reaction media.
Key words Candida parapsilosis; carbonyl reductase;rational design;site-directed;enzymes stability


 GEL M, RIEDEL A, ZNISZCZO
GEL M, RIEDEL A, ZNISZCZO A, et al.Immobilization of an integral membrane protein for biotechnological phenylacetaldehyde production[J].Journal of Biotechnology, 2014, 174:7-13.
A, et al.Immobilization of an integral membrane protein for biotechnological phenylacetaldehyde production[J].Journal of Biotechnology, 2014, 174:7-13.