凡纳滨对虾(Litopenaeus vannamei)又称白对虾、白腿虾,营养丰富、滋味鲜美,是我国大宗养殖水产品之一[1]。据《2020中国渔业统计年鉴》[2],2019年我国对虾经济总产值超过5 000亿元,对虾养殖总面积23.74 万hm2,养殖产量达212.14万t。凡纳滨对虾加工、贮藏及运输过程中易出现肌肉软化、壳肉分离等品质劣变。PENG等[3]研究发现虾头肝胰腺中内源蛋白酶可以迁移至虾肌肉组织中降解肌原纤维蛋白,导致虾肌肉组织软化。因此,对虾加工过程中通常将虾头去掉,产品主要以冻虾仁和去头虾为主[4-5],但虾肉仍会发生自溶现象,质地软化,对水产品质量产生不良影响。
国内外研究发现,肌肉组织中内源蛋白酶对肌原纤维的降解有较大影响,抑制蛋白酶的作用有利于产品的贮藏[6-7]。水产品中内源性蛋白酶主要包含半胱氨酸蛋白酶、天冬氨酸蛋白酶、丝氨酸蛋白酶和基质金属蛋白酶4种[8],其中内源性半胱氨酸蛋白酶主要降解肌原纤维蛋白,内源性丝氨酸蛋白酶降解肌原纤维和结缔组织蛋白[9]。组织蛋白酶是一种半胱氨酸蛋白酶,是造成肌肉蛋白降解的关键因素[10]。AHMED等[11]发现组织蛋白酶除了能水解肌原纤维蛋白和相关蛋白外,还具有在死后存储后期分解肌动蛋白和肌球蛋白的能力。水产动物肌肉中组织蛋白酶的种类有很多,主要有组织蛋白酶L、B、H和D[12]。GE等[13]发现组织蛋白酶L在肌肉细丝的拆卸中起主要作用,是一种最容易使肌原纤维蛋白降解的蛋白酶。半胱氨酸蛋白酶对降解蛋白表现明显,因此,为防止水产品肌肉的死后软化,提高水产品的质量,研究组织蛋白酶L的作用机制,同时寻找其抑制机制非常有意义[14]。
近年来,有关凡纳滨对虾内源蛋白酶的研究主要是以虾头为研究对象,探究内源蛋白酶的酶学特性以及降解肌肉蛋白的机理,但是对凡纳滨对虾肌肉中内源蛋白酶的分离纯化及其酶学特性研究却鲜见报道。本研究以凡纳滨对虾肌肉为研究对象,进行凡纳滨对虾肌肉中组织蛋白酶L提取工艺优化,探究其提取工艺的最佳条件,运用生化分离纯化技术获取高纯度的组织蛋白酶L,验证其对肌原纤维的降解。为进一步探究组织蛋白酶L自溶机制提供高纯度肌肉组织蛋白酶L,为寻求降低组织蛋白酶L对虾肉质地劣化提供科学依据。
新鲜凡纳滨对虾,平均体长(9.50±0.50) cm,平均体重(7.08±0.30) g,广东省湛江市霞山水产品批发市场。
7-氨基-4-甲基香豆素(7-amido-4-methylcoumarin,AMC)、N-苄氧羰基-L-苯丙氨酰-L-精氨酸香豆素(benzyloxycarbonyl-arginylarginine-4-methyl-7-coumarylamide,Z-Phe-Arg-AMC),美国Sigma公司;Sephacaryl S-100、O-sepharose F.F阴离子层析柱,日本GE Healthcare公司;蛋白标准品,上海碧云天生物技术有限公司;硫酸铵、三羟甲基氨基甲烷[tris(hydroxymethyl)methyl aminomethane,Tris]、苯甲基磺酰氟(phenylmethylsulfonyl fluoride, PMSF)、二甲基亚砜(dimethyl sulfoxide, DMSO)、EDTA,上海源叶生物科技有限公司;其他试剂均为国产试剂纯。
Varioskan Flas全自动酶标仪、Thermo Lynx6000高速落地离心机,美国赛默飞世尔科技公司;BSA224S-CW万分之一天平,德国赛多利斯集团;BSZ-100液晶版自动部分收集器,上海青浦沪西仪器厂;GelDoc EZ G凝胶成像仪,美国伯乐公司。
1.3.1 凡纳滨对虾肌肉组织蛋白酶L粗酶液的提取
参考田元勇等[15]的方法并进行改进。在冰浴条件下,将去头尾、虾壳和肠线的虾肉用绞肉机绞碎。取5.0 g的虾肉糜,加入一定体积比的缓冲液[包含一定浓度Tris-HCl缓冲液,半胱氨酸(L-cysteine,L-Cys)溶液和PMSF溶液,pH=7.0],在冰浴条件下高速均质(12 000 r/min,1 min),调节pH后在4 ℃条件下冷冻离心(8 500 r/min,20 min),得到的上清液为组织蛋白酶L粗酶液。
1.3.2 单因素试验
分别以pH值、提取料液比、浸提时间、L-Cys浓度、PMSF浓度、缓冲液种类及缓冲液浓度为影响因素,以组织蛋白酶L酶活力为指标进行单因素试验[16]。
1.3.3 Plackett-Burman试验
通过对单因素试验进行分析,选择各影响因子的高(+1)、低(-1)2个水平,并以组织蛋白酶L活力为考察指标,采用Plackett-Burman试验筛选出显著影响组织蛋白酶L活力的因子。
1.3.4 双因素等重复试验
根据单因素试验和Plackett-Burman试验结果,采用双因素等重复试验,分析2个因素的交互作用。
1.3.5 AMC标准曲线的制作
用蒸馏水稀释AMC储备液得到一系列浓度的AMC溶液,使用全自动酶标仪在激发波长344 nm、发射波长436 nm下,以AMC浓度为横坐标,436 nm下荧光强度值为纵坐标,绘制标准曲线。
1.3.6 凡纳滨对虾肌肉组织蛋白酶L活力测定方法
参考祝倩倩[17]的方法,进行适当修改。取100 μL粗酶液,依次加入250 μL 50 mmol/L乙酸钠-乙酸缓冲液(pH 4.0),50 μL 10 μmol/L的底物Z-Phe-Arg-AMC,混匀后在60 ℃反应20 min,加入400 μL终止液(含0.1 mol/L乙酸钠、0.1 mol/L乙酸、0.1 mol/L氯乙酸钠,pH 4.55)终止反应,利用全自动酶标仪测定其荧光强度,所用的激发波长为344 nm,发射波长为436 nm。空白对照组先添加反应终止液,使酶失活,再加底物进行反应[18]。
酶活力单位(U)定义为在最适反应温度(60 ℃)和pH 4.0条件下,1 min内水解底物并释放1 ng AMC产物的酶量(1 ng AMC/min)[19]。总酶活力及酶活力得率计算如公式(1)、公式(2)所示:
(1)
式中:X为总酶活力,U;V1为反应体系总体积,mL;V2为粗酶液总体积,mL;V3为反应体系粗酶液加入量,mL;T为反应时间,min。
酶活力得率![]()
(2)
式中:X为总酶活力,U;M为虾肉质量,g。
1.3.7 组织蛋白酶L的分离纯化
粗酶液分别进行饱和度为40%、50%、60%、70%、80%、90%硫酸铵溶液的分级沉淀[20],充分透析后上样于Q-Sepharose F.F阴离子交换层析,经20 mmol/L pH 7.0的Tris-HCl缓冲液平衡后,用0.1~0.5 mol/L 5个梯度的NaCl缓冲液(pH 7.0)线性洗脱2个柱体积,每管收集4 mL,在紫外波长280 nm下检测收集溶液的吸收波长,作出蛋白峰值曲线。收集可检测到酶活力的蛋白溶液,经分子质量10 kDa的超滤离心管浓缩,浓缩酶液经Sephadacryl S-100凝胶过滤层析,用20 mmol/L pH 7.0的Tris-HCl缓冲液洗脱,收集可检测到酶活力的蛋白峰尖和峰腰溶液,每管收集1.5 mL,做蛋白峰值与酶活曲线。利用SDS-PAGE技术对工艺优化提取前后,层析前后的组织蛋白酶L进行鉴定[21]。
1.3.8 组织蛋白酶L对肌原纤维蛋白的降解分析
1.3.8.1 肌原纤维蛋白的提取
取5.0 g虾糜加入45.0 mL预冷的0.02 mol/L Tris-HCl缓冲液(pH 7.0),在冰浴条件下均质1 min后,进行4 ℃,12 000 r/min离心10 min,弃上清液,重复操作1次后,往沉淀中加入0.02 mol/L 磷酸缓冲液(0.5 mol/L NaCl,pH 7.5),冰浴条件下均质1 min后,在4 ℃,12 000 r/min离心15 min,取上清液即为虾肉肌原纤维,立即分装冷藏备用[22]。
1.3.8.2 组织蛋白酶L对肌原纤维蛋白的降解作用
在提取的肌原纤维蛋白中加入纯化后组织蛋白酶L,与50 mmol/L乙酸钠-乙酸缓冲液(pH 4.0)充分混合,在50 ℃条件下分别反应0、30、60、120 min后[19],用SDS-PAGE进行分析,观察肌原纤蛋白的降解情况[3]。
以AMC浓度为横坐标,436 nm下荧光强度值为纵坐标,绘制标准曲线,得到AMC标准曲线y=129.51x+0.060 2 (R2=0.999 8)。
单因素试验结果见图1。在pH 3.0~8.0提取的组织蛋白酶L均有活性,在pH 7.0时出现最大值,在pH 4.0条件下出现了最小值。用Tris-HCl缓冲液的提取结果均优于NaH2PO4-Na2HPO4缓冲液,在浓度达到40 mmol/L时达到最大值,随着缓冲液浓度继续上升,活性开始下降。Tris不易与钙、镁等离子和重金属离子发生沉淀,可减少对提取过程的干扰,有利于酶的提取[23]。随着料液比的增大,酶活性有所升高,在料液比1∶8后总酶活力变化不大。随着浸提时间延长,酶活力稍有下降,且呈现下降的程度保持不变,可能是4 ℃条件下浸提时有部分酶失活。随着L-Cys浓度增加,酶活力逐渐上升;当浓度达到6 mmol/L时出现最大值,当浓度继续增大时,酶活力略有下降,但与不添加L-Cys相比依然表现出激活作用。组织蛋白酶L是巯基蛋白酶,酶的活性中心含有巯基基团[24]。L-Cys是一种巯基保护剂,能保护活性中心的巯基从而提高组织蛋白酶L的活力。PMSF是一种丝氨酸蛋白酶抑制剂,适当浓度的PMSF能够激活半胱氨酸蛋白酶[25],在提取缓冲液中加入PMSF可以排除丝氨酸蛋白酶和其他蛋白酶的干扰,避免酶在提取过程中被其他蛋白酶作用而失活。随着PMSF浓度的增大,酶活力逐渐提升,在浓度达到0.4 mmol/L时出现最大值,浓度继续增大时,活性呈现下降趋势,但与不添加PMSF相比依然表现促进作用。
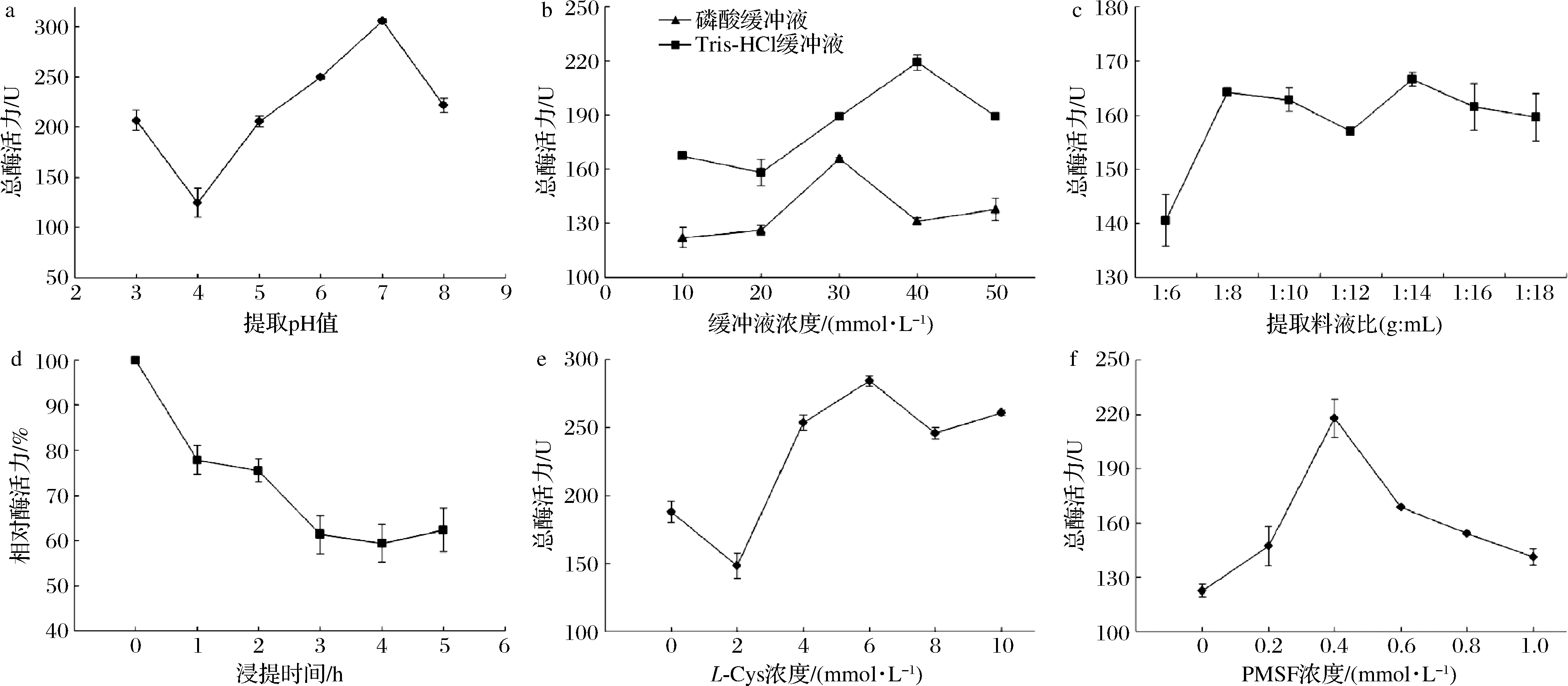
a-提取pH;b-缓冲液种类及缓冲液浓度;c-提取料液比;d-浸提时间;e-L-Cys浓度;f-PMSF浓度
图1 不同提取pH、缓冲液种类及缓冲液浓度、提取料液比、浸提时间、L-Cys浓度、PMSF浓度对组织蛋白酶L活性的影响
Fig.1 Effects of different extraction pH, buffer type and buffer concentration, solid-liquid ratio, extraction time, L-Cys
concentration, and PMSF concentration on the activity of cathepsin L
利用Design-Expert 11.0软件来设计Plackett-Burman试验,选择试验次数N为12。探究提取料液比、提取pH值、Tris-HCl缓冲液浓度、L-Cys浓度、PMSF浓度等5个因素对组织蛋白酶L活性的影响,如表1、表2所示。因浸提时间在0 h时的总酶活力最高,且总酶活力随着时间延长逐渐下降,考虑到提取效率,此因素不参与该试验[26]。实验数据用Design-Expert 11.0软件处理,其中提取pH与提取料液比为显著性因素(表3)。
表1 Plackett-Burman设计的因素和水平
Table 1 Plackett-Burman test design factors and levels

水平提取pHTris-HCl缓冲液浓度/(mmol·L-1)L-Cys浓度/(mmol·L-1)PMSF浓度/(mmol·L-1)料液比(g∶mL)-16.53060.41∶6+18.0407.50.51∶8
表2 Plackett-Burman试验设计及结果
Table 2 Plackett-Burman test design and results

试验号提取pHTris-HCl缓冲液浓度L-Cys浓度PMSF浓度料液比组织蛋白酶L总酶活力/U1+1+1-1+1+1111.342-1+1+1+1-1331.343+1+1+1-1-1153.114+1-1-1-1+1127.345-1+1-1+1+1214.886+1+1-1-1-1176.857+1-1+1+1+1151.838-1-1+1-1+1208.799-1+1+1-1+1246.0110+1-1+1+1-1163.4611-1-1-1+1-1304.5912-1-1-1-1-1290.71
表3 各因素效应值及其显著性分析
Table 3 Effect size and significance analysis of each factor
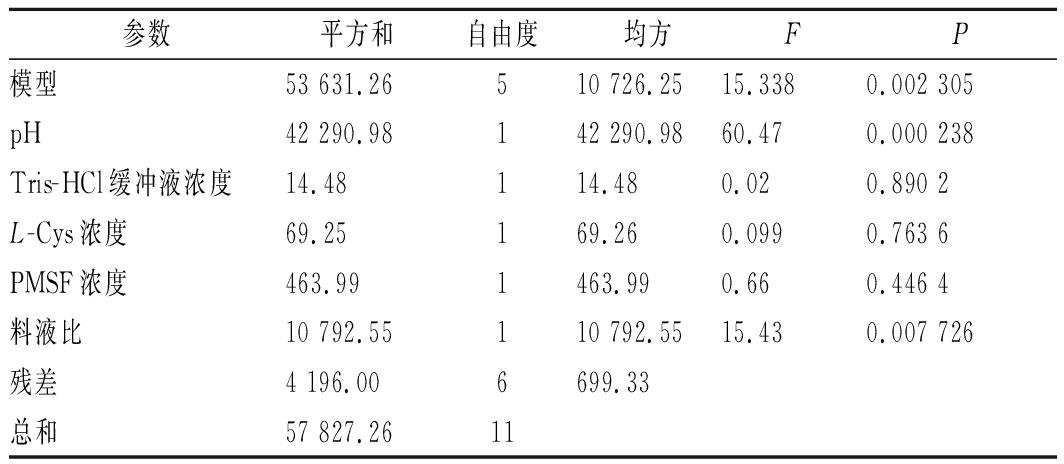
参数平方和自由度均方FP模型53 631.26510 726.2515.3380.002 305pH42 290.98142 290.9860.470.000 238Tris-HCl缓冲液浓度14.48114.480.020.890 2L-Cys浓度69.25169.260.0990.763 6PMSF浓度463.991463.990.660.446 4料液比10 792.55110 792.5515.430.007 726残差4 196.006699.33总和57 827.2611
为研究提取pH与提取料液比的交互作用对组织蛋白酶L总酶活力的影响,进行双因素等重复试验,用SPSS 22.0软件对结果进行方差分析,结果如表4、表5所示。提取pH、提取料液比、提取pH与提取料液比交互作用的P值均为0.00,验证了Plackett-Burman试验中提取pH与提取料液比对组织蛋白酶L总酶活力有显著性影响的结论,且反映了两者存在显著的交互作用。
表4 双因素等重复试验试验设计方案及结果
Table 4 Two factors repeated equally test
design scheme and results
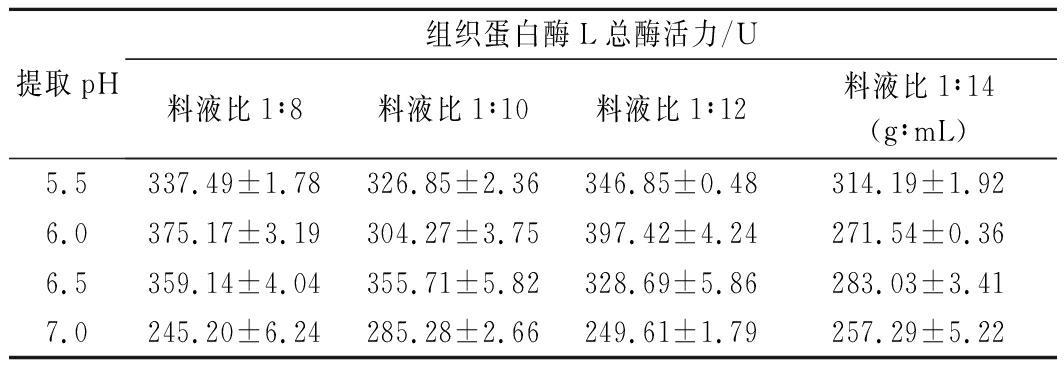
提取pH组织蛋白酶L总酶活力/U料液比1∶8料液比1∶10料液比1∶12料液比1∶14(g∶mL)5.5337.49±1.78326.85±2.36346.85±0.48314.19±1.926.0375.17±3.19304.27±3.75397.42±4.24271.54±0.366.5359.14±4.04355.71±5.82328.69±5.86283.03±3.417.0245.20±6.24285.28±2.66249.61±1.79257.29±5.22
表5 提取pH及提取料液比对组织蛋白酶L
总酶活力作用的双因素方差分析
Table 5 Two-factor analysis of variance of total
enzyme activity of cathepsin L by the extraction pH
value and the material/liquid radio
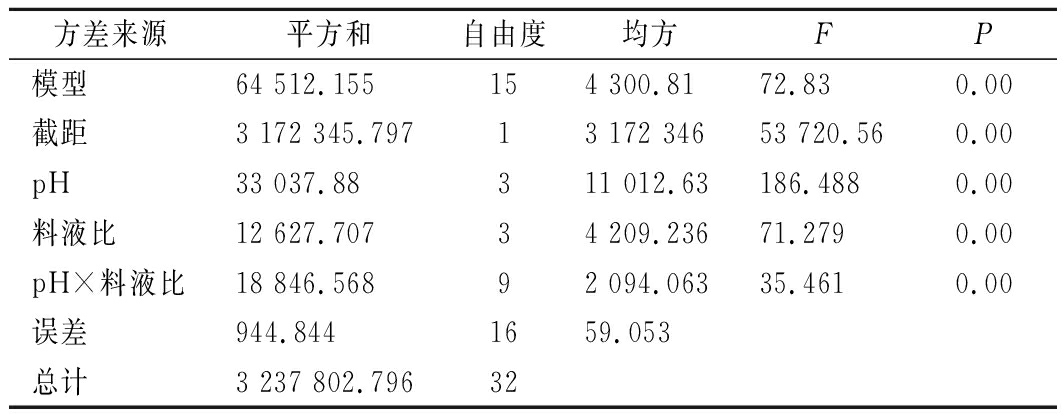
方差来源平方和自由度均方FP模型64 512.155154 300.8172.830.00截距3 172 345.79713 172 34653 720.560.00pH33 037.88311 012.63186.4880.00料液比12 627.70734 209.23671.2790.00pH×料液比18 846.56892 094.06335.4610.00误差944.8441659.053总计3 237 802.79632
通过单因素试验与Plackett-Burman试验分析得知影响提取组织蛋白酶L活力的显著因素为pH值和提取料液比[16],在双因素等重复试验中结果中发现在条件为提取pH值6.0、提取料液比1∶12(g∶mL)时,组织蛋白酶L总酶活力出现最大值(397.42±4.24) U;其次是在提取pH值6.0、提取料液比1∶8(g∶mL)时,组织蛋白酶L总酶活力值达(375.17±3.19)U,与最大值相差12.25 U。综合提取成本,选择提取pH 6.0和料液比1∶8(g∶mL)为最适提取条件,同时结合单因素试验中的结果,确定凡纳滨对虾肌肉组织蛋白酶L的最佳提取条件为:缓冲液体系(Tris-HCl缓冲液浓度40 mmol/L,L-Cys浓度6 mmol/L,PMSF浓度0.4 mmol/L),料液比1∶8(g∶mL),pH 6.0。优化后的总酶活力值从62.36 U升至378.36 U,酶活力得率从60.9 U/g 提高到150.1 U/g。
粗酶液经Q-Sepharose F.F阴离子柱交换层析,结果见图2,总共洗脱出5个主要的蛋白吸收峰,其中峰1为穿透峰,穿透峰峰值最高但未测出酶活力,表明缓冲液能够较好地洗脱出杂蛋白;组织蛋白酶L从峰2开始被洗脱出来,其中组织蛋白酶L主要在峰3时被洗脱出来,峰4、峰5基本上不含有组织蛋白酶L,其中峰3对应的盐浓度为0.2 mol/L,可知0.2 mol/L NaCl为最佳洗脱浓度,所以主要收集0.2 mol/L NaCl缓冲液洗脱出来的溶液进行下一步的浓缩和纯化。颜龙杰等[19]采用SP-Sepharose阳离子层析柱线性洗脱组织蛋白酶L,崔昱清等[22]采用DEAE Sephacel 阴离子交换层析柱梯度洗脱组织蛋白酶L。本实验采用Q-Sepharose F.F阴离子交换层析柱运用NaCl梯度洗脱取得较好的分离效果,纯化倍数达到13.09,同时操作过程简单,上样量大。
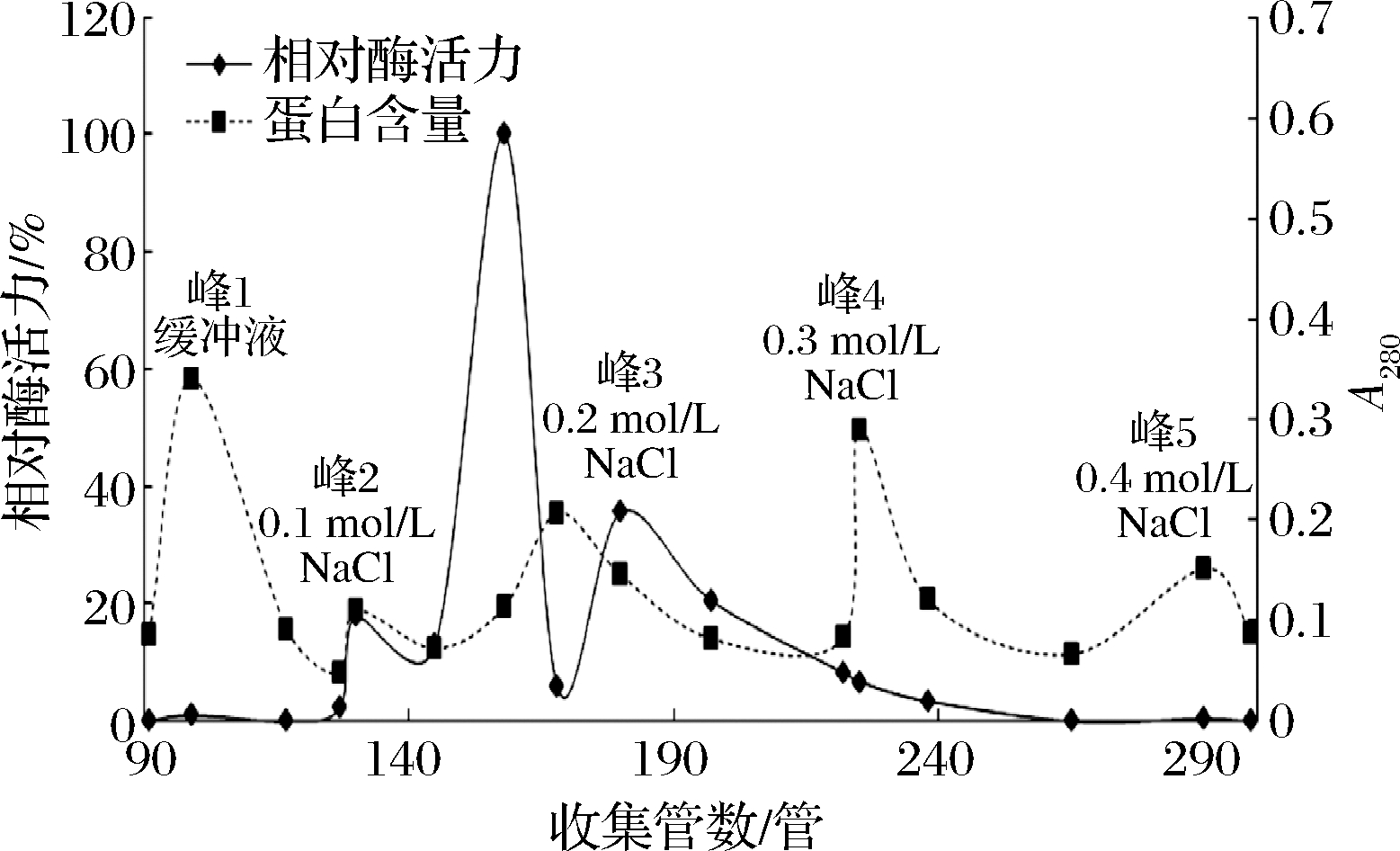
图2 Q-Sepharose F.F 阴离子交换柱层析纯化
组织蛋白酶L
Fig.2 Purification of cathepsin L by Q-Sepharose
F.F anion exchange column chromatography
将经过阴离子交换层析柱0.2 mol/L盐浓度缓冲液洗脱得到的样品进行Sephacryl S-100凝胶层析后结果如图3所示,经过Sephacryl S-100凝胶层析柱,组织蛋白酶L能够很好地与杂质蛋白分离开,图中出现2个主要的蛋白吸收峰,其中绝大部分蛋白质集中在第1个蛋白峰但对应的组织蛋白酶L活性不明显;而第2个蛋白峰刚好相反,蛋白含量极低但对应组织蛋白酶L活性极高。沈建东[27]采用Sephacryl S-200 HR凝胶层析柱从皱纹盘鲍组织中分离组织蛋白酶L。本实验运用Sephacryl S-100凝胶层析柱分离后组织蛋白酶L纯化倍数为298.28,过程操作简单,分离效果好。组织蛋白酶L在分离纯化过程中受到温度、离子浓度、盐浓度、酶相互作用等的影响逐渐失去活性,因此在获得较高纯度组织蛋白酶L时,组织蛋白酶L部分损失导致得率降低[28]。其中组织蛋白酶L纯化过程中的比活力、得率、纯化度如表6所示,经过离子交换层析和凝胶过滤层析后得到的活性成分与粗酶液相比较,比活力从0.34提高到101.15 U/mg,纯化倍数为298.28,产率为16.50%。
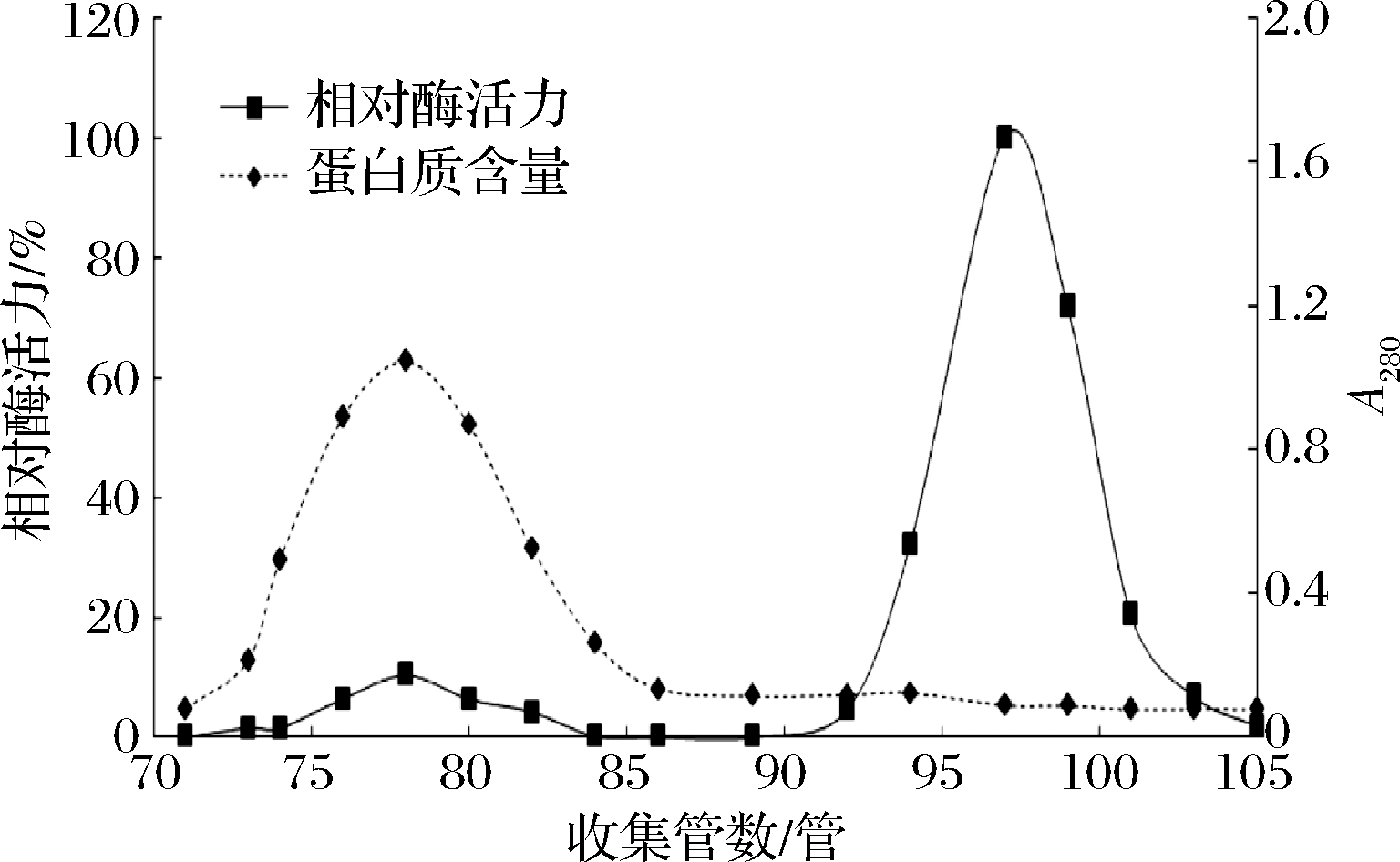
图3 Sephadex S-100 凝胶层析柱纯化组织蛋白酶L
Fig.3 Purification of cathepsin L by Sephadex S-100
gel column
表6 组织蛋白酶L主要提取分离结果对比
Table 6 Comparison of main extraction and
separation results of cathepsin L
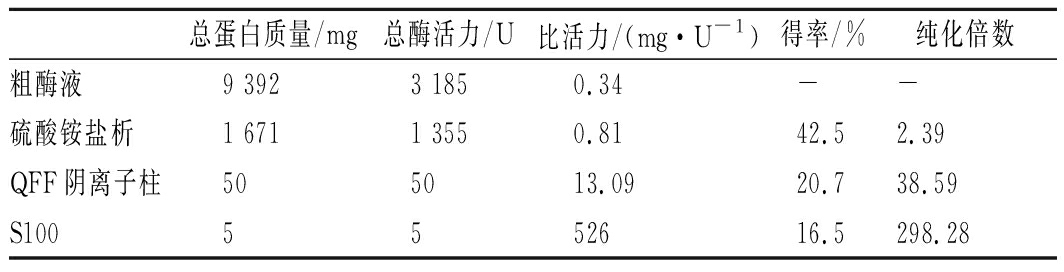
总蛋白质量/mg总酶活力/U比活力/(mg·U-1)得率/%纯化倍数粗酶液9 3923 1850.34--硫酸铵盐析1 6711 3550.8142.52.39QFF阴离子柱505013.0920.738.59S1005552616.5298.28
经过各种纯化方式收集的蛋白酶进行SDS-PAGE,结果如图4所示,每个分离纯化方法都起到一定的纯化效果,其中粗酶液主要含有5条蛋白带,经过离子交换层析除去了大部分杂蛋白,再经过凝胶过滤层析得到高纯度的蛋白酶液,电泳结果显示单条蛋白条带其分子质量大小约为46 kDa,因此本试验筛选的工艺参数能够有效地分离组织蛋白酶L。

M-标准分子质量蛋白; L0-工艺优化前提取酶液;L1-工艺优化后
提取酶液;Q-F.F-Q-Sepharose F.F阴离子柱交换层析收集液;
S-100-Sephacryl S-100凝胶层析收集液
图4 组织蛋白酶L的SDS-PAGE电泳
Fig.4 SDS-PAGE analysis of cathepsin L
本研究从虾肉中纯化出的组织蛋白酶L的分子质量与已经报道的组织蛋白酶L的分子质量(约为31 kDa)差距较大,卜兴江等[29]发现中国明对虾组织蛋白酶L基因的酶原片段表达产物分子质量在40 kDa左右,颜龙杰等[19]从凡纳滨对虾肝胰腺中纯化获得1种组织蛋白酶L,分子质量约为31 kDa,存在的差异可能是提取组织蛋白酶L的部位和原料不同造成的,有待进一步深入研究。
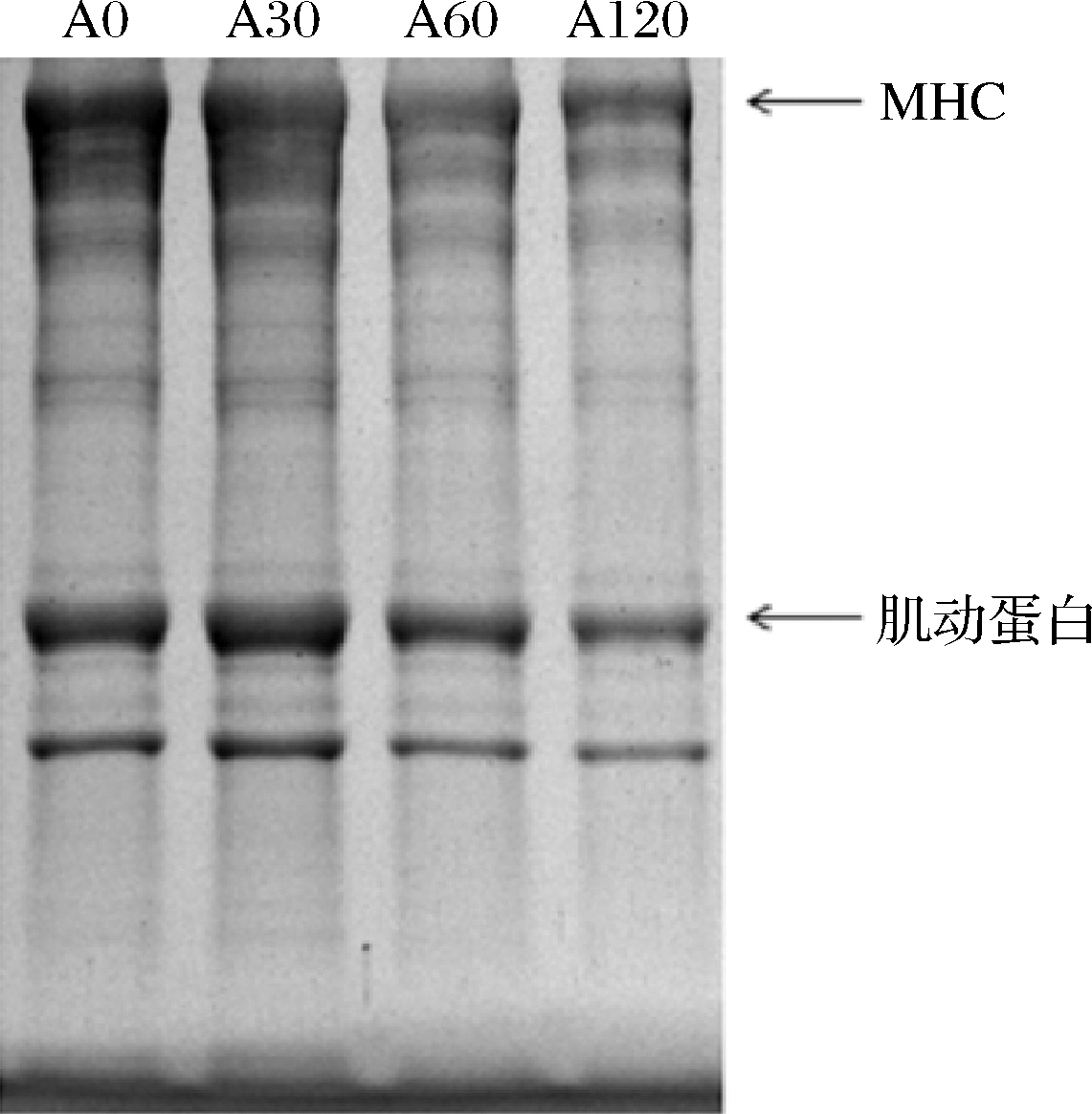
A0-0min;A30-30min;A60-60min;A120-120min
图5 组织蛋白酶L对虾肉肌原纤维蛋白的降解情况
Fig.5 Cathepsin L degradation of shrimp myofibrillar protein
虾在贮藏过程中,易出现虾体软化和质构劣变现象,主要原因是虾肉中肌原纤维蛋白的裂解。有研究发现肌肉中内源蛋白酶对肌原纤维有明显降解作用,其中内源性半胱氨酸蛋白酶主要降解肌原纤维蛋白[9],其中组织蛋白酶L是一种半胱氨酸蛋白水解酶。XU等[10]研究发现半胱氨酸蛋白酶对冷冻鱼片肌肉降解的软化作用较为明显,YANG等[28]发现组织蛋白酶L对肌原纤维蛋白降解作用比其他蛋白酶强,对肌肉蛋白品质和质地特性的影响也比其他蛋白酶大。ZHANG等[12]发现组织蛋白酶L在石斑鱼肌原纤维蛋白的降解中起最重要的作用。PENG等[3]发现凡纳滨对虾肝胰腺中的蛋白酶对肌肉降解有一定作用,并且组织蛋白酶L广泛存在于凡纳滨对虾肌肉中[30],为进一步验证组织蛋白酶L对凡纳滨对虾中肌原纤维蛋白的降解作用,进行了组织蛋白酶水解肌原纤维蛋白的模拟体系,验证纯化后组织蛋白酶L对凡纳滨对虾肌原纤维蛋白的降解作用。在pH 4.0条件下内源蛋白酶对肌原纤维的降解作用明显,50~60 ℃是内源蛋白酶的反应最适温度。在50 ℃条件下,在肌原纤维蛋白中加入纯化后的组织蛋白酶L,随着时间的延长,组织蛋白酶L对肌球蛋白重链(myosin heavy chain,MHC)和肌动蛋白迅速降解,MHC与肌动蛋白降解越来越明显,说明纯化组织蛋白酶L对肌原纤维蛋白有明显降解作用(图5)。本试验证实了组织蛋白酶L是降解肌原纤维蛋白的主要酶类之一,但具体内源蛋白酶的降解作用机制有待进一步研究。
通过单因素试验、Plackett-Burman试验和双因素等重复试验,确定对虾肌肉中组织蛋白酶L最佳提取条件为:缓冲液体系(Tris-HCl缓冲液浓度40 mmol/L,L-Cys浓度6 mmol/L,PMSF浓度0.4 mmol/L),料液比1∶8(g∶mL),pH 6.0,在此条件下提取的组织蛋白酶L酶活力得率达150.1 U/g。粗酶液进一步分离纯化得到单条带的组织蛋白酶L,酶比活力从0.34 提高到了101.15 U/mg,纯化倍数达到298.28倍,得率为16.50%,分子质量为46.4 kDa,提纯后的组织蛋白酶L会使肌球蛋白重链和肌动蛋白迅速降解,这表明提纯后的组织蛋白酶L对肌原纤维蛋白有明显的降解作用。本研究为虾类贮藏过程中品质控制提供科学依据,而组织蛋白酶L对肌肉的作用机制有待进一步研究。
[1] YUAN Y, LUO J X, ZHU T T, et al.Alteration of growth performance, meat quality, antioxidant and immune capacity of juvenile Litopenaeus vannamei in response to different dietary dosage forms of zinc:Comparative advantages of zinc amino acid complex[J].Aquaculture, 2020, 522:735120.
[2] 农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会.2020年中国渔业统计年鉴[M].北京:中国农业出版社, 2020.
Ministry of Agriculture and Rural Affairs of the People′s Republic of China, National Fisheries Technology Extension Centre, China Society of Fisheries.2020 China Fishery Statistical Yearbook[M].Beijing:China Agriculture Press, 2020.
[3] PENG Y H, CHEN S Y, JI H W, et al.Localization of trypsin-like protease in postmortem tissue of white shrimp (Litopenaeus vannamei) and its effect in muscle softening[J].Food Chemistry, 2019, 290:277-285.
[4] LI D Y, XIE H K, LIU Z Y, et al.Shelf life prediction and changes in lipid profiles of dried shrimp (Penaeus vannamei) during accelerated storage[J].Food Chemistry, 2019, 297:124951.
[5] 杨帆, 万金庆, 厉建国.微冻贮藏虾仁的水分迁移与品质变化[J].食品与发酵工业, 2019, 45(20):68-74.
YANG F, WAN J Q, LI J G.Study on water migration and quality changes of shrimp in hyper-chilling storage[J].Food and Fermentation Industries, 2019, 45(20):68-74.
[6] SINGH A, BENJAKUL S.Proteolysis and its control using protease inhibitors in fish and fish products:A review[J].Comprehensive Reviews in Food Science and Food Safety, 2018, 17(2):496-509.
[7] YANG F, JING D T, YU D W, et al.Differential roles of ice crystal, endogenous proteolytic activities and oxidation in softening of obscure pufferfish (Takifugu obscurus) fillets during frozen storage[J].Food Chemistry, 2019, 278:452-459.
[8] 殷浩文, 张璐璐, 张坤, 等.水产品贮藏过程中蛋白质降解机制及防控措施研究进展[J].安徽农业科学, 2020, 48(18):4-7.
YIN H W, ZHANG L L, ZHANG K, et al.Research progress of protein degradation mechanism and prevention and control measures during aquatic product storage[J].Journal of Anhui Agricultural Sciences, 2020, 48(18):4-7.
[9] LIU B, LIU Z Q, LI D Y, et al.Action of endogenous proteases on texture deterioration of the bay scallop (Argopecten irradians) adductor muscle during cold storage and its mechanism[J].Food Chemistry, 2020, 323:126790.
[10] XU Y S, GE L H, JIANG X Q, et al.Inhibitory effect of aqueous extract of Allium species on endogenous cathepsin activities and textural deterioration of ice-stored grass carp fillets[J].Food and Bioprocess Technology, 2015, 8(10):2 171-2 175.
[11] AHMED Z, DONKOR O, STREET W A, et al.Calpains-and cathepsins-induced myofibrillar changes in post-mortem fish:Impact on structural softening and release of bioactive peptides[J].Trends in Food Science & Technology, 2015, 45(1):130-146.
[12] ZHANG X C, XIE J.The differential effects of endogenous cathepsin and microorganisms on changes in the texture and flavor substances of grouper (Epinephelus coioides) fillets[J].RSC Advances, 2020, 10(18):10 764-10 775.
[13] GE L H, XU Y S, XIA W S, et al.Synergistic action of cathepsin B, L, D and calpain in disassembly and degradation of myofibrillar protein of grass carp[J].Food Research International, 2018, 109:481-488.
[14] TAKAHASHI K, KUROSE K, OKAZAKI E, et al.Effect of various protease inhibitors on heat-induced myofibrillar protein degradation and gel-forming ability of red tilefish (Branchiostegus japonicus) meat[J].LWT-Food Science and Technology, 2016, 68:717-723.
[15] 田元勇, 宋扬, 郑尧, 等.鱿鱼肝脏蛋白酶的鉴定及组织蛋白酶L的分离纯化[J].食品科学, 2017, 38(24):28-33.
TIAN Y Y, SONG Y, ZHENG Y, et al.Identification of proteases and purification of cathepsin L from squid liver[J].Food Science, 2017, 38(24):28-33.
[16] 李琳, 王正全, 张晶晶, 等.暗纹东方鲀肌肉组织蛋白酶B提取工艺优化[J].食品科学, 2016, 37(3):91-96.
LI L, WANG Z Q, ZHANG J J, et al.Optimization of extraction conditions for cathepsin B from Takifugu obscures muscle[J].Food Science, 2016, 37(3):91-96.
[17] 祝倩倩. 中华绒螯蟹和南极磷虾组织蛋白酶家族的酶学性质研究[D].青岛:青岛科技大学, 2017.
ZHU Q Q.Study on enzymatic properties of cathepsin family from Eriocheir sinensis and Euphausia superba [D].Qingdao:Qingdao University of Science and Technology, 2017.
[18] 曹晓杰, 孙钦秀, 魏帅, 等.加热过程中虾肌肉组织蛋白酶L的酶活力变化及其动力学[J].广东海洋大学学报, 2020, 40(3):108-113.
CAO X J, SUN Q X, WEI S, et al.Changes and kinetics activity of cathepsin L from shrimp muscle during heating[J].Journal of Guangdong Ocean University, 2020, 40(3):108-113.
[19] 颜龙杰, 沈建东, 张凌晶, 等.凡纳滨对虾组织蛋白酶L性质分析及其对肌肉蛋白的降解[J].食品科学, 2017, 38(22):34-40.
YAN L J, SHEN J D, ZHANG L J, et al.Characterization of cathepsin L from Litopenaeus vannamei and its effect on muscular protein degradation[J].Food Science, 2017, 38(22):34-40.
[20] 郭晓坤, 李傲婷, 韩佳润, 等.海参肠组织蛋白酶D的提取及酶学特性研究[J].食品工业科技, 2017, 38(18):135-139;144.
GUO X K, LI A T, HAN J R, et al.Extraction and characterization of cathepsin D from sea cucumber (Stichopus japonicus) guts[J].Science and Technology of Food Industry, 2017, 38(18):135-139;144.
[21] FUJITA T, SHIOTA K, YOSHIKAWA J, et al.Simple method for analyzing the purity of protease-containing samples by acid-treatment SDS-PAGE[J].Journal of Bioscience and Bioengineering, 2019, 128(5):630-635.
[22] 崔昱清, 王复龙, 崔保威, 等.牛胰脏组织蛋白酶L的纯化和酶学性质[J].食品科学, 2015, 36(15):142-146.
CUI Y Q, WANG F L, CUI B W, et al.Purification and characterization of cathepsin L from bovine pancreas[J].Food Science, 2015, 36(15):142-146.
[23] 卢涵.-20 ℃下鳙鱼肉中组织蛋白酶B及L对其肌纤维微结构及持水力的影响[J].华中农业大学学报, 2019, 38(5):122-129.
LU H.Effects of cathepsin B and L on myofibrillar microstructure and water-holding capacity of bighead carp (Aristichthys nobilis) fillets stored at -20 ℃[J].Journal of Huazhong Agricultural University, 2019, 38(5):122-129.
[24] 王玲, 年益莹, 薛鹏, 等.刺参2种天冬氨酸蛋白酶的酶学性质及其对自溶的影响[J].食品科学, 2018, 39(14):99-105.
WANG L, NIAN Y Y, XUE P, et al.Two aspartic proteases in sea cucumber (Stichopus japonicus):Enzymatic properties and effect on autolysis[J].Food Science, 2018, 39(14):99-105.
[25] SHEN J D, CAI Q F, YAN L J, et al.Cathepsin L is an immune-related protein in Pacific abalone (Haliotis discus hannai):Purification and characterization[J].Fish and Shellfish Immunology, 2015, 47(2):986-995.
[26] 王文婷, 刘昕, 余群力, 等.牦牛肉组织蛋白酶L提取工艺的优化[J].食品与发酵工业, 2013,39(1):225-230.
WANG W T, LIU X, YU Q L, et al.Optimization of the technology for extracting cathepsin L from yak meat[J].Food and Fermentation Industries, 2013,39(1):225-230.
[27] 沈建东. 皱纹盘鲍组织蛋白酶L的分离纯化、性质分析及分子克隆[D].厦门:集美大学, 2013.
SHEN J D.Purification, enzymatic characterization and molecular cloning of cathepsin L from Pacific abalone (Haliotis discus hannai) [D].Xiamen:Jimei University, 2013.
[28] YANG F, RUSTAD T, XU Y S, et al.Endogenous proteolytic enzymes-A study of their impact on cod (Gadus morhua) muscle proteins and textural properties in a fermented product[J].Food Chemistry, 2015, 172:551-558.
[29] 卜兴江, 仉晓文, 孙允东, 等.中国明对虾组织蛋白酶L的原核重组表达及其组织分布[J].中国水产科学, 2008, 15(6):910-916.
BU X J, ZHANG X W, SUN Y D, et al.Recombinant expression and tissue distribution of cathepsin L from Chinese shrimp Fenneropenaeus chinensis[J].Journal of Fishery Sciences of China, 2008, 15(6):910-916.
[30] SRIKET C, BENJAKUL S, VISESSANGUAN W.Characterisation of proteolytic enzymes from muscle and hepatopancreas of fresh water prawn (Macrobrachium rosenbergii)[J].Journal of the Science of Food and Agriculture, 2011, 91(1):52-59.