重组谷氨酸棒杆菌全细胞催化一步法合成高果糖浆
HABIMANA,乔郅钠,徐美娟,杨套伟,张显,邵明龙,饶志明*
(江南大学 生物工程学院,江苏 无锡,214122)
摘 要 高果糖浆是一种可替代蔗糖的甜味剂,在食品和饮料行业应用广泛。该研究实现了经密码子优化的密苏里游动放线菌(Actinoplanes missouriensis) CICIM B0118(A)来源的葡萄糖异构酶在食品安全菌株谷氨酸棒杆菌(Corynebacterium glutamicum) 13032中的异源表达,构建了重组谷氨酸棒杆菌C.glutamicum 13032/pXMJ19-xylA。以其细胞菌体作为全细胞催化剂,对D-葡萄糖异构化生成D-果糖的全细胞转化体系进行优化,结果表明,菌体质量浓度40 g/L、底物D-葡萄糖质量浓度180 g/L、Mg2+浓度10 mmol/L、Co2+浓度1 mmol/L,70 ℃、220 r/min下连续转化18 h,D-果糖质量浓度达到103.32 g/L,转化率为57.4%,实现了高果糖浆的一步法安全生物合成。该研究为高果糖浆的工业化生产提供了实验和理论基础,具有重要的参考价值。
关键词 葡萄糖异构酶;异构化;全细胞催化;谷氨酸棒杆菌;高果糖浆
DOI:10.13995/j.cnki.11-1802/ts.027307
引用格式:HABIMANA,乔郅钠,徐美娟,等.重组谷氨酸棒杆菌全细胞催化一步法合成高果糖浆[J].食品与发酵工业,2022,48(2):8-14.HABIMANA,QIAO Zhina,XU Meijuan, et al.Recombinant Corynebacterium glutamicum whole cell catalyzes one-step synthesis of high fructose syrup[J].Food and Fermentation Industries,2022,48(2):8-14.
第一作者:硕士研究生(饶志明教授为通信作者,E-mail:raozhm@jiangnan.edu.cn)
基金项目:国家自然科学基金项目(31770058);江苏省自然科学基金项目(BK20181205)
收稿日期:2021-03-10,改回日期:2021-05-05
高果糖浆(high fructose syrup,HFS)是一种功能性糖类水溶液,用作蔗糖的替代品,是生产营养性饮料和食品最常用的甜味剂之一[1-2];还被认为是生产5-羟甲基糠醛和乙酰丙酸的可再生资源,可用于合成其他有价值的生物石油化学产品,如塑料、绿色溶剂、润滑剂和有价值的生物燃料[3-5]。与其他类型的糖相比,HFS还具备高甜度、高溶解度、低黏度、增强风味等优点,是良好的保湿剂,且不会在酸性食品中引起任何副作用、不会形成晶体[6-8]。根据果糖含量不同,可将HFS分为HFS-42、HFS-55和HFS-90这3种类型[9],但由于HFS-42型高果糖浆中果糖含量低,其医疗和保健价值不能得到充分发挥,且在低温贮运时易结晶析出[10],因此,具有更高果糖浓度的HFS-55型高果糖浆成为主流产品。
HFS的生产方法有化学催化法和酶法。化学催化法是葡萄糖在碱/酸性环境下异构化成果糖,异构化过程需在高温条件下进行,导致副产物多、选择性低[11-12]。酶法已成为HFS工业化生产的主要方法。TSUMURA等[13]发现嗜水假单胞菌中的木糖异构酶可以将葡萄糖异构化生成果糖。TSUMURA[14]和TAKASAKI等[15]先后发现了暗色产色链霉菌和白色链霉菌的葡萄糖异构酶,可以将葡萄糖异构化为果糖。已商业化的、用于HFS生产的葡萄糖异构酶,一般在60 ℃左右催化,转化率只能达到42%~45%,仅能用于HFS-42型高果糖浆的制备,要想获得HFS-55型高果糖浆,还需进行浓缩分离纯化操作[16]。BHOSALE等[16]发现,温度升高有利于葡萄糖异构化生成果糖,可以获得更高果糖浓度的HFS。因此,有很多研究通过筛选耐高温的葡萄糖异构酶,使其可以在在较高温度下仍具有较高酶活力,以实现一步法合成HFS-55型高果糖浆[17-19]。虽然,一步法生物合成HFS-55已取得一定成效,但其宿主细胞大多是大肠杆菌(Escherichia coli) BL21,在催化过程中,E.coli BL21可能会将不符合食品卫生要求的有害物质带入产品中,因此,实现葡萄糖异构酶在研究背景清晰的食品安全菌株中的异源表达,以一步法安全合成HFS-55型高果糖浆是非常有意义的。
谷氨酸棒杆菌是公认的食品安全性菌株,本研究以谷氨酸棒杆菌(Corynebacterium glutamicum) 13032作为宿主细胞,异源表达了经密码子优化的密苏里游动放线菌(Actinoplanes missouriensis) CICIM B0118(A)来源的葡萄糖异构酶,构建了重组谷氨酸棒杆菌C.glutamicum 13032/pXMJ19-xylA。以重组谷氨酸棒杆菌的细胞菌体作为全细胞催化剂,对D-葡萄糖异构化生成D-果糖的全细胞催化条件进行优化,最优转化体系下,实现了HFS-55型高果糖浆的一步法安全合成。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
菌株E.coli BL21、C.glutamicum 13032及质粒pXMJ19均由本实验室保存。含经密码子优化的A.missouriensis CICIM B0118(A)来源的葡萄糖异构酶编码基因xylA(GeneBank登录号:FJ858195.1)的重组质粒pET28a-xylA由苏州金唯智生物科技有限公司合成。
1.1.2 实验试剂
限制性内切酶EcoR I和Hind Ⅲ、高保真酶、同源重组酶克隆试剂盒,TaKaRa公司;小量质粒提取试剂盒、琼脂糖凝胶DNA回收试剂盒,上海捷瑞生物工程有限公司;氯霉素、异丙基-β-D-硫代半乳糖(isopropyl-β-D -thiogalactopyranoside,IPTG),上海生物工程(上海)股份有限公司;D-葡萄糖,麦克林;D-果糖,阿拉丁;甘油、咪唑、氯化钠等均为国产分析纯。
1.1.3 培养基及培养条件
LB培养基(g/L):酵母提取物5,胰蛋白胨10,氯化钠10(固体培养基添加质量分数为1.5%的琼脂粉),用于大肠杆菌培养;培养温度为37 ℃。
脑心浸液(brain heart infusion,BHI)培养基:38.5 g/L,用于谷氨酸棒杆菌培养,培养温度为30 ℃。
1.2 实验方法
1.2.1 重组菌株的构建
1.2.1.1 重组大肠杆菌E.coli BL21/pXMJ19-xylA的构建
以苏州金唯智生物科技有限公司提供的重组质粒pET28a-xylA为模板,以xylA-F:GAAACAGAATTAATTAAGCTT A AAGGAGGGAAATCATGTCTGTCCA-GGCCACACGCGAAG(Hind Ⅲ)和xylA-R:CAAAACAGCCAAGCTGAATTCTTAGCGGGCTCCGAGCAGGTGC(EcoR I)为引物进行PCR扩增,胶回收纯化后的PCR产物与事先用Hind Ⅲ和EcoR I双酶切且纯化后的pXMJ19线性化质粒按同源重组试剂盒说明书进行连接,连接产物转化E.coli BL21感受态细胞,得到的重组大肠杆菌命名为E.coli BL21/pXMJ19-xylA,重组质粒命名为pXMJ19-xylA。通过转化子菌落PCR和测序分析验证是否正确。
1.2.1.2 重组谷氨酸棒杆菌C.glutamicum 13032/pXMJ19-xylA的构建
将重组质粒pXMJ19-xylA电转化至C.glutamicum 13032感受态细胞,挑取转化子进行菌落PCR验证,验证正确的重组菌株命名为C.glutamicum 13032/pXMJ19-xylA。
1.2.2 葡萄糖异构酶的表达
将冻管保存的重组谷氨酸棒杆菌C.glutamicum 13032/pXMJ19-xylA首先在BHI固体平板上进行划线活化。之后,挑取单菌落转接含50 μg/mL氯霉素的10 mL BHI液体培养基,30 ℃、200 r/min下培养12~24 h后,按1%接种量转接含相同浓度氯霉素的50 mL BHI液体培养基,30 ℃、200 r/min下培养3~4 h,加入IPTG使其终浓度为0.5 mmol/L,继续于30 ℃摇床中培养12 h,以诱导GI表达。最后,4 ℃、10 000 r/min下离心10 min收集细胞,PBS(pH 7.4,0.05 mol/L)缓冲液洗涤2次后悬浮,加入适量溶菌酶后在冰上放置2~3 h,利用超声破碎仪对细胞进行破碎,设置参数:破1 s停3 s,共30 min。细胞破碎完成后,将破碎液在4 ℃、12 000 r/min条件下离心20 min,去除细胞破碎杂质,上清液处理后进行SDS-PAGE分析。
1.2.3 重组谷氨酸棒杆菌全细胞催化性能测试
反应体系 (25 mL):2.5 mL 8 mmol/L MgCl2、2.5 mL 200 μmol/L CoCl2、12.5 mL 2 mol/L D-葡萄糖和1 g重组谷氨酸棒杆菌菌体。70 ℃下反应1 h,冰浴5 min 终止反应[20]。离心取上清液进行HPLC分析。
HPLC检测条件为:RID示差检测器,Hi-Plex Ca(300 mm×7.7 mm)色谱柱,流动相为超纯水,流速为0.5 mL/min,柱温为80 ℃,进样量10 μL,检测波长为210 nm。
1.2.4 全细胞催化条件优化
1.2.4.1 菌体质量浓度对全细胞催化体系的影响
在底物D-葡萄糖质量浓度180 g/L、pH 7.0、Mg2+浓度10 mmol/L、Co2+浓度1 mmol/L条件下,控制菌体质量浓度分别为20、30、40、50、60 g/L(以细胞干重计,下同),70 ℃下反应1 h,HPLC检测转化液中D-果糖含量,以确定最适菌体质量浓度。
1.2.4.2 金属离子对全细胞催化体系的影响
在菌体质量浓度40 g/L、底物D-葡萄糖质量浓度180 g/L、pH 7.0条件下,分别添加不同金属离子Ba2+(1 mmol/L)、Cu2+(1 mmol/L)、Fe2+(1 mmol/L)、Mg2+(10 mmol/L)、Ca2+(1 mmol/L)、Mn2+(1 mmol/L)、Co2+(1 mmol/L)和Zn2+(1 mmol/L),70 ℃下反应1 h,HPLC检测转化液中D-果糖含量。
1.2.4.3 底物D-葡萄糖质量浓度对全细胞催化体系的影响
在菌体质量浓度40 g/L、pH 7.0、Mg2+浓度10 mmol/L、Co2+浓度1 mmol/L条件下,控制全细胞转化体系中底物D-葡萄糖质量浓度为18、90、180、270、360 g/L,70 ℃下反应1 h,HPLC检测转化液中D-果糖含量,以确定最适底物质量浓度。
1.2.4.4 pH对全细胞催化体系的影响
在菌体质量浓度40 g/L、底物D-葡萄糖质量浓度180 g/L、Mg2+浓度10 mmol/L、Co2+浓度1 mmol/L条件下,分别在pH 4.0~10.0(间隔1.0)的反应体系下,70 ℃下反应1 h,HPLC检测转化液中D-果糖含量,以确定最适反应pH。考察的缓冲液包括pH 4.0、5.0、6.0的乙酸-乙酸钠缓冲液,pH 7.0、8.0的Tris-HCl 缓冲液、pH 9.0、10.0的甘氨酸-NaOH 缓冲液,浓度均为50 mmol/L。
1.2.4.5 反应温度对全细胞催化体系的影响
在菌体质量浓度40 g/L、底物D-葡萄糖质量浓度180 g/L、pH 7.0、Mg2+浓度10 mmol/L、Co2+浓度1 mmol/L条件下,将全细胞催化体系分别置于40、50、60、70、80 ℃恒温水浴锅中反应1 h,HPLC检测转化液中D-果糖含量,以确定最适反应温度。
1.2.5 全细胞生物催化合成高果糖浆
将冻管保存的重组谷氨酸棒杆菌C.glutamicum 13032/pXMJ19-xylA在BHI固体平板上划线活化,挑取单菌落转接含50 μg/mL氯霉素的10 mL BHI液体培养基,30 ℃、200 r/min下培养12~24 h后,按1%接种量转接含相同氯霉素浓度的200 mL BHI液体培养基,30 ℃、200 r/min下培养3~4 h,加入IPTG继续于30 ℃摇床中培养12 h之后,4 ℃、10 000 r/min下离心10 min收集细胞,用作全细胞催化剂。
在最优全细胞转化条件(菌体质量浓度40 g/L、底物D-葡萄糖质量浓度180 g/L、pH 8.0、Mg2+浓度10 mmol/L、Co2+浓度1 mmol/L)下,70 ℃、220 r/min磁力搅拌器上反应18 h,每隔3 h采集1 mL样品,4 ℃、12 000 r/min离心15 min,获得的上清液进行HPLC分析,检测D-果糖含量。
2 结果与分析
2.1 葡萄糖异构酶编码基因xylA的克隆与表达
目前,已商业化的、用于HFS生产的葡萄糖异构酶,主要来源于凝结芽孢杆菌、鼠灰链霉菌和红色链霉菌。当温度高于60 ℃时,催化效率较低,转化率只能达到42%~45%。密苏里游动放线菌来源的葡萄糖异构酶具有高温下酶活力水平高、pH稳定范围为6.0~9.0等特点,这些都有利于HFS的合成。并且,有研究清晰表明了该来源葡萄糖异构酶的活性位点、底物结合位点等,为后期理性改造提高酶催化活性、热稳定性等提供了重要借鉴[21]。因此,本研究选用密苏里游动放线菌来源的葡萄糖异构酶进行HFS的合成。
将从NCBI数据库中检索到的A.missouriensis CICIM B0118(A)来源的葡萄糖异构酶编码基因的序列[21],长度为1 185 bp,提交至苏州金唯智生物科技有限公司人工合成,获得重组质粒pET28a-xylA,以该质粒为模板进行PCR扩增,电泳结果如图1-a所示,特异性条带(图1-a中的泳道1和2)位置与目标一致。将同源重组连接产物转入E.coli BL21感受态细胞中,构建重组大肠杆菌E.coli BL21/pXMJ19-xylA。重组大肠杆菌E.coli BL21/pXMJ19-xylA培养获得的重组质粒pXMJ19-xylA电转至C.glutamicum 13032,转化子菌落PCR鉴定结果如图1-b所示,目的条带的大小与预期一致,重组谷氨酸棒杆菌C.glutamicum 13032/pXMJ19-xylA构建成功,并按照方法1.2.2对重组谷氨酸棒杆菌C.glutamicum 13032/pXMJ19-xylA进行葡萄糖异构酶的诱导表达,SDS-PAGE分析表达情况,结果如图1-c所示,从图中泳道2和3可以看出,重组菌株C.glutamicum 13032/pXMJ19-xylA在分子质量43 kDa处有明显的蛋白表达条带,即葡萄糖异构酶在C.glutamicum 13032中成功实现表达。
2.2 全细胞催化性能测试
由于全细胞可保护酶免受恶劣环境和剪切力等的影响,而且可以重复批次转化,反应过程也无需添加任何辅因子或辅酶,因此,已逐渐替代粗酶或者纯酶广泛应用于目的产物的生物合成[22]。因此,本研究拟利用重组谷氨酸棒杆菌的全细胞作为催化剂来实现HFS的生物合成。
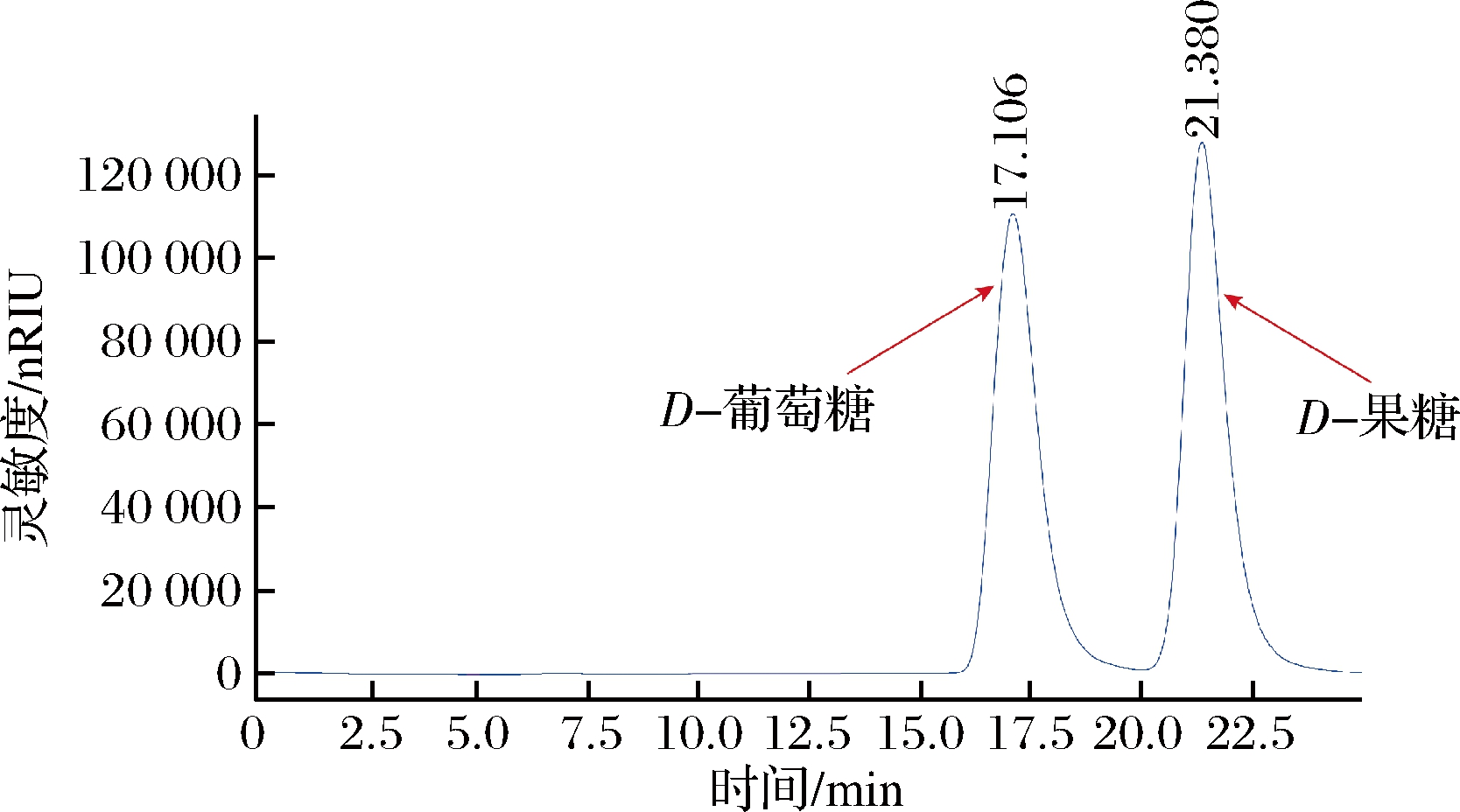
首先,对重组谷氨酸棒杆菌的全细胞催化性能进行测试,看其是否具备将D-葡萄糖异构化生成D-果糖的能力。结果如图2所示,重组谷氨酸棒杆菌全细胞催化剂可异构化D-葡萄糖生成D-果糖,图中D-葡萄糖出峰时间为17.106 min,D-果糖出峰时间为21.380 min,即重组谷氨酸棒杆菌具有生产HFS的潜力。下一步将针对D-葡萄糖异构化生成D-果糖的全细胞催化体系进行优化,探索菌体浓度、二价金属离子、底物D-葡萄糖浓度、反应pH以及反应温度对D-果糖合成的影响。
2.3 全细胞催化条件的优化
2.3.1 菌体浓度对D-葡萄糖生物转化合成D-果糖的影响
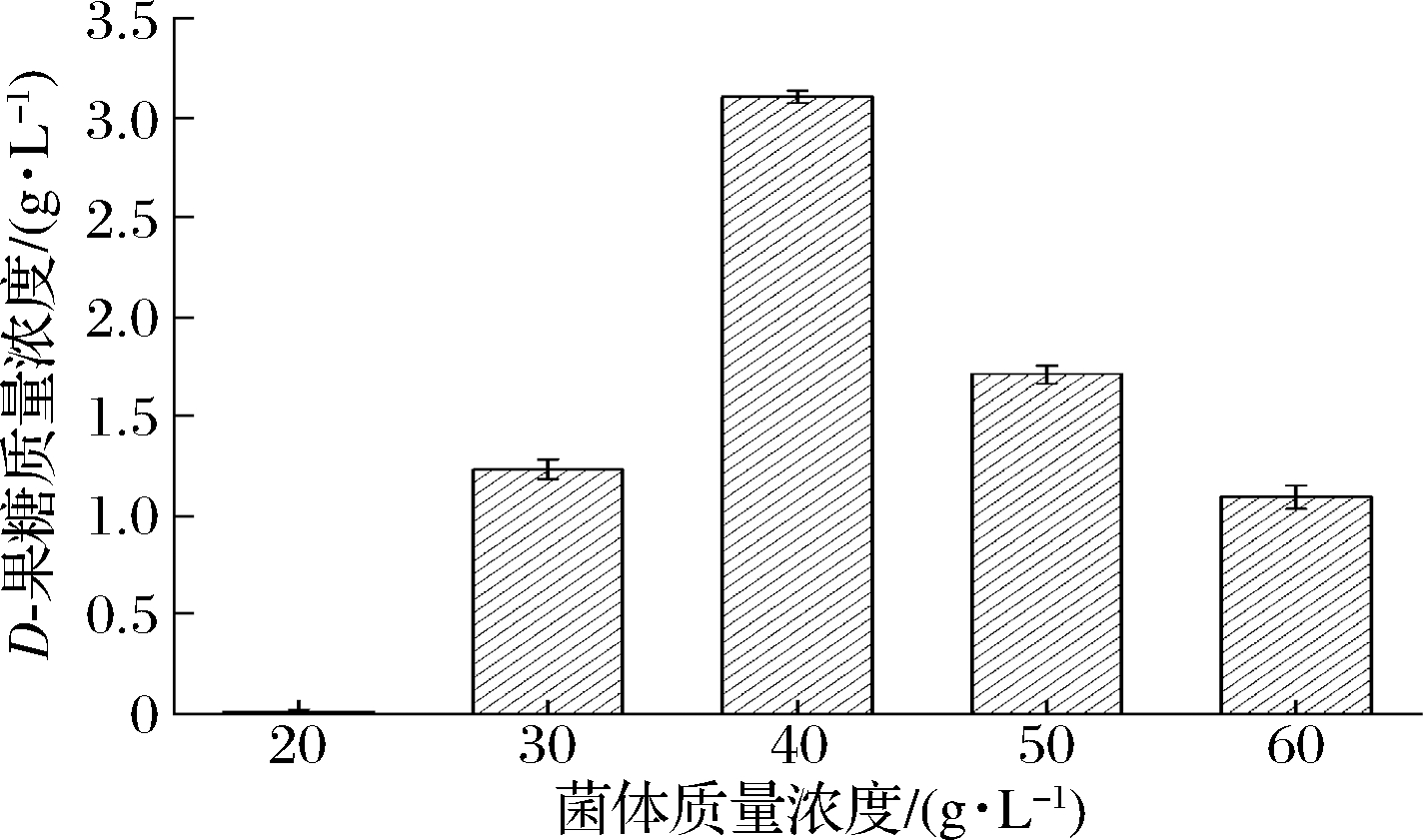
菌体浓度在一定程度上反映了转化体系中葡萄糖异构酶含量,因此,菌体浓度的不同可能会对D-葡萄糖异构化生成D-果糖的催化过程产生不同影响,结果如图3所示。随着菌体质量浓度升高,D-果糖含量不断上升;当菌体质量超过40 g/L时,虽然菌体浓度升高,但D-果糖含量却下降,可能是菌体浓度过高反而不利于底物输入和产物输出,因此,D-果糖含量下降。菌体质量浓度为40 g/L时,D-果糖含量最高,为3.1 g/L,即全细胞催化合成D-果糖的最适菌体质量浓度为40 g/L。
2.3.2 二价金属离子对D-葡萄糖生物转化合成D-果糖的影响
葡萄糖异构酶是一种金属酶,结合二价金属离子,D-葡萄糖异构化生成D-果糖的过程需二价金属离子来辅助异构化反应,二价金属离子对葡萄糖异构酶有3种作用:活化、稳定和提高底物D-葡萄糖的亲和力[16]。不同的葡萄糖异构酶需要不同的二价金属离子,目前所报道的大多数葡萄糖异构酶主要以Mg2+、Mn2+、Co2+[23],或以其中2种金属离子作为辅助催化剂[24]。
不同二价金属离子可能对D-葡萄糖异构化生成D-果糖的催化过程产生不同影响,因此,本研究测试了不同二价金属离子Ba2+、Cu2+、Fe2+、Mg2+、Ca2+、Mn2+、Co2+和Zn2+对D-葡萄糖异构化合成D-果糖的影响,结果如图4所示。结果表明,Cu2+、Ca2+和Zn2+的存在不利于D-葡萄糖异构化生成D-果糖,可能是Cu2+、Ca2+和Zn2+会抑制葡萄糖异构酶活性,因此,不利于D-果糖合成。而Ba2+、Fe2+、Mg2+、Mn2+和Co2+的存在则促进了D-果糖的合成,尤其是Mg2+和Co2+的存在,使得D-果糖含量分别达4.95、2.96 g/L,是对照(1.02 g/L)的4.85、2.9倍。
2.3.3 底物D-葡萄糖浓度对D-葡萄糖生物转化合成D-果糖的影响
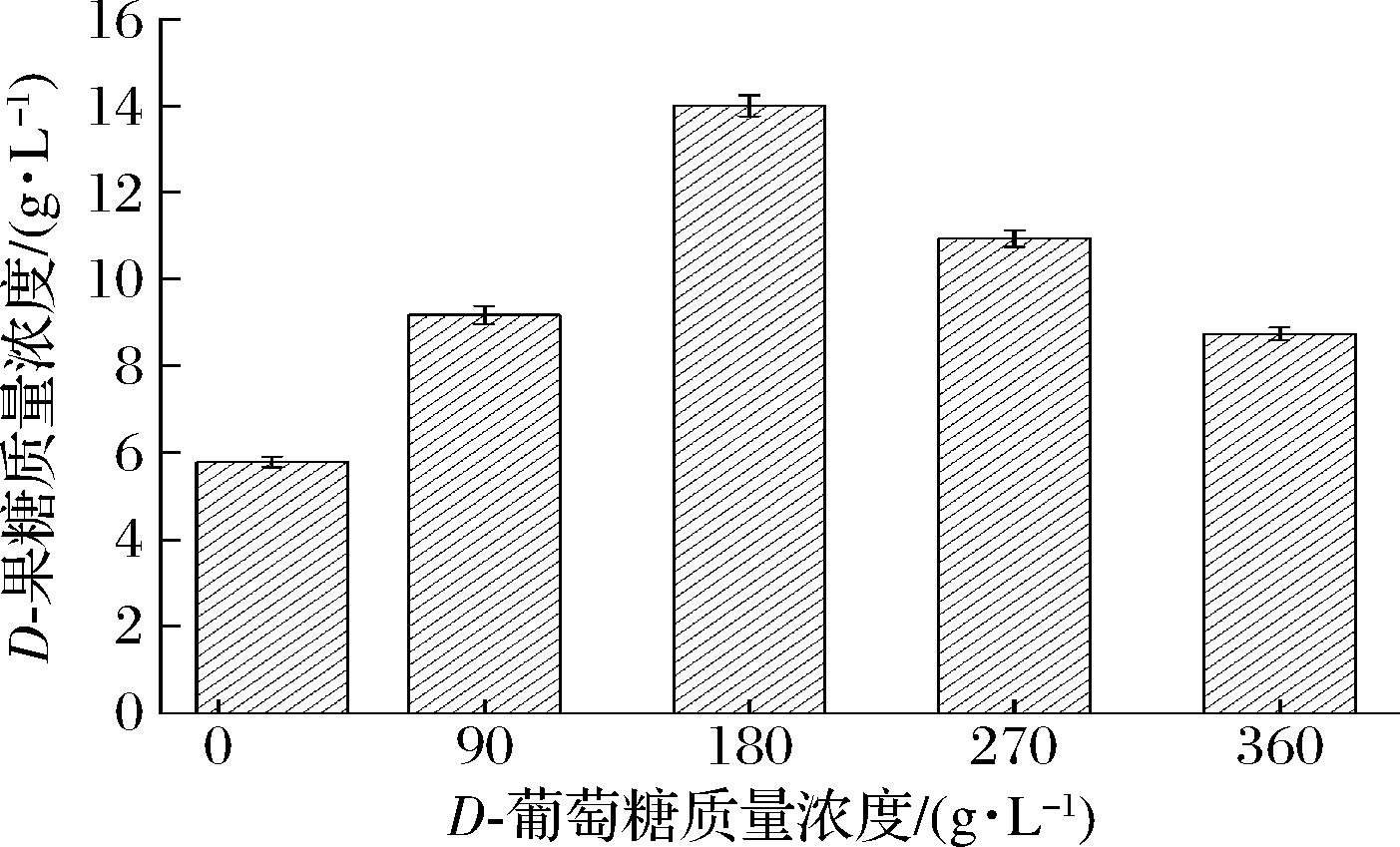
适当提高底物浓度可以加快酶促反应速率,促进产物合成。由图5可以看出,底物D-葡萄糖质量浓度在0~180 g/L,D-果糖含量随D-葡萄糖浓度的升高而升高,当底物D-葡萄糖质量浓度为180 g/L时,D-果糖含量达到最高,为14 g/L。当底物质量浓度高于180 g/L时,D-葡萄糖浓度升高,D-果糖含量反而下降,可能是D-葡萄糖浓度超过一定值后,继续升高就会对葡萄糖异构酶活性产生抑制,不利于葡萄糖异构化生成D-果糖,因此,D-果糖含量下降。
2.3.4 反应pH对D-葡萄糖生物转化合成D-果糖的影响
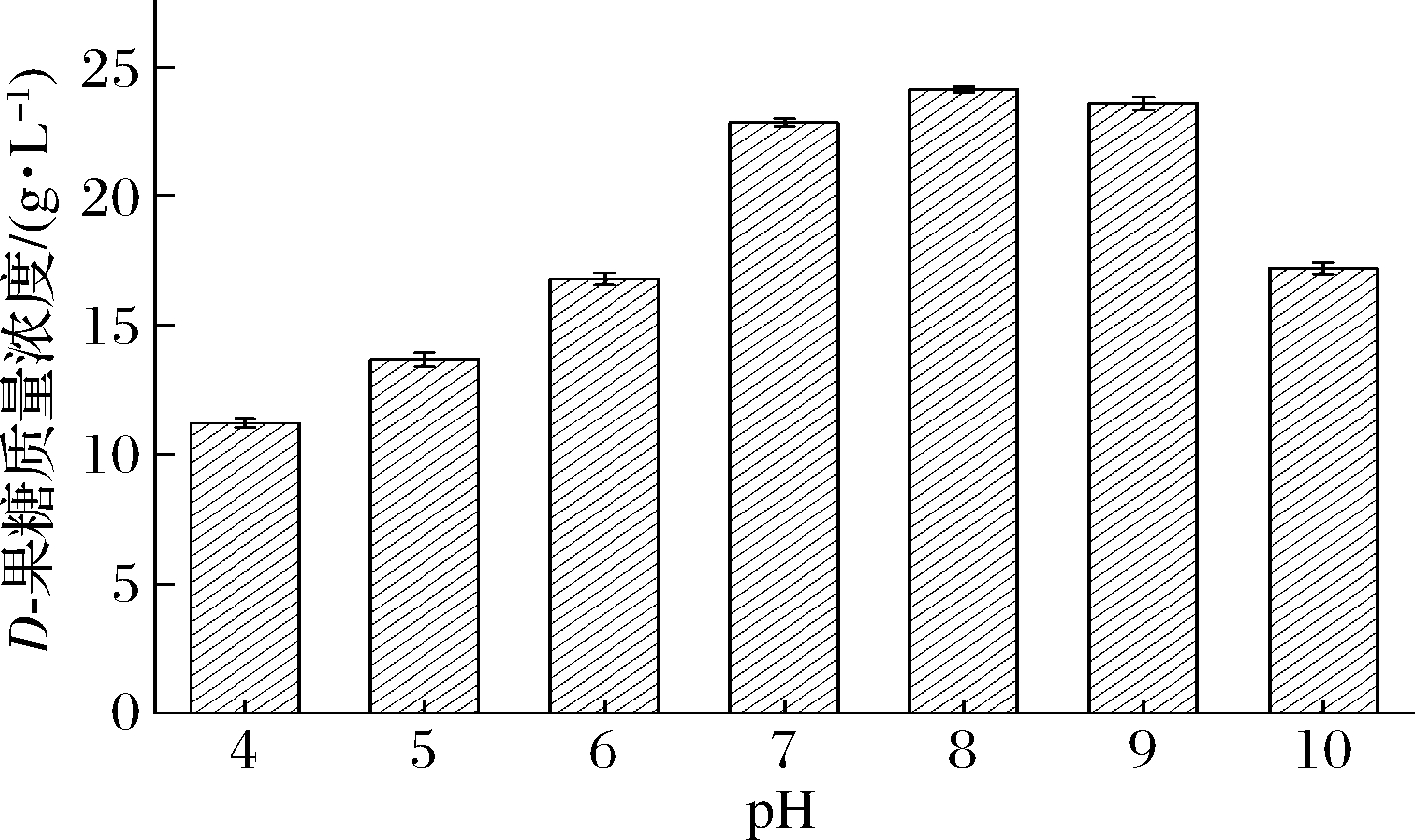
在D-葡萄糖异构化生成D-果糖过程中,最适pH一般为7.0~9.0,pH对D-果糖的生物转化率影响显著,少数葡萄糖异构酶在弱酸性pH环境中有较好的催化活力,弱酸性条件下异构化,可以减少副产物生成[25]。由图6可以看出,本研究选用的经密码子优化的A.missouriensis CICIM B0118(A)来源的GI在pH 7.0~9.0,D-果糖含量处于较高水平,分别达到22.83、24.10、23.56 g/L。而在酸性pH 4.0~6.0及过碱pH 10.0条件下,D-果糖含量水平不高,不利于D-葡萄糖异构化生成D-果糖。
2.3.5 反应温度对D-葡萄糖生物转化合成D-果糖的影响
先前研究表明,葡萄糖异构酶催化的D-葡萄糖异构化反应是一个热力学平衡反应,随着温度升高,催化平衡向D-果糖生成方向进行,高温有利于D-果糖生成[26]。因此,本研究也针对D-葡萄糖异构化生成D-果糖的全细胞催化体系的反应温度进行了研究(图7)。A.missouriensis CICIM B0118(A)来源的葡萄糖异构酶能耐受的温度范围较广,70 ℃为其生物转化反应的最适温度,此时,D-果糖含量为25.34 g/L;反应温度在90 ℃时,D-果糖含量仍处于较高水平,为21.23 g/L,仅较最适反应温度下的D-果糖含量下降了16.22%。已商业化的葡萄糖异构酶Sweetzyme® T因不耐高温,80 ℃时酶活力下降迅速,不利于D-果糖生成,导致了D-果糖含量严重下降。与其相比,A.missouriensis CICIM B0118(A)来源的葡萄糖异构酶更具备高温催化能力,有利于HFS的工业化生产。
2.4 全细胞催化合成高果糖浆
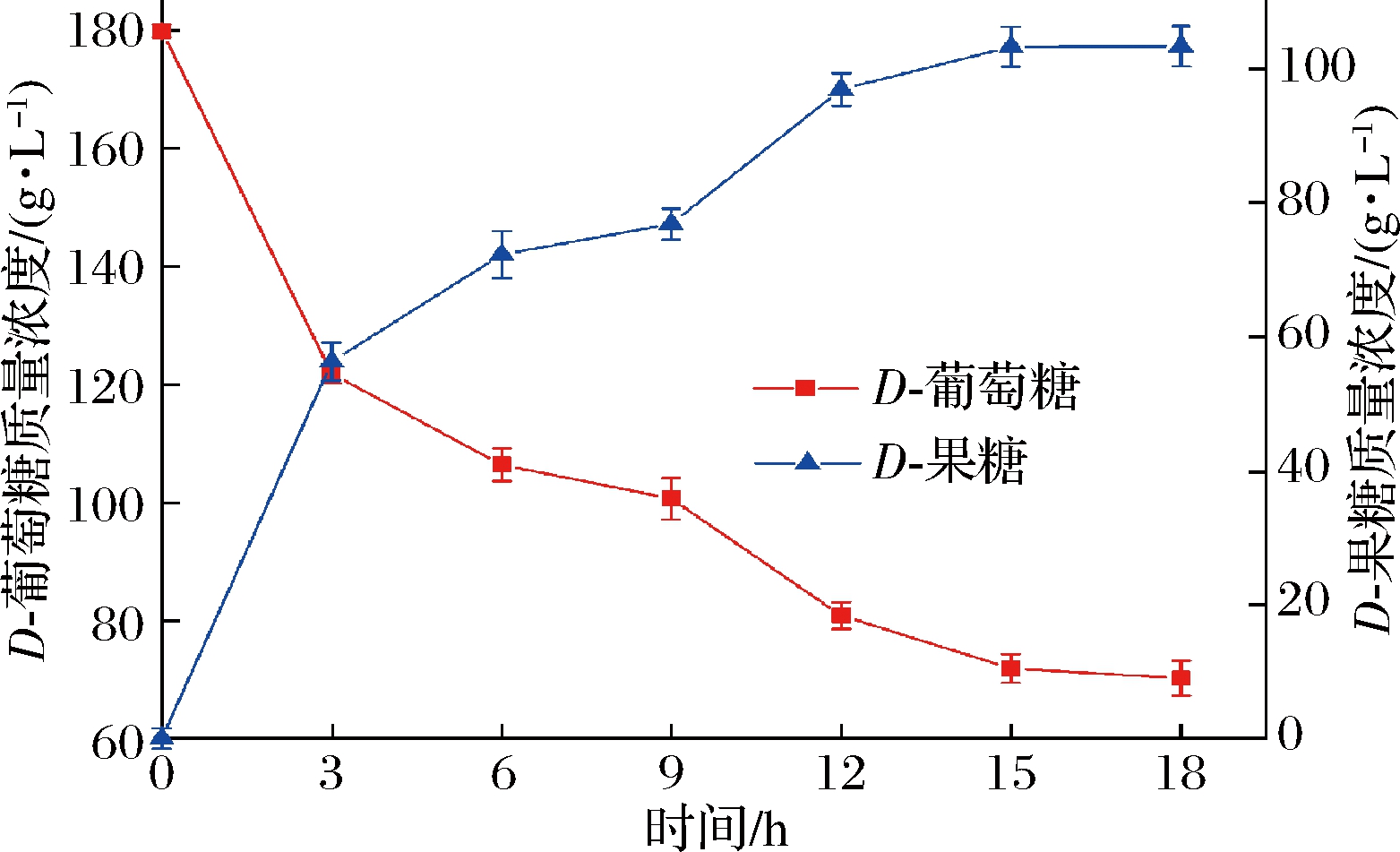
在最佳转化条件下,将4 g重组谷氨酸棒杆菌菌体添加到含180 g/L葡萄糖、10 mmol/L Mg2+和1 mmol/L Co2+的100 mL Tris-HCl缓冲液(pH 8.0)中,70 ℃、220 r/min下进行转化,每3 h取样,离心取上清液,HPLC检测D-果糖含量。结果如图8所示,转化前期(0~15 h),D-果糖浓度随着底物D-葡萄糖的消耗而逐渐升高,转化15 h时,转化液中剩余的D-葡萄糖质量浓度为71.87 g/L,D-果糖质量浓度达到103.23 g/L,转化率为57.35%;之后,D-葡萄糖消耗减缓,反应基本趋于平衡,D-果糖浓度几乎维持恒定,18 h时,转化液中剩余的D-葡萄糖质量浓度为70.23 g/L,D-果糖质量浓度达到103.32 g/L,转化率为57.4%。可见,重组菌株C.glutamicum 13032/pXMJ19-xylA实现了一步法安全合成HFS-55型高果糖浆,为HFS-55型高果糖浆的可持续化、安全工业化生产提供了重要借鉴。
3 讨论
高果糖浆因具有甜味纯正、渗透压高、吸潮性好、成本低廉等优点而被广泛应用于食品、饮料、烘焙、医药等领域。目前,一步法生物合成HFS-55已取得一定成效,但其宿主细胞大多是大肠杆菌。在催化过程中,大肠杆菌可能会将不符合食品卫生要求的有害物质带入产品中,因此,实现葡萄糖异构酶在研究背景清晰的食品安全菌株中的异源表达,以一步法安全合成HFS-55型高果糖浆是非常有意义的。已有研究者在食品安全菌株枯草芽孢杆菌中成功表达了葡萄糖异构酶,但其转化率均不超过52%[27-28]。
本文首次成功实现了A.missouriensis CICIM B0118(A)来源的葡萄糖异构酶在食品安全菌株C.glutamicum 13032中的异源表达,构建了重组谷氨酸棒杆菌C.glutamicum 13032/pXMJ19-xylA,并以其菌体作为全细胞催化剂,对D-葡萄糖异构化生成D-果糖的全细胞转化条件(菌体浓度、二价金属离子、底物浓度、pH、温度)进行优化。在最优转化条件下,连续转化18 h,D-果糖质量浓度达到103.32 g/L,转化率为57.4%,实现了HFS-55型高果糖浆的一步法安全生物合成。研究发现A.missouriensis CICIM B0118(A)来源的葡萄糖异构酶在较宽的温度(60~90 ℃)、pH (7.0~9.0)范围内仍具有较好活性,能更好地应用于HFS-55型高果糖浆的工业化生产。本研究只进行了初步探索,并未对高果糖浆的合成进行放大试验,今后将针对HFS-55型高果糖浆的5 L发酵罐水平进行研究,并针对葡萄糖异构酶进行理性改造,提高葡萄糖异构酶活力水平,加快其生物转化速率,以实现HCS-55型高果糖浆的可持续化、高效、安全的工业化生产。
参考文献
[1] JIN L Q, XU Q, LIU Z Q, et al.Immobilization of recombinant glucose isomerase for efficient production of high fructose corn syrup [J].Applied Biochemistry and Biotechnology, 2017, 183(1):293-306.
[2] SINGH R S, CHAUHAN K, PANDEY A, et al.Biocatalytic strategies for the production of high fructose syrup from inulin[J].Bioresource Technology, 2018, 260:395-403.
[3] STÅHLBERG T, WOODLEY J M, RIISAGER A.Enzymatic isomerization of glucose and xylose in ionic liquids[J].Catalysis Science & Technology, 2012, 2(2):291-295.
[4] LIU C, CARRAHER J M, SWEDBERG J L, et al.Selective base-catalyzed isomerization of glucose to fructose [J].ACS Catalysis, 2014, 4(12):4 295-4 298.
[5] YANG Q, SHERBAHN M, RUNGE T.Basic amino acids as green catalysts for isomerization of glucose to fructose in water[J].ACS Sustainable Chemistry & Engineering, 2016, 4(6):3 526-3 534.
[6] 赵锡武, 何玉莲.果糖的特性及应用 [J].饮料工业, 2006, 9(4): 4-9.
ZHAO X W, HE Y L.Characteristics and use of fructose[J].The Beverage Industry, 2006, 9(4):4-9.
[7] NEIFAR S, CERVANTES F V, BOUANANE-DARENFED A, et al.Immobilization of the glucose isomerase from Caldicoprobacter algeriensis on Sepabeads EC-HA and its efficient application in continuous high fructose syrup production using packed bed reactor [J].Food Chemistry, 2020, 309:125710.
[8] JIA D X, ZHOU L, ZHENG Y G.Properties of a novel thermostable glucose isomerase mined from Thermus oshimai and its application to preparation of high fructose corn syrup [J].Enzyme and Microbial Technology, 2017, 99:1-8.
[9] 贾东旭, 周霖, 王腾,等.耐高温葡萄糖异构酶重组菌发酵与转化条件研究[J].食品与发酵工业, 2017,43(7):13-19.
JIA D X, ZHOU L, WANG T, et al.Research on fermentation and conversion conditions of recombinant strain harboring thermophilic glucose isomerase [J].Food and Fermentation Industries, 2017,43(7):13-19.
[10] 牟德华, 李艳, 杨树森, 等.果葡糖浆的特性、发展及生产现状 [J].河北科技大学学报, 1999, 20(2):77-82.
MOU D H, LI Y, YANG S S, et al.Characteristics and development of fructose corn syrupsn and its present production condition [J].Journal of Hebei University of Science and Technology, 1999, 20(2):77-82.
[11] DE BRUYN C A L, VAN EKENSTEIN W A.Action des alcalis sur les sucres, II.Transformation réciproque des uns dans les autres des sucres glucose, fructose et mannose [J].Recueil Des Travaux Chimiques Des Pays-Bas, 2010, 14(7):203-216.
[12] LI C X, WANG Y, ZHANG Y, et al.Isomerization kinetics of glucose to fructose in aqueous solution with magnesium-aluminum hydrotalcites [J].ChemistrySelect, 2020, 5(1):270-279.
[13] TSUMURA N, SATO T.Enzymatic conversion of D-glucose to D-fructose[J].Agricultural Biological Chemistry, 1961, 25(8):620-625.
[14] TSUMURA N.Industrial aspects of immobilized glucose isomerase [J].Agricultural Biological Chemistry, 1993, 29:1 123-1 129.
[15] TAKASAKI Y.Studies on sugar-isomerizing enzyme [J].Agricultural and Biological Chemistry, 1966, 30(12):1 247-1 253.
[16] BHOSALE S H, RAO M B, DESHPANDE V V.Molecular and industrial aspects of glucose isomerase [J].Microbiological Reviews, 1996, 60(2):280-300.
[17] XU H, SHEN D, WU X Q, et al.Characterization of a mutant glucose isomerase from Thermoanaerobacterium saccharolyticum[J].Journal of Industrial Microbiology & Biotechnology, 2014, 41(10):1 581-1 589.
[18] KARAOGLU H, YANMIS D, SAL F A, et al.Biochemical characterization of a novel glucose isomerase from Anoxybacillus gonensis G2T that displays a high level of activity and thermal stability [J].Journal of Molecular Catalysis B:Enzymatic, 2013, 97:215-224.
[19] DAI C X, MIAO T T, HAI J P, et al.A Novel glucose isomerase from Caldicellulosiruptor bescii with great potentials in the production of high-fructose corn syrup[J].BioMed Research International, 2020(5):1-7.
[20] LIU Z Q, ZHENG W, HUANG J F, et al.Improvement and characterization of a hyperthermophilic glucose isomerase from Thermoanaerobacter ethanolicus and its application in production of high fructose corn syrup[J].Journal of Industrial Microbiology & Biotechnology, 2015, 42(8):1 091-1 103.
[21] 王贺, 杨瑞金, 华霄,等.密苏里游动放线菌葡萄糖异构酶基因xylA的克隆及其表达条件的优化[J].食品科学, 2010, 31(15):171-176.
WANG H, YANG R J, HUA X, et al.Cloning of glucose isomerase gene form Actinomyces missouriensis and its expression in Escherichia coli[J].Food Science, 2010(15):171-176.
[22] STRAATHOF A J J, WAHL S A, BENJAMIN K R, et al.Grand research challenges for sustainable industrial biotechnology [J].Trends in Biotechnol, 2019, 37(10):1 042-1 050.
[23] FAN L J, ZHANG Y C, QU W, et al.Cloning and analysis of the xylAB operon and characterization of xylose isomerase from Thermoanaerobacter ethanolicus [J].Biotechnology Letters, 2011, 33(3):593-598.
[24] CHAUTHAIWALE J, RAO M L.Production and purification of extracellular D-xylose isomerase from an alkaliphilic, thermophilic Bacillus sp.[J].Applied & Environmental Microbiology, 1994, 60(12):4 495-4 499.
[25] LIU S Y, WIEGEL J, GHERARDINI F C.Purification and cloning of a thermostable xylose (glucose) isomerase with an acidic pH optimum from Thermoanaerobacterium strain JW/SL-YS 489 [J].Journal of Bacteriology, 1996, 178(20):5 938-5 945.
[26] JIA D X, WANG T, LIU Z J, et al.Whole cell immobilization of refractory glucose isomerase using tris(hydroxymethyl)phosphine as crosslinker for preparation of high fructose corn syrup at elevated temperature[J].Journal of Bioscience and Bioengineering, 2018, 126(2):176-182.
[27] ZHU L Y, SHEN B W, SONG Z, et al.Permeabilized TreS-expressing Bacillus subtilis cells decorated with glucose isomerase and a shell of zif-8 as a reusable biocatalyst for the coproduction of trehalose and fructose [J].Journal of Agricultural and Food Chemistry, 2020, 68 (15):4 464-4 472.
[28] LEE C Y, BHATNAGAR L, SAHA B C, et al.Cloning and expression of the Clostridium thermosulfurogenes glucose isomerase gene in Escherichia coli and Bacillus subtilis[J].Applied & Environmental Microbiology, 1990, 56(9):2 638-2 643.
Recombinant Corynebacterium glutamicum whole cell catalyzes one-step synthesis of high fructose syrup
HABIMANA,QIAO Zhina,XU Meijuan,YANG Taowei,ZHANG Xian,SHAO Minglong,RAO Zhiming*
(School of Biotechnology, Jiangnan University, Wuxi 214122, China)
ABSTRACT High fructose syrup is a sweetener that can replace sucrose, which is widely applied in the food and beverage industries. In this study, the codon-optimized glucose isomerase from Actinoplanes missouriensis CICIM B0118 (A) was expressed heterologously in the food-safe strain Corynebacterium glutamicum 13032, and the recombinant C. glutamicum 13032/pXMJ19-xylA was constructed. The whole cell conversion system of D-glucose isomerization to the biosynthesis of D-fructose was optimized. The results showed that the yield of D-fructose reached 103.32 g/L when the continuous conversion was performed at 70 ℃ and 220 r/min for 18 h, with 40 g/L bacterial cells, 180 g/L D-glucose, 10 mmol/L Mg2+ , and 1 mmol/L Co2+ . The conversion rate was 57.4%, and the safe one-step biosynthesis of high fructose syrup was achieved. This research provided an experimental and theoretical basis for the industrialized synthesis of high fructose syrup, and had important reference value.
Key words glucose isomerase;isomerization;whole cell catalysis;Corynebacterium glutamicum; high fructose syrup