水果和蔬菜被认为是人体内活性氧(reactive oxygen species, ROS)清除剂的主要来源[1],西葫芦(Cucurbita pepo L.)一年生蔓生草本,是我国主要的蔬菜之一。西葫芦富含多种营养物质,具有润肺止咳等功效,具有极高的商品价值。新鲜西葫芦采摘后为了延长其商品期往往会放置在低温环境下贮藏、运输,低温环境可以降低果实的呼吸和新陈代谢速率,减少营养物质的消耗和水分的散失,保持西葫芦果实的口感,延缓果实的成熟和衰老。在低温贮藏过程中,温度过低或贮藏时间过长都会导致果实发生冷害。冷害是指0 ℃以上的低温对热带和亚热带植物造成的生理伤害,西葫芦果实的冷害症状表现为表皮呈凹陷皱缩、水渍状斑点,果肉变软失去弹性等[2]。
采后热处理是指在高于正常生长温度(一般在35~50 ℃)下处理果蔬,以达到刺激生理应激反应,影响抗氧化酶的活性,提高果蔬抵御外界胁迫能力的目的。ZHANG等[3]、ENDO等[4]、HUAN等[5]学者认为热处理技术通过保护细胞膜的完整性、增强抗氧化系统活性来提高果蔬抗冷性,减轻低温贮藏下果蔬冷害发生率。热空气处理可以延长果蔬在低温下的贮藏时间在桃[6-7]、青椒[8]等冷敏性果蔬中得到证实。果蔬内部温度变化、处理时间和升温速率是影响处理效果的关键因素[9-10],而空气湿度的不同也会导致果实内部升温速率不同,空气湿度越高,果蔬升温速率越快[11]。大多学者在热空气处理技术中主要侧重温度和时间的变化,而对于空气湿度参数研究却少有提及,因此可能会导致对于相同品种的果蔬,不同学者得到不同的最佳处理温度和时间,如:对于“解放钟”枇杷,刘风娟等[12]采取38 ℃处理36 h、段杨峰[13]采取38 ℃处理6 h、宋钰兴等[14] 采取45 ℃处理3 h都得到了较好的处理效果。本研究以“绿丰”西葫芦为实验材料,探究不同湿度的热空气处理(44 ℃,2.3 h)对低温贮藏0~15 d西葫芦果实的品质和抗氧化系统的影响,旨在为西葫芦低温贮藏保鲜中贮前热空气处理条件的选取提供依据与借鉴。
试验用西葫芦于2020年9月采购自上海市浦东新区书院镇果蔬种植园,挑选尺寸大小相似(平均长度为25 cm,平均直径为6.2 cm)的果实于当天送到实验室。选择成熟度一致,无病虫害,表皮无机械损伤的西葫芦果实作为实验研究对象。根据常温物体在44 ℃热空气中露点温度的不同,以及前期20%湿度热空气处理试验中西葫芦果实失水软化严重的结果,本试验划分5个试验组。分别是CK组(对照组)、HAT90组(90%湿度热空气组)、HAT80组(80%湿度热空气组)、HAT60组(60%湿度热空气组)、HAT40组(40%湿度热空气组)。根据前期试验结果选择热处理时间、温度(2.3 h,44 ℃)在恒温恒湿箱(±0.5 ℃,±3%湿度)中进行不同湿度的热空气处理。热处理完毕后将西葫芦在室温[(20±1) ℃]下晾干复温1 h再将每2根西葫芦装入打孔的聚乙烯保鲜袋(厚度0.02 mm)移至冷库[(4±0.5) ℃、湿度(80±5)%]中贮藏。贮藏时间为15 d,每隔5 d取出观察冷害指数并取样测定相关指标。
丙二醛(malondialdehyde, MDA)测试盒,上海兰拓生物科技有限公司;维生素C检测试剂盒,上海源叶生物科技有限公司;H2O2测试盒、超氧阴离子自由基(superoxide anion, ![]() 测试盒、超氧化物歧化酶(superoxide dismutase, SOD)测试盒、过氧化物酶(peroxidase, POD)测试盒、过氧化氢酶(catalase, CAT)测定试剂盒,南京建成生物工程研究所。
测试盒、超氧化物歧化酶(superoxide dismutase, SOD)测试盒、过氧化物酶(peroxidase, POD)测试盒、过氧化氢酶(catalase, CAT)测定试剂盒,南京建成生物工程研究所。
F2640多点温度采集仪,福禄克公司;H-2050R-1型高速冷冻离心机,长沙湘仪离心机有限公司;BPS-100CA型恒温恒湿箱,上海一恒科学仪器有限公司;WT-B电子天平,杭州万特衡器有限公司;AUW320分析天平,上海亚津电子科技有限公司;DDS-307型电导率仪,上海笛柏实验设备有限公司;THZ-82A型恒温振荡箱,江苏省金坛市环宇科学仪器厂;SMS TA.XT PLUS质构仪,Stable Micro System公司;T6新世纪紫外可见分光光度计,北京普析通用仪器有限责任公司。
1.3.1 果实内部温度的测定
采用F2640多点温度采集仪每隔3 s采集热空气处理过程中西葫芦果实内部温度在中心、距外表皮3 mm处的温度变化,测量精度为±0.1 ℃。
1.3.2 冷害指数的测定
冷害的测定方法参考ZHANG等[15]方法进行,每个试验组随机选取5根西葫芦分别在贮藏5、10、15 d将果实从冷库中取出后移至20 ℃常温下放置2 d后观察其表面的水渍斑点和凹陷,根据冷害部位的面积占比评定冷害级数,冷害指数计算如公式(1)所示,结果以%表示。
冷害指数![]()
(1)
式中:冷害级数为:0级,无冷害症状;1级,冷害症状面积≤10%;2级,10%<冷害症状面积≤25%;3级,25%<冷害症状面积≤50%;4级,冷害症状面积>50%。
1.3.3 失重率、硬度的测定
失重率的测定参考姜雪等[16]的方法,各组取6根西葫芦称初始重量之后,热空气处理组和CK组分别进行2.3 h的热空气处理和室温放置试验后称重放入冷库中,每隔5 d测量1次重量,结果以%表示,计算方法如公式(2)所示:
失重率![]()
(2)
硬度的测定参考何全光等[17]的方法,去除果皮和果瓤,取厚度相同的扇形西葫芦果肉采用英国SMS公司的TA.XT PLUS 质构仪,测定选择TPA模式,采用平底探头返回速度10 mm/s,接触力5 g,压缩程度85%。测定果肉硬度,结果以N表示,重复3次。
1.3.4 电解质外渗率、MDA含量的测定
电解质外渗率的方法参考赵昱瑄等[18]的方法略作修改。用打孔器取10片相同大小的果肉圆片,用去离子水冲洗3次后,准确加入20 mL去离子水测定溶液电解质外渗率,记录为R0(记录温度20~25 ℃)。振荡1.5 h,在相同温度下,测量溶液的电解质渗透率记录为R1。测量后,将烧杯口用保鲜膜和橡皮筋紧封,置于100 ℃沸水中蒸20 min,取出后待水温冷却至相同的温度。此时再次测量电解质外渗率并记录为R2。根据公式(3)计算电解外渗率并重复3次。每组随机取3个果实,每个果实重复3次。
(3)
MDA含量的测定采用上海兰拓生物科技有限公司的MDA测试盒。结果以 nmol/g表示。
![]() 和H2O2含量测定
和H2O2含量测定
![]() 活力的测定参照南京建成抗超氧阴离子自由基测试盒说明书,取1 g西葫芦果肉在冰浴下研磨加4 mL pH 7.2 PBS缓冲液8 000×g离心20 min取上清液,测定结果以U/g表示。
活力的测定参照南京建成抗超氧阴离子自由基测试盒说明书,取1 g西葫芦果肉在冰浴下研磨加4 mL pH 7.2 PBS缓冲液8 000×g离心20 min取上清液,测定结果以U/g表示。
H2O2含量的测定参照南京建成H2O2含量测试盒说明书,取3 g西葫芦果肉在冰浴下研磨,加3 mL pH 7.2 PBS缓冲液8 000×g离心20 min取上清液,测定结果以mmol/g表示。
1.3.6 SOD、CAT、POD活性的测定
SOD活性的测定参照南京建成SOD测试盒说明书,取0.5 g西葫芦果肉在冰浴下研磨,加4.5 mL pH 7.2 PBS缓冲液8 000×g离心20 min,取上清液进行测定。以每克组织在1 mL反应液中SOD抑制率达50%时所对应的SOD量为1个SOD活力单位(U),结果以U/g表示。
CAT活性的测定参照南京建成过氧化氢酶测试盒说明书,取1 g西葫芦果肉在冰浴下研磨,加4 mL pH 7.2 PBS缓冲液8 000×g离心20 min,取上清液进行测定。以每毫克组织蛋白每秒钟分解1 μmol的H2O2的量为1个活力单位,结果以 U/mg prot 表示。
POD活性的测定参照南京建成过氧化物酶测试盒说明书,取1 g西葫芦果肉在冰浴下研磨,加4 mL pH 7.2 PBS缓冲液8 000×g离心20 min,取上清液进行测定。以在37 ℃条件下,每毫克组织蛋白每分钟催化1 μg底物的酶量定义为1个酶活力单位,结果以U/mg prot 表示。
1.3.7 抗坏血酸(ascorbic acid, ASA)含量的测定
ASA含量的测定参考上海源叶维生素C检测试剂盒说明书,取1 g西葫芦果肉在冰浴下研磨,加5 mL pH 7.2 PBS缓冲液8 000×g离心20 min,取上清液进行测定。结果表示为100 g样品中ASA含量,以mg/100g表示。
试验数据采用 Excel 2016 处理作图,图表结果均为平均值±标准差。SPSS 21.0对实验结果进行单因素方差分析及Duncan多重比较,显著性水平设为0.05。
图1-a、图1-b所示分别为热空气处理(44 ℃、2.3 h)过程中西葫芦果实内部表皮层和中心处温度场的变化。如图1-a所示,在处理前期,HAT90组、HAT80组、HAT60组、HAT40组表皮层升温速率呈递减趋势,其中HAT90组初期升温速率分别是HAT80组、HAT60组、HAT40组的1.26、1.71、1.69倍。HAT80组在热处理前期高于HAT60组、HAT40组,但在2 853 s HAT80组与HAT60组温度曲线存在交叉,之后HAT80组升温速率开始变缓直到4 653 s升温速率开始加快直到5 703 s、39.68 ℃升温速率渐渐与HAT60组、HAT40组近似重合。如图1-b所示,果实中心温度场变化与表皮层升温速率相似,但由于西葫芦果实内部传热热阻较大,导致中心温度变化存在滞后性,但仍可以看出HAT90组具有最高的升温速率,然后是HAT80组,HAT60组、HAT40组升温速率相差不大。在相同的热处理温度和时间下,HAT90组、HAT80组、HAT60组、HAT40组在处理过程结束后分别达到了43.95、41.79、41.54、41.32 ℃。
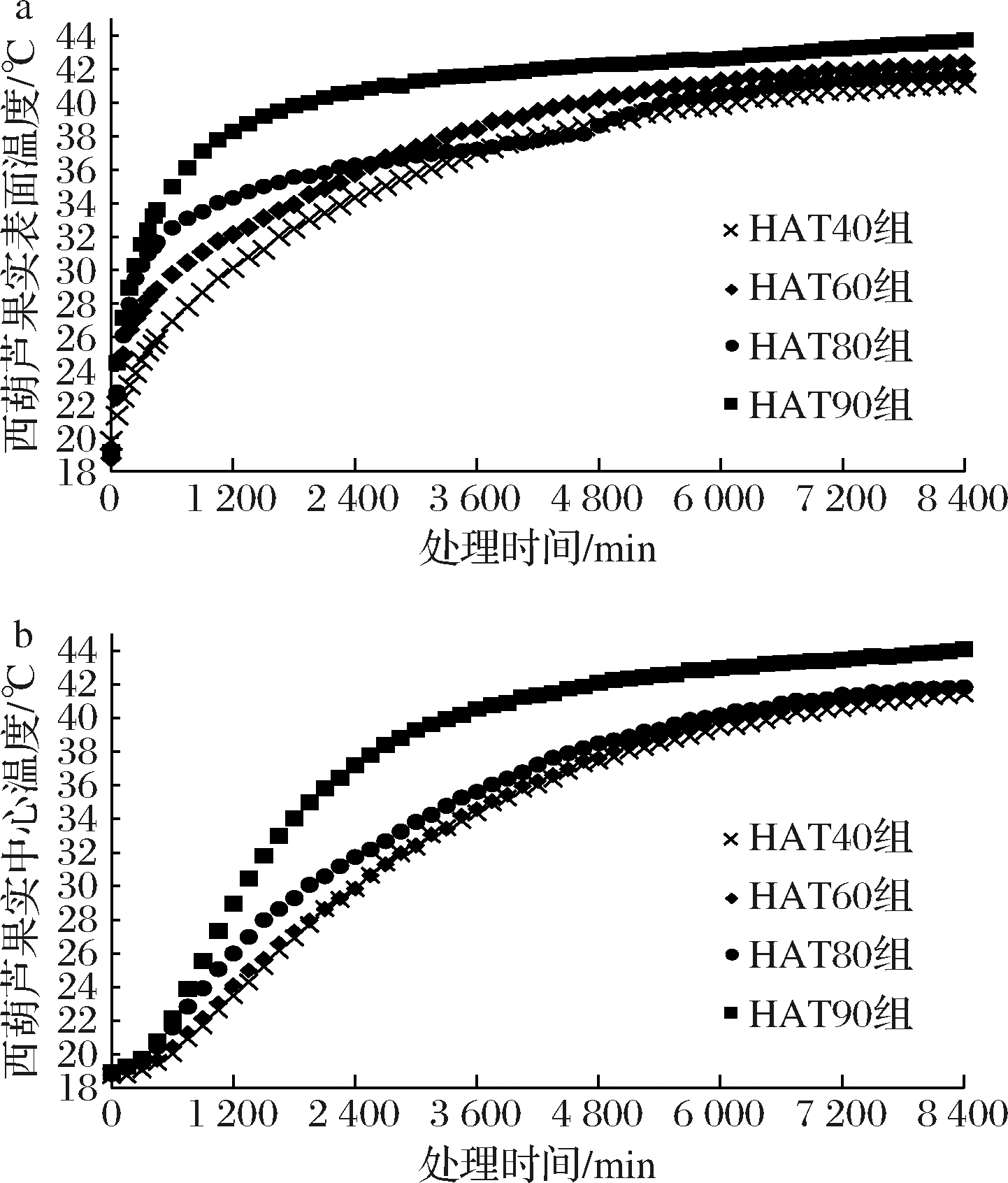
a-表皮温度;b-中心温度
图1 不同湿度热空气处理西葫芦果实温度测定
Fig.1 Temperature measurement of the skin,center temperature of
zucchini fruits treated with hot air with different humidity
低温贮藏是延长采后果蔬品质最有效的方式。贮藏温度的降低和贮藏时间的延长容易导致更加严重的冷害症状,部分冷敏性果蔬在离开冷藏条件转移到较温暖的环境后中冷害症状才得以表现。冷害指数是反映果蔬受冷害程度的重要指标,同时也是影响低温贮藏果蔬货架期的主要原因[4]。由图2-a可知,在贮藏期第10天,HAT80组冷害指数比CK组少24.9%。CK组果实低温贮藏15 d后,CK组冷害指数与处理组之间有显著差异。如图2所示,西葫芦果实冷害指数随贮藏时间的延长呈增长趋势,在整个贮藏期中,CK组的冷害指数始终高于其他处理组,表明热空气处理可以有效地减少西葫芦冷害症状的发生,该结论与龚国强等[19]研究的热处理西葫芦冷害指数相似。贮藏前期各处理组无明显冷害症状出现,CK组出现明显冷害症状。贮藏中后期各组西葫芦冷害症状发展迅速,在第15天出现严重冷害症状,但处理组冷害指数显著小于CK组,其中HAT80组的冷害指数分别比CK组、HAT90组、HAT60组、HAT40组少24.39%、13.89%、13.89%、8.82%。

图2 不同湿度热空气处理对低温贮藏西葫芦果实
冷害指数的影响
Fig.2 The effect of hot air treatments with different humidity on the
chilling injury of zucchini fruits stored at low temperature
注:同一阶段HAT和CK组中不同小写字母表示差异显著
(P<0.05)(下同)
硬度、失重率是表示果蔬失水量的重要指标,水分的流失会导致果实的萎蔫褐变,使果蔬的质地、口感下降,并加速衰老[20]。在恒温条件下,相对湿度的微小变化可以显著影响新鲜农产品的失水率[21]。由于热空气处理过程中会导致水分的损耗,试验中失重率指标添加2.3 h处理后的数值,以期看出处理过程中西葫芦果实水分的损耗。如图3-a所示,热处理后处理组西葫芦果实的失重率显著高于CK组,分别是HAT90组、HAT80组、HAT60组、HAT40组的23.45%、32.37%、21.74%、18.61%。同时HAT80组失重率也显著低于其他处理组(P<0.05),可能是由于较高湿度的热空气有着较大的水蒸气分压力,较低的压差减少了果实内水分的传质速率。HAT90组具有较高的失重率可能是因为西葫芦果实升温速率较快,呼吸速率的大小一般随着温度的升高而变大,呼吸熵也越大[22],较高的果体温度加快了果实的呼吸作用,加快了呼吸底物消耗速率和水分的散失[23-24]。随着贮藏时间的延长,失重率呈上升趋势,在贮藏后期失重率的增长率达到最大,其中HAT80组的失重率分别是CK组、HAT90组、HAT60组、HAT40组的0.73、0.87、0.84、0.88倍。
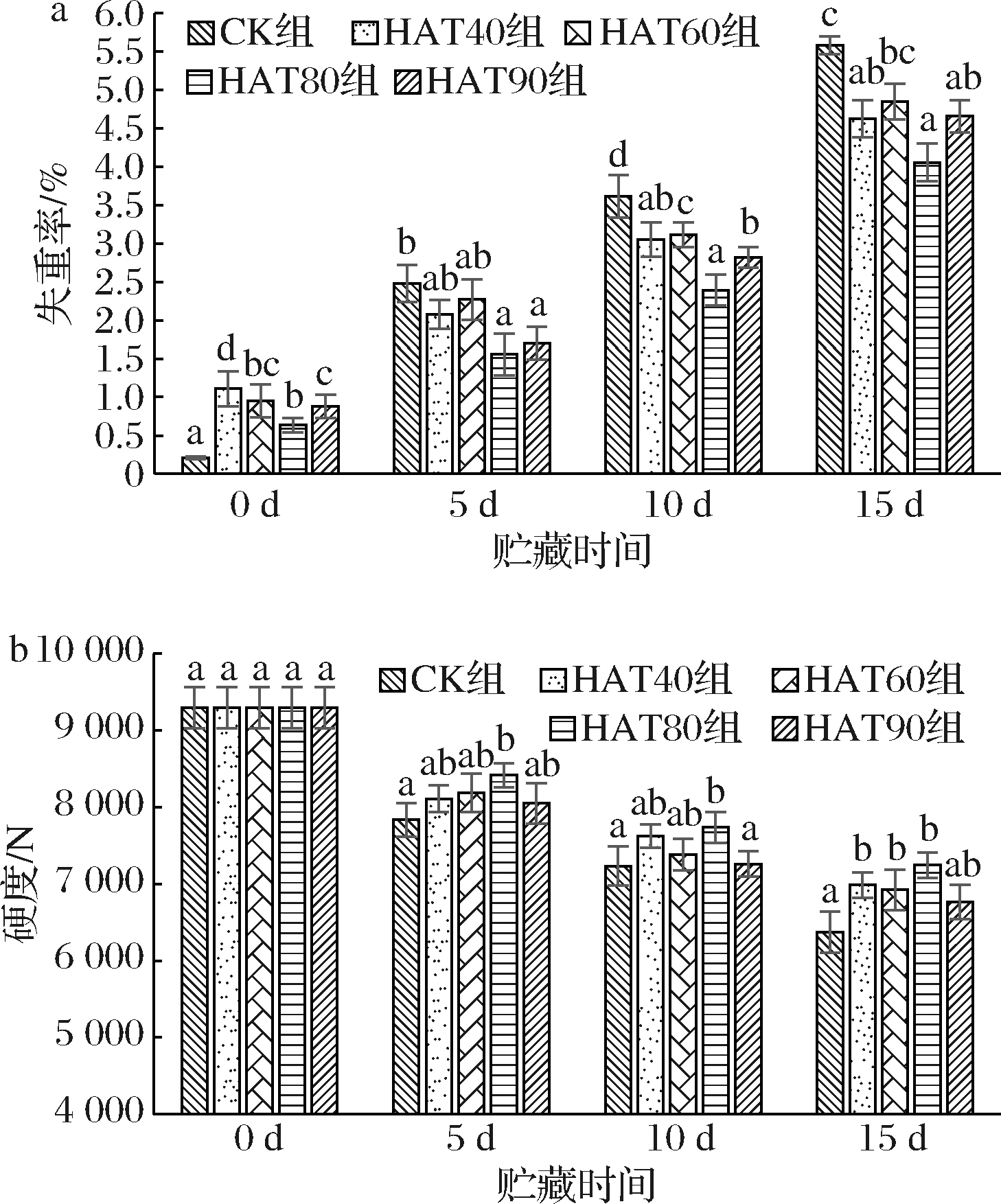
a-失重率;b-硬度
图3 不同湿度热空气处理对低温贮藏西葫芦
果实失重率、硬度的影响
Fig.3 The effect of hot air treatments with different humidity on the
weight loss, hardness of zucchini fruits stored at low temperature
影响果蔬采后商品价值和货架期主要的指标之一是硬度,往往随低温贮藏时间的延长呈下降趋势。如图3-b所示,在贮藏前期各组硬度分别比初始值低15.73%、13.45%、9.49%、11.97%、12.8%,HAT80组硬度显著大于其他组(P<0.05);HAT80组硬度值分别比CK组、HAT90组、HAT60组、HAT40组高7.41%、4.57%、2.81%、3.8%。贮藏过程中HAT80组西葫芦果实硬度中期比前期降低了8.78%;后期比中期降低了6.78%。贮藏后期HAT40组、HAT60组、HAT80组硬度分别比CK组高9.7%、8.67%、13.75%。在贮藏前期,各处理组间失重率、硬度没有显著性差异(P>0.05),这点从冷害指数上也得到相同的结论,表明第5天各组间品质相差不大,与硬度、失重得到相似结论。 DONOGHUE等[25]认为辣椒果实变软的原因可能是水分流失对果实结构的整体影响,而不是果皮本身细胞壁破坏。在整个贮藏过程中各处理组失重率与硬度呈负相关,但HAT80组的数值都显著优于其他组(P<0.05),这表明HAT80组热空气处理可以较好地维持西葫芦果实的品质,保持较低的失重和较高的硬度。
DONOGHUE等[25]认为辣椒果实变软的原因可能是水分流失对果实结构的整体影响,而不是果皮本身细胞壁破坏。在整个贮藏过程中各处理组失重率与硬度呈负相关,但HAT80组的数值都显著优于其他组(P<0.05),这表明HAT80组热空气处理可以较好地维持西葫芦果实的品质,保持较低的失重和较高的硬度。
导致冷害症状的主要原因可能是凝胶相的形成对膜的破坏[26]。果蔬在遭受冷害的情况下,既会导致膜蛋白变性,分子排列序列改变,细胞膜通透性增加,细胞内的电解质(糖分、氨基酸等)外渗,电解质外渗率增加,又会使细胞中产生的![]() 和羟自由基,诱导膜脂饱和脂肪酸发生过氧化作用,产生脂质自由基,而脂质自由基又可以进一步诱导膜脂过氧化,导致细胞膜通透性增加。MDA含量反映膜脂过氧化的程度,它的积累是活性氧毒害作用的表现[16]。MDA作为膜脂过氧化作用的最终产物可以与电解质渗透率一起作为评价果蔬细胞膜完整性与冷害程度的指标[27-28]。如图4-a、图4-b所示,随着贮藏时间的延长,西葫芦果实的电解质外渗率和MDA含量呈正相关,热空气处理组电解质外渗率与MDA含量都显著小于CK组(P<0.05),表明热空气处理可以维持低温贮藏下西葫芦果实细胞膜的完整性,延缓膜脂过氧化进程。热空气处理维持了西葫芦果实细胞膜的完整性表现为处理组具有较轻的冷害症状,这一结果同样在柑橘[29]、桃[30]等果实中发现。在贮藏前期各处理组电解质外渗率和MDA含量值相差不大,但处理组显著小于CK组值(P<0.05)。此外HAT80组处理对电解质外渗率和MDA含量的增长有较好的抑制作用,在贮藏末期,西葫芦受低温胁迫影响严重电解质外渗率和MDA含量明显增大,但HAT80组电解质外渗率达到了各组的最低值(67.72%),与其余各组差异显著(P<0.05),相比CK组的82.75%,降低了18.16%;MDA含量也有着相似的结果,在末期HAT80组MDA含量达到了29.26 nmol/g,比CK组降低了23.92%,表明HAT80组可以较好地维持西葫芦果实低温贮藏下细胞膜的完整性并减少脂质过氧化损伤。
和羟自由基,诱导膜脂饱和脂肪酸发生过氧化作用,产生脂质自由基,而脂质自由基又可以进一步诱导膜脂过氧化,导致细胞膜通透性增加。MDA含量反映膜脂过氧化的程度,它的积累是活性氧毒害作用的表现[16]。MDA作为膜脂过氧化作用的最终产物可以与电解质渗透率一起作为评价果蔬细胞膜完整性与冷害程度的指标[27-28]。如图4-a、图4-b所示,随着贮藏时间的延长,西葫芦果实的电解质外渗率和MDA含量呈正相关,热空气处理组电解质外渗率与MDA含量都显著小于CK组(P<0.05),表明热空气处理可以维持低温贮藏下西葫芦果实细胞膜的完整性,延缓膜脂过氧化进程。热空气处理维持了西葫芦果实细胞膜的完整性表现为处理组具有较轻的冷害症状,这一结果同样在柑橘[29]、桃[30]等果实中发现。在贮藏前期各处理组电解质外渗率和MDA含量值相差不大,但处理组显著小于CK组值(P<0.05)。此外HAT80组处理对电解质外渗率和MDA含量的增长有较好的抑制作用,在贮藏末期,西葫芦受低温胁迫影响严重电解质外渗率和MDA含量明显增大,但HAT80组电解质外渗率达到了各组的最低值(67.72%),与其余各组差异显著(P<0.05),相比CK组的82.75%,降低了18.16%;MDA含量也有着相似的结果,在末期HAT80组MDA含量达到了29.26 nmol/g,比CK组降低了23.92%,表明HAT80组可以较好地维持西葫芦果实低温贮藏下细胞膜的完整性并减少脂质过氧化损伤。
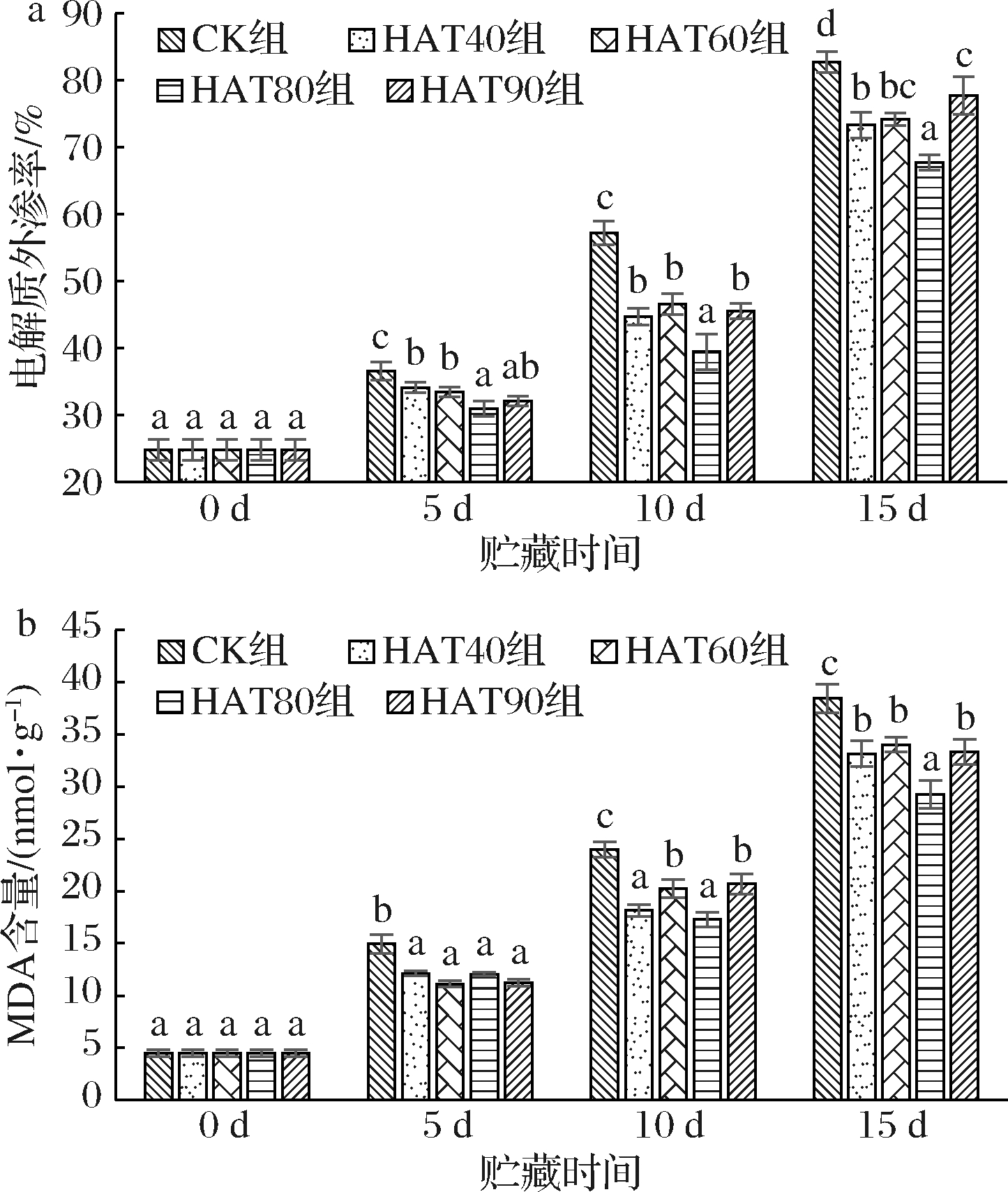
a-电解质外渗率;b-MDA含量
图4 不同湿度热空气处理对低温贮藏西葫芦
电解质外渗率、MDA含量的影响
Fig.4 The effect of hot air treatment with different humidity on the
electrolyte leakage, MDA content of zucchini fruits
stored at low temperature
低温胁迫除了对膜完整性的直接影响外,冷害的次要反应是氧化应激,它诱导有害活性氧的积累,如![]() 和H2O2。H2O2本身就是活性氧,是氧化代谢的一部分,具有中等反应性。
和H2O2。H2O2本身就是活性氧,是氧化代谢的一部分,具有中等反应性。![]() 是电子传递过程中的代谢产物,是一种氧化还原活性都很强的活性氧。活性氧可以直接或间接地启动膜脂过氧化作用,破坏细胞膜的完整性,加速低温下果蔬的机体损伤[31]。如图5-a、图5-b所示,果实H2O2在每个贮藏阶段增幅较均匀,CK组含量与前一阶段分别增长了2.08、3.34、4.31 mmol/g;果实
是电子传递过程中的代谢产物,是一种氧化还原活性都很强的活性氧。活性氧可以直接或间接地启动膜脂过氧化作用,破坏细胞膜的完整性,加速低温下果蔬的机体损伤[31]。如图5-a、图5-b所示,果实H2O2在每个贮藏阶段增幅较均匀,CK组含量与前一阶段分别增长了2.08、3.34、4.31 mmol/g;果实![]() 在贮藏末期有较大的增幅,其中CK组到达了17.26 U/g。到贮藏期15 d结束,各组H2O2含量与
在贮藏末期有较大的增幅,其中CK组到达了17.26 U/g。到贮藏期15 d结束,各组H2O2含量与![]() 活力持续增加,CK组果实H2O2含量增长3.81倍
活力持续增加,CK组果实H2O2含量增长3.81倍![]() 活力增长2.61倍。与CK组相比HAT处理显著延缓了H2O2含量与
活力增长2.61倍。与CK组相比HAT处理显著延缓了H2O2含量与![]() 活力的增长(P<0.05)。贮藏前中期HAT80组值显著低于其他组,HAT80组H2O2含量在第5天、第10天、第15天分别比同期CK组低
活力的增长(P<0.05)。贮藏前中期HAT80组值显著低于其他组,HAT80组H2O2含量在第5天、第10天、第15天分别比同期CK组低![]() 活力在第5天、第10天、第15天分别比同期CK组低10%、14.31%、10.37%。
活力在第5天、第10天、第15天分别比同期CK组低10%、14.31%、10.37%。
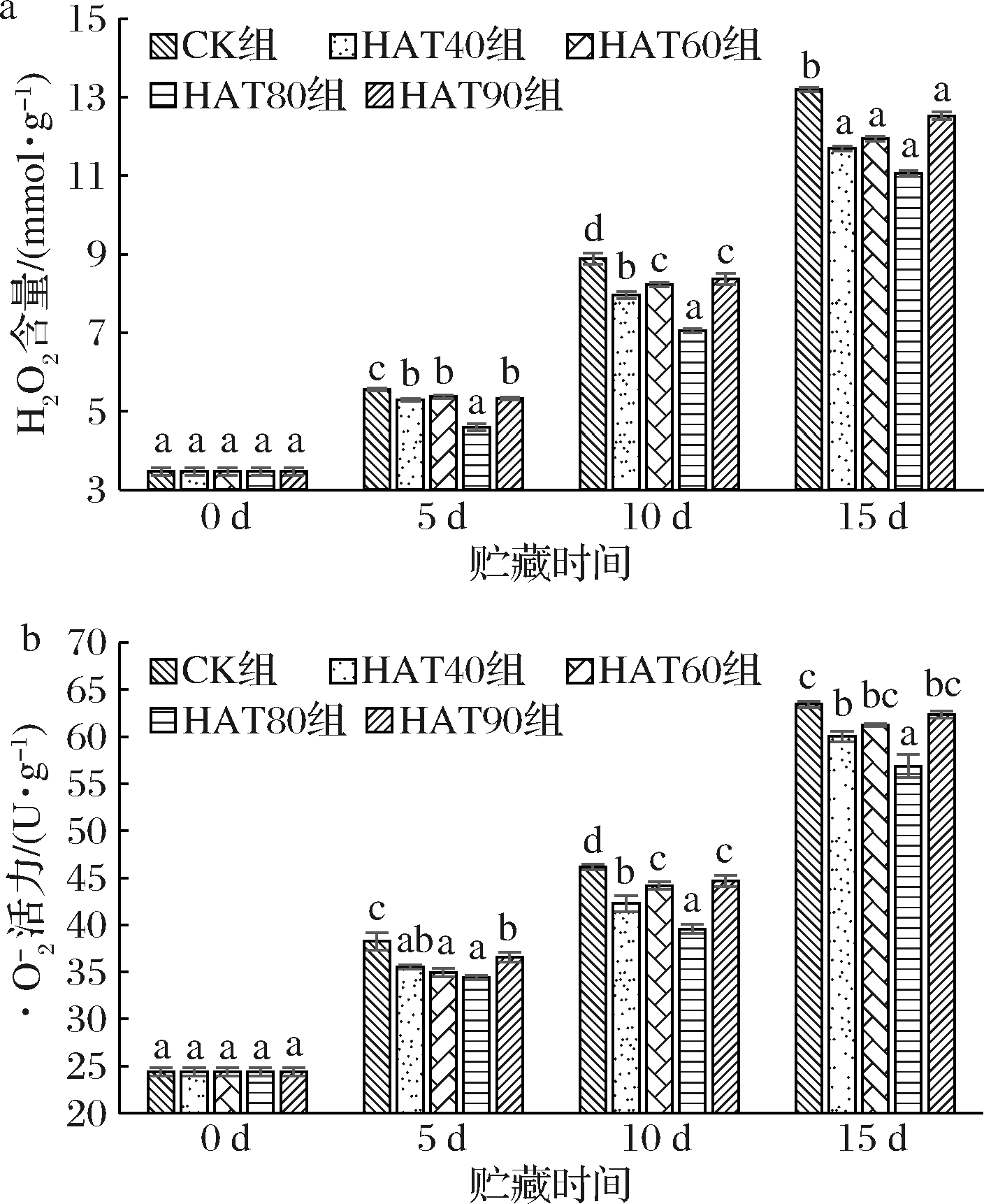
a-H2O2含量;![]() 活性
活性
图5 不同湿度热空气处理对低温贮藏西葫芦
果实H2O2含量![]() 活性的影响
活性的影响
Fig.5 The effect of hot air treatments with different
humidity on H2O2 content, ![]() of
of
zucchini fruits stored at low temperature
抗坏血酸含量可以作为采后果蔬抗氧化应激能力水平的重要标志。抗坏血酸的生成和消耗能力与果蔬对外界胁迫(低温)的耐受性有关。当环境温度异于果蔬正常生长温度,都可能会激活抗坏血酸合成基因的翻译和转录,抗坏血酸代谢基因的高表达增强了冷敏果蔬的抗冷性[4]。如图6所示,贮藏前期各组抗坏血酸含量较初始值有所上升且处理组抗坏血酸含量之间无显著差异(P>0.05),但都显著大于CK组(P<0.05),表明西葫芦果实合成抗坏血酸抵御外界低温胁迫影响,且经热空气处理可以提高西葫芦果实对低温胁迫的抗性,这与冷害指数得到相同的结论。贮藏中后期HAT80组的抗坏血酸含量显著低于其他处理组,表明处理湿度的差异能显著影响低温下西葫芦果实抗环血酸含量的合成和消耗。
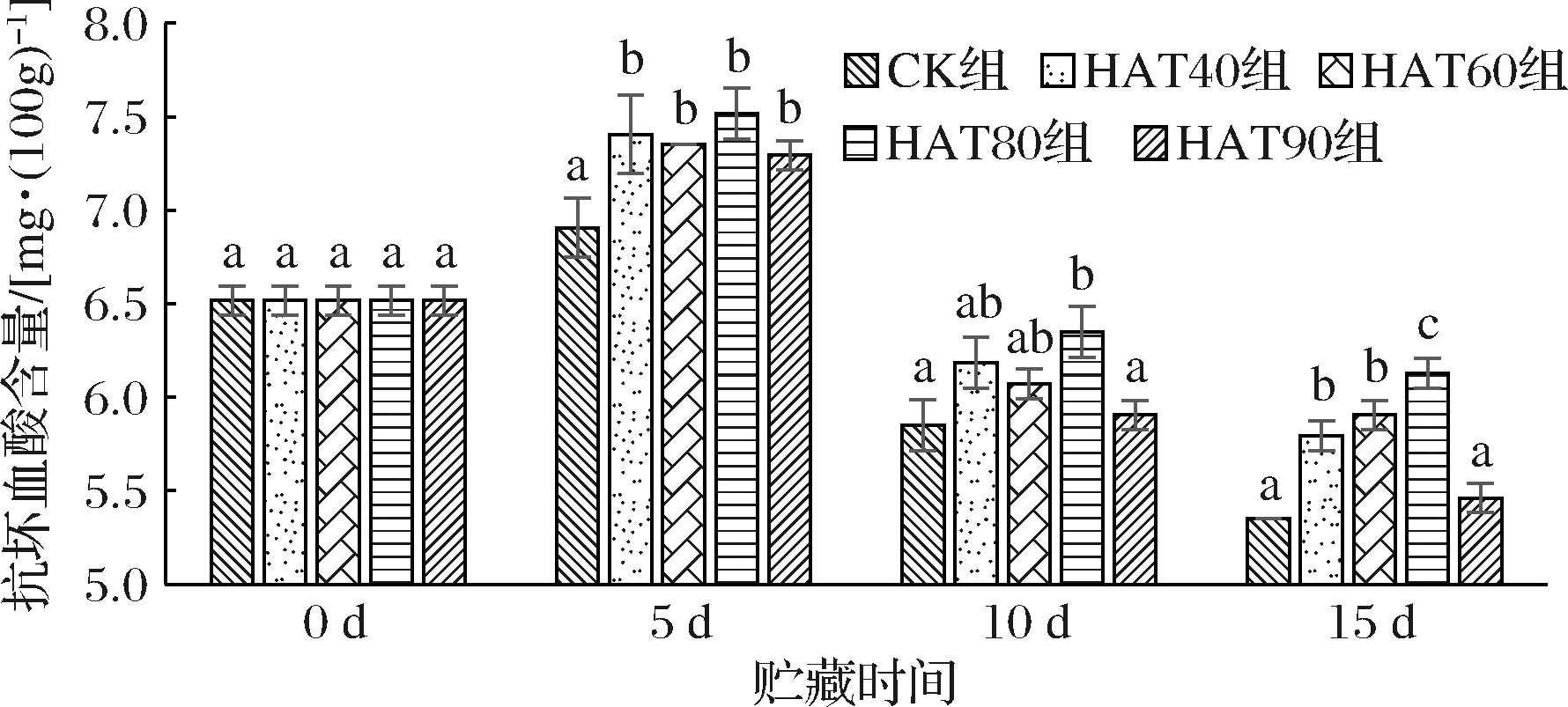
图6 不同湿度热空气处理对低温贮藏西葫芦果实
抗坏血酸含量的影响
Fig.6 The effect of hot air treatments with different humidity on the
ascorbic acid content of zucchini fruits stored at low temperature
SOD能够清除![]() 减少对细胞膜系统的氧化损伤和对有机体的毒害作用。如图7-a所示,各组SOD活性在整个贮藏期中呈现相似的下降趋势,在贮藏中后期SOD活性有较大的降低,这一结论同样在热处理枇杷[32],梨[33]等果实中得到证实。贮藏第10、第15天CK组SOD活性分别较前一次降低142.63、151.15 U/g,表明贮藏前期各组西葫芦可以保持较高的SOD活性,贮藏中后期由于活性氧代谢的失衡,果实SOD活性急剧下降。HAT80组在整个贮藏过程中都有着较高的SOD活性,同期SOD活力在第5天、第10天、第15天分别比CK组高7.33%、14.67%、6.03%。
减少对细胞膜系统的氧化损伤和对有机体的毒害作用。如图7-a所示,各组SOD活性在整个贮藏期中呈现相似的下降趋势,在贮藏中后期SOD活性有较大的降低,这一结论同样在热处理枇杷[32],梨[33]等果实中得到证实。贮藏第10、第15天CK组SOD活性分别较前一次降低142.63、151.15 U/g,表明贮藏前期各组西葫芦可以保持较高的SOD活性,贮藏中后期由于活性氧代谢的失衡,果实SOD活性急剧下降。HAT80组在整个贮藏过程中都有着较高的SOD活性,同期SOD活力在第5天、第10天、第15天分别比CK组高7.33%、14.67%、6.03%。
CAT是植物体内活性氧清除系统中的重要保护酶,能够催化H2O2分解为水和氧气,减少H2O2对果蔬组织造成的氧化损伤。如图7-b所示,西葫芦果实CAT活性在贮藏期内呈先上升后下降的趋势,在贮藏前期,各组果实CAT活性无显著差异(P>0.05);第10天CAT活性出现了较大的降幅,CK组、HAT90组、HAT80组、HAT60组、HAT40组分别比第5天降低了30.11、23.97、19.39、23.73、21.20 U/mg,其中HAT80组具有较低的降幅。
POD是果蔬体内普遍存在的一种氧化还原酶,随着果蔬的成熟衰老和对外界胁迫的应答发生变化,POD同样能够清除H2O2,防止过量自由基对机体造成的损害。如图7-c所示,POD活性在贮藏期内迅速上升,处理组的POD活性显著大于CK组(P<0.05)。贮藏末期HAT80组POD活性分别比CK组、HAT90组、HAT60组、HAT40组高6.98%、2.85%、4.62%、3.95%,可以有效地维持贮藏过程中POD活性。

a-SOD;b-CAT;c-POD
图7 不同湿度热空气处理对低温贮藏西葫芦果实SOD、CAT、POD活性的影响
Fig.7 The effect of hot air treatment with different humidity on SOD、CAT、POD activity of zucchini fruits stored at low temperature
SOD、CAT、和POD作为细胞内清除活性氧的保护酶,在正常状况下会协同清除果蔬受外界胁迫时过量产生的活性氧,维持活性氧代谢的平衡,避免活性氧在植物体内过量的积累导致氧化损伤[34]。随着贮藏期的延长,SOD活性、CAT活性、抗坏血酸含量的下降,POD活性的上升表示果实内活性氧清除能力先上升后在逐渐下降,这与果实内![]() 氧化物质含量的上升以及电解质外渗率、MDA含量的上升相呼应,这一结论也在枇杷[32]、黄瓜[16]等果蔬中得到。在植物中过量积累
氧化物质含量的上升以及电解质外渗率、MDA含量的上升相呼应,这一结论也在枇杷[32]、黄瓜[16]等果蔬中得到。在植物中过量积累![]() 的部分细胞会导致代谢功能的损伤和细胞完整性的丧失[31]。如图6和图8所示,与抗氧化系统指标相对的是各组
的部分细胞会导致代谢功能的损伤和细胞完整性的丧失[31]。如图6和图8所示,与抗氧化系统指标相对的是各组![]() 含量随着贮藏时间的延长呈上升趋势,表明虽然果实的抗氧化系统在不断清除活性氧,但随着贮藏时间的延长,果实细胞代谢功能破坏程度逐渐加深,氧化损伤逐渐加重。但CK组与热处理组之间存在显著性差异(P<0.05),表明适宜的热空气处理促进抗氧化系统的激活,抑制
含量随着贮藏时间的延长呈上升趋势,表明虽然果实的抗氧化系统在不断清除活性氧,但随着贮藏时间的延长,果实细胞代谢功能破坏程度逐渐加深,氧化损伤逐渐加重。但CK组与热处理组之间存在显著性差异(P<0.05),表明适宜的热空气处理促进抗氧化系统的激活,抑制![]() 含量的增长。在贮藏前中期80%组与其他处理组之间也存在显著性差异,表明处理时湿度的差异也会导致细胞内积累氧化物的差异。
含量的增长。在贮藏前中期80%组与其他处理组之间也存在显著性差异,表明处理时湿度的差异也会导致细胞内积累氧化物的差异。
热处理对采后果实成熟的影响取决于果实的耐热性水平、传热速率和能量平衡(温差、比热容和相对湿度)、处理时间等因素[35]。相对湿度的差异可能同样会对热处理后果蔬贮藏品质有影响。热空气处理初期,果蔬表面会被加热到环境温度所对应的湿球温度[36],由湿空气焓湿图得知当干球温度一定,相对湿度越高,湿球温度越高,焓值越高。由傅里叶导热定律得知加热介质焓值越高,加热速率越大[37]。所以在热空气处理过程中,HAT90组果实表皮层和中心温度升温速率快这点与BARATI等[11]发现相同。根据焓湿图计算得到,将20 ℃的西葫芦放入44 ℃的热空气中,当相对湿度高于25.13%时,水蒸气会结露附着在西葫芦果实上,直到 HAT90组、HAT80组、HAT60组、HAT40组外表皮温度分别超过对应的露点温度41.95、39.73、34.45、27.36 ℃为止,水蒸气不会再凝结附着在果实外表。综合温度场结果从传热特性分析可知,根据湿空气的露点温度空气湿度对传热的影响可能分为2种情况,一种情况为当热空气湿度较低且西葫芦果实温度低于露点温度时,湿空气中的水分会在西葫芦果实表面凝结,此时由于空气湿度较低导致露点温度也较低,凝结的水分量较少。由于风扇的强制热空气对流导致凝结水分有较快的蒸发速率,并且直到西葫芦温度大于露点温度这一时间内,果实表面附着凝结水的蒸发速率大于凝结速率,此时主要是通过对流传热对西葫芦果实进行热处理,表面凝结水分会蒸发吸收一部分热量,对于传热起到了阻碍作用,升温速率较慢,HAT60组、HAT40组以及HAT80组后期可能属于这一种,且HAT60组表面水分量和蒸发完全所需时间长于HAT40组,但由于湿度60%的空气焓值高于湿度 40%空气所以在中心温度测温中,2组升温速率相差不大;另一种情况为当湿度较高且果实外表皮温度低于露点温度时,西葫芦果实表面凝结水速率大于强制热空气对流导致的水分蒸发速率,表面凝结水量增加迅速,过多时还会形成水膜直至果蔬表面温度高于露点温度,此时对流换热与导热共同作用,凝结水分起到促进传热的作用,升温速率较快,HAT90组一直处于这一状态。而HAT80组在前期处于水分促进传热阶段,直到水分凝结量开始降低;在处理中后期,HAT80组在表面温度达到39.73 ℃后不再凝结水分后处于水分阻碍传热阶段。HAT80组在达到露点温度前,表面水分处在不断凝结和蒸发状态,这点与表皮层测温由一段降温趋势可以相印证。热处理达到2 853 s后,升温速率减慢表明这之后时间里表面凝结水分处于阻碍传热作用,直到4 653 s温度达到38.13 ℃后升温速率开始加快,表明凝结水分阻碍作用减少直到凝结水消失。由HAT80组的处理效果优于HAT40组、HAT60组、HAT90组可知,升温速率在一定范围内时,随着升温速率的增加,热处理效果越好,但当升温速率过快时,果蔬可能如同在较高温度下处理,会受到热损伤,这一点与姜雪等[38]选择处理初始机体温度较高的西葫芦结论相似,较大的传热温差可能会在处理过程中不断积累较多“热应力”造成热损伤[39]。PEREZ-CARRILLO等[40]使用湿度100%与湿度50%进行热空气处理木瓜,得到湿度50%可以有效减少木瓜的冷害与腐烂症状。HAT80组的升温速率适宜,可能会促进西葫芦果实生理应激反应加强。
本研究表明,采用80%湿度的热空气处理,既可以有效减少处理过程中热应力的过量积累防止热损伤,又可以在低温贮藏下增强抗氧化酶活性,减轻氧化损伤,减轻冷害症状的发生,提高贮藏西葫芦品质。该结论为采后果蔬热空气处理传热过程的进一步研究提供了一定的参考与借鉴。
[1] JIMENÉZ-MONREAL A M, GARC A-DIZ L, MART
A-DIZ L, MART NEZ-TOMÉ M, et al.Influence of cooking methods on antioxidant activity of vegetables[J].Journal of Food Science, 2010, 74(3):97-103.
NEZ-TOMÉ M, et al.Influence of cooking methods on antioxidant activity of vegetables[J].Journal of Food Science, 2010, 74(3):97-103.
[2] SEVILLANO L, SANCHEZ-BALLESA M T, ROMOJARO F, et al.Physiological, hormonal and molecular mechanisms regulating chilling injury in horticultural species.Postharvest technologies applied to reduce its impact[J].Journal of the Science of Food and Agriculture, 2009, 89(4):555-573.
[3] ZHANG X H, SHEN L, LI F J, et al.Hot air treatment-induced arginine catabolism is associated with elevated polyamines and proline levels and alleviates chilling injury in postharvest tomato fruit[J].Journal of the Science of Food and Agriculture, 2013, 93(13):3 245-3 251.
[4] ENDO H, OSE K, BAI J H, et al.Effect of hot water treatment on chilling injury incidence and antioxidative responses of mature green mume (Prunus mume) fruit during low temperature storage[J].Scientia Horticulturae, 2019, 246:550-556.
[5] HUAN C, HAN S, JIANG L, et al.Postharvest hot air and hot water treatments affect the antioxidant system in peach fruit during refrigerated storage[J].Postharvest Biology & Technology, 2017, 126:1-14.
[6] WANG K, SHAO X F, GONG Y F, et al.Effects of postharvest hot air treatment on gene expression associated with ascorbic acid metabolism in peach fruit[J].Plant Molecular Biology Reporter, 2014, 32(4):881-887.
[7] ZHOU H J, YE Z W, SU M S, et al.Effect of heat treatment on protein content and the quality of ‘Hujingmilu’ peach [Prunus persica (L.) Batsch][J].HortScience:A Publication of the American Society for Horticultural Science, 2015, 50(10):1 531-1 536.
[8] 邵婷婷, 姜雪, 张敏, 等.贮前强制对流热空气处理对低温胁迫下青椒果实ASA-GSH循环代谢的影响[J].食品与发酵工业,2019, 45(18):65-72.
SHAO T T, JIANG X, ZHANG M, et al.Effects of pre-storage forced convective hot air treatment on ASA-GSH cycle of green pepper in low temperature stress[J].Food and Fermentation Industries, 2019, 45(18):65-72.
[9] 丁玉先, 张娜, 陈爱强.采后果蔬热处理条件的传热特性分析[J].食品与发酵工业, 2020, 46(7):188-193.
DING Y X, ZHANG N, CHEN A Q.Analysis of heat transfer characteristics of postharvest heat treatment conditions of fruits and vegetables[J].Food and Fermentation Industries, 2020, 46(7):188-193.
[10] CHEN A Q, YANG Z, YIN H J, et al.Preservation quality of cold shock treated cucumber and heat transfer characteristic during treatment[J].Transactions of the Chinese Society of Agricultural Engineering, 2011, 27(11):349-353.
[11] BARATI E, ESFAHANI J A.A new solution approach for simultaneous heat and mass transfer during convective drying of mango[J].Journal of Food Engineering, 2011, 102(4):302-309.
[12] 刘风娟, 邵兴锋, 屠康, 等.采后热处理对枇杷果实冷藏期间品质的影响[J].果树学报, 2009, 26(5):649-653.
LIU F J, SHAO X F, TU K, et al.Effect of postharvest heat treatment on the quality of loquat fruit in cold storage[J].Journal of Fruit Science, 2009, 26(5):649-653.
[13] 段杨峰. 热空气和MeJA复合处理对枇杷果实保鲜的作用及其机理研究[D].南京:南京农业大学, 2010.
DUAN Y F.Study on effect and mechanisms of hot air combined with MeJA on ouality maintenance in loquat fruit[D].Nanjing:Nanjing Agricultural University, 2010.
[14] 宋钰兴, 邵兴锋, 施婷婷, 等.高温短时热空气处理对枇杷品质和冷害的影响[J].果树学报, 2011, 28(5):837-842.
SONG Y X, SHAO X F, SHI T T, et al.Effects of short-time hot air treatment on the quality and chilling injury of loquat fruits during storage at low temperature[J].Journal of Fruit Science, 2011, 28(5):837-842.
[15] ZHANG M, LIU W, LI C, et al.Postharvest hot water dipping and hot water forced convection treatments alleviate chilling injury for zucchini fruit during cold storage[J].Scientia Horticulturae, 2019, 249:219-227.
[16] 姜雪, 张敏, 赵昱瑄, 等.不同初始机体温度对热水处理西葫芦果实低温贮藏品质和活性氧代谢的影响[J].食品与发酵工业, 2020, 46(5):231-239.
JIANG X, ZHANG M, ZHAO Y X, et al.Effects of different initial body temperatures on low-temperature storage quality and active oxygen metabolism of hot water treated zucchini fruit[J].Food and Fermentation Industries, 2020, 46(5):231-239.
[17] 何全光, 黄梅华, 张娥珍,等.芒果TPA质构测定优化及不同成熟度芒果质构特性分析[J].食品工业科技, 2016, 37(18):122-126.
HE Q G, HUANG M H, ZHANG E Z, et al, Optimization for mango texture profile analysis and characterization of texture to different maturaity of mango[J].Science and Technology of Food Industry, 2016, 37(18):122-126.
[18] 赵昱瑄, 张敏, 姜雪, 等.短时热处理对低温逆境下黄瓜不同部位的冷害及活性氧代谢影响[J].食品与发酵工业, 2020, 46(7):180-187.
ZHAO Y X, ZHANG M, JIANG X, et al.Effects of short time heat treatment on chilling injury and reactive oxygen metabolism in different parts of cucumber under low temperature [J].Food and Fermentation Industries, 2020, 46(7):180-187.
[19] 龚国强, 于梁.低温对黄瓜果实超氧化物歧化酶(SOD)的影响[J].园艺学报, 1996, 23(1):97-98.
GONG G Q, YU L.Effect of low temperature on superoxide dismutase (SOD) in cucumber fruit[J].Acta Horticulturae Sinica, 1996, 23(1):97-98.
[20] LUFU R, AMBAW A, OPARA U L.Water loss of fresh fruit:Influencing pre-harvest, harvest and postharvest factors[J].Entia Horticulturae, 2020, 272:109519.
[21] BARTZ, JERRY.Postharvest physiology and pathology of vegetables coatings and other supplemental treatments to maintain vegetable quality[J].2002.DOI:10.1201/9780203910092.ch17.
[22] 王相友, 李霞, 王娟, 等.气调包装下果蔬呼吸速率研究进展[J].农业机械学报,2008(8):94-100;78.
WANG X Y, LI X, WANG J, Advances of respiration rate in modified atmosphere packaging for fruits and vegetables [J].Transactions of the Chinese Society for Agricultural Machinery,2008(8):94-100;78.
[23] BOVI G G, GUIDO R, CALEB O J, et al.Measurement and modelling of transpiration losses in packaged and unpackaged strawberries[J].Biosystems Engineering, 2018, 174:1-9.
[24] XANTHOPOULOS G T, TEMPLALEXIS C G, ALEIFERIS N P, et al.The contribution of transpiration and respiration in water loss of perishable agricultural products:The case of pears[J].Biosystems Engineering, 2017, 158:76-85.
[25] O′DONOGHUE E M, SOMERFIELD S D, CHEN R K Y, et al.Cell wall composition during expansion, ripening and postharvest water loss of red bell peppers (Capsicum annuum L.)[J].Postharvest Biology and Technology, 2020, 168:111225.
[26] PROMYOU S, KETSA S, DOORN W G V.Hot water treatments delay cold-induced banana peel blackening[J].Postharvest Biology & Technology, 2008, 48(1):132-138.
[27] 孙玉芳. 温度胁迫对黄连生理生化特性影响研究[D].重庆:西南大学, 2006.
SUN Y F.Study about effects of temperature stress on physiological and biochemical character of Coptis chinensis Franch[D].Chongqing:Southwest University, 2006.
[28] 侯建设, 李春荣, 李中华.贮前热处理对青椒冷害、活性氧代谢和膜脂过氧化的影响[J].食品工业, 2009, 30(6):1-4.
HOU J S, LI C R, LI Z H, Effect of prestorage heat treatment on chilling injury, activated oxygen metabolism and membrane lipid peroxidation in green pepper fruits[J].The Food Industry, 2009, 30(6):1-4.
[29] ![]()
![]() CHEN C Y, CHEN Y, et al.Improving storability of “Nanfeng” mandarins by treating with postharvest hot water dipping[J].Journal of Food Quality, 2020, 2020:1-12.
CHEN C Y, CHEN Y, et al.Improving storability of “Nanfeng” mandarins by treating with postharvest hot water dipping[J].Journal of Food Quality, 2020, 2020:1-12.
[30] HUAN C, HAN S, JIANG L, et al.Postharvest hot air and hot water treatments affect the antioxidant system in peach fruit during refrigerated storage[J].Postharvest Biology & Technology, 2017, 126:1-14.
[31] YANG S, SU X, PRASAD K N, et al.Oxidation and peroxidation of postharvest banana fruit during softening [J].Pakistan Journal of Botany, 2008, 40(5):2 023-2 029.
[32] ZHANG Y, JIN P, HUANG Y P, et al.Effect of hot water combined with glycine betaine alleviates chilling injury in cold-stored loquat fruit[J].Postharvest Biology & Technology, 2016, 118:141-147.
[33] 王玲利, 刘超, 曾明, 等.采后处理对“黄冠”梨膜脂过氧化和保护酶活性的影响[J].中国南方果树, 2017, 46(2):132-136.
WANG L L, LIU C, ZENG M, et al.Effects of postharvest treatment on membrane lipid peroxidation and protective enzyme activity of “Huangguan” pear[J].South China Fruits, 2017, 46(2):132-136.
[34] BOWLER C, MONTAGU M V, INZE D. Superoxide dismutase and stress tolerance[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1992, 43(1):83-116.
[35] PAULL R E, CHEN N J.Heat treatment and fruit ripening[J].Postharvest Biology & Technology, 2000, 21(1):21-37.
[36] AVERSA M, CURCIO S, ![]() V, et al.An analysis of the transport phenomena occurring during food drying process[J].Journal of Food Engineering, 2007, 78(3):922-932.
V, et al.An analysis of the transport phenomena occurring during food drying process[J].Journal of Food Engineering, 2007, 78(3):922-932.
[37] 巨浩羽, 肖红伟, 郑霞, 等.干燥介质相对湿度对胡萝卜片热风干燥特性的影响[J].农业工程学报, 2015(16):296-304.
JU H Y, XIAO H W, ZHENG X, et al.Effect of hot air relative humidity on drying characteristics of carrot slabs[J].Transactions of the Chinese Society of Agricultural Engineering, 2015(16):296-304.
[38] 姜雪, 张敏, 赵昱瑄, 等.不同初始机体温度对热水处理西葫芦果实低温贮藏品质和活性氧代谢的影响[J].食品与发酵工业, 2020, 46(5):231-239.
JIANG X, ZHANG M, ZHAO Y X, et al.Effects of different initial body temperatures on low-temperature storage quality and active oxygen metabolism of hot water treated zucchini fruit[J].Food and Fermentation Industries, 2020, 46(5):231-239.
[39] PAN Y F, CHEN L, CHEN X T, et al.Postharvest intermittent heat treatment alleviates chilling injury in cold-stored sweet potato roots through the antioxidant metabolism regulation[J].Journal of Food Processing and Preservation, 2019, 43(12):14274.
[40] PEREZ-CARRILLO E, YAHIA E M, ARIZA R, et al.Forced hot air treatment at low relative humidity is effective in reducing chilling injury and decay development in Papaya fruit[J].Acta Horticulturae, 2003, 604:697-702.