天然干酪的成熟即通过微生物和酶的作用,使干酪中原有的大分子物质逐步分解并产生丰富的风味化合物及前体物质,赋予干酪以色泽、质地和风味[1]。然而,干酪成熟是一个较长的过程,恒温恒湿的后熟条件需要大量成本投入,此外,由于标准化生产,巴氏杀菌后的原料乳制得的干酪缺乏传统干酪的香味,这可能是和非发酵剂乳酸菌(non-starter lactic acid bacteria,NSLAB)数量的减少和重要酶的失活有关[2]。在加工过程中添加NSLAB作为附属发酵剂来丰富干酪的风味并加速成熟是目前较为常见且有效的方法。
NSLAB主要是通过提升相关酶的含量来加速蛋白质和脂肪的代谢,促进小分子肽、游离脂肪酸(free fatty acid,FFA)和游离氨基酸(free amino acid,FAA)的生成,以提升干酪风味、缩短成熟时间[3]。此外,对功能食品日益增长的需求推动了益生菌干酪的开发。研究表明,乳酸菌作为附属发酵剂应用于干酪加工中,不仅可以增强干酪的风味,而且还具有抗氧化、抗高血压等活性功能[4]。
NSLAB菌株的特异性、发酵剂和NSLAB之间菌群的相互作用都会导致产品特性的差异[5]。此外,NSLAB作为附属发酵剂在加速干酪成熟过程中,能够在释放功能性活性肽的同时,减少苦味肽的生成,从而改善干酪的口感与风味。本研究通过对24株LAB菌株进行特性研究、筛选,然后利用干酪浆模型快速评价NSLAB对干酪蛋白的水解特性,以考量NSLAB在干酪环境中作为附属发酵剂的实际可行性,为改善天然干酪成熟特性的研究奠定基础。
1 材料与方法
1.1 材料与仪器
1.1.1 材料
24株LAB,由本实验室前期分离;生牛乳,光明乳业股份有限公司;CHOOZIT MA 14 LYO发酵剂(乳酸乳球菌乳酸亚种,乳酸乳球菌乳脂亚种)、Marzyme 150 MG凝乳酶,丹尼斯克(中国)有限公司;L-亮氨酸对硝基苯胺,探索平台;其余试剂均为分析纯。
1.1.2 仪器
KBF240型培养箱,德国Binder公司;Bag Mixer®400均质机,法国interscience公司;PB-10型pH计,瑞士梅特勒-托利多公司;Foss 8400全自动凯氏定氮仪,瑞典FOSS分析仪器有限公司;多功能酶标仪,美谷分子仪器限公司;Waters e2695高效液相色谱仪,美国Waters公司。
1.2 实验方法
1.2.1 菌株和培养条件
本研究中使用的24株LAB的菌株信息如表1所示。将菌株在MRS培养基中37 ℃连续传代2次。
表1 本研究中所用乳酸菌的种类、菌株编号及来源
Table 1 Species, strain ID, and sources of LAB strains used in this study
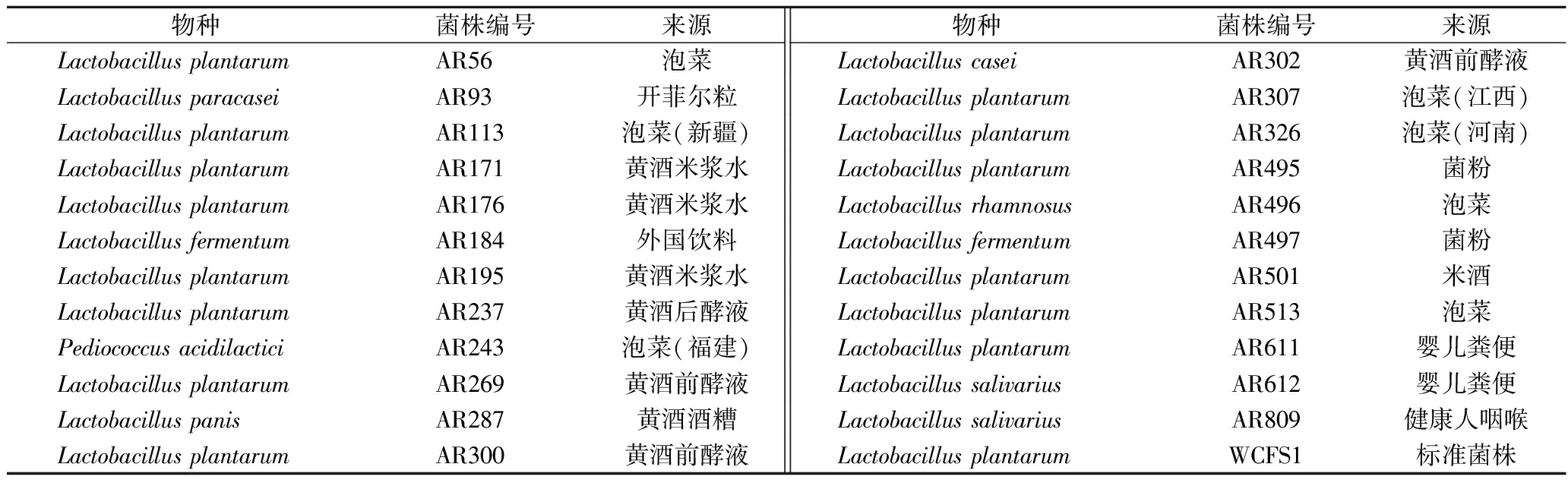
物种菌株编号来源物种菌株编号来源Lactobacillus plantarumAR56泡菜Lactobacillus caseiAR302黄酒前酵液Lactobacillus paracaseiAR93开菲尔粒Lactobacillus plantarumAR307泡菜(江西)Lactobacillus plantarumAR113泡菜(新疆)Lactobacillus plantarumAR326泡菜(河南)Lactobacillus plantarumAR171黄酒米浆水Lactobacillus plantarumAR495菌粉Lactobacillus plantarumAR176黄酒米浆水Lactobacillus rhamnosusAR496泡菜Lactobacillus fermentumAR184外国饮料Lactobacillus fermentumAR497菌粉Lactobacillus plantarumAR195黄酒米浆水Lactobacillus plantarumAR501米酒Lactobacillus plantarumAR237黄酒后酵液Lactobacillus plantarumAR513泡菜Pediococcus acidilacticiAR243泡菜(福建)Lactobacillus plantarumAR611婴儿粪便Lactobacillus plantarumAR269黄酒前酵液Lactobacillus salivariusAR612婴儿粪便Lactobacillus panisAR287黄酒酒糟Lactobacillus salivariusAR809健康人咽喉Lactobacillus plantarumAR300黄酒前酵液Lactobacillus plantarumWCFS1标准菌株
1.2.2 附属发酵剂的筛选
1.2.2.1 产酸能力
将24株LAB按照1%的接种量分别接种于10%质量分数的脱脂乳培养基中,在30 ℃下培养,分别测定培养0、6 和24 h后的培养基pH值[6]。
1.2.2.2 自溶度
参考SCATASSA等[7]的方法测定自溶度。
1.2.2.3 氨肽酶活力测定
(1)细菌无细胞提取液(cell-free extract,CFE)的制备。制备方法参考文献[8]。
(2)酶活力测定。参考文献[9]的方法。氨肽酶活力:在37 ℃条件下,在410 nm下、1 min使吸光度改变0.001个单位所需酶的数量为1 U。结果表示为U/mg蛋白质。
1.2.2.4 蛋白水解活性
将菌株点接在含1%脱脂乳粉的PCA培养基上,37 ℃培养48 h[10]。选择有透明圈形成的阳性菌株测定其蛋白水解度。
使用邻苯二甲醛(o-phthalaldehyde,OPA)试剂法测定菌株的蛋白水解活性[11]。根据酪氨酸标准曲线,以水解产生的相当于酪氨酸的FAA的量表征蛋白水解度。
1.2.2.5 脂解活性
将菌株点接在含0.1%三丁酸甘油酯的MRS培养基上,37 ℃培养72 h,观察有无透明圈形成[1]。
1.2.2.6 耐盐性和产胞外多糖情况
在含有2%、4%、6% 质量分数NaCl的液体MRS中分别接种24株LAB,37 ℃培养,分别测定培养液在0和24 h的OD600,以测试菌株的耐盐性[12]。
用10%的蔗糖代替MRS中的葡萄糖,使用接种环法测试菌株产EPS情况[13]。
1.2.2.7 在低温条件下的生长情况
将菌株接种于液体MRS中,分别在4、10、15 ℃ 3个温度条件下培养24 h,通过测定OD600值判断24株LAB的生长状况[14]。
1.2.3 干酪凝乳及干酪浆模型的制备
(1)干酪凝乳的制作流程。参考袁然等[15]的方法。
(2)干酪浆模型的制作。将上述干酪凝块与50 g/L的无菌NaCl溶液按照2∶1的质量比装入无菌均质袋中,制成对照样;实验样分别加入4种NSLAB菌株的菌悬液(终浓度106 CFU/mL)[16]。使用均质机匀浆后,置于30 ℃培养箱中后熟。分别在第0、3、6、9、12天对各组干酪浆进行取样分析。
1.2.4 不同NSLAB菌株对干酪浆模型的影响
1.2.4.1 干酪浆组分和pH测定
水分:参考GB 5009.3—2016 《食品安全国家标准 食品中水分的测定》;脂肪:参考GB5009.6—2016 《食品安全国家标准 食品中脂肪的测定》;蛋白质:参考GB5009.6—2016 《食品安全国家标准 食品中蛋白质的测定》,使用Foss 8400全自动凯氏定氮仪测定;pH:将干酪浆与无菌水按1∶2质量比混匀,用pH计测定pH值。
1.2.4.2 干酪浆模型成熟期间微生物变化情况
在LM17培养基上(30 ℃有氧条件下培养48 h)计数发酵剂乳球菌数;在ROGOSA培养基上(37 ℃厌氧条件下培养48 h)计数总NSLAB数[17]。
1.2.4.3 蛋白水解情况
(1)pH 4.6-SN。取2.5 g干酪浆,加入22.5 mL 0.9%的NaCl溶液中,调节pH值至4.6,在25 ℃水浴1 h后离心,取上清液进行凯氏定氮[18]。
(2)12% TCA-SN。取pH 4.6-SN溶液和24% 三氯乙酸(trichloroacetic acid,TCA)溶液各4 mL,混匀后25 ℃水浴1 h,离心、取上清液进行凯氏定氮[19]。
(3)干酪浆模型成熟过程中水溶性多肽的RP-HPLC。取pH 4.6-SN上机分析,RP-HPLC采用梯度洗脱模式,具体条件参照贾宏信等[20]的研究。
1.2.5 数据处理
采用SPSS 17.0、Origin 2019对数据进行处理分析,数据用均值±标准差(n=3)的形式表示。
2 结果与分析
2.1 附属发酵剂的筛选结果
2.1.1 菌株产酸能力与自溶度评价
在干酪加工中,NSLAB的酸化能力不宜过高,以避免干酪过度酸化。24株LAB的酸化结果如图1-a所示,根据附属发酵剂的酸化标准[21],除了菌株AR93和AR184在6 h后的ΔpH≥0.4,其余菌株的酸化能力均较低;24 h后酸化结果表明,13株菌株在24 h内ΔpH均<1,符合NSLAB筛选条件。
NSLAB菌体裂解并随后释放胞内酶能力是干酪成熟过程中一个理想的特性。胞内蛋白酶、脂肪酶等可以促进干酪中小分子物质的生成。如SEIXAS等[12]从手工Serrano干酪中分离出的Leuconostoc mesenteroides UEL28菌株自溶度为11.8%。结果显示(图1-b),42%的菌株具有良好的自溶度(自溶度>25%),其中,AR809的自溶能力最强,达到52%。根据AYAD等[21]所述标准,除了自溶度<15%的AR243和AR513,其余22株LAB的自溶度均符合筛选条件。
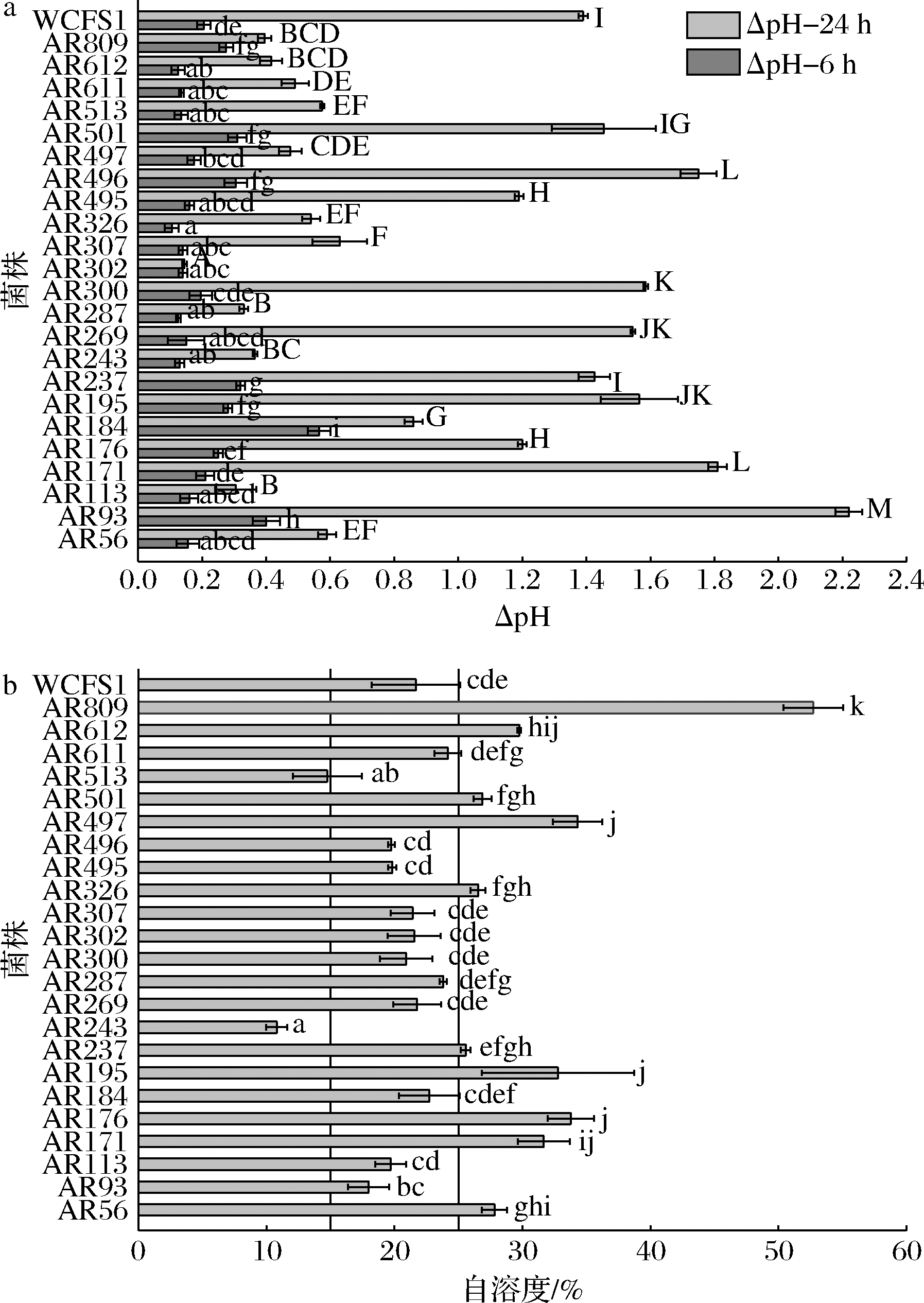
a-酸化能力;b-自溶度
图1 24株LAB的酸化能力和自溶度
Fig.1 Acidification and autolysis activities of 24 LAB strains
注:a中不同小写字母表示菌株发酵6 h后的pH值存在显著差异, 不同大写字母表示菌株发酵24 h后的pH值存在显著差异 (P<0.05);b中不同小写字母表示结果存在显著差异(下同)
2.1.2 氨肽酶与蛋白水解能力评价
氨肽酶能够顺式水解肽链氨基末端的疏水性氨基酸[22]。在附属发酵剂菌株的筛选研究中,所选菌株的氨肽酶活力在0.1~143 U/mg不等。如GONZ LEZ等[8]从传统西班牙干酪中筛选出的Lactobacillus plantarum GE2077酶活力为18 U/mg,酶活力值最高的L.paracasei GE2036的酶活力为143 U/mg。
LEZ等[8]从传统西班牙干酪中筛选出的Lactobacillus plantarum GE2077酶活力为18 U/mg,酶活力值最高的L.paracasei GE2036的酶活力为143 U/mg。
本研究中,24株LAB的亮氨酸氨肽酶活性范围为6.5~55.7 U/mg(图2-a),其中AR171、AR184、AR287、AR469、AR497、AR611、AR612、AR809的氨肽酶活力较高,具有作为NSLAB的潜力。
蛋白水解活性是NSLAB作为附属发酵剂的一项重要特性,适度的蛋白水解可以加速小分子物质的生成。结果表明,24株LAB菌落周围均有透明圈的形成,选择阳性菌株进一步测定其蛋白水解度。酪氨酸标准曲线的回归方程为y=0.0039x+0.0247,R2=0.998 6。如图2-b所示,菌株的蛋白水解活性在70.59~209.18 mg/L,菌株AR496蛋白水解活力最高,且不同菌株之间的蛋白水解活性存在显著差异(P<0.05)。在NIETO-ARRIBAS等[6]的研究中,3株LAB候选菌株的蛋白水解活性在90~135 mg/L上下,表明本研究中菌株的蛋白水解活性具备作为NSLAB的应用潜力。

a-氨肽酶活性;b-蛋白水解活性
图2 24株LAB的氨肽酶活性和蛋白水解活性
Fig.2 Aminopeptidase and proteolytic activities of 24 LAB strains
2.1.3 脂解活性
在脂肪酶的作用下,甘油三酯可以被水解为单、双甘油三酯,以及FFA和甘油[23]。结果显示(表2),10个LAB菌株具有脂解活性,其中AR809的透明圈比值最大,在干酪生产中有良好应用潜力。
2.1.4 耐盐性和产EPS情况
在成熟过程中,干酪高盐的环境要求NSLAB对盐有一定的耐受性。结果表明(表2),所有菌株均可以在2%~4%的盐含量下存活,可作为干酪生产中的附属发酵剂。
乳酸菌在生长过程中分泌的EPS,可以改善干酪的质地[10]。结果显示,有8株LAB可以产生EPS。
2.1.5 低温条件下的生长情况
如表2所示,50%的LAB可在4 ℃下存活,但是生长情况不佳。随着温度的提升,所有菌株在10和15 ℃条件下的OD600值均增加,表明菌株可在此温度下生长。在干酪成熟过程中,环境温度普遍在10 ℃上下,这表明所选24株LAB均符合NSLAB菌株的筛选标准。
表2 LAB菌株的耐盐能力、低温条件下生长情况、 产胞外多糖和脂解能力
Table 2 Salt tolerance, cold resistance, EPS and lipolytic activities of LAB
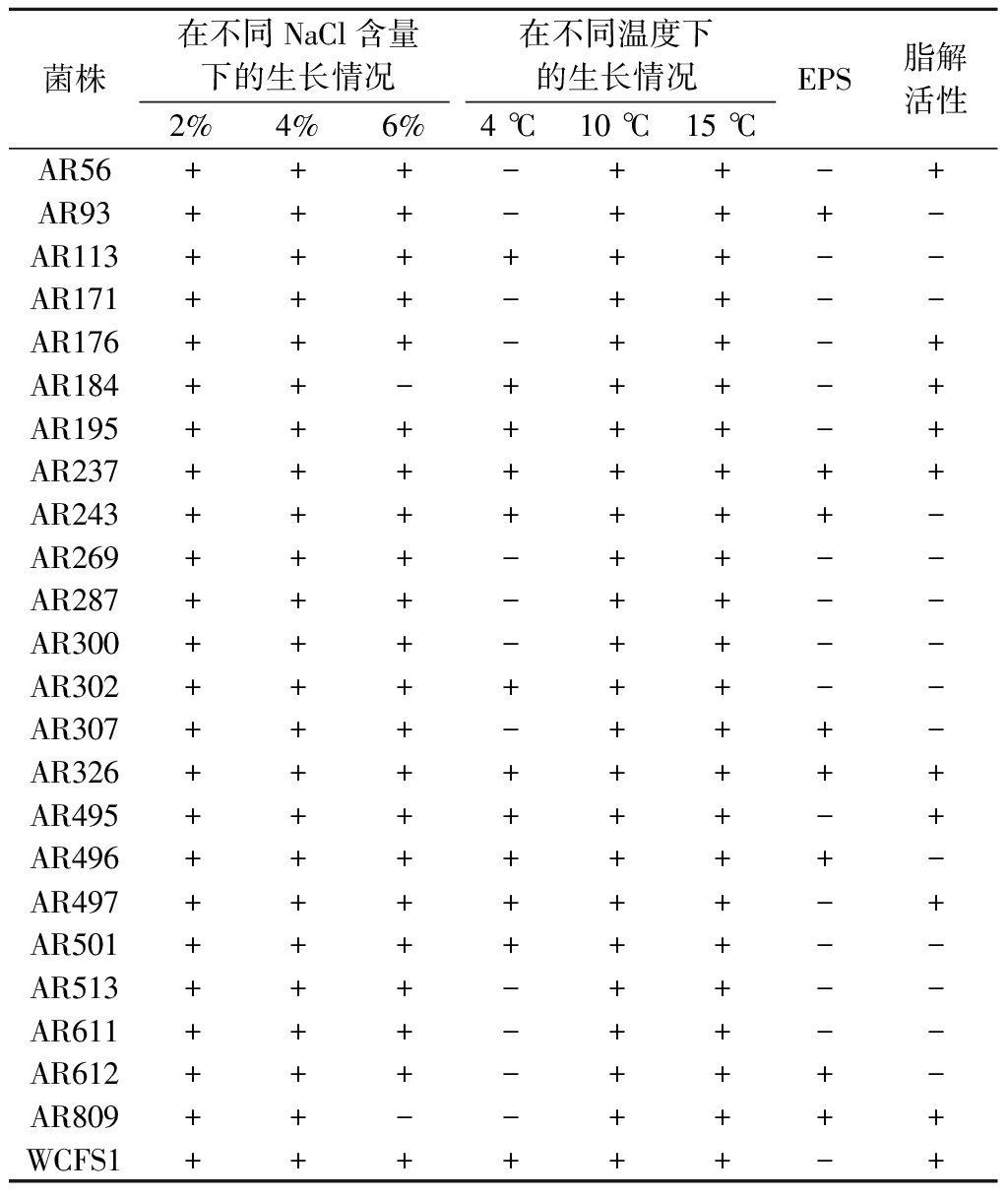
菌株在不同NaCl含量下的生长情况在不同温度下的生长情况2%4%6%4 ℃10 ℃15 ℃EPS脂解活性AR56+++-++-+AR93+++-+++-AR113++++++--AR171+++-++--AR176+++-++-+AR184++-+++-+AR195++++++-+AR237++++++++AR243+++++++-AR269+++-++--AR287+++-++--AR300+++-++--AR302++++++--AR307+++-+++-AR326++++++++AR495++++++-+AR496+++++++-AR497++++++-+AR501++++++--AR513+++-++--AR611+++-++--AR612+++-+++-AR809++--++++WCFS1++++++-+
注:+表示生长/阳性;-表示不生长/阴性
综合上述筛选指标,选择了4株具有良好应用潜力的菌株:AR497、AR611、AR612、AR809。上述菌株具有低产酸能力、高自溶度和氨肽酶活力、具有适度蛋白水解活性、能够适应干酪后熟过程中的高盐低温环境。将4株菌添加到干酪浆模型中,快速考量各菌株对干酪成熟特性的实际影响。
2.2 四种乳杆菌对干酪浆模型的影响
2.2.1 干酪浆组分和pH结果分析
取成熟12 d的干酪浆进行成分分析,结果表明(表3),分别添加4种附属发酵剂的实验组与对照相比,其脂肪、蛋白质和水分含量均无明显差别(P>0.05),即附属发酵剂的添加不会改变干酪的总成分。
表3 干酪浆组成分析 单位:%
Table 3 The composition of cheese slurries
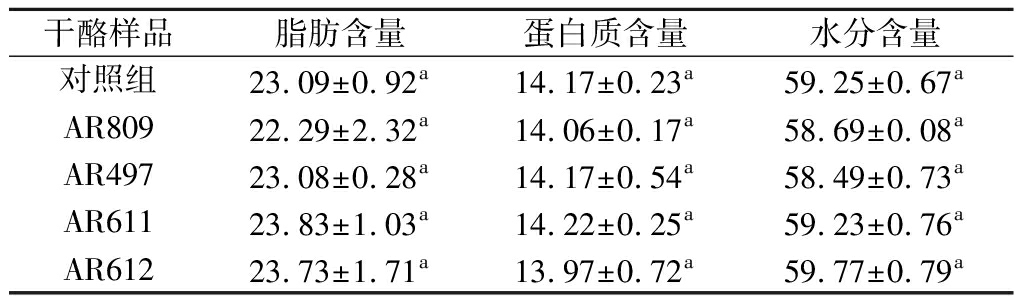
干酪样品脂肪含量蛋白质含量水分含量对照组23.09±0.92a14.17±0.23a59.25±0.67aAR80922.29±2.32a14.06±0.17a58.69±0.08aAR49723.08±0.28a14.17±0.54a58.49±0.73aAR61123.83±1.03a14.22±0.25a59.23±0.76aAR61223.73±1.71a13.97±0.72a59.77±0.79a
注:同一列中不同的上标字母表示结果具有显著差异(P<0.05)
由图3所示,在成熟过程中,干酪浆pH呈先下降、后略升高,最后趋于稳定的趋势。在成熟过程中,4个实验组和对照组的pH变化未见显著差异(P>0.05),表明4株NSLAB菌株的加入对模型体系的pH无负面影响。

图3 干酪浆模型成熟期内的pH变化
Fig.3 Changes in pH of cheese slurry model during ripening
2.2.2 干酪浆模型成熟过程中的微生物变化情况
如图4-a所示,在对照组和实验组中,发酵剂乳酸菌浓度变化趋势基本相同,在第12天时基本都维持在106 CFU/g干酪浆,这些结果表明,NSLAB的加入对发酵剂的存活无明显影响。

a-乳酸乳球菌菌落数;b-附属发酵剂菌落数
图4 干酪浆模型成熟过程中发酵剂乳球菌和 附属发酵剂的变化情况
Fig.4 Changes of Lactococcus starters and adjunct cultures of cheese slurry model during ripening
如图4-b所示,对照组和实验组中附属发酵剂NSLAB的初始浓度约为106 CFU/g干酪浆,在0~3 d内增加到107~108 CFU/g;随后可能由于菌体发生了自溶,菌落浓度略有下降;在12 d的成熟时间内总体趋于稳定且菌落数保持在较高水平。在对照组中,NSLAB的数量从第0天时未检出,增加到成熟第12天时的104 CFU/g。由于制作和取样过程均在无菌操作台上完成,尽可能避免外界污染,因此,这种结果可能是由于不定形NSLAB的形成造成[17]。
2.2.3 蛋白水解
(1)pH 4.6-SN、12% TCA-SN。pH 4.6-SN可代表初级蛋白水解。如图5-a所示,随着后熟过程进行,5组模型组的pH 4.6-SN含量都在不断增加,在成熟第6天时,4组实验组的pH 4.6-SN含量均高于对照组。第12天的方差分析表明,AR809和AR611两组的pH 4.6-SN含量与对照相比具有显著性差异(P<0.05)。
12% TCA-SN可作为二次蛋白水解程度的指标。由图5-b可看出,试验组的12% TCA-SN含量均高于对照组,且AR809组含量最高。这可能由于AR809自溶释放出更多胞内氨肽酶等,促进了小分子物质的生成。不同菌株对干酪浆二次蛋白水解的影响各不相同,这可能是由于它们在干酪基质中实际酶活性的差异性所致。

a-pH 4.6-SN含量;b-12% TCA-SN含量
图5 干酪浆模型成熟过程中蛋白质降解
Fig.5 Degradation of protein during ripening cheese slurry model
(2)干酪浆模型成熟过程中水溶性多肽的RP-HPLC。以AR809和对照组的RP-HPLC结果为例(图6),在第0天时,干酪浆中的亲水性肽(11.2~21.9 min洗脱)和疏水性肽(21.9~69 min洗脱)的峰区相似;随着后熟的进行,亲水性多肽的种类和含量呈增加趋势;第12天时,对照组和4个实验组的图谱出现差异,其中含L.salivarius AR809的实验组与对照相比,峰数和峰面积更多,表明干酪中酪蛋白的二次水解受到NSLAB的影响。
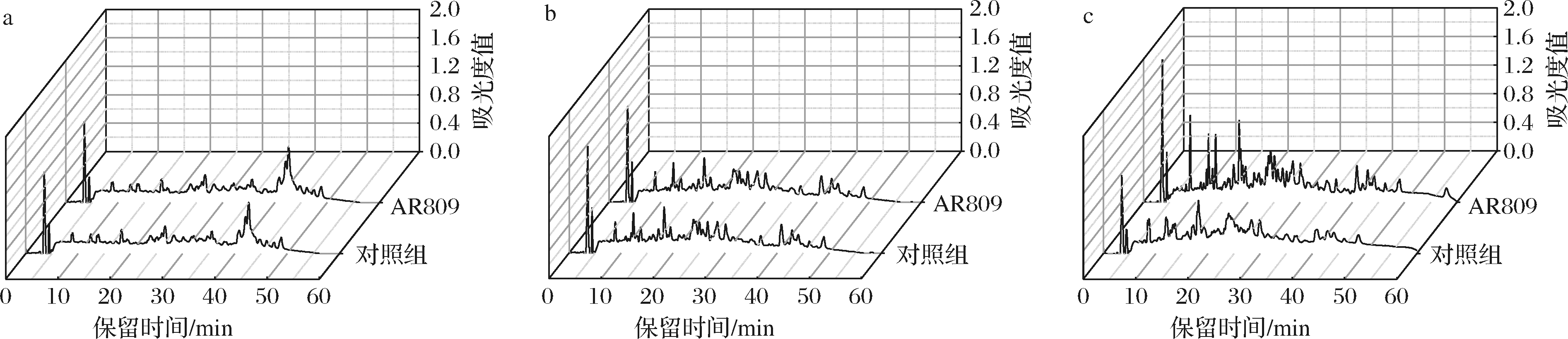
a-第0天;b-第6天;c-第12天
图6 干酪浆模型成熟0、6、12 d后水溶性组分肽的RP-HPLC
Fig.6 RP-HPLC of water-soluble fraction cheese slurry model after 0, 6 or 12 d ripening
此外,前期的研究表明,AR809可以通过激活icaR基因和抑制icaA基因的表达来抑制金黄色葡萄球菌(Staphylococcus aureus)生物膜的形成,从而有效缓解S.aureus引起的咽炎[24]。将AR809作为干酪成熟过程中的附属发酵剂,可能是将益生菌引入人体的一种实用途径。
3 结论
本研究通过对24株LAB的菌株特性进行评估,筛选出4株具有应用潜力的NSLAB菌株;然后以干酪浆为快速成熟模型,评估NSLAB在复杂的干酪环境中的促熟作用。结果表明,NSLAB的加入均可促进酪蛋白的水解,但不同菌株具有不同的水解能力,L.salivarius AR809的促进作用最为明显。这可能是由于干酪中微生物的相互作用或AR809能够更好地适应干酪环境,促使AR809释放更多与蛋白水解相关的酶,进一步促进水溶性肽等低分子物质的产生。研究结果表明,AR809 具有作为附属发酵剂应用于干酪生产的潜力。此外,益生菌强化食品对人类健康有积极影响,AR809作为1株具有缓解咽炎功能特性的益生菌,对人体健康具有积极作用。
本实验所用的干酪浆模型,其组成和质地与天然干酪相似,但具有较高的含水量和成熟温度,因此可加快体系内的生化反应,从而可以对NSLAB的作用进行快速评估。在接下来的研究中,还需进一步研究L.salivarius AR809在干酪成熟过程中的实际促熟作用,并研究AR809对干酪益生功能特性的影响。
[1] MENG Z X, ZHANG L W, XIN L, et al.Technological characterization of Lactobacillus in semihard artisanal goat cheeses from different Mediterranean areas for potential use as nonstarter lactic acid bacteria[J].Journal of Dairy Science, 2018, 101(4):2 887-2 896.
[2] G MEZ-RUIZ J
MEZ-RUIZ J  , CABEZAS L, MART
, CABEZAS L, MART NEZ-CASTRO I, et al.Influence of a defined-strain starter and Lactobacillus plantarum as adjunct culture on volatile compounds and sensory characteristics of Manchego cheese[J].European Food Research and Technology, 2008, 227(1):181-190.
NEZ-CASTRO I, et al.Influence of a defined-strain starter and Lactobacillus plantarum as adjunct culture on volatile compounds and sensory characteristics of Manchego cheese[J].European Food Research and Technology, 2008, 227(1):181-190.
[3] LEVANTE A, BANCALARI E, TAMBASSI M, et al.Phenotypic diversity of Lactobacillus casei group isolates as a selection criterion for use as secondary adjunct starters[J].Microorganisms, 2020, 8(1):128.
[4] DE MORAES G M D, DOS SANTOS K M O, DE BARCELOS S C, et al.Potentially probiotic goat cheese produced with autochthonous adjunct culture of Lactobacillus mucosae:Microbiological, physicochemical and sensory attributes[J].LWT, 2018, 94:57-63.
[5] HYNES E, OGIER J C, SON O, et al.Influence of starter and adjunct lactobacilli culture on ripening of miniature washed-curd cheeses[J].Le Lait, 2003, 83(1):17-29.
[6] NIETO-ARRIBAS P, POVEDA J M, SESE A S, et al.Technological characterization of Lactobacillus isolates from traditional Manchego cheese for potential use as adjunct starter cultures[J].Food Control, 2009, 20(12):1 092-1 098.
A S, et al.Technological characterization of Lactobacillus isolates from traditional Manchego cheese for potential use as adjunct starter cultures[J].Food Control, 2009, 20(12):1 092-1 098.
[7] SCATASSA M L, GAGLIO R, MACALUSO G, et al.Transfer, composition and technological characterization of the lactic acid bacterial populations of the wooden vats used to produce traditional stretched cheeses[J].Food Microbiology, 2015, 52:31-41.
[8] GONZ LEZ L, SACRIST
LEZ L, SACRIST N N, ARENAS R, et al.Enzymatic activity of lactic acid bacteria (with antimicrobial properties) isolated from a traditional Spanish cheese[J].Food Microbiology, 2010, 27(5):592-597.
N N, ARENAS R, et al.Enzymatic activity of lactic acid bacteria (with antimicrobial properties) isolated from a traditional Spanish cheese[J].Food Microbiology, 2010, 27(5):592-597.
[9] 孟昭旭. 山羊奶干酪中NSLAB的筛选及其促干酪成熟作用研究[D].哈尔滨:哈尔滨工业大学, 2019.
MENG Z X.Study on screening of NSLAB in goat cheese and the role of NSLAB accelerating cheese ripening[D].Harbin:Harbin Institute of Technology, 2019.
[10] FRANCIOSI E, SETTANNI L, CAVAZZA A, et al.Biodiversity and technological potential of wild lactic acid bacteria from raw cows’ milk[J].International Dairy Journal, 2009, 19(1):3-11.
[11] MAZORRA-MANZANO M A, ROBLES-PORCHAS G R, GONZ LEZ-VEL
LEZ-VEL ZQUEZ D A, et al.Cheese whey fermentation by its native microbiota:proteolysis and bioactive peptides release with ACE-inhibitory activity[J].Fermentation, 2020, 6(1):19.
ZQUEZ D A, et al.Cheese whey fermentation by its native microbiota:proteolysis and bioactive peptides release with ACE-inhibitory activity[J].Fermentation, 2020, 6(1):19.
[12] SEIXAS F N, RIOS E A, MARTINEZ DE OLIVEIRA A L, et al.Selection of Leuconostoc strains isolated from artisanal Serrano Catarinense cheese for use as adjuncts in cheese manufacture[J].Journal of the Science of Food and Agriculture, 2018, 98(10):3 899-3 906.
[13] FGUIRI I, ZIADI M, ATIGUI M, et al.Isolation and characterisation of lactic acid bacteria strains from raw camel milk for potential use in the production of fermented Tunisian dairy products[J].International Journal of Dairy Technology, 2016, 69(1):103-113.
[14] 宋兰兰, 马春丽, 屈倩, 等.改善低盐干酪苦味附属发酵剂菌株的筛选[J].食品科学, 2017, 38(18):35-41.
SONG L L, MA C L, QU Q, et al.Screening of strains of adjunct culture for improving bitterness of low-sodium cheese[J].Food Science, 2017, 38(18):35-41.
[15] 袁然, 王光强, 张汇, 等.红曲干酪的工艺及成熟特性研究[J].工业微生物, 2018, 48(2):47-58.
YUAN R, WANG G Q, ZHANG H, et al.Optimization of processing Monascus-fermented cheese and its ripening characteristics[J].Industrial Microbiology, 2018, 48(2):47-58.
[16] CASTADA H Z, PARK C, HARPER W J, et al.Suppression of propanoic acid, acetic acid and 3-methylbutanoic acid production by other volatiles in a Swiss cheese curd slurry system[J].International Dairy Journal, 2016, 54:29-32.
[17] MILESI M M, MCSWEENEY P L H, HYNES E R.Viability and contribution to proteolysis of an adjunct culture of Lactobacillus plantarum in two model cheese systems:Cheddar cheese-type and soft-cheese type[J].Journal of Applied Microbiology, 2008, 105(3):884-892.
[18] 沈兴旺, 李婉麒, 赵创谦, 等.高品质牦牛发酵乳的成熟特性[J].食品与发酵工业, 2020, 46(20):40-45;52.
SHEN X W, LI W Q, ZHAO C Q, et al.Study on maturation characteristics of high-quality yak yogurt[J].Food and Fermentation Industries, 2020, 46(20):40-45;52.
[19] YUCEER Y K, TUNCEL B, GUNESER O, et al.Characterization of aroma-active compounds, sensory properties, and proteolysis in Ezine cheese[J].Journal of Dairy Science, 2009, 92(9):4 146-4 157.
[20] 贾宏信, 龚广予.干酪乳杆菌LC2 W对切达干酪蛋白质降解的影响[J].江苏农业科学, 2013, 41(12):261-264.
JIA H X, GONG G Y.The effect of Lactobacillus casei LC2 W on protein degradation of cheddar cheese[J].Jiangsu Agricultural Sciences, 2013, 41(12):261-264.
[21] AYAD E H E, NASHAT S, EL-SADEK N, et al.Selection of wild lactic acid bacteria isolated from traditional Egyptian dairy products according to production and technological criteria[J].Food Microbiology, 2004, 21(6):715-725.
[22] MA C L, ZHANG L W, MA D X, et al.Technological characterisation of Lactobacilli isolated from Chinese artisanal fermented milks[J].International Journal of Dairy Technology, 2012, 65(1):132-139.
[23] SHARMA R, CHISTI Y, BANERJEE U C.Production, purification, characterization, and applications of lipases[J].Biotechnology Advances, 2001, 19(8):627-662.
[24] JIA G C, CHE N, XIA Y J, et al.Adhesion to pharyngeal epithelium and modulation of immune response:Lactobacillus salivarius AR809, a potential probiotic strain isolated from the human oral cavity[J].Journal of Dairy Science, 2019, 102(8):6 738-6 749.