餐厨垃圾是世界上最丰富的有机废弃物,是城市生活垃圾的主要部分。我国新鲜餐厨垃圾含水率高达70%~90%,干其含油率高达20%~30%[1],在进行资源化利用时通常需要进行预处理,主要包括破碎、过滤以及不同程度的清洗,产生大量的油脂废水。餐厨垃圾油脂废水中含动植物油和脂肪,在水体表层形成油膜阻碍O2传递[2-3]。餐厨垃圾油脂废水直接通过下水道排放会危害水体生态系统,造成严重的环境威胁[4-5]。此外,油脂也是城市污水中需要预先处理的重要污染物之一[6]。
油脂废水的主要处理方式有物理法、机械法、化学法和生物法等[7]。物理法、机械法等只能去除部分的浮油和分散油,而水体中的乳化油和溶解油的处理难度较大。化学法虽能较好地处理乳化油,但对生态环境不友好且难以降解[8]。而生物法是微生物通过分泌脂肪酶类对油脂进行生物氧化;处理工艺简单、成本低,且不会造成二次污染,是深度处理有机物的重要手段之一[9-10]。因此,寻找和筛选高效的油脂降解菌是进行餐厨垃圾油脂废水生物处理过程中的关键。本研究使用大豆油为模式底物,从不同餐厨垃圾样本中筛选出1株能在中温条件下高效降解油脂的酯香微杆菌,命名为JY34,为餐厨垃圾中油脂废水的处理提供了理论基础,并拓宽了该类菌的应用场景。
1 材料与试剂
1.1 材料与培养基
用于分离油脂降解菌的样品来源于江苏苏州多个餐厨垃圾处理点,取样后于4 ℃冷藏备用。餐厨垃圾由中国农业大学有机循环研究院食堂提供。
食用大豆油、1.6%中性红溶液、甘油三丁酸酯、对硝基苯酚、对硝基苯酚棕榈酸酯、Taq premix,生工生物工程(上海)股份有限公司;其他试剂均为国产或进口分析纯。
富集培养基(g/L):蛋白胨10.0,酵母粉5.0,NaCl 5.0,大豆油20.0,pH自然。
LB培养基(g/L):蛋白胨10,酵母粉5.0,NaCl 10.0,pH自然。
油脂中性红培养基:NaCl 5.0 g,蛋白胨10.0 g,花生油10.0 g,牛肉膏5.0 g,琼脂20.0 g, 蒸馏水定容至1 000 mL,1.6%中性红水溶液1 mL,pH 7.2。
三丁酸甘油酯培养基(g/L):特殊蛋白胨5.0,酵母提取物3.0,琼脂20.0,甘油三丁酸酯10.0,pH自然。
大豆油无机盐培养基(g/L):(NH4)2SO4 5.0,K2HPO4 2.0,MgSO4·7H2O 0.5,NaCl 2.0,NaH2PO4 2.0,大豆油 10.0,pH自然。
脂肪种子培养基(g/L):葡萄糖20.0,蛋白胨20.0,(NH4)2SO45.0,K2HPO4 1.0,MgSO4·7H2O 0.5,大豆油10.0,pH自然。
脂肪酶发酵培养基(g/L):蛋白胨20.0,葡萄糖5.0,(NH4)2SO4 1.0,K2HPO4 1.0,MgSO4·7H2O 0.5,大豆油10.0,pH自然。
各培养基均121 ℃灭菌20 min。
1.2 仪器与设备
5418 R冷冻离心机,艾本德(上海)国际贸易有限公司;XSP-BM-8CAP显微镜,上海彼爱姆光学仪器制造有限公司;NanoDrop-2000核酸检测仪、Bio-Rad PCR仪,赛默飞世尔科技公司;TU-1810紫外可见分光光度计,北京普析通用仪器有限责任公司;BioTek多功能微孔板检测仪,北京伯腾仪器有限公司提供。
1.3 油脂降解菌的筛选
1.3.1 菌种的驯化与分离
称取10 g冷藏样品与300 mL富集培养基混合均匀,在30 ℃、200 r/min条件下振荡培养7 d,在第4天补充1%(体积分数,下同)大豆油加以驯化。第1次培养结束后,静置后取上层液体10 mL加入到新的富集培养基中,在30 ℃、200 r/min条件下继续培养7 d,并于第4天补充2%大豆油。每周依次按1%梯度补加大豆油,驯化1个月后进行分离。将最后转接的培养液稀释涂布在LB固体平板上,于30 ℃生化培养箱培养2 d。在相同条件下,选取生长速度快、菌落形态差异显著的单菌落进行编号。
1.3.2 初筛
单菌落转接于油脂中性红培养基平板上,置于30 ℃培养箱培养3 d,每天定时观察菌落颜色变化。挑选变红的菌株制成菌液滴加5 μL于三丁酸甘油酯固体平板上,于30 ℃生化培养箱培养3 d。选择同一培养条件下生长速度快,透明圈较大的菌株为初步筛选的油脂降解菌,并转接至斜面保存备用。
1.3.3 复筛
从斜面挑取初筛的解油菌分别接种于5 mL LB液体培养基试管中于30 ℃、180 r/min摇床培养14~16 h,获得种子液,通过血球计数板计数调整菌液浓度至1×107 CFU/mL。菌液按2%(体积分数,下同)的接种量接种至50 mL培养基中,于30 ℃、180 r/min摇床发酵3 d后测定油脂降解率。
1.3.4 油脂降解率的测定
大豆油标准曲线的测定:精确称取10.0 g大豆油,溶于100 mL容量瓶中,用石油醚定容至标线,制备成含100 mg/mL大豆油标准溶液母液。随后分别吸取母液配制成0、0.4、0.8、1.2、1.6、2.0、2.4、3.2、4 mg/mL大豆油标准溶液。采用紫外分光光度法[11]在225 nm波长下,以石油醚作为空白溶液,分别测量上述系列质量浓度的大豆油标准溶液的吸光值来绘制标准曲线。发酵液油脂通过石油醚萃取,充分摇匀后静置30 min,取上层液体适当稀释后测定吸光值,根据标准曲线计算剩余油脂的浓度,根据公式(1)计算油脂降解率:
油脂降解率![]()
(1)
1.4 油脂降解菌的鉴定
1.4.1 菌落和细胞形态观察
取斜面保藏菌种在LB平板上划线,于30 ℃生化培养箱培养3 d,观察菌落形态变化,显微镜观察菌体形态。
1.4.2 目的菌株16S rDNA的基因测序分析
挑取单菌落进行菌落PCR。扩增体系(50 μL):DNA模板2 μL,引物27F 0.6 μL,1492R 0.6 μL,PCR Premix 25 μL,ddH2O补足至50 μL。反应程序:预变性95 ℃ 5 min,变性94 ℃ 1 min,退火54 ℃ 1 min,延伸72 ℃ 1.5 min,35个循环,72 ℃ 5 min,4 ℃保存。PCR产物纯化后由上海生工生物工程有限公司进行测序,将所得序列在GenBank用BLAST进行检索比对,筛选出与该序列相似性较高的16S rDNA序列,用MEGA 7.0构建系统发育树,寻找与其同源性最近的菌种。
1.5 油脂降解条件的研究
将活化后的菌株JY34接入50 mL LB培养基中,于30 ℃、180 r/min摇床中培养14~16 h。获得种子液后,将菌浓度调节至1×107 CFU/ mL备用。
温度考察:设置培养温度为20、30、40、50、60 ℃,按照2%的接种量分别接种1 mL菌液于含1.5%大豆油的50 mL无机盐培养基中(pH 7.0),180 r/min发酵3 d后测定不同温度条件下的油脂降解率。pH考察:设置pH为5.0、6.0、7.0、8.0、9.0,在相同条件下进行发酵后测定不同pH条件下的油脂降解率。接种量考察:设置接种量分别为1.0%、1.5%、2.0%、2.5%、3.0%,测定不同接种量条件下的油脂降解率。底物浓度考察:设置大豆油添加量为1.0%、1.5%、2.0%、2.5%、3.0%,测定不同含油量条件下的油脂降解率。
1.6 油脂降解菌脂肪酶发酵测定
1.6.1 酶活力定义及标准曲线的测定
在30 ℃,pH 7.0条件下,样品水解对硝基苯酚棕榈酸酯(p-nitrophenyl palmitate,p-NPP),每分钟释放出1 μmol对硝基苯酚(p-nitrophenol,p-NP)所需的酶量为1个酶活力单位(U)。反应体系及计算公式参照梁秋艳[12]的方法。
1.6.2 发酵粗酶液脂肪酶活力测定
将种子液按2%的接种量接种至装有50 mL脂肪酶发酵培养基中,于30 ℃、180 r/min摇床培养48 h后收集发酵液。经8 000 r/min离心10 min后取上清液5 mL于离心管中,立即置于冰上待测。根据公式(2)计算实测吸光度值:
ΔA=A-A0
(2)
式中:A,样品吸光度值;A0,空白对照组吸光度值。
1.7 油脂降解菌在油脂废水中的发酵测定
称取餐厨垃圾湿重2 kg,用2 L水分4次进行反复冲洗,获得餐厨垃圾油脂废水。将油脂废水均匀取样100 mL于三角瓶中,设置空白对照组和处理组,每个处理组重复3次。对照组不加菌,处理组接入JY34菌液4 mL,于30 ℃、180 r/min培养6 d后测定0、3、6 d的油脂降解率。
1.8 数据分析
每组处理设3个平行,采用Excel 2019对数据进行统计和分析,采用Origin 2021和MEGA 7.0进行绘图。
2 结果与分析
2.1 油脂降解菌的筛选
2.1.1 油脂降解菌初筛
在油脂中性红固体平板上培养3 d后菌落明显变红的菌株共10株,表明这10株菌具有油脂降解功能,依次编号为1~10。随后将这10株菌再经过三丁酸甘油酯平板验证后,结果表明生长较好且水解圈较大的有5株菌,分别是编号为2、5、6、7、9的菌株(表1)。
表1 十株解油菌在三丁酸甘油酯平板上的水解及生长能力
Table 1 Hydrolysis and growth ability of ten oil-degrading bacteria on glycerol tributyrate plate
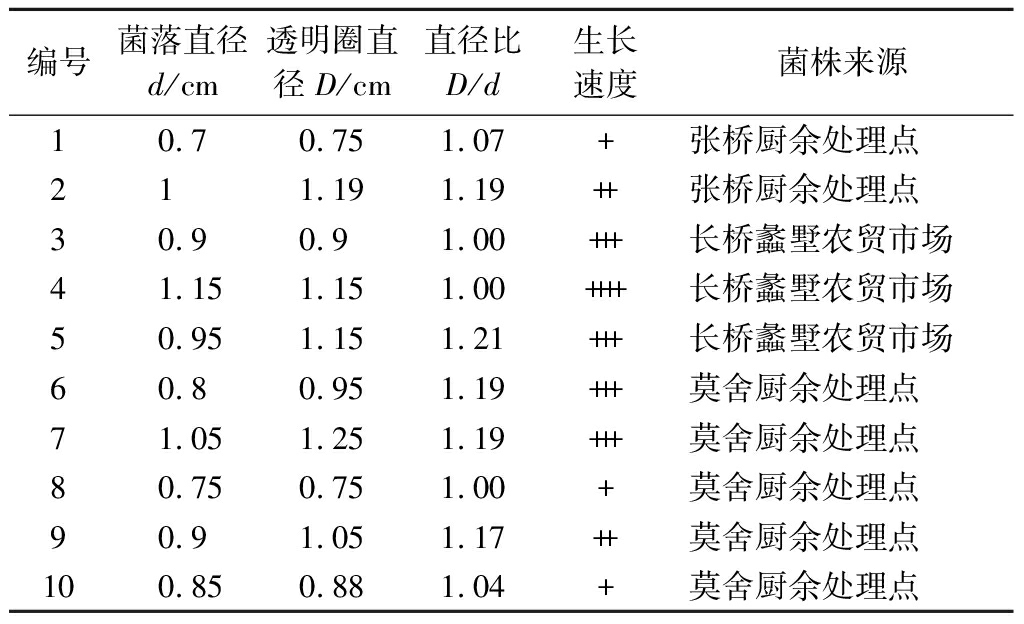
编号菌落直径d/cm透明圈直径D/cm直径比D/d生长速度菌株来源10.70.751.07+张桥厨余处理点211.191.19++张桥厨余处理点30.90.91.00+++长桥蠡墅农贸市场41.151.151.00++++长桥蠡墅农贸市场50.951.151.21+++长桥蠡墅农贸市场60.80.951.19+++莫舍厨余处理点71.051.251.19+++莫舍厨余处理点80.750.751.00+莫舍厨余处理点90.91.051.17++莫舍厨余处理点100.850.881.04+莫舍厨余处理点
注:+表示该菌在30 ℃培养下生长速度极慢;++表示生长速度慢;+++表示生长速度一般;++++表示生长速度较快
2.1.2 大豆油标准曲线的绘制
通过测定得到大豆油溶液的标准曲线为y=2.193 2x-0.500 6,相关系数R2=0.997 9,表明0~4.0 mg/mL范围内油脂质量浓度与OD225呈良好的线性相关性,利用该方法可以准确地测定油脂质量浓度。
2.1.3 油脂降解菌复筛
对初筛的5株菌进行了大豆油无机盐培养基发酵,结果表明编号为5、6、7的菌株OD600达到1.3以上,油脂降解率达到了60%以上;其中7号菌株油脂降解效果最好,降解率为92.6%(图1),命名为JY34。该菌分离于餐厨垃圾处理点的油污样品中,表明菌株JY34对油脂有较好的环境适应性。
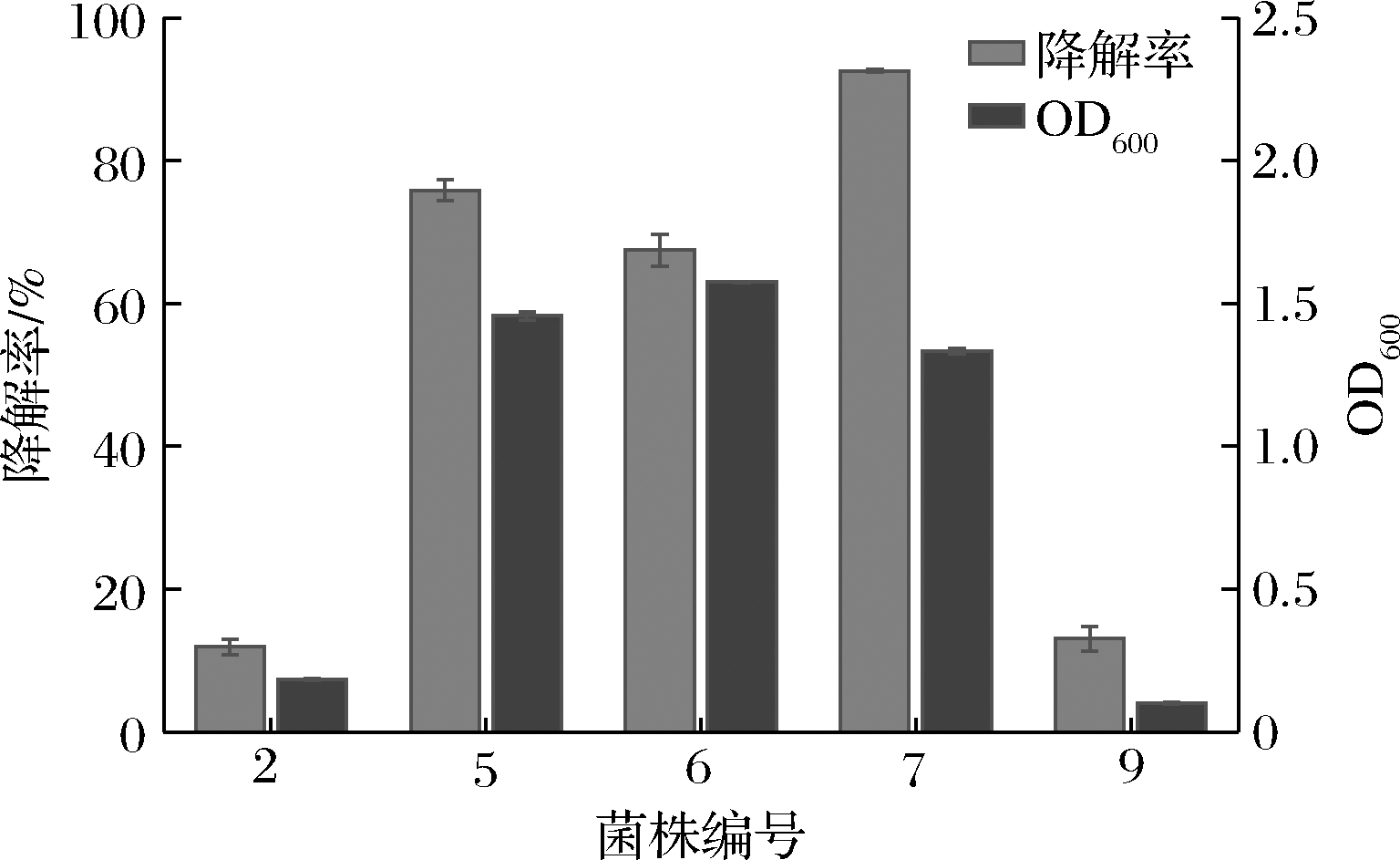
图1 五株初筛菌的油脂降解率及OD600值
Fig.1 Lipid degradation rate and growth OD600 of five bacterial strains obtained by preliminary screening
2.2 菌种鉴定
2.2.1 菌落与细胞形态
JY34的菌落呈圆形、边缘平整、中心凸起,表面湿润、光滑,前期为白色,2 d后逐渐变黄,最后呈亮黄色、不透明,黏湿、易挑起;通过结晶紫简单染色后在100×光学显微镜下呈短杆状细胞(图2)。

a-菌落形态 b-细胞形态
图2 解油菌JY34的菌落及细胞形态
Fig.2 Colony and cell morphology of lipid-degrading bacteria JY34
2.2.2 16S rDNA序列鉴定
将菌株的16S rDNA的扩增产物经琼脂糖凝胶电泳后获得单一DNA条带,分子质量在1 400~2 000 bp,如图3-a所示。PCR产物经测序后得出该16S rDNA的长度为1 429 bp。将该序列上传至GenBank后用BLAST进行检索比对,筛选出相似性较高的16S rDNA序列后用MEGA 7.0进行多重序列比对并构建系统发育树。序列的系统发生分析选择Neighbor-Joining法,可靠性检验采用Bootstrap法进行1 000次重复。结果表明,与目标菌株进化关系最近的菌种为酯香微杆菌(Microbacterium esteraromaticum),两者一致性高达98.73%。

a-16S rDNA扩增产物凝胶电泳图;b-系统发育树
图3 解油菌JY34的16S rDNA的PCR扩增产物 电泳及系统发育树
Fig.3 16S rDNA gel electrophoretic map and phylogenetic tree of lipid-degrading bacteria JY34
2.3 不同发酵条件对菌株JY34油脂降解率的影响
2.3.1 发酵温度对油脂降解率的影响
由图4可知,在20~30 ℃时,随温度升高油脂降解率从48.39%提高至68.92%;在30~60 ℃,随温度的升高油脂降解率大幅降低,从68.92%降至1.97%。这是因为菌株JY34是中温细菌,其生长的最适温度在30 ℃左右且不耐高温,所以在40 ℃时其解油能力相较于在30 ℃时降低了40.82%。当温度升至50~60 ℃时,菌株细胞膜上的蛋白质不耐高温而逐渐失活,几乎难以存活,故解油能力差。非寒冷季节,餐厨垃圾油脂废水水温约为20~30 ℃,而菌株JY34在20 ℃时油脂降解率能达到48.39%,说明该菌株在常温条件下的适应能力较好。

图4 菌株JY34在不同温度条件下的油脂降解率
Fig.4 Lipid degradation rate of strain JY34 under different temperatures
2.3.2 pH对油脂降解率的影响
为考察菌株JY34对油脂废水pH的适应能力,研究了不同pH条件下JY34的油脂降解能力。图5表明,pH从5.0升高至7.0时,油脂降解率从17.58%提高至58.53%;当pH从7.0升高至9.0时,油脂降解率从58.53%降至36.68%。这说明菌株JY34在近中性及中性条件时代谢活性高,解油能力较强。
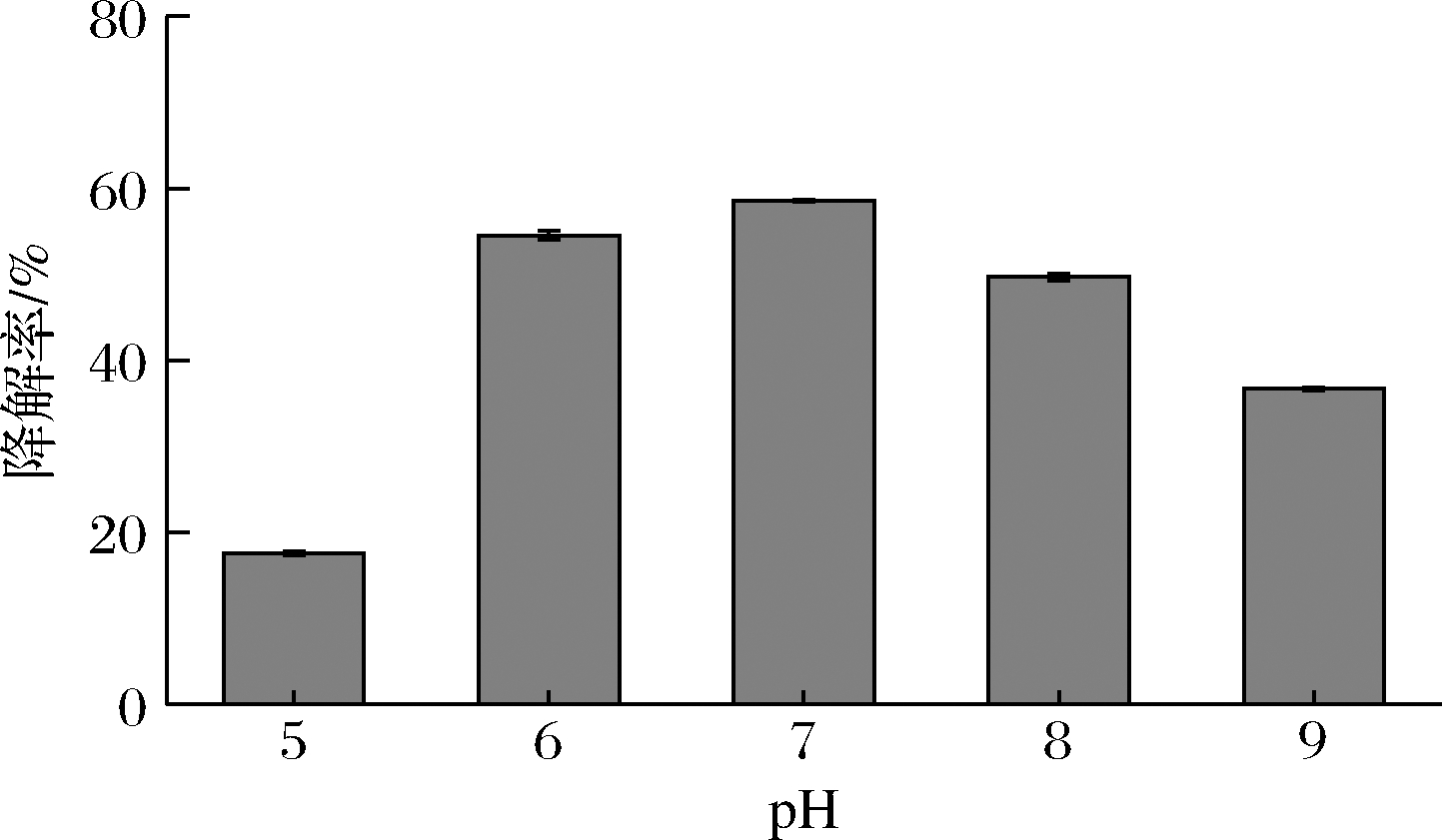
图5 菌株JY34在不同pH条件下的油脂降解率
Fig.5 Lipid degradation rate of strain JY34 under different pH conditions
餐厨垃圾过滤、清洗后制造的油脂废水的pH值在6.0~7.0,而一般的解油细菌通常在碱性条件下才能较好地发挥解油功能[13],故对于餐厨垃圾油脂废水处理适用性不强。而菌株JY34在pH 6.0~7.0左右时降解率高达50%~73.76%,故该菌株能够较好地降解餐厨垃圾处理废水中的油脂。此外,在pH 5.0时,降解率达到17.58%,在pH 8.0~9.0时,降解率达36.68%~49.70%,说明该菌株耐碱能力较强,也能较好地用于碱性油脂废水的处理。
2.3.3 接种量对油脂降解率的影响
接种量大小是影响菌种发酵密度的关键因素,接种量太大容易使菌体密度过高,导致发酵供氧不足,影响细胞生长,进而导致解油能力下降;接种量太小,培养时间延长,短时间内产酶量下降,油脂降解率大幅降低。为了考察菌株JY34用于油脂废水处理中合适的接种量,研究了以不同接种量接入大豆油无机盐发酵培养基对油脂降解率的影响。图6表明,菌株JY34接种量从1.0%提高至2.0%时,油脂降解率从3.73%提高到了67.59%;当接种量从2.0%提高至3.0%时,油脂降解率均降低。这说明,当接种量<2.0%时,菌体细胞数太少,不足以克服含油环境,降解效果差。相较于1.0%和1.5%的接种量,接入2.0%处理油脂降解率分别提高了63.86%、53.55%。当接种量>2.0%时,油脂降解率减小,说明接入菌体过多,影响了细胞对O2的摄取,导致细胞代谢活性差。而接种量为2.5%和3.0%的处理相较于1.0%和1.5%的处理,其油脂降解率均大幅提高,这表明接种量不宜低于2%,以避免菌株JY34难以达到适宜的细胞密度来发挥解油能力。
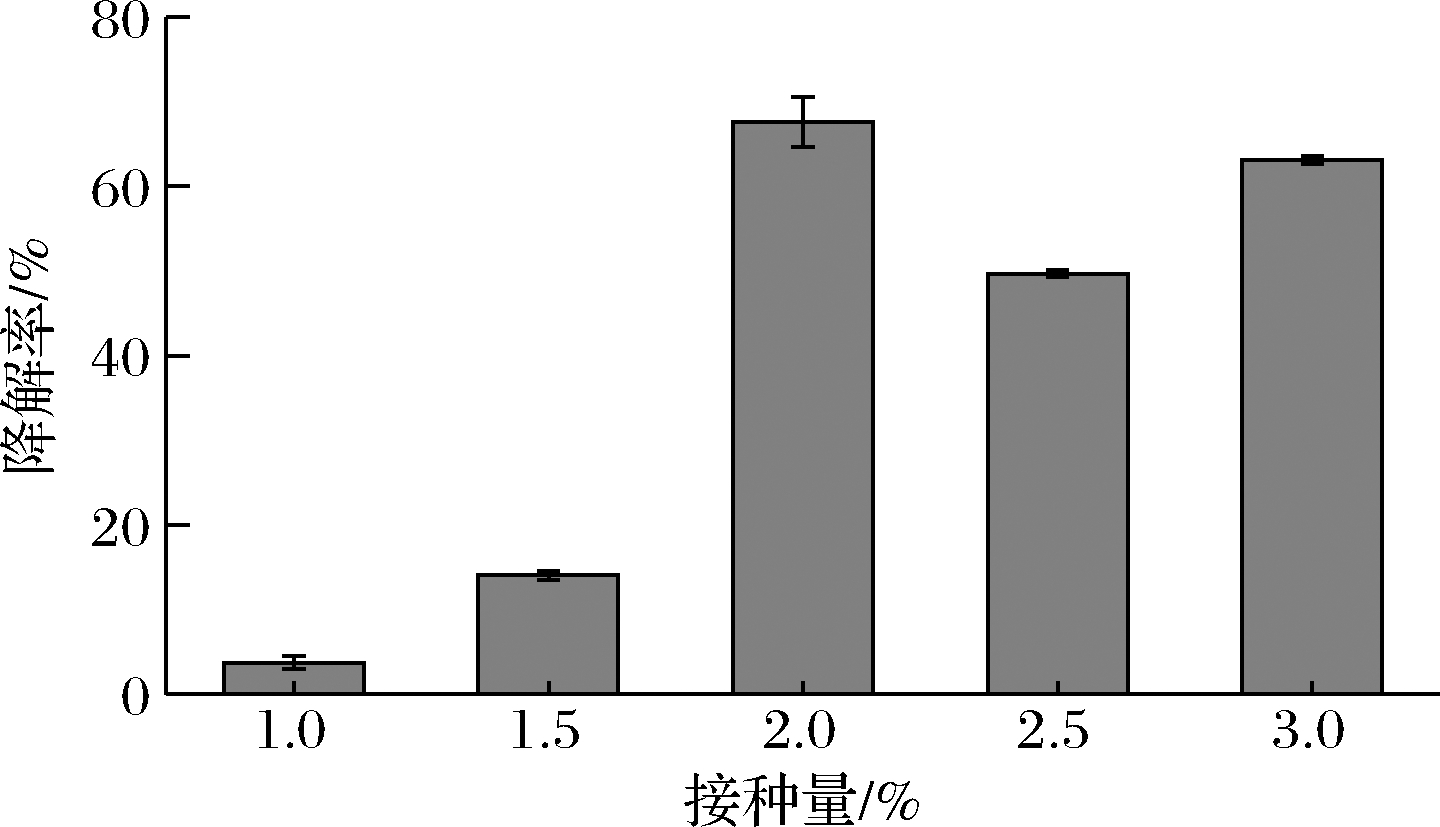
图6 菌株JY34在不同接种量条件下的油脂降解率
Fig.6 Lipid degradation rate of strain JY34 under different inoculation conditions
2.3.4 含油量对油脂降解率的影响
含油量大小是影响菌株发酵降解油脂的重要因素,油脂含量过大,会降低溶氧量,导致菌体细胞摄氧不足;油脂含量较小时,有利于油脂被降解完全。为了考察菌株JY34在不同油脂含量废水处理中的降解能力,研究了不同含油量的大豆油无机盐发酵培养基对油脂降解率的影响。图7表明,菌株JY34能够较好地处理油脂含量为1%~1.5%的油脂废水。当油脂添加量从1.0%提高至3.0%时,油脂降解率从98.78%不断降低至21.44%;这是因为随着含油量的增加,溶氧量越来越少,阻碍细胞代谢,不能正常分泌脂肪酶,导致解油能力弱。在实际应用中,餐厨垃圾的脱油、脱盐都将使用大量水,降低了油脂的相对浓度,故菌株JY34在餐厨垃圾油脂废水中的降解能力会相对增强。此外,菌株JY34还可以应用于餐厨垃圾好氧堆肥过程中。在餐厨堆肥中接入具有油脂降解能力的微生物菌种,能促进堆肥过程中有机物质的降解[14];并且堆肥初期堆体温度通常较低、pH值近中性,非常适合菌株JY34生长代谢[15]。

图7 菌株JY34在不同含油量条件下的油脂降解率
Fig.7 Lipid degradation rate of strain JY34 under different oil content
2.4 菌株JY34产脂肪酶发酵结果
2.4.1 脂肪酶酶活力标准曲线绘制
通过测定得到脂肪酶活力标准曲线为y=132.86x-8.537 3,相关系数R2=0.995 6,表明p-NP标准溶液与吸光度呈良好的线性相关性,利用该方法可以准确地测定脂肪酶酶活力。
2.4.2 脂肪酶酶活力大小
如图8所示,菌株JY34发酵后的粗酶液在30、37、50 ℃下的酶活力分别为67.4、104.1、159.5 U/L,其中温发酵后粗酶液的酶活力较低。
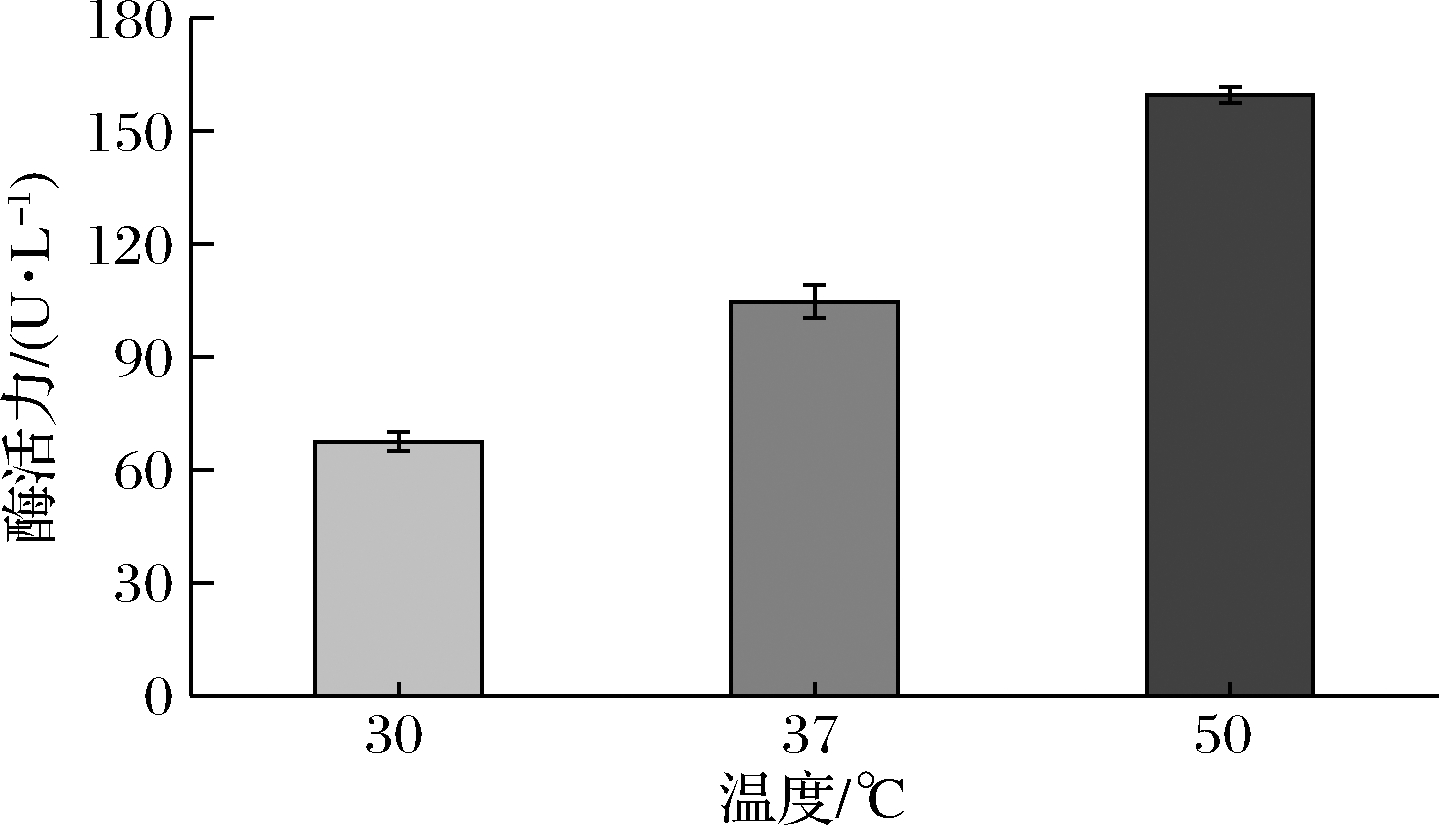
图8 菌株JY34在不同温度条件下的酶活力
Fig.8 Enzyme activity of strain JY34 at different temperature
天然分离的野生菌种的脂肪酶活力经优化后相对较高,刘小玉等[16]分离的蜡状芽孢杆菌的酶活力为3.35 U/mL,辛国芹[17]分离的解脂耶氏酵母的酶活力为4.8 U/mL,程爽等[18]分离的沙雷氏菌的酶活力为2.39 U/mL。此外,结果显示JY34菌株的脂肪酶耐受温度较广;在30~50 ℃时,随温度的提高,脂肪酶活力不断增加(图8)。这表明菌株JY34虽是中温菌,却能产耐高温脂肪酶,且酶活力在高温时更大。利用这一点,可以达到中低温发酵,高温有效降解的效果。
2.5 菌株JY34在餐厨垃圾油脂废水中的处理效果
餐厨垃圾油脂废水的初始油脂含量为5.07%,pH值为6.55,电导率为2.33 mS/cm;将菌株JY34接入后发酵处理6 d,空白对照组在3 d、6 d的降解率分别为11.6%和44.62%,而处理组为47.49%和72.92%,分别是对照组的4.1倍和1.63倍(图9),差异显著(P<0.05)。但是,发酵6 d后油脂降解率才达到70%以上,说明菌株活性不够高。这可能是因为餐厨垃圾在过滤、清洗时用水较少,造成油脂浓度较高及废水中含盐量较高。过高的油浓度不利于细胞充分摄入O2,而过高的含盐量会使微生物细胞由于外界渗透压过高导致细胞脱水死亡。因此,将耐盐能力纳入筛选指标是必要的。

图9 菌株JY34在餐厨油脂废水中的油脂降解率
Fig.9 Lipids degradation rate of strain JY34 in food wastewater containing lipids
3 结论与讨论
将不同来源的样品进行初筛和复筛后得到1株高效油脂降解菌JY34,经16S rDNA测序鉴定为Microbacterium esteraromaticum。对菌株JY34油脂降解能力的考察结果表明,菌株JY34在30 ℃、pH 7.0,接种量2%,油脂含量1%时,油脂降解率高达98.78%。该菌为中温菌,能在20~30 ℃下高效降解油脂废水。其脂肪酶粗酶液在30、37、50 ℃反应条件下的酶活力分别达到67.4、104.1、159.5 U/L,在高温反应时具有较大酶活力。
在餐厨垃圾油脂废水的实际处理中,接入菌株JY34的处理在3 d、6 d的油脂降解率分别为47.49%和72.92%,是对照组的4.1倍和1.63倍;说明菌株JY34在餐厨垃圾油脂废水中适应性较好,解油能力较强。但发酵6 d后的油脂降解率才达到72.92%,说明菌株的生长代谢能力受到了一定抑制,可能是油脂废水中的高浓度盐离子和油脂等引起的。因而,在这类降解菌的筛选中,应该将耐盐能力纳入筛选范围,并进一步提高油脂浓度加以驯化,以获得高耐受性菌株。
[1] 任连海, 王攀, 贺艳坤.含油量对餐厨垃圾好氧堆肥的影响[J].建设科技, 2013(8):50-53.
REN L H, WANG P, HE Y K.Effect of oil content on aerobic composting of kitchen waste[J].Construction Science and Technology, 2013(8):50-53.
[2] GAO L L, LU Y C, ZHANG J L, et al.Biotreatment of restaurant wastewater with an oily high concentration by newly isolated bacteria from oily sludge[J].World Journal of Microbiology & Biotechnology, 2019, 35(11):179.
[3] WITHARANA A, MANATUNGE J, RATNAYAKE N, et al.Rapid degradation of FOG discharged from food industry wastewater by lipolytic fungi as a bioaugmentation application[J].Environmental Technology, 2018, 39(16):2 062-2 072.
[4] SUGIMORI D.Edible oil-degradation by using yeast coculture of Rhodotorula pacifica ST3411 and Cryptococcus laurentii ST3412[J].Applied Microbiology and Biotechnology, 2009, 82(2):351-357.
[5] 卢永昌, 张继龙, 张建栋, 等.餐饮高浓度含油废水降解菌筛选及降解特性研究[J].工业水处理, 2019, 39(12):64-68;100.
LU Y C, ZHANG J L, ZHANG J D, et al.Bacterial screening for degradation of high concentration oily wastewater in catering industry and its degradation characteristics[J].Industrial Water Treatment, 2019, 39(12):64-68;100.
[6] REN J, FAN B, HUHETAOLI, et al.Biodegradation of waste cooking oils by Klebsiella quasivariicola IUMR-B53 and characteristics of its oil-degrading enzyme[J].Waste and Biomass Valorization, 2021, 12(3):1 243-1 252.
[7] 徐昆鹏. 含油废水处理方法的研究现状及展望[J].化工管理, 2021(24):21-22.
XU K P.Research status and prospect of oily wastewater treatment methods[J].Chemical Enterprise Management, 2021(24):21-22.
[8] 王长青, 张西华, 宁朋歌,等.含油废水处理工艺研究进展及展望[J].化工进展, 2021, 40(1):451-462.
WANG C Q, ZHANG X H, NING P G, et al.Research advances and perspective on treatment processes for oily wastewater[J].Chemical Industry and Engineering Progress, 2021, 40(1):451-462.
[9] GAUR N, NARASIMHULU K, Y P.Recent advances in the bio-remediation of persistent organic pollutants and its effect on environment[J].Journal of Cleaner Production, 2018, 198:1 602-1 631.
[10] BECKER P, KÖSTER D, POPOV M N, et al.The biodegradation of olive oil and the treatment of lipid-rich wool scouring wastewater under aerobic thermophilic conditions[J].Water Research, 1999, 33(3):653-660.
[11] 沈叔平, 汪小梅.废水中动植物油脂的紫外分光光度测定法[J].中国环境监测, 1994, 10(3):4-7.
SHEN S P, WANG X M.Determination of animal and vegetable fats and oils in wastewater by ultraviolet spectrophotometry[J].Environmental Monitoring in China, 1994, 10(3):4-7.
[12] 梁秋艳. 低温脂肪酶产生菌株的筛选、发酵条件优化及其酶学性质研究[D].石河子:石河子大学, 2014.
LIANG Q Y.Study on the screening, optimization of its fermentation conditions and enzymatic properties of a cold-adapted lipase-producing strain[D].Shihezi:Shihezi University, 2014.
[13] 王森, 张卡, 王泳浩, 等.一株油脂降解菌的筛选鉴定及降解效果分析[J].生物技术进展, 2021, 11(1):99-104.
WANG S, ZHANG K, WANG Y H, et al.Screening and identification of an oil degrading bacterium and analysis of its explanation effect[J].Current Biotechnology, 2021, 11(1):99-104.
[14] LEMUS G R, LAU A K.Biodegradation of lipidic compounds in synthetic food wastes during composting[J].Canadian Biosystems Engineering, 2002, 44(6):33-39.
[15] ONWOSI C O, IGBOKWE V C, ODIMBA J N, et al.Composting technology in waste stabilization:On the methods, challenges and future prospects[J].Journal of Environmental Management, 2017, 190:140-157.
[16] 刘小玉, 付登强.产脂肪酶蜡状芽孢杆菌菌株分离和鉴定[J].中国热带农业, 2021(6):68-73.
LIU X Y, FU D Q.Isolation and identification of a lipase producing strain of Bacillus cereus[J].China Tropical Agriculture, 2021(6):68-73.
[17] 辛国芹. 一株产脂肪酶菌株的分离筛选及鉴定[J].广东饲料, 2021, 30(8):27-29.
XIN G Q.Isolation, screening and identification of a lipase-producing strain[J].Guangdong Feed, 2021, 30(8):27-29.
[18] 程爽, 包朋鑫, 徐玉晨, 等.一株脂肪酶产生菌的筛选鉴定及其发酵条件优化[J].中国食品添加剂, 2021, 32(11):73-80.
CHENG S, BAO P X, XU Y C, et al.Isolation, identification of a lipase-producing bacterium and its optimized fermentation conditions[J].China Food Additives, 2021, 32(11):73-80.