大豆蛋白(soy protein isolate, SPI)具有较高营养价值,同时又具有良好的乳化性、起泡性和凝胶性等加工特性,价廉物美,在食品工业中被广泛应用。然而,SPI由于分子质量相对较大、且分子内疏水基团较多等固有结构特性,使得各类性质与动物源蛋白相比,依然有很多差距。因此,提升SPI的凝胶性等特性,始终是研究热点。
目前,基于超高温瞬时热处理、pH偏移[1]、钙促预凝胶[2]、轻度酶解[3]等的各种方法,均能使SPI凝胶性得到不同程度的提升。近年来,基于蛋白-蛋白相互作用提高蛋白凝胶性质的方法引起了许多学者的重视。WONG等[4]用豌豆蛋白和乳清蛋白在盐溶液中以2∶8的比例混合制备了热诱导凝胶,混合凝胶在储能模量和凝胶强度均高于纯SPI或纯乳清蛋白凝胶;NGUYEN等[5]发现在乳清蛋白中添加一定比例的酪蛋白酸钙能诱导形成大聚集体并降低形成凝胶所需的最小乳清蛋白浓度。SPI与其他蛋白间相互作用也一直是研究的热点。高雪丽[6]发现,小麦蛋白与大豆7S亚基、11S亚基相互作用,可以提升小麦-SPI面团的持水性,有利于减缓面制品老化。ZHANG等[7]发现在SPI钙诱导凝胶中加入乳清蛋白后能改善凝胶的机械性能,SPI与乳清蛋白的疏水相互作用导致凝胶弹性的增加。综上,基于亲水性不同、二硫键含量不同的蛋白的相互作用,可能是提升蛋白溶解性、凝胶性等性质的有效途径。
目前SPI与植物蛋白相互作用的研究主要集中在小麦蛋白这种溶解度较差的蛋白,SPI与亲水性好的植物蛋白间相互作用的研究还未见报道。油茶籽蛋白(camellia seed protein isolate, CPI)[8]是一种分子质量低、亲水性好、溶解度高的新型植物蛋白,目前对CPI的研究主要集中在其抗氧化活性,对其功能性质的研究较少。李慧珍[8]采用分步提取法分离出CPI,油茶籽粕蛋白分子质量小,约为14 kDa,通过比较发现其溶解度、乳化性和乳化稳定性均高于大豆分离蛋白。CPI具有与SPI不同的亲疏水性和相对分子质量,可能与SPI发生相互作用,对SPI热诱导凝胶产生促进效果。
因此,本文主要研究不同比例SPI-CPI混合对凝胶性质影响,同时以纯SPI、CPI作为对照,探究不同亲疏水性蛋白间的相互作用及其对蛋白凝胶性质的影响,为植物蛋白间相互作用的研究提供实验依据和理论基础。
1 材料与方法
1.1 材料与仪器
大豆,哈尔滨市弘扬农业开发有限公司;油茶籽,江西赣州市上犹县丰哥土特产商行;正己烷、无水乙醇、NaOH、盐酸、硫酸、(NH4)2S2O8、甘氨酸、十二烷基硫酸钠(sodium dodecyl sulfate, SDS)、三羟甲基氨基甲烷,牛血清白蛋白(bovine serum albumin, BSA)、二硫代二硝基苯甲酸(dithionitrobenzoic acid, DNTB)、三氯乙酸(trichloroacetic acid, TCA)、8-苯胺-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid, ANS)等,国药集团化学试剂有限公司;丙烯酰胺、β-巯基乙醇、SDS-PAGE标准蛋白,美国Bio-Rad公司;其他试剂均为分析纯,上海国药集团化学试剂有限公司。
Agilent 1100高效液相色谱(配G1314A VWD检测器),美国安捷伦公司;F-2700荧光分光光度计,日本日立公司;SpectraMax 190酶标仪,美国分子仪器公司;Nano-ZS激光粒度分析仪,英国马尔文仪器有限公司;Mini-Protein Tetra Cell电泳仪、Gel DocTM EZ Imager凝胶成像系统,美国Bio-Rad公司;GL-10MD高速冷冻离心机,湖南湘仪仪器有限公司;LGJ-25C冷冻干燥机,北京四环启航科技有限公司;SevenEasy pH计、电子分析天平,梅特勒-托利多仪器有限公司。
1.2 实验方法
1.2.1 植物蛋白的提取
1.2.1.1 SPI的制备
大豆经破碎得到豆粉,采用料液比为1∶3(g∶mL)的V(正己烷)∶V(无水乙醇)=9∶1混合液脱脂,抽滤得到的脱脂粉于通风橱中过夜风干。根据JIANG等[9]的方法提取蛋白,将脱脂粉与去离子水按1∶10(g∶mL)的料液比混合,用2 mol/L NaOH溶液调节pH值至8.0,室温下搅拌2 h后10 000×g离心20 min,取上清液用2 mol/L HCl溶液调节pH值至4.5,静置30 min后6 500×g离心10 min,取蛋白沉淀重新溶于去离子水中,2 mol/L NaOH溶液调节pH至中性,4 ℃下搅拌2 h,冷冻干燥得到大豆分离蛋白,-80 ℃保存。测得SPI质量分数为93.53%。
1.2.1.2 CPI的制备
油茶籽仁破碎得到油茶籽粉,采用料液比为1∶3(g∶mL)的V(正己烷)∶V(无水乙醇)=9∶1混合溶液脱脂,抽滤得到的脱脂粉于通风橱中过夜风干。脱脂粉与70%乙醇溶液按1∶10(g∶mL)的料液比搅拌1 h,除去茶皂素,抽滤得到的油茶籽粉于通风橱中过夜风干。根据JIANG等[9]的方法,操作同SPI的制备,测其蛋白质质量分数为74.35%。
1.2.2 蛋白质理化性质的测定
1.2.2.1 氨基酸组成的测定
根据YU等[10]的方法测定SPI和CPI的总氨基酸组成,其中色氨酸用碱水解样品测定,其余17种氨基酸用酸水解样品测定。酸水解过程:称取一定质量蛋白,加8 mL 6 mol/L HCl溶液,充N2 3 min,120 ℃水解22 h。水解后加4.8 mL 10 mol/L NaOH溶液,蒸馏水定容至25 mL。定容后样品用双层滤纸过滤,过滤后15 000×g离心30 min。取上清液待测。碱水解过程:称取一定质量蛋白,加8 mL 5 mol/L NaOH溶液,充N2 3 min,120 ℃水解22 h。水解后加6.7 mL 6 mol/L HCl溶液,蒸馏水定容至25 mL。定容后样品用双层滤纸过滤,过滤后15 000×g离心30 min。取上清液待测。
采用HPLC法测定氨基酸含量。色谱柱为Agilent Hypersil ODS柱(250 mm×4.0 mm,5 μm),柱温40 ℃,流速1.0 mL/min,进样量10 μL。流动相:V(27.6 mmol/L醋酸钠)∶V(三乙胺)∶V(四氢呋喃)=500∶0.11∶2.5(A)和V(80.9 mmol/L醋酸钠)∶V(甲醇)∶V(乙腈)=1∶2∶2(B)。洗脱梯度:0 min,92% A,8% B;17 min,50% A,50% B;20.1 min,0% A,100% B;24 min,100% A,0% B。脯氨酸在262 nm波长下检测,其余氨基酸检测波长为338 nm。
1.2.2.2 SPI与CPI复配溶液的制备
将SPI与CPI按照一定的比例混合分散于去离子水中配制成质量浓度为120 g/L的溶液,室温搅拌2 h备用。SPI与CPI的混合比例分别是10∶0、0∶10、10∶1、10∶2、10∶3和10∶4,分别记为SPI、CPI、SC10∶:1、SC10∶2、SC10∶3、SC10∶4。
1.2.2.3 流变性质的测定
采用HAKAA MARS Ⅲ旋转流变仪测定蛋白溶液的流变性质。使用直径35 mm的平板探头,平板间距1.0 mm,吸取1 mL蛋白样品进行温度扫描。温度扫描的参数是:应变1%(线性范围内),频率1 Hz,以2 ℃/min的升温速率从25 ℃升温至95 ℃,保温10 min,从2 ℃/min的降温速率从95 ℃降温至25 ℃,记录弹性模量和黏性模量随温度和时间的变化。在样品边缘滴加硅油防止升温过程中水分蒸发。
1.2.2.4 凝胶强度的测定
将1.2.2.2中制备的复配蛋白溶液移入10 mL烧杯中,保鲜膜封口,95 ℃水浴35 min,取出后于冰水浴冷却,4 ℃存放过夜。采用TA-XT Plus质构仪测定复配凝胶的凝胶强度。蛋白凝胶于25 ℃平衡1 h后从烧杯中小心取出,切割为高度20 mm的圆柱体。选用P/36R探头,测试参数为:测前速度1 mm/s,测试速度5 mm/s,测后速度5 mm/s,下压2次,探头2次测定的时间间隔为5 s,触发力5.0 g,压缩形变50%。凝胶硬度为第2次挤压变形时凝胶产生应力的最大值。
1.2.2.5 持水性的测定
根据简华君[11]的方法测定凝胶持水性。蛋白凝胶于25 ℃平衡1 h后从烧杯中小心取出,称量后移入50 mL离心管中,10 000×g离心15 min。用滤纸小心吸取离心后凝胶表面的水渍。持水率(%)定义为离心后凝胶质量占离心前凝胶质量的百分比。
1.2.2.6 微观结构测定
使用扫描电子显微镜对凝胶微观结构进行观察。制备好的蛋白凝胶放入足量液氮中急速冷冻干燥。对冷冻干燥样品进行离子溅射喷金处理,在高真空模式下观察样品表面形貌,电子枪加速电压为3 kV。
1.2.2.7 溶解度的测定
将蛋白样品稀释成质量浓度为10 mg/mL的溶液,室温下磁力搅拌1 h,12 000×g离心15 min。收集上清液,以BSA作为标准品,采用双缩脲法测定蛋白含量。蛋白质的溶解度为上清液中的蛋白含量与总蛋白含量的比值。
1.2.2.8 十二烷基硫酸钠-丙烯酰胺凝胶电泳(SDS-PAGE)分析
采用4%浓缩胶,12%分离胶,1 mm凝胶板,上样量为10 μL。电泳样品沸水浴5 min,浓缩胶电压为40 V,分离胶电压为80 V。用考马斯亮蓝快速染液染色30 min,去离子水脱色数次至底色褪去。
1.2.2.9 表面游离巯基及二硫键的测定
根据BEVERIDGE等[12]的方法适当修改,测定表面游离巯基及二硫键含量。
表面游离巯基含量测定:将1.2.2.2中制备的蛋白溶液稀释为5 mg/mL,加入0.05 mL DNTB溶液,室温放置1 h后于波长412 nm处测定吸光度值,计算如公式(1)所示:
表面游离巯基含量![]()
(1)
式中:73.53,DNTB试剂的摩尔消光系数;A412,蛋白样品的吸光度值;c,蛋白质量浓度,mg/mL;D,稀释倍数,5.05。
总自由巯基含量测定:取1 mL 1.2.2.2中制备的蛋白溶液,加入4 mL尿素-盐酸胍溶液(包含8 mol/L尿素和5 mol/L盐酸胍),再加入0.05 mL DTNB溶液,室温放置1 h后于波长412 nm处测定吸光度值,计算公式同表面游离巯基。
总巯基含量测定:取1 mL 1.2.2.2中制备的蛋白溶液,加入0.05 mL β-巯基乙醇和4 mL尿素-盐酸胍溶液,25 ℃条件下水浴1 h。取出后加入10 mL的12%的TCA,25 ℃条件下再次水浴1 h。水浴后混合物5 000 ×g离心10 min。取沉淀分散在5 mL 12% TCA中,离心除去β-巯基乙醇,重复2~3次。最后将沉淀溶解在10 mL尿素-盐酸胍溶液中,加入0.04 mL DNTB溶液,在波长412 nm下测定吸光度。以不加蛋白的样品为对照,在波长412 nm下测定吸光度值,计算如公式(2)所示:
二硫键含量![]()
(2)
1.2.2.10 表面疏水性的测定
以ANS作为荧光探针测定蛋白质表面疏水性。用磷酸盐缓冲液(10 mmol/L, pH 7.0)稀释蛋白样品,制备质量浓度为0.02、0.04、0.06、0.08、0.1 mg/mL的蛋白溶液;2 mL蛋白样品和20 μL ANS (8.0 mmol/L磷酸盐缓冲液,pH 7.0)混合,室温避光保存3 min。荧光强度(fluorescence index,FI)用荧光光谱仪测量,激发波长为390 nm,发射波长为470 nm,狭缝宽度为5 nm。通过线性回归分析计算FI与蛋白浓度的初始斜率,将其作为蛋白疏水性(H0)的指标。
1.2.2.11 粒径的测定
将1.2.2.2中制备的蛋白溶液稀释为1 mg/mL,采用Malvern Nano-ZS型动态光散射仪对蛋白溶液的粒径进行测定,测定温度为25 ℃。
1.2.2.12 傅里叶红外光谱(Fourier transform infrared spectroscopy,FTIR)分析
使用带有单反射衰减全反射(attenuated total reflection,ATR)附件的FTIR光谱仪对蛋白二级结构进行分析,以空气为参比,记录4 000~650 cm-1的光谱,分辨率为4 cm-1,扫描次数为32次,使用OMNIC v.8.0和Peakfit v.4.12软件进行数据分析。
1.3 数据统计分析
所有实验均重复3次,结果表示为平均值±标准偏差。实验数据采用Excel 2019绘图,采用Statistix Version 9.0软件进行单因素ANOVA判断(邓肯分析),P<0.05表示具有显著性差异。
2 结果与分析
2.1 两种蛋白的氨基酸组成分析
SPI和CPI的氨基酸组成及疏水性见表1。SPI的亲疏水性氨基酸比例为1.09∶1,而CPI的亲疏水性氨基酸比例1.3∶1,CPI中亲水氨基酸含量占比高于SPI。SPI主要依靠疏水相互作用、二硫键和氢键等相互作用形成凝胶,其中疏水相互作用对凝胶的形成至关重要。当蛋白质被加热时,包埋在蛋白质内部的疏水氨基酸残基暴露出来,导致疏水性增加,从而促进凝胶的形成。因此,蛋白氨基酸残基的疏水性是影响蛋白凝胶特性的重要因素。此外,凝胶还受蛋白溶解度、蛋白形状、温度、盐离子和pH值等因素的影响[13]。亲水氨基酸倾向于定位在蛋白质表面,CPI的亲水氨基酸含量高,意味着其可能比SPI更亲水。2种蛋白混合后加热可能会产生相互作用,以改善SPI热诱导凝胶性质。
表1 SPI和CPI的氨基酸组成
Table 1 The amino acid composition of soy protein and camelia seed protein
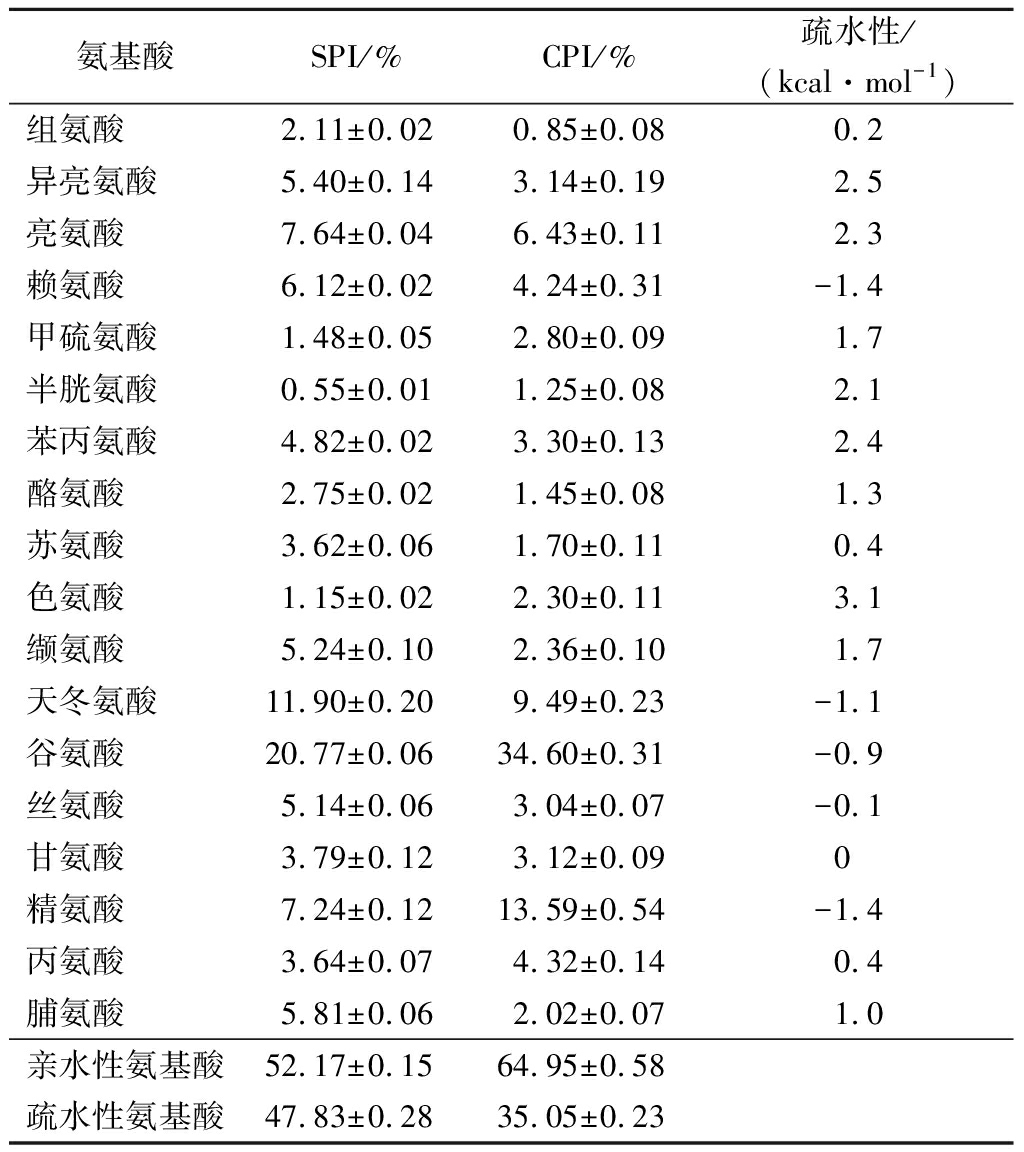
氨基酸SPI/%CPI/%疏水性/(kcal·mol-1)组氨酸2.11±0.020.85±0.080.2异亮氨酸5.40±0.143.14±0.192.5亮氨酸7.64±0.046.43±0.112.3赖氨酸6.12±0.024.24±0.31-1.4甲硫氨酸1.48±0.052.80±0.091.7半胱氨酸0.55±0.011.25±0.082.1苯丙氨酸4.82±0.023.30±0.132.4酪氨酸2.75±0.021.45±0.081.3苏氨酸3.62±0.061.70±0.110.4色氨酸1.15±0.022.30±0.113.1缬氨酸5.24±0.102.36±0.101.7天冬氨酸11.90±0.209.49±0.23-1.1谷氨酸20.77±0.0634.60±0.31-0.9丝氨酸5.14±0.063.04±0.07-0.1甘氨酸3.79±0.123.12±0.090精氨酸7.24±0.1213.59±0.54-1.4丙氨酸3.64±0.074.32±0.140.4脯氨酸5.81±0.062.02±0.071.0亲水性氨基酸52.17±0.1564.95±0.58疏水性氨基酸47.83±0.2835.05±0.23
2.2 凝胶性质分析
2.2.1 流变性质分析
储能模量(Pa)的变化可用于表征蛋白质凝胶的流变学性质。图1是SPI和复配蛋白在加热过程中储能模量(G′)随时间和温度的变化图,表2是CPI添加比例对凝胶温度、初始弹性模量和终点弹性模量的影响。其中,0~35 min为升温阶段(25~95 ℃),35~45 min为保温阶段(95 ℃),45~80 min为降温阶段(95~25 ℃)。蛋白质在加热过程中弹性模量(G′)值急剧上升,表明蛋白质受热变性,凝胶网络开始形成,该温度被定义为成胶的凝胶起始温度或凝胶点。凝胶点可通过弹性模量(G′)和黏性模量(G″)发生交点时的温度来定义,预示着体系中的溶液逐渐向固体转变[14]。
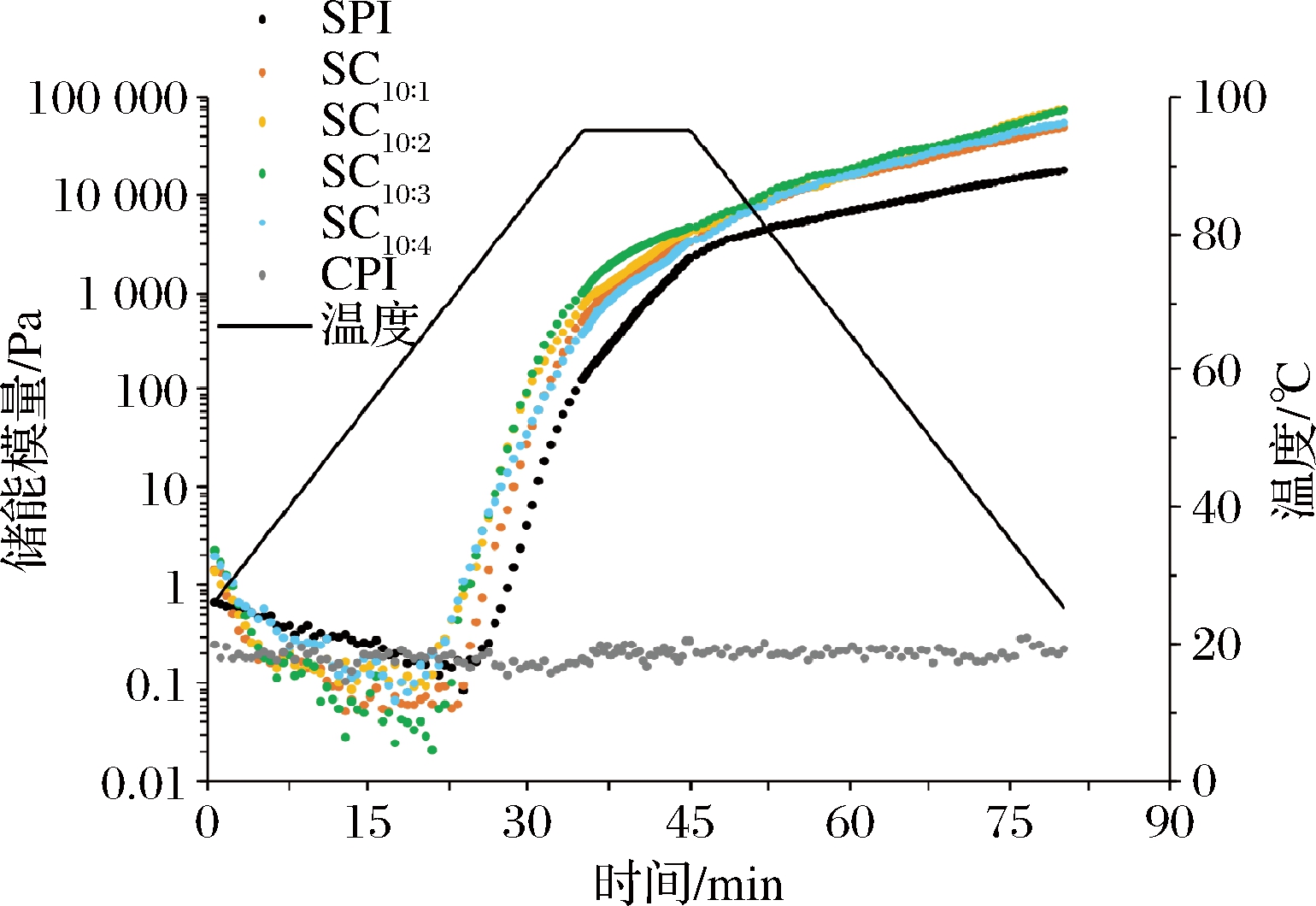
图1 CPI添加比例对弹性模量的影响
Fig.1 Effect of camellia seed protein addition ratio on storage modulus
表2 CPI添加比例对凝胶温度、初始弹性模量和 终点弹性模量的影响
Table 2 Effect of camellia seed protein addition ratio on gel temperature, initial storage modulus, and final storage modulus
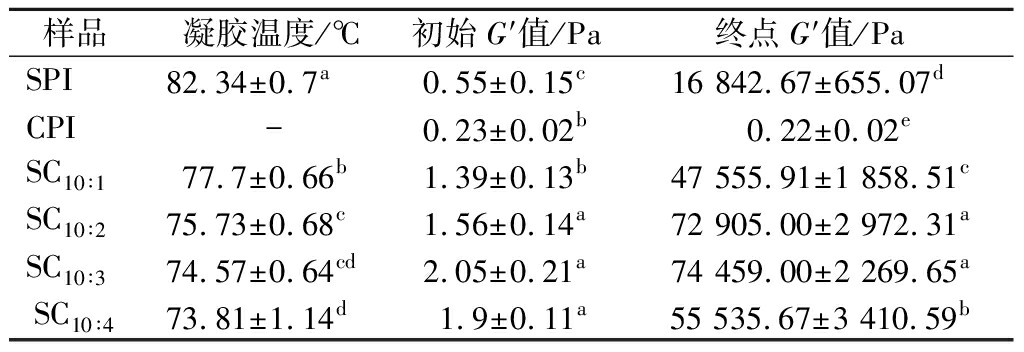
样品凝胶温度/℃初始G′值/Pa终点G′值/PaSPI82.34±0.7a0.55±0.15c16 842.67±655.07dCPI-0.23±0.02b0.22±0.02eSC10∶177.7±0.66b1.39±0.13b47 555.91±1 858.51cSC10∶275.73±0.68c1.56±0.14a72 905.00±2 972.31aSC10∶374.57±0.64cd2.05±0.21a74 459.00±2 269.65aSC10∶473.81±1.14d1.9±0.11a55 535.67±3 410.59b
注:不同小写字母表示具有显著性差异(P<0.05)(下同)
由图1可知,在整个升温过程中CPI的储能模量保持不变,维持在0.2 Pa左右,不具备形成热诱导凝胶的能力。SPI及其复配蛋白样品表现出典型的豆类植物蛋白流变曲线特征。升温阶段,温度未到达蛋白质凝胶点前,G′值基本保持不变,随着温度升高超过凝胶点后,G′值迅速上升,此时蛋白质内部的疏水基团暴露,蛋白变性聚集开始形成网络结构。SPI中加入CPI后,混合蛋白的凝胶温度由原来的82.34 ℃逐步下降至73.81 ℃。随着溶液中CPI含量的增加,复配蛋白的G′值也随之增大,但当CPI在体系中的比例增加至10∶4时,G′值开始下降。这可能与实验中总蛋白浓度固定在12%有关,当SPI与CPI比例达到10∶4时,SPI在体系中的浓度仅为8.5%,接近其临界凝胶浓度。另外,复合蛋白的热凝胶性质也受聚集体粒径大小、含量高低、反应活性等因素影响[15]。
2.2.2 凝胶强度及持水性分析
为了研究CPI的添加及添加比例对复配蛋白凝胶特性的影响,测定了凝胶强度和凝胶持水性。如图2所示,与单纯的SPI凝胶相比,CPI的添加比例为10∶1时,复配蛋白凝胶强度由213 g提高至350 g;随着CPI添加比例的增加,凝胶强度先增加后降低,最高可提升至427 g(SC10∶3)。从图2持水性结果看,CPI的加入并未使复配蛋白凝胶的持水性发生太大变化,而是在99.72%~99.89%波动,复配蛋白凝胶持水性好。一般而言,2种蛋白质混合,当其中的一种蛋白不能形成凝胶并保持溶解性良好的状态下,混合物凝胶强度的提升原因一般认为有3种:(1)作为填充物的某种蛋白保持可溶状态的单相凝胶[16];(2)2种蛋白之间的相互作用产生了结合,那么非凝胶组分的蛋白可能会通过非特异性相互作用吸附或者结合在连续相凝胶网络上;(3)2种蛋白发生共聚合形成杂合单一的凝胶网络[17]。为了研究CPI对于SPI凝胶性提升的原因,本文通过测定凝胶结构、混合物溶解度、电泳、表面游离巯基含量、二硫键含量、表面疏水性、溶液粒径分布、二级结构变化等来探索2种蛋白相互作用机制。

图2 CPI添加比例对凝胶强度及持水率的影响
Fig.2 Effect of camellia seed protein addition ratio on gel strength and water holding capacity
2.2.3 凝胶结构分析
图3-a为SPI、CPI和复配蛋白凝胶的宏观图片,除CPI外,SPI与复配蛋白在12%浓度下均可形成凝固型凝胶。SPI呈黄色,CPI呈褐色,随着体系中CPI含量的增加,复配凝胶的颜色逐渐加深。舒敏[18]提取的CPI也为褐色,主要是由于油茶籽粕中含有茶红色素,且蛋白提取过程中多酚类物质会发生氧化褐变。

a-凝胶宏观图片;b-SPI微观结构;c-SC10∶1微观结构; d-SC10∶2微观结构;e-SC10∶3微观结构;f-SC10∶4微观结构
图3 CPI添加比例对凝胶宏观图片和微观结构的影响
Fig.3 Effect of camellia seed protein addition ratio on gel macrostructure and microstructure
图3-b~图3-f为SPI凝胶和复配蛋白凝胶的微观结构图。SPI凝胶的网络结构疏松,网络孔隙较大;SPI和CPI的复配凝胶形成了均一的交联网络,体系中CPI的添加比例对凝胶微观结构有明显的影响。随着CPI比例的增加,凝胶网络结构中网孔直径减小,网孔数量增加。当SPI与CPI间的比例增加到10∶4时,凝胶网络的网孔直径增大,这是因为CPI不具备形成凝胶的能力,SPI为凝胶网络结构的主要成分,体系中SPI含量过低不利于致密凝胶网络的形成。这也进一步说明了当SPI与CPI的比例为10∶4时复配蛋白的凝胶强度开始下降的原因。因此,CPI的少量添加有利于促进复配蛋白形成致密均匀的凝胶网络结构,提高蛋白凝胶强度。
2.3 SPI和CPI的相互作用机制
2.3.1 溶解度分析
复合蛋白质的溶解度是表征蛋白-蛋白之间相互作用的一个途径。SPI、CPI和复配蛋白的溶解度见图4。CPI的溶解度为92.73%,显著高于SPI(87.89%)。复配后,复配比例为10∶1时,溶解度并未增加,随着体系中油茶籽含量增加,溶解度由88.84%(SC10∶1)提升至93.40%(SC10∶4)。此外,蛋白质的溶解度与蛋白质表面的亲疏水平衡有关,这种平衡取决于分子表面的氨基酸组成。CPI的疏水氨基酸含量低,说明蛋白质分子表面可能有更多亲水氨基酸;分子质量小,意味着蛋白质与水分子接触的表面积增加,有利于促进蛋白质与水之间的相互作用[19]。SPI与CPI发生相互作用,改变SPI表面的亲疏水平衡,增强复配蛋白与水之间的相互作用,促使溶液中SPI不可溶聚集体形成可溶性聚集体,溶解度得到提高。张蒙琪[20]将SPI与全蛋液以3∶1的比例混合后,发现混合物的溶解度(64.44%)高于SPI(53.56%)和全蛋液(54.90%),2种蛋白的相互作用促进了溶解度的提升。溶解度的提升与混合蛋白凝胶性提升有关,溶解度的提升使体系中有更多蛋白参与凝胶结构的形成,使凝胶网络更加致密均匀。

图4 CPI添加比例对蛋白溶解度的影响
Fig.4 Effect of camellia seed protein addition ratio on protein solubility
2.3.2 电泳分析
为了探讨CPI与SPI间产生的相互作用类型,采用还原和非还原SDS-PAGE分析了2种植物蛋白及其复配后产物的亚基组成变化,结果见图5。从非还原电泳图可知,SPI主要由α′、α、β、AB、A、B亚基组成,在>100 kDa处出现多条大聚集体条带。CPI主要由3条较低分子质量的肽段组成,分子质量分别是48、40、14 kDa。随着CPI的添加比例升高,复配蛋白中组成SPI的6个亚基的条带占比减少,样品中SPI的含量减少,同时CPI中14 kDa条带含量显著减少。值得注意的是,4个复配样品电泳图中浓缩胶和分离胶顶层条带颜色变深,分离胶泳道最上端的2条条带颜色也加深,这说明2种蛋白间发生强相互作用并在亚基之间形成了大聚集体。对比分析还原和非还原电泳,可以发现除了SC10∶3和SC10∶4两个样品分离胶顶层条带留有少量聚集体外,其他聚集体条带变浅甚至消失,电泳结果说明,2种蛋白形成了二硫键参与的复合物,这种复合物的形成可能是混合蛋白凝胶温度的下降和凝胶强度提升的原因。
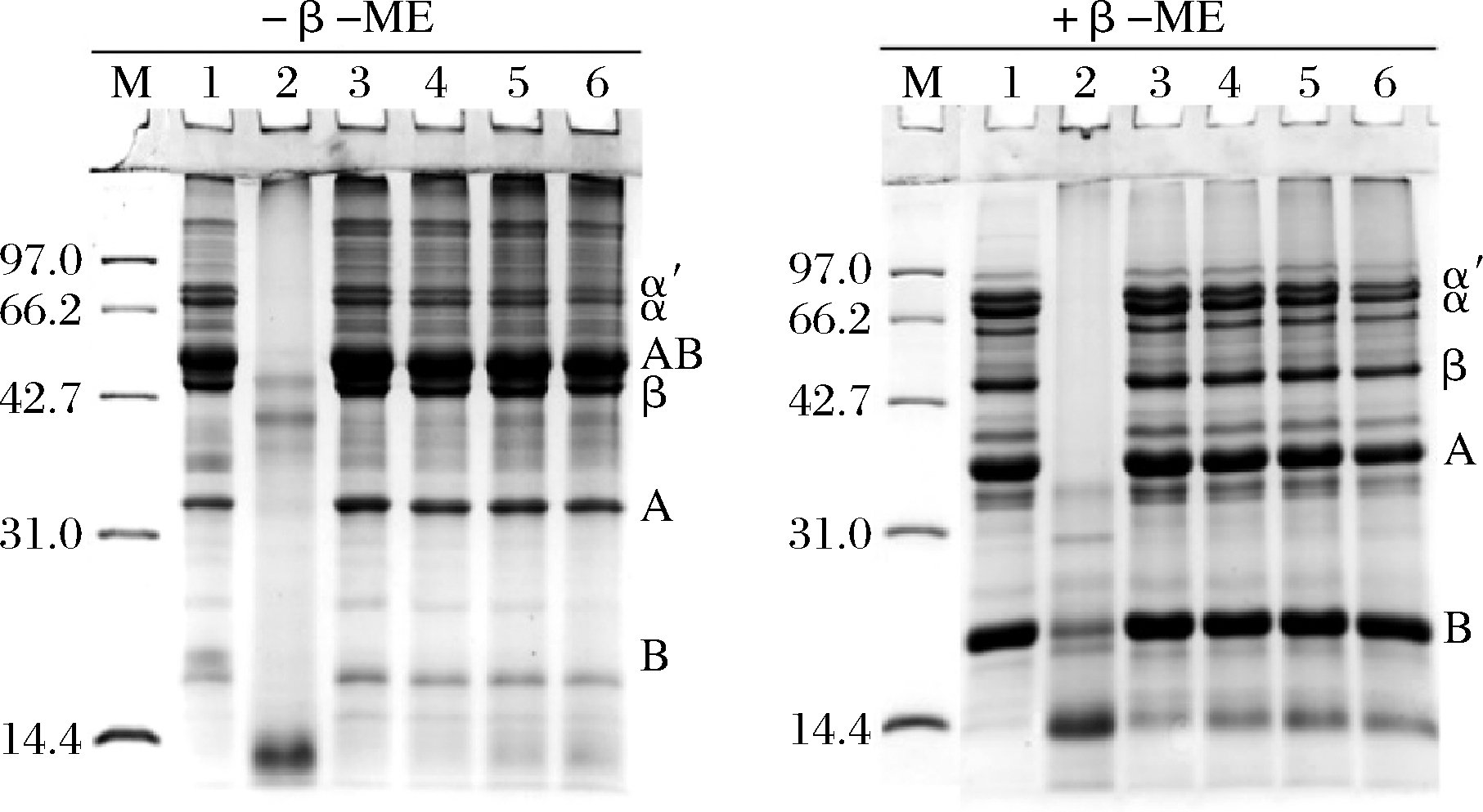
M-标品蛋白,泳道1~6分别是SPI、CPI、SC10∶1、 SC10∶2、SC10∶3、SC10∶4
图5 SPI与CPI复配后的SDS-PAGE图
Fig.5 SDS-PAGE pattern of soy protein and camelia seed protein mixed solution
2.3.3 表面游离巯基含量和二硫键含量分析
表面游离巯基含量的变化与蛋白质构象变化和蛋白质展开程度密切相关。SPI、CPI和复配蛋白表面游离巯基、二硫键含量的变化见图6。SPI的表面游离巯基含量高于CPI,CPI的添加使体系中游离巯基含量降低;SPI的二硫键含量低于CPI,随着体系中CPI含量的增加,复配蛋白的二硫键含量增加。氨基酸分析和电泳分析结果显示,CPI的半胱氨酸含量远高于SPI;2种蛋白混合物中存在由二硫键参与形成的复合物。因此由混合物蛋白中表面游离巯基下降、二硫键含量上升可知,SPI与CPI生成了新的二硫键。刘鑫硕等[21]研究马铃薯蛋白与蛋清蛋白相互作用,也发现2种蛋白复配后存在二硫键相互作用。
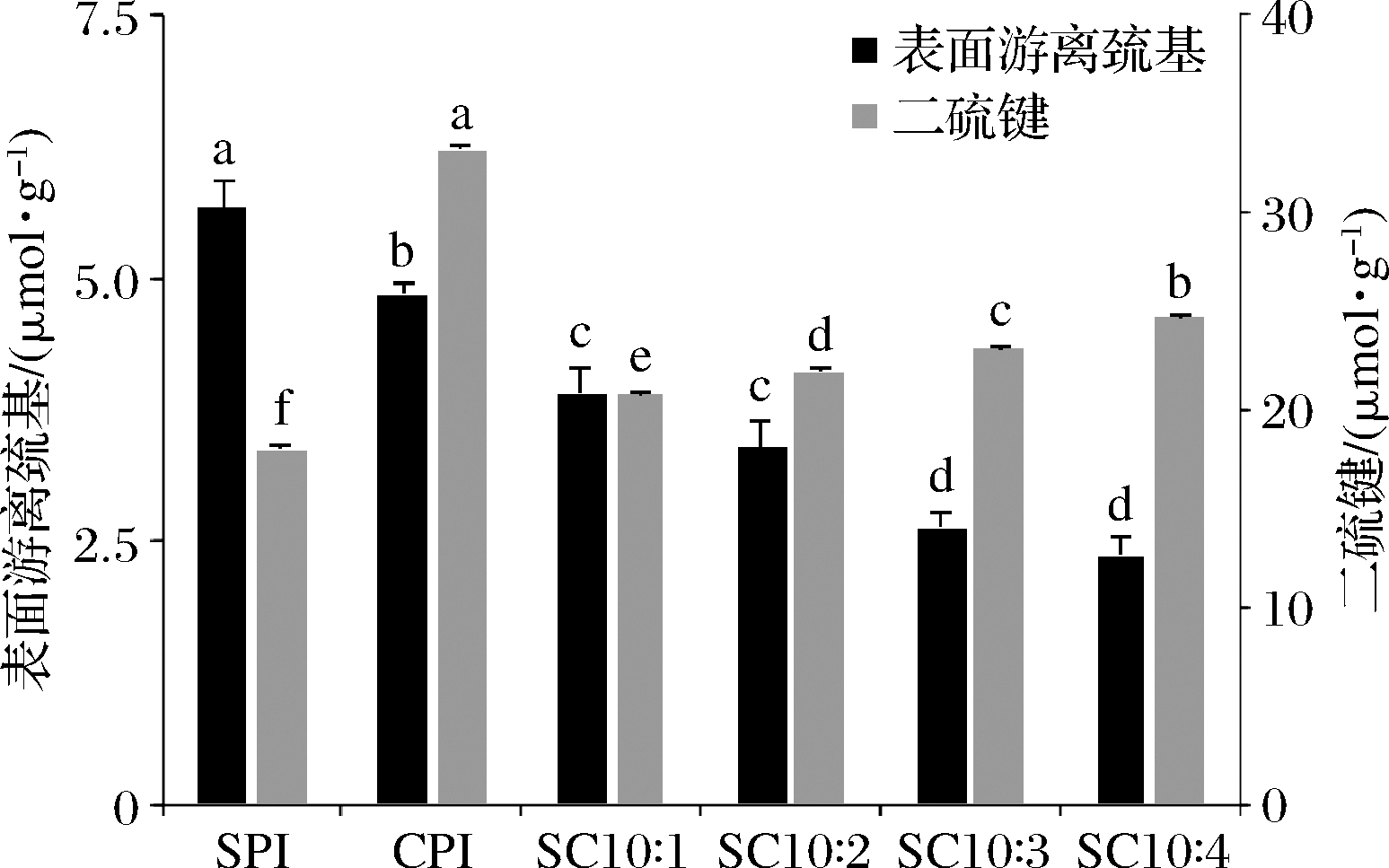
图6 CPI添加比例对表面游离巯基及二硫键含量的影响
Fig.6 Effect of camellia seed protein addition ratio on surface free sulfhydryl group and disulfide bond contents
2.3.4 表面疏水性分析
表面疏水性反映了蛋白质的展开程度和表面疏水基团的暴露程度,这些结构的变化能改变蛋白质间的疏水相互作用,进而影响凝胶的形成[22]。为了进一步探明SPI与CPI复配后有效促进凝胶强度上升和凝胶温度下降的原因,测定了SPI、CPI和复配蛋白的表面疏水性,结果见图7。SPI与CPI的表面疏水性差异极大;随着蛋白混合物中CPI含量的增加,混合蛋白的表面疏水性也显著下降,存在显著的量效关系。蛋白质的表面疏水性与其氨基酸组成有关,特别是与分子表面暴露的氨基酸残基的类型和数量有关[23]。该结果也进一步说明,2种蛋白之间存在相对较强的相互作用,形成的复合物的整体疏水性下降,这可能也是复合蛋白溶解性提高的重要原因。
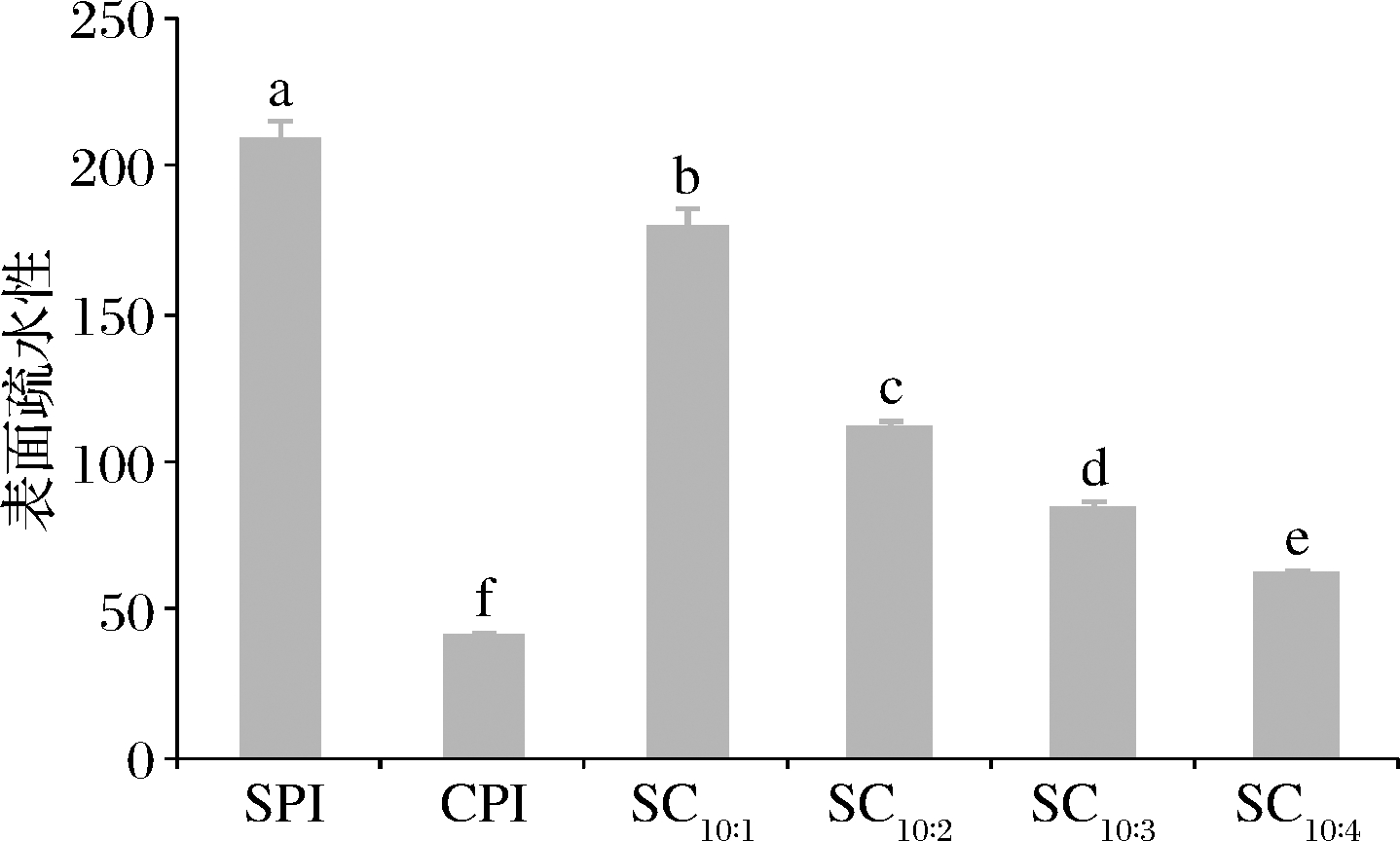
图7 CPI添加比例对表面疏水性的影响
Fig.7 Effect of camellia seed protein addition ratio on surface hydrophobicity
2.3.5 粒径分析
为了进一步证实2种蛋白相互作用形成的复合物的状态,采用动态光散射测定了2种蛋白及其复配后的粒径变化。图8显示,SPI的粒径呈双峰分布,位于60和255 nm处,CPI则主要分布在15 nm处,在60和300 nm处存在2个小峰,说明CPI的粒径远小于SPI。SPI和CPI复配后的粒径分布与SPI类似,CPI在15 nm处的粒径峰消失,说明2种蛋白间产生了相互作用,形成了复合物。PIZONES等[24]也发现了类似的实验结果,将大豆7S球蛋白与β-乳球蛋白以5∶5的比例复配后,复配蛋白的粒径分布图中没有β-乳球蛋白的峰,几乎与7S球蛋白峰重合,2种蛋白间发生了络合。
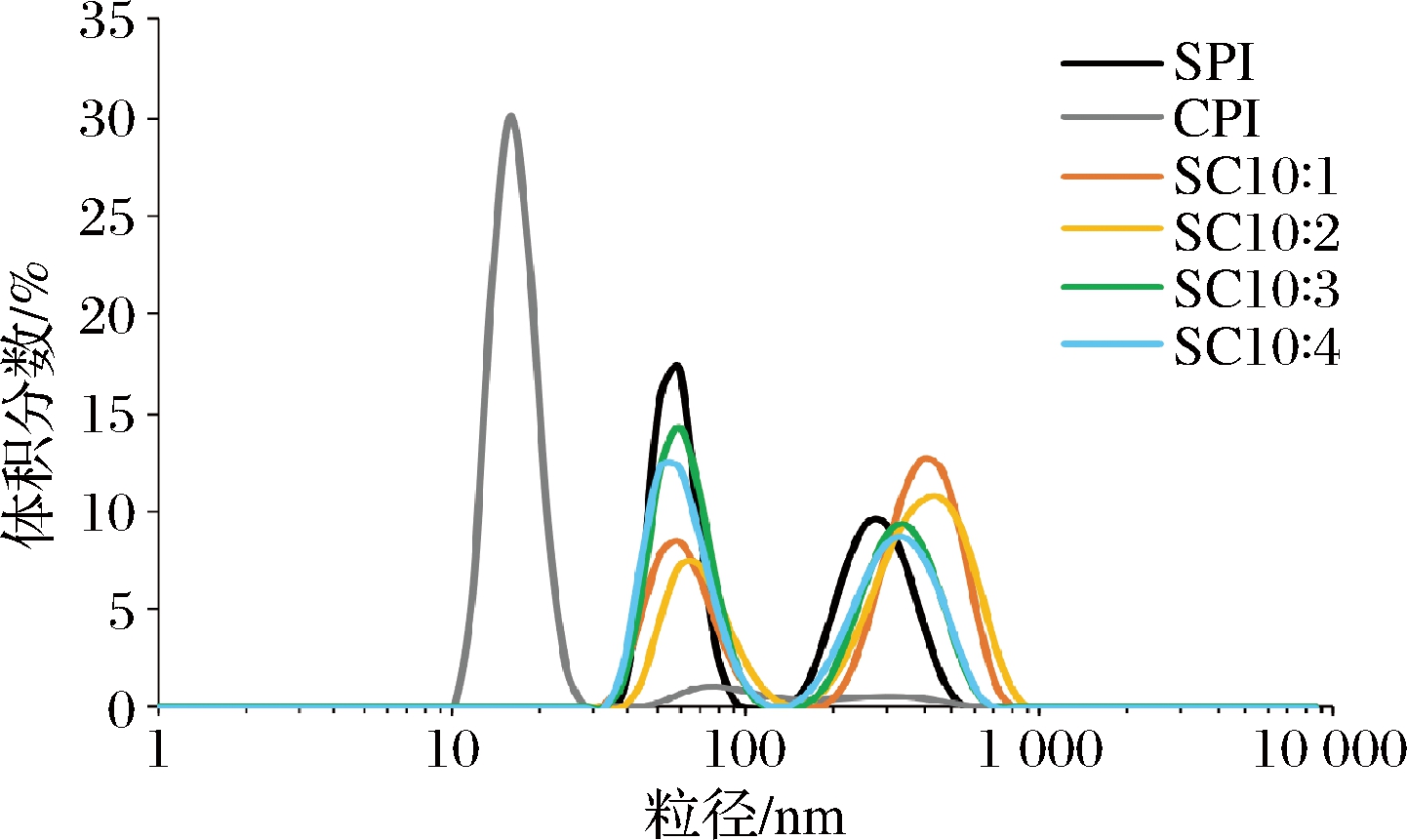
图8 CPI添加比例对蛋白粒径的影响
Fig.8 Effect of camellia seed protein addition ratio on protein particle size
2.3.6 红外光谱分析
采用傅里叶红外光谱对SPI、CPI和复配蛋白的二级结构变化进行分析,如图9所示。蛋白质的主要特征谱带由酰胺Ⅰ带(1 600~1 700 cm-1)、酰胺Ⅱ带(1 480~1 575 cm-1)和酰胺Ⅲ带(1 230~1 400 cm-1)组成,其中酰胺Ⅰ带是由4种不同的二级结构组成,可采用高斯积分法拟合计算蛋白中各二级结构的含量占比,如表3所示。SPI二级结构以β-折叠为主,其次是β-转角、无规卷曲和α-螺旋,与安然[25]的研究结果相似。CPI二级结构同样以β-折叠为主,但其相对含量低于SPI,而其他几种二级结构相对含量则高于SPI。2种蛋白复配后,随着CPI含量的增加,复配蛋白的β-折叠相对含量下降,β-转角和无规卷曲的含量增至与CPI相近,α-螺旋相对含量无明显变化。说明2种蛋白间发生相互作用导致复配蛋白的二级结构由有序态向无序态转变,这种改变有利于复配凝胶强度的改善。

图9 CPI添加比例对FTIR光谱的影响
Fig.9 Effect of camellia seed protein addition ratio on FTIR spectra
表3 CPI添加比例对二级结构的影响
Table 3 Effect of camellia seed protein addition ratio on the secondary structure
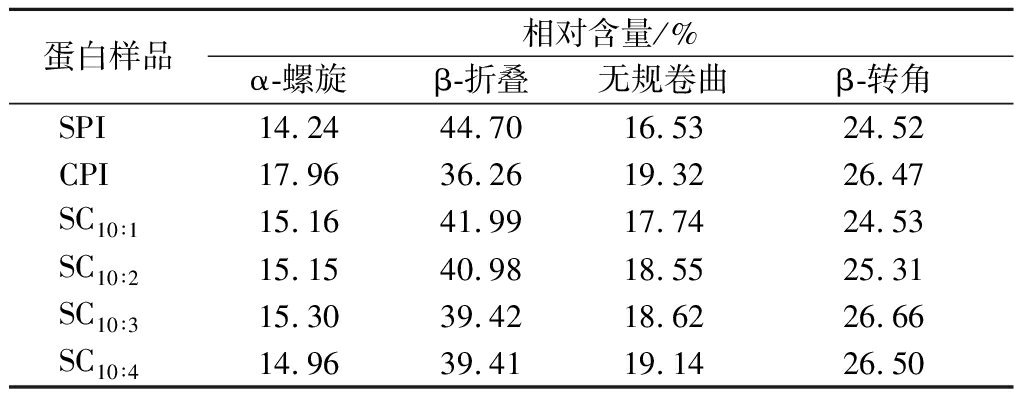
蛋白样品相对含量/%α-螺旋β-折叠无规卷曲β-转角SPI14.2444.7016.5324.52CPI17.9636.2619.3226.47SC10∶115.1641.9917.7424.53SC10∶215.1540.9818.5525.31SC10∶315.3039.4218.6226.66SC10∶414.9639.4119.1426.50
3 结论
本文利用SPI和不同比例的CPI复配制备凝胶,从2种蛋白自身氨基酸组成、复配蛋白溶液的凝胶性质以及2种蛋白相互作用机制3方面进行研究,揭示了CPI对复配凝胶特性的改善机制。结果表明,一定比例的CPI可以有效提升SPI的凝胶强度。这种提升作用主要是基于2种蛋白间发生二硫键相互作用,使SPI和CPI形成了二硫键参与的复合物,有效诱导复配蛋白溶解度提升,促进复配蛋白形成致密均匀的凝胶网络结构。本研究结果说明,基于亲疏水性和二硫键含量有显著差异的蛋白的相互作用,可以提升混合蛋白的溶解性和凝胶性,这为未来高凝胶性植物基蛋白的制造提供了一种新的思路。
[1] 蒋将. pH偏移处理诱导熔球态大豆蛋白的结构变化及功能性质的改善[D].无锡:江南大学, 2011.
JIANG J.pH-shifting induced structural changes and functionality enhancements of soy proteins in molten globule state[D].Wuxi:Jiangnan University, 2011.
[2] 刘德阳. 盐离子对大豆分离蛋白凝胶特性和微结构影响研究[D].无锡:江南大学, 2015.
LIU D Y.Effect of salt ions on the gel properties and microstructure of soy protein isolate[D].Wuxi:Jiangnan University, 2015.
[3] XIA W J, SIU W K, SAGIS L M C.Linear and non-linear rheology of heat-set soy protein gels:Effects of selective proteolysis of β-conglycinin and glycinin[J].Food Hydrocolloids, 2021, 120:106962.
[4] WONG D, VASANTHAN T, OZIMEK L.Synergistic enhancement in the co-gelation of salt-soluble pea proteins and whey proteins[J].Food Chemistry, 2013, 141(4):3 913-3 919.
[5] NGUYEN B T, NICOLAI T, CHASSENIEUX C, et al.Heat-induced gelation of mixtures of whey protein isolate and sodium caseinate between pH 5.8 and pH 6.6[J].Food Hydrocolloids, 2016, 61:433-441.
[6] 高雪丽. 大豆7S、11S球蛋白与分离蛋白影响面团特性及馒头品质的机理研究[D].杨凌:西北农林科技大学, 2015.
GAO X L.The effect of glycinin, β-conglycinin, soy protein isolate on dough properties and steamed bread quality[D].Yangling:Northwest A & F University, 2015.
[7] ZHANG X Y, ZHANG S, ZHONG M M, et al.Soy and whey protein isolate mixture/calcium chloride thermally induced emulsion gels:Rheological properties and digestive characteristics[J].Food Chemistry, 2022, 380:132212.
[8] 李慧珍. 油茶粕蛋白质的分离提取、理化性质及体外消化产物的抗氧化性研究[D].南昌:南昌大学, 2013.
LI H Z.Extraction and separation, characterization of protein in Camellia aleifera seed cake and antioxidant activity of its digestion products in vitro[D].Nanchang:Nanchang University, 2013.
[9] JIANG J, CHEN J, XIONG Y L.Structural and emulsifying properties of soy protein isolate subjected to acid and alkaline pH-shifting processes[J].Journal of Agricultural and Food Chemistry, 2009, 57(16):7 576-7 583.
[10] YU M, ZENG M M, QIN F, et al.Physicochemical and functional properties of protein extracts from Torreya grandis seeds[J].Food Chemistry, 2017, 227:453-460.
[11] 简华君. 大豆蛋白对肌纤维复合蛋白凝胶性质的影响[D].无锡:江南大学, 2014.
JIAN H J.Effects of soy protein on the gelling properties of myofibrillar protein[D].Wuxi:Jiangnan University, 2014.
[12] BEVERIDGE T, TOMA S J, NAKAI S.Determination of SH- and SS-groups in some food proteins using Ellman’s reagent[J].Journal of Food Science, 1974, 39(1):49-51.
[13] NISHINARI K, FANG Y, GUO S, et al.Soy proteins:A review on composition, aggregation and emulsification[J].Food Hydrocolloids, 2014, 39:301-318.
[14] RENKEMA J M S, GRUPPEN H, VAN VLIET T.Influence of pH and ionic strength on heat-induced formation and rheological properties of soy protein gels in relation to denaturation and their protein compositions[J].Journal of Agricultural and Food Chemistry, 2002, 50(21):6 064-6 071.
[15] 武肖. 热诱导聚集对大豆蛋白凝胶流变特性及稳定性影响[D].杭州:浙江工商大学, 2013.
WU X.The influence of heat-induced aggregate on gel rheological properties and stability in soybean protein solutions[D].Hangzhou:Zhejiang Gongshang University, 2013.
[16] POLYAKOV V I, GRINBERG V Y, TOLSTOGUZOV V B.Thermodynamic incompatibility of proteins[J].Food Hydrocolloids, 1997, 11(2):171-180.
[17] NICOLAI T.Gelation of food protein-protein mixtures[J].Advances in Colloid and Interface Science, 2019, 270:147-164.
[18] 舒敏. 影响茶油品质的因素及茶饼粕蛋白的研究[D].南昌:南昌大学, 2008.
SHU M.Study on factors of affecting the quality of edible camellia oil and camellia seed cake protein[D].Nanchang:Nanchang University, 2008.
[19] SOLTANI FIROUZ M, FARAHMANDI A, HOSSEINPOUR S.Recent advances in ultrasound application as a novel technique in analysis, processing and quality control of fruits, juices and dairy products industries:A review[J].Ultrasonics Sonochemistry, 2019, 57:73-88.
[20] 张蒙琪. 鸡蛋蛋白与大豆分离蛋白间相互作用及其凝胶特性的研究[D].无锡:江南大学, 2021.
ZHANG M Q.The research of interaction between hen egg proteins and soybean protein isolate and its gelation properties[D].Wuxi:Jiangnan University, 2021.
[21] 刘鑫硕, 刘倩楠, 刘伟, 等.马铃薯蛋白与蛋清蛋白混合凝胶特性分析[J].食品科学, 2022, 43(2):34-40.
LIU X S, LIU Q N, LIU W, et al.Gelling properties of potato protein-egg white mixtures[J].Food Science, 2022, 43(2):34-40.
[22] MOHAN M, RAMACHANDRAN D, SANKAR T V.Functional properties of Rohu (Labeo rohita) proteins during iced storage[J].Food Research International, 2006, 39(8):847-854.
[23] YANG J Q, LIU G Y, ZENG H B, et al.Effects of high pressure homogenization on faba bean protein aggregation in relation to solubility and interfacial properties[J].Food Hydrocolloids, 2018, 83:275-286.
[24] PIZONES RUIZ-HENESTROSA V M, MARTINEZ M J, CARRERA S NCHEZ C, et al.Mixed soy globulins and β-lactoglobulin systems behaviour in aqueous solutions and at the air-water interface[J].Food Hydrocolloids, 2014, 35:106-114.
NCHEZ C, et al.Mixed soy globulins and β-lactoglobulin systems behaviour in aqueous solutions and at the air-water interface[J].Food Hydrocolloids, 2014, 35:106-114.
[25] 安然. 大豆分离蛋白可溶性热聚集行为及其超声调控研究[D].哈尔滨:东北农业大学, 2019.
AN R.Study on soluble thermal aggregates of soybean protein isolate and its ultrasonic regulation[D].Harbin:Northeast Agricultural University, 2019.