大豆亲脂蛋白(soybean lipophilic protein,SLP)是大豆球蛋白(11S)和伴大豆球蛋白(7S)在蛋白分离或加工过程中发生蛋白和磷脂结合形成的亲脂蛋白复合物,占储存蛋白的30%左右,作为大豆蛋白的一种新组分,自2007年提出以来,大豆亲脂性蛋白一直备受关注[1]。
目前,大豆亲脂性蛋白主要围绕其良好的表面活性,如乳化性和起泡性等展开研究,与11S和7S球蛋白相比,添加0.000 1%的SLP能使界面张力降低10 mN/m,且SLP乳液在高盐高浓度条件下表现出一定的热稳定性[2]。WANG等[3]研究认为SLP纳米乳液是一种有前景的递送体系,能在低盐离子浓度下最大限度地提高递送效率,如LI等[4]通过大豆亲脂蛋白-甲基纤维素复合物封装亲水性维生素B12建立水包油包水(W/O/W)体系,使其在存储期间能起到包埋营养素,而在消化过程起到缓释作用;ZHONG等[5]也发现SLP纳米颗粒是白藜芦醇良好载体,在十二烷基硫酸钠作用下SLP解离缔合封装的白藜芦醇纳米颗粒具有良好的抗氧化性和可消化性;本研究团队前期也发现经超声诱导SLP自组装封装姜黄素形成的纳米颗粒具有良好的抗氧化性[6]。然而因为SLP磷脂含量高、表面疏水性强以及自身紧凑的结构溶解度大大降低,限制了乳化性等其他功能特性的发挥,进而制约SLP的开发应用。
自组装是基础粒子由无序到有序转变的过程,是一种制备具有吸引特性新粒子的“自下而上”的一种新技术[7-8]。研究显示蛋白可以在不同pH-偏移诱导条件下形成具有不同结构性质的聚集物,且具有双亲性的蛋白在等电点附近通过自组装可以形成具有特殊功能性质的球形聚集物,如菠萝蛋白酶在其等电点附近诱导能形成具有特殊功能的熔球态结构蛋白[9];β-乳球蛋白在等电点附近(pI 4.6~5.8)自组装形成以球形聚集体为主体的稳定微凝胶[10],这有助于其在食品领域中的应用,因此如何稳定形成的球形颗粒则是当前研究重点关注的问题。前期,本研究团队研究了热诱导条件下SLP解离缔合行为,发现在90 ℃条件下SLP能形成均一稳定的纳米体系[11]。然而,目前关于pH偏移诱导SLP解离缔合行为及自组装纳米颗粒表征的研究鲜有报道。
本研究以SLP为研究对象,通过不同pH偏移诱导SLP自组装形成纳米颗粒,利用傅里叶红外光谱(Fourier infrared spectroscopy,FTIR)、紫外光谱(ultraviolet spectroscopy,UV)、荧光光谱(fluorescence spectroscopy,FS)和圆二色谱(circular dichroism,CD)表征不同pH偏移诱导解离缔合对SLP结构的影响;采用差示扫描量热分析(differential scanning calorimetry,DSC)表征不同pH体系诱导对SLP结构稳定性的影响;通过柔性和乳化性评估不同pH偏移诱导解离缔合行为对SLP功能性的影响;以期为SLP在食品领域进一步开发应用提供理论支撑。
1 材料与方法
1.1 材料与试剂
大豆亲脂蛋白,自制;一级大豆色拉油,九三粮油工业集团有限公司。聚丙烯酰胺凝胶电泳套装、溴化钾(光谱纯),北京索莱宝生物科技有限公司;其余试剂均为国产分析纯。
1.2 仪器与设备
J-815圆二色谱,英国应用光物理公司;紫外光谱仪、傅里叶红外光谱仪、DSC-4000差示量热扫描仪,美国珀金埃尔股份有限公司;F-4600型荧光光谱仪,日本日立仪器(上海)有限公司;Nano-ZS-90型马尔文激光粒度仪,英国马尔文仪器有限公司。ALPHA 1-2 LD plus型冷冻干燥机,德国Christ公司。
1.3 实验方法
1.3.1 pH偏移诱导处理
用浓度为10 mmol/L、pH为1.0~7.0的磷酸盐缓冲液(phosphate buffer saline,PBS)将SLP配制成蛋白浓度为10 mg/mL的溶液,在室温条件(25±2) ℃下分别诱导0.5、1.0、2.0、4.0、8.0、12.0、24.0 h;诱导结束后pH调回中性(pH 7),储藏于4 ℃备用。
1.3.2 乳化性
将15 mL质量浓度为5 mg/mL的SLP溶液和5 mL大豆油加入到50 mL的EP管中,在10 000 r/min条件下均质2 min,用移液器从EP管底部吸取50 μL乳液于5 mL浓度为1 g/L、pH为7.0的SDS溶液中,充分混合后在500 nm波长下测吸光值。乳化性计算如公式(1)(2)所示[12]:
(1)
(2)
式中:EAI,乳化活性指数,m2/g;ESI,乳化稳定指数,min;N,稀释倍数,100;c,蛋白质浓度,g/mL;Φ,光程,0.01 m;θ,油相体积分数,0.25;A0、A10分别为0和10 min的吸光值。
1.3.3 柔性测定
在4 mL质量浓度为1 mg/mL样品液中按体积比16∶1加入浓度为0.05 mol/L,pH 7.0的Tris-HCl胰蛋白酶液(250 U/mg),37 ℃反应5 min,用4 mL浓度为50 g/L的三氯乙酸终止反应,8 000 r/min离心10 min,取上清液在280 nm波长下测吸光值作为柔性指标[13]。
1.3.4 差示扫描量热分析
精确称取2.000 mg样品密封于50 μL铝制液体皿中,以升温速率10 ℃/min,在20~120 ℃内利用DSC-4000差示量热扫描仪测定样品的热流曲线,以空的密封铝液体坩埚作为参比,试验数据分析采用Pyris Software DSC 4000通用分析软件进行。
1.3.5 粒径测定
将样品用pH 7.2的PBS稀释成质量浓度1 mg/mL的溶液,并经0.45 μm水系醋酸纤维素滤膜过滤,设定蛋白折光率为1.145,吸光值为0.001,在25 ℃条件下平衡3 min,通过马尔文激光粒度仪测定样品的粒径分布曲线。
1.3.6 紫外光谱测定
取质量浓度为0.1 mg/mL的样品,设定分辨率为0.2 nm,扫描速率为600 nm/min,通过紫外光谱仪获取190~800 nm原始蛋白紫外光谱,利用origin微分变换获得二阶导数紫外光谱。
1.3.7 内源荧光光谱测定
将样品液用pH 7.2的PBS稀释为质量浓度为0.1 mg/mL的溶液,在激发和发射狭缝均为5 nm、电压为500 V条件下,以激发波长295 nm,300~400 nm波长扫描得到荧光光谱,扫描3次取平均值最后得到内源荧光光谱图。
1.3.8 外源荧光光谱测定
将20 μL浓度为8 mmol/L的荧光探针(1-苯胺基-8-萘磺酸,ANS)加入到4 mL浓度为0.1 mg/mL的样品中,避光静置3 min后,设定狭缝为5 nm、激发波长390 nm,通过F-4600型荧光光谱仪扫描400~600 nm荧光发射光谱。
1.3.9 傅里叶红外光谱测定
精确称取2 mg样品,按质量比1∶100加入KBr粉末,经充分研磨混合均匀后压片成型,采用傅里叶红外光谱仪在分辨率4 cm-1,扫描次数32条件下扫描4 000~400 cm-1的红外光谱,经基线校准后,采用Peakfit 4.0.2计算酰胺I带(1 700~1 600 cm-1)获取蛋白二级结构信息。
1.3.10 圆二色谱的测定
用浓度为0.01 mol/L,pH为7.0的PBS将样品稀释至质量浓度为0.2 mg/mL的溶液,以相应磷酸盐缓冲液为对照,在光径10 mm,扫描频率为90 nm/min,间隔时间0.25 s条件下采用ChirascanqCD圆二色谱获取190~260 nm的远紫外圆二色谱。
1.4 数据与分析
数据采用Excel 2013和SPSS 22.0进行分析(LSD,P<0.05)和处理,实验均重复3次,数据以平均值±标准偏差表示。
2 结果与分析
2.1 pH偏移诱导对SLP结构影响分析
2.1.1 三级构象分析
由于一阶紫外光谱难以辨别蛋白微环境变化后各个芳香族氨基酸的贡献率,故使用紫外二级导数光谱辨别不同微环境条件下芳香族氨基酸暴露程度从而监测蛋白构象的变化[14]。pH偏移诱导SLP的二阶紫外导数光谱如图1-a所示。在280~300 nm存在2个正吸收峰(288和296 nm)和2个负吸收峰(283和291 nm),据文献报道,采用波峰和波谷距离“a”与“b”的比值“r”以及蓝移程度来判断pH偏移诱导后酪氨酸在SLP三级构象改变的贡献,r值越大表示酪氨酸和色氨酸暴露程度越大,即蛋白三级构象越松散[15]。

a-二阶导数光谱;b-二阶导数光谱的r值
图1 pH偏移诱导对SLP二阶导数紫外光谱影响
Fig.1 Effects of pH-shift induction on the second-derivative UV spectra of SLP
由图1-b可知,pH偏移诱导引起SLP的r值均大于天然状态的r值,且在诱导8~10 h后其r值趋于相对稳定状态,SLP酪氨酸和色氨酸暴露程度达到动态平衡,蛋白三级构象伸展趋于动态稳定。在0.5~8 h内r值变化规律不是很明显,可能是SLP非单一组分,且含有较高含量的磷脂成分,在初始偏移诱导处理阶段蛋白构象转换、蛋白质-溶剂热力学系统未达到平衡状态,因而r值变化相对无序[16]。这与周向军等[17]在蚕豆分离蛋白pH偏移过程中研究结果相一致。
图2-a为pH偏移诱导对SLP内源荧光光谱的影响,结果显示pH偏移诱导增加了SLP的内源荧光强度,且随着pH的减小伴随微小的蓝移,表明pH偏移诱导使得SLP表面分布更多的疏水性氨基酸,并在偏移处理8~10 h后SLP的内源荧光强度趋于相对稳定状态(图2-b)。
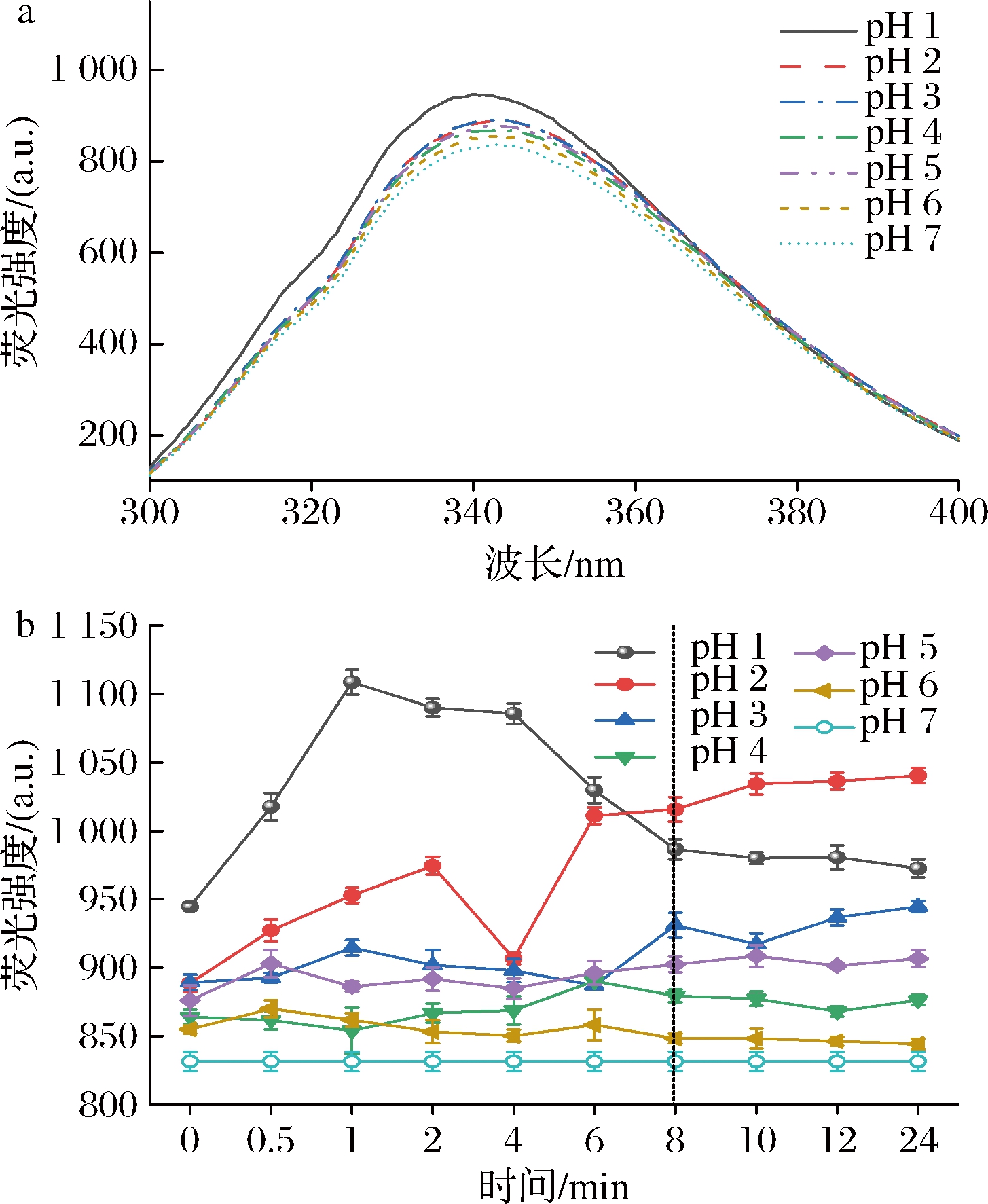
a-pH偏移诱导10 h时SLP的内源荧光光谱图; b-pH偏移诱导过程中SLP的最大内源荧光吸收值
图2 pH偏移诱导对SLP内源荧光光谱的影响
Fig.2 Effects of pH-shift induction on the intrinsic fluorescence spectra of SLP
外源荧光结果如图3-a所示,天然SLP具有最小的外源荧光强度和最大的λmax,随着pH的减小和诱导时间的增加,SLP外源荧光强度呈增加并趋于稳定趋势且伴随一定程度的蓝移;在诱导8~10 h后SLP外源荧光强度变化达到相对稳定状态(图3-b),表明大部分酪氨酸和色氨酸残基暴露于蛋白分子表面,蛋白三级构象变得更加松散。研究显示,在pH偏移诱导过程中蛋白主要发生以下3个主要反应:(1)蛋白大分子解聚而降低分子质量;(2)谷氨酸残基和精氨酸残基脱氨反应;(3)部分氨基酸降解。这些反应都增加了蛋白分子中羰基含量并影响疏水相互作用和静电引力,进而达到pH偏移诱导改变蛋白构象,最终使得埋藏于蛋白球形结构核心内部的疏水基团暴露于分子表面,因而使得表面疏水性增大[18]。这为调控和构造不同结构的SLP-多酚复合物及其应用提供了基础[19]。
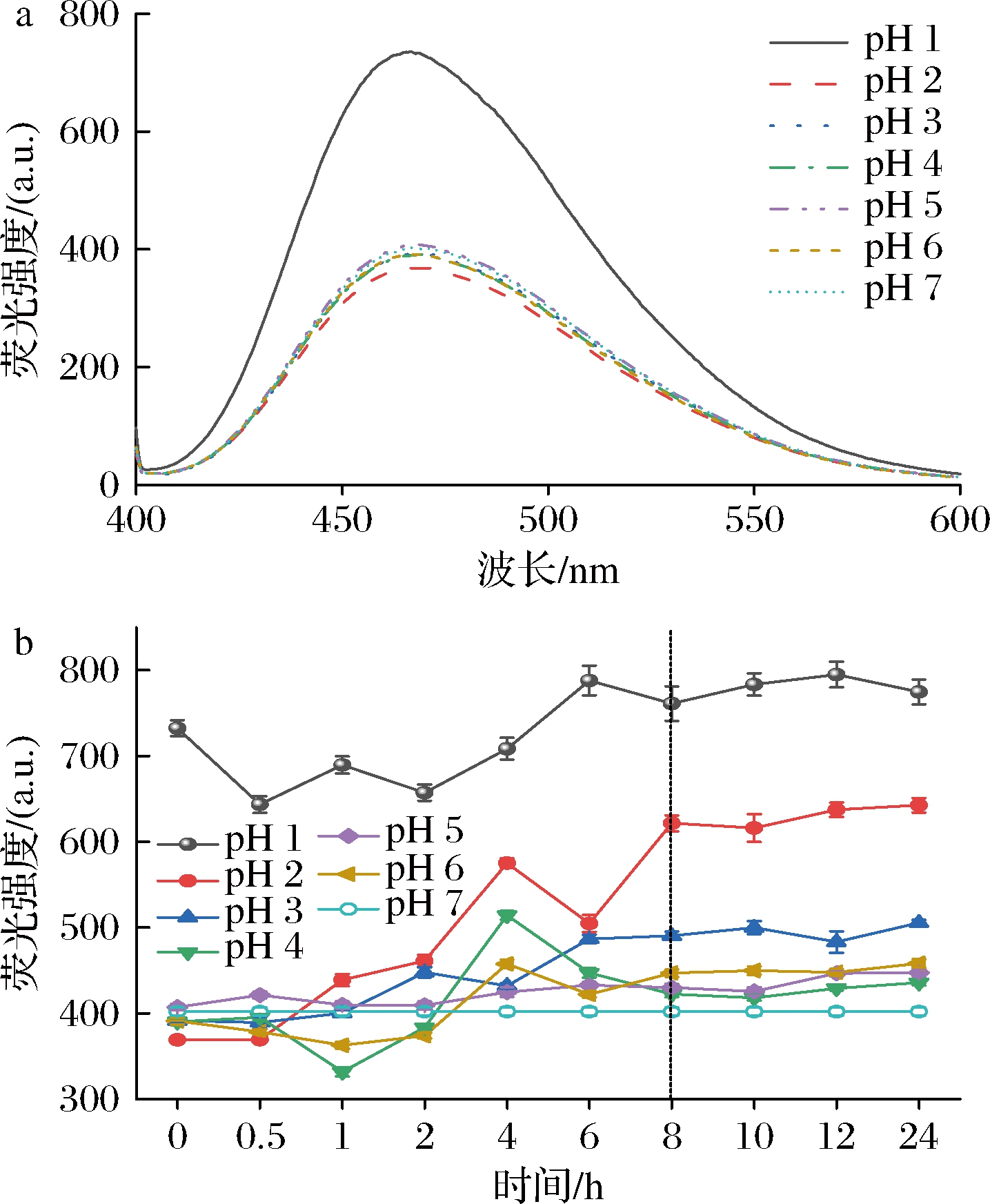
a-pH偏移诱导10 h时SLP的外源荧光光谱图; b-pH偏移诱导过程中SLP的最大外源荧光吸收值
图3 pH偏移诱导对SLP外源荧光光谱的影响
Fig.3 Effects of pH-shift induction on the extrinsic fluorescence spectra of SLP
2.1.2 二级构象分析
多肽和蛋白的红外光谱中有9个吸收谱带(酰胺A、B和酰胺I-VII)是多肽和蛋白碳骨架的特征吸收带,其中酰胺I带(1 700~1 600 cm-1)中的C![]() O基(1 650 cm-1)伸缩振动峰含有80%的肽键信息以及部分C—N反相位的伸缩振动和N—H面内振动,研究显示酰胺I带的振动频率与蛋白二级结构密切相关[14]。
O基(1 650 cm-1)伸缩振动峰含有80%的肽键信息以及部分C—N反相位的伸缩振动和N—H面内振动,研究显示酰胺I带的振动频率与蛋白二级结构密切相关[14]。
pH偏移诱导SLP的FTIR透射图谱、酰胺I带吸光图谱、Gauss曲线拟合图谱(以pH 7为例)、酰胺I带二阶导数吸光图谱和二级结构含量变化如图4所示。

a-红外透射光谱图;b-红外酰胺I带吸光图谱;c-pH 7偏移诱导10 h时SLP的Gauss曲线拟合图谱; d-红外酰胺I带二阶导数光谱;e-二级结构含量;f-圆二色谱图
图4 pH偏移诱导10 h时对SLP傅里叶红外光谱和圆二色谱的影响
Fig.4 Effects of pH-shift induction on the FTIR and CD spectra of SLP
由图4-e可知,由于pH 5偏移诱导处理最接近SLP等电点(pI 5.2),在该条件下的SLP分子间静电斥力减弱引起分子间聚集大幅度增加(18.15%)以及形成相对结构紧密的蛋白构象。天然SLP二级结构的α-螺旋主吸收振动峰在1 653 cm-1,随着pH偏移诱导pH值的减小(pH 7降至1),酰胺I带的二阶导数图谱显示α-螺旋特征峰在1 653 cm-1吸收强度呈减弱趋势,β-折叠特征峰1 612、1 623、1 638 cm-1逐渐增强;其中1 638、1 612 cm-1代表分子间和分子内聚集程度反向平行β-折叠结构的吸收强度呈下降趋势,分别由15.16%降至9.98%和5.71%将至3.98%。通过对酰胺I带进行Gauss多峰拟合求得SLP具体二级结构含量,发现α-螺旋相对含量由19.62%降低至12.67%;同时伴随着β-折叠含量呈逐渐增加趋势,其相对含量由34.06%增加至52.14%;与JIANG等[20]采用极端酸pH偏移诱导处理大豆蛋白发现α-螺旋含量减小而β-折叠含量增加结果相似。
进一步通过圆二色谱解析pH偏移诱导对SLP二级构象的影响(图4-f),CD图谱中208 nm处为α-螺旋特征峰、216 nm处为β-折叠特征峰,在pH 5偏移诱导处理的SLP圆二谱图性状和肩峰位置与天然态相比发生明显变化,该结果与红外表征结果相一致(图4-d),可能是由于接近SLP等电点(pI 5.2),SLP之间静电斥力减弱、分子内氢键被破坏同时疏水相互作用增加导致分子间聚集程度增大,而随着pH偏移的减小,pH偏移诱导SLP的CD在208和222 nm处肩峰吸收强度下降但峰型和位置没有发生明显变化,表明pH偏移诱导在一定程度上降低了SLP的α-螺旋结构含量而增加了β-折叠结构含量,该结果与FTIR的Gauss多峰拟合结果一致(图4-e)。这是因为随着偏移诱导pH的减小,游离的氢离子含量增加,大量的氢离子作用于SLP表面正电荷密度增强,使得蛋白表面亲水性侧链发生明显变化而引起蛋白结构伸展并暴露出疏水性残基,最终导致维系蛋白二级结构的氢键作用力被破坏,引起α-螺旋结构解旋进而暴露出更多的β-折叠及无规则卷曲结构[21]。研究发现在蛋白等电点附近诱导偏移处理同样能获得基本保持天然二级结构而三级结构松散的类似熔球态蛋白结构,如菠萝蛋白酶在等电点附近(pH 10)诱导4 h后能获得内源荧光和外源荧光强度增强并保持大量二级结构的特殊熔球态蛋白结构[9,22]。
2.1.3 热稳定性分析
pH偏移诱导对SLP构象热稳定性影响如图5所示,pH偏移诱导(10 h)后的SLP均显示出7S和11S球蛋白典型热吸收峰,SLP焓值和变性温度随着偏移诱导pH的减小呈现出先增大后降低的趋势,并在SLP等电点附近出现最大的变性温度和焓值,MOLINA等[23]和RENKEMA等[24]研究也显示向日葵和大豆的11S球蛋白在等电点附近变性温度和焓值达到最大值。在低pH偏移诱导条件下(pH 由5降到1)SLP的11S球蛋白变性峰温度由最大值97.27 ℃降至87.29 ℃、7S球蛋白变性峰温度由最大值76.77 ℃降至64.57 ℃,同时总焓值由最大值4.87 J/g减少至0.34 J/g,且均小于天然态;表明低pH偏移诱导引起11S球蛋白和7S球蛋白的六聚体和三聚体解聚,而蛋白分子部分展开和蛋白结构内部分子斥力增强造成SLP蛋白分子热稳定性下降;这与上文光谱解析pH偏移诱导对SLP蛋白构象影响结果一致。
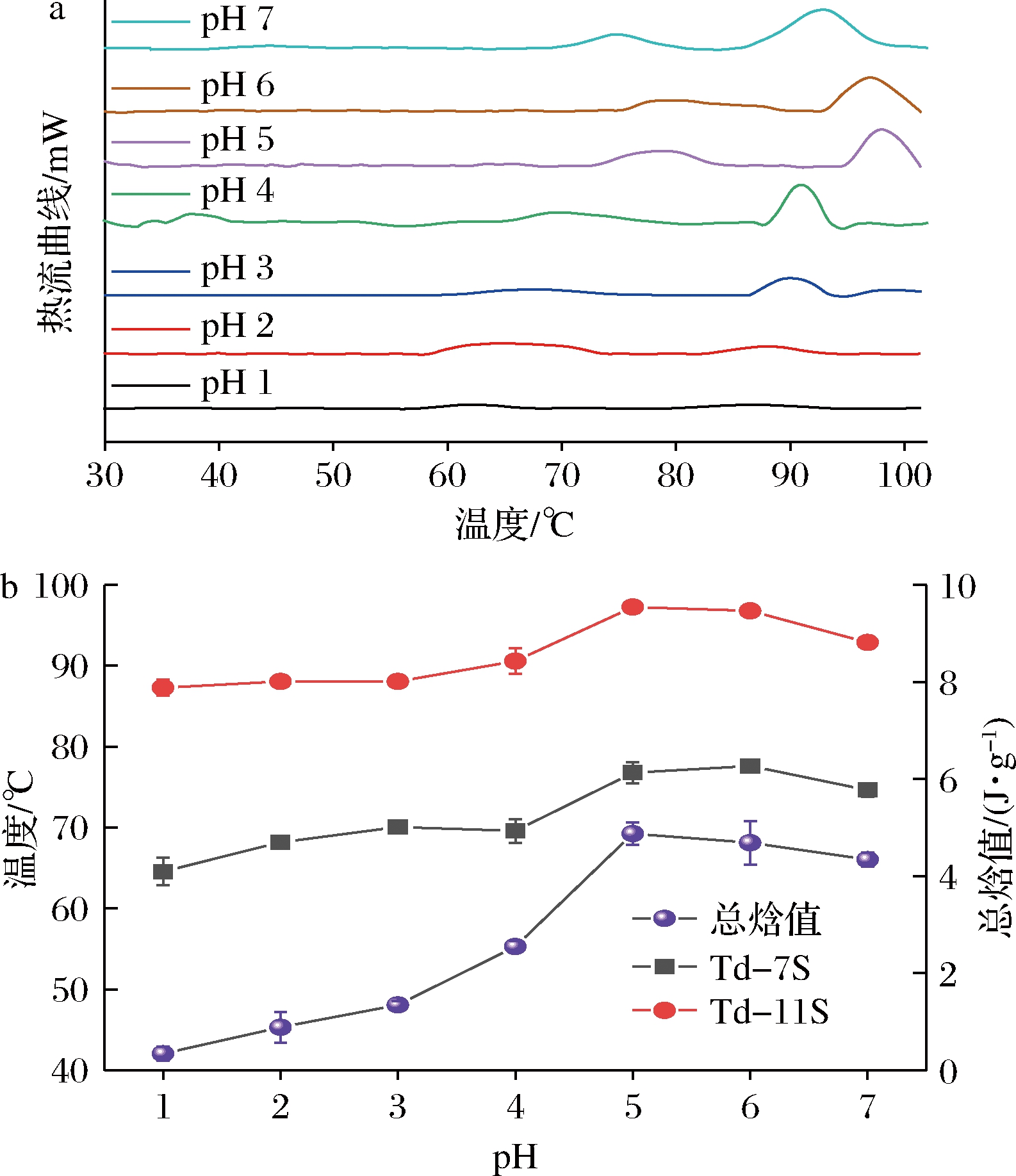
a-热流曲线图;b-变性温度和总焓值
图5 pH偏移诱导10 h时对SLP热稳定性影响
Fig.5 Effects of pH-shift induction on thermal stability of SLP
2.2 pH偏移诱导对SLP自组装纳米颗粒尺寸的影响
如图6所示,天然态SLP呈多峰分布,在10 000 nm附近有较大的分布;随着偏移诱导pH的减小,SLP流体动力学半径先增大后减小,并伴随着多分散系数下降,SLP粒径逐渐趋于单分布;在pH 4条件下诱导偏移处理的SLP颗粒呈窄的单峰分布且具有最大的流体动力学半径,表明在酸性环境诱导条件下,SLP分子结构内质子化程度增大,分子内部斥力增强,引起SLP紧凑的结构向无序状态展开,并在进一步的pH偏移诱导过程中SLP纳米颗粒发生自组装,形成形状较规则的球体纳米颗粒,其分子形态由无序聚集状态向粒径分布均匀、尺寸均一、形状规整的球形纳米颗粒转变,如图7所示。然而在pH 1和2 条件诱导处理的SLP流体动力学半径比天然态SLP要小,并伴随着在10 nm左右处的颗粒分布增多的现象,这是因为在极端酸性条件下,SLP分子中的11S六聚体和7S三聚体逐渐解聚引起SLP整体分子流体动力学半径减小。

a-SLP的粒径分布图;b-SLP的粒径图;c-SLP的图
图6 pH偏移诱导10 h时对SLP粒径和多分散系数的影响
Fig.6 Effects of pH-shift induction on the size and polydisperity index of SLP

图7 pH偏移诱导SLP自组装纳米颗粒行为示意图
Fig.7 Idealized schematic self-assembly of SLP by pH-shift induction
2.3 pH偏移诱导对SLP纳米颗粒微观形态影响
由图8可知,pH偏移诱导使SLP由无规则、大小不一、棱角分明且质地相对密实的块片状向纳米尺度的球形颗粒转变;因pH 5条件处最接近SLP等电点(pI 5.2),SLP分子表面净电荷最小、分子斥力减弱以及强烈的疏水相互作用使得SLP分子发生强烈的集聚效应而形成质地密实的颗粒。随着偏移诱导pH的减小,SLP体系中球形颗粒逐渐增多,在pH 4条件形成的球形颗粒分布较为均匀,而在极端pH条件形成的球形颗粒相对集中且尺寸较小。SCHMITT等[10]研究发现在100 nm扫描电镜下,在pH 4.6~7.0诱导的β-乳球蛋白纳米颗粒中,等电点附近(5.0)形成的纳米颗粒成团状,而接近中性pH 5.8~7.0 的β-乳球蛋白纳米颗粒呈现线状,pH也大,线状越突出,但是在低于等电点附近的pH 4.6的蛋白纳米颗粒呈现相对分布均匀的球形纳米颗粒,这与本研究基本一致,其差异为本研究在pH 5.0~7.0呈现片状和块状分布形貌,主要是由于本研究采用的扫描电镜精度过低(放大倍数为100 μm)造成的。此外,周向军等[17]在pH偏移结合温和热处理对蚕豆分离蛋白结构的影响中也发现类似的实验现象。

a-pH 1;b-pH 2;c-pH 3;d-pH 4;e-pH 5;f-pH 6;g-pH 7
图8 不同pH偏移诱导10 h对SLP自组装纳米颗粒 微观形貌的影响
Fig.8 Effects of pH-shift induction on SLP self-assembly particles by SEM
2.4 pH偏移诱导对SLP乳化特性的影响
2.4.1 pH偏移诱导对SLP蛋白溶解性的影响
如图9所示,pH 1诱导处理的SLP溶解度比天然的SLP大(45%),可能是在极端酸性条件下SLP蛋白分子解聚形成小分子质量亚基从而提高溶解度;随着pH偏移诱导pH由2增大到6,SLP溶解度逐渐减小,可能是pH偏移诱导处理使得SLP蛋白结构部分去折叠、结构伸展,更多的疏水性氨基酸残基暴露于蛋白表面,引起SLP表面疏水性增强,并在溶液体系中通过疏水相互作用形成溶解度差的大分子聚集体,从而造成SLP蛋白溶解度下降,与其他学者[20,25-26]发现pH偏移诱导引起SPI溶解度降低结果相符。

图9 pH偏移诱导(10 h)对SLP蛋白溶解特性的影响
Fig.9 Effects of pH-shift induction (10 h) on the protein solubility of SLP
注:不同小写字母表示在P<0.05水平存在显著性差异
2.4.2 pH偏移诱导对SLP柔性影响
如图10所示,在等电点附近(pH 5)处理的SLP因处于净电荷基本为零、由于分子间斥力降低而引起强烈的聚集效应形成紧凑的三级构象,从而导致SLP柔性最小;试验结果显示pH偏移诱导能使蛋白结构部分去折叠、结构展开从而有效降低SLP蛋白刚性结构,从而导致SLP柔性增强[13]。

图10 pH偏移诱导(10 h)对SLP分子柔性的影响
Fig.10 Effects of pH-shift induction (10 h) on the molecule flexibility of SLP
2.4.3 pH偏移诱导对SLP乳化特性的影响
由图11可知,在pH 5条件下诱导的SLP由于净电荷接近零,分子间斥力降低而引起强烈的聚集效应形成大量难溶性大分子聚集物,降低溶解度,并使SLP构象密实刚性增强而柔性降低。与天然SLP相比,pH偏移诱导处理提高了SLP乳化活性和乳化稳定性;这可能归功于:pH偏移诱导处理使得蛋白结构部分去折叠、结构伸展,蛋白结构刚性下降而柔性增加,更有利于蛋白分子迅速吸附在油水界面膜上;而且结构伸展后暴露出更多疏水性氨基酸,使得蛋白表面疏水性增强从而提高了SLP表面活性,这与紫外光谱和荧光光谱分析结果相一致;而且SLP构象伸展以及解聚后暴露出埋藏于内部的磷脂和oleosin进一步提高了SLP的乳化功能特性。其他学者[20,25-26]也发现大豆分离蛋白和黑芸豆分离蛋白经pH偏移诱导处理能提高其乳化功能特性。

图11 pH偏移诱导(10 h)对SLP乳化特性的影响
Fig.11 Effects of pH-shift induction (10 h) on the emulsibility of SLP
此外,在pH 4偏移诱导处理的SLP乳化功能特性表现突出,除了上述原因外,还可能与pH偏移诱导过程中SLP纳米颗粒发生自组装,形成形状较规则的球体纳米颗粒,其分子形态由无序聚集状态向粒径分布均匀、尺寸均一、形状规整的球形纳米颗粒转变有关,因为颗粒均一的蛋白分子能迅速吸附,并形成稳定的油水界面膜从而提高乳化活性和乳化稳定性[27];且研究表明,在等电点附近诱导处理的蛋白具有较大电荷补丁和良好吸附能力的多孔纳米材料[22, 28]。
3 结论与讨论
本实验联合多光谱、热分析和动态光散射等技术,研究了pH偏移诱导SLP解离缔合行为并对其自组装纳米颗粒进行表征,通过观察不同pH条件下(pH 1~6)SLP蛋白三级构象的影响,详细分析了pH偏移诱导10 h对SLP蛋白构象、流体动力学半径、热稳定性和乳化特性的影响。实验结果表明,通过荧光光谱和紫外二阶导数光谱分析发现pH偏移诱导使得SLP蛋白结构经历去折叠、单带亚基解离以及再聚集过程,大约10 h后SLP构象趋于稳定状态,最终使得pH偏移诱导后的SLP蛋白表面分布更多的酪氨酸和色氨酸并且具有松散三维构象。SLP经pH偏移诱导10 h后,蛋白表面亲水性侧链发生明显变化而最终导致维系蛋白二级结构的氢键作用力被破坏,引起α-螺旋结构解旋,含量下降,而β-折叠含量增加;同时DSC结果显示在等电点处SLP具有最大的抗变性能力,而pH偏移诱导能诱发SLP聚集体解聚、蛋白结构伸展而引起热稳定性下降。pH偏移诱导过程中SLP纳米颗粒发生自组装,形成形状较规则和尺寸均一的球体纳米颗粒,其分子形态由无序聚集状态向粒径分布均匀状态转变,在pH 4条件下诱导偏移处理的SLP颗粒呈较窄的正态分布且具有最大的流体动力学半径,并呈现出良好的分子柔性和乳化特性。
[1] 曾剑华, 刘琳琳, 杨杨, 等.大豆亲脂蛋白组分分析及体外抗氧化特性[J].食品科学, 2020, 41(14):58-65.
ZENG J H, LIU L L, YANG Y, et al.Composition and in vitro antioxidant properties of soy lipophilic protein[J].Food Science, 2020, 41(14):58-65.
[2] MATSUMURA Y, SIRISON J, ISHI T, et al.Soybean lipophilic proteins:Origin and functional properties as affected by interaction with storage proteins[J].Current Opinion in Colloid & Interface Science, 2017, 28:120-128.
[3] WANG D Q, QI B K, XU Q Q, et al.Effect of salt ions on an ultrasonically modified soybean lipophilic protein nanoemulsion[J].International Journal of Food Science & Technology, 2021, 56(12):6 719-6 731.
[4] LI L J, HE M Y, YANG H D, et al.Effect of soybean lipophilic protein-methyl cellulose complex on the stability and digestive properties of water-in-oil-in-water emulsion containing vitamin B12[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2021, 629:127364.
[5] ZHONG M M, SUN Y F, SUN Y D, et al.Sodium dodecyl sulfate-dependent disassembly and reassembly of soybean lipophilic protein nanoparticles:An environmentally friendly nanocarrier for resveratrol[J].Journal of Agricultural and Food Chemistry, 2022, 70(5):1 640-1 651.
[6] 朱秀清, 衣程远, 刘琳琳, 等.超声诱导大豆亲脂蛋白复合姜黄素及其特性研究[J].食品与发酵工业, 2022, 48(3):115-122.
ZHU X Q, YI C Y, LIU L L, et al.Embedding curcumin with soybean lipophilic protein induced by ultrasonic treatment and the analysis of its properties[J].Food and Fermentation Industries, 2022, 48(3):115-122.
[7] MEISL G, MICHAELS T C, AROSIO P, et al.Dynamics and Control of Peptide Self-Assembly and Aggregation[M].Biological and Bioinspired Nanomaterials.Springer, 2019:1-33.
[8] PAULSON J A, MESBAH A, ZHU X X, et al.Control of self-assembly in micro- and nano-scale systems[J].Journal of Process Control, 2015, 27:38-49.
[9] DAVE S, MAHAJAN S, CHANDRA V, et al.Trifluoroethanol stabilizes the molten globule state and induces non-amyloidic turbidity in stem bromelain near its isoelectric point[J].International Journal of Biological Macromolecules, 2011, 49(4):536-542.
[10] SCHMITT C, BOVAY C, VUILLIOMENET A M, et al.Multiscale characterization of individualized β-lactoglobulin microgels formed upon heat treatment under narrow pH range conditions[J].Langmuir, 2009, 25(14):7 899-7 909.
[11] 孙冰玉, 刘琳琳, 石彦国,等.大豆亲脂蛋白热诱导解离缔合及自组装纳米颗粒表征[J].农业机械学报, 2021, 52(2):346-354.
SUN B Y, LIU L L, SHI Y G, et al.Characterization of dissociation-association behavior and self-assembly nanoparticles of soybean lipophilic protein by heating induction[J].Transactions of the Chinese Society for Agricultural Machinery, 2021, 52(2):346-354.
[12] GAO H, MA L, LI T Q, et al.Impact of ultrasonic power on the structure and emulsifying properties of whey protein isolate under various pH conditions[J].Process Biochemistry, 2019, 81:113-122.
[13] XU Y Y, WANG G R, WANG X B, et al.Effects of homogenization on the molecular flexibility and emulsifying properties of soy protein isolate[J].Food Science and Biotechnology, 2018, 27(5):1 293-1 299.
[14] GÜLER G, VOROB’EV M M, VOGEL V, et al.Proteolytically-induced changes of secondary structural protein conformation of bovine serum albumin monitored by Fourier transform infrared (FT-IR) and UV-circular dichroism spectroscopy[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2016, 161:8-18.
[15] WANG K Q, SUN D W, PU H B, et al.Principles and applications of spectroscopic techniques for evaluating food protein conformational changes:A review[J].Trends in Food Science & Technology, 2017, 67:207-219.
[16] CHANG C H, NIU F G, SU Y J, et al.Characteristics and emulsifying properties of acid and acid-heat induced egg white protein[J].Food Hydrocolloids, 2016, 54:342-350.
[17] 周向军, 董瑞红, 高义霞.pH偏移结合温和热处理对蚕豆分离蛋白结构和功能的影响[J].食品与发酵工业, 2019, 45(1):100-108.
ZHOU X J,DONG R H,GAO Y X.Effects of pH-shifting combined with mild heating processes on structural and functional properties of broad bean protein isolates[J].Food and Fermentation Industries, 2019, 45(1):100-108.
[18] LEE H, YILDIZ G, DOS SANTOS L C, et al.Soy protein nano-aggregates with improved functional properties prepared by sequential pH treatment and ultrasonication[J].Food Hydrocolloids, 2016, 55:200-209.
[19] TANG C H.Nanostructured soy proteins:Fabrication and applications as delivery systems for bioactives (a review)[J].Food Hydrocolloids, 2019, 91:92-116.
[20] JIANG J, XIONG Y L, CHEN J.pH Shifting alters solubility characteristics and thermal stability of soy protein isolate and its globulin fractions in different pH, salt concentration, and temperature conditions[J].Journal of Agricultural and Food Chemistry, 2010, 58(13):8 035-8 042.
[21] 张玉姣, 唐乾, 曹洪玉,等.酸诱导拥挤条件下肌红蛋白及突变体去折叠过程[J].物理化学学报, 2013, 29(8):1 785-1 792.
ZHANG Y J, TANG Q, CAO H Y, et al.Acid-induced unfolding process of myoglobin and its mutant under macromolecular crowding conditions[J].Acta Physico-Chimica Sinica, 2013, 29(8):1 785-1 792.
[22] DAVE S, MAHAJAN S, CHANDRA V, et al.Specific molten globule conformation of stem bromelain at alkaline pH[J].Archives of Biochemistry and Biophysics, 2010, 499(1-2):26-31.
[23] MOLINA M I, PETRUCCELLI S, A
 N M C.Effect of pH and ionic strength modifications on thermal denaturation of the 11S globulin of sunflower (Helianthus annuus)[J].Journal of Agricultural and Food Chemistry, 2004, 52(19):6 023-6 029.
N M C.Effect of pH and ionic strength modifications on thermal denaturation of the 11S globulin of sunflower (Helianthus annuus)[J].Journal of Agricultural and Food Chemistry, 2004, 52(19):6 023-6 029.
[24] RENKEMA J M S, GRUPPEN H, VAN VLIET T.Influence of pH and ionic strength on heat-induced formation and rheological properties of soy protein gels in relation to denaturation and their protein compositions[J].Journal of Agricultural and Food Chemistry, 2002, 50(21):6 064-6 071.
[25] 杨昱, 雷泽夏, 白靖文, 等.极端pH处理对大豆分离蛋白、β-伴大豆球蛋白、大豆球蛋白结构和功能特性的影响[J].中国食品学报, 2018, 18(7):306-313.
YANG Y, LEI Z X, BAI J W, et al.Effect of extreme pH treatment on the structure and functional properties of soybean protein, β-conglycinin and glycinin[J].Journal of Chinese Institute of Food Science and Technology, 2018, 18(7):306-313.
[26] LIU Q, GENG R, ZHAO J Y, et al.Structural and gel textural properties of soy protein isolate when subjected to extreme acid pH-shifting and mild heating processes[J].Journal of Agricultural and Food Chemistry, 2015, 63(19):4 853-4 861.
[27] TANG C H.Emulsifying properties of soy proteins:A critical review with emphasis on the role of conformational flexibility[J].Critical Reviews in Food Science and Nutrition, 2017, 57(12):2 636-2 679.
[28] DE VRIES R.Monte Carlo simulations of flexible polyanions complexing with whey proteins at their isoelectric point[J].The Journal of Chemical Physics, 2004, 120(7):3 475-3 481.