南极磷虾(Euphausia superba)是一种主要分布在南冰洋的浮游生物,其总生物量超过8亿t,体内富含高质量蛋白和活性物质,具有很高的开发利用价值[1-3]。目前南极磷虾产品主要有南极磷虾粉、生物活性肽和南极磷虾油等[4-5]。南极磷虾粉作为销售量最高的南极磷虾产品,经乙醇提取南极磷虾油后形成脱脂南极磷虾粉,通常被厂家作为饲料蛋白源直接售卖给饲料企业[6]。随着南极磷虾渔业及生产加工技术的发展和社会对高附加值南极磷虾产品需求的增加,充分利用南极磷虾资源开发海洋保健食品、药物和生物制品将是南极磷虾产业健康发展的重要方向之一,也是海洋生物资源有效利用亟待解决的问题。
以获取南极磷虾生物活性肽为目的,利用蛋白酶水解脱脂南极磷虾粉是提高其附加值的一种有效方法。近年来,相关研究表明一些蛋白酶解物具有影响细胞生长代谢、生物合成及蛋白表达的功能[7]。其主要原因是蛋白酶解液中的寡肽不仅为细胞生长提供易分解的氮源,还能够提供多种营养成分、贴壁因子及生长因子类似物等,且不同类型蛋白酶解物对细胞生长和提高靶向蛋白产量具有协同作用[8]。
经脱芳和分离纯化处理后的蛋白酶解物可制备出高F值寡肽,这类寡肽一般是由3~9个氨基酸残基所组成的寡肽混合物,其相对分子质量在0.2~0.6 kDa,且支链氨基酸(branched chain amino acid, BCAA),即亮氨酸、异亮氨酸和缬氨酸,与芳香族氨基酸(aromatic amino acid, AAA),即苯丙氨酸、色氨酸和酪氨酸的物质的量比值大于20[9]。高F值寡肽具有辅助治疗肝性脑病、改善营养状态、降低血氨、抗疲劳、解酒等功能[10-13]。
本研究以萃取南极磷虾油后的脱脂南极磷虾粉为原料,通过碱性蛋白酶和复合风味蛋白酶二次酶解工艺提升脱脂南极磷虾粉的酶解效率,并利用活性炭吸附技术脱除芳香族氨基酸,制备南极磷虾高F值小分子肽(Antarctic krill peptides with high-Fischer ratio, HF-AKP)。并以人肝癌细胞株HepG2为研究对象,探讨HF-AKP对体外培养的HepG2细胞生长、凋亡周期和细胞凋亡相关蛋白表达情况的影响。旨在为提升脱脂南极磷虾粉的附加值,为高F值南极磷虾生物活性肽的产业化开发利用提供理论和技术支持。
1 实验方法
1.1 材料与试剂
脱脂南极磷虾粉由威海市宇王集团有限公司提供(总蛋白含量为74.2%,水分含量为4.9%);Alcalase® 2.4 L碱性蛋白酶(1.2×105 U/g)、Flavourzyme® 500MG复合风味蛋白酶(2.9×104 U/g),诺维信公司;甲醛、NaOH、HCl,国药集团化学试剂有限公司;活性炭(200目),上海鑫汇活性炭有限公司;Cell Counting Kit-8试剂盒(C0037)、PI细胞周期、细胞凋亡检测试剂盒(C1052)、蛋白裂解液(P0012S),碧云天生物技术有限公司;DMEM细胞培养基、胎牛血清、0.25%胰蛋白酶、青-链霉素、5-氟尿嘧啶(5-fluorouracil,5-FU)、HepG2细胞、人Bcl-2检测试剂盒(ELISA)、Bax检测试剂盒(ELISA)、人核因子κB(nuclear factor κB,NF-κB)试剂盒(ELISA),上海圆创生物科技有限公司。
1.2 仪器设备
Kjeltec TM 2200凯氏定氮仪,丹麦福斯公司;CF16RXII高速冷冻离心机,日本日立集团;Power wave XS酶标仪,美国BioTek公司;PHSJ-3F pH计,上海精密科学仪器有限公司;Minimate TFF system切向流超滤装置,美国PALL公司;VIVAFLOW 50 R超滤膜包,德国赛利多斯公司;8000细胞培养箱,美国赛默飞世尔科技;FACSVerse流式细胞仪,美国BD公司。
1.3 实验方法
1.3.1 HF-AKP的制备
脱脂南极磷虾粉(浸泡,粉碎) → 碱性蛋白酶[料液比1∶17.5(g∶mL),加酶量5.0%(质量分数,下同),温度55 ℃,酶解6 h]→复合风味蛋白酶(加酶量4.0%,酶解3 h,温度50 ℃)→沸水灭活12 min→离心(5 000 r/min,15 min)→上清超滤纳滤(<5 kDa,Antarctic krill peptides,AKP)→活性炭(7.0%,1.5 h)吸附→离心(8 000 r/min,5 min)→HF-AKP
1.3.2 水解度(degree of hydrolysis,DH)的测定
DH测定参考李明杰等[14]的方法,按照公式(1)计算。公式(1)中酶解上清液中的氨基酸态氮含量参照GB/T 5009.39—2003《食品安全国家标准 酱油卫生标准的分析方法》甲醛电位滴定法测定,总氮含量参照GB/T 5009.5—2010《食品安全国家标准 食品中蛋白质的测定》凯氏定氮法测定。
(1)
1.3.3 碱性蛋白酶酶解条件优化
试管内加入2.0 g脱脂南极磷虾粉,以料液比1∶15.0(g∶mL)、加酶量5.0%、酶解温度50 ℃、时间3 h(pH=7.0)为起始最优条件,进行单因素优化实验。本研究中,以DH为检测指标,碱性蛋白酶酶解条件优化选取料液比(A)、加酶量(B)、酶解温度(C)和酶解时间(D)为单因素指标(表1),根据单因素试验结果,选取各因素最优水平,对碱性蛋白酶酶解的L9(34)正交试验(表2)进行优化。
表1 碱性蛋白酶酶解条件单因素水平表
Table 1 Factors and levels of single hydrolysis conditions for Alacalase

水平因素A(料液比)/(g∶mL)B(加酶量)/%C(温度)/℃D(时间)/h11∶10.02.040221∶12.53.045331∶15.04.050441∶17.55.055551∶20.06.0606
表2 碱性蛋白酶酶解条件L9(34)正交因素水平表
Table 2 Factors and levels of L9(34) orthogonal hydrolysis conditions for Alacalase
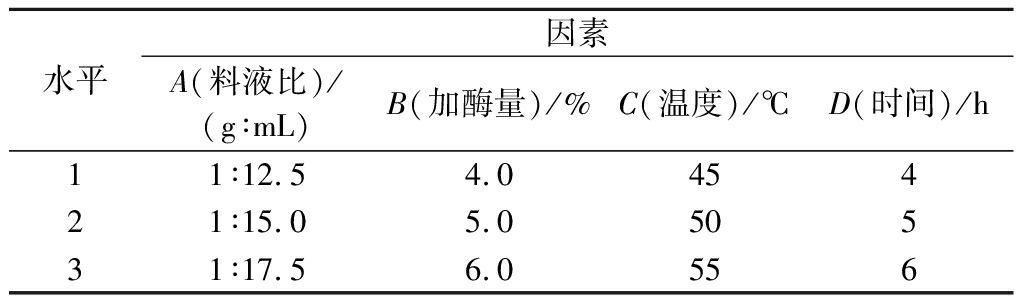
水平因素A(料液比)/(g∶mL)B(加酶量)/%C(温度)/℃D(时间)/h11∶12.54.045421∶15.05.050531∶17.56.0556
1.3.4 复合风味蛋白酶二次酶解条件及优化
在碱性蛋白酶最优条件酶解基础上,以加酶量3.0%,时间3 h为起始最优条件,进行单因素优化实验(温度50 ℃,pH=7.0)。以DH为指标,筛选复合风味蛋白酶二次酶解的最佳加酶量和酶解时间,各因素对应水平见表3。
表3 复合风味蛋白酶酶解条件单因素水平表
Table 3 Factors and levels of single hydrolysis conditions for Flavourzyme

因素水平12345A(加酶量)/%0.01.02.03.04.0B(时间)/ h2345
1.3.5 氨基酸组成及F值测定
参照GB/T 5009.124—2003《食品安全国家标准 食品中氨基酸的测定》分析HF-AKP的氨基酸组成。根据公式(2)计算F值。
(2)
式中:MVal,缬氨酸摩尔浓度;MIle,亮氨酸摩尔浓度;MLeu,异亮氨酸摩尔浓度;MTyr,酪氨酸摩尔浓度;MPhe,苯丙氨酸摩尔浓度;MTrp,色氨酸摩尔浓度。
1.3.6 HF-AKP对HepG2细胞生长的影响
参照陈永强等[15]的方法,对人肝癌细胞株HepG2细胞进行培养。用CCK-8法测定HF-AKP对HepG2细胞生长的影响,参考陈永强等[15]的方法并稍作修改:将生长到对数期的HepG2细胞稀释至5.0×104 cells/mL,接种100.0 μL到96孔板,在37 ℃、5.0%的CO2培养箱内培养24 h和48 h。将HF-AKP加入到培养后的HepG2细胞使终质量浓度分别达到40.9、81.8、163.6 mg/L,补足体积至200.0 μL,此为实验组;加入100.0 μL的PBS和终质量浓度为20.0 mg/L的5-FU分别为空白和阳性对照组。将HepG2细胞放置于37 ℃,5.0% CO2培养箱内培养24 h后加入20.0 μL的CCK-8在相同条件下避光孵育3 h,在450 nm下测定同一时间点吸光度。由预实验可知,HF-AKP对HepG2细胞生长有抑制作用,因此,按公式(3)计算细胞增殖抑制率:
细胞增殖抑制率![]()
(3)
1.3.7 PI/RNase单染检测凋亡周期
调整细胞浓度为5.0×105 cells/mL,接种于6孔细胞培养板,37 ℃,5.0% CO2培养箱内培养24 h,吸取HF-AKP和5-FU加入到完全培养基中,使其终质量浓度分别为163.6和20.0 mg/L,补足每个孔的培养基至总体积为200.0 μL,另设置阴性对照组培养。后续参照李娜等[16]的方法操作,用流式细胞仪检测HF-AKP和5-FU对HepG2细胞凋亡周期的影响。
1.3.8 ELISA检测NF-κB、Bcl-2及Bax蛋白的表达水平
细胞培养方法同1.3.7,离心收集各组细胞的上清液,根据试剂盒说明书检测细胞上清液中NF-κB、Bcl-2及Bax蛋白的含量。
1.3.9 数据分析
实验中所有数据均进行3次平行测定,用平均值±方差来表示。采用单因素方差分析(ANOVA)对各组间数值进行统计分析,然后采用SPSS进行Duncan多重比较,P<0.05表示统计学上差异显著。
2 结果与分析
2.1 酶解条件的优化
2.1.1 碱性蛋白酶酶解条件的优化
从图1-a可知,随着料液比(g∶mL,下同)的增加,DH显著增加(图1-a)。当料液比继续增加到1∶20.0时,DH达到最大值(9.9±0.1)%,但其与在料液比为1∶15.0、1∶17.5时的DH无显著差异(P>0.05)。考虑到反应体系中水相过多会对后续酶解液浓缩及真空干燥步骤造成较大影响,因此选择1∶12.5、1∶15.0、1∶17.5作为正交试验料液比因素的三水平。同时,随着加酶量的增加,总体DH也显著增加(P<0.05),在加酶量6.0%处达到最大值(10.1±0.4)%(图1-b)。考虑到蛋白酶制剂的经济成本和DH增值的大小,选择4.0%、5.0%、6.0%为正交试验加酶量因素的三水平。随着温度和时间的增加,DH显著增加(P<0.05)(图1-c和图1-d)。在60 ℃时,DH达到最大值(9.2±0.1)%;但温度由55 ℃增加到60 ℃时,DH增长不显著(P>0.05)。在6 h达到最大值(10.2±0.3)%,5~6 h的DH变化无显著差异(P>0.05)。考虑到能量损耗和工艺时长等因素,选择酶解温度45、50、55 ℃和酶解时间4、5、6 h作为后续正交试验的单因素水平。
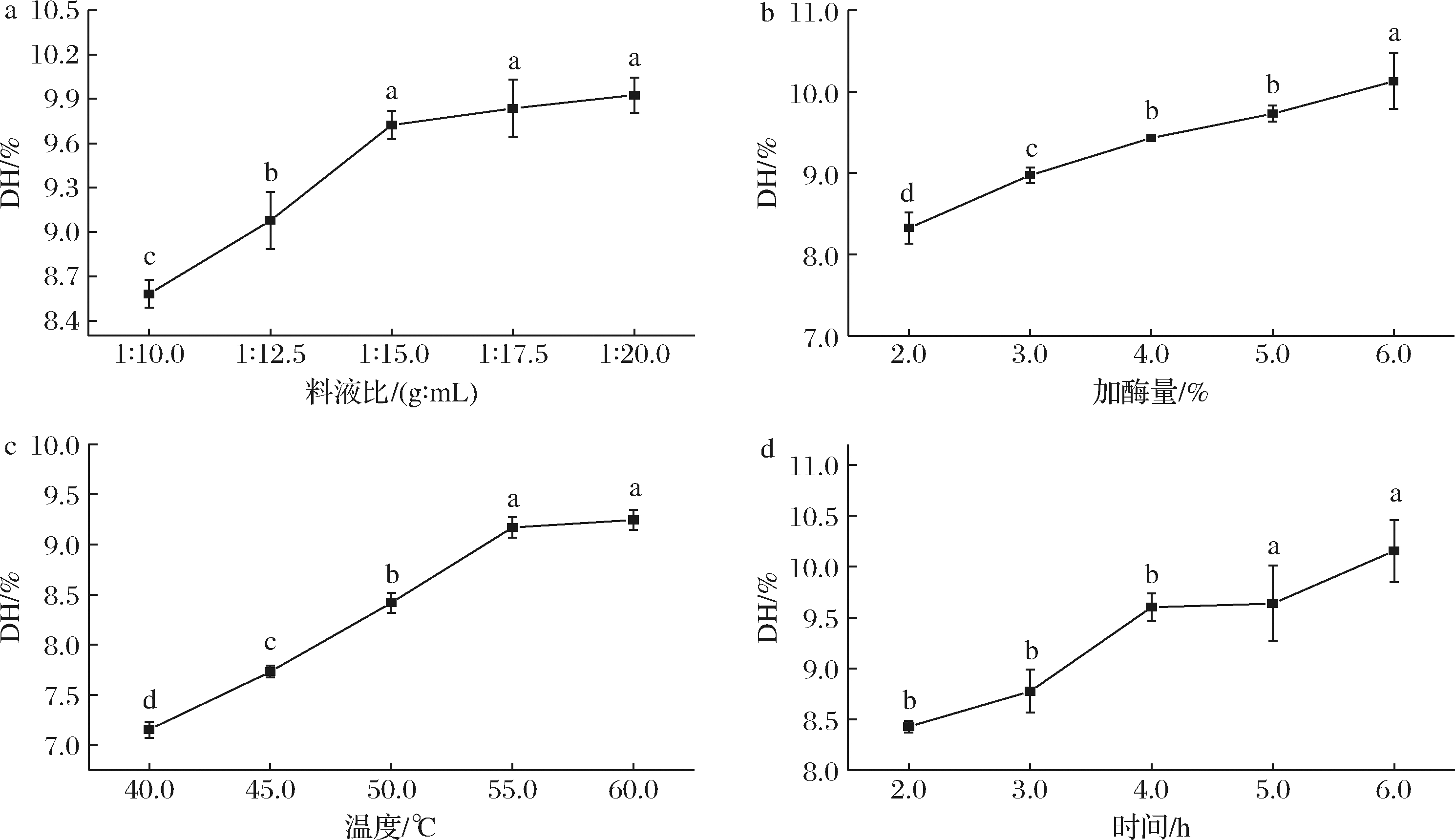
a-料液比;b-加酶量;c-温度;d-时间
图1 碱性蛋白酶的单因素酶解工艺参数优化
Fig.1 Optimization of single factor enzymatic hydrolysis conditions for Alacalase
注:不同字母表示具有显著差异(P<0.05,下同)
碱性蛋白酶在不同因素条件下酶解工艺条件优化结果见表4和表5。
表4 碱性蛋白酶正交试验L9(34)结果
Table 4 Results of orthogonal test L9(34) for Alacalase

序列因素A/(g·mL-1)B/%C/℃D/hDH/%11∶12.54.04547.7±0.021∶12.55.05059.0±0.231∶12.56.055610.0±0.241∶15.04.05069.3±0.151∶15.05.05549.6±0.261∶15.06.04559.4±0.171∶17.54.055510.0±0.181∶17.55.045610.4±0.191∶17.56.05049.4±0.2K18.98.99.18.9K29.49.69.29.4K310.09.59.89.9R1.10.70.71.0
表5 碱性蛋白酶正交试验L9(34)方差分析结果
Table 5 Results of orthogonal test L9(34) variance analysis for Alacalase

方差来源偏差平方和自由度F值P值A/(g·mL-1)1.72.01.4<0.05B/%0.82.00.7<0.05C/℃1.52.01.2<0.05D/h0.82.00.7<0.05误差4.88.0
注:F0.05(2,8)=4.5
实验结果显示,4个因素均对酶解效率有显著影响,其F值均小于F临界值(P<0.05)。4个因素条件对南极磷虾粉DH影响程度依次是A>D>B=C。因此,实验确立碱性蛋白酶酶解最优条件为A3B2C3D3,即料液比为1∶17.5,加酶量5.0%,温度55 ℃,时间6 h。此条件下进行平行试验,DH值为(10.7±0.2)%。
2.1.2 复合风味蛋白酶二次酶解及优化
目前国内外制备海洋动物蛋白源高F值寡肽多采用复合风味蛋白酶进行二次酶解,从而提高酶解产物得率[17]。此外复合风味蛋白酶具有水解肽链端疏水氨基酸的特点,可以实现去除酶解液中苦味的目的。本课题组前期研究结果表明,利用复合风味蛋白酶获得的酶解液风味最佳,并且可以减少苦味氨基酸含量[18]。
图2-a结果显示,DH随复合风味蛋白酶量的增加而显著增加(P<0.05)。在加酶量4.0%时DH达到最大值(17.3±0.2)%。根据DH的大小,选择复合风味蛋白酶最佳加酶量为4.0%。同时,DH随着复合风味蛋白酶酶解时间的延长而增大(图2-b),在酶解5 h达到最大DH值(18.2±0.6)%,但酶解时间从3 h增加到5 h,DH无显著差异(P>0.05)。综合考虑,选择复合风味蛋白酶的最佳条件为加酶量4.0%,酶解3 h。

a-加酶量;b-时间
图2 复合风味蛋白酶酶解条件参数优化
Fig.2 Optimization of enzymatic hydrolysis conditions for Flavourzyme
2.2 AKP(<5 kDa)的吸附脱芳处理
目前酶解液脱芳多采用活性炭吸附法[19-20],活性炭具有很高的吸附效率,对疏水性化合物的亲和力极高,在支链氨基酸和芳香族氨基酸同时存在的情况下,会优先吸附芳香族氨基酸[21]。因此,本研究中将二次酶解产物经超滤膜(5 kDa)和纳滤膜(500 Da)过滤,得到脱脂南极磷虾小分子肽混合物(<5 kDa,AKP),再通过一定量的活性炭对芳香族氨基酸进行吸附,得到HF-AKP。
由表6可知,AKP经活性炭处理后,芳香族氨基酸中酪氨酸(Tyr)、苯丙氨酸(Phe)、色氨酸(Trp)的含量分别从(34.0±1.2)、(43.7±2.5)、(6.7±0.1) μmol/mL降低到(0.9±0.2)、(1.1±0.0)、0.0 μmol/mL,支链氨基酸与芳香族氨基酸的摩尔比(F值)由2.4±0.2上升至87.2±0.7,且HF-AKP中苯丙氨酸(Phe)和酪氨酸(Tyr)含量为(0.37±0.1)%,这两个数值(F值>20.0,Phe+Tyr含量<2.0%)说明HF-AKP符合高F值小分子肽的要求[22]。
表6 脱脂南极磷虾酶解液(<5 kDa)脱芳 前后氨基酸组成分析 单位:μmol/mL
Table 6 Analysis of amino acid composition of skim antarctic krill protein enzyme-hydrolysates(<5 kDa) before and after dearomatization
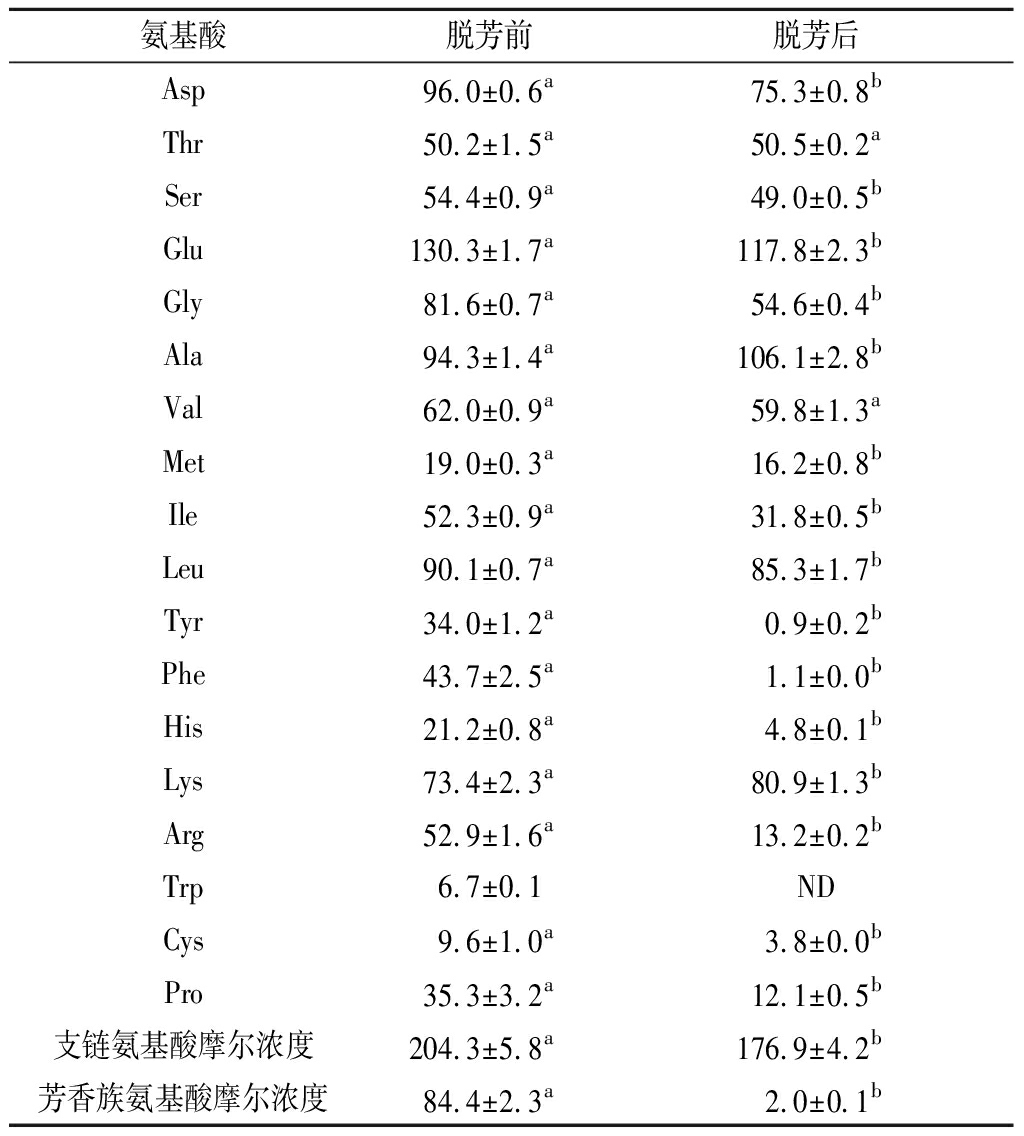
氨基酸脱芳前脱芳后Asp96.0±0.6a75.3±0.8bThr50.2±1.5a50.5±0.2aSer54.4±0.9a49.0±0.5bGlu130.3±1.7a117.8±2.3bGly81.6±0.7a54.6±0.4bAla94.3±1.4a106.1±2.8bVal62.0±0.9a59.8±1.3aMet19.0±0.3a16.2±0.8bIle52.3±0.9a31.8±0.5bLeu90.1±0.7a85.3±1.7bTyr34.0±1.2a0.9±0.2bPhe43.7±2.5a1.1±0.0bHis21.2±0.8a4.8±0.1bLys73.4±2.3a80.9±1.3bArg52.9±1.6a13.2±0.2bTrp6.7±0.1NDCys9.6±1.0a3.8±0.0bPro35.3±3.2a12.1±0.5b支链氨基酸摩尔浓度204.3±5.8a176.9±4.2b芳香族氨基酸摩尔浓度84.4±2.3a2.0±0.1b
目前报道的高F值产品F值多在20~40,如金枪鱼高F值寡肽F值为30.3[17];罗非鱼高F值寡肽的F值为23.1[23];高F值栉孔扇贝酶解液的F值为34.7[21];带鱼高F值寡肽的F值为28.1[9];LAN等[24]利用南极磷虾粉两步酶解法制取高F值寡肽的F值为21.1。本实验中经处理所得到的HF-AKP的F值均高于上述文献结果。
2.3 HF-AKP对HepG2细胞生长的影响
HF-AKP和5-FU对HepG2细胞生长的影响见图3。20.0 mg/L 5-FU作用于HepG2细胞24 h时,对HepG2细胞增殖抑制率为(53.8±0.4)%,而作用48 h时,对细胞增殖抑制率为(58.6±0.2)%;24 h时,HF-AKP实验组(40.9、81.8、163.6 mg/L)对HepG2细胞增殖抑制率分别为(23.7±0.2)%、(40.1±0.4)%和(64.1±0.2)%,而48 h时HF-AKP实验组对HepG2细胞增殖抑制率分别为(25.4±0.3)%、(43.0±0.3)%、(67.9±0.4)%。与空白对照组相比,5-FU(20.0 mg/L)和HF-AKP(40.9、81.8、163.6 mg/L)对HepG2细胞生长均有明显的抑制作用(P<0.01),细胞增殖抑制率和HF-AKP的浓度正相关,且高浓度的HF-AKP(163.6 mg/L)的抑制效果优于阳性对照(5-FU,20.0 mg/L)。
随着HF-AKP浓度升高及作用时间延长,细胞增殖抑制率上升,说明HF-AKP以剂量和时间正向依赖性抑制HepG2细胞的生长。阳性对照组(5-FU)和HF-AKP实验组的细胞增殖抑制率在24 h和48 h时的差异虽然有显著差异(P<0.01),但是从数值上看,细胞抑制率增加不高,故后期在细胞凋亡和细胞因子ELISA检测试验中均选择样品处理肝癌细胞24 h,HF-AKP的质量浓度选定163.6 mg/L。

a-处理24 h;b-处理48 h
图3 CCK-8法测定样品对HepG2肝癌细胞增殖抑制情况
Fig.3 Inhibition of the proliferation of HepG2 liver cancer cells by CCK-8 methods
注:5-FU为阳性对照(20 mg/L 5-FU);HF-AKP1为40.9 mg/L HF-AKP;HF-AKP2为 81.8 mg/L HF-AKP;HF-AKP3为 163.6 mg/L HF-AKP(下同)
2.4 PI/RNase单染检测HepG2细胞凋亡周期
5-FU和HF-AKP对HepG2细胞生长周期的影响见图4。与空白对照组相比,HF-AKP组(163.6 mg/L)和阳性对照组(5-FU,20.0 mg/L)处理HepG2细胞24 h后,G0/G1期细胞比例上升,分别从(46.0±2.4)%增加到(71.2±1.5)%和(62.0±0.8)%,而S期细胞则从(50.6±1.1)%分别减少到(26.2±3.1)%和(35.1±0.6)%。可见5-FU和HF-AKP均可使HepG2细胞周期阻滞于G0/G1期,且HF-AKP阻滞效果更佳。

a-对照;b-5-FU;c-HF-AKP3;d-细胞周期分布
图4 样品对HepG2细胞周期分布的影响及样品处理HepG2细胞24 h后细胞周期分布图
Fig.4 Effects of samples on the cell cycle distribution in HepG2 cells and the cell cycle distribution of HepG2 cells after exposure to samples for 24 h
2.5 ELISA检测NF-κB、Bcl-2及Bax蛋白的表达水平
肝细胞的凋亡及再生是人体维持内环境稳定的重要措施,诸多研究表明,调亡因子作用的减弱和抗调亡因子作用的增强是肝癌的重要发病机制之一[25]。NF-κB是抗炎和凋亡基因表达过程中的一种关键的调控因子[26],而Bcl-2和Bax是与细胞凋亡有关的关键基因,有研究发现Bax/Bcl-2两蛋白之间的比例关系亦是决定细胞凋亡的关键因素[27]。因此在研究活性物质对细胞生长影响时,通常检测Bax蛋白和Bcl-2蛋白这2个Bcl-2家族最具代表性的促凋亡蛋白和抗凋亡蛋白的表达量,同时也会检测Bax与Bcl-2蛋白表达量的比值来判断活性物质对细胞生长的作用机制。
本研究中采用人核因子NF-κB、Bcl-2及Bax相关检测试剂盒(ELISA),检测5-FU(20.0 mg/L)和HF-AKP(163.6 mg/L)作用于HepG2细胞24 h时,HepG2细胞上清液中NF-κB、Bcl-2及Bax蛋白的表达水平,结果见表7。与对照组相比,5-FU(20.0 mg/L)和HF-AKP(163.6 mg/L)处理HepG2细胞24 h后,显著抑制HepG2细胞上清液中NF-κB、Bcl-2蛋白的表达量(P<0.05),5-FU(20.0 mg/L)和HF-AKP(163.6 mg/L)亦促进Bax蛋白的表达,但并不显著(P>0.05),另外5-FU和HF-AKP组的Bax/Bcl-2比值均显著高于空白对照组(P<0.05)。由于Bax大量表达时会加速细胞凋亡,而Bcl-2占优势时细胞继续生长繁殖,所以推测HepG2细胞凋亡与Bax/Bcl-2蛋白表达比值增加和NF-κB蛋白表达减少有关。
表7 样品对HepG2细胞上清液中NF-κB、 Bcl-2及Bax蛋白表达量的影响
Table 7 Effect of samples on the expression of NF-κB, Bcl-2 and Bax protein in the supernatant of HepG2 cells
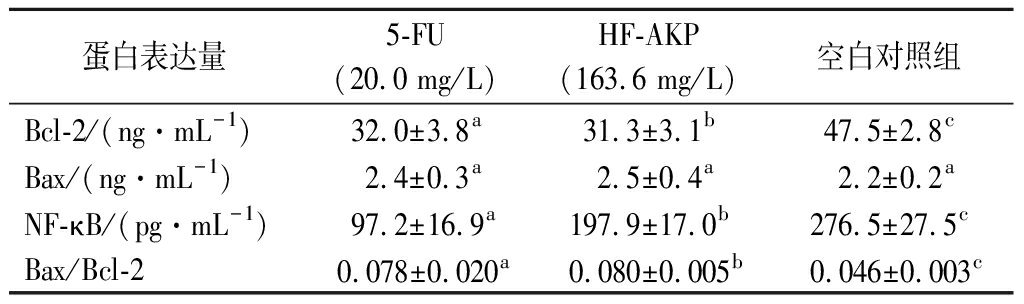
蛋白表达量5-FU(20.0 mg/L)HF-AKP(163.6 mg/L)空白对照组Bcl-2/(ng·mL-1)32.0±3.8a31.3±3.1b47.5±2.8cBax/(ng·mL-1)2.4±0.3a2.5±0.4a2.2±0.2aNF-κB/(pg·mL-1)97.2±16.9a197.9±17.0b276.5±27.5cBax/Bcl-20.078±0.020a0.080±0.005b0.046±0.003c
吴靖娜等[28]的研究表明,鲍内脏肽粉对H2O2氧化损伤的HepG2细胞有一定增殖作用,且剂量-效应关系明显,推测鲍内脏肽粉对H2O2诱导的HepG2细胞损伤有一定的保护作用。魏彬彬[29]研究发现对虾肽的美拉德产物对HepG2细胞的生长有显著的促进作用,且浓度越高,细胞增殖效果越明显。本研究结果与上述结果截然相反,研究所制备的HF-AKP可显著抑制人肝癌细胞株HepG2细胞生长,并在一定的范围内呈剂量、时间依赖性,HF-AKP能诱导HepG2细胞发生凋亡,将细胞阻滞于G0/G1期,其凋亡机制可能与Bax/Bcl-2蛋白表达比值增加,以及NF-κB蛋白表达减少有关,推测HF-AKP有一定抗肿瘤功效。
3 结论
研究以南极磷虾油生产后的脱脂南极磷虾粉为原料,采用双酶分步水解制备蛋白酶解液。优化后的最佳碱性蛋白酶酶解工艺为料液比1∶17.5,加酶量5.0%,时间6 h,温度55 ℃;二次酶解复合风味蛋白酶的最优工艺为加酶量4.0%,时间3 h。在优化的酶解条件下,酶解液先经超滤、纳滤得到<5 kDa的南极磷虾小分子肽,再采用活性炭静态吸附脱除其中的游离芳香族氨基酸,制备得到F值为87.2±0.7的脱脂南极磷虾高F值小分子肽。
CCK-8实验、细胞凋亡周期以及NF-κB、Bcl-2及Bax蛋白表达量ELISA检测结果均表明:HF-AKP可显著抑制人肝癌细胞株HepG2的生长,并在一定的范围内呈剂量、时间依赖性,剂量-效应关系明显。HF-AKP可将HepG2细胞周期阻滞于G0/G1期,进而影响细胞增殖。其凋亡机制可能与Bax/Bcl-2蛋白表达比值增加,以及NF-κB蛋白表达减少有关,推测HF-AKP可能有一定抗肿瘤功效。由于目前对蛋白水解物影响动物细胞生命活动的作用机理尚未完全阐明,且蛋白水解物中的活性多肽的组成亦多种多样,后期还需进一步对本研究中所制备的HF-AKP中活性肽组分进行进一步分离纯化,并深入研究其对HepG2细胞生长的影响及调控机制。
[1] CHEN Y C, TOU J C, JACZYNSKI J.Amino acid and mineral composition of protein and other components and their recovery yields from whole Antarctic krill (Euphausia superba) using isoelectric solubilization/precipitation[J].Journal of Food Science, 2009, 74(2):H31-H39.
[2] 迟海, 李学英, 杨宪时, 等.南极磷虾冻藏温度下的品质变化及其货架期分析[J].水产学报, 2012, 36(1):153-160.
CHI H, LI X Y, YANG X S, et al.Analysis of quality changes and shelf-life of Antarctic krill(Euphausia superba)at frozen temperature[J].Journal of Fisheries of China, 2012, 36(1):153-160.
[3] 迟海, 李学英, 杨宪时, 等.南极大磷虾0、5和20 ℃贮藏中的品质变化[J].海洋渔业, 2010, 32(4):447-453.
CHI H, LI X Y, YANG X S, et al.Sensory, microbiological and chemical changes of Euphausia superba during storage at 0, 5, and 20 ℃[J].Marine Fisheries, 2010, 32(4):447-453.
[4] JI W, ZHANG C H, JI H W.Two novel bioactive peptides from Antarctic krill with dual angiotensin converting enzyme and dipeptidyl peptidase IV inhibitory activities[J].Journal of Food Science, 2017, 82(7):1 742-1 749.
[5] LIU S L, HU W, FANG Y Z, et al.Extraction of oil from wet Antarctic krill (Euphausia superba) using a subcritical dimethyl ether method[J].RSC Advances, 2019, 9(59):34 274-34 282.
[6] WANG L Z, XUE C H, WANG Y M, et al.Extraction of proteins with low fluoride level from Antarctic krill (Euphausia superba) and their composition analysis[J].Journal of Agricultural and Food Chemistry, 2011, 59(11):6 108-6 112.
[7] 谷瑞增, 刘艳, 林峰, 等.蛋白水解物在动物细胞培养中的应用研究进展[J].生物技术通报, 2012(9):21-27.
GU R Z, LIU Y, LIN F, et al.Application and research progress of protein hydrolysates in animal cell culture[J].Biotechnology Bulletin, 2012(9):21-27.
[8] MENDONÇA R Z, DE OLIVEIRA E C, PEREIRA C A, et al.Effect of bioactive peptides isolated from yeastolate, lactalbumin and NZCase in the insect cell growth[J].Bioprocess and Biosystems Engineering, 2007, 30(3):157-164.
[9] 陶静, 丁冬各, 陈荫, 等.带鱼高F值寡肽的制备工艺及活性[J].水产学报, 2018, 42(10):1 648-1 660.
TAO J, DING D G, CHEN Y, et al.Preparation and bioactivity evaluation of high Fischer ratio oligo-peptide from Trichiurus japonicus[J].Journal of Fisheries of China, 2018, 42(10):1 648-1 660.
[10] ARAI S, KIMURA H.Comparative nutritional value for amino acids, oligopeptides and soybean protein[J].Journal of the American Oil Chemists’ Society, 1987, 64(12):1 692-1 696.
[11] 张铁华, 殷涌光, 刘静波, 等.高F值寡肽抗疲劳作用的研究及其饮料的开发[J].食品科学, 2007, 28(5):308-312.
ZHANG T H, YIN Y G, LIU J B, et al.Study on function of anti-fatigue high F ratio oligo-peptide from corn gluten meal and preparation of its beverage[J].Food Science, 2007, 28(5):308-312.
[12] 黄程, 杜帅, 宋茹, 等.鲣鱼肉高F值寡肽液的生理活性研究[J].食品工业, 2015, 36(3):246-249.
HUANG C, DU S, SONG R, et al.Activity of high Fischer ratio oligo-peptide from ground meat of Eleotridae[J].The Food Industry, 2015, 36(3):246-249.
[13] 张铁华, 王海波, 李文亮, 等.玉米高F值寡肽生理功能及研究状况[J].食品研究与开发, 2006, 27(6):136-138.
ZHANG T H, WANG H B, LI W L, et al.Physiological function and review of high F ratio oligo-peptide[J].Food Research and Development, 2006, 27(6):136-138.
[14] 李明杰. 南极大磷虾多肽制备工艺优化、脱氟及其体外活性的研究[D].青岛:中国海洋大学, 2012.
LI M J.Research on preparation of defluorination polypeptide from Euphausia superba and study of polypeptide’s activity in vitro[D].Qingdao:Ocean University of China, 2012.
[15] 陈永强, 刘金娟, 曹成亮, 等.紫甘薯汁抗肿瘤活性及诱导人肝癌细胞HepG2凋亡机制研究[J].食品科学, 2013, 34(1):263-267.
CHEN Y Q, LIU J J, CAO C L, et al.Anti-tumor activity of purple sweet potato juice and its apoptosis-inducing mechanism in HepG2 cells[J].Food Science, 2013, 34(1):263-267.
[16] 李娜, 宋金春.荷叶碱对人肝癌细胞株HepG2凋亡及其作用机制[J].中国药物警戒, 2017, 14(12):715-719;726.
LI N, SONG J C.Effects of nuciferine on apoptosis of human hepatocellular carcinoma cell line HepG2 and its mechanism[J].Chinese Journal of Pharmacovigilance, 2017, 14(12):715-719;726.
[17] 罗红宇, 杜帅, 郑斌, 等.双酶分步水解金枪鱼(Eleotridae)碎肉制备高F值酶解液的工艺研究[J].海洋与湖沼, 2013, 44(4):906-912.
LUO H Y, DU S, ZHENG B, et al.Preparation process of high Fischer ratio hydrolysates from tuna(Eleotridae)ground meat by sequential hydrolysis[J].Oceanologia et Limnologia Sinica, 2013, 44(4):906-912.
[18] 黄艳青, 陆建学, 龚洋洋, 等.南极磷虾酶解液特性分析[J].食品工业科技, 2019, 40(5):23-30.
HUANG Y Q, LU J X, GONG Y Y, et al.Characteristics of Antarctic krill protein enzyme-hydrolysates[J].Science and Technology of Food Industry, 2019, 40(5):23-30.
[19] CERMAKOVA L, KOPECKA I, PIVOKONSKY M, et al.Removal of cyanobacterial amino acids in water treatment by activated carbon adsorption[J].Separation and Purification Technology, 2017, 173:330-338.
[20] 祁文翰, 楼康薇, 罗红宇.高F值寡肽液中芳香族氨基酸的脱除工艺优化[J].浙江海洋学院学报(自然科学版), 2017, 36(2):122-129.
QI W H, LOU K W, LUO H Y.The removal process optimization of aromatic amino acids in high Fischer ratio oligo-peptide[J].Journal of Zhejiang Ocean University (Natural Science), 2017, 36(2):122-129.
[21] 刘海梅, 王芸, 裴继伟, 等.活性炭法制备高F值栉孔扇贝酶解液的工艺条件[J].食品与发酵工业, 2020, 46(22):167-172.
LIU H M, WANG Y, PEI J W, et al.Process conditions of enzymatic hydrolysis of scallop Chlamys farreri with high Fischer ratio by activated carbon method[J].Food and Fermentation Industries, 2020, 46(22):167-172.
[22] OKITA M, WATANABE A, NAGASHIMA H.Nutritional treatment of liver cirrhosis by branched-chain amino acid-enriched nutrient mixture[J].Journal of Nutritional Science and Vitaminology, 1985, 31(3):291-303.
[23] 范春华, 段杉, 曹庸, 等.碱性蛋白酶水解罗非鱼碎肉制备高F值寡肽的工艺研究[J].农产品加工, 2015(23):31-34;38.
FAN C H, DUAN S, CAO Y, et al.Preparation of high Fischer ratio oligopeptides from meat attached to tilapia bones by hydrolysis with alkalase[J].Farm Products Processing, 2015(23):31-34;38.
[24] LAN C, ZHAO Y Q, LI X R, et al.High Fischer ratio oligopeptides determination from Antartic krill:Preparation, peptides profiles, and in vitro antioxidant activity[J].Journal of Food Biochemistry, 2019, 43(5):e12827.
[25] ASGHAR U, MEYER T.Are there opportunities for chemotherapy in the treatment of hepatocellular cancer?[J].Journal of Hepatology, 2012, 56(3):686-695.
[26] BASKARAN R, POORNIMA P, HUANG C Y, et al.Neferine prevents NF-κB translocation and protects muscle cells from oxidative stress and apoptosis induced by hypoxia[J].BioFactors, 2016, 42(4):407-417.
[27] 李懿, 赵莉莉, 李易, 等.表没食子儿茶素没食子酸酯通过PI3K/AKT信号通路抑制人肝癌细胞株HepG2增殖和促进凋亡[J].世界华人消化杂志, 2015, 23(20):3 188-3 194.
LI Y, ZHAO L L, LI Y, et al.Epigallocatechin-3-gallate induces human liver cancer HepG2 cell apoptosis and growth inhibition by suppressing phosphatidylinositol3 kinase/protein kinase B signaling[J].World Chinese Journal of Digestology, 2015, 23(20):3 188-3 194.
[28] 吴靖娜, 潘南, 苏捷, 等.基于体外化学与细胞模型评价鲍内脏肽粉的抗氧化活性[J].现代食品科技, 2015, 31(12):26-31.
WU J N, PAN N, SU J, et al.Evaluation of antioxidant activity of polypeptides from Abalone viscera using in vitro chemistry and cell culture model[J].Modern Food Science and Technology, 2015, 31(12):26-31.
[29] 魏彬彬. 对虾肽美拉德反应产物及其分离组分的理化特性与抗氧化活性研究[D].青岛:中国海洋大学, 2013.
WEI B B.Chemical characterization, antioxidative capacity and isolation of Maillard reaction products from shrimp peptides[D].Qingdao:Ocean University of China, 2013.