胶原是一种广泛分布于动物骨骼、皮肤和肌腱等组织器官的大分子蛋白质,因其具有良好的生物相容性、生物降解性、低免疫原性和成骨性等性能,被广泛应用于食品、生物医药和组织材料等领域[1-3]。典型的Ⅰ型胶原分子质量约为300 kDa,由2条α1和1条α2链组成,3条链相互缠绕形成胶原的3股螺旋结构,这对于维持胶原的生理活性具有至关重要的作用[4]。在生理条件下,胶原分子自发聚集形成纤维束,对机体的组织和器官起着支撑和保护的作用[5]。在离体条件下,胶原分子的聚集行为易受到环境的影响而发生改变。TIAN等[6]研究了盐浓度对罗非鱼皮胶原聚集行为的影响,发现随着盐浓度的增加,胶原成纤维能力和纤维凝胶强度降低,但胶原纤维凝胶的弹性和熔融温度却逐渐增强。由于胶原产品生产主要在离体条件下进行,因此,研究胶原分子在不同环境下的聚集行为对胶原产品的生产具有重要的指导意义。
胶原产品在实际应用时,需通过物理、化学等手段进行修饰,以提高其热稳定性、机械强度等理化特性[7-8]。在前期的研究中,作者在天然胶原分子的侧链上分别引入了亲水和疏水基团,成功制备了一种新型的酰化胶原[9-10]。这种酰化胶原不仅维持了天然胶原的三股螺旋结构,使其依旧保持良好的生物活性,同时具有良好的表面活性,其在较低浓度下能够形成胶束、囊泡等表面活性剂缔合体系,对胶原应用于生物医药、组织工程和食品生产具有重要的作用。与天然胶原相比,酰化胶原分子的聚集行为也受到环境因素的影响。
胶原分子聚集行为的传统研究方法主要是浊度法[11]。由于浊度法灵敏度较低,因此其应用范围受到了一定的限制。近年来,荧光光谱技术具有灵敏度和分辨率高的优点,已被广泛用于蛋白质分子的研究。由于胶原分子本身含有具有荧光特性的酪氨酸(tyrosine,Tyr)和苯丙氨酸(phenylalanine,Phe)残基,因此,通过荧光光谱技术对胶原分子进行内源性荧光检测,能有效研究胶原分子的聚集行为。如在DUAN等[12]的研究中发现,胶原分子的荧光峰位置在引入丝胶后发生红移,表明胶原分子的聚集程度降低。
本文主要以天然胶原和酰化胶原为研究对象,通过荧光光谱技术分别研究浓度、温度和pH对天然胶原和酰化胶原分子聚集行为的影响。此外,对一维荧光光谱数据进行分析处理,得到天然胶原和酰化胶原分子在不同环境条件下的二维荧光光谱,可进一步研究天然胶原和酰化胶原分子基团对外扰条件刺激的响应顺序。
1 材料与方法
1.1 实验材料
1.1.1 主要试剂
新鲜牛皮,当地农贸市场购买;天然胶原与酰化胶原,实验室自制;月桂酰氯、琥珀酸酐,美国Sigma公司;胃蛋白酶,阿拉丁生物试剂有限公司;冰醋酸、NaCl等,科龙化工试剂厂。
1.1.2 主要仪器
CH1006超级恒温水浴槽,上海衡平仪器有限公司;3700高速冷冻离心机,日本KUBOTA公司;FD-1型冷冻真空干燥机,北京博医康实验仪器有限公司;Cary Eclipse,G9800A荧光分光光度计,美国安捷伦公司。
1.2 实验方法
1.2.1 天然胶原和酰化胶原的制备
天然胶原的提取和酰化胶原的制备分别参照文献[9]和[13]进行,并将样品置于干燥器中保存备用。
1.2.2 浓度对天然胶原和酰化胶原分子聚集行为的影响
分别将天然胶原和酰化胶原海绵溶解于0.1 mol/L的醋酸和0.01 mol/L的PBS(pH 7.4)溶液中,得到质量浓度为0.1~0.9 mg/mL的天然胶原和酰化胶原溶液,质量浓度间隔为0.1 mg/mL。将样品置于恒温水浴槽中恒温10 min后,采用荧光分光光度计获得样品的荧光光谱图。荧光分光光度计扫描条件为:扫描温度为20 ℃,激发波长253 nm,波长扫描范围为265~450 nm,狭缝宽度为5 nm。
1.2.3 温度对天然胶原和酰化胶原分子聚集行为的影响
分别将天然胶原和酰化胶原海绵溶解于0.1 mol/L的醋酸和0.01 mol/L的PBS(pH 7.4)溶液中,得到0.4 mg/mL的样品溶液。将样品溶液置于恒温水浴槽中恒温30 min,采用荧光分光光度计获得不同温度下的样品荧光光谱图。荧光分光光度计扫描条件为:激发波长253 nm,波长扫描范围为265~450 nm,狭缝宽度为5 nm,扫描温度为10~70 ℃,温度间隔为5 ℃。
1.2.4 pH对天然胶原和酰化胶原分子聚集行为的影响
分别将天然胶原和酰化胶原海绵溶解于0.1 mol/L的醋酸和0.01 mol/L的PBS(pH 7.4)溶液中,得到0.4 mg/mL的样品溶液。采用1.0 mol/L的NaOH溶液或HCl溶液调节样品溶液的pH,使样品溶液pH为3.0~9.0,pH间隔为1.0。随后,将不同pH的样品置于恒温水浴槽中恒温10 min,采用荧光分光光度计获得样品的荧光光谱图。荧光分光光度计扫描条件为:扫描温度为20 ℃,激发波长253 nm,波长扫描范围为265~450 nm,狭缝宽度为5 nm。
1.2.5 二维(2D)荧光光谱数据分析
采用Origin 8.5和2Dshige(KwanseiGakuin)软件对上述天然胶原和酰化胶原分子在激发波长为253 nm的荧光光谱数据进行分析,获得以浓度和温度为外扰的2D荧光光谱图,进一步研究天然胶原和酰化胶原分子基团对外扰条件刺激的响应顺序。
2 结果与分析
2.1 浓度对天然胶原和酰化胶原分子聚集行为的影响
由图1-a可知,在激发波长为253 nm条件下,天然胶原分子在发射波长为277和293 nm处出现了特征荧光峰,350 nm后未出现明显特征峰。根据蛋白质荧光归属理论,277和293 nm分别归属于Phe和Tyr[14]。由于天然胶原质量浓度不断增加,Phe和Tyr的数量逐渐增加,从而导致其荧光强度增加。此外,Phe具有疏水性,在胶原聚集体内部靠近参与氢键形成;而Tyr具有亲水性,在胶原聚集体外部靠近参与氢键的形成,进一步使其在277 nm和293 nm处的峰强逐渐增加[15]。然而,随着天然胶原浓度的升高,其位于277 nm处的峰变宽,而位于293 nm处的峰逐渐尖锐,这可能是因为Phe(能量供体)与Tyr(能量受体)间发生了荧光共振能量转移[14]。此外,Tyr的特征峰由303降低至293 nm,DING等[16]认为这是由于胶原不断聚集导致Tyr特征峰蓝移造成的。由此可见,随着天然胶原浓度的增强,其荧光强度逐渐增加,表明其聚集程度也不断增加。
图1-b所示为不同浓度酰化胶原分子的荧光光谱。与天然胶原分子的荧光光谱相似,酰化胶原分子在277和293 nm出现了分别归属于Phe和Tyr的特征峰,荧光强度随酰化胶原质量浓度增加而增加,表明酰化胶原的聚集程度逐渐增加。随着酰化胶原浓度的增加,具有疏水性的Phe和具有亲水性的Tyr数量不断增加,且形成大量的氢键,从而导致其在277和293 nm处峰强的增加。与天然胶原分子荧光光谱不同的是,酰化胶原分子在360~400 nm处出现了宽峰,这是由于Tyr残基因近距离接触出现的激发状态,处于激发状态的Tyr残基不断聚集[17],这也表明酰化胶原分子比天然胶原分子更易聚集[9]。此外,酰化胶原分子位于293 nm处归属于Tyr的荧光峰强度在低浓度下较弱,这可能是因为低浓度下Tyr数量较少,且在360~400 nm处形成了Tyr的激发态,使得位于293 nm的Tyr聚集态较少,导致其荧光强度较弱。由图1-b可知,随着酰化胶原浓度的增加,位于360~400 nm的宽峰强度呈先增加后稳定的趋势,但峰的位置不断增加,这可能是因为酰化胶原浓度增加,Tyr数量增加,荧光强度增强;同时,因激发状态不稳定,不断向稳定的聚集状态转变,从而导致峰的位置增加,而峰的强度达到一定程度后趋于稳定。

a-天然胶原;b-酰化胶原
图1 不同质量浓度下的天然胶原和酰化 胶原分子荧光光谱
Fig.1 Fluorescence spectra of native and acylated collagen molecules under various concentrations
2.2 温度对天然胶原和酰化胶原分子聚集行为的影响
由图2-a可知,天然胶原分子在277和293 nm出现了分别归属于Phe和Tyr的特征峰,且荧光强度随着温度的升高而降低。这是因为温度升高,溶质与溶剂分子的动能增大,使得分子碰撞几率逐渐增大,具有荧光特性的Phe和Tyr的能量向分子碰撞转移,从而导致天然胶原分子的荧光强度逐渐降低[16]。同时,由于温度升高,天然胶原分子不断出现解聚集,直至发生变性而导致无规卷曲构造的形成,使得由Phe和Tyr参与形成的氢键被大量破坏,也导致天然胶原分子荧光强度逐渐降低。此外,位于277和293 nm处的荧光峰的尖锐程度与天然胶原浓度的影响刚好相反,进一步验证了温度对天然胶原分子解聚集的影响。

a-天然胶原;b-酰化胶原
图2 不同温度下的天然胶原和酰化胶原分子荧光光谱
Fig.2 Fluorescence spectra of native and acylated collagen molecules under various temperatures
图2-b所示为温度对酰化胶原分子荧光光谱的影响。与天然胶原分子相似,酰化胶原分子归属于Phe和Tyr的荧光峰强度随着温度的升高而降低,这也是由于基团荧光效率、氢键破坏和结构破坏等原因造成的。与天然胶原分子不同之处在于酰化胶原分子在400 nm处出现了宽峰,归属于Tyr的激发态。然而此处的荧光位置和强度均没有发生变化,这是因为不同温度下的酰化胶原浓度不变,而处于激发态的Tyr本身就是一种过渡状态,其不断的向聚集态转变,因此强度没有发生变化。
2.3 pH对天然胶原和酰化胶原分子聚集行为的影响
pH变化会改变胶原及其衍生物的表面电荷,从而影响其在溶液中的聚集行为[18]。由图3-a可知,随着pH不断增加,天然胶原分子的荧光强度呈先增强后减弱的趋势。在pH 7.0时,天然胶原分子荧光强度最大,表明此时天然胶原分子的聚集程度最大。天然胶原的等电点位于pH 7.0附近[9],当溶液pH接近天然胶原等电点时,天然胶原分子易形成疏水核,Phe和Tyr分别集中于疏水核的内部和外部,并形成大量氢键[19],导致荧光强度增加。
由图3-b可知,与天然胶原分子相似,酰化胶原分子的荧光强度随pH的升高也呈现先增加后降低的趋势。与之不同的是,酰化胶原分子在pH 5.0时,荧光强度最强,表明此时酰化胶原分子聚集程度最大。这是因为酰化胶原分子的等电点为4.93[9],此时电荷排斥作用减弱,而疏水作用和氢键占主导优势,使酰化胶原分子不断聚集,最终导致荧光强度增强。此外,归属于酰化胶原分子Tyr激发态的宽峰强度在pH 5.0处也达到最大值,这也可能是因为静电荷作用,加快了Tyr激发态向聚集态的转变速度。

a-天然胶原;b-酰化胶原
图3 不同温度下的天然胶原和酰化胶原分子荧光光谱
Fig.3 Fluorescence spectra of native and acylated collagen molecules under various temperatures
2.4 二维荧光光谱分析
2.4.1 浓度的影响
为获得浓度对天然胶原分子基团响应的影响,采用二维荧光光谱分析技术作了进一步的研究。在二维荧光光谱图中同时存在同步和异步相关光谱。同步相关谱图中存在自相关峰和交叉峰,自相关峰代表微环境对分子基团运动的影响;而交叉峰主要是不同基团之间的同步性取向,表明基团之间的协同作用[15]。异步光谱图中主要存在异步交叉峰,其峰的位置与同步交叉峰相对应,辅助提供分子基团在外扰条件下的响应顺序[20]。
由图4-a可知,天然胶原二维荧光同步图中存在很强的正自相关峰(293,293),由于Phe位于天然胶原分子聚集体内部,导致(277,277)处强度非常微弱,表明位于聚集体外部的Tyr比Phe对浓度更为敏感。异步图中(图4-b)存在异步交叉峰(277,293)和(293,277),其信号强度分别为正和负。结合同步图中的所有信号强度均为正,根据NODA读谱规则[21],天然胶原分子基团在以浓度为外扰的响应顺序为:277 nm>293 nm,即随着天然胶原浓度的升高,天然胶原分子不断聚集,位于聚集体内部的Phe优先响应形成稳定的疏水内核,位于聚集体外部的Tyr紧随其后。

a-同步图;b-异步图
图4 不同浓度下的天然胶原二维荧光同步图和异步图
Fig.4 2D synchronous correlation spectrum and asynchronous correlation spectrum of native collagen under various concentrations
图5为以浓度为外扰的酰化胶原分子在253 nm激发波长的2D同步和异步荧光光谱。从图5-a可以看出,由于酰化胶原分子的表面活性较天然胶原分子强[9],位于聚集体内部的Phe对浓度敏感性显著降低。然而,同步图中存在很强的正自相关峰(310,310)和(420,420),分别归属于Tyr的聚集态和Tyr的激发态[22]。此外,位于(420,420)处的自相关峰强于位于(310,310)处的自相关峰,表明处于激发态的Tyr比聚集态的Tyr对浓度更为敏感。异步图中(图5-b)存在异步交叉峰(310,420)和(420,310),其信号强度分别为负和正。结合同步图中的同步交叉峰的信号强度,根据NODA读谱规则[21],酰化胶原分子基团在以浓度为外扰的响应顺序为:420 nm>310 nm,即随着浓度的升高,Tyr的激发态首先响应,随后导致聚集态的Tyr响应。
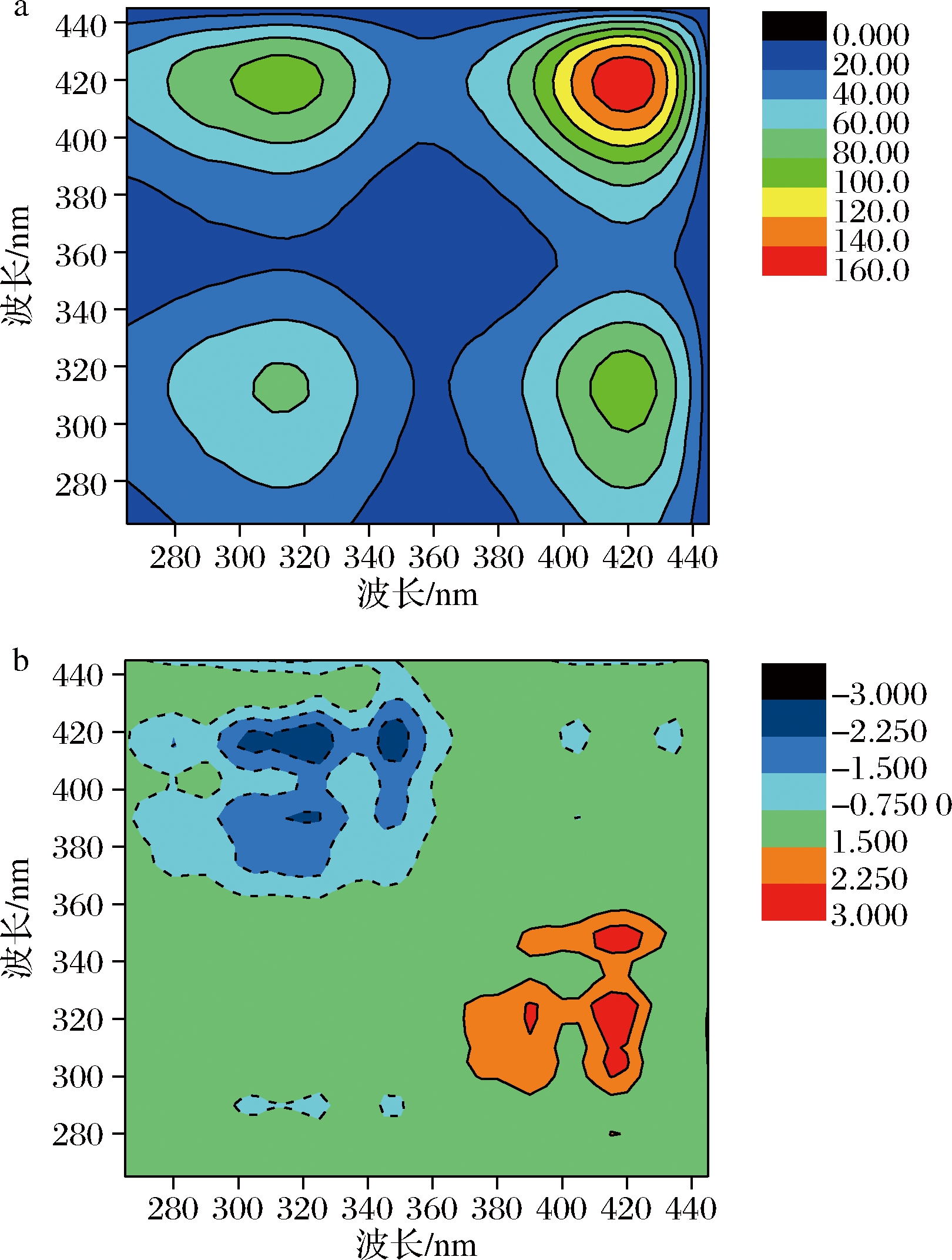
a-同步图;b-异步图
图5 不同浓度下的酰化胶原二维荧光同步图和异步图
Fig.5 2D synchronous correlation spectrum and asynchronous correlation spectrum of acylated collagen under various concentrations
2.4.2 温度的影响
由图6-a可知,不同温度下二维荧光同步图中存在很强的归属于Tyr的正自相关峰(293,293),表明位于天然胶原聚集体外部的Tyr对温度的影响更为敏感。异步图中(图6-b)存在负的异步交叉峰(277,293)和正的异步交叉峰(293,277)。结合同步图中的所有信号强度均为正,根据NODA读谱规则[21],天然胶原分子基团以温度为外扰的响应顺序为:293 nm>277 nm,即温度影响下,分子运动加剧,位于天然胶原聚集体外部的Tyr对温度敏感,优先响应,并反向提供能量给Phe,所以Phe最后响应。
图7为以温度为外扰的酰化胶原分子2D同步和异步荧光光谱。与天然胶原分子相比,酰化胶原分子聚集性更强,使其Phe对温度敏感性显著降低。

a-同步图;b-异步图
图6 不同温度下的二维荧光光谱同步图和异步图
Fig.6 2D synchronous correlation spectrum and asynchronous correlation spectrum of native collagen under various temperatures

a-同步图;b-异步图
图7 不同温度下酰化胶原分子二维荧光 光谱同步图和异步图
Fig.7 2D synchronous correlation spectrum and asynchronous correlation spectrum of acylated collagen under various temperatures
从图7-a可知,同步图中存在很强的归属于Tyr的正自相关峰(420,420),归属于Tyr的激发态;同时出现微弱的正自相关峰(310,310),归属于Tyr的聚集态,表明激发态的Tyr比聚集态的Tyr对温度更敏感[22]。根据NODA读谱规则[21],同步交叉峰和异步交叉峰(310,420)信号均为负,因此,酰化胶原分子基团以温度为外扰的响应顺序为:310 nm>420 nm。这可能是因为Tyr激发态始终是一种过渡状态,其不断向聚集态转变,因此处于一种动态平衡的状态,随温度的升高,其响应并不明显,从而导致Tyr聚集态优先相应。
2.4.3 pH的影响
由图8-a可知,pH为外扰的天然胶原二维荧光同步图中存在很强的归属于Tyr的正自相关峰(293,293),同时存在正的同步交叉峰(277,293),表明位于天然胶原聚集体外部的Tyr对pH更为敏感。异步图中(图8-b)存在负的异步交叉峰(277,293)和正的异步交叉峰(293,277)。结合同步交叉峰信号,根据NODA读谱规则[21],天然胶原分子基团以pH为外扰的响应顺序为:293 nm>277 nm,即在pH影响下,位于天然胶原聚集体外部的Tyr对电荷更为敏感,优先响应。

a-同步图;b-异步图
图8 pH影响的天然胶原二维荧光光谱同步图和异步图
Fig.8 2D synchronous correlation spectrum and asynchronous correlation spectrum of native collagen under various pH
图9为以pH为外扰的酰化胶原分子2D同步和异步荧光光谱。与天然胶原分子相比,位于酰化胶原分子聚集体内部的Phe对pH不敏感,因此主要出现了归属于Tyr激发态和聚集态的相关峰。从图9-a可知,同步图中存在很强的归属于Tyr激发态的正自相关峰(420,420),表明激发态的Tyr比聚集态的Tyr对pH更为敏感。根据NODA读谱规则[21],同步图中的所有信号均为正,异步交叉峰(310,420)信号为负,因此,酰化胶原分子基团以pH为外扰的响应顺序为:420 nm>310 nm。这可能是因为pH会影响酰化胶原分子的静电荷,而电荷加速了Tyr激发态的变化,因此导致其优先响应,而Tyr聚集态则随后响应。

a-同步图;b-异步图
图9 pH影响的酰化胶原二维荧光光谱同步图和异步图
Fig.9 2D synchronous correlation spectrum and asynchronous correlation spectrum of acylated collagen under various pH
3 结论
以天然胶原和酰化胶原为研究对象,采用荧光光谱技术研究浓度、温度和pH对其分子聚集行为的影响,得到以下结论:
(1)随着浓度增加,Tyr和Phe数量增加并参与氢键的形成,使得天然胶原和酰化胶原分子不断聚集,从而导致荧光强度增加;酰化胶原分子出现了归属于Tyr激发态的宽峰,表明酰化胶原比天然胶原更易聚集。
(2)随着胶原和酰化胶原温度的升高,由于基团的荧光效率降低,分子碰撞导致的猝灭几率增大以及其结构的转变,导致了天然胶原和酰化胶原分子的荧光强度逐渐降低。
(3)随着pH的升高,天然胶原和酰化胶原分子的聚集程度均呈现先增加后降低的趋势。在等电点附近,电荷排斥作用减弱,疏水作用和氢键占主导优势,聚集程度最大。
(4)采用二维荧光光谱对一维数据进一步分析,发现二维荧光光谱能够有效地判断出不同基团对以浓度、温度和pH为外扰条件刺激的响应顺序。
[1] LI Y B, LIU Y Z, LI R H, et al.Collagen-based biomaterials for bone tissue engineering[J].Materials & Design, 2021, 210:110049.
[2] CHEN X H, JIN W G, CHEN D J, et al.Collagens made from giant salamander (Andrias davidianus) skin and their odorants[J].Food Chemistry, 2021, 361:130061.
[3] YAN M Y, WANG X P.Study on the kinetic self-assembly of type I collagen from tilapia (Oreochromis niloticus) skin using the fluorescence probe thioflavin T[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2018, 203:342-347.
[4] DING C C, ZHANG M, LI G Y.Fluorescence study on the aggregation of collagen molecules in acid solution influenced by hydroxypropyl methylcellulose[J].Carbohydrate Polymers, 2016, 136:224-231.
[5] REVELL C K, JENSEN O E, SHEARER T, et al.Collagen fibril assembly:New approaches to unanswered questions[J].Matrix Biology Plus, 2021, 12:100079.
[6] TIAN H H, REN Z Y, SHI L F, et al.Self-assembly characterization of tilapia skin collagen in simulated body fluid with different salt concentrations[J].Process Biochemistry, 2021, 108:153-160.
[7] ZHANG Y, HUANG Y, PANG Y Y, et al.Modification of collagen with proanthocyanidins by mimicking the bridging role of glycosaminoglycans for dentine remineralization[J].Materials & Design, 2021, 210:110067.
[8] YU F, XU R C, HUANG L, et al.Isocyanate-terminated urethane-based methacrylate for in situ collagen scaffold modification[J].Materials Science and Engineering:C, 2020, 112:110902.
[9] LI C H, TIAN H L, DUAN L, et al.Characterization of acylated pepsin-solubilized collagen with better surface activity[J].International Journal of Biological Macromolecules, 2013, 57:92-98.
[10] LI C H, LIU W T, DUAN L, et al.Surface activity of pepsin-solubilized collagen acylated by lauroyl chloride along with succinic anhydride[J].Journal of Applied Polymer Science, 2014, 131(14):DOI:10.1002/app.40174.
[11] TIAN H L, LI C H, LIU W T, et al.The influence of chondroitin 4-sulfate on the reconstitution of collagen fibrils in vitro[J].Colloids and Surfaces B:Biointerfaces, 2013, 105:259-266.
[12] DUAN L, YUAN J J, YANG X, et al.Interaction study of collagen and sericin in blending solution[J].International Journal of Biological Macromolecules, 2016, 93:468-475.
[13] ZHANG Z J, LI G Y, SHI B.Physicochemical properties of collagen, gelatin and collagen hydrolysate derived from bovin limed split wasts[J].Journal of the Society of Leather Technologists and Chemists,2006, 90:23-28.
[14] WU K, LIU W T, LI G Y.The aggregation behavior of native collagen in dilute solution studied by intrinsic fluorescence and external probing[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2013, 102:186-193.
[15] LI C H, WU Y, LI G Y, et al.Aggregation behavior of acylated pepsin-solubilized collagen based on fluorescence spectrum technology[J].Applied Spectroscopy, 2020, 74(4):391-399.
[16] DING C C, ZHANG M, WU K, et al.The response of collagen molecules in acid solution to temperature[J].Polymer, 2014, 55(22):5 751-5 759.
[17] LI J H, LI G Y.The thermal behavior of collagen in solution:Effect of glycerol and 2-propanol[J].International Journal of Biological Macromolecules, 2011, 48(2):364-368.
[18] PENG B L, HAO Y L, KANG H M, et al.Aggregation behavior of N-carboxyethylchitosan in aqueous solution:Effects of pH, polymer concentration, and presence of a gemini surfactant[J].Carbohydrate Research, 2010, 345(1):101-107.
[19] PADRICK S B, MIRANKER A D.Islet amyloid polypeptide:Identification of long-range contacts and local order on the fibrillogenesis pathway[J].Journal of Molecular Biology, 2001, 308(4):783-794.
[20] 李从虎, 吴彦, 马兴红, 等.基于荧光光谱技术研究胶原蛋白溶液中分子的聚集行为[J].光谱学与光谱分析, 2019, 39(7):2 023-2 028.
LI C H, WU Y, MA X H, et al.Aggregation behavior of collagen molecules in aqueous solution based on fluorescence spectroscopy technology[J].Spectroscopy and Spectral Analysis, 2019, 39(7):2 023-2 028.
[21] NODA I.Generalized two-dimensional correlation method applicable to infrared, Raman, and other types of spectroscopy[J].Applied Spectroscopy, 1993, 47(9):1 329-1 336.
[22] LAKOWICZ J R.Protein Fluorescence[M]//Principles of Fluorescence Spectroscopy.Boston, MA:Springer US, 1999:445-486.