海洋鱼皮中蛋白质含量丰富,且以胶原蛋白为主。以海洋鱼皮为原料经过现代生物酶解工艺加工制备的胶原蛋白肽不仅有蛋白质的营养特性,而且也具有一定的生理活性,特别是在美容护肤方面具有抗氧化、促进伤口愈合、免疫调节等功能[1-4]。大米肽(rice peptides, RP)是以大米蛋白为原料,经过酶解技术获得的小分子低聚肽类原料。课题组前期已经针对RP的美白作用进行了考察,RP中含有能够在mRNA和蛋白水平上调控基因信号通路以抑制酪氨酸酶蛋白表达的特征结构,能够对皮肤美白起促进作用[5-6]。
大量的研究证明了具有生理活性的低聚肽复合能够协同增效[7-9]。然而,胶原蛋白肽(collagen peptides, CP)与RP复合后对皮肤健康的作用影响尚无研究。因此,本文选取CP与RP,以不同比例复合,对其在体外保湿、体外抗氧化、体外抑制酪氨酸酶的能力进行了研究,并基于小鼠黑素瘤细胞B16,对2种肽及其复合物对细胞内氧化平衡及酪氨酸酶的影响进行了评价,旨在确定CP及RP在影响皮肤保湿、皮肤美白和抗衰老方面等的作用比例,为其作用机制研究及在美容方面的潜在应用奠定理论基础。
1 材料和方法
1.1 材料和仪器
1.1.1 主要材料
CP、RP,北京中食海氏生物技术有限公司;酪氨酸酶(T3824-25KU)、荧光素钠(sodium fluorescein, FL)、(S)-6-甲氧基-2,5,7,8-四甲基色满-2-羧酸[(S)-6-methoxy-2,5,7,8-tetramethylchromane-2-carboxylic acid,Trolox],Sigma;2,2-偶氮二(2-甲基丙基咪)二盐酸盐(2,2′-azobis 2-methylpropionamidine dihydrochloride,AAPH)、左旋多巴(levodopa,L-DOPA),Aldrich;PBS缓冲液、DMEM培养基,Thermo Fisher公司;胎牛血清、青链霉素溶液,Gibco;氧自由基吸收能力(oxygen radical absorbance capacity, ORAC)Assay试剂盒,Abcam;超氧化物歧化酶(superoxide dismutase, SOD)试剂盒、聚氰基丙烯酸正丁酯(bicinchoninic acid, BCA)试剂盒,碧云天;CCK-8试剂盒,日本同仁化学研究所;硫酸铵、甘油,北京化工厂。
1.1.2 主要仪器
Spectra MR多功能酶标仪,Dynex;AC2-6S1 ESCO生物安全柜,新加坡艺思高科技有限公司;240i直热式二氧化碳培养箱,Thermo Fisher;SpectraMax i3x荧光酶标仪,美谷分子仪器(上海)有限公司。
1.2 实验方法
1.2.1 主要试剂配制
Trolox储备液:Trolox配制成10 mmol/L的水溶液,使用时梯度稀释。L-DOPA母液:将0.02 g L-DOPA溶于10 mL的PBS溶液中,分装并储存于-20 ℃。使用时按照设定的浓度梯度稀释。酪氨酸酶母液:将1 mL PBS溶液加入至酪氨酸酶试剂瓶中,充分振荡溶解,分装并储存于-20 ℃。使用时按照设定的浓度梯度稀释,并置于冰上操作。
1.2.2 体外评价
1.2.2.1 保湿功能评价
参考王昌涛等[10]保湿剂性能体外评价法,并略有改动。利用硫酸铵饱和溶液来控制干燥器内相对湿度(relative humidity, RH)保持在81%。以2 cm×2 cm的3M胶带粘贴在表面皿上模拟皮肤。将配制好的CP及RP溶液分别取200 μL滴加至贴有3 M胶带的表面皿上,置于干燥器内,分别于0和4 h称取质量,保湿率的计算如公式(1)所示:
保湿率![]()
(1)
式中:m0,贴有3 M胶带的表面皿质量,m1,放置样品初始表面皿质量(0 h),m2,放置4、8 h后表面皿质量。
1.2.2.2 体外抗氧化活性评价
采用ORAC法评价样本的总抗氧化活性,具体方法参考文献,并有改动[11-12]。
标准曲线的绘制:Trolox配制成250、100、50、25、12.5、6.25、0 μmol/L水溶液。于96孔板中设置空白对照组、AAPH对照组,Trolox组,各组均加入30 μL FL溶液;取PBS 270 μL于空白对照组中,60 μL于模型对照组中,30 μL于Trolox组中,之后取梯度Trolox溶液30 μL加入Trolox组;分别取AAPH溶液210 μL加入模型对照组及Trolox组。振荡使混合均匀,设置酶标仪激发波长为491 nm,扫描波长为512 nm,采集时间间隔3.5 ms,采集次数40次。以Trolox浓度为横坐标、OD值为纵坐标绘制曲线,计算荧光半数衰减时间。再以Trolox浓度为横坐标,各组Trolox浓度梯度对应的荧光半数衰减时间为纵坐标,绘制基于Trolox的ORAC标准曲线。
CP及RP的ORAC值测定:CP及RP以PBS为溶剂,分别配制成溶液,如表1所示。根据上述方法,设置空白对照组、模型对照组及实验组,计算各样本的ORAC值。
表1 待测样品体外实验配制方法
Table 1 Preparation method of samples to be tested in vitro
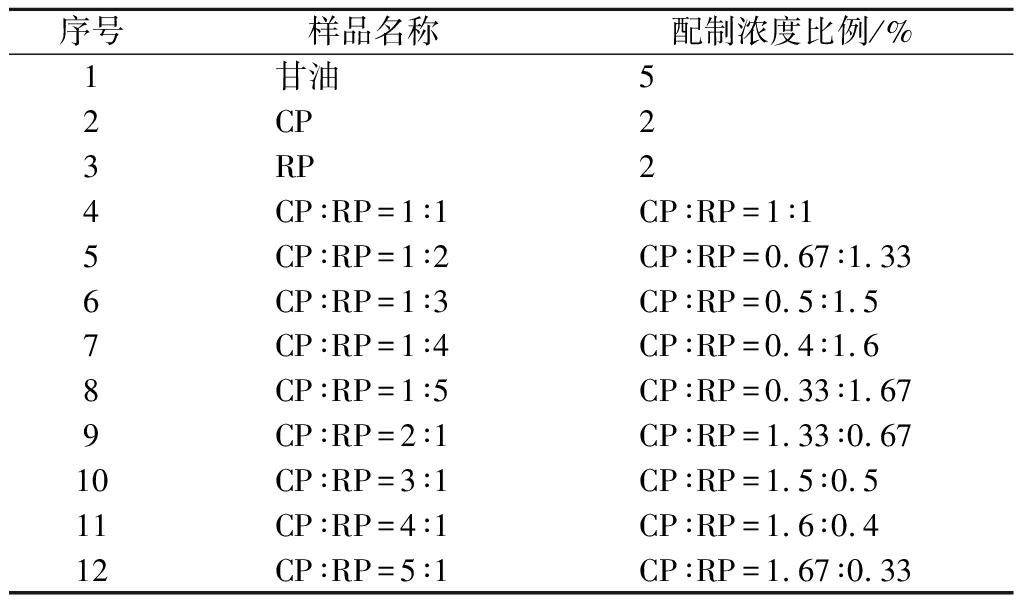
序号样品名称配制浓度比例/%1甘油52CP23RP24CP∶RP=1∶1CP∶RP=1∶15CP∶RP=1∶2CP∶RP=0.67∶1.336CP∶RP=1∶3CP∶RP=0.5∶1.57CP∶RP=1∶4CP∶RP=0.4∶1.68CP∶RP=1∶5CP∶RP=0.33∶1.679CP∶RP=2∶1CP∶RP=1.33∶0.6710CP∶RP=3∶1CP∶RP=1.5∶0.511CP∶RP=4∶1CP∶RP=1.6∶0.412CP∶RP=5∶1CP∶RP=1.67∶0.33
1.2.2.3 体外抑制酪氨酸酶活性评价
参考文献[13-14]所述实验方法并有所改动。经预实验确定L-DOPA溶液、酪氨酸酶溶液的工作体系的终浓度及孵育时间。以配制好的CP、RP及CP和RP一定比例复配的混合液与酪氨酸酶溶液配制成酶系混合物,共同孵育30 min,孵育温度为37 ℃。同时以配制好的CP、RP及CP和RP一定比例复配的混合液与L-DOPA配制成底物混合物,共同孵育30 min,孵育温度为37 ℃。取950 μL底物混合物加入6孔板,取50 μL酶系混合物加入到底物混合物中,振荡3 s后立即检测混合体系在波长490 nm下的1 min内吸光值变化。每组数据设置3次平行实验。
1.2.3 细胞水平评价
1.2.3.1 B16细胞培养
小鼠黑素瘤细胞B16,中国医学科学院基础医学研究所细胞中心。利用DMEM高糖培养基(含10%胎牛血清,1%青链霉素溶液)在37 ℃、5% CO2及充分饱和湿度环境下培养。当细胞融合至培养瓶80%时,可进行细胞传代,一般培养3 d后可传代。传代方法为:弃去旧培养液,用PBS清洗1次,利用适量质量分数0.25%胰蛋白酶消化(通常75 mL培养瓶加入1 mL胰蛋白酶消化),制备成细胞悬液,按照1∶3传代。当细胞到达对数生长期时,可利用细胞计数板计数。用不含胎牛血清的空白DMEM高糖培养基将细胞调整至适当浓度,接种于细胞板放入培养箱中培养,每一次实验应采用同一传代细胞。
1.2.3.2 CCK-8法检测CP和RP的B16细胞毒性
在96孔板中加入浓度为2×104个/mL的细胞悬液,每孔100 μL,常规培养24 h后,在每孔中加入10 μL待测样品或空白DMEM高糖培养基,继续常规培养24 h。每孔加入10 μL CCK-8溶液,常规培养2 h后,检测波长450 nm处的吸光值。CCK-8法检测细胞活性的计算如公式(2)所示:
细胞活力![]()
(2)
1.2.3.3 抗氧化活性评价
SOD活性检测:使用25 mL培养瓶培养B16细胞,设置对照组(DMEM高糖培养基+B16细胞)、实验组(含有样品的DMEM高糖培养基+B16细胞),培养24 h。采用SOD试剂盒,按照上述方法将25 mL培养瓶中的细胞制备成细胞裂解液加入到96孔板中,每孔100 μL。按照试剂盒说明书检测B16细胞中的SOD酶活性。每组数据设置3组平行实验。
DCFH-DA法测定活性氧自由基(reactive oxygen species, ROS):将细胞按照2×104个/mL的密度接种于不透明的96孔黑板中,设置对照组(DMEM高糖培养基+B16细胞)、实验组(含有样品的DMEM高糖培养基+B16细胞),培养24 h。之后向每孔中加入10 μmol/L DCFH-DA探针,常规培养20 min,用PBS漂洗2次,荧光酶标仪检测细胞在激发/发射波长为485 nm/530 nm下的荧光强度。
1.2.3.4 细胞内酪氨酸酶活性评价
采用前述方法制备经待测样品培养的细胞裂解液,取上清液加入到96孔板中,每孔100 μL,再加入80 μL L-DOPA,常规孵育30 min,在490 nm下检测各孔吸光值。
1.2.3.5 细胞内黑色素含量的测定
使用25 mL培养瓶培养B16细胞,设置对照组(DMEM高糖培养基+B16细胞+0.3 μmol/L α-MSH)、实验组(含有样品的DMEM高糖培养基+B16细胞+0.3 μmol/L α-MSH),培养24 h。去除培养瓶中的液体,使用胰蛋白酶消化后,收集细胞于离心管中,加入100 μL 1 mol/L NaOH溶液混匀,于80 ℃水浴30 min后,在405 nm下检测各管中样品的吸光值。
1.2.4 统计学处理
采用SPSS v20软件对实验数据进行统计学分析,数据结果采用单因素方差分析,若t检验,P<0.05,则证明有显著性差异,P<0.01,则证明有极显著性差异。
2 结果与讨论
2.1 体外保湿功能评价
皮肤的柔软和光滑是由水分决定的,仅1%的含水量变化就能显著改变皮肤的弹性和渗透性[15],因此保湿功能是评价美容功能的重要指标。以护肤品体外保湿评价常用的5%甘油为阳性对照[16],由图1可知,与纯水组相比,5%甘油处理后的保湿率显著提升。在设定的实验条件下,CP单独使用的保湿效果与5%甘油无显著性差异,且要好于RP单独使用;而CP与RP复配组的结果显示,CP与RP的比例设置为2∶1、3∶1、4∶1和5∶1时,与RP单独使用组有显著性差异,与5%甘油无显著性差异。

图1 CP与RP体外保湿结果
Fig.1 Results of moisturizing for CP and RP in vivo
注:*表示与RP组有显著性差异(P<0.05)
2.2 体外抗氧化结果
氧化致皮肤衰老是指活性氧簇随着年龄增长或应激反应无法及时清除而大量累积,与细胞内的大分子物质结合造成不可修复损伤的过程[17-18]。因此,抗氧化能力是考察美容功能的重要指标。经Excel软件处理得到Trolox相对荧光强度随时间衰减的净面积作为纵坐标,以Trolox标准溶液的浓度作为横坐标,绘制Trolox系列标准溶液标准曲线,标准曲线方程为y=0.133 4x+0.085 2,相关系数为R2=0.999 7,如图2所示。

图2 Trolox标准曲线
Fig.2 Trolox standard curve
不同浓度的CP、RP及CP和RP一定比例复配的混合液对氧自由基的吸收能力(ORAC)实验结果如图3所示。体外过氧自由基吸收能力(ORAC)测定的结果以Trolox当量表示,与RP相比,CP对于过氧自由基的吸收能力更强,具有更好的抗氧化性。当CP与RP以一定比例复合后,抗氧化能力随CP含量的增强呈梯度剂量效应。当CP与RP的混合比例在4∶1和5∶1时,ORAC值与比例为3∶1的结果无显著性差异(P>0.05),但与比例为2∶1组的结果有显著性差异(P<0.05)。
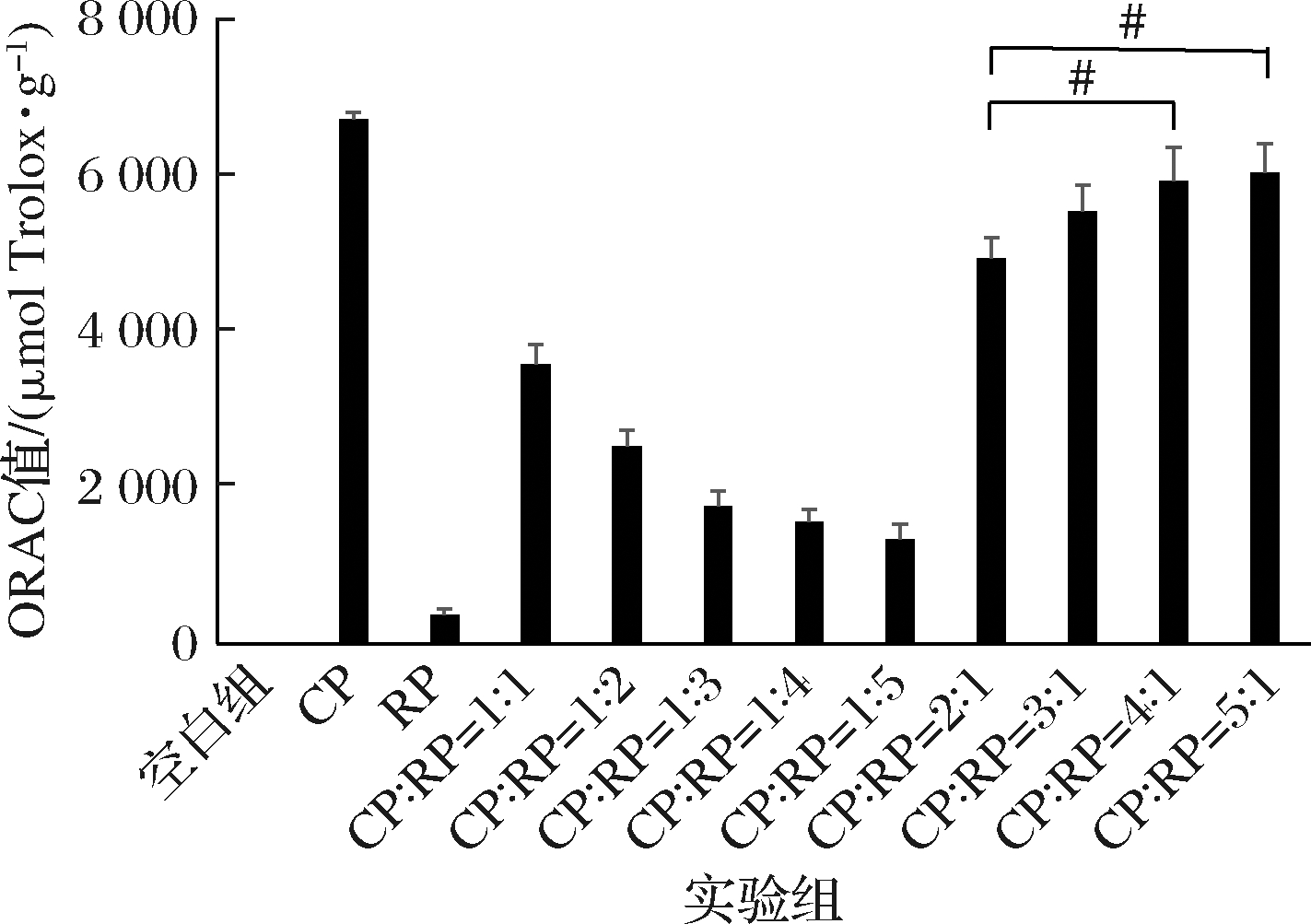
图3 CP、RP及其复合物体外抗氧化(ORAC)结果
Fig.3 Antioxidant (ORAC) results of CP, RP and their complexes in vitro
注:#表示与CP∶RP=2∶1组有显著性差异(P<0.05)
2.3 体外抑制酪氨酸酶实验结果
酪氨酸酶活性测定法具有测定时间短、操作简便、所需费用低的特点,适用于对美白剂进行快速筛选[19]。CP、RP及2种原料复配对酪氨酸酶的抑制活性结果如图4所示。
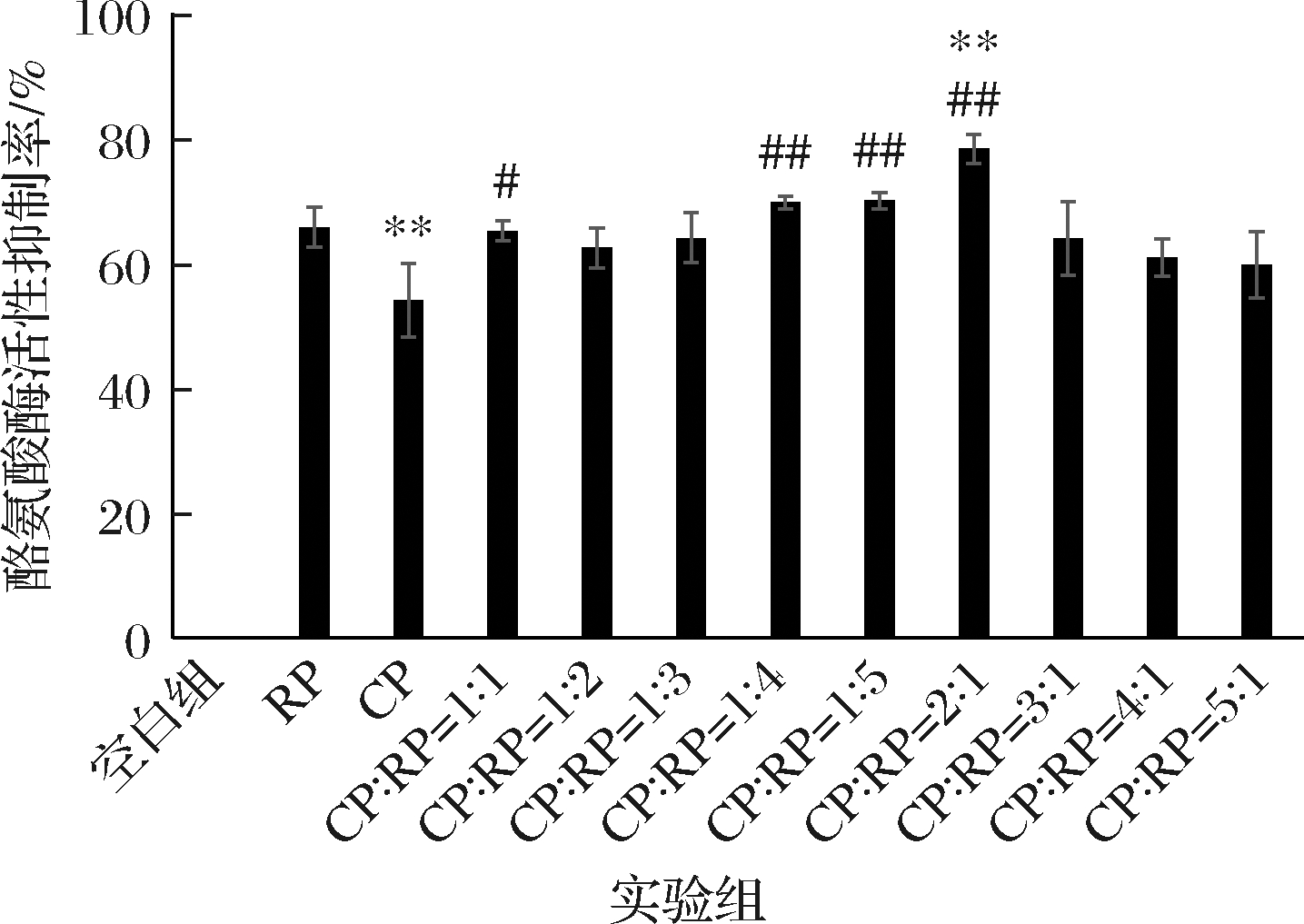
图4 CP、RP及其复合物体外抑制酪氨酸酶实验结果
Fig.4 Results of inhibition of tyrosinase by CP, RP and their complexes in vitro
注:#,与CP组相比,差异显著(P<0.05),##差异 极显著(P<0.01);*,与RP组相比差异显著(P<0.05), **,差异极显著(P<0.01)(下同)
在单独使用时,RP比CP的酪氨酸酶抑制活性更强且差异极显著,但当二者复配时呈现出了不同的结果。CP与RP以1∶1的比例复配时,酪氨酸酶抑制活性与RP单独使用无显著差异(P>0.05),但与CP单独使用差异显著(P<0.05),此外,随着CP与RP比例的升高至1∶4和1∶5时,酪氨酸酶活性抑制率与CP呈极显著差异(P<0.01)。当CP与RP以2∶1比例复配时,对酪氨酸酶的抑制率效果最好,且高于其他复配比例组合的结果,与RP、CP单独使用组的结果差异极显著(P<0.01)。说明RP与CP的复配对酪氨酸酶的抑制活性并非简单叠加,而是协同增效。因此,结合体外抗氧化实验结果,选择CP∶RP=1∶1、2∶1和3∶1进行下一步细胞实验的探讨。
2.4 CCK-8法确定待测样品的B16细胞毒性
采用CCK-8法对不同浓度的RP、CP及CP与RP的复配溶液进行了B16细胞毒性考察,结果如表2所示。综合各实验组的细胞存活率,样品质量浓度为200 μg/mL组与空白组无显著性差异,因此选择样品质量浓度为200 μg/mL作为细胞实验的样品添加浓度。
表2 CCK-8法测定细胞毒性结果
Table 2 Cytotoxicity determination (CCK-8)
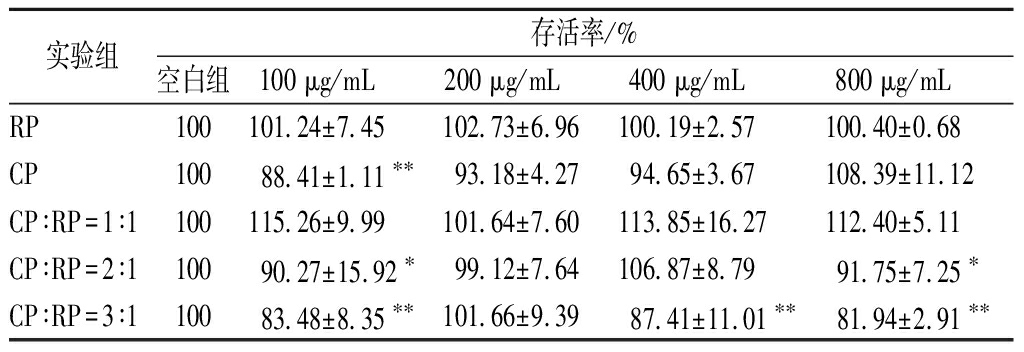
实验组存活率/%空白组100 μg/mL200 μg/mL400 μg/mL800 μg/mLRP100101.24±7.45102.73±6.96100.19±2.57100.40±0.68CP10088.41±1.11∗∗93.18±4.2794.65±3.67108.39±11.12CP∶RP=1∶1100115.26±9.99101.64±7.60113.85±16.27112.40±5.11CP∶RP=2∶110090.27±15.92∗99.12±7.64106.87±8.7991.75±7.25∗CP∶RP=3∶110083.48±8.35∗∗101.66±9.3987.41±11.01∗∗81.94±2.91∗∗
注:*,与空白组相比,差异显著(P<0.05),**,差异极显著(P<0.01)
2.5 RP、CP及其复合物对B16细胞内酪氨酸酶活性的影响
皮肤中黑色素的生成过程的关键限速酶是酪氨酸酶[20],酪氨酸酶将酪氨酸催化生成多巴、多巴醌,再通过进一步的生化反应生成黑色素。为研究RP和CP及其复合物对B16细胞内酪氨酸酶的影响检测了B16细胞内酪氨酸酶的活性。如图5所示,与空白组相比,经过RP、CP及其复合物处理的B16细胞内酪氨酸酶的活性均有降低。CP与RP以2∶1的比例复合对细胞内酪氨酸酶的活性抑制效果最佳,且与RP组、CP组差异极显著(P<0.01),当比例为3∶1时,与RP组差异显著(P<0.05)。由此可知,对于抑制B16细胞内酪氨酸酶活性的最佳复配比例为CP∶RP=2∶1。
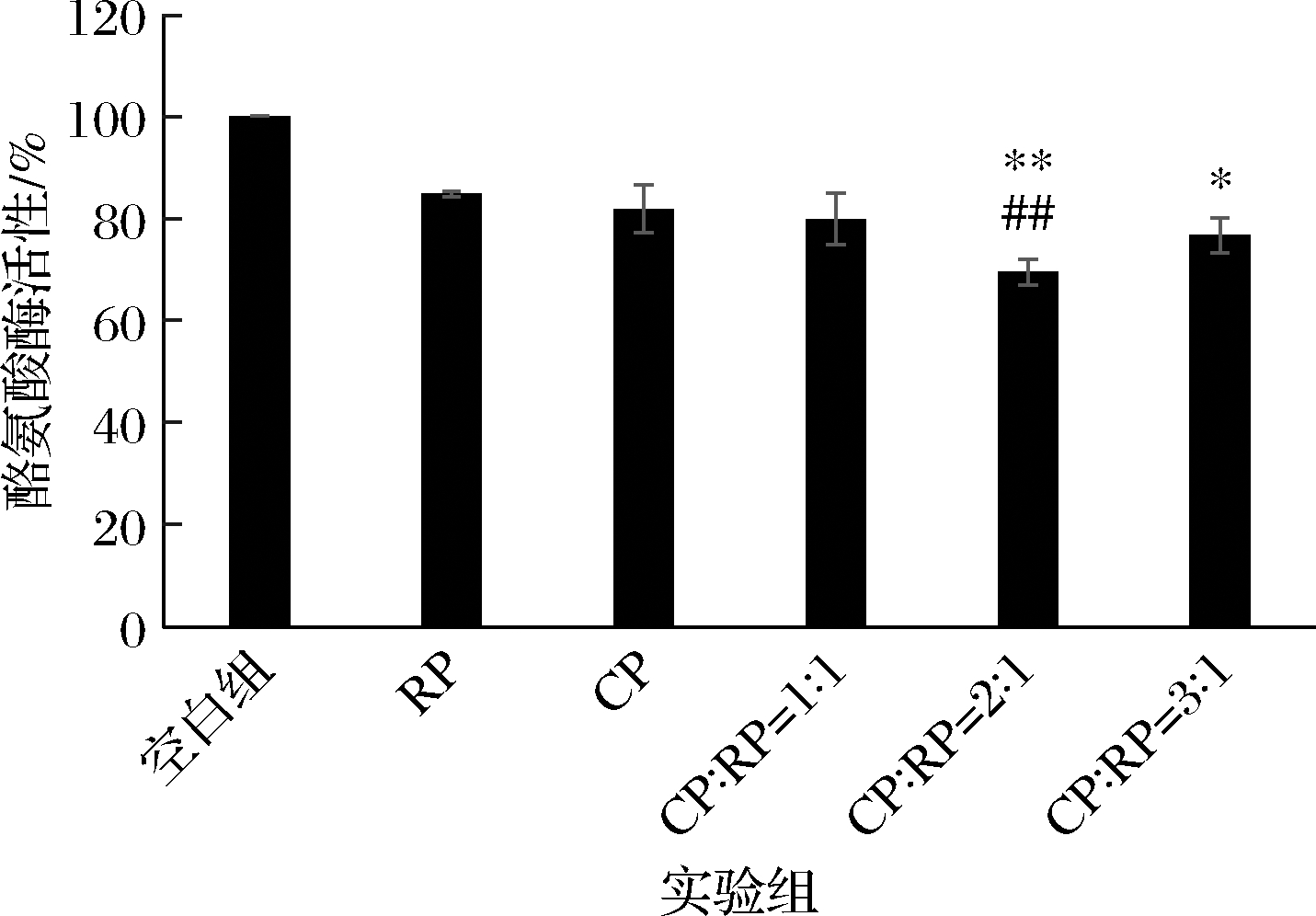
图5 CP、RP及其复合物对B16细胞内酪氨酸酶 活性的影响
Fig.5 Effects of CP, RP and their complexes on tyrosinase activity in B16
2.6 RP、CP及其复合物对B16细胞内抗氧化水平的影响
细胞内过量的的ROS能够引起细胞内氧化应激,消耗抗氧化物质或导致抗氧化酶失活,诱导黑色素细胞增殖和激活黑色素生成的关键酶,刺激黑色素生成[21]。SOD是广泛存在于生物体内的抗氧化酶,在维持机体氧化与抗氧化平衡中起到至关重要的作用[22]。因此,细胞内ROS和SOD水平能够反应细胞内氧化和抗氧化的水平。图6和图7的结果显示,随着RP、CP及其复合物的加入,细胞内ROS水平降低,SOD活力升高。且当二者复合时,抗氧化效果更好。同时,CP与RP以2∶1的比例复合时,ROS相对含量与RP组、CP组差异极显著(P<0.01),SOD活力与RP组、CP组差异极显著(P<0.01),抗氧化水平最强。

图6 CP、RP及其复合物对B16细胞内ROS水平的影响
Fig.6 Effects of CP, RP and their complexes on ROS level in B16

图7 CP、RP及其复合物对B16细胞内SOD活力的影响
Fig.7 Effects of CP, RP and their complexes on SOD activity in B16
3 结论
体外抗氧化实验(ORAC)法检测得到的最佳抗氧化复配肽的比例为CP∶RP=3∶1,这与B16细胞内SOD酶活性和ROS含量检测对应的复配肽比例CP∶RP=2∶1不一致,这可能与抗氧化物质、自由基以及二者之间的作用机制的复杂性相关。事实上,没有任何1种单一反应可以精确地反映所有自由基混合物中所有的抗氧化剂的抗氧化能力。抗氧化剂系统包括酶,如超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶等,还包括一些大分子,如白蛋白、铜蓝蛋白、铁蛋白等,也包括一些小分子,如抗坏血酸、生育酚、泛素-10、还原型谷胱甘肽等。因此,难以单独测量组织中每种抗氧化成分以及不同抗氧化成分之间的相互作用。因此,以ORAC等为代表的总抗氧化能力测定方法,由于其高特异性而被广泛使用。然而,ORAC也具有一定缺陷,例如,CAO等[23]认为,ORAC法与TEAC法对抗氧化水平的检测结果可能不具有相关性。
尽管CP与RP均具有一定的抗氧化性和保湿性能,且对于酪氨酸酶活性具有一定的抑制作用,但是CP在抗氧化和保湿方面具有更好的效果,而RP在抑制酪氨酸酶活性方面效果更佳。因此,为了寻求1款在促进皮肤健康方面功效更全面的原料,将CP和RP进行了复配,结果发现复配原料能够在促进保湿、抗氧化和抑制酪氨酸酶活性方面能够比单一原料使用协同增效。
CP与RP以2∶1的比例复配,能够表现出比5%甘油更强的体外保湿效果;体外生化实验中,具有比2种肽原料单独使用或以其他比例复配更强的酪氨酸酶抑制活性;并在小鼠黑素瘤细胞B16的细胞实验中,能够清除细胞内的氧自由基,提高细胞内SOD酶的活力,显著降低酪氨酸酶的活性。
[1] SI S Y, GUO Y C, XU B X, et al.Protective effects of collagen peptides on the dexamethasone-induced immunosuppression in mice[J].International Journal of Peptide Research and Therapeutics, 2021, 27(2):1 493-1 499.
[2] CHEN J D, SUN S S, LI Y S, et al.Proteolysis of tilapia skin collagen:Identification and release behavior of ACE-inhibitory peptides[J].LWT, 2021, 139:110502.
[3] 苏宏娇, 武学霞, 刘天天,等.口服小分子胶原蛋白肽对面部皮肤年轻化的效果[J].中华医学美学美容杂志, 2020, 26(3):235-241.
SU H J, WU X X, LIU T T, et al.Effect of oral administration of low-molecular-weight collagen peptide on facial skin rejuvenation[J].Chinese Journal of Medical Aesthetics and Cosmetology, 2020, 26(3):235-241.
[4] PENG X, XU J, TIAN Y, et al.Marine fish peptides (collagen peptides) compound intake promotes wound healing in rats after cesarean section[J].Food & Nutrition Research, 2020, 64:4247.
[5] ZHANG R X, WEI Y, LI M L, et al.Melanogenesis effects of rice protein hydrolysate and its characteristic peptides Leu-Leu-Lys, Leu-Pro-Lys, and pyroGlu-Lys on UVB-induced human epidermal melanocyte cells[J].Food & Function, 2020, 11(10):8 757-8 767.
[6] OCHIAI A, TANAKA S, TANAKA T, et al.Rice bran protein as a potent source of antimelanogenic peptides with tyrosinase inhibitory activity[J].Journal of Natural Products, 2016, 79(10):2 545-2 551.
[7] 肖岚, 李诚, 程小平, 等.牦牛血抗氧化低聚肽的稳定性及与其他食源性低聚肽抗氧化互作分析[J].江苏农业科学, 2019,47(15):226-232.
XIAO L, LI C, CHENG X P, et al.Analysis of stability of yak blood antioxidant oligopeptide and its antioxidant interactions with other food derived oligopeptides[J].Jiangsu Agricultural Sciences, 2019,47(15):226-232.
[8] OHNO M, ITO K, LAN V T T, et al.Synergistic inhibition of human dipeptidyl peptidase IV by combinations of peptides[J].Peptides, 2015, 69:115-117.
[9] 饶胜其, 徐美玲, 高璐, 等.鸡蛋清蛋白酶解肽和大豆蛋白酶解肽的协同抗氧化活性[J].食品科学, 2014, 35(23):108-113.
RAO S Q, XU M L, GAO L, et al.Synergistic antioxidant activities of peptides derived from egg white proteins and soybean proteins by enzymatic hydrolysis[J].Food Science, 2014, 35(23):108-113.
[10] 王昌涛, 何聪芬, 董银卯, 等.保湿剂性能评价体内法和体外法比较的研究[J].香料香精化妆品, 2006(4):14-16;36.
WANG C T, HE C F, DONG Y M, et al.Study on moisturizing agent performance by in vivo vs in vitro way[J].Flavour Fragrance Cosmetics, 2006(4):14-16;36.
[11] 郑景如, 孙馨娉, 蔡紫仪, 等.优选南极磷虾蛋白肽抗氧化活性组分[J].食品安全质量检测学报, 2020, 11(1):189-195.
ZHENG J R, SUN X P, CAI Z Y, et al.Optimizing the antioxidant components of Antarctic krill protein peptides[J].Journal of Food Safety & Quality, 2020, 11(1):189-195.
[12] 林恋竹, 朱启源, 赵谋明.辣木籽抗氧化肽的制备及其对氧化损伤红细胞的保护作用[J].食品科学, 2019, 40(7):40-46.
LIN L Z, ZHU Q Y, ZHAO M M.Preparation of antioxidant peptide from Moringa oleifera seeds and its protective effects on oxidatively damaged erythrocytes[J].Food Science, 2019, 40(7):40-46.
[13] 王飞飞, 王敏竹, 王晗, 等.藏荆芥提取物对酪氨酸酶活性及其动力学研究[J].日用化学工业, 2019, 49(5):315-319;345.
WANG F F, WANG M Z, WANG H, et al.The effect of extract of Nepeta angustifolia C.Y.Wu on tyrosinase activity and kinetics[J].China Surfactant Detergent & Cosmetics, 2019, 49(5):315-319;345.
[14] 黄佳楠, 管福琴, 李林蔚, 等.黑果枸杞果实提取物中花色苷对酪氨酸酶活性的抑制作用初探[J].植物资源与环境学报, 2020, 29(3):75-77.
HUANG J N, GUAN F Q, LI L W, et al.Preliminary study on inhibitory effect of anthocyanins from fruit extracts of Lycium ruthenicum on tyrosinase activity[J].Journal of Plant Resources and Environment, 2020, 29(3):75-77.
[15] PADAMWAR M N, PAWAR A P, DAITHANKAR A V, et al.Silk sericin as a moisturizer:An in vivo study[J].Journal of Cosmetic Dermatology, 2005, 4(4):250-257.
[16] 李来丙, 龚必珍.芦荟在护肤制品中的保湿性的研究[C].中国化工学会精细化工专业委员会第59次学术会议暨全国第十一次工业表面活性剂技术经济与应用开发会议.北京:中国化工学会, 2002.
LI L B, GONG B Z.Study on Moisture Retention of Aloe in Cosmetic of Skin Protection[C].The 59th Academic Conference of the Fine Chemicals Professional Committee of the Chinese Chemical Society and the 11th National Conference on Technology, Economy and Application Development of Industrial Surfactants.Beijing:The Chemical Industry and Engineering Society of China, 2002.
[17] KRISTAL B S, YU B P.An emerging hypothesis:Synergistic induction of aging by free radicals and Maillard reactions[J].Journal of Gerontology, 1992, 47(4):B107-B114.
[18] 陈菊萍, 陶佳, 徐剑丹, 等.皮肤老化与非酶翻译后修饰的相关研究进展[J].皮肤性病诊疗学杂志, 2019, 26(6):378-380.
CHEN J P, TAO J, XU J D, et al.Research progress of skin aging and non enzymatic post-translational modification[J].Journal of Diagnosis and Therapy on Dermato-Venereology, 2019, 26(6):378-380.
[19] 陶丽莉, 刘洋, 吴金昊, 等.化妆品美白功效评价方法研究进展[J].日用化学品科学, 2015, 38(3):15-21.
TAO L L, LIU Y, WU J H, et al.Advance in the study of efficacy assessment of lightening cosmetics[J].Detergent & Cosmetics, 2015, 38(3):15-21.
[20] LIN J Y, FISHER D E.Melanocyte biology and skin pigmentation[J].Nature, 2007, 445(7 130):843-850.
[21] 姜锐, 刘建增, 徐晓浩, 等.人参提取物对于α-MSH作用的小鼠黑色素瘤B16细胞黑色素生成作用机制研究[C].第十一届中国化妆品学术研讨会论文集.北京:中国香料香精化妆品工业协会, 2016.
JIANG R, LIU J Z, XU X H, et al.Ginseng Extract Inhibit α-Melanocyte-Stimulating Hormone-Induced Melanogenesis B16 Mouse Melanoma Cells[C].The 11th China Cosmetic Academic Symposium.Beijing:China Association of Fragrance Flavor and Cosmetic Industries, 2016.
[22] 高鑫. 季铵化壳聚糖修饰的超氧化物歧化酶抗骨关节炎的药效学研究[D].济南:山东大学, 2018.
GAO X.Study on the therapeutic effect of superoxide dismutase conjugated with O-quaternary chitosan derivatives on osteoarthritis[D].Jinan:Shandong University, 2018.
[23] CAO G H, PRIOR R L.Comparison of different analytical methods for assessing total antioxidant capacity of human serum[J].Clinical Chemistry, 1998, 44(6):1 309-1 315.