一般传统鸡汤熬制通过热反应使鸡肉风味物质转移至水中,并将蛋白质水解成氨基酸,所熬制的鸡汤风味鲜美[1],但是这种方式消耗大量能量,成本较高。一些餐饮业使用鸡肉风味基料替代鸡汤经过长时间熬制产生的鸡肉香味,但是多数鸡汤风味模拟性较差,可能是因为企业为了降低成本使用了植物蛋白风味基料[2],与鸡肉风味相似度不高。
研究发现,鸡骨架作为鸡肉分割生产的副产物,蛋白质和呈味氨基酸含量高于鸡肉,有较高的营养价值,具有作为风味基料的潜力[3]。利用鸡骨架酶解产物进行美拉德反应制备鸡肉风味基料,可以使鸡肉本身的风味物质得到表达,同时对低附加值产品鸡骨架进行利用,降低了生产成本。于亚辉等[4]以鸡肉酶解液为反应基底,探究制备风味基料的最优条件,得到的产物色泽均匀、肉香味突出;曾晓房[3]以鸡骨架酶解液为原料,优化了制备鸡肉风味基料的条件,研究了酶解肽在反应中的降解、酶解程度以及肽段组分对肽降解的影响及其内在关系。工业生产通过酶解和美拉德反应制备风味基料的研究大都是探究反应的最佳条件,对美拉德反应前后的呈味特性分析少见报道。
因此,本研究对鸡骨架进行酶解,以酶解液为原料,探究pH、温度和时间对褐变程度、低分子香味中间体生成量和感官评价的影响,通过Box-Behnken响应面优化反应条件。对反应前后的滋味、气味、游离氨基酸和挥发性风味物质含量进行分析,以期利用鸡骨架制备风味基料,为鸡肉分割副产物的综合利用提供理论参考。
1 材料与方法
1.1 材料与试剂
黄羽肉鸡鸡骨架取自新兴县温氏佳丰食品有限公司鸡肉分割生产线,肉鸡品种为818肉杂鸡,日龄52 d左右,母鸡,取样时间为宰后1~2 h。
风味蛋白酶(酶活力30 000 U/g),金克隆生物技术有限公司;NaOH等试剂均为分析纯,上海麦克林生化科技有限公司。
1.2 仪器
HWS-26 电热恒温水浴锅,上海齐欣科学仪器有限公司;MS304TS/02电子天平、S2-Food Kit型pH计,瑞士梅特勒托利多公司;Allegar-64R 型低温离心机,美国贝克曼库尔特公司;PD500高速均质机,普律玛仪器有限公司;DH-9240A烘箱,上海浦东荣丰科学仪器有限公司;INFINITE 200 PRO酶标仪,瑞士帝肯公司;LC-20AT 高效液相色谱仪,岛津公司;LDZH-200KBS立式压力蒸汽灭菌器,上海申安医疗器械厂;FlavourSpec®气相离子迁移谱仪,德国GAS公司;SA-402B 电子舌,日本INSENT公司;PEN3便携式电子鼻,德国埃尔森斯检测公司。
1.3 试验方法
1.3.1 酶解液的制备
参考张恒[5]的方法并做适当修改。将鸡骨架洗净、沥干、绞碎成鸡骨泥,加入一定量的去离子水调节蛋白浓度为5%(蛋白质浓度用凯氏定氮法测量),用匀浆机匀浆(10 000 r/min, 20 s×3),经加热预处理10 min,加入风味蛋白酶7 000 U/g,调节pH为7,置于恒温水浴(50 ℃)中酶解4 h,酶解结束后沸水浴10 min灭酶,此时具有最高的水解度和氮回收率,分别达到33.54%和96.20%。冷却后离心(3 580×g,10 min),上清液即为酶解液。
1.3.2 鸡骨架美拉德反应产物(Maillard reaction products, MRPs)的制备
参考曾晓房[3]的方法并做适当修改,取50 g鸡骨架酶解液,加入水解植物蛋白10 g(游离氨基酸含量为2 932.5 mg/g),葡萄糖1.5 g,木糖1.5 g,半胱氨酸盐酸盐0.6 g,甘氨酸0.4 g,丙氨酸0.4 g,维生素B1 0.75 g,鸡脂2 g,酵母抽提物0.12 g,调节反应pH,使其在一定的温度和时间进行美拉德反应。
1.3.3 反应工艺的选择
固定反应原料,控制时间60 min,温度110 ℃,调节pH分别为4、5、6、7、8,优化美拉德反应的最佳pH值;固定反应原料,并将pH值调节最佳,将温度调节为80、90、100、110、120 ℃,反应60 min,优化最佳反应温度;固定反应原料,将pH和温度调为最佳,调节反应时间为15、30、45、60和75 min,优化最佳反应时间。
1.3.4 褐变程度的测定
参考CHEN等[6]的方法并做适当修改,将鸡骨架MRPs稀释20倍,以水为参比,测定其在420 nm处的吸光值,吸光值表示褐变程度。
1.3.5 低分子香味中间体含量的测定
美拉德反应过程中会产生低分子香味中间体,一般用280 nm的吸光度值表示[7],吸光度越大,产生的香味物质越多。将MRPs稀释80倍,测定其在280 nm处的吸光度。
1.3.6 Friedman排序检验法
将MRPs稀释10倍,置于常温(27 ℃)下放置30 min,以避免因为温度引起的评估差异。样品以5个编号随机编码,呈现给10个经过培训的感官评价员,评价过程中禁止评价员互相讨论。感官评价方法参考Friedman排序检验法[8],根据样品的风味和可接受程度对样品进行排序,用Kramer检定法对样品的显著性差异进行分析。
1.3.7 Box-Behnken响应面试验
响应面设计中因素及水平见表1。
表1 响应面设计因素及水平
Table 1 Factors and levels of response surface method
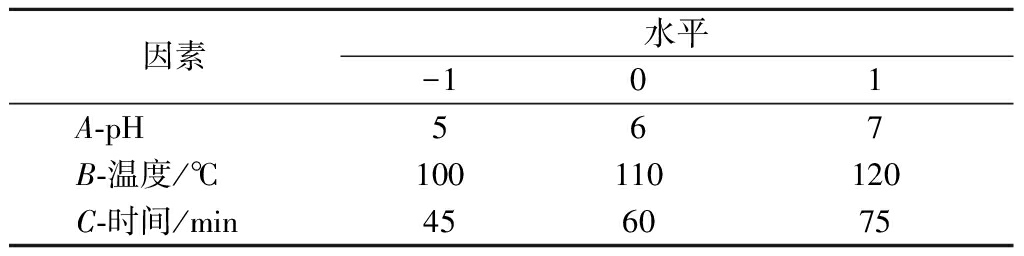
因素水平-101A-pH567B-温度/℃100110120C-时间/min456075
1.3.8 模糊感官评价
参考高娟等[9]的方法并做适当修改。
1.3.8.1 建立因素集和评语集
因素集是感官评价指标的集合。本试验因素集U={u1,u2,u3,u4}={肉香味,烤香味,硫味,糊味};评语集是感官评价员对因素集反馈信息的集合,本试验以极优、优、良、中、差和极差为评语等级,评语集V={V1,V2,V3,V4,V5,V6}={极优,优,良,中,差,极差},其中V1=5分、V2=4分、V3=3分、V4=2分、V5=1分、V6=0分。
1.3.8.2 建立感官评价因素权重集
通过用户调查法确定鸡骨架MRPs评价过程中肉香味、烤香味、硫味和糊味4个因素所占的权重。对4个因素在整体质量因素的权重进行打分,总分为10分,评价员认为肉香味、烤香味和硫味占的比重越大,评分越高,糊味占的比重越大,评分越低。根据10名评价员的评价结果进行处理后即可得到因素集的模糊权重向量α=(α1,α2, α3,α4)=(0.39, 0.34, 0.14, 0.13),其中α1+α2+α3+α4=1。
1.3.8.3 模糊矩阵及模糊变换
统计各因素中每个等级票数占总票数的比例可得到Cij(i=1, 2, 3,…m;j=1, 2, 3, …n),根据投票结果可以得出从α到V的关系矩阵Rk。其中,k为样品编号,B为k号样品的综合评价结果,即Bk=α×Rk。最后各个评价的等级值乘等级分值后进行加和,得出模糊评价等级值Y,Y=B×V。
1.3.9 电子舌测定
参考石月等[10]的方法。准确移取30 mL样品于烧杯中,按照1∶4体积比加入蒸馏水,以8 000×g离心10 min后通过0.45 μm滤膜抽滤至澄清,取40 mL样品放于电子舌专用杯中进行检测,采样时间为120 s,每组样品重复4次。运用系统自带的数据库进行分析。
1.3.10 电子鼻测定
参考GAO等[11]的方法并做适当修改,室温下吸取1 mL样品置于20 mL顶空瓶中,在室温下放置20 min进行测定,每个样品测3个平行。
1.3.11 氨基酸含量的测定
取10 μL样品放置于离心管中,氮吹仪45 ℃下吹干,加入10 μL干燥剂,氮气流吹干,加入衍生剂20 μL密闭衍生30 min,氮气流下吹干,加入稀释剂200 μL,上机测定。
1.3.12 挥发性风味物质的测定
参考胡洋健等[12]的方法。采用气相-离子迁移谱(GC-ion mobility spectroscopy, GC-IMS)对酶解液和MRPs进行挥发性风味物质的检测。分别取100 μL放入顶空进样瓶,80 ℃孵化10 min,每个样品运行时间30 min。
1.4 数据处理
数据用平均值±标准差表示(n=3),用SPSS Statistics 25软件进行单因素方差分析和独立样本t检验,如果ANOVA效应显著,用Duncan’s方法进行多重比较,显著水平设为P<0.05;响应曲面试验用Design-Expert 8.0.6软件进行设计和结果统计分析,用Origin 2018软件绘图;利用R软件结合FactoMineR[13]和factoextra[14]程序包对电子鼻测定结果进行主成分分析和绘图。
2 结果与分析
2.1 单因素试验结果
2.1.1 pH对美拉德反应的影响
由图1可知,随着pH的增加,420 nm处的吸光值逐渐增大,表明褐变程度逐渐升高,280 nm处的吸光值在pH 4~8先升高后降低,在pH为6时有最大值0.66,反映出低分子香味中间体生成量先增加后减小。pH对美拉德反应的风味物质具有很重要的影响[15],在pH过低时,肽段的氨基和氨基酸发生质子化,阻碍了羰胺缩合反应,使得一些特征风味减少[16],pH较高时反应速度加快[17],但是褐变严重且生成不具有香味的大分子物质,故pH为6时低分子香味中间体生成量最高。

图1 不同pH对MRPs褐变程度和中间产物生成量的影响
Fig.1 Effect of different pH on the browning degree of MRPs and the amount of intermediate products
注:不同字母表示差异显著(P<0.05)(下同)
根据Friedman排序检验法对不同pH的样品品质进行评价,不同pH条件下的秩和见表2,秩次从大到小表示品质从优到劣,样品进行显著性分析,查表3得J=10(评价员数),P=5(样品数)的临界值,上段用于确定样品间是否有显著性差异,若有显著性差异,通过下段对样品的显著性差异进行分组。在5%显著性水平上,由Rimin=20>17=RE,Rimax=40<43=RC可知,各样品在该水平上有显著性差异,通过下段将样品分组:<23的为一组,>37的为一组,位于23~37的为一组,因此,将5个样品分为3组:ABD、C和E组,由此可知,C组(pH 6)整体风味最好,E组(pH 8)整体风味最差。低pH造成的还原环境促进H2S的释放从而形成多硫化物[18],pH过高时,产生较多的NH3,在这2个条件下,均不能产生较好的风味。通过秩和比较RC=43>RB=37>RD=30,选择pH 6为反应的最佳pH。
表2 不同pH条件下样品的秩和
Table 2 Rank sum of samples under different pH conditions
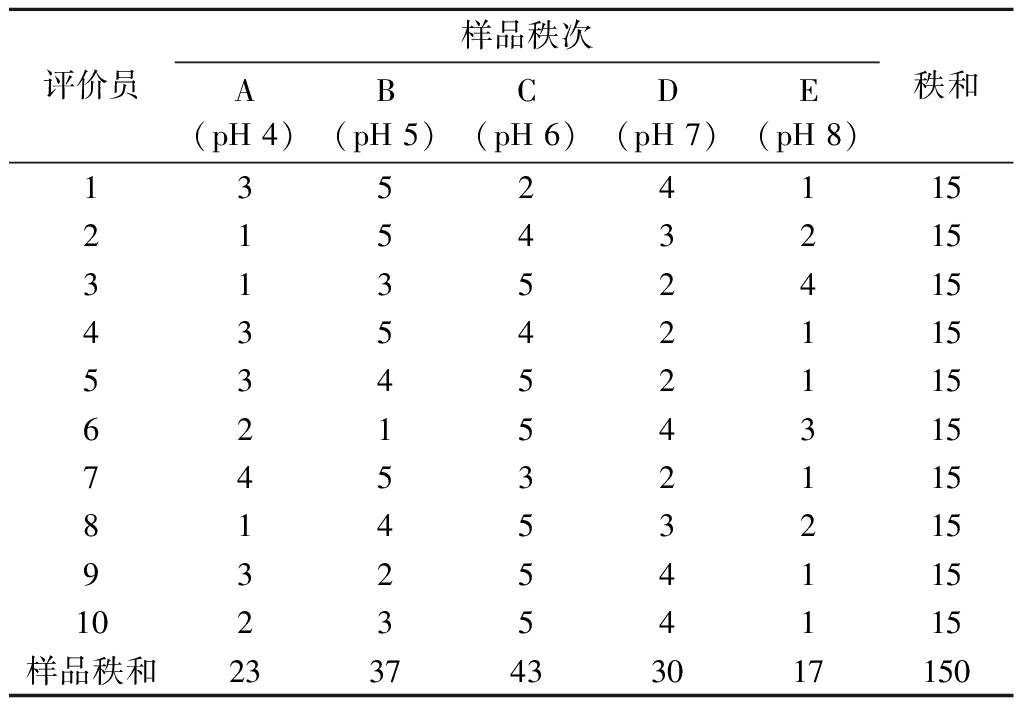
评价员样品秩次A(pH 4)B(pH 5)C(pH 6)D(pH 7)E(pH 8)秩和135241152154321531352415435421155345211562154315745321158145321593254115102354115样品秩和2337433017150
表3 顺位检验法检验表[8]
Table 3 Test table of sequential test method

范围5%显著水平1%显著水平上段20~4018~42下段23~3720~40
2.1.2 温度对美拉德反应的影响
如图2所示,随着温度的升高,褐变程度增加(P<0.05),美拉德反应在第3阶段产生的类黑精类物质增多,反应体系颜色加深。低分子香味中间体的生成量随着温度增加呈现先增加后降低的趋势(P<0.05),在100 ℃时280 nm处吸光值达到0.63,低分子香味中间体积累量最多,温度较高时一些糖类物质遭到破坏,蛋白肽发生热降解,产生过多杂味物质,同时伴随有焦糊味[9],这可能是温度升高低分子香味中间体生成量减少的原因之一。TAN等[19]提出不同的温度会导致反应沿不同的支路进行,故温度不同时褐变程度和低分子香味中间体生成量有较大的区别。
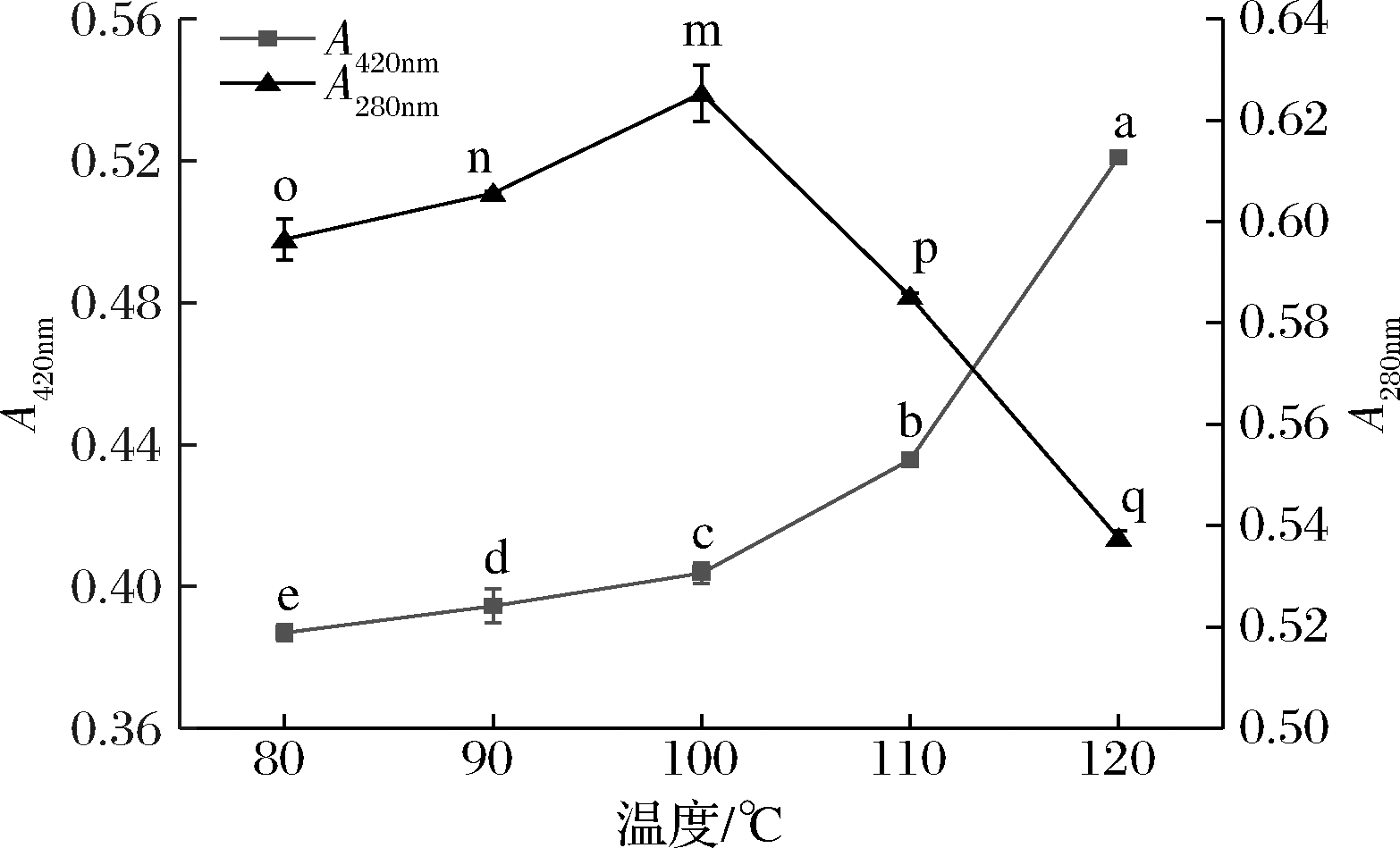
图2 不同温度对MRPs褐变程度和中间产物生成量的影响
Fig.2 Influence of different temperatures on browning degree of MRPs and production of intermediates
由表4可知,在5%显著性水平上,由Rimin=21>13=RE,Rimax=40<45=RC可知,各样品在该水平上有显著性差异,通过下段将样品分为3组,AE、BD和C组,由此可知,C组(100 ℃)整体风味最好,肉香浓郁,B组(90 ℃)和D组(110 ℃)次之,A组(80 ℃)和E组(120 ℃)整体风味最差。温度较低时蛋白质与糖反应不充分,游离氨基不会马上暴露出来,肉香味没有被完全释放出来,温度较高时有较大的焦糊味等不愉快的气味。故选择100 ℃作为反应温度。
2.1.3 时间对美拉德反应的影响
如图3所示,随着反应时间的延长,MRPs褐变程度显著增大(P<0.05),类黑精物质的生成量也不断增加。在15~60 min,低分子香味中间体生成量不断增加(P<0.05),而后随着时间延长而减小,在60 min时有最高的低分子香味中间体生成量。
表4 不同温度下样品的秩和
Table 4 Rank sum of samples at different temperatures
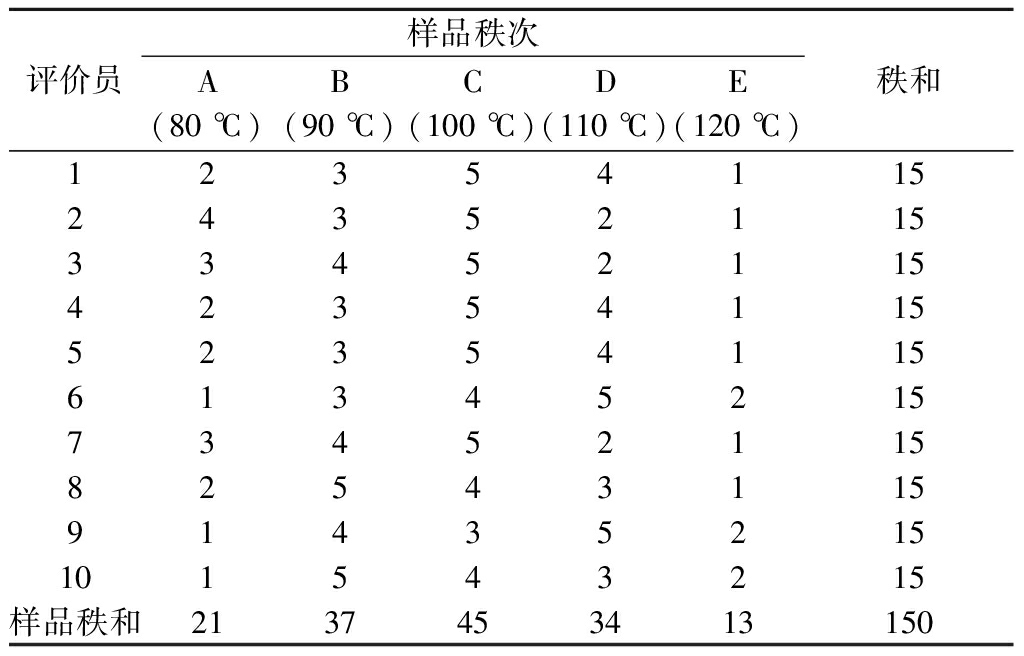
评价员样品秩次A(80 ℃)B(90 ℃)C(100 ℃)D(110 ℃)E(120 ℃)秩和123541152435211533452115423541155235411561345215734521158254311591435215101543215样品秩和2137453413150
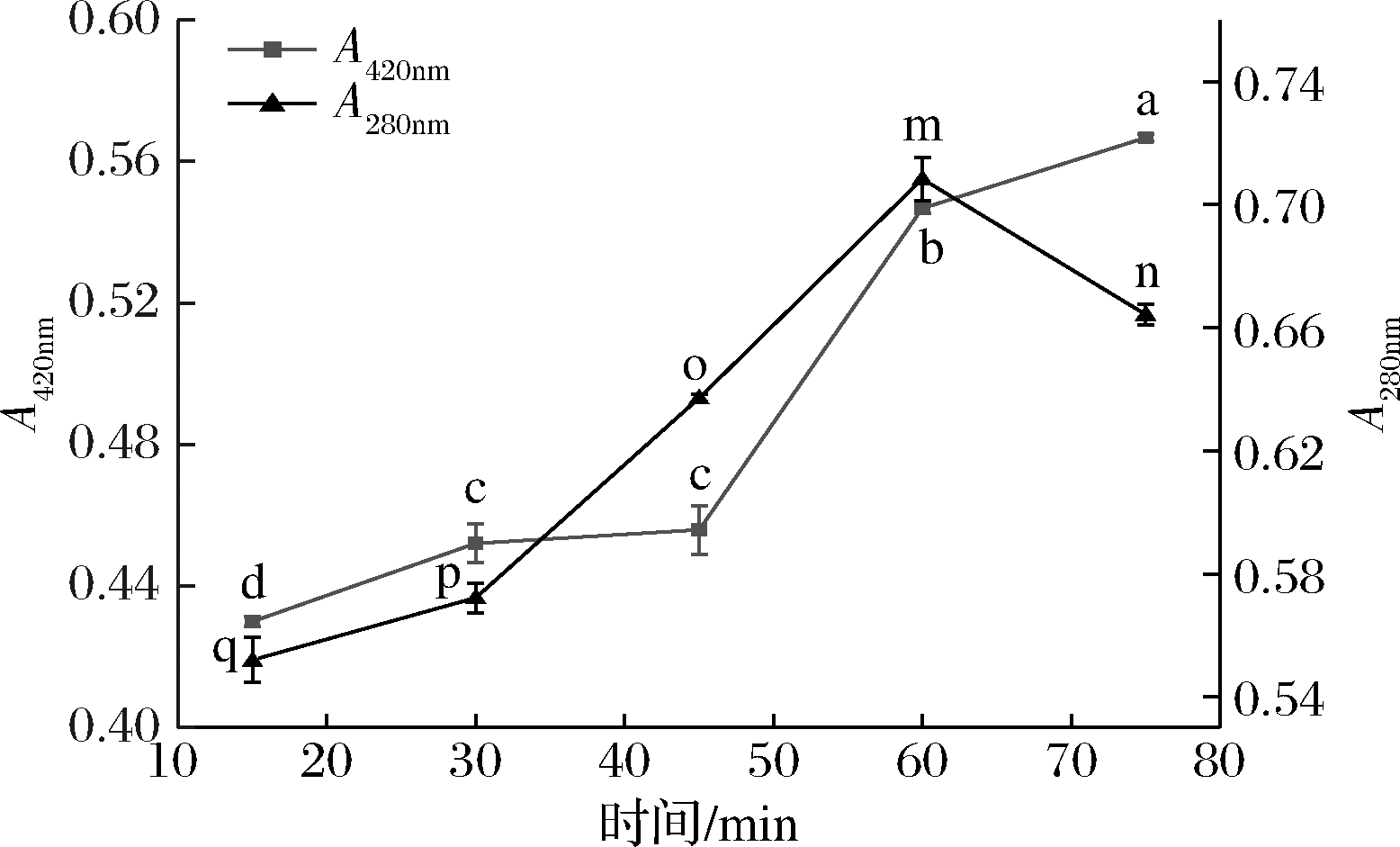
图3 不同时间对MRPs褐变程度和中间产物生成量的影响
Fig.3 Effect of different time on the browning degree of MRPs and the production of intermediates
由表5可知,在5%显著性水平上,由Rimin=21>20=RE,Rimax=40<42=RD可知,各样品在该水平上有显著性差异,通过下段将样品分为3组,ABC、D和E组,由此可知,D组(60 min)整体风味最好,ABC组次之,E组整体风味最差,原因可能是时间太短,美拉德反应不充分,产生的风味物质较少,时间太长,会产生较重糊味和硫味,掩盖肉香味和烤香味。选择60 min作为后续反应时间。
表5 不同反应时间样品的秩和
Table 5 Rank sum of samples at different time

评价员样品秩次A(15 min)B(30 min)C(45 min)D(60 min)E(75 min)秩和142351152314521534135215424531155251431561245315754321158145321592435115101235415样品秩和2529344220150
2.2 响应面试验结果及最佳工艺验证
2.2.1 回归模型的建立和方差分析
响应面实验设计及结果如表6所示,对实验结果进行方差分析,对数据进行多元回归拟合,得到感官评价对pH(A)、温度(B)、时间(C)的二次响应曲面回归方程如下:
Y=86.19-4.05A-6.94B-1.82C+0.085AB-1.91AC-0.84BC-7.63A2-8.39B2-7.63C2
表6 响应曲面试验设计与结果
Table 6 Design and experimental results of response surface methodology(RSM)
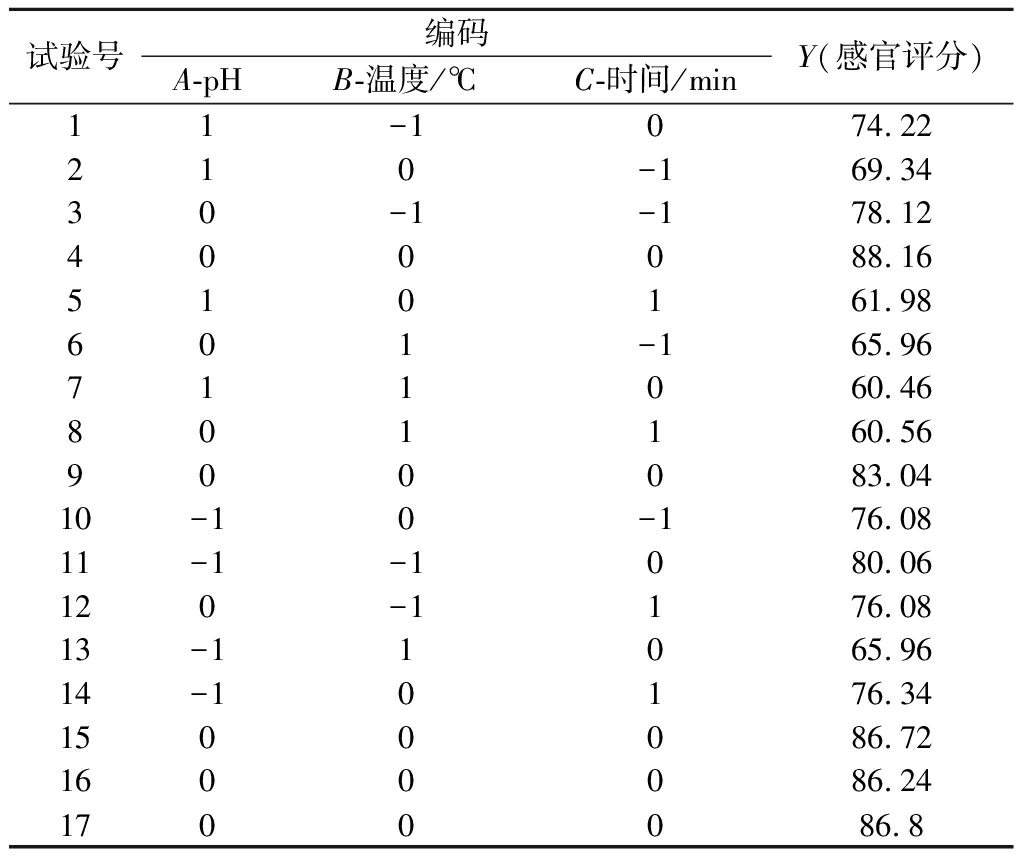
试验号编码A-pHB-温度/℃C-时间/minY(感官评分)11-1074.22210-169.3430-1-178.12400088.16510161.98601-165.96711060.46801160.56900083.0410-10-176.0811-1-1080.06120-1176.0813-11065.9614-10176.341500086.721600086.241700086.8
MRPs对感官评价的回归方程方差分析见表7。模型整体P<0.000 1,说明该模型极显著。根据回归方程中一次项的均方可知,影响美拉德反应过程中产物对感官评价的因素重要性排序为:温度(B)>pH(A)>时间(C),温度和pH对模型有极显著性影响(P<0.01),时间对模型具有显著影响(P<0.05)。失拟项P=0.446 3>0.05,不显著,表明未知因素对试验结果的影响较小,残差主要来自于随机误差。本模型的决定系数R2=0.982 0,说明该模型能够解释98.20%的响应值变化,校正拟合度![]() 模型与试验拟合程度较好,可以用此模型来进行较为准确的预测分析。
模型与试验拟合程度较好,可以用此模型来进行较为准确的预测分析。
表7 感官评价结果方差分析
Table 7 Analysis of variance of sensory evaluation results

变异来源平方和自由度均方F值P值模型1 439.309159.9242.43<0.000 1∗∗A-pH131.541131.5434.900.000 6∗∗B-温度385.591385.59102.30<0.000 1∗∗C-时间26.43126.437.010.033 0∗AB0.02910.0297.667×10-30.932 7AC14.52114.523.850.090 5BC2.8212.820.750.415 5A2245.191245.1965.05<0.000 1∗∗B2296.111296.1178.56<0.000 1∗∗C2244.871244.8764.96<0.000 1∗∗残差26.3873.77失拟11.9333.981.100.446 3纯误差14.4643.61总变异1 465.6916
注:*表示差异显著(P<0.05);**表示差异极显著(P<0.01)
图4能比较直观地表示出当固定1个因素为中心点水平时,其他各因素交互作用对感官评价的影响,当固定1个因素,随着另一因素水平的升高,响应值均是先增大后减小,在中间出现最大值,与单因素试验结果一致。
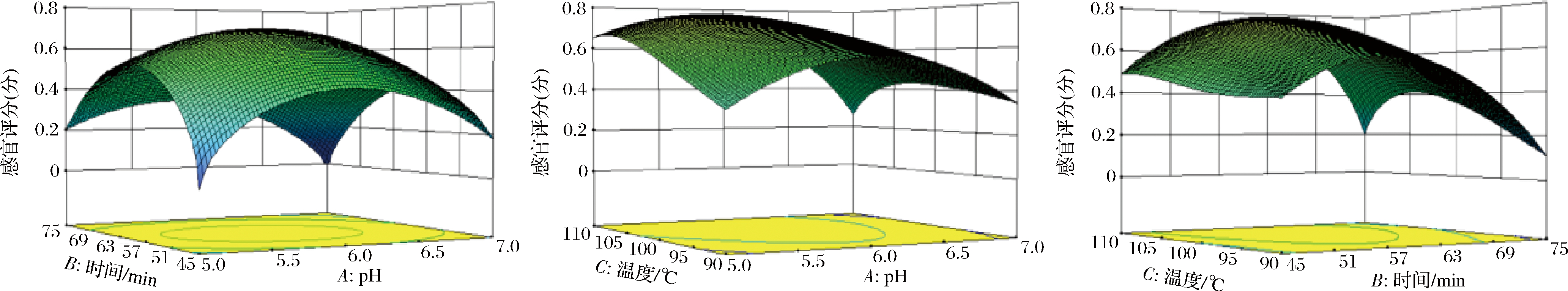
图4 感官评价模型中各因素交互响应面图
Fig.4 The interactive response surface of various factors in the sensory evaluation model
2.2.2 工艺优化与结果验证
结合响应曲面进行优化分析,以感官评分为评价指标,得到美拉德反应的最优工艺为pH 5.71,59.12 min,107.03 ℃,在此条件下感官评分的预测值为82.49。为方便操作,将其修正为pH 5.7,60 min,105 ℃,得出感官评分为82.66,与预测值接近,表明预测值与实际值拟合较好,模型可行。
2.3 美拉德反应对酶解液滋味轮廓的影响
电子舌可以反映不同样品的滋味特性差异,一般认为酸味值>-13,咸味值>-6,甜味、鲜味和涩味>0时,认为有该味道[20]。由图5可知美拉德反应前后有一定的滋味差异。其中酸味、咸味和丰富度显著增加(P<0.05),苦味、鲜味、甜味降低(P<0.05),这可能是由于美拉德反应产生了大量的呈味物质。鲜味降低可能是因为在反应过程中pH值逐渐降低呈现酸性,导致谷氨酸无法生成谷氨酸盐[21]。反应后酸味响应值增加,酸味对苦味有一定的掩盖作用[10],苦味响应值降低,表明美拉德反应对苦味有一定的削弱作用,能在一定程度改善酶解液的风味,这可能与氨基酸中精氨酸(Arg)和组氨酸(His)含量减少有关,陈晓[22]对鸡肝蛋白酶解物进行美拉德反应后也得到了相似的结果。由以上结果可知,美拉德反应可以改善酶解液的苦味,增加咸味,丰富产物的风味。这与高娟等[9]对羊肚菌美拉德反应前后的滋味分析结果一致。

图5 酶解液和美拉德反应产物电子舌响应值的雷达图
Fig.5 Radar diagram of electronic tongue response values of enzymatic hydrolysate and Maillard reaction liquid
注:MJY、MRPs分别表示酶解液和美拉德反应产物(下同)
2.4 美拉德反应对酶解液气味轮廓的影响
电子鼻作为一种新型智能感官技术,可以对不同样品的香气进行分析,能减少人感官评价所带来的误差,重复性好[23]。其有10个不同的传感器,由每个传感器的响应值绘制雷达图和主成分分析(principal component analysis,PCA)图(图6)。主成分1和主成分2的贡献率分别为63.3%和25%,贡献率之和达到88.3%,能解释大部分处理给酶解液和MRPs带来的变化,表明该评估方法有一定的可行性。经过美拉德反应后,极大地增加了W2W和W1W两个传感器的响应值,这2个传感器分别对有机硫化物和硫化物灵敏。有研究[24-25]对肉中的风味物质进行检测,发现含硫化合物是肉香的主要化合物,对肉制品的风味起关键作用。其呈味阈值低,朱照华[26]提出含硫化合物主要通过美拉德反应产生,本试验中反应后的有机硫化物和硫化物都比反应前增加了100%,显著增加了肉香味。W3S、W5C、W6S传感器分别对长链烷烃、短链烷烃芳香成分、氢化物有选择性,反应前后这几个传感器的响应值变化不大。W2S、W1S、W5S传感器分别对醇和醛酮类、甲基类和氮氧化合物敏感,经过美拉德反应这几个传感器的响应值略有升高。W3C(对芳香成分敏感,氨类)、W1C(对芳香成分敏感,苯类)2个传感器的响应值略有降低。总体来说,美拉德反应可以产生更多的含硫化合物,同时使氨类等不愉快的气味减弱,整体风味得到改善。

a-雷达图;b-PCA图
图6 酶解液和美拉德反应产物电子鼻响应值的 雷达图和PCA图
Fig.6 Radar and PCA of electronic nose response values of enzymatic hydrolysate and Maillard reaction liquid
2.5 美拉德反应对酶解液游离氨基酸含量的影响
酶解液和美拉德反应前的氨基酸含量如表8所示,大多数氨基酸在美拉德反应后含量减少,其中酪氨酸、赖氨酸和异亮氨酸减少比例最高,分别达到71.81%、56.66%和55.79%,表明这3种氨基酸是参与美拉德反应的主要氨基酸,童彦等[17]分析了鱼蛋白水解液美拉德反应前后的氨基酸组成变化,发现酪氨酸、赖氨酸和精氨酸是反应的主要氨基酸,与本研究结果相近。反应后甘氨酸、丝氨酸和半胱氨酸含量大幅增加,其中甘氨酸和丝氨酸为甜味氨基酸,可提供清香甜味,减弱苦味,从食物中去除不愉快的气味[27];半胱氨酸属于含硫氨基酸,对肉香味的形成有重要作用。
表8 美拉德反应前后氨基酸含量
Table 8 Amino acid content before and after Maillard reaction

氨基酸含量/[mg·(100 mL-1)]酶解液美拉德反应产物减少比例/%氨基酸含量/[mg·(100 mL-1)]酶解液美拉德反应产物减少比例/%天冬氨酸(Asp)65.57±5.10∗42.04±0.29 35.89谷氨酸(Glu)163.59±5.56471.41±8.02∗-188.17丝氨酸(Ser)9.14±1.4847.42±2.76∗-418.82甘氨酸(Gly)42.53±6.58469.41±15.80∗-1 003.72组氨酸(His)45.31±5.03∗24.08±2.9746.85精氨酸(Arg)32.19±6.9828.53±9.8411.37苏氨酸(Thr)66.35±5.52∗33.60±2.6349.36丙氨酸(Ala)124.54±5.06370.44±23.38∗-197.45脯氨酸(Pro)55.24±5.02136.50±8.69∗-147.10酪氨酸(Tyr)72.23±6.93∗20.36±2.52 71.81缬氨酸(Val)87.68±6.82∗66.06±8.5224.66蛋氨酸(Met)47.65±6.78∗30.13±3.8036.77半胱氨酸(Cys)20.07±0.1289.82±9.50∗-347.53异亮氨酸(Ile)95.76±5.17∗42.34±5.8855.79亮氨酸(Leu)139.99±1.00∗107.86±14.0322.95苯丙氨酸(Phe)75.28±5.02∗55.70±6.0426.01赖氨酸(Lys)136.28±5.47∗59.06±5.5256.66
注:采用独立样本t检验,同行“*”表示差异显著(P<0.05)(下同)
2.6 美拉德反应对挥发性风味物质的影响
本研究中酶解液和MRPs共检测出80余种挥发性风味物质,根据NIST质谱库,共鉴别出29种物质,其中包括8种醇类物质、6种醛类物质、7种酮类物质、3种烯类物质、3种酯类物质和2种吡嗪类物质,多数物质同时具有单体和二聚体。酶解液和MRPs挥发性风味物质的指纹图谱见图7,颜色越深代表含量越高。

图7 酶解液和MRPs的指纹图谱
Fig.7 Fingerprint of enzymolysis solution and Maillard reaction solution
表9列举出了反应前后相对含量较高或存在较大差异的物质及其相对含量。在已鉴别出类别的物质中,醇类、醛类和酮类对水解液和MRPs贡献较大,且水解液中这3类物质的含量显著高于MRPs(P<0.05),水解液中醛类物质含量最高,达到22.73%,MRPs中醇类物质含量最高,达到15.15%,其中反应后1-己醇和乙醇的含量显著高于反应前,1-己醇具有的水果芬芳香气和乙醇具有的酒香味,这种物质改善了酶解液的风味。与醇类、醛类和酮类相比,一些挥发性化合物(例如烯类、酯类和吡嗪类)对整体香气贡献程度较少,水解液中烯类物质含量显著高于MRPs(P<0.05),经过美拉德反应后酯类和吡嗪类物质含量显著增加(P<0.05),吡嗪类属于杂环化合物,具有气味阈值低的特点,对整体风味的改善也具有重要的作用[6]。除此之外,由于NIST数据库的有限性,还含有29种未被定性的物质,它们的含量有较大差别,也是反应后风味改变的原因。
表9 挥发性风味物质相对含量
Table 9 Relative contents of volatile flavor substances
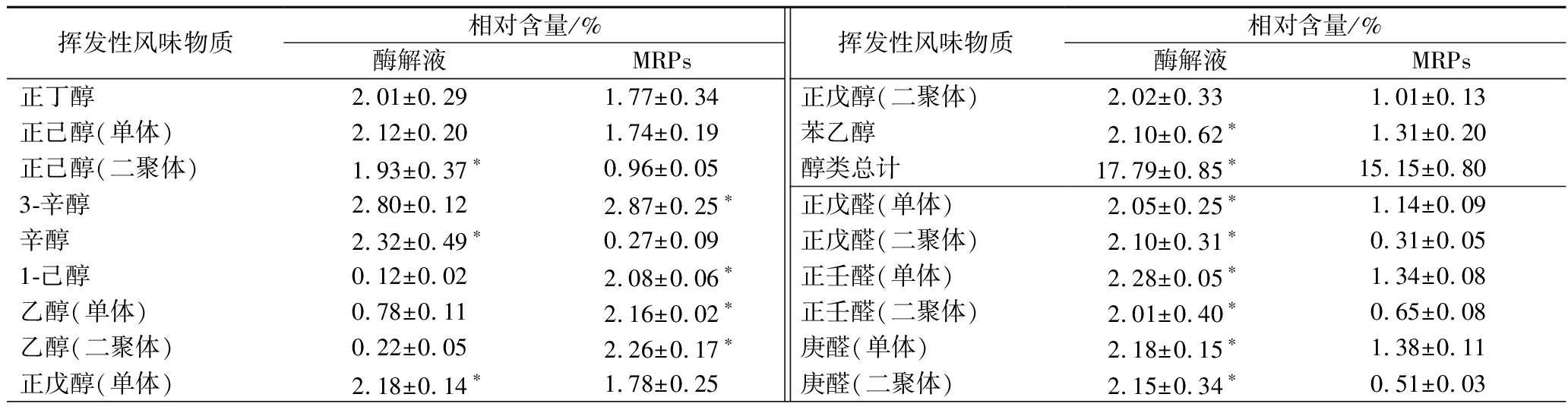
挥发性风味物质相对含量/%酶解液MRPs挥发性风味物质相对含量/%酶解液MRPs正丁醇2.01±0.291.77±0.34正己醇(单体)2.12±0.201.74±0.19正己醇(二聚体)1.93±0.37∗0.96±0.053-辛醇2.80±0.122.87±0.25∗辛醇2.32±0.49∗0.27±0.091-己醇0.12±0.022.08±0.06∗乙醇(单体)0.78±0.112.16±0.02∗乙醇(二聚体)0.22±0.052.26±0.17∗正戊醇(单体)2.18±0.14∗1.78±0.25正戊醇(二聚体)2.02±0.331.01±0.13苯乙醇2.10±0.62∗1.31±0.20醇类总计17.79±0.85∗15.15±0.80正戊醛(单体)2.05±0.25∗1.14±0.09正戊醛(二聚体)2.10±0.31∗0.31±0.05正壬醛(单体)2.28±0.05∗1.34±0.08正壬醛(二聚体)2.01±0.40∗0.65±0.08庚醛(单体)2.18±0.15∗1.38±0.11庚醛(二聚体)2.15±0.34∗0.51±0.03
续表9

挥发性风味物质相对含量/%酶解液MRPs挥发性风味物质相对含量/%酶解液MRPs己醛(单体)2.27±0.08∗1.51±0.23己醛(二聚体)2.17±0.19∗1.50±0.11辛醛(单体)2.32±0.04∗1.01±0.07辛醛(二聚体)2.11±0.37∗0.29±0.04苯甲醛(单体)0.94±0.172.18±0.37∗苯甲醛(二聚体)0.14±0.022.31±0.21∗醛类总计 22.73±1.32∗14.13±0.782-庚酮(单体)2.03±0.28∗0.86±0.062-庚酮(二聚体)1.68±0.57∗0.30±0.052-辛酮4.6±0.43∗0.65±0.032-丁酮1.33±0.391.70±0.382,3-戊二酮1.10±0.381.55±0.532-丁酮(单体)1.17±0.321.81±0.562-丁酮(二聚体)0.23±0.082.12±0.53∗2-戊酮0.55±0.131.57±0.782-己酮2.01±0.720.92±0.18酮类总计 14.74±0.25∗10.93±0.47α-蒎烯(单体)2.13±0.601.05±0.18α-蒎烯(二聚体)1.89±0.47∗0.57±0.11柠檬烯2.19±0.23∗0.61±0.04苯乙烯0.04±0.012.06±0.08∗烯类总计6.22±0.12∗4.55±0.31丙酸乙酯1.92±0.352.25±0.22乙酸异戊酯0.26±0.061.39±0.65∗乙酸乙酯(单体)0.67±0.181.88±0.58∗乙酸乙酯(二聚体)0.12±0.021.92±0.71∗酯类总计2.98±0.187.45±0.58∗2,5-二甲基吡嗪0.36±0.022.06±0.07∗甲基吡嗪0.33±0.062.30±0.20∗吡嗪类总计0.68±0.034.36±0.12∗其他总计34.87±2.2643.43±1.82∗
3 结论
本研究通过单因素试验和响应曲面优化试验得到美拉德反应的最优条件为pH 5.7,时间60 min,温度105 ℃。在此条件下制备的MRPs与反应前相比,削弱了酶解液的苦味,增加了咸味,丰富了整体风味,游离氨基酸总量大幅增加,其中酪氨酸、赖氨酸和异亮氨酸含量减少最多,说明这几种氨基酸是参与美拉德反应的主要氨基酸。由GC-IMS分析可知,经过美拉德反应,醇类、醛类、酮类和烯类物质含量减少,而酯类、吡嗪类和一些未被定性出来的物质含量增加。本研究为制备出肉味逼真的风味基料提供理论参考。
[1] 黄佳露, 王凤丽, 刘若男, 等.基于智能燃气灶的乌鸡汤炖制工艺分析[J].现代食品科技, 2020, 36(9):251-259.
HUANG J L, WANG F L, LIU R N, et al.Process analysis of the stewing method of silky fowl soup based on intelligent gas stove[J].Modern Food Science and Technology, 2020, 36(9):251-259.
[2] 于亚辉, 陈沁雯, 李晓婷, 等.响应面法优化鸡肉复合调味料的制作工艺[J].中国调味品, 2020, 45(2):93-97;103.
YU Y H, CHEN Q W, LI X T, et al.Optimization of the production process of chicken compound seasoning by response surface method[J].China Condiment, 2020, 45(2):93-97;103.
[3] 曾晓房. 鸡骨架酶解及其产物制备鸡肉香精研究[D].广州:华南理工大学, 2007.
ZENG X F.Enzymatic hydrolysis characteristics of chicken bone and chicken process flavor preparation of its hydrolysate[D].Guangzhou:South China University of Technology, 2007.
[4] 于亚辉, 谢昭鹏, 张帆, 等.鸡肉酶解产物制备热反应型风味基料的研究[J].中国调味品, 2019, 44(6):60-64.
YU Y H, XIE Z P, ZHANG F, et al.Study on preparation of thermal reactive flavor base from chicken enzymatic hydrolysis products[J].China Condiment, 2019, 44(6):60-64.
[5] 张恒. 鸡骨酶解过程中的呈味特性及氨基酸释放规律研究[D].雅安:四川农业大学, 2010.
ZHANG H.Taste characteristics and release of amino acid of chicken bone hydrolysates during enzymatic hydrolysis[D].Ya’an:Sichuan Agricultural University, 2010.
[6] CHEN K N, YANG X X, HUANG Z, et al.Modification of gelatin hydrolysates from grass carp (Ctenopharyngodon idellus) scales by Maillard reaction:Antioxidant activity and volatile compounds[J].Food Chemistry, 2019, 295:569-578.
[7] 吴靖娜, 靳艳芬, 陈晓婷, 等.鲍鱼蒸煮液美拉德反应制备海鲜调味基料工艺优化[J].食品科学, 2016, 37(22):69-76.
WU J N, JIN Y F, CHEN X T, et al.Optimization of preparation of seafood flavor condiment base from cooked abalone juice by Maillard reaction[J].Food Science, 2016, 37(22):69-76.
[8] 张水华, 孙君社, 薛毅.食品感官鉴评[M].第2版.广州:华南理工大学出版社, 1999.
ZHANG S H, SUN J S, XUE Y.Food Sensory Evaluation[M].2nd ed.Guangzhou:South China University of Technology Press, 1999.
[9] 高娟, 杜佳馨, 吴限, 等.羊肚菌酶解液制备美拉德反应肉味调味基料[J].食品科学, 2020, 41(24):242-250.
GAO J, DU J X, WU X, et al.Preparation of meaty flavoring base from enzymatic hydrolysate of morel mushroom by Maillard reaction[J].Food Science, 2020, 41(24):242-250.
[10] 石月, 王金厢, 李学鹏, 等.鱼骨泥酶解工艺优化及酶解液呈味特性研究[J].食品工业科技, 2021, 42(23):218-227.
SHI Y, WANG J X, LI X P, et al.Study on optimization of enzymatic hydrolysis of fish bone paste and flavor characteristics of hydrolysates[J].Science and Technology of Food Industry, 2021, 42(23):218-227.
[11] GAO L H, LIU T, AN X J, et al.Analysis of volatile flavor compounds influencing Chinese-type soy sauces using GC-MS combined with HS-SPME and discrimination with electronic nose[J].Journal of Food Science and Technology, 2017, 54(1):130-143.
[12] 胡洋健, 邓绍林, 张馨月, 等.宰后不同成熟时间处理对白切鸡肉食用品质的改善[J].现代食品科技, 2020, 36(11):170-179.
HU Y J, DENG S L, ZHANG X Y, et al.Improvement of different post-mortem conditioning span treatments on eating quality of soft-boiled chicken[J].Modern Food Science and Technology, 2020, 36(11):170-179.
[13] L S, JOSSE J, HUSSON F.FactoMineR:An R Package for multivariate analysis[J].Journal of Statistical Software, 2008, 25(1):1-18.
S, JOSSE J, HUSSON F.FactoMineR:An R Package for multivariate analysis[J].Journal of Statistical Software, 2008, 25(1):1-18.
[14] KASSAMBARA A, MUNDT F.Factoextra:Extract and Visualize the Results of Multivariate Data Analyses[M/OL].2017.https://www.zdfans.com/html/16285.html
[15] MADRUGA M S, MOTTRAM D S.The effect of pH on the formation of maillard-derived aroma volatiles using a cooked meat system[J].Journal of the Science of Food and Agriculture, 1995, 68(3):305-310.
[16] SCALONE G L L, LAMICHHANE P, CUCU T, et al.Impact of different enzymatic hydrolysates of whey protein on the formation of pyrazines in Maillard model systems[J].Food Chemistry, 2019, 278:533-544.
[17] 童彦, 雒莎莎, 应铁进.鱼蛋白水解液美拉德反应条件优化及反应前后氨基酸组成变化[J].中国食品学报, 2011, 11(8):101-106.
TONG Y, LUO S S, YING T J.Optimization of Maillard reaction condition for fish protein hydrolysate and the changes of the amino acids component before and after reaction[J].Journal of Chinese Institute of Food Science and Technology, 2011, 11(8):101-106.
[18] YANG C, SONG H L, CHEN F.Response surface methodology for meat-like odorants from Maillard reaction with glutathione I:The optimization analysis and the general pathway exploration[J].Journal of Food Science, 2012, 77(9):C966-C974.
[19] TAN Z W, YU A N.Volatiles from the Maillard reaction of L-ascorbic acid with L-glutamic acid/L-aspartic acid at different reaction times and temperatures[J].Asia-Pacific Journal of Chemical Engineering, 2012, 7(4):563-571.
[20] 黄孝闯, 张雅玮, 任晓镤, 等.电子舌与感官评定对咸度评价的比较[J].食品工业科技, 2017, 38(11):285-290.
HUANG X C, ZHANG Y W, REN X P, et al.Comparison of electronic tongue and sensory on evaluation of saltiness[J].Science and Technology of Food Industry, 2017, 38(11):285-290.
[21] HAN J R, YAN J N, SUN S G, et al.Characteristic antioxidant activity and comprehensive flavor compound profile of scallop (Chlamys farreri) mantle hydrolysates-ribose Maillard reaction products[J].Food Chemistry, 2018, 261:337-347.
[22] 陈晓. 鸡肝蛋白酶解物的美拉德反应条件优化及其产物特性[D].合肥:安徽农业大学, 2020.
CHEN X.Optimization of Maillard reaction conditions for chicken liver protein enzymatic hydrolysate and its product characteristics[D].Hefei:Anhui Agricultural University, 2020.
[23] 李云龙. 香辛料中三种植物化合物对牛肉汤营养成分和风味的影响[D].上海:上海海洋大学, 2020.
LI Y L.Impact of three phytochemicals from spices on the nutrient release and flavor formation in the beef soup[D].Shanghai:Shanghai Ocean University, 2020.
[24] 刘源. 鸭肉风味及其在加工过程中的变化研究[D].南京:南京农业大学, 2006.
LIU Y.Studies on the flavor compounds of duck meat & its changes during the processing[D].Nanjing:Nanjing Agricultural University, 2006.
[25] 赵冰, 任琳, 李家鹏, 等.盐焗工艺对盐焗鸡翅挥发性风味物质的影响[J].肉类研究, 2012, 26(11):6-11.
ZHAO B, REN L, LI J P, et al.Effect of different processing methods on volatile flavor compounds in salt-baked chicken wings[J].Meat Research, 2012, 26(11):6-11.
[26] 朱照华. 含硫风味化合物及其形成原理[J].江苏调味副食品, 2016, 33(3):4-8.
ZHU Z H.Sulfur-containing flavor compounds and its formation principle[J].Jiangsu Condiment and Subsidiary Food, 2016, 33(3):4-8.
[27] 陈敏. 氨基酸的风味与功能[M].北京:中国林业出版社, 2008.
CHEN M.Flavor and Function of Amino Acids[M].Beijing:China Forestry Publishing House, 2008.