交替糖蔗糖酶(alternansucrase,ASR,EC 2.4.1.140)是GH70家族的4大经典葡聚糖蔗糖酶之一,它可以进行葡萄糖基转移,催化形成具有α-1,3糖苷键和α-1,6糖苷键交替连接的葡聚糖,即交替糖[1]。交替糖只能被异麦芽糖糊精酶和互变酶切割[2],而对其他微生物和哺乳动物的水解酶具有抗降解性,应用范围主要涉及纳米科技、医药、食品、化妆品等领域[3-4],尤其作为一种具有良好益生功能的新资源食品极具市场开发潜力[5]。
虽然以ASR制备交替糖的研究热度一直不减,但如今交替糖仍然没有进入市场得到大规模的应用。此前所报道的野生型菌株生产ASR的最高酶活力为1.5 U/mL[6],表达水平较低。此外,野生型菌株还存在被其他酶和共合成的聚合物污染、提取纯化过程复杂等问题,所以生产过程很不经济,难以满足工业化生产的需要[7]。VAN LEEUWEN等[8]在Escherichia coli TOP10中成功表达ASR,但酶活力几乎没有提高。在大肠杆菌中表达的重组菌虽然避免了野生型菌株提取和纯化的复杂步骤,但不仅需要进行细胞破碎,且极易形成包涵体[9],同时由于含有内毒素导致其表达的酶无法用于食品行业。朱洁[10]尝试了在枯草芽孢杆菌中表达ASR,3 L罐发酵酶活力水平依然较低,仅为3.9 U/mL,所以依靠枯草芽孢杆菌异源表达大规模生产ASR也难以实现。
毕赤酵母(Pichia pastoris)作为表达宿主有众多优势[11],可以克服其他宿主的缺点。本研究选择P.pastoris作为ASR的异源表达的宿主,将来源于Leuconostoc mesenteroides NRRL B-1355的ASR基因在P.pastoris中实现高水平分泌表达,并进行了重组酶的酶学性质的研究。另外,本文将该酶应用于催化合成交替糖,研究了该酶催化不同受体反应对产物组成的影响,以期为ASR工业化生产以及交替糖大规模的市场应用提供借鉴。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
菌株E.coli JM109、P.pastoris X33,以及载体pPIC9K均由本实验保存。E.coli JM109用于ASR基因的克隆和测序实验。P.pastoris GS115用作异源表达宿主,pPIC9K作为重组ASR的表达载体。ASR基因来源于Leuconostoc mesenteroides NRRL B-1355(GenBank编号为AJ250173.2)。交替糖蔗糖酶基因、实验所用引物均由天霖生物科技有限公司合成。
1.1.2 主要试剂
抗生素zeocin,北京索莱宝科技有限公司;PrimeSTAR® Max DNA Polymerase,宝日医生物技术(北京)有限公司;蛋白质Marker,赛默飞世尔科技;T4 DNA连接酶、一步克隆试剂盒、核酸分子量Marker,诺维赞有限公司;质粒小量提取试剂盒、胶回收试剂盒,生工生物工程(上海)股份有限公司;其他试剂均为市售分析纯。
1.1.3 培养基
LB、YPD、MD、BMGY与BMMY配方参照Invitro-gen公司的《毕赤酵母表达操作手册》。
PTM1(g/L):CuSO4·5H2O 6,MnSO4·H2O 3,FeSO4·7 H2O 65,NaI 0.08,Na2MoO4·2H2O 0.2,CoCl2 0.5,H3BO3 0.02,生物素0.2,浓H2SO4 5 mL。
1.2 实验方法
1.2.1 表达载体pPIC9K-asr的构建
根据GenBank上发表的ASR基因序列,按照P.pastoris密码子偏好性进行优化,由天霖生物技术公司合成。以pUC57-ASR为模板,用引物F1、R1扩增ASR基因片段;以pPIC9K质粒为模板,设计引物F2、R2扩增P.pastoris表达载体片段。通过胶回收验证PCR产物,并使用胶回收试剂盒分别回收ASR基因片段和pPIC9K载体片段。通过一步克隆试剂盒将回收的片段和载体按照2∶1的物质的量比,在37 ℃下反应30 min连接。将连接产物转化E.coli JM109感受态细胞,涂布卡那霉素抗性平板。使用引物F1和F2进行菌落PCR,筛选阳性转化子,扩增提取质粒,测序正确后用于转化P.pastoris。
表1 引物序列
Table 1 Primer sequences

引物引物序列(5′-3′)F1AAGTCTGGTAAAGTTTGGGTR1TTAAGCTTGCAAAGCTCTCTF2AGAGAGCTTTGCAAGCTTAAGGTGGAGGTGGATCTcaR2ACCCAAACTTTACCAGACTTAGCTTCAGCCTCTCTCT
1.2.2 重组ASR在P.pastoris中的表达与摇瓶筛选
本研究采用P.pastoris GS115作为表达宿主。P.pastoris GS115感受态细胞根据Invitrogen标准操作流程制备。使用Sac I线性化pPIC9K-asr质粒,用PCR产物纯化试剂盒纯化回收线性化片段。吸取1 μg线性化片段加入感受态细胞中,冰浴30 min后转入电转杯中,在1 500 V下点击5 ms,迅速加入1 mL 1 mol/L的冰预冷山梨醇,30 ℃孵育2 h后涂布MD平板。在MD平板培养2~3 d后,挑取转化子进行G418抗性筛选,G418质量浓度分别为0.5、1、2、4 mg/mL。将正确的转化子接种至BMGY培养基中,30 ℃,220 r/min培养24 h,然后4 ℃,5 000 r/min离心10 min去除上清液得到菌体。用30 mL BMMY培养基重悬菌体,30 ℃,220 r/min培养72 h,每12 h添加终体积分数为1%的甲醇。诱导结束后,4 ℃,7 000 r/min离心5 min收集粗酶液,选择酶活力最高的菌株用于3 L罐高密度发酵。
1.2.3 重组P.pastoris 3 L罐高密度发酵
将摇瓶筛选出的菌株在YPD平板上30 ℃培养48 h,挑取单菌落接种至100 mL YPD培养基中,30 ℃,220 r/min培养至OD600=10~12后,接种至900 mL BSM培养基中。设定初始发酵温度为30 ℃,pH 5.5,溶氧关联搅拌控制为20%。出现溶氧反弹之后开始流加500 g/L甘油(含有12% PTM1),当OD600达到100,停止流加甘油并饥饿培养1 h。诱导阶段,将温度调整至25 ℃,用甲醇控制仪流加开始流加甲醇(含有12% PTM1),控制溶氧20%~30%诱导产酶。每隔一段时间取样测定OD600、酶活力,直至OD600和酶活力不再显著增加,终止发酵。
1.2.4 酶活力的测定
用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法进行ASR的酶活力测定[12]。以1 mL 200 g/L蔗糖溶液为底物,加入0.9 mL酸缓冲液(50 mmol/L,pH 5.5),在40 ℃水浴锅中保温10 min,加入0.1 mL的酶液,40 ℃、pH 5.5反应30 min。吸取0.5 mL反应液,加入1 mL DNS溶液,沸水浴7 min,冰水冷却,加水定容至5 mL,在540 nm下测定吸光值。根据吸光值计算出果糖浓度。ASR酶活力定义:每分钟产生1 μmol果糖所需的酶量为1 U的酶活力。
1.2.5 ASR的酶学性质
将高密度发酵所得酶液经过阴离子交换柱纯化后,考察温度和pH对ASR的影响。
最适pH和pH稳定性:在40 ℃条件下,50 mmol/L,pH为3.0~9.0缓冲液内,间隔0.5个pH测定酶活力,按酶活力最高的为100%,计算其他pH下的相对酶活力以确定最适pH;将酶置于50 mmol/L,pH为3.0~9.0缓冲液内,于4 ℃冰箱放置7 d,测定残留酶活力以确定pH稳定性。
最适温度和温度稳定性:采用50 mmol/L,pH 5.5的醋酸缓冲液,在30~60 ℃间隔5 ℃测定酶活力,按酶活力最高的为100%,计算各温度下的相对酶活力以确定最适温度;采用50 mmol/L,pH 5.5的醋酸缓冲液,将酶液分别放置在30、35、40、45、50 ℃保温,每隔一段时间取样测定残留酶活力以确定温度稳定性。
以5、10、20、40、80 g/L的蔗糖为底物,在40 ℃,50 mmol/L,pH 5.5的醋酸钠缓冲液下测定反应过程中果糖的生成量。根据Lineweaver-Burk双倒数法作图,以1/V对1/S作图,绘制ASR作用于不同浓度底物的动力学曲线。
1.2.6 交替糖的制备
用pH 5.5的50 mmol/L醋酸缓冲液配制总质量浓度为300 g/L的蔗糖和麦芽糖(或其他小分子糖)溶液,使其物质的量比为2∶1,总反应体系为10 mL,加入0.6 U/mL ASR酶液,置于40 ℃,150 r/min的水浴摇床中反应48 h后,将反应液沸水煮10 min终止反应用于后续分析。或者以300 g/L蔗糖为唯一底物,其他条件同上。
1.2.7 薄层色谱(thin-layer chromatography,TLC)分析
采用TLC来确定最终催化反应体系中生成的单糖和寡糖。以1 mg/mL果糖、蔗糖、麦芽糖、麦芽三糖、麦芽四糖、麦芽五糖、麦芽六塘、麦芽七糖作为marker,点样量10 μL。将获得的反应液离心,稀释10倍,在薄层层析硅胶板上点样1 μL,展开剂为V(正丁醇)∶V(乙醇)∶V(水)=5∶5∶3[13]。在室温下将50 mL展开剂在200 mm×100 mm的展开缸中预饱和60 min,放入样品展开4 h。用12%硫酸甲醇溶液在110 ℃烘箱中显色30 min,根据TLC颜色变化来定性分析产物的组成。
2 结果与分析
2.1 重组ASR的异源表达
通过PCR扩增的pPIC9K载体以及ASR基因,经过琼脂糖凝胶电泳鉴定,大小分别为7 443和6 150 bp(图1-a),使用无缝克隆试剂盒将片段连接后转化E.coli JM109感受态细胞,涂布卡那霉素抗性平板。将转化子菌落PCR得到6 150 bp单一条带(图1-b),则为阳性转化子,测序正确,重组质粒pPIC9K-asr构建成功。

a-PCR扩增电泳图;b-转化子的PCR鉴定结果 M-DNA marker;a1-载体pPIC9K的PCR产物; a2-目的基因asr的PCR产物; b1~10-阳性转化子中asr的PCR产物;b11-对照(pPIC9K)
图1 PCR扩增和转化子的PCR鉴定结果电泳图
Fig.1 Agarose gel electrophoresis of PCR amplification and identification of transformant
使用SacI线性化pPIC9K-asr质粒,经过PCR产物纯化试剂盒回收后,取1 μg电转化P.pastoris GS115感受态细胞,涂布MD平板生长后,进行抗生素筛选。挑取正确转化子摇瓶诱导表达后,离心收集上清液粗酶液,测定酶活力(表2)。选定摇瓶酶活力最高的2号菌株,作为3 L发酵罐高密度发酵的菌株。
表2 重组ASR摇瓶水平酶活力
Table 2 Recombinant ASR expression activities in shake flask level
编号123456789酶活力/(U·mL-1)1.92.90.00.20.01.30.01.60.0
2.2 ASR的3 L发酵罐高密度发酵
挑取2号菌株的单菌落接种至100 mL YPD液体培养基中,培养至OD600达到10~12。按体积分数为10%接种量接种至装有BSM培养基的3 L发酵罐中,分批培养一定时间后,当观察到溶氧突然上升,即表示发酵罐内基础培养基中所含的碳源已被菌体耗尽,不能满足菌体的生长代谢,补加甘油作为碳源来供给菌体正常的生长代谢直至OD600达到100,停止流加甘油。等到溶氧再次反弹后,饥饿培养1 h,开始流加甲醇进行诱导。将发酵过程中所取的样品进行SDS-PAGE分析,结果如图2所示,GS115/pPIC9K-asr约在200 kDa处有一条明显的条带,与理论蛋白分子质量一致,随着诱导时间的延长,GS115/pPIC9K-asr目的蛋白条带逐步加深。发酵过程中,OD600在达到530后(图2-b),不再增加,整个诱导过程持续了72 h。ASR的酶活力随着诱导时间的延长逐步增大,最终达到34.5 U/mL,约是摇瓶水平的12倍。
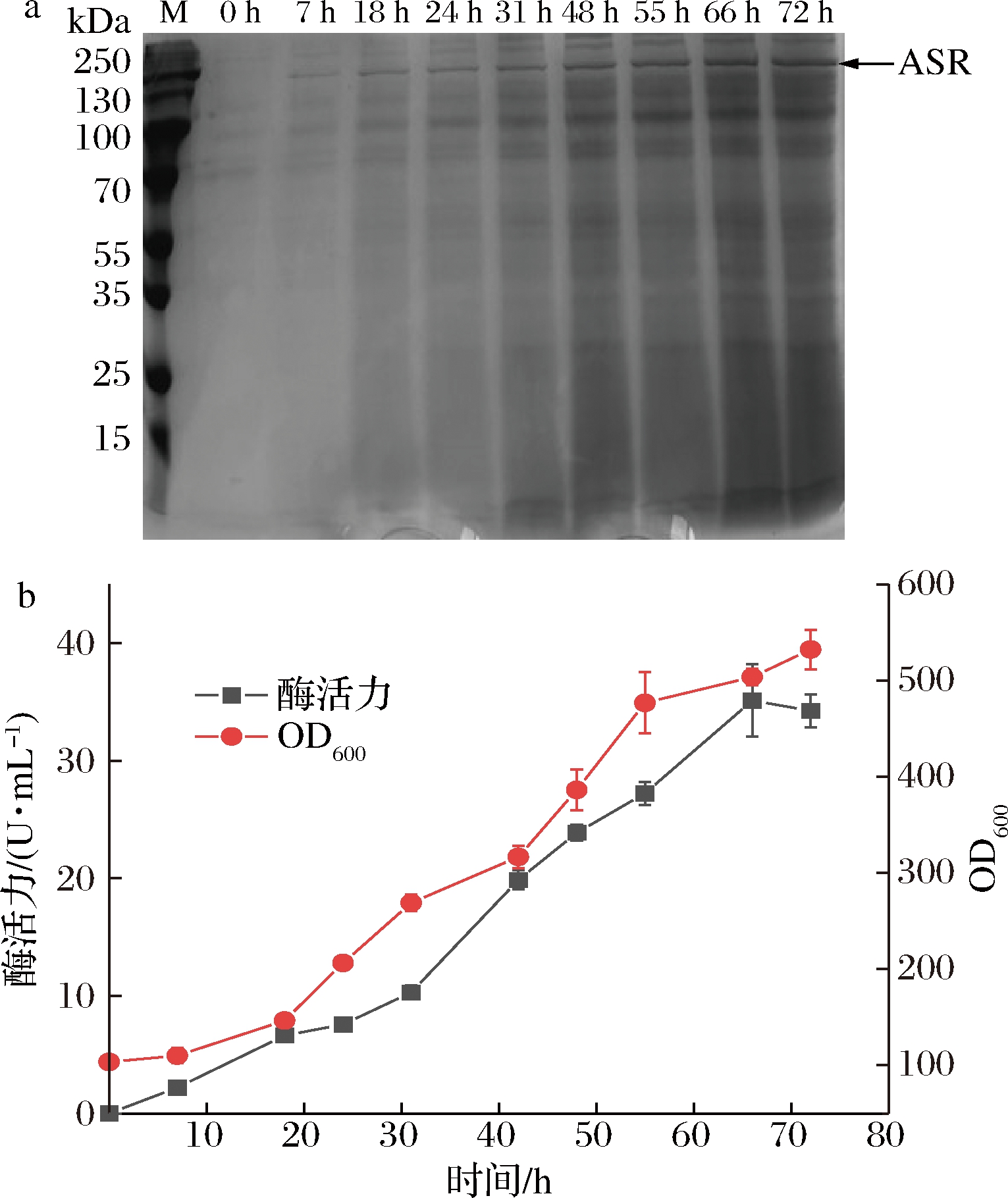
a-不同时间发酵液上清液SDS-PAGE图; b-发酵过程中酶活力和细胞OD600曲线图
图2 3 L发酵罐重组菌发酵过程图
Fig.2 Fermentation of recombinant P.pastoris in 3 L fermenter
2.3 ASR酶学性质的研究
2.3.1 pH对ASR活性的影响
为了探究重组ASR的最适pH,将酶的反应温度控制为40 ℃,50 mmol/L不同pH缓冲液范围内探究重组ASR的酶活性。如图3-a所示,随着pH的增加,ASR的酶活力先增加后减少,当pH值为6.0时酶活力最大,即重组ASR的最适pH为6.0。
将酶置于50 mmol/L不同pH缓冲液范围内于4 ℃放置7 d,探究重组ASR的pH稳定性。pH为4.0~9.0时,重组ASR的相对酶活力均在90%以上(图3-b),表明重组ASR具有广泛的pH稳定性。
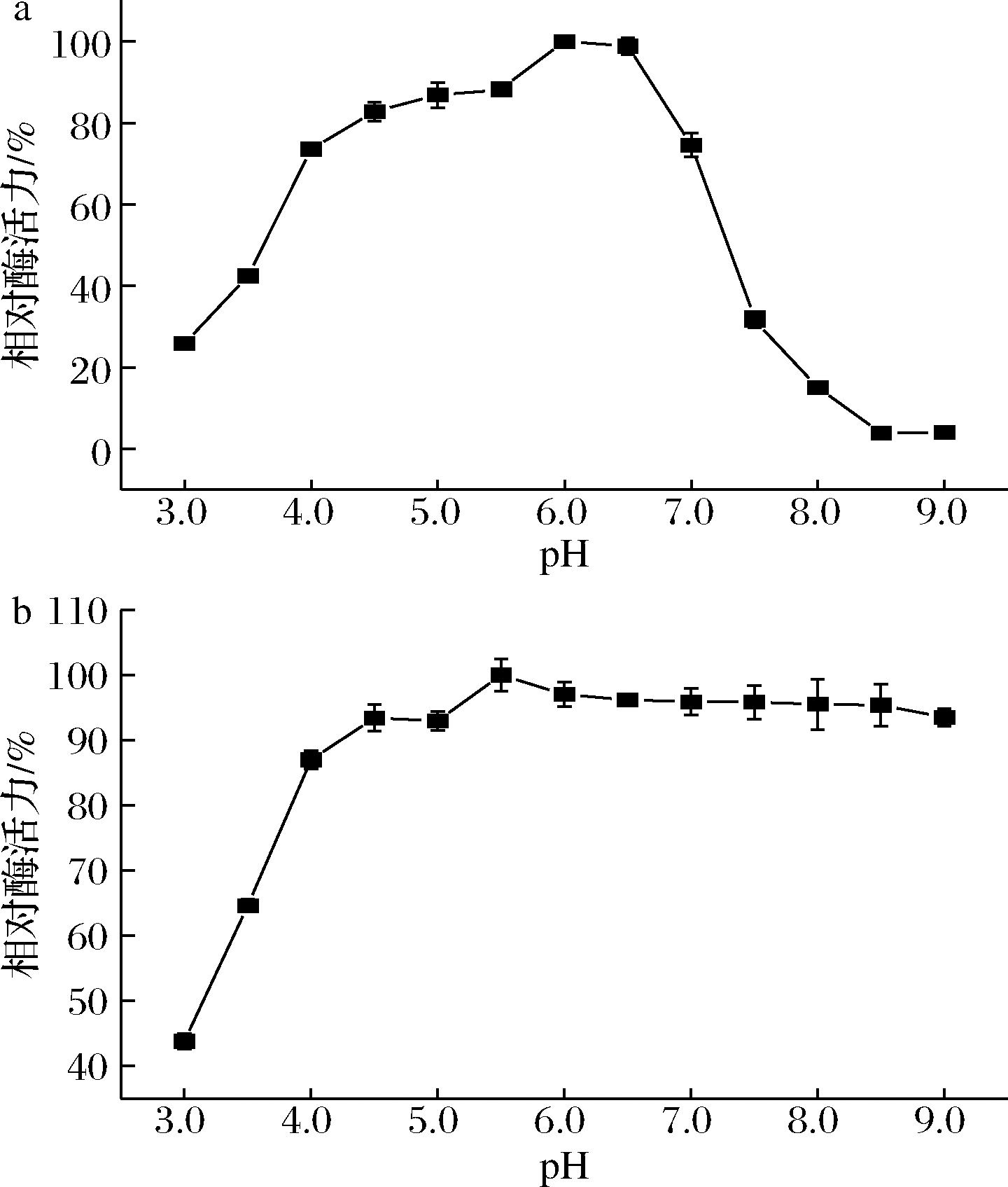
a-最适pH;b-pH稳定性
图3 pH对重组ASR活性和稳定性的影响
Fig.3 Effect of pH on the activity and stability of recombinant ASR
2.3.2 温度对ASR活性的影响
为了探究重组ASR的最适温度,在30~60 ℃下分别考察ASR活性(图4-a)。在30~55 ℃,ASR均保持50%以上的相对酶活力。当温度>55 ℃时,重组ASR的酶活力急剧下降,其相对酶活力降至25%以下。ASR酶活力呈现先上升后下降的趋势,在50 ℃时具有最大值,为最适温度。
酶的热稳定性也是酶的一种重要的性质,是实际生产过程中选择酶反应温度的重要指标之一,在30~60 ℃下考察酶的热稳定性,间隔0.5 h取样测定重组ASR的残余酶活力(图4-b)。ASR在不高于40 ℃时具有较好的热稳定性,在30、35 ℃下保温24 h仍可维持75%以上的活性;在40 ℃下,ASR的酶活力下降比较缓慢,孵育10 h仍然可以维持50%以上的活力;当温度>40 ℃时,ASR热稳定性较差,在50、60 ℃下酶活力几乎在前1 h就完全丧失。
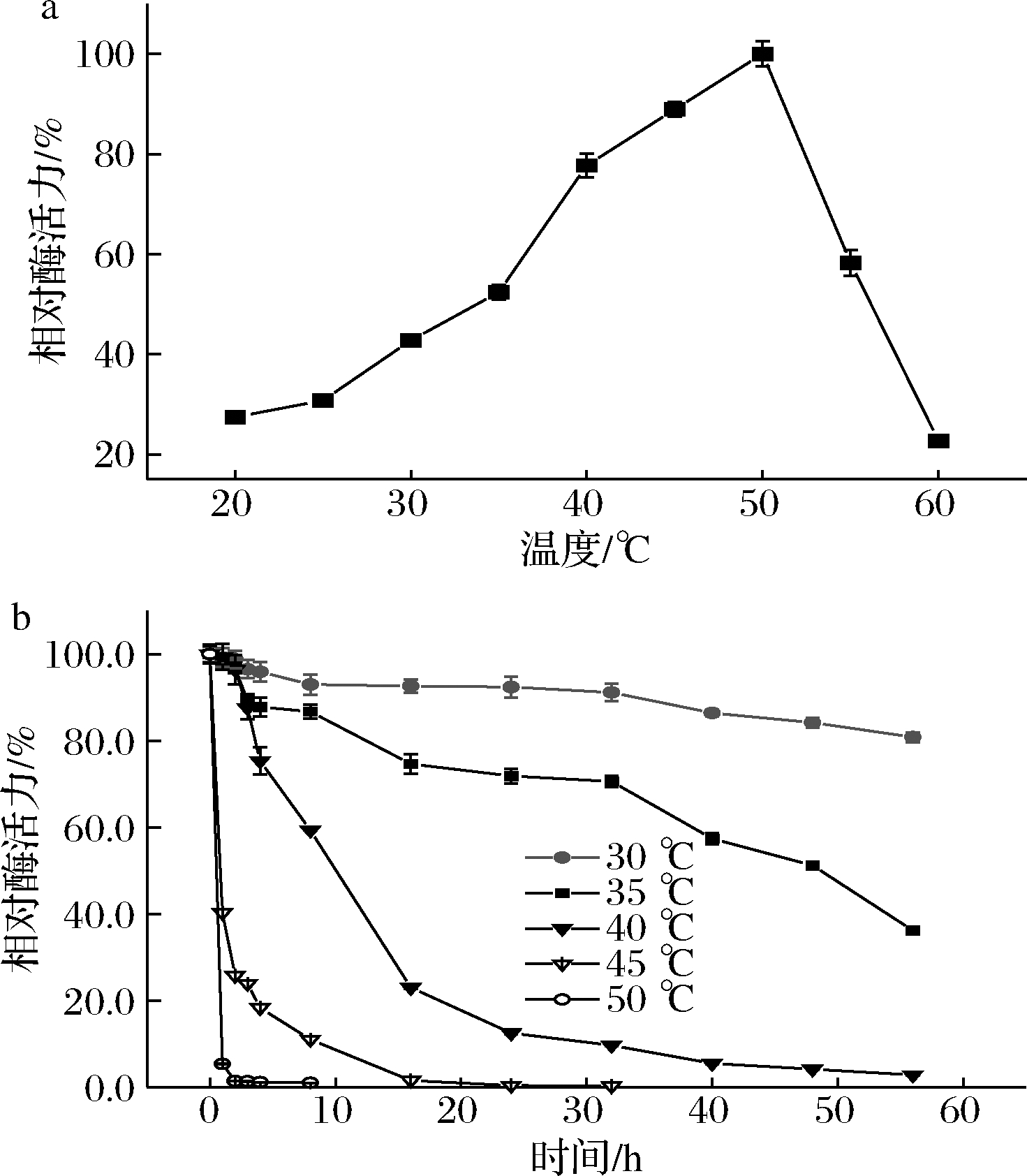
a-最适温度;b-温度稳定性
图4 温度对重组ASR活性和稳定性的影响
Fig.4 Effect of temperature on the activity and stability of recombinant ASR
2.3.3 ASR动力学参数测定
以不同浓度的蔗糖为底物,在40 ℃,pH 5.5下测定反应过程中果糖的生成量,即为底物蔗糖的消耗量,以1/V对1/S作图,绘制ASR的动力学曲线(图5)。在该动力学曲线中,横轴的截距即为1/Km,纵轴的截距即为Vmax。根据回归方程求得,ASR动力学参数Km、Vmax、kcat分别是31.97 mmol/L,0.22 mmol/(min·L),0.36 s-1。
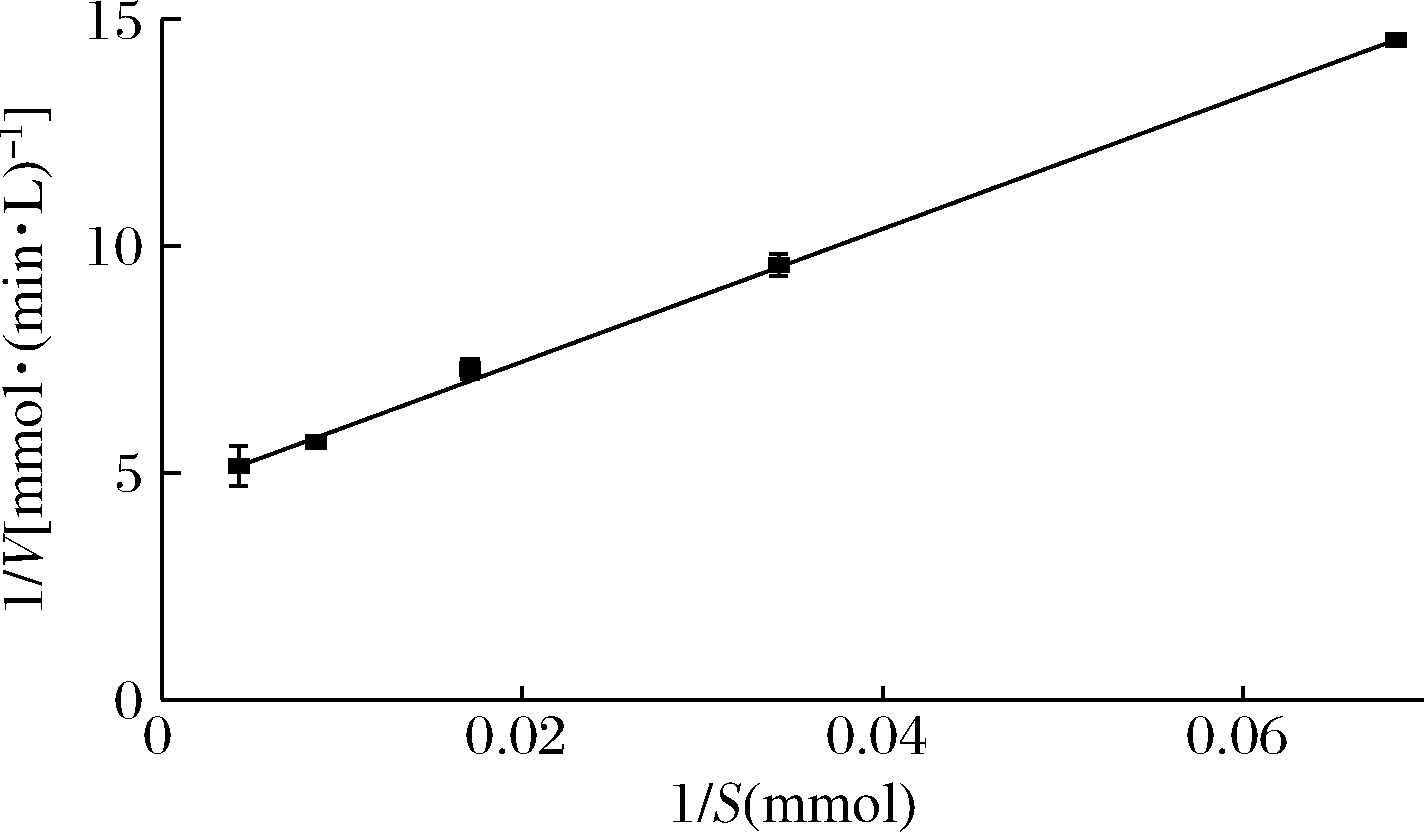
S-蔗糖的量;V-果糖生成速度
图5 ASR对蔗糖的双倒数曲线
Fig.5 Lineweaver-Burk plot of ASR using sucrose as substrates
2.4 交替糖的制备及分析
2.4.1 以蔗糖为唯一底物制备交替糖
本研究中采用pH 5.5的50 mmol/L醋酸缓冲液配制总质量浓度为300 g/L的蔗糖加入0.6 U/mL的ASR酶液催化48 h后,稀释10倍后进行TLC分析,由TLC结果(图6)可知,当以蔗糖为唯一底物反应时,只有多糖和少量三糖产生,没有产生更高聚合度的寡糖。

M-标准品marker;G1-葡萄糖;G2-蔗糖;G3~G7麦芽三糖~ 麦芽七糖;S-蔗糖;g-葡萄糖;F-果糖;m-麦芽糖;L-乳糖; T-半乳糖;0-反应0 h样品;1-反应48 h样品; 红色方框表示聚合度超过5的交替寡糖
图6 不同小分子糖受体的催化产物TLC图
Fig.6 Products of ASR reaction with different saccharide receptors
2.4.2 以蔗糖为受体,其他小分子糖为供体制备交替糖
选择了容易获取且价格较为低廉的葡萄糖、乳糖、海藻糖、麦芽糖作为制备交替糖的受体。控制蔗糖和其他小分子糖的物质的量比为3∶1,用pH 5.5的50 mmol/L醋酸缓冲液配制总质量浓度为300 g/L的总底物量,加入0.6 U/mL的酶催化48 h后,稀释10倍后进行TLC分析(图6)。当蔗糖为供体,受体是海藻糖时,没有观察到任何寡糖的产生,产物中只有多糖;乳糖、果糖为受体时,产物是三糖和多糖;葡萄糖、麦芽糖为受体时,产物是多糖和多种寡糖的混合物,并且由葡萄糖生成的产物聚合度比麦芽糖的低、颜色比麦芽糖的浅。进一步考察了麦芽糖为受体时的催化反应过程,通过每隔8 h取样,使用TLC分析详细记录反应过程中底物的消耗、产物的生成情况,如图7所示,随着时间的延长,产物中有聚合度为3~7甚至更高的寡糖产生。

M-标准品marker;G1-葡萄糖;G2-蔗糖; G3~G7-麦芽三糖~麦芽七糖
图7 麦芽糖为受体的催化产物TLC图
Fig.7 Products of ASR reaction with maltose receptors
3 结论与讨论
本研究将来源于ASR的基因首次在P.pastoris中成功实现高水平分泌表达,酶活力达到34.5 U/mL。这是ASR首次在真核宿主中异源表达,同时也是目前所报道的ASR最高酶活力水平,解决了ASR酶活力较低的问题,有助于对ASR开展进一步深入的研究。重组ASR广泛的pH稳定性和较好的温度稳定性表明了其具有应用于工业食品生产的巨大潜力。在以不同底物生产交替糖时,以蔗糖为唯一底物几乎可以专一性生产交替糖多糖,这一特性可应用于交替糖多糖的生产。当蔗糖为供体,其他小分子糖为受体时,只有麦芽糖可以生产较高聚合度的寡糖产物,其他小分子糖只能生成多糖和聚合度较低寡糖的混合物。研究结果一方面扩大了交替糖多糖生产的底物范围,另一方面说明麦芽糖是生产交替糖寡糖的良好受体。由此可见,本研究重组表达的ASR具有良好的生产交替糖功能,为后续规模化制备交替糖提供重要技术支撑。
[1] MOLINA M, MOULIS C, MONTIES N, et al.A specific oligosaccharide-binding site in the alternansucrase catalytic domain mediates alternan elongation[J].The Journal of Biological Chemistry, 2020, 295(28):9 474-9 489.
[2] BIELY P, C TÉ G L, BURGESS-CASSLER A.Purification and properties of alternanase, a novel endo-α-1, 3-α-1, 6-d-glucanase[J].European Journal of Biochemistry, 1994, 226(2):633-639.
TÉ G L, BURGESS-CASSLER A.Purification and properties of alternanase, a novel endo-α-1, 3-α-1, 6-d-glucanase[J].European Journal of Biochemistry, 1994, 226(2):633-639.
[3] WANGPAIBOON K, PADUNGROS P, NAKAPONG S, et al.An α-1, 6-and α-1, 3-linked glucan produced by Leuconostoc citreum ABK-1 alternansucrase with nanoparticle and film-forming properties[J].Scientific Reports, 2018, 8:8340.
[4] CHAROENWONGPAIBOON T, SUPRADITAPORN K, KLAIMON P, et al.Effect of alternan versus chitosan on the biological properties of human mesenchymal stem cells[J].RSC Advances, 2019, 9(8):4 370-4 379.
[5] FROHBERG C, PILLING J.Use of alternan as texturizing agent in foodstuffs and cosmetics:US10463606[P].2019-11-05.
[6] RAEMAEKERS M H M, VANDAMME E J.Production of alternansucrase by Leuconostoc mesenteroides NRRL B-1355 in batch fermentation with controlled pH and dissolved oxygen[J].Journal of Chemical Technology & Biotechnology, 1997, 69(4):470-478.
[7] 许婷. Leuconostoc citreum SK 24.002产交替糖蔗糖酶的研究[D].无锡:江南大学, 2014.
XU T.Research of alternansucrase produced by Leuconostoc citreum SK24.002[D].Wuxi:Jiangnan University, 2014.
[8] VAN LEEUWEN S S, KRALJ S, EEUWEMA W, et al.Structural characterization of bioengineered α-D-glucans produced by mutant glucansucrase GTF180 enzymes of Lactobacillus reuteri strain 180[J].Biomacromolecules, 2009, 10(3):580-588.
[9] MOLINA M, MOULIS C, MONTIES N, et al.Deciphering an undecided enzyme:Investigations of the structural determinants involved in the linkage specificity of alternansucrase[J].ACS Catalysis, 2019, 9(3):2 222-2 237.
[10] 朱洁. Leuconostoc citreum交替糖蔗糖酶异源表达、发酵优化及制备交替糖的研究[D].无锡:江南大学, 2019.
ZHU J.Heterologous expression and fermentation optimization of Leuconostoc citreum alternansucrase, and its application in preparation of alternan[D].Wuxi:Jiangnan University, 2019.
[11] PE A D A, GASSER B, ZANGHELLINI J, et al.Metabolic engineering of Pichia pastoris[J].Metabolic Engineering, 2018, 50:2-15.
A D A, GASSER B, ZANGHELLINI J, et al.Metabolic engineering of Pichia pastoris[J].Metabolic Engineering, 2018, 50:2-15.
[12] MILLER G L.Use of dinitrosalicylic acid reagent for determination of reducing sugar[J].Analytical Chemistry, 1959, 31(3):426-428.
[13] ZHAI L T, FENG L L, XIA L, et al.Crystal structure of glycogen debranching enzyme and insights into its catalysis and disease-causing mutations[J].Nature Communications, 2016, 7:11229.